食醋在中国已经有三千多年的历史,在不断发展过程中形成了四大名醋:山西老陈醋、镇江香醋、四川保宁麸醋、福建永春老醋[1]。我国食醋发酵通常以高粱、麸皮、小麦、大米、豌豆等为原料进行发酵,在发酵过程中有霉菌、酵母菌、醋酸菌和乳酸菌等微生物共同参与,上述微生物将原料中的淀粉、蛋白质等物质降解为还原糖和氨基酸等,同时代谢产生有机酸和醇类、醛类、酮类、酯类等风味物质,赋予食醋丰富的滋味和气味[2]。微生物在食醋发酵中起着重要作用,也对食醋品质有着极大影响。食醋具有较低pH,可以抑制大多数微生物生长,因而具有久放不坏的特征。然而,仍有一些耐酸微生物在食醋中生长繁殖,不仅影响产品质量甚至导致食醋变质,同时还可能造成潜在危害。
本文综述了引起食醋变质的微生物的种类、微生物导致食醋变质的现象及原因,以及食醋发酵微生物或食醋变质微生物的检测方法,以期为食醋污染微生物研究及生产企业防控食醋变质提供参考。
1 微生物污染引起食醋变质现象及原因
1.1 微生物污染食醋出现的变质现象
微生物污染食醋后,成品醋可能出现产气、发黏、返浑、产膜等现象,这些变质现象可能单独出现或一同出现。微生物污染导致食醋出现产气变质,主要原因是微生物在生长代谢过程中产生二氧化碳。郑宇等[3]检测产气食醋中气体组成,发现产气食醋气体组成主要为二氧化碳,而不是硫化氢、氨气等有害气体。食醋发黏具体表现为醋液黏稠度增加、流动性变差,搅拌后有拉丝现象。食醋返浑可分为生物性和非生物性,生物性返浑主要表现为醋液浑浊沉淀物增加,一般由于芽孢杆菌属(Bacillus spp.)和葡糖醋杆菌属(Gluconacetobacter)等大量繁殖产生菌体沉淀和代谢物所致[4]。食醋产膜主要是由微生物引起,据目前报道导致食醋产膜的主要是好氧微生物,如:醋酸杆菌属(Acetobacterium spp.)、一些好氧性芽孢杆菌等[5]。
1.2 微生物污染食醋的原因
我国食醋生产企业常采用开放式固态发酵工艺,该工艺与液态发酵相比具有操作简单、能耗低、发酵过程易控制、对发酵环境要求低、风味良好等优点,深受企业喜爱。但是这种发酵工艺也存在一定的缺点,如环境中微生物容易进入发酵体系造成污染,这是导致食醋变质的因素之一[4]。食醋发酵过程中被微生物污染,污染微生物与发酵微生物产生竞争关系,导致糖化不彻底、酒精发酵和醋酸发酵变弱、原料利用率降低、成品食醋颜色变浅、产品品质不佳、生产成本上升等问题[6]。除此以外,参与发酵过程的某些耐热乳杆菌和芽孢杆菌等存在于生醋中,在后续灭菌工艺中无法彻底杀灭,导致食醋残留污染微生物,进而这些微生物利用食醋中营养物质进行生长繁殖,导致出现产气、浑浊、产生沉淀等变质现象[3]。食醋完成熬制后通常采用管路运输至大罐(缸)进行陈酿,在这一过程中如果运输管路、大罐(缸)清洗消毒不彻底以及陈酿环境如空气带菌,将发生二次污染,此外如包装环节因接触罐管路、包材、空气等引起食醋二次污染微生物,同样都会导致食醋产品发生变质。
2 引起食醋变质的微生物
食醋是一种酸性食品,含有较高含量的乙酸、乳酸等有机酸,这些有机酸不仅赋予食醋独特的风味,影响食醋滋味、口感,还提供低pH环境,使得不耐酸微生物细胞膜遭到破坏、蛋白质和核酸分子变性从而抑制其生长繁殖[7],减少了微生物污染的可能性。即使食醋在出厂前,会对菌落总数和霉菌酵母数等进行检测,在检测均符合要求情况下,食醋产品仍存在货架期内出现胀气变质,甚至酸败、发黏等问题,该现象在夏季尤为突出。导致食醋变质的微生物大多具有较强的耐酸能力,能够在pH 3.0~4.5的食醋中生长繁殖,主要包括芽孢杆菌属、乳杆菌属(Lactobacillus spp.)以及葡糖醋杆菌属等,这些微生物能利用食醋中的还原糖、氨基酸等营养物质,进而导致食醋出现产气、发黏、沉淀、产膜、异味等一系列变质现象。
2.1 芽孢杆菌属
芽孢杆菌属是革兰氏阳性,需氧或兼性厌氧的杆状细菌,具有耐高温、耐酸等特点。芽孢杆菌除了产生芽孢来应对食醋的酸胁迫外,其还能通过代谢途径维持胞内pH的稳定。李长福等[8]研究表明凝结魏茨曼氏菌(Weizmannia coagulans,原名为Bacillus coagulans)在pH 3.5环境,以果糖为碳源时,菌体耐酸能力提高21%,这种变化主要取决于凝结魏茨曼氏菌以果糖为碳源时胞内ATP的提高,细胞膜不饱和脂肪酸含量的增加以及与控制耐酸相关的基因表达水平提高。食醋中的还原糖主要以果糖和葡萄糖为主[9],芽孢杆菌利用食醋的果糖在一定程度上提高了其对食醋耐酸性。在食醋酿造过程中将芽孢杆菌控制在一定范围内有助于食醋的发酵,许伟[10]在镇江香醋发酵阶段分离得到了4株芽孢杆菌,研究发现这些芽孢杆菌能产酸和吡嗪类物质,对食醋风味有着重要影响。康雪梅等[11]从醋醅中分离得到中村芽孢杆菌(Bacillus nakamurai),其在pH 3.0条件下能正常生长且产生的淀粉酶能保存80%以上的酶活性,可提高5.0%~8.4%出醋率,同时该菌具有产3-羟基-2-丁酮能力。但如果食醋在后处理加工过程中未有效杀灭芽孢杆菌,会导致食醋变质。郑宇等[3]采用传统培养和16S rDNA测序技术对产气变质食醋进行研究,从中分离得到16株具有耐热产气性能的菌株,其中10株为芽孢杆菌,分别为耐酸梭状芽孢杆菌(Clostridium aciditolerans)、枯草芽孢杆菌(B.subtilis)、梭状芽孢杆菌属(Clostridium spp.)等。栾春光等[12]采用实时荧光定量聚合酶链式反应(quantitative real-time quantitative polymerase chain reaction,qPCR)对涨壶食醋和未涨壶食醋进行分析,结果表明涨壶食醋中芽孢杆菌浓度为1.0×105 copies/mL,是未涨壶食醋的100倍,以芽孢杆菌为主的多种产气微生物参与了陈酿食醋气体的产生过程,最终导致食醋产品出现产气变质问题。芽孢杆菌不仅会导致食醋产气,甚至还有引起食醋返浑、出现沉淀、恶臭等现象。李伟丽等[13]从返浑腐败食醋中分离得到84株菌,16S rDNA测序结果表明为83株芽孢杆菌和一株耐酸乳杆菌(Lactobacillus acetotolerans),其中芽孢杆菌主要为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、地衣芽孢杆菌(Bacillus licheniformis)、蜡样芽孢杆菌(Bacillus cereus)等,分离得到了产气荚膜梭菌(Clostridium perfringens),它在37 ℃下利用食醋中的多种糖类物质生长繁殖并代谢生成H2S,从而导致食醋风味的变化,使其出现腐败味。王俊等[14]从固态发酵食醋中分离得到的芽孢杆菌,当添加5×103CFU/mL该芽孢杆菌到无菌成品醋中时,9 d便会引起食醋返浑并产生酸臭味,破坏了食醋原有风味。表1列举了不同芽孢杆菌导致食醋出现变质的现象,可知芽孢杆菌可导致食醋出现胀气、产生沉淀浑浊等变质现象,而且由芽孢杆菌引起的变质问题在全国各地均有报道。
表1 芽孢杆菌引起食醋变质现象
Table 1 Bacillus causing spoilage in vinegar

菌株号菌种来源变质现象参考文献W6-XBacillus sp.山西某陈醋胀气[15]4号1号B. tequilensisB. velezensis江苏某调味品厂胀气沉淀[16]A菌Bacillus sp.贵阳某调味品厂返浑[17]X-1X-4Paenibacillus sp.B. cereus宁波某调味品厂产膜[18]TYF-03TYF-11B. ginsengihumi山西某醋厂胀气[19]SG-1SG-2SG-3B. subtilisB. megateriumB. licheniformis内蒙古地区食醋产膜[20]123B. subtilisB. thuringiensisB. amyloliquefaciens山西某食醋厂浑浊[21]
2.2 乳酸菌
乳酸菌在食醋发酵过程中起着重要的作用,其可以利用醋醅中的还原糖等物质产生乳酸、乙酸等有机酸,对食醋风味有着重要的贡献。乳酸菌可以通过氨基酸代谢、脲酶体系、柠檬酸盐代谢等来维持胞内pH的稳定,从而提高耐酸能力。LI等[22]以变质食醋中分离得到的一株金山醋酸乳杆菌产气亚种(Acetilactobacillus jinshanensis subsp.aerogenes)为对象,发现该菌可在6°食醋中存活约15 d,在pH 3.2培养基添加20 mmol/L精氨酸时其生物量提高4.1倍。ZHANG等[23]通过添加外源谷胱甘肽使得乳酸乳球菌 (Lactococcus lactis) SK11在pH 4.0中存活率提高了15.9倍。食醋中氨基酸含量可达3 311.5 mg/100 mL[24],氨基酸代谢能有效提高乳酸菌的耐酸性,使得其能在成品醋pH 3.5~4.0的酸性环境生长,利用食醋中氨基酸、还原糖等营养物质大量繁殖从而引起食醋变质。ENTANI等[25]首次从日本变质的谷物醋中分离鉴定出耐酸乳酸菌(Lactobacillus acetotolerans),该菌生长缓慢,能引起谷物醋浑浊变质。除此以外,翟磊等[26]从污染食醋中分离得到一株耐酸乳杆菌,研究表明该菌以葡萄糖、果糖、纤维二糖等为碳源,代谢产物主要为乙酸和乳酸。WANG等[27]采用改良的MRS培养基从胀气变质食醋中分离得到金山醋酸乳杆菌产气亚种,该菌可利用食醋中的糖类产乳酸和乙酸,具有较强的耐酸性。表2列举了乳酸菌引起食醋变质的现象。由于乳酸菌相对于芽孢杆菌而言耐热性差,因此在防控乳酸菌引起的变质时,采用较低的热灭菌温度即可杀灭。
表2 乳酸菌引起食醋变质现象
Table 2 Lactic acid bacteria causing spoilage in vinegar
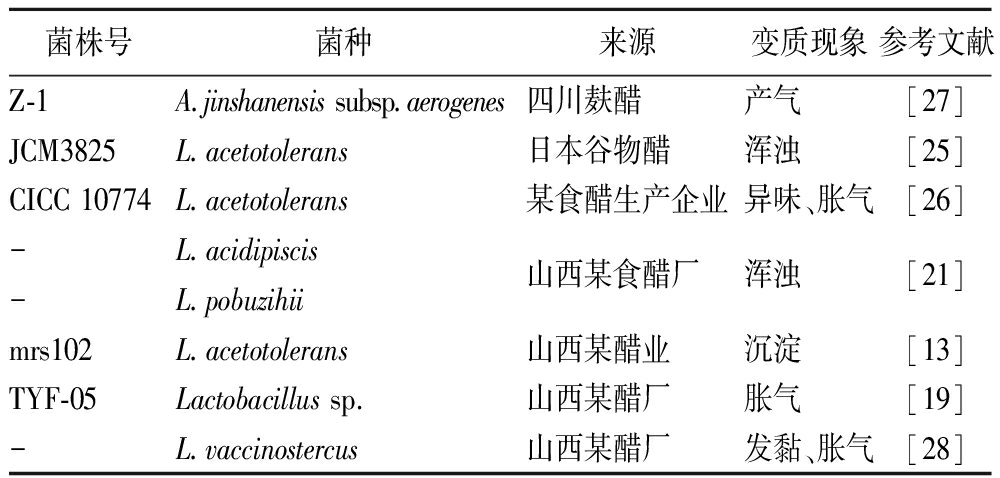
菌株号菌种来源变质现象参考文献Z-1A.jinshanensis subsp.aerogenes四川麸醋产气[27]JCM3825L.acetotolerans日本谷物醋浑浊[25]CICC 10774L.acetotolerans某食醋生产企业异味、胀气[26]-L.acidipiscis山西某食醋厂浑浊[21]-L.pobuzihiimrs102L.acetotolerans山西某醋业沉淀[13]TYF-05Lactobacillus sp.山西某醋厂胀气[19]-L.vaccinostercus山西某醋厂发黏、胀气[28]
2.3 葡糖醋杆菌属
葡糖醋杆菌属能够氧化葡糖酸盐和醋酸盐、具有将乙醇氧化为乙酸的能力,在食醋发酵过程中较为常见[29]。苏俊霞[30]从镇江香醋中分离到一株中间葡糖醋杆菌(Gluconacetobacter intermedius),进一步对其发酵特性进行研究,结果表明该菌能够产生大量乙酸和葡萄糖酸等有机酸以及3-羟基-2-丁酮等风味物质,认为其是镇江香醋发酵过程中的功能微生物。葡糖醋杆菌属中某些菌株还具有产细菌纤维素的能力[31],这些细菌纤维素在食醋中表现为返浑、沉淀、产膜等变质现象。薛建华等[32]从食醋中分离产生絮状物的葡糖醋杆菌。崔云等[17]将返浑食醋中分离得到的葡糖醋杆菌属反接至食醋中,7 d后食醋开始返浑。王俊等[14]研究葡糖醋杆菌对食醋返浑的影响,结果表明接种葡糖醋杆菌的食醋在第24 d后出现返浑现象,沉淀量可达到每100 mL食醋0.303 g。陈菊等[33]采用高通量测序对苹果醋中絮状沉淀物质进行分析,结果表明絮状沉淀中葡糖醋杆菌属占比达15.92%,是沉淀物中的优势菌。以上研究均表明葡糖醋杆菌属是导致食醋变质的主要微生物之一,该菌在食醋中生长繁殖产生细菌纤维素,从而使得食醋表现出返浑、沉淀增加、出现絮状物等固形物增加的变质现象。
2.4 其他微生物
芽孢杆菌属、乳酸菌属和葡糖醋杆菌属是引起食醋变质的常见微生物,除了上述微生物会导致食醋出现变质外,头状葡萄球菌(Staphylococcus capitis)和产碱普罗威登斯菌(Providencia alcalifacien)同样也会引起食醋出现变质,变质现象均表现为产气变质[34-35]。一些不可培养的微生物也有可能会导致食醋出现变质现象。林秀敏等[36]对浑浊食醋进行研究,镜检结果显示其中存在革兰氏阴性菌和酵母菌,但无法进行分离培养,推测可能是由不可培养微生物或非生物因素导致食醋出现浑浊。马净丽等[37]对胀气食醋进行研究,发现导致食醋胀气的为一种耐热杆菌,但该杆菌采用GB/T 4789.22——2003《食品卫生微生物学检验 调味品检验》规定的检测方法未能检出。正如前文所述,部分食醋污染微生物处于活的不可培养状态或为不可培养微生物,使得常用培养基及培养条件不能对其进行分离获得纯培养物。
3 检测方法
3.1 微生物传统分离检测法
针对上述芽孢杆菌属、乳酸菌属、葡糖醋杆菌属等食醋污染微生物的检测鉴定大多先采用固体平板分离、革兰氏染色等传统分离鉴定法,将引起食醋变质的微生物从变质食醋中分离出来,进行初步鉴定。除了依照GB 2719——2018《食品安全国家标准 食醋》对变质食醋中菌落总数和大肠菌群进行检测外,还有学者采用GB/T 4789.22——2003《食品卫生微生物学检验 调味品检验》对沙门氏菌属(Salmonella spp.)、志贺氏菌属(Shigella spp.)、金黄色葡萄球菌(Staphylococcu aureus)等进行检测[38]。牟娟等[39]采用高通量测序技术对产气变质食醋进行研究,结果表明造成食醋产气变质的主要微生物是乳酸杆菌,但是采用PCA培养基、虎红培养基、醋酸菌培养基、MRS培养基均未检出,说明引起食醋胀气的乳酸菌处于活的不可培养状态或为不可培养微生物。如上所述,导致食醋变质的微生物受到食醋特性的影响导致一般培养基无法有效检出,因而需对多种培养基进行选择或优化特定培养基,才可从变质食醋中检出。孙文丽等[16]采用MRS培养基、YPD培养基、糖发酵培养基等常用于微生物分离的培养基均未能从胀气食醋中分离得到变质菌,而采用AAM培养基从中分离获得贝莱斯芽孢杆菌、特基拉芽孢杆菌,从营养肉汤培养基从中分离获得腐生葡萄球菌、头状葡萄球菌等。WANG等[27]采用MRS培养基无法从胀气食醋中分离得到变质菌,将MRS改良后,在厌氧条件下成功分离鉴定出金山醋酸乳杆菌产气亚种,将其回接至食醋中导致产气变质现象。刘芳[40]采用食醋产气菌检测培养基结合杜氏小管对胀气食醋进行检测,结果表明当接种量为1 mL时,该培养基可有效检测出含菌量为10 CFU/mL的污染食醋样品,但检测时间需要18~22 d。
传统分离检测法检测成本低、所需设备少,是分离食醋变质微生物的首要方法。但是这种方法存在一定的缺点,一是需要对不同污染微生物最适培养温度、pH、培养基类型、需氧性等进行探究从而需要花费大量的人力物力。二是检测周期长,一般食醋污染微生物至少需要2 d、多则7 d甚至更长时间进行培养,结果有一定的滞后性。三是结果准确率低,能够分离检测的菌株有限,仅依靠菌落形态、菌体形态及生理生化特征很难对菌株进行准确的鉴定。且食醋中部分微生物受酸胁迫影响而存在活的不可培养状态或为不可培养微生物,不能通过传统分离鉴定法进行检测与鉴定。目前对食醋变质微生物的分离鉴定采用改良培养基的分离法(厌氧或好氧)对引起变质的微生物进行分离,进而采用其他分子生物学技术对其鉴定,可在一定程度上弥补传统分离检测法准确率低的缺点。
3.2 微生物非传统分离检测法
3.2.1 PCR检测技术
PCR的基本原理与DNA复制高度相似,是采用特异性引物针对特定的DNA分子片段进行扩增,对扩增的产物进行检测的一种分子生物学技术。PCR技术可以快速、高效、特异性地检测样品中是否含有目标微生物,可以用于定性、定量判别[41]。
3.2.1.1 环介导等温扩增
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是一种在恒温条件下进行核酸扩增的PCR技术,其具有操作简单、检测结果直观、灵敏性强等优点[42]。在LAMP反应体系中添加钙黄绿素、羟甲基柰酚蓝、酚红等指示剂通过观察显色效果进行定性判断[43]。李涛等[44]以哈维氏弧菌Toic基因为靶基因,构建LAMP对其进行检测,结果表明该方法检测试剂最快为35 min,灵敏度可达100 fg/mL,特异性强,与8种弧菌及金黄色葡萄球菌无交叉反应。李冉等[45]以表皮葡萄球菌SesB基因设计特异性引物,构建LAMP对其进行定性检测,结果表明该方法具有灵敏性强,最低检出限为10 copies/μL。目前LAMP尚未有报道用于食醋变质微生物的检测中,LAMP具有灵敏度高,反应条件简单,整个反应过程仅需65 ℃恒温1 h便可完成,与高通量测序、其他PCR技术相比仪器设备需求低,仅需采用水浴锅便可完成,在基层企业有着被广泛的应用前景。
3.2.1.2 实时荧光定量PCR
将PCR产物进行琼脂糖凝胶电泳,可以将不同分子质量的PCR产物分离出来,通过条带的亮度可以初步的判断扩增产物的浓度,但仍达不到定量要求。qPCR是在普通PCR基础上添加荧光染料或荧光标记的特异性探针,对PCR产物进行标记,进而在扩增过程中对荧光强度进行连续追踪,达到定量要求[46]。qPCR在食品行业有着广泛的应用,如在醋、酸面团、啤酒、发酵乳等食品微生物检测中均有所应用。但目前该技术较少应用于食醋污染微生物的定量分析中,大多应用于检测食醋发酵过程中微生物的定量检测。孙佳[47]以pheS基因序列为靶序列设计特异性引物构建qPCR对镇江香醋中优势菌——金山醋酸乳杆菌(Acetilactobacillus jinshanensis)进行定量分析,研究表明构建的方法特异性高,与醋醅中常见12种细菌无交叉,线性检测范围最低可达2.24 lg(copies/μL),加标回收率为95%~105%。张媛等[48]以A.jinshanensis特有的单拷贝基因为目的基因设计特异性引物,构建qPCR应用于酒醅和酒曲中进行定量分析,结果表明该技术最低检出限为3.5 lg(copies/μL)。如前文所述,导致食醋变质的微生物大多来自于发酵过程中,采用qPCR技术对食醋发酵过程中的微生物进行监控可有效的解决食醋变质问题。
3.2.1.3 叠氮溴化丙锭-qPCR
传统的PCR技术一般是指对整个体系中的某一DNA进行扩增,由于部分已经死亡的微生物DNA并未完全降解,故无法针对活菌进行扩增。研究者利用叠氮溴化丙锭(propidium monoazide,PMA)在强烈自然光下与DNA分子形成共价连接的化学修饰,修饰后的DNA无法经PCR进行扩增,且该染料完全不能透过细胞膜,因此开发出能够单独扩增活细胞的PMA-qPCR[49]。马丹等[50]采用PMA-qPCR建立了高灵敏和高特异性的检测植物乳杆菌的方法,当PMA添加量为2 μg/mL时便可以消除已死亡的植物乳杆菌假阳性的干扰同时不会影响活菌qPCR的扩增,该技术最低检出限可达15拷贝/反应体系,采用该技术对样品进行检测与平板计数法结果无显著差异。ZHOU等[51]采用PMA-qPCR对牛奶中B.cereus进行定量分析,结果表明当添加3 μg/mL PMA时便可以消除死亡的B.cereus假阳性的干扰,检出限可达129 CFU/mL。但目前国内外尚未有PMA-qPCR应用于变质食醋中微生物的检测报道。将该技术应用于食醋生产环节中可有效、快捷地检测出引起食醋变质的微生物,在污染源筛查、定量检测中具有较大的应用前景。
3.2.2 高通量测序技术
常用高通量测序包含扩增子测序、宏基因组测序等方法。扩增子测序通过高通量技术对扩增后的PCR产物进行检测,从而分析该种群物种组成、相对丰度等信息,但是该技术对微生物鉴定仅达属水平,无法鉴定到种水平[52]。宏基因组测序是通过收集样品中的全部DNA来构建宏基因组文库,该技术不仅可以将微生物鉴定到种水平,而且还可以对样品中的特定基因与数据库进行比对筛选出某种特定功能的基因。
高通量测序技术广泛应用于变质食醋中微生物鉴定,能够有效地鉴别引起食醋变质微生物的组成。WANG等[27]采用宏基因组测序技术对产气食醋进行研究,结果表明引起食醋变质的微生物为A.jinshanensis,进一步结合测序结果与数据库注释可知,该菌不含有金黄色葡萄球菌(Staphylococcu aureus)、肠杆菌科等致病菌毒力因子,是一株安全菌株。曹晋宜等[28]采用宏基因组测序技术对发黏食醋进行研究,结果表明发黏食醋中主要微生物为乳酸杆菌,最终采用M17培养基从中分离得到牛痘乳杆菌(Lactobacillus vaccinostercus)。陈菊等[33]采用扩增子测序对苹果醋絮状沉淀进行分析,结果表明絮状沉淀中含有片球菌属(Pediococcus)、葡糖醋杆菌属、乳杆菌属、副球菌属(Paracoccus)、溶杆菌属(Lysobacter)、水杆菌属(Aquabacterium)6个属细菌,将其接种至未变质苹果醋中会进一步导致浑浊。采用高通量测序技术对变质食醋进行检测,可以有效地检测引起食醋变质的主要微生物。可以预见,随着相关高通量测序的快速发展、测序成本的大幅度降低及测序结果分析的自动化和智能化,基于高通量测序技术的快速检测技术在食醋变质微生物,特别是不可培养状态或不可培养微生物的检测中将会得到广泛的应用和发展。
3.2.3 其他检测技术
除上述PCR和高通量测序外,还有酶联免疫法[53]、高光谱成像技术[54]、胶体金免疫层析法[55]等检测技术。其中酶联免疫法是一种以免疫反应为基础的快速检测手段,通过抗体酶复合物与底物发生的颜色反应来检测目标,其操作简单快速,结果准确[56]。酶联免疫法在沙门氏菌属(Salmonella)、大肠杆菌(Escherichia coli)和S.aureus检测中广泛应用,不仅应用于食醋中氨基甲酸乙酯[57]和黄曲霉毒素[58]等有害物质的检测,还在食醋污染微生物的检测中也有所应用,刘书亮等[59]通过建立间接ELISA方法实现了对一株新型食醋污染菌A.jinshanensis的检测,其最低检出浓度为105 CFU/mL,为有效解决食醋污染提供了一种可靠的方法。
传统的检测技术已经不能满足变质食醋微生物的检出要求,而各种新型检测技术仍在发展阶段,存在设备成本高、专业性强、操作复杂等问题。随着研究的不断深入,建立食醋变质微生物的快速检测,并成功应用于食醋行业具有重要意义。
4 食醋污染微生物防控措施
图1为改良后食醋固态发酵生产工艺流程,在物料混合、发酵、翻醅、淋醋环节,环境中的微生物容易进入体系,从而造成污染导致原料利用率下降,进而提高生产成本,因而在每轮发酵结束后应对发酵池、翻醅机等生产装置进行清洗、保持车间整洁。目前食醋固态发酵罐的研究开发已成为热点并具有一定应用前景[60]。
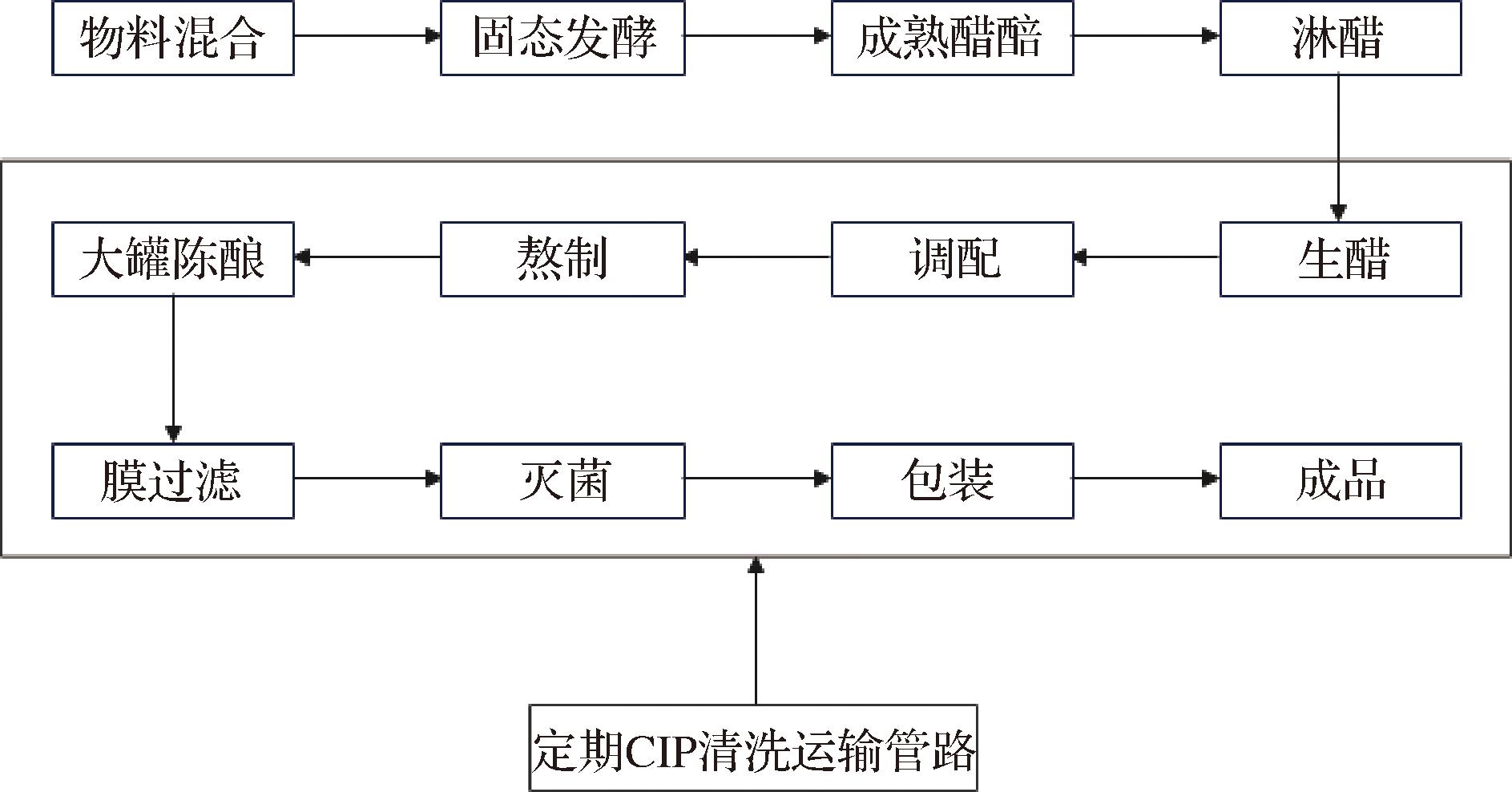
图1 开放式固态发酵生产食醋流程
Fig.1 Open solid-state fermentation production process of vinegar
在食醋调配、陈酿等阶段管路运输、大罐陈酿等后处理阶段是食醋污染的高发阶段,生产企业应注意管路、大罐等是否存在密封不严、渗漏等问题,定期对运输管路、陈酿大罐等设施设备进行微生物监控和CIP清洗,在进行陈酿前采用熬制等热处理工序是保障食醋安全陈酿的重要手段。在食醋陈酿过程中被污染,若污染微生物为乳酸菌、短乳杆菌等不耐热微生物则需要重新加热进行杀菌处理。王建云等[38]研究表明若导致食醋发黏产气的微生物为芽孢杆菌,采用超高温瞬时灭菌(145 ℃,6 s)对食醋进行灭菌处理的效果,在跟踪1年内未发现变质现象。如果超高温瞬时杀菌仍不能有效解决芽孢杆菌污染食醋问题,可适当添加一定的防腐剂如山梨酸钾、苯甲酸钠等抑制其繁殖[5,13]。虽然食醋熬制能够增加食醋风味的生成,但是反复热杀菌会导致原有的挥发性物质减少以及沉淀物质的增加,使得食醋失去原有风味。食醋若被微生物污染后热杀菌无疑会使得生产率下降,增加企业成本,防腐剂的添加会影响消费者的购买欲望,因而从源头做好微生物监控和定期CIP清洗是解决微生物污染食醋的必要措施。
灌装环节是保障食醋产品安全的最后环节,若食醋在这个关键环节引起二次污染耐酸微生物,将会导致食醋在货架期内出现胀气、发黏、沉淀、产膜等一系列问题,企业不仅需要对产品进行召回,还会损害企业在消费者心中形象,造成不可估量的损失。灌装环节的灌装车间空气净化、醋液带菌种类与带菌量测定、管路及设备的清洗消毒、包装材料染菌等步骤均需杀菌或消毒处理并达到企业内控指标要求,加以严格控制和实施有效的检测,防止二次污染的发生,才能有效解决食醋产品变质风险问题。
5 结论及展望
本文对食醋污染微生物原因、导致食醋变质的常见微生物、相关微生物的检测方法以及食醋污染微生物防控措施进行归纳总结。食醋污染最主要的原因是:生醋后处理阶段微生物进入运输管路、大罐(缸)及管路清洗消毒不彻底以及陈酿、包装环境如空气带菌而发生二次污染。最常见的污染微生物是芽孢杆菌、乳杆菌以及葡糖醋杆菌等,这些耐酸微生物通常导致食醋出现产气变质、浑浊、沉淀物增加,严重变质还会出现恶臭、产膜等现象。传统检测方法凭借技术要求与检测成本低的优势,虽然其检测周期长但仍广泛应用于食醋变质微生物的检测。随着科学技术的不断发展,各种新型检测技术层出不穷,但是由于检测设备昂贵、操作复杂、专业性强等原因未能有效应用于食醋变质微生物的检测中。相信随着检测设备成本的下降、操作要求的降低,各种新型检测技术将会不断应用于食醋污染微生物的检测中。
食醋变质微生物研究未来的发展方向主要有:a)虽然新型检测技术层出不穷,但针对食醋变质微生物检测仍主要集中于传统分离检测,新型检测技术是否可用于食醋变质微生物的检测仍需进一步研究。b)目前对食醋变质微生物的研究主要集中于分离鉴定,后续可深入研究食醋变质微生物的变质机制、耐酸机制、是否存在种群互作等方面。
[1] 于华, 唐姣, 赵佳丽, 等. 四川麸醋发酵过程中醋醅理化指标及有机酸变化分析[J]. 中国酿造, 2020, 39(7):51-55.YU H, TANG J, ZHAO J L, et al. Analysis of physicochemical indexes and organic acid changes of Cupei during Sichuan bran vinegar fermentation process[J]. China Brewing, 2020, 39(7):51-55.
[2] KONG Y, ZHANG L L, SUN Y, et al. Determination of the free amino acid, organic acid, and nucleotide in commercial vinegars[J]. Journal of Food Science, 2017, 82(5):1116-1123.
[3] 郑宇, 牛纪伟, 张祥龙, 等. 传统食醋中潜在污染微生物的分离鉴定[J]. 现代食品科技, 2016, 32(11):334-339; 327.ZHENG Y, NIU J W, ZHANG X L, et al. Separation and identification of potential microbial contaminants in traditional vinegar[J]. Modern Food Science and Technology, 2016, 32(11):334-339; 327.
[4] 王兴洁, 刘爱平, 敖晓琳, 等. 中国传统食醋微生物污染及控制措施研究进展[J]. 食品与发酵工业, 2019, 45(10):260-265.WANG X J, LIU A P, AO X L, et al. Microbial contamination and control measures during traditional Chinese vinegar fermentation[J]. Food and Fermentation Industries, 2019, 45(10):260-265.
[5] 赵爽, 朱亚琴, 刘书亮, 等. 袋装变质食醋产膜菌的分离鉴定及其控制[J]. 食品工业科技, 2014, 35(23):118-122.ZHAO S, ZHU Y Q, LIU S L, et al. Identification and controlling of producing membrane strains isolated from bagged deterioration vinegar[J]. Science and Technology of Food Industry, 2014, 35(23):118-122.
[6] 张琪, 王静慧, 花锦, 等. 产黄青霉、扣囊复膜孢酵母替代部分大曲提高食醋原料利用率[J]. 中国酿造, 2018, 37(5):28-32.ZHANG Q, WANG J H, HUA J, et al. Substitutes for part of Daqu with Penicillium chrysogenum and Saccharomycopsis fibuligera to enhance utilization rate of raw materials in vinegar[J]. China Brewing, 2018, 37(5):28-32.
[7] AIT BAHADOU S, OUIJJA A, KARFACH A, et al. New potential bacterial antagonists for the biocontrol of fire blight disease (Erwinia amylovora) in Morocco[J]. Microbial Pathogenesis, 2018, 117:7-15.
[8] 李长福, 吴影, 周子吕, 等. 碳源对凝结芽孢杆菌耐酸特性的影响及其机制研究[J]. 食品与发酵工业, 2019, 45(24):16-21.LI C F, WU Y, ZHOU Z L, et al. Effect and mechanisms of carbon sources on acid tolerance of Bacillus coagulans[J]. Food and Fermentation Industries, 2019, 45(24):16-21.
[9] 凌蕾, 张季, 向丽萍, 等. 基于HPLC-ELSD法测定食醋中5种还原糖的含量[J]. 现代食品, 2020, 26(13):167-171.LING L, ZHANG J, XIANG L P, et al. Determination of sugars in vinegar by HPLC-ELSD[J]. Modern Food, 2020, 26(13):167-171.
[10] 许伟. 镇江香醋醋酸发酵过程微生物群落及其功能分析[D]. 无锡: 江南大学, 2011.XU W. Microbial community and its function analysis during acetic acid fermentation of Zhenjiang aromatic vinegar[D]. Wuxi: Jiangnan University, 2011.
[11] 康雪梅, 罗雯, 郭建, 等. 固态食醋自然发酵醋醅中生淀粉酶产生菌的筛选及初步应用[J]. 中国调味品, 2023, 48(10):78-84.KANG X M, LUO W, GUO J, et al. Screening and preliminary application of raw amylase-producing bacteria in fermented grains by natural fermentation of solid-state vinegar[J]. China Condiment, 2023, 48(10):78-84.
[12] 栾春光, 郝建秦, 李伦, 等. 高通量测序技术在食醋涨壶微生物鉴定中的应用[J]. 中国食品学报, 2018, 18(9):273-279.LUAN C G, HAO J Q, LI L, et al. The characterization of the bacteria responsible for causing package swelling in vinegar using high-throughput sequencing technology[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(9):273-279.
[13] 李伟丽, 赵超, 车建途, 等. 腐败醋中微生物的分离鉴定及乳酸链球菌素对其抑制作用[J]. 食品科学, 2015, 36(1):174-178.LI W L, ZHAO C, CHE J T, et al. Inhibitory effect of nisin on microorganisms isolated and identified from spoiled vinegar[J]. Food Science, 2015, 36(1):174-178.
[14] 王俊, 卢红梅, 崔云. 杂菌污染对固态发酵食醋返混的影响[J]. 食品科学, 2013, 34(5):172-176.WANG J, LU H M, CUI Y. Effect of bacterial contamination on turbidity of solid-state fermented vinegar[J]. Food Science, 2013, 34(5):172-176.
[15] 张怀敏, 段国锋, 李江涌, 等. 导致老陈醋产气微生物的分离和鉴定[J]. 山西农业大学学报(自然科学版), 2016, 36(8):594-598.ZHANG H M, DUAN G F, LI J Y, et al. Isolation and identification of microorganism which led the Vinegar gas-producing[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2016, 36(8):594-598.
[16] 孙文丽, 孙玲, 邢政, 等. 胀气食醋中污染微生物的分离鉴定及其生理生化特性[J]. 食品工业科技, 2018, 39(17):99-105.SUN W L, SUN L, XING Z, et al. Separation, identification, physiological and biochemical characteristics of pollution microbes in swollen vinegar[J]. Science and Technology of Food Industry, 2018, 39(17):99-105.
[17] 崔云, 卢红梅, 张义明, 等. 食醋中微生物的分离与鉴定[J]. 中国酿造, 2008, 27(22):29-31.CUI Y, LU H M, ZHANG Y M, et al. Microbial separation and identification in the vinegar[J]. China Brewing, 2008, 27(22):29-31.
[18] 贺德贵, 邢利民, 盛明健, 等. 浙江玫瑰醋异常发酵微生物的鉴定及控制途径探索[J]. 中国酿造, 2021, 40(11):43-48.HE D G, XING L M, SHENG M J, et al. Identification and control methods exploration of abnormal fermentation microorganisms of Zhejiang rosy vinegar[J]. China Brewing, 2021, 40(11):43-48.
[19] 李敏, 李瑶, 赵魁, 等. 食醋酿造过程中条件致腐微生物的分离鉴定及强产气菌群TYF-LIM-L09的生长特征[J]. 食品与生物技术学报, 2020, 39(5):95-103.LI M, LI Y, ZHAO K, et al. Isolation and identification of high-temperature tolerant spoilage microbes during vinegar brewing and growth characterization of the bacterial consortium TYF-LIM-L09 with A srong gas-producing ability[J]. Journal of Food Science and Biotechnology, 2020, 39(5):95-103.
[20] 杨荣杰. 食醋中产膜菌株的分离鉴定及其特性研究[D]. 呼和浩特: 内蒙古农业大学, 2012.YANG R J. Isolation, identification and characteristics of membrane-producing strains in vinegar[D]. Hohhot: Inner Mongolia Agricultural University, 2012.
[21] LI P, LI S, CHENG L L, et al. Analyzing the relation between the microbial diversity of DaQu and the turbidity spoilage of traditional Chinese vinegar[J]. Applied Microbiology and Biotechnology, 2014, 98(13):6073-6084.
[22] LI Q, HU K D, MOU J, et al. Insight into the acid tolerance mechanism of Acetilactobacillus jinshanensis subsp. aerogenes Z-1[J]. Frontiers in Microbiology, 2023, 14:1226031.
[23] ZHANG J, FU R Y, HUGENHOLTZ J, et al. Glutathione protects Lactococcus lactis against acid stress[J]. Applied and Environmental Microbiology, 2007, 73(16):5268-5275.
[24] 李婷, 王争争, 李慧, 等. 四大名醋呈味物质比较分析[J]. 中国调味品, 2020, 45(10):144-147.LI T, WANG Z Z, LI H, et al. Comparative analysis of flavor substances in the four famous Chinese vinegar[J]. China Condiment, 2020, 45(10):144-147.
[25] ENTANI E, MASAI H, SUZUKI K I. Lactobacillus acetotolerans, a new species from fermented vinegar broth[J]. International Journal of Systematic Bacteriology, 1986, 36(4):544-549.
[26] 翟磊, 程宵宵, 苏姣姣, 等. 一株食醋污染菌CICC10774的鉴定及其生长代谢特性[J]. 微生物学通报, 2016, 43(7):1524-1531. ZHAI L, CHENG X X, SU J J, et al. Identification and characterization of strain CICC 10774 causing vinegar spoilage[J]. Microbiology China, 2016, 43(7):1524-1531.
[27] WANG X J, HU K D, LIU F, et al. Isolation and characterization of a gas-producing and acid-resistant bacterium from spoiled vinegar[J]. International Journal of Food Microbiology, 2023, 394:110167.
[28] 曹晋宜, 赵红年, 赵凌雁, 等. 食醋中有害微生物的分离与鉴定[J]. 中国酿造, 2017, 36(2):115-118.CAO J Y, ZHAO H N, ZHAO L Y, et al. Isolation and identification of harmful microorganism from vinegar[J]. China Brewing, 2017, 36(2):115-118.
[29] LU Z M, WANG Z M, ZHANG X J, et al. Microbial ecology of cereal vinegar fermentation: Insights for driving the ecosystem function[J]. Current Opinion in Biotechnology, 2018, 49:88-93.
[30] 苏俊霞. 镇江香醋醋醅中醋酸菌多样性及Gluconacetobacter intermedius特性的研究[D]. 无锡: 江南大学, 2014.SU J X. Study on the diversity of acetic acid bacteria and the characteristics of Gluconacetobacter intermedius in Zhenjiang vinegar fermented grains[D]. Wuxi: Jiangnan University, 2014.
[31] SOUZA E F, FURTADO M R, CARVALHO C W P, et al. Production and characterization of Gluconacetobacter xylinus bacterial cellulose using cashew apple juice and soybean molasses[J]. International Journal of Biological Macromolecules, 2020, 146:285-289.
[32] 薛建华, 梁建明, 王福中. 食醋中絮状物产生菌的分离鉴定及检测方法研究[J]. 中国酿造, 2014, 33(1):114-116.XUE J H, LIANG J M, WANG F Z. Isolation, identification and detection methods for floc-producing bacteria in vinegar[J]. China Brewing, 2014, 33(1):114-116.
[33] 陈菊, 陈林, 胡涛, 等. 苹果醋饮料生产过程微生物污染关键点的分析[J]. 食品与发酵工业, 2019, 45(21):195-200.CHEN J, CHEN L, HU T, et al. Analysis of critical site for microbial contamination in apple vinegar beverage production[J]. Food and Fermentation Industries, 2019, 45(21):195-200.
[34] 白成松, 卢红梅, 杨新, 等. 赤水晒醋一株产气微生物的分离鉴定[J]. 中国酿造, 2017, 36(6):72-75.BAI C S, LU H M, YANG X, et al. Isolation and identification of a gas-producing bacterium from Chishui Sun vinegar[J]. China Brewing, 2017, 36(6):72-75.
[35] 李盈颖, 高雯, 周帼萍. 山西老陈醋样品的污染微生物分析[J]. 食品科学, 2016, 37(12):226-231.LI Y Y, GAO W, ZHOU G P. Case analysis of contaminated Shanxi aged vinegar[J]. Food Science, 2016, 37(12):226-231.
[36] 林秀敏, 陈楷, 蒋佳希, 等. 食醋浑浊现象的微生物因素分析与探讨[J]. 食品安全质量检测学报, 2017, 8(4):1293-1297.LIN X M, CHEN K, JIANG J X, et al. Analysis and discussion on microbial factors of turbidity of vinegar[J]. Journal of Food Safety &Quality, 2017, 8(4):1293-1297.
[37] 马净丽, 钱锋. 解决食醋胀桶问题的探讨[J]. 中国酿造, 2010, 29(9):123-127.MA J L, QIAN F. How to prevent barrel packed vinegar from barrel-swelling problem[J]. China Brewing, 2010, 29(9):123-127.
[38] 王建云, 秦伟军, 李圣云, 等. 食醋发粘劣变控制技术研究[J]. 中国调味品, 2016, 41(6):117-120.WANG J Y, QIN W J, LI S Y, et al. Study on control technology of vinegar about pastiness and deterioration[J]. China Condiment, 2016, 41(6):117-120.
[39] 牟娟, 刘芳, 王兴洁, 等. 胀气变质食醋理化指标及细菌多样性分析[J]. 食品与发酵工业, 2021, 47(20):278-284.MOU J, LIU F, WANG X J, et al. Analysis of physicochemical indexes and bacterial diversity of swollen vinegar[J]. Food and Fermentation Industries, 2021, 47(20):278-284.
[40] 刘芳. 胀气变质食醋特性及其污染微生物检测与控制研究[D]. 雅安: 四川农业大学, 2018.LIU F. Study on the characteristics of flatulence deteriorated vinegar and the detection and control of its polluting microorganisms[D]. Ya’an: Sichuan Agricultural University, 2018.
[41] 刘津, 刘二龙, 谢力, 等. 数字聚合酶链式反应技术在食品安全检测领域的研究应用进展[J]. 食品科学, 2016, 37(17):275-280.LIU J, LIU E L, XIE L, et al. Progress in research and application of digital polymerase chain reaction (dPCR) in food safety detection[J]. Food Science, 2016, 37(17):275-280.
[42] FEI Y J, WU Z F, SHEN K X, et al. A contamination-free and visual method using LAMP (loop-mediated isothermal amplification) and molecular beacon for sensitive and specific detection of rainbow trout (Oncorhynchus mykiss)[J]. Food Control, 2023, 154:110014.
[43] 高洁, 王楠, 张娟, 等. 基于环介导等温扩增技术快速检测疣孢褐盘菌[J]. 食品安全质量检测学报, 2022, 13(20):6503-6510.GAO J, WANG N, ZHANG J, et al. Rapid detection of Peziza badia based on loop-mediated isothermal amplification method[J]. Journal of Food Safety &Quality, 2022, 13(20):6503-6510.
[44] 李涛, 周永灿, 曹贞洁, 等. 哈维氏弧菌可视化LAMP快速检测方法的建立及应用[J]. 广东海洋大学学报, 2023, 43(6):81-88.LI T, ZHOU Y C, CAO Z J, et al. Establishment and application of rapid visual LAMP method for detection of Vibrio harveyi[J]. Journal of Guangdong Ocean University, 2023, 43(6):81-88.
[45] 李冉, 薛晶, 郭文平, 等. 环介导等温扩增技术可视化快速检测表皮葡萄球菌方法的建立[J]. 承德医学院学报, 2023, 40(6):456-460.LI R, XUE J, GUO W P, et al. Development of loop-mediated isothermal amplification for rapid and visual detection of Staphylococcus epidermidis[J]. Journal of Chengde Medical University, 2023, 40(6):456-460.
[46] KUBISTA M, ANDRADE J M, BENGTSSON M, et al. The real-time polymerase chain reaction[J]. Molecular Aspects of Medicine, 2006, 27(2-3):95-125.
[47] 孙佳. 金山醋酸乳杆菌比较基因组分析与酿醋功能评价[D]. 无锡: 江南大学, 2021.SUN J. Comparative genome analysis and vinegar-making function evaluation of Lactobacillus acetobacter Jinshan[D]. Wuxi: Jiangnan University, 2021.
[48] 张媛, 廖卫芳, 缪礼鸿, 等. 采用实时荧光定量PCR法检测白酒酿造系统中的重要功能菌株Lactobacillus jinshani[J]. 食品与发酵工业, 2022, 48(6):270-275.ZHANG Y, LIAO W F, MIAO L H, et al. Detection of important functional strain Lactobacillus jinshani in Baijiu brewing system by real-time fluorescence quantitative PCR[J]. Food and Fermentation Industries, 2022, 48(6):270-275.
[49] ZENG D X, CHEN Z, JIANG Y, et al. Advances and challenges in viability detection of foodborne pathogens[J]. Frontiers in Microbiology, 2016, 7:1833.
[50] 马丹, 杨彬彬, 陶文靖, 等. 叠氮溴化丙锭-qPCR法定量检测植物乳杆菌[J]. 食品安全质量检测学报, 2021, 12(12):4867-4875. MA D, YANG B B, TAO W J, et al. Quantitative detection of Lactobacillus plantarum by propidium monoazide-qPCR[J]. Journal of Food Safety &Quality, 2021, 12(12):4867-4875.
[51] ZHOU P, XIE G Y, LIANG T B, et al. Rapid and quantitative detection of viable emetic Bacillus cereus by PMA-qPCR assay in milk[J]. Molecular and Cellular Probes, 2019, 47:101437.
[52] WU L Y, WEN C Q, QIN Y J, et al. Phasing amplicon sequencing on Illumina Miseq for robust environmental microbial community analysis[J]. BMC Microbiology, 2015, 15:125.
[53] 邱黎. 酶联免疫吸附技术在食品微生物检测中的应用[J]. 食品安全导刊, 2022(33):178-181.QIU L. Application of enzyme-linked immunosorbent assay in the detection of food microorganisms[J]. China Food Safety Magazine, 2022(33):178-181.
[54] 赵婕秀, 董庆利, 陈培琴, 等. 高光谱成像技术在动物源性食品微生物污染快速检测中的应用进展[J]. 食品工业科技, 2022, 43(7):467-473.ZHAO J X, DONG Q L, CHEN P Q, et al. Application progress of hyperspectral imaging technology in rapid detection of microbial contamination in animal derived food[J]. Science and Technology of Food Industry, 2022, 43(7):467-473.
[55] LIN L, SONG S S, WU X L, et al. A colloidal gold immunochromatography test strip based on a monoclonal antibody for the rapid detection of triadimefon and triadimenol in foods[J]. Food and Agricultural Immunology, 2020, 31(1):475-488.
[56] GRACIAS K S, MCKILLIP J L. A review of conventional detection and enumeration methods for pathogenic bacteria in food[J]. Canadian Journal of Microbiology, 2004, 50(11):883-890.
[57] 任勃儒. 发酵醋液中氨基甲酸乙酯免疫快速检测技术研究[D]. 保定: 河北大学, 2016.REN B R. Study on rapid immunoassay of ethyl carbamate in fermented vinegar[D]. Baoding: Hebei University, 2016.
[58] 齐惠萍, 吕建明, 李常青. ELISA法检测食醋中黄曲霉毒素B1方法的改进[J]. 中国食品卫生杂志, 2008, 20(4):313-315.QI H P, LYU J M, LI C Q. Improvement on pretreatment method of aflatoxin B1 in vinegar with enzyme-linked immunosorbent assay[J]. Chinese Journal of Food Hygiene, 2008, 20(4):313-315.
[59] 刘书亮, 王兴洁, 李建龙, 等. 一株新型食醋污染菌的间接ELISA检测方法, 中国, 202210437222.4[P]. 2022.10.25.LIU S L, WANG X J, LI J L, et al. Indirect ELISA for a novel vinegar contaminating strain, China, 202210437222.4[P]. 2022.10.25.
[60] 李晓伟. 食醋固态发酵罐条件优化及发酵动力学分析[D]. 天津: 天津科技大学, 2022.LI X W. Optimization of solid-state fermentation conditions of vinegar and analysis of fermentation kinetics[D]. Tianjin: Tianjin University of Science &Technology, 2022.