燕窝是雨燕科金丝燕属鸟类用其分泌出的唾液与其羽毛混合筑成的巢窝[1],用于产卵和孵育雏燕,当雏燕成年飞走后燕窝即被舍弃,随后被人们采摘下来并加工成可食用燕窝[2]。燕窝自古有“东方珍品”、“稀世名药”的美称,随着社会的进步和人们生活质量的提高,燕窝产品正逐渐进入寻常百姓家,成为众多消费者追捧的滋补品。我国已成为全球燕窝深加工与消费的中心,2022年国内燕窝市场规模达到430亿元。自古国人便将燕窝看作是一种药食两用的天然滋补品,据《本草求真》《本草纲目拾遗》等中医药物典籍记载,燕窝具有益气补中、滋阴润肺、化痰止咳,治疗肺结核、慢性腹泻等功效。20世纪90年代以来,随着药理和药效学研究的深入,国内外学者进一步揭示了燕窝在免疫调节、抗病毒、改善神经退行性疾病、提高智力与记忆力等方面的积极作用[3],使燕窝的健康价值得到了更为广泛的认可。
神经退行性疾病,作为一类由病理性蛋白积累、突触及神经元网络功能异常等核心病理机制引发的神经元损伤性疾病,其显著症状包括记忆力衰退、行为异常以及认知功能下滑等[4]。当下,我国正步入老龄化社会,老年人口不断增长,与之伴随的是老年性痴呆、震颤性麻痹、卒中及多灶性、梗塞性痴呆等神经退行性疾病的频发。这些疾病在降低患者生活质量的同时,也给家庭和社会带来了沉重的负担。因此,发展神经退行性疾病的预防和改善方法具有重要现实意义。神经炎症是神经退行性疾病的病理表现及重要诱因之一,膳食营养干预在神经炎症相关的神经退行疾病中具有预防作用。研究表明,燕窝作为一种药食两用资源,对神经退行性疾病、焦虑和抑郁等具有潜在的改善作用[5-6]。本文旨在全面梳理燕窝神经保护作用的研究进展,为燕窝神经保护作用的进一步研究提供参考。
1 燕窝的基本组成与活性成分
1.1 燕窝基本营养成分
燕窝的分类方式多样,包括考虑其原产地、杂质含量、筑巢地点、色泽、形态部位以及食用方式等,多项国内外研究显示,尽管燕窝分类多样,但不同类别燕窝在营养成分的种类上并无显著区别[7]。在组分构成上,燕窝表现出较全面的营养特性,其主要成分包括蛋白质(>50%)、碳水化合物(20%~30%)、矿物质(5%)和脂肪(<0.5%)[3,7-8]。燕窝中蛋白质含量最高,其中必需氨基酸包括赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸,总必需氨基酸含量达到17.8 g/100 g[8]。燕窝中主要的碳水化合物为唾液酸,平均含量约为10%[9]。由于燕窝中唾液酸含量在天然食物中居首,故唾液酸又被称为“燕窝酸”。燕窝中的矿物质主要为钙、镁、钠、钾等常量元素和铁、锌、锰、铬、铜等必需微量元素。另外,有研究表明燕窝中还存在微量的类表皮生长因子[9]。
1.2 燕窝主要活性成分
1.2.1 蛋白质
燕窝中蛋白质含量丰富,占燕窝总成分的半数以上。前期研究从燕窝中鉴定出398种蛋白[3],其中多种蛋白质具有神经保护作用。HOU等[10]研究表明燕窝内富含乳铁蛋白和卵转铁蛋白,这两种蛋白通过清除人神经母细胞瘤细胞(SH-SY5Y细胞)中的自由基物质,有效促进了神经细胞的保护活性。ZUKEFLI等[11]研究结果显示,燕窝中存在法氏囊上皮与具有支持突触延伸作用的神经元糖蛋白前体,有一定的神经营养功能。YEW等[12]则在研究中发现,燕窝中含有排斥性引导分子蛋白质家族成员B,这种蛋白作为一类骨形态发生蛋白(bone morphogenetic protein,BMP)共受体,可以通过BMP信号途径促进突触的延展和轴突的伸长,也在神经系统的发展进程中起到重要作用。
1.2.2 聚糖
碳水化合物是燕窝中含量仅次于蛋白质的物质,约占总成分的20%~30%。燕窝中的碳水化合物组成较为特殊,基本单元包括唾液酸(7.64%~12.52%)、N-乙酰氨基半乳糖(3.79%~7.20%)、N-乙酰氨基葡萄糖(4.76%~5.64%)、半乳糖(4.58%~16.90%)、甘露糖(0.48%~1.05%)、岩藻糖(0.36%~1.14%),少数研究还检测到微量的木糖(0.21%)和鼠李糖(0.02%)[13]。DAUD等[14]发现燕窝聚糖的聚合度分布在7~22,单糖之间存在较多的β-糖苷键连接形式。燕窝聚糖进一步与肽段上的天冬酰胺氮或丝/苏氨酸羟基以共价结合的形式连接,分别形成N型糖或O型糖链。WIERUSZESK等[15]对燕窝进行碱性还原处理后,释放得到的O型糖为单或双唾液酸化。日本学者YAGI的团队则报道了燕窝中N型聚糖的结构,发现一个含有α-2,3-N-乙酰神经氨酸残基的三触角结构为N聚糖的主要成分(57%),N聚糖中唾液酸化高分支的结构有助于抑制流感病毒感染[16]。YOU等[17]从燕窝炖煮后的上清液中,纯化得到3种唾液酸化的糖蛋白(43 kDa α-2,3,50 kDa α-2,6,43 kDa α-2,6),凝集素染色显示唾液酸主要以α-2,3连接形式结合在糖链的末端。LIU等[18]研究发现甘露聚糖可通过对肠道中微生物组的重塑和增强短链脂肪酸的形成显著减轻五转家族性阿尔茨海默病模型小鼠的认知和精神缺陷。与燕窝多糖结构相似的五味子多糖也被证实可通过调控肠-脑轴发挥神经保护作用[19]。因此,燕窝中的聚糖也可能是具有神经保护作用的活性物质。
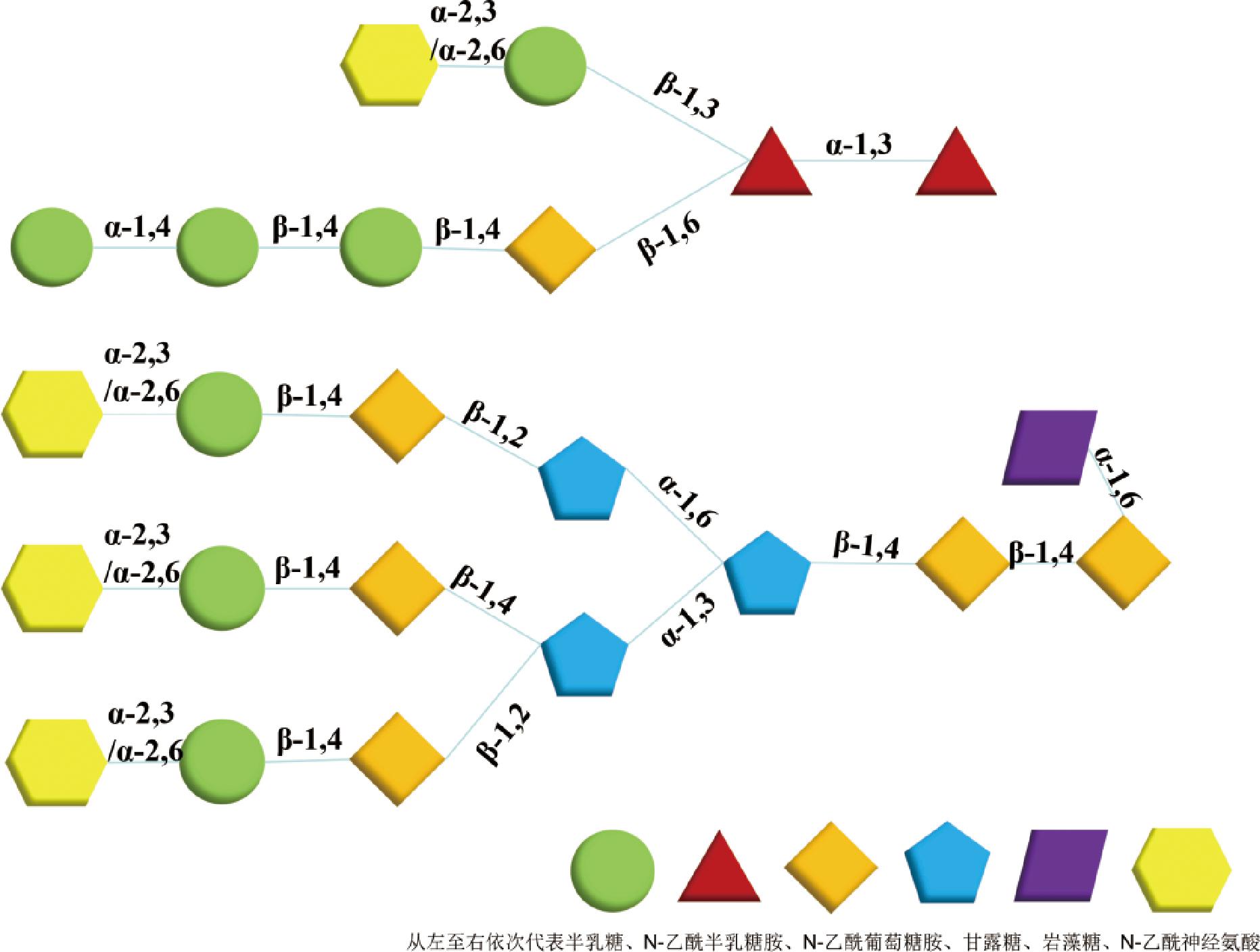
图1 燕窝中O糖链(上)、N糖链(下)典型结构
Fig.1 The typical structure of O-glycan (top) andN-glycan (bottom) chain in edible bird’s nest
1.2.3 唾液酸
唾液酸是燕窝成分中最主要的单糖代表,约占燕窝干重的7%~15%。唾液酸是具有九碳骨架的α-酮酸,是一系列羧基化单糖酰化的衍生物。根据C-5上连接基团的不同,唾液酸可分为神经氨酸、脱氨神经氨酸、N-乙酰神经氨酸(N-acetylneuraminic acid Neu5Ac)和N-羟基乙酰神经氨酸四种。目前鉴定出燕窝中的唾液酸种类以Neu5Ac主,故Neu5Ac也被称为燕窝酸。唾液酸一般结合在糖脂或糖蛋白糖链的非还原末端,燕窝中的唾液酸则以α-2,3或2,6糖苷键与半乳糖相连,进而连接在N型或O型聚糖末端,且多个唾液酸分子可能结合在同一分支化的糖链上。唾液酸被认为可以改善大脑功能,这一点也在许多研究中得到证实。AHMAD等[20]研究发现唾液酸提取物可以有效改善小鼠的大脑认知能力,这与嗜铬细胞瘤和神经母细胞瘤细胞系的活力增加有关。在另一项对胚胎神经外胚层干细胞模型的研究中,Neu5Ac还被证明能通过显著促进神经元分化、迁移和增殖发挥神经营养作用[12]。WANG[21]的研究则从基因层面上揭示了唾液酸改善大脑的功能,他发现富含唾液酸的饮食会增加仔猪大脑中的唾液酸水平和2个学习相关基因的表达,同时也会增强他们的记忆能力和学习能力。
2 燕窝神经保护作用及机制
2.1 神经营养作用
孕期及哺乳期女性在燕窝消费人群中占有较高比例。目前已有一些研究揭示了妊娠期和/或哺乳期摄入燕窝对子代智力发育的影响,其机制主要集中在唾液酸的神经营养作用方面。燕窝的特征成分唾液酸对婴儿的大脑发育至关重要,它参与构成神经节苷脂和聚唾液酸。而神经节苷脂在增强突触通路、记忆的形成以及神经细胞的生长方面发挥着关键作用[22-23]。MIJDAM等[24]发现,发育中的神经元对唾液酸的需求量很大,如果唾液酸生物合成途径被阻断将导致异常的突触形成,从而导致不规则神经元网络的异常形成。此外,XIE等[25]发现母鼠在孕期或哺乳期摄入燕窝后,其子代在Morris水迷宫实验中展现出了卓越的空间学习能力。同时,这些子代位于海马体CA1、CA2、CA3区域的脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)水平显著上升,且CA1、CA2、CA3、DG区的神经元数量也明显增加。类似地,MAHAQ等[26]的研究也指出,经过连续6周的燕窝喂养后,母鼠(F0)的后代(F1和F2)在Y迷宫实验中表现出优于对照组的空间识别能力,且这些后代的大脑中与学习记忆功能密切相关的基因,如GNE、ST8SiaIV、SLC17A5和BDNF的表达水平均有所上调。Siglecs是糖基化识别因子,主要存在于免疫细胞中,能够识别及结合不同糖基化位点,调节肠道微生物,进一步影响宿主免疫应答[14]。鲁佩涵等[27]发现唾液酸可以通过升高唾液酸结合免疫球蛋白样凝集素(sialic acid-binding immunoglobulin-like lectins,Siglecs)水平调节肠道代谢产物,如短链脂肪酸和神经递质类似物质,从而影响神经传递及认知功能,促进BDNF分泌来营养神经。这些发现为燕窝通过神经营养作用促进神经系统发育和学习记忆功能提供了有力的证据。
2.2 基于氧化应激调控的神经保护作用
氧化应激是指机体在清除体内的老化细胞或遭受不同类型的伤害时,体内活性氧(reactive oxygen species,ROS)生成量过多,从而导致正常的氧化/抗氧化平衡被破坏,是一种对细胞有害的病理过程[28]。中枢神经系统因其需氧量高,抗氧化损伤能力较差,极易受到氧化应激损伤的影响。氧化应激反应可引起血管内皮损伤,刺激凝血因子释放,引起血液流变学改变,并可影响血脑屏障,激活神经胶质细胞,加速神经细胞凋亡[29]。同时,氧化应激导致细胞内ROS累积,过量ROS促进蛋白质修饰和DNA损伤,进一步诱导神经元死亡,从而诱发神经疾病。
由于组分中含有氨基酸、唾液酸、甘油三酯、维生素、乳铁蛋白、葡萄糖胺等成分,燕窝一直被认为具有较高的抗氧化活性,主要体现在可以减少自由基的生成并增强抗氧化酶谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的表达来降低氧化应激水平[30]。GSH-Px是人体内重要的抗氧化酶,主要发挥防御功能,催化神经细胞中的神经递质多巴胺自动氧化并释放的有毒的多巴胺-醌类物质、超氧自由基和过氧化氢的还原,从而消除这些有毒物质的活性。超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)是评价氧化应激水平的常见指标。董建辉等[31]通过对氧化应激细胞模型的研究证实,燕窝及其活性肽能够通过提高SOD、GSH-Px两种酶的活性降低胞内ROS、MDA水平,从而缓解氧化应激。HU等[32]试验结果则表明燕窝能通过提高果蝇体内SOD和过氧化氢酶的活性并降低MDA积累水平,从而实现抗氧化作用,能有效延缓果蝇衰老并推迟其死亡时间。此外,燕窝中的甘油三酯富含不饱和脂肪酸,可发挥抗氧化作用,降低氧化应激水平[3]。燕窝被报道保护下丘脑-神经垂体系统细胞免于H2O2的毒性,其提取物保护人肝癌细胞免于H2O2诱导的毒性反应。YEW等[33]也在SH-SY5Y细胞实验的基础上,证实了燕窝提取物能够通过双重机制有效抑制细胞凋亡:一是提高细胞活力,二是抑制氧化应激与Caspase-3的激活。Caspase-3是一种关键的蛋白酶,不仅主导细胞凋亡过程,还是细胞毒性T淋巴细胞杀伤机制的重要参与者。这一发现为燕窝在氧化应激导致的神经退行性疾病治疗中提供了潜在的治疗价值。
2.3 基于炎症调控的神经保护作用
炎症反应作为机体对抗内外刺激的一种固有免疫机制,具有双重性。它在清除内外刺激源、修复机体损伤方面发挥关键作用,然而,过度激活的炎症反应却可能对机体造成损害。特别对于大脑而言,这种脑部的炎症反应所带来的损伤可能是导致急性或慢性脑部疾病的元凶之一[34-35]。这种神经炎症会扰乱中枢神经系统功能,诱发脑内神经元细胞的凋亡以及突触功能受损,从而导致大脑的学习认知功能衰退[36-37]。在神经炎症的进程中,小胶质细胞和星形胶质细胞作为关键的细胞介质,其活动会进一步加剧该病理状态的发展[38-39]。
大量研究表明燕窝可以通过调控炎症发挥神经保护作用。由艳燕[40]针对脂多糖诱导的小鼠RAW264.7单核巨噬细胞,分析了不同燕窝糖蛋白对细胞增殖和NO生成的抑制效应,结果揭示这些糖蛋白展现出了极为显著的抗炎活性。这一发现为燕窝在神经保护领域的应用提供了有力的科学支撑。除此之外,研究表明燕窝中的酸性哺乳动物几丁质酶能够通过激活辅助型Th2细胞产生控制抗炎反应的白细胞介素-13,同时燕窝中的赖氨酰氧化酶样蛋白3通过去除信号转导及转录激活子的乙酰基和乙酰氨基基团,有助于控制炎症反应[2]。另外,CAREENA等[5]基于Wistar大鼠模型的研究揭示了燕窝的多重功效。他们发现,燕窝能够显著抑制肿瘤坏死因子、白细胞介素-1β及白细胞介素-6等炎症性细胞因子的产生,同时对抗神经炎症和氧化应激过程,保护神经系统,对预防阿兹海默症等神经退行性疾病具有潜在价值。YEW等[41]的研究则聚焦于燕窝对羟基多巴胺处理的C57BL/6 J小鼠的神经保护作用。研究结果表明,燕窝不仅能通过增强谷胱甘肽过氧化物酶-1的表达和小胶质细胞的活化来增强神经保护,而且可以通过减少NO的生成和脂质过氧化有效抑制神经炎症反应,从而展现出显著的神经保护效果。
2.4 基于肠-脑轴调控的神经保护作用
2.4.1 燕窝的消化吸收特性
燕窝进入人体需要经过胃肠道的消化、吸收作用,随后进入代谢途径,参与某个或某几个通路环节中酶或小分子代谢物的上调或下调,从而表现出一定的生物活性。对燕窝的营养学评价以及功效机制解析,离不开对燕窝的消化吸收情况的分析。林洁茹[42]采用美国药典方法对80 ℃煮1 h后的燕窝粉末模拟消化,经SDS-PAGE电泳凝胶分离,发现燕窝蛋白质大部分为不溶于水的高分子蛋白,分子质量达100 kDa以上;经胃蛋白酶或胰蛋白酶消化,水解物大部分可溶于水,消化后蛋白质主要分布在55~100 kDa。鉴于燕窝内含有一部分中高分子量的蛋白质,而这些蛋白质具备抗消化特性,推测其有可能在肠上皮细胞表面直接产生效用,进而激活肠道免疫系统并发挥出药理作用。王鑫等[44]对燕窝粉末炖煮后进行体外静态模拟胃肠消化,发现消化产物中仍残留50%以上不溶物;可溶性蛋白质水解度为11.54%,其中糖蛋白被水解成37~150 kDa的条带,这些糖链与蛋白质之间紧密结合;总糖的溶解度低于40%,未溶解态唾液酸质量分数达到56%。综合上述研究可以发现,燕窝中蛋白质的溶解度相对较低,并且经过消化后,多肽、游离态以及聚糖态的唾液酸含量也较低,推测燕窝中部分抗消化蛋白质可能直接作用于肠道发挥作用。
目前针对燕窝吸收的研究相对较少。由艳燕[40]通过人结肠腺癌细胞(Caco-2细胞)跨膜转运吸收模型,发现燕窝酶解产物的添加浓度为200 mg/mL时,3 h后仅有微量糖蛋白透过单层细胞膜,浓度低于使用方法的检出限。在5~30 min,检测到细胞膜电位跨上皮电阻值随作用时间延长而降低,说明酶解产物作用使细胞间紧密连接暂时开放,大分子如糖肽、肽以及蛋白质,在通过肠道单细胞层时,倾向于利用胞旁转运的方式,这一机制与蛋白质和多肽在肠道内的吸收方式相吻合。因此推测燕窝的消化产物在肠道内的吸收主要依赖胞旁转运。然而,值得注意的是,小肠肠管表面的细胞间隙仅占总面积的1%~10%,且这些间隙高度紧密连接,因此燕窝消化产物对肠道细胞紧密连接的影响较小,其吸收率受到限制,尤其是大分子蛋白的吸收效率显著低下。因此,燕窝消化产物中较高分子质量的蛋白、糖肽和多肽很可能进入结肠发挥效用。
2.4.2 燕窝的肠道益生作用
近5年来,越来越多的学者关注燕窝中耐消化成分的益生活性。DAUD等[14]将燕窝多糖提取物和燕窝糖蛋白模拟消化后,在体外模拟发酵模型中与相关微生物共培养。结果表示,上述2种消化产物均诱导双歧杆菌的数量显著增加;与改善炎症相关的2种菌属奇异菌属(Atopobium spp.),普拉梭菌(Faecalibacterium prausnitzii)(普拉梭菌)的数量增加且生长时间延长。在燕窝聚糖作用下,能够改善肠道失调的梭状芽孢杆菌(产丙酸和丁酸)在发酵6 h内高增长,在发酵12 h后仍持续增长。24 h发酵后,燕窝聚糖发酵组中获得大量的乙酸、丙酸和少量的丁酸,而燕窝糖肽组中主要为乙酸、丙酸和丁酸。鲁佩涵等[27]则进一步探究唾液酸结构对燕窝益生活性的影响,发现去唾液酸燕窝(acidolysis bird’s nest,ABN)和Neu5Ac单体在抗氧化、促益生菌生长和短链脂肪酸产生等生理活性与燕窝存在显著差异。具体而言,燕窝能有效促进短双歧杆菌、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)等益生菌的生长,并通过增加乙酸、丁酸的含量优化肠道环境,而ABN则不具备这种效果。为了验证这一发现,研究者们进一步展开了孕妇粪便的体外发酵实验。他们观察到燕窝能够降低孕晚期孕妇粪菌中肠杆菌属(Enterobacter)、大肠杆菌-志贺氏菌(Escherichia-Shigella)和克雷伯氏菌属(Klebsiella)等致病菌的丰度,同时增加拟杆菌属(Bacteroides)等潜在益生菌以及粪杆菌属(Faecalibacterium)和粪球菌属(Coprococuus)等产短链脂肪酸菌的丰度。张晓旭等[45]通过运用高分辨率质谱技术,对鲜炖燕窝中的小分子物质进行了深入分析,并进一步探讨了这些物质与肠道菌群的关联性。研究结果显示,特定的脂类物质,特别是那些含有芳香C![]() C双键、羧酸键以及酰胺键的磷酸酯类和脂肪酰类物质,与肠道中的有益菌群呈正相关关系,而与有害菌群则显示出负相关趋势。由此可见,燕窝对肠道菌群有一定的调控能力,燕窝糖蛋白或聚糖是一类潜在的益生元,并且燕窝中唾液酸糖链结构的完整性对其益生效果具有关键作用。
C双键、羧酸键以及酰胺键的磷酸酯类和脂肪酰类物质,与肠道中的有益菌群呈正相关关系,而与有害菌群则显示出负相关趋势。由此可见,燕窝对肠道菌群有一定的调控能力,燕窝糖蛋白或聚糖是一类潜在的益生元,并且燕窝中唾液酸糖链结构的完整性对其益生效果具有关键作用。
2.4.3 基于肠-脑轴的神经保护作用研究进展
肠-脑轴是一个复杂的通信系统,它涵盖了中枢神经系统(central nervous system,CNS)、自主神经系统的交感神经与副交感神经分支、肠神经系统、下丘脑-垂体-肾上腺轴、神经内分泌系统以及神经免疫系统,实现了中枢神经系统与肠道神经系统之间的双向互动。1931年EULER等[46]在探究乙酰胆碱在兔肠组织中的分布时,偶然发现一种具有某种生物活性的物质同时存在于脑和肠的提取物中,这一发现为肠道与脑部之间的信息交流提供了初步证据。随着大脑与肠道之间信号传递和相互调控作用认识的不断深入,肠-脑轴的概念被提出并得到广泛重视[47]。近年来,肠道菌群在精神健康领域的研究备受关注且发展迅速,被视为与免疫炎症、氧化应激、表观遗传修饰以及神经可塑性等精神健康密切相关的机制之一,已成为当前研究的热点[48]。肠道菌群不仅能在胃肠道中参与调控肠道内环境,实现对机体代谢、免疫炎症反应等多种生理过程的调控,还可以通过肠-脑轴途径对脑功能和行为产生显著影响。同时,肠道微生物可与脑器官形成紧密关联,其机制是在肠道中产生的多种信号实现对特定脑区功能的调节,相应的中枢神经系统也可以通过多种途径影响胃肠道功能。此外,肠道菌群还能够通过产生菌群代谢产物,影响机体免疫反应、调节迷走神经及干预肠内分泌系统等多种途径和神经系统相互作用,自下而上影响认知学习功能。炎症信号在胃肠道和CNS间可通过3条平行但相关的途径传递:系统体液途径、细胞免疫途径、神经途径。对于系统体液途径,肠道微生物及其产物可以影响肠道通透性和CNS的神经免疫调节功能,典型物质包括次级胆汁酸、吲哚衍生物、多胺、短链脂肪酸等[49](图2);在神经途径中,连接CNS和胃肠道的神经元可传递炎症信号,从而引发CNS的反应以便恢复体内平衡;在细胞免疫途径中,肠道免疫细胞可直接促进CNS内的神经炎症反应[50]。
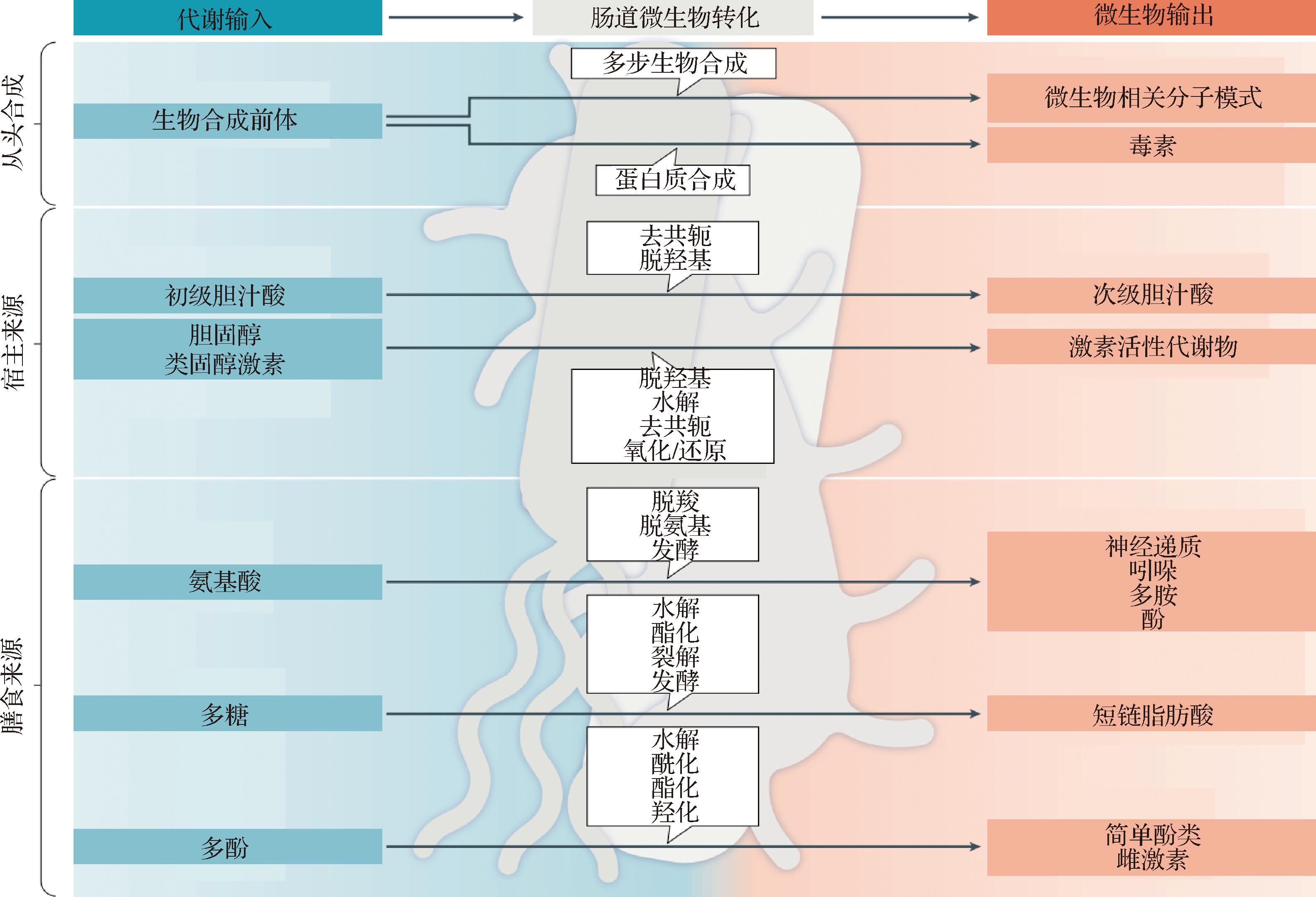
图2 影响CNS的肠道菌群代谢物
Fig.2 Gut bacterial metabolites affecting CNS
随着肠-脑轴炎症信号传导途径的不断明晰,人们发现肠道菌群是肠-脑轴中的关键调节因子,因此开展了大量靶向肠道菌群直接或间接干预神经炎症的研究。目前,临床前或临床研究中的干预措施主要有抗生素、益生菌、益生元、饮食调整、粪便微生物移植等。某些益生元经肠道微生物降解后,转变成抗炎产物,同时改变肠道微生物的组成,促进阿尔兹海默症患者肠道菌群由促炎型向抗炎型转化[28]。燕窝与认知功能的改善存在相关性,研究表明其对阿尔兹海默症具有神经保护作用[6],具有抑制神经炎症和神经元细胞死亡的能力。对大鼠及其子代饲喂唾液酸糖肽,分析肠道菌群结构以及大脑神经发育情况,结果表明燕窝可提高大鼠子代的学习记忆能力,并对子代大鼠的肠道菌群产生积极影响;其增强子代学习记忆能力的作用机制可能与降低肠道菌中Staphylococcus、Ruminococcus等有害菌的比例,同时提高Rikenella、Lactococcus等有益菌的比例有关[51]。范群艳[52]通过肠道组织病理学观察和肠道菌群多样性研究燕窝对断乳后仔鼠肠道形态和菌群的影响。结果表明,通过灌胃缺锌母鼠予燕窝或唾液酸,尤其是孕乳期灌胃,可改变仔鼠肠道Staphylococcus和norank_f__Muribaculaceae等菌群的相对丰度,这些菌群可能间接影响5-羟色胺、多巴胺、去甲肾上腺素等神经递质的水平,促进仔鼠大脑脑组织神经的发育,从而起到改善缺锌孕鼠哺乳后仔鼠大脑学习记忆、脑焦虑或抑郁等行为功能。结合燕窝的消化吸收情况、燕窝糖蛋白/肽的益生作用,肠-脑轴被认为是燕窝发挥神经保护作用的可能途径。然而,目前燕窝的肠-脑轴调控途径尚未明确建立,特异性的菌群代谢物、肠源性神经递质以及信号传导途径仍需要深入研究。
3 总结
近年来,燕窝作为滋补品的消费需求逐年增加。燕窝的神经营养、保护作用契合当前老龄化社会神经退行性疾病的防治需求,本文梳理了燕窝神经保护作用的研究进展。目前关于燕窝神经保护作用的活性成分主要包括唾液酸、蛋白质和聚糖,涉及的作用机制主要包括神经营养、氧化应激和炎症反应调控。值得注意的是,近年来越来越多的研究开始关注燕窝中耐消化糖蛋白/肽的益生作用,肠-脑轴被认为是燕窝发挥神经保护作用的可能途径。
目前已有较多的实验证据支持燕窝的神经保护作用,但现有的研究仍然具有一定的局限性。一方面,目前燕窝的活性成分研究主要集中在燕窝中的唾液酸,未来还可以从蛋白质等其他活性成分以及各成分之间的协同作用进行研究。另一方面,不同工艺的燕窝产品组分的消化吸收率有待进一步研究,未来还需不断创新燕窝加工工艺,提高燕窝活性成分的生物利用度。此外,针对燕窝基于肠-脑轴调控的神经保护作用仍需要更加充分、更加深入的研究和分析。
[1] 邬天雨. 燕窝的古今系统评述[D]. 哈尔滨: 黑龙江中医药大学, 2015.WU T Y. Review on the ancient and modern system of bird’s nest[D]. Harbin: Heilongjiang University of Chinese Medicine, 2015.
[2] 袁满, 林小仙, 王东亮. 浅析燕窝中的核心营养物质蛋白质[J]. 中国食品, 2024(2):92-94.YUAN M, LIN X X, WANG D L. Analysis on protein, the core nutrient in bird’s nest[J]. China Food, 2024(2):92-94.
[3] 李翠, 徐小涵, 林小仙, 等. 燕窝营养成分与功效研究现状[J/OL]. 食品与发酵工业. https://doi.org/10.13995/j.cnki.11-1802/ts.037340.LI C, XU X H, LIN X X, et al. Research status of the nutritional composition and efficacy of bird’s nest [J]. Food and Fermentation Industry. https://doi.org/10.13995/j.cnki.11-1802/ts.037340.
[4] WILSON D M, COOKSON M R, VAN DEN BOSCH L, et al. Hallmarks of neurodegenerative diseases[J]. Cell, 2023, 186(4):693-714.
[5] CAREENA S, SANI D, TAN S N, et al. Effect of edible bird’s nest extract on lipopolysaccharide-induced impairment of learning and memory in wistar rats[J]. Evidence-Based Complementary and Alternative Medicine, 2018, 2018:9318789.
[6] SARKAR A, HARTY S, LEHTO S M, et al. The microbiome in psychology and cognitive neuroscience[J]. Trends in Cognitive Sciences, 2018, 22(7):611-636.
[7] 白伟娟,张小江,张晓婷,等.燕窝加工及其营养成分分析概述[J].食品工业,2022,43(6):342-346.BAI W J, ZHANG X J, ZHANG X T , et al. Overview of bird’s nest processing and its nutrient composition analysis [J]. Food Industry, 2022,43(6): 342-346.
[8] QUEK M C, CHIN N L, YUSOF Y A, et al. Characterization of edible bird’s nest of different production, species and geographical origins using nutritional composition, physicochemical properties and antioxidant activities[J]. Food Research International, 2018, 109:35-43.
[9] 张晨曦, 林小仙, 张维悦, 等. 燕窝对不同周期女性潜在调控作用的研究进展[J]. 食品与发酵工业, 2023, 49(5):328-336.ZHANG C X, LIN X X, ZHANG W Y, et al. Research progress of the potentially regulatory effect of edible bird’s nest on females in different lifecycles[J]. Food and Fermentation Industries, 2023, 49(5):328-336.
[10] HOU Z P, IMAM M U, ISMAIL M, et al. Lactoferrin and ovotransferrin contribute toward antioxidative effects of Edible Bird’s Nest against hydrogen peroxide-induced oxidative stress in human SH-SY5Y cells[J]. Bioscience, Biotechnology, and Biochemistry, 2015, 79(10):1570-1578.
[11] ZUKEFLI S N, CHUA L S, RAHMAT Z. Protein extraction and identification by gel electrophoresis and mass spectrometry from edible bird’s nest samples[J]. Food Analytical Methods, 2017, 10(2):387-398.
[12] YEW M Y, KOH R Y, CHYE S M, et al. Neurotrophic properties and the de novo peptide sequencing of edible bird’s nest extracts[J]. Food Bioscience, 2019, 32:100466.
[13] JAMALLUDDIN N H, TUKIRAN N A, AHMAD FADZILLAH N, et al. Overview of edible bird’s nests and their contemporary issues[J]. Food Control, 2019, 104:247-255.
[14] DAUD N, SARBINI S R, BABJI A S, et al. Characterization of edible swiftlet′s nest as a prebiotic ingredient using a simulated colon model[J]. Annals of Microbiology, 2019, 69(12):1235-1246.
[15] WIERUSZESKI J M, MICHALSKI J C, MONTREUIL J, et al. Structure of the monosialyl oligosaccharides derived from salivary gland mucin glycoproteins of the Chinese swiftlet (genus Collocalia). Characterization of novel types of extended core structure, Gal beta(1::3)[GlcNAc beta(1::6)]GalNAc alpha(1::3)GalNAc (-ol), and of chain termination, [Gal alpha(1::4)]0-1[Gal beta(1::4)]2GlcNAc beta(1::.)[J]. Journal of Biological Chemistry, 1987, 262(14):6650-6657.
[16] YAGI H, YASUKAWA N, YU S Y, et al. The expression of sialylated high-antennary N-glycans in edible bird’s nest[J]. Carbohydrate Research, 2008, 343(8):1373-1377.
[17] 由艳燕, 李兆杰, 薛长湖, 等. 美拉德反应对燕窝糖蛋白糖基化修饰及模拟胃肠液消化作用的影响[J]. 中国食品学报, 2014, 14(11):11-16.YOU Y Y, LI Z J, XUE C H, et al. The effects of Maillard reaction on glycoproteinglycosylation in edible bird’s nestand simulated gastrointestinal digestion in vitro[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(11):11-16.
[18] LIU Q, XI Y J, WANG Q X, et al. Mannan oligosaccharide attenuates cognitive and behavioral disorders in the 5xFAD Alzheimer′s disease mouse model via regulating the gut microbiota-brain axis[J]. Brain, Behavior, and Immunity, 2021, 95:330-343.
[19] 傅俊. 五味子多糖的结构表征、体外消化酵解特征及改善阿尔兹海默症的机制研究[D]. 长春: 吉林大学, 2023.FU J. Structural characterization, in vitro digestion and glycolysis characteristics of Schisandra chinensis polysaccharide and its mechanism of improving Alzheimer′s disease[D]. Changchun: Jilin University, 2023.
[20] AHMAD H, ABDUL KHALID S, RASHED A, et al. Effects of sialic acid from edible bird nest on cell viability associated with brain cognitive performance in mice[J]. World Journal of Traditional Chinese Medicine, 2019, 5(4):214.
[21] WANG B. Sialic acid is an essential nutrient for brain development and cognition[J]. Annual Review of Nutrition, 2009, 29:177-222.
[22] WANG B. Molecular mechanism underlying sialic acid as an essential nutrient for brain development and cognition[J]. Advances in Nutrition, 2012, 3(3):465S-472S.
[23] LOH S P, CHENG S H, MOHAMED W. Edible bird’s nest as a potential cognitive enhancer[J]. Frontiers in Neurology, 2022, 13:865671.
[24] MIJDAM R, BIJNAGTE-SCHOENMAKER C, DYKE E, et al. Sialic acid biosynthesis pathway blockade disturbs neuronal network formation in human iPSC-derived excitatory neurons[J]. Journal of Neurochemistry, 2023, 167(1):76-89.
[25] XIE Y, ZENG H L, HUANG Z J, et al. Effect of maternal administration of edible bird’s nest on the learning and memory abilities of suckling offspring in mice[J]. Neural Plasticity, 2018, 2018:7697261.
[26] MAHAQ O, P RAMELI M A, JAOI EDWARD M, et al. The effects of dietary edible bird nest supplementation on learning and memory functions of multigenerational mice[J]. Brain and Behavior, 2020, 10(11): e01817.
[27] 鲁佩涵, 吴剑荣, 柳训才, 等. 燕窝中结合唾液酸调节5种益生菌生长以及孕妇肠道菌群组成的研究[J]. 食品与发酵工业, 2023, 49(17):53-61.LU P H, WU J R, LIU X C, et al. Regulation of bacteria growth of five probiotics and intestinal flora of pregnant women by bound sialic acid of edible bird’s nest[J]. Food and Fermentation Industries, 2023, 49(17):53-61.
[28] QIAN X H, SONG X X, LIU X L, et al. Inflammatory pathways in Alzheimer′s disease mediated by gut microbiota[J]. Ageing Research Reviews, 2021, 68:101317.
[29] 郑勇, 程贝, 陈亦辉, 等. 星蒌承气汤联合丁苯酞治疗缺血性脑卒中疗效及对患者氧化应激、血液流变学的影响[J]. 陕西中医, 2023, 44(2):191-194.ZHENG Y, CHENG B, CHEN Y H, et al. Effect of Xinglou Chengqi decoction combined with butylphthalide on oxidative stress and hemorheology in patients with ischemic stroke[J]. Shaanxi Journal of Traditional Chinese Medicine, 2023, 44(2):191-194.
[30] YEW M Y, KOH R Y, CHYE S M, et al. Edible bird’s nest improves motor behavior and protects dopaminergic neuron against oxidative and nitrosative stress in Parkinson’s disease mouse model[J]. Journal of Functional Foods, 2018, 48:576-585.
[31] 董建辉, 田巧基, 段素芳, 等. 燕窝提取物的抗氧化及促进表皮细胞生长活性比较[J]. 食品与发酵工业, 2019, 45(17):73-78.DONG J H, TIAN Q J, DUAN S F, et al. Comparative study on anti-oxidation and promotion activity of epidermal cell growth of edible bird’s nest water extract[J]. Food and Fermentation Industries, 2019, 45(17):73-78.
[32] HU Q, LI G, YAO H, et al. Edible bird’s nest enhances antioxidant capacity and increases lifespan in Drosophila Melanogaster[J]. Cellular and Molecular Biology, 2016, 62(4):116-122.
[33] YEW M Y, KOH R Y, CHYE S M, et al. Edible bird’s nest ameliorates oxidative stress-induced apoptosis in SH-SY5Y human neuroblastoma cells[J]. BMC Complementary and Alternative Medicine, 2014, 14:391.
[34] HARRY G J, KRAFT A D. Neuroinflammation and microglia: Considerations and approaches for neurotoxicity assessment[J]. Expert Opinion on Drug Metabolism &Toxicology, 2008, 4(10):1265-1277.
[35] MEYER K C. Inflammation, Advancing Age and Nutrition[M]. Amsterdam: Elsevier, 2014:29-38.
[36] TERRANDO N, ERIKSSON L I, RYU J K, et al. Resolving postoperative neuroinflammation and cognitive decline[J]. Annals of Neurology, 2011, 70(6):986-995.
[37] KITAZAWA M, ODDO S, YAMASAKI T R, et al. Lipopolysaccharide-induced inflammation exacerbates tau pathology by a cyclin-dependent kinase 5-mediated pathway in a transgenic model of Alzheimer’s disease[J]. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 2005, 25(39):8843-8853.
[38] SADIGH-ETEGHAD S, MAJDI A, MAHMOUDI J, et al. Astrocytic and microglial nicotinic acetylcholine receptors: An overlooked issue in Alzheimer’s disease[J]. Journal of Neural Transmission (Vienna, Austria, 2016, 123(12):1359-1367.
[39] VON B R. Glial cell dysregulation: A new perspective on Alzheimer disease[J]. Neurotoxicity Research, 2007, 12(4):215-232.
[40] 由艳燕. 燕窝唾液酸糖蛋白的纯化鉴定及体外消化吸收、抗炎活性研究[D]. 青岛: 中国海洋大学, 2014.YOU Y Y. Purification, identification, in vitro digestion, absorption and anti-inflammatory activity of sialoglycan from bird’s nest[D]. Qingdao: Ocean University of China, 2014.
[41] YEW M Y, KOH R Y, CHYE S M, et al. Edible bird’s nest improves motor behavior and protects dopaminergic neuron against oxidative and nitrosative stress in Parkinson’s disease mouse model[J]. Journal of Functional Foods, 2018, 48:576-585.
[42] 林洁茹. 燕窝DNA基原鉴定及抗病毒作用研究[D]. 广州: 广州中医药大学, 2010.LIN J R. Identification of DNA motif of bird’s nest and its antiviral effect[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2010.
[43] 冼小敏, 侯雁, 林洁茹, 等. 燕窝蛋白质在模拟胃肠环境中的降解研究[J]. 中药材, 2010, 33(11):1760-1763.XIAN X M, HOU Y, LIN J R, et al. Study on degradation of protein of the edible birds’ nest (Aerodramus) in vitro[J]. Journal of Chinese Medicinal Materials, 2010, 33(11):1760-1763.
[44] 王鑫, 范群艳, 连建梅, 等. 燕窝消化特性的体外实验[J]. 食品与生物技术学报, 2021, 40(8):70-77.WANG X, FAN Q Y, LIAN J M, et al. Study on in vitro digestion characteristics of bird’s nest[J]. Journal of Food Science and Biotechnology, 2021, 40(8):70-77.
[45] 张晓旭, 林小仙, 张丹, 等. 基于傅里叶变换红外光谱技术解析鲜炖燕窝中功能因子与肠道菌群的关系[J]. 光谱学与光谱分析, 2023, 43(8):2452-2457.ZHANG X X, LIN X X, ZHANG D, et al. Study on the analysis of the relationship between functional factors and intestinal flora in freshly stewed bird’s nest based on Fourier transform infrared spectroscopy[J]. Spectroscopy and Spectral Analysis, 2023, 43(8):2452-2457.
[46] EULER U S V, GADDUM J H. An unidentified depressor substance in certain tissue extracts[J]. Journal of Physiology, 1931, 72(1):74-87.
[47] VUONG H E, YANO J M, FUNG T C, et al. The microbiome and host behavior[J]. Annual Review of Neuroscience, 2017, 40:21-49.
[48] 高标, 蔡梦宇, 屈易萃, 等. 食物防治抑郁症的研究现状及趋势分析[J]. 食品与生物技术学报, 2022, 41(8):53-64.GAO B, CAI M Y, QU Y C, et al. Research status and trend analysis of food interventions for depression[J]. Journal of Food Science and Biotechnology, 2022, 41(8):53-64.
[49] NEEDHAM B D, KADDURAH-DAOUK R, MAZMANIAN S K. Gut microbial molecules in behavioural and neurodegenerative conditions[J]. Nature Reviews. Neuroscience, 2020, 21(12):717-731.
[50] AGIRMAN G, YU K B, HSIAO E Y. Signaling inflammation across the gut-brain axis[J]. Science, 2021, 374(6571):1087-1092.
[51] 赵平, 孔令胜, 季晓宇, 等. 唾液酸灌胃干预肠道微生态预防小鼠更年期抑郁症的机制[J]. 山东医药, 2024, 64(7):42-47.ZHAO P, KONG L S, JI X Y, et al. Mechanism of sialic acid intervention in intestinal microecology to prevent climacteric depression in mice[J]. Shandong Medical Journal, 2024, 64(7):42-47.
[52] 范群艳. 基于脑肠轴的燕窝对断乳后仔鼠智力影响的分子机制[D]. 福州: 福建农林大学, 2023.FAN Q Y. Molecular mechanism of the influence of bird’s nest on intelligence of weaned rats based on brain-gut axis[D]. Fuzhou: Fujian Agriculture and Forestry University, 2023.