近代以来,动物蛋白因营养价值丰富、加工性能优良而被广泛使用,但研究表明,动物蛋白的大量摄入常与慢性疾病的发生密切相关,同时动物蛋白的生产消耗大量资源且产生较多温室气体,对生态环境造成极大负担。相比动物蛋白,植物蛋白不仅具有生产环保和可持续性高的优点,还兼具多种健康功能,包括降低心血管病、糖尿病、非酒精性肝病和某些肿瘤的患病风险[1]。随着人们对健康饮食愈发重视和对可持续化发展的追求,植物蛋白受到消费者青睐,并逐渐走向市场,相关研究也因此具有重要的价值和应用潜力。
蛋白质溶解度是评价其加工价值的一个重要参数,是研究起泡性、乳化性、胶凝性等功能特性的基础[2],一般溶解度越高,蛋白质功能特性越好,越有利于其在食药领域的广泛利用。溶解度由多种因素相互影响,可根据来源不同分为内部及外部因素,内部因素指基于蛋白质自身结构的因素如极性/非极性氨基酸比例、相互作用力、空间结构变化等,外部因素指生产流程(提取、加工、贮藏)中不同条件的影响。目前,改善蛋白质溶解度的方法可根据使用技术性质不同,分为物理改性、化学改性、生物改性及复合改性四类,物理和生物改性技术已广泛应用于市场,采用不同技术手段提升蛋白质溶解度已成为重要研究方向之一。
本文基于植物蛋白溶解度不佳而导致的应用受限展开讨论,分析影响溶解度的内外因素,并整理提高植物蛋白溶解度的技术和效果,旨在为提高植物蛋白利用率和植物基蛋白类产品开发提供一定参考。
1 植物蛋白及溶解性
1.1 植物蛋白
蛋白质是人类营养中重要的常量营养素,为人体提供必需氨基酸,在食品的配方、加工、贮存和消费中发挥着重要作用[3]。植物蛋白通常来源于谷物、豆类、坚果和油籽或其加工副产物。随着世界人口的不断增长,人类面临粮食紧缺的巨大挑战,较动物蛋白而言,植物蛋白因低廉的生产成本、丰富的种植资源、环境的可持续性和动物蛋白的可替代性成为一种极具潜力的解决方案[4]。但其相对较差的功能特性也限制着其在食品中的应用,因此解决溶解度问题、改善加工属性、扩大应用是植物蛋白发展的重要研究方向。
1.2 溶解性
蛋白质溶解度是指在特定条件下处于可溶性状态的蛋白质中氮的比例,也就是样品中蛋白质溶解到溶液中的量[5]。大部分植物蛋白溶解性较差,例如我国四大主粮:水稻、小麦、玉米、马铃薯,虽然产量丰富但很少可利用至水基食品。大米蛋白中水不溶性的谷蛋白和醇溶蛋白占80%以上,溶解度<10%[6]。小麦蛋白溶解度为8%~15%,其大部分为不溶于水的麦醇溶蛋白和麦谷蛋白[7]。玉米蛋白中醇溶蛋白组分含量最多,占比50%~55%,溶于水的清蛋白<10%[8]。马铃薯蛋白较其余3种蛋白溶解性略高,约为30%~40%[9]。溶解度可反映其他功能特性的优劣,较低的溶解度不仅造成资源在水基产品中的利用受到限制,也可能导致植物蛋白资源在其他领域(如凝胶、膜、泡沫等)的应用受阻,因此改善溶解度是提高利用率的关键环节。
2 影响植物蛋白溶解性的内部因素
2.1 极性/非极性氨基酸比例
溶解度受氨基酸组成、序列、分子质量、极性和非极性基团的构象与含量的影响[5]。研究表明,带负电荷氨基酸含量高,疏水和芳香族氨基酸含量低的蛋白质溶解度较好[10]。如精米蛋白比其余品种具有更多负电荷和极性氨基酸,溶解度与其相对比例呈正相关[11]。蛋白质中极/非极性氨基酸的比例会影响蛋白质表面亲疏水的平衡,表面亲疏水差异是与溶解性密切相关的参数,如薏米仁蛋白的3种组分由于亲/疏水氨基酸含量的差异导致两亲性不同,3种组分溶解度与表面疏水性呈负相关[12]。虽然亲/疏水氨基酸的含量是决定其表面疏水性的关键因素,但纯度和自组装过程也会影响其总疏水性。低共熔溶剂法提取的燕麦蛋白中较多的β-折叠和β-转角结构可能抵消了亲水氨基酸残基对燕麦蛋白溶解度的积极贡献[13]。
2.2 相互作用力
离子间相互作用可以促进蛋白质和溶剂的相互作用,疏水相互作用使蛋白质分子间相互分离,2种作用力变化可影响蛋白质的溶解度。当蛋白质表面电荷减少,分子间斥力减弱,易发生碰撞、凝聚而产生沉淀,导致溶解度降低,反之溶解度提高[14]。如图1所示,蛋白质溶解度随pH的变化一般为“U”型,长梗扁桃种子蛋白随pH变化表现为经典的“U”型,在pH=4.0时,溶解度最低,pH值远离等电点时,溶解度呈上升趋势[15]。
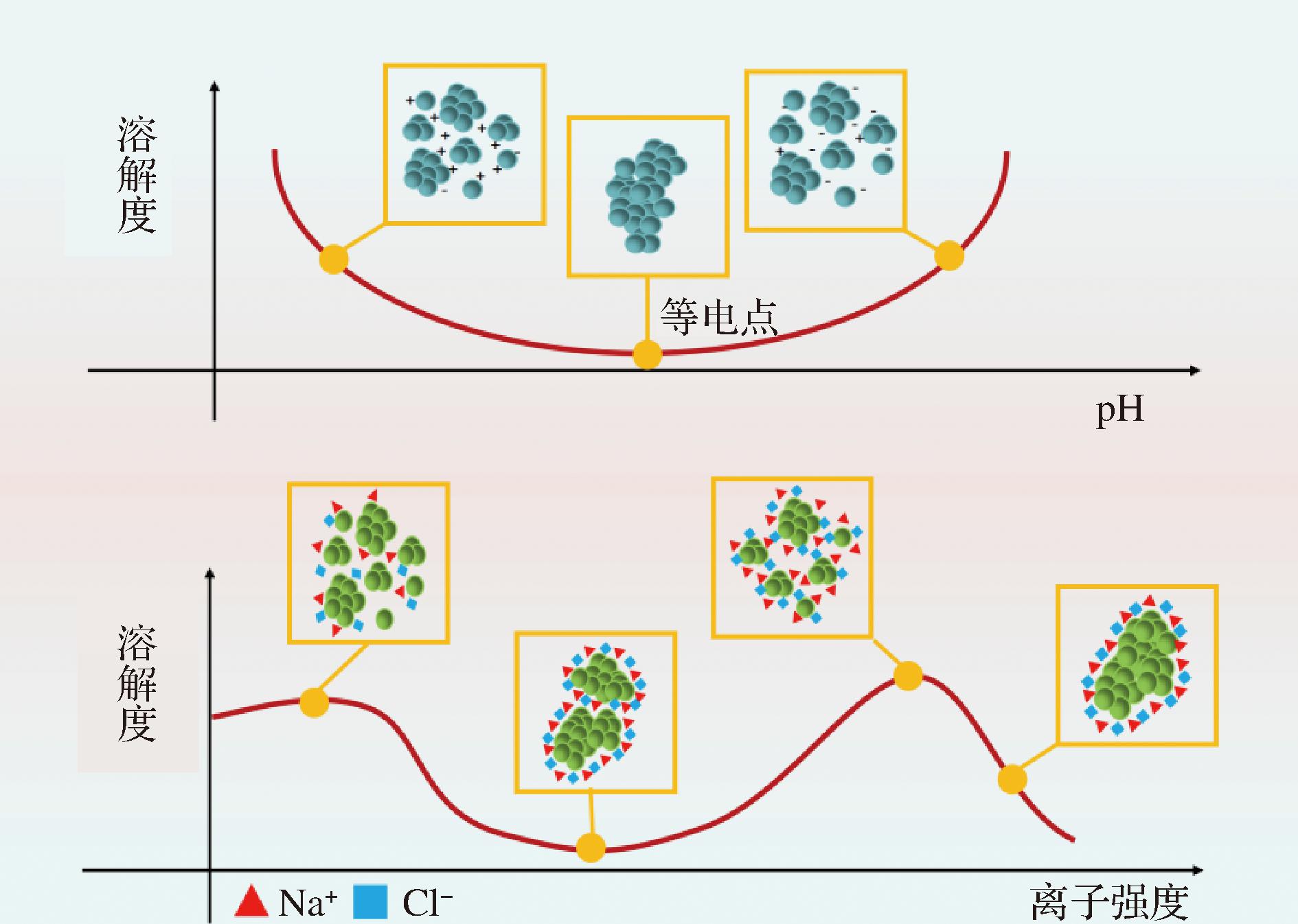
图1 离子间相互作用对蛋白质溶解度的影响
Fig.1 Effect of inter-ionic interactions on protein solubility
在富含盐离子溶液中,随着盐离子浓度增加,蛋白质间的静电斥力被屏蔽,蛋白质聚集,溶解度下降;随着表面电荷增加,静电斥力作用增强,溶解度升高,当盐离子浓度过高时,水分子间的相互作用增强,水与蛋白质相互作用减少,从而导致蛋白质聚集和溶解度下降。GUL等[16]以不同离子强度NaCl处理榛子蛋白,当离子强度增加到0.2 mol/L时,其溶解度部分下降,而随着离子强度继续增加,溶解度显著增加。离子对蛋白质溶解度的影响不仅受离子强度的影响,还受离子类型的影响。LI等[17]以不同离子浓度氯化钠、磷酸钠处理燕麦分离蛋白,磷酸钠处理表现出与氯化钠相似的溶解模式,但在相同的离子强度下溶解度通常更大,是由于磷酸离子与蛋白质氨基或氨基酸侧链极性基之间的相互作用更强。
2.3 空间结构变化
一般认为蛋白质二级、三级结构的改变对其溶解性影响较大。目前,针对二级结构变化的研究较多,如研究显示大米谷蛋白中α-螺旋含量的变化与溶解性呈现显著负相关[18];MUNE等[19]研究发现豇豆蛋白的溶解度随无序结构比例的增加而提高,随β-折叠比例的增加而降低。蛋白质结构展开会导致疏水基团的暴露,局部展开有利于溶解,当疏水氨基酸充分暴露,溶解度下降。如油菜籽蛋白在pH偏移处理下溶解度提高,是由于在极酸/碱性条件下,结构展开重折叠,极性基团暴露[20]。而热处理降低藜麦蛋白溶解度,是由于湿热处理使蛋白质内部的疏水基团暴露,蛋白之间的相互作用增强,亲疏水平衡破坏,从而导致溶解性降低[21]。
2.4 蛋白质组成
Osborne分级法是蛋白质常用的分类方法之一,根据蛋白质在水、盐、醇以及碱溶液中的溶解性来划分,可分为清蛋白、球蛋白、醇溶蛋白和谷蛋白。如表1所示,4种蛋白组分的含量差异可体现蛋白质溶解度区别,一般清蛋白和球蛋白含量较多的蛋白水溶性较好。
表1 蛋白质组成对溶解性的影响 单位:%
Table 1 Effect of protein composition on solubility
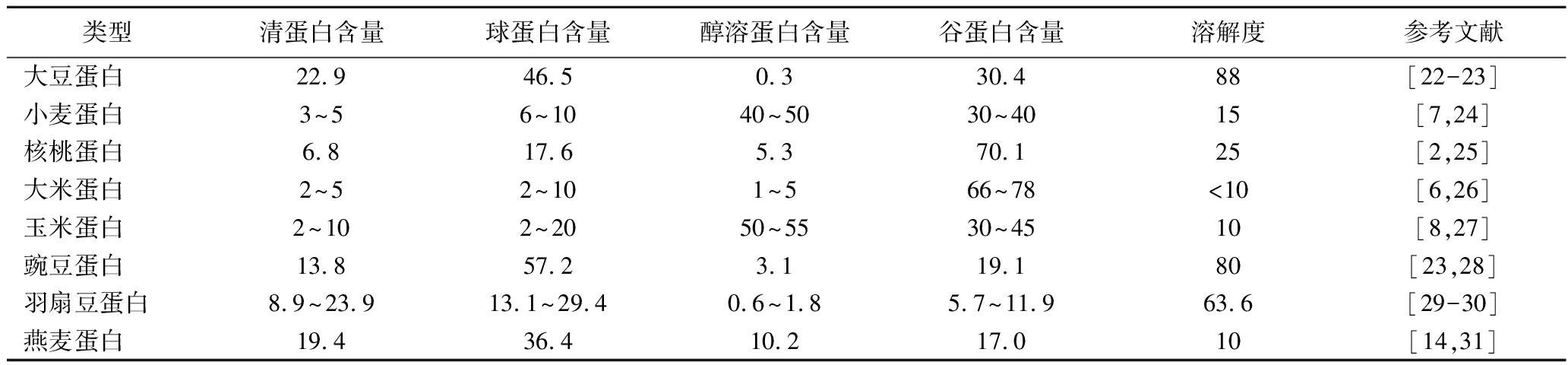
类型清蛋白含量球蛋白含量醇溶蛋白含量谷蛋白含量溶解度参考文献大豆蛋白22.946.50.330.488[22-23]小麦蛋白3~56~1040~5030~4015[7,24]核桃蛋白6.817.65.370.125[2,25]大米蛋白2~52~101~566~78<10[6,26]玉米蛋白2~102~2050~5530~4510[8,27]豌豆蛋白13.857.23.119.180[23,28]羽扇豆蛋白8.9~23.913.1~29.40.6~1.85.7~11.963.6[29-30]燕麦蛋白19.436.410.217.010[14,31]
注:%代表质量分数。
2.5 分子尺寸
聚集体的结构、含量、聚集速率、尺寸和表面性质等会影响蛋白质的溶解度[32]。如图2所示,一般情况下,当蛋白质形成较大的聚集体时,溶液粒径较大,溶解性差,反之溶解性较好。酸处理导致南瓜籽蛋白、大豆蛋白、豌豆蛋白溶解度显著降低,是由于酸性处理后蛋白质-水相互作用减弱,蛋白过度聚集形成不溶性聚集物[23]。YANG等[33]通过高压均质处理蚕豆蛋白,溶解度从35%提高至98%以上,溶解度的增加是由于聚集体(>1 μm)通过高压均质化形成可溶性聚集体。
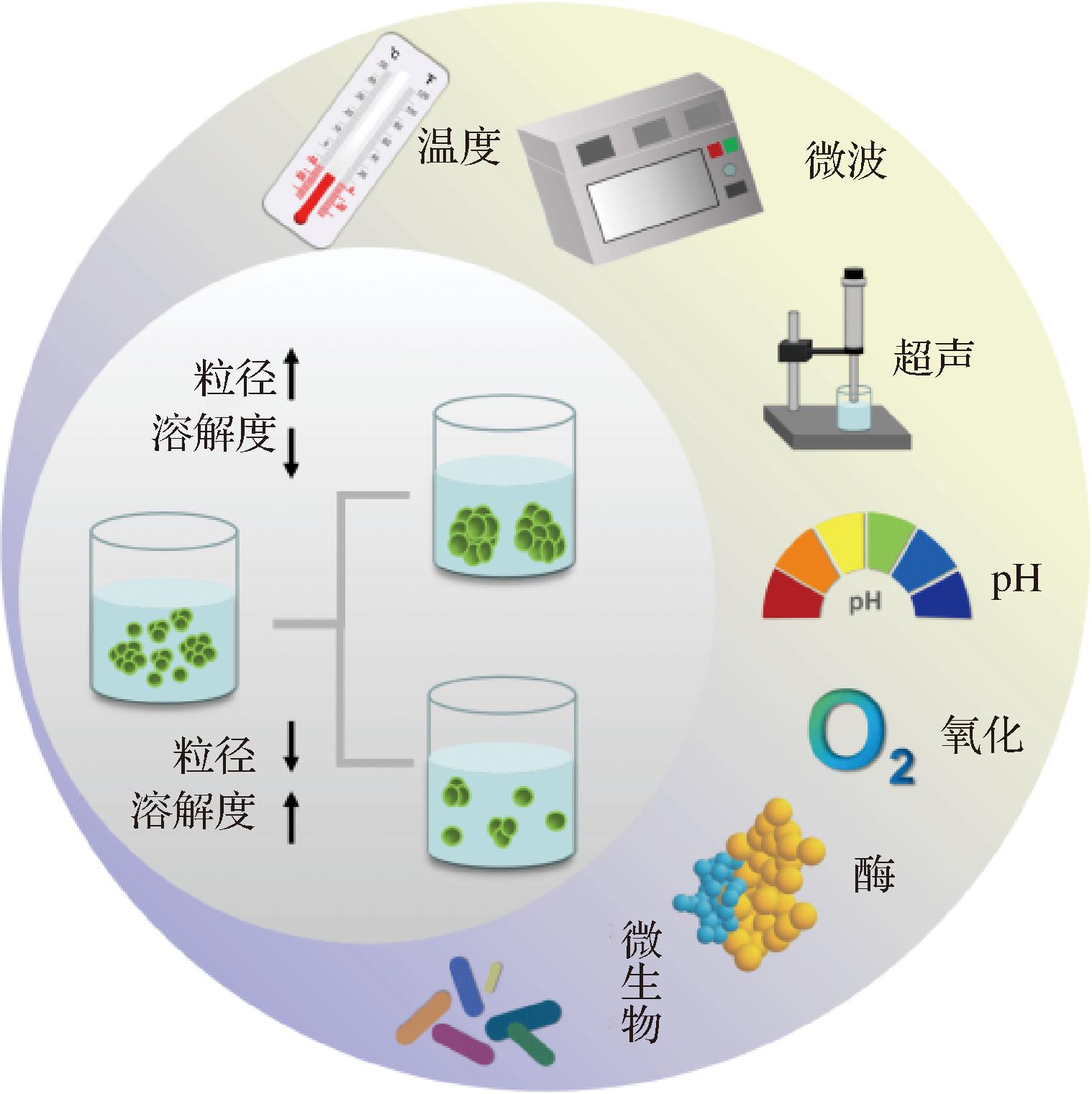
图2 分子尺寸对蛋白质溶解度的影响
Fig.2 Effect of molecular size on protein solubility
注:↑表示增大,↓表示减小。
2.6 其他物质结合
在食品体系中,多种物质并存是普遍存在的,当蛋白质与其他物质间发生相互作用,结构、空间位阻、界面性质发生变化,会导致溶解度改变。蛋白质与多酚相互作用对溶解度产生不同影响,取决于蛋白结构变化的差异,结构展开或表面电荷变化促进溶解,疏水位点过度暴露或形成较大聚集体抑制溶解。如多酚与核桃蛋白结合可降低表面疏水性,增强表面电荷或发生共价相互作用,形成较大的可溶性蛋白聚集物,溶解度提高[34]。而张雪春等[35]发现核桃蛋白和8种多酚结合后溶解度均显著降低,侧链上的羟基、氨基和羧基可与多酚形成氢键,产生疏水相互作用,屏蔽氨基酸残基所带电荷,从而降低溶解度。
一般条件下,蛋白质与多糖相互作用可提高溶解度,因多糖链多羟基亲水基团的引入,使分子亲水能力增强。如YU等[36]研究发现高变性花生蛋白分离物与田菁胶共价结合后,蛋白溶解度从610.0 g/L增加到1 240.0 g/L。根据糖基化条件不同,对蛋白溶解度会造成不同程度影响,LI等[37]以苹果果胶、柑橘果胶、芒果果胶和甜菜果胶对椰子蛋白进行糖基化处理,结果表明复合物溶解度低于混合物,可能由于热处理导致椰子蛋白变性,破坏了其高级结构,导致多肽链的膨胀和疏水基团的暴露,形成较大的聚集体,使得在水基介质体系中难以均匀分散。
3 影响植物蛋白溶解性的外部因素
3.1 提取条件
3.1.1 溶剂提取法
在酸、碱或高温等极端条件下提取蛋白质会导致蛋白质结构不可逆变化,使溶解度下降;反之,在适当条件下提取则可提高蛋白质溶解度。溶剂提取法是指将蛋白质溶解或是萃取至溶剂中,通过沉淀、烘干、冷冻干燥、喷雾干燥等获得蛋白质的方法,常用溶剂包括水、碱液、盐液、丙酮、乙醇等[38]。目前较受关注的是反胶束法及低共熔溶剂法,如图3所示。反胶束是指油相中表面活性剂的浓度超过临界胶束浓度后,亲水极性端自发向内与水接触,疏水非极性端向外接触非极性有机溶剂所形成的具有热力学稳定性和光学透明性的纳米级聚合体[39]。使用反胶束法分离蛋白质和油脂,有机相可溶解油脂,聚合体形成的“水池”溶解蛋白质等活性物质,陈玉婷[40]研究发现反胶束法和碱溶酸沉法所得的核桃蛋白均具备良好的溶解性,反胶束法所制备的蛋白氮溶解性略低。而杨光胜[41]的研究则表明,与碱提酸沉法相比,反胶束法所制得的大豆蛋白溶解度更高,可能是因为反胶束法提取的植物蛋白分子质量较小,而小分子蛋白更易溶解。低共熔溶剂是继离子液体后产生的新一代绿色溶剂,是一种极具应用前景的物质,其是由一定化学计量比的氢键受体和氢键供体组合成的2/3组分低共熔混合物,该法制备方法简单且具有生物可降解、可回收和成本低的优势。研究发现在不同离子浓度、pH值和温度下,低共熔溶剂法比碱提酸沉法提取的魔芋飞粉蛋白质溶解性更好,约为碱提酸沉法提取的1.5倍[42]。
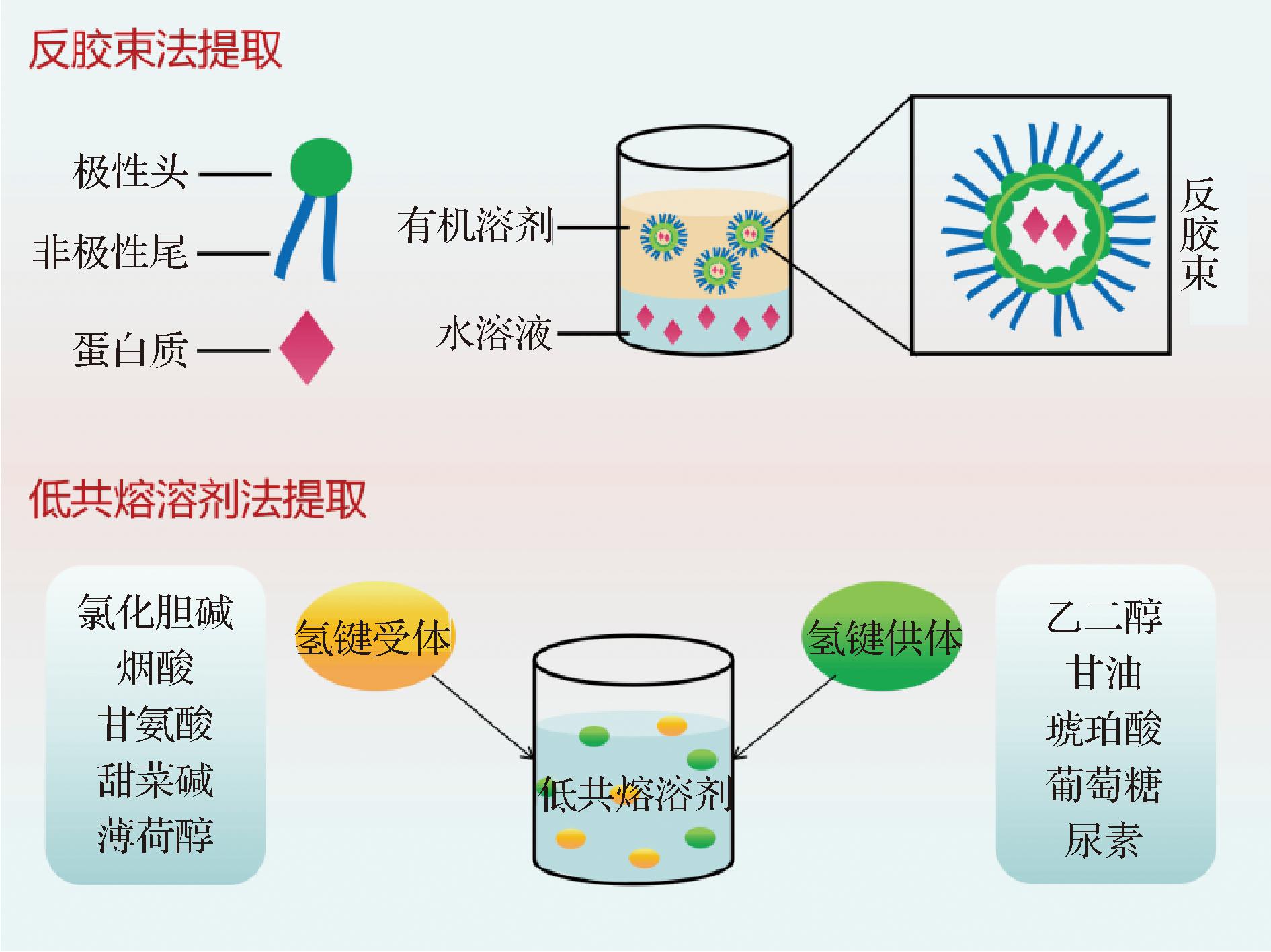
图3 反胶束法与低共熔溶剂法提取蛋白
Fig.3 Protein extraction by reverse micellar method and low eutectic solvent method

图4 植物蛋白的开发及未来应用潜力
Fig.4 Development of plant proteins and potential for future applications
3.1.2 沉淀法
沉淀法是影响蛋白质分子间电荷排斥作用和水化膜以破坏蛋白质胶体稳定性,使原料中蛋白质沉淀析出的方法,可分为等电点沉淀、盐析、有机溶液沉淀法等[43]。碱溶酸沉法是植物蛋白提取中最常用的方法,利用溶解度随pH升高而增大的原理,溶于碱液后再调至等电点,使蛋白质沉淀出来。在适宜的范围内使用沉淀法可提高蛋白质溶解度,万晨茜等[44]发现碱溶酸沉法提取的蛋白质溶解性最高,并且显著高于酶法和盐浸法。沉淀pH值或范围不同也会影响蛋白质溶解度,KALAYDZHIEV等[45]分别按照pH 10.5~2.5和pH 2.5~8.5的顺序等电沉淀,从菜籽粕中分离出2种蛋白,酸性条件下前者具有较高的溶解度,可能由于前者碱性蛋白质含量较高,在酸性条件下带正电荷,水合条件更加适宜。
3.1.3 酶法
酶法提取是指利用碳水化合物酶(纤维素酶、半纤维素酶、果胶酶等)以及蛋白酶的特异性和高效性,对植物细胞壁进行降解,并使大分子蛋白分解为易溶的小分子,从而为提取植物蛋白创造条件[46]。CONDE等[47]通过酶处理向日葵蛋白,发现溶解度随水解度的增加而增加。BRASPAIBOON等[48]比较酶法和碱法提取大米中蛋白质,发现酶法提取总可溶性蛋白含量最高。但也有研究表明酶法提取会导致蛋白质溶解性降低,主要由于提取需提供酶所需环境,碱性条件下有可能破坏蛋白质一些理化特征,提取结束后的高温水浴灭活,导致分子在疏水作用下展开,并通过疏水作用和二硫化物的形成使分子折叠,使表面疏水性增加[44]。
3.1.4 物理辅助法
为了进一步提高提取效率,常使用物理方法辅助蛋白质提取。超声作为一种常用的辅助技术手段,在一定范围内,超声的空化作用可使蛋白质尺寸减小,破坏不溶性聚集体内非共价键,形成可溶性聚合物,从而提高溶解度。但超声条件过强时,部分蛋白质将变性,发生聚集,降低蛋白质与水的结合程度,可能会导致溶解度的下降[49]。具体见表2。
表2 物理辅助法对溶解性的影响
Table 2 Effect of physically assisted methods on solubility

提取法蛋白名称处理条件蛋白质溶解度改良程度参考文献扁豆蛋白pH 9,超声功率:750 W提高63.4%[50]超声辅助碱法辣木籽蛋白pH 11,超声时间:15 min,超声功率:750 W(5.56±0.13)%~(29.82±0.21)%[51]大豆蛋白pH 9.6,超声时间:13.5 min提高57.9%[52]超声辅助酶法大米蛋白α-淀粉酶,功率密度:100 W/LpH 7~11显著高于对照[53]山核桃蛋白碱性蛋白酶,超声功率:400 W,超声时间:15 min47.98%~70.77%[54]酶法辅助碱法杏仁蛋白碱性蛋白酶,pH 930.9%~60.8%[55]芝麻蛋白碱性蛋白酶,pH 12(198.33±0.37) mg/g~(252.711±0.09) mg/g[56]微波辅助DES法小麦胚芽蛋白碳酸钾∶无水甘油3∶1(摩尔比),辐照时间:3.28 minpH范围内显著高于对照[57]
3.2 加工条件
3.2.1 物理因素
加工过程中的热、电、机械力等物理因素可对蛋白质的溶解度造成不同影响,适当加热可以促进可溶性小分子聚物溶解,以增加蛋白质的溶解度,但随着加热时间延长或温度升高,小分子可溶蛋白聚集成大分子蛋白,降低蛋白溶解度,甚至造成蛋白质变性,导致沉淀产生[58]。
物理改性改善蛋白质溶解度具有加工费用低、耗时少、无毒副作用、对蛋白营养价值破坏小的优点,缺点是改性范围窄。目前常用的物理改性改善蛋白质溶解度的方法见表3。
表3 物理改性改善蛋白质溶解度的技术及效果
Table 3 Techniques and effects of physical modification to improve protein solubility

技术条件原理效果参考文献超声波600 W,15 min破坏蛋白质分子聚集的物理力,释放出较小的可溶性蛋白质提高22%[59]高速剪切60 ℃,5 min颗粒之间强剪切、拉伸和挤压相互作用,使颗粒尺寸变小,与水作用表面积增加24.33%~62.81%[60]超高压150 MPa,1循环产生更小蛋白质颗粒,增加蛋白质与水接触面积,从而增加溶解度63.15%~71.61%[61]微波除霜模式,36 s氨基酸的极性基团受到影响,导致极性氨基酸含量和表面疏水性变化,进而影响溶解度72.14%~82.47%[62]微射流125 MPa,4循环蛋白质受到强大的剪切、高速冲击、瞬时压降和空化力以及额外热效应的影响,改变结构,影响溶解度提高约20%[63]
3.2.2 化学因素
化学因素包括处理过程中的酸碱、电解质、基团引入等,其中,常利用蛋白质侧链基团的化学活性改变蛋白质的结构、静电荷和疏水性,以此达到改善蛋白质功能特性的目的,如亲水亲油基团、二硫键、带负电荷基团等[64]。目前常用蛋白质化学改性方法见表4,化学改性具有反应速度快、效率高、性能好、改性效果明显、易发生交联等优点,缺点为试剂专一性不强、反应条件苛刻、反应复杂激烈、难以控制、易有化学物质残留和副产物混杂。具体见表4。
表4 化学改性改善蛋白质溶解度的技术及效果
Table 4 Techniques and effects of chemical modification to improve protein solubility

方法条件原理效果参考文献磷酸化三磷酸钠,pH 9引入亲水性磷酸基团,增加蛋白质分子表面负电荷,蛋白质水合作用增强6.67%~58.4%[65]pH偏移pH偏移至13.0,4 h形成熔融球状结构,增强蛋白质-水相互作用,构象变化,可溶性蛋白质聚集体形成提高约75%[66]酰化辛烯基琥珀酸酐,pH 8引起蛋白质构象和表面电荷变化,排斥力阻止蛋白质聚集物形成pH 5~12 比对照更具可溶性[67]糖基化蛋白质∶葡聚糖1∶4(质量比)防止蛋白质间相互作用导致的聚集和沉淀,从而提高蛋白质与水分子的反应显著高于对照[68]多酚接枝化核桃蛋白,鞣花酸、表没食子儿茶素-3-没食子酸酯,0.2、0.5 mg/mL显著降低其表面疏水性,增加表面电荷40%~92%[69]蛋白质复合化大豆蛋白∶小麦蛋白7∶3(质量比)复合物粒径增大,部分疏水性基团被埋没,导致表面疏水性降低显著高于2种蛋白[70]
3.2.3 生物因素
影响蛋白质溶解性的生物因素主要是酶处理使蛋白质发生降解或交联聚合,进而改善蛋白质的功能特性,常用酶包括谷氨酰胺转氨酶、碱性蛋白酶、胰蛋白酶和木瓜蛋白酶等。除此外,还常采用预处理的方式提高蛋白质溶解度,主要的2种方法为发酵和发芽,如表5所示。生物改性优点为反应条件温和、高效性、专一性强、易控制、安全可靠、效果显著,缺点为价格高昂,酶解过程中产生不良风味的问题暂时没有得到解决。
表5 生物改性改善蛋白质溶解度的技术及效果
Table 5 Techniques and effects of biomodification to improve protein solubility

方法条件原理效果参考文献酶水解碱性蛋白酶,pH 8,300 min水解造成亲水区域的暴露,包括小分子多肽表面的离子、极性和带电氨基酸,促进蛋白质与水的相互作用提高约80%[71]酶交联谷氨酰胺转氨酶,50 ℃,pH 8酶交联使氢键发生断裂,并作用于极性基团,使极性残基数量增加,并且蛋白质分子间以及分子内发生交联化,蛋白质网络空间结构发生一定变化,促进溶解17.43%~34.29%[72]复合酶谷氨酰胺转胺酶和蛋白质谷氨酰胺酶,4 h增加蛋白质的结构灵活性和净电荷提高84.9%[73]菌种发酵植物乳杆菌,3 h蛋白降解为小肽,与水作用增强97.62%~98.89%[74]发芽35 ℃,48 h发芽过程中,蛋白酶水解储存蛋白为游离氨基酸和短肽,使其具有更高的溶解度36.57%~84.98%[75]
3.2.4 复合因素
一般情况下,影响蛋白质溶解度因素不是单一的,而是在多种因素相互作用下造成的变化。复合改性是将2种及以上改性方式结合起来,实现协同作用,提高植物蛋白溶解效率,但复合处理在一定条件下也可产生相反的作用,MASTANI等[76]使用超声和微波处理乳清蛋白与小麦谷蛋白后,蛋白质溶解度显著降低,可能是由于蛋白质表面疏水基团暴露,导致表面疏水性增加。具体见表6。
表6 复合改性改善蛋白质溶解度的技术及效果
Table 6 Techniques and effects of compound modification to improve protein solubility

具体类型方法条件原理效果参考文献物理协同脉冲电场协同超声波场强15 kV/cm,超声功率:300 W,时间:36 s蛋白质分子部分打开,增强蛋白质和水分子交互作用,并使表面电荷性质增强提高约10%[77]化学协同糖基化协同酰化大豆蛋白∶葡聚糖∶琥珀酸酐1∶0.1∶1或1∶1∶0.1(质量比)分子内和分子间电荷排斥的结合促进蛋白质的展开整个pH范围内均有提高[78]生物协同酶法协同发酵木瓜蛋白酶,解淀粉乳杆菌酶解与发酵后生成小分子蛋白质表面电荷和蛋白质展开pH 4, 7.3%~36.7%[30]物理协同化学挤压协同磷酸化喂料速度:10 kg/h,螺杆转速:300 r/min,豌豆蛋白∶三聚磷酸钠 3∶2(体积比)极性磷酸根基团使蛋白水合作用改善,电负性增加,分子间静电排斥力提高9.83%~10.85%[79]脉冲电场协同pHpH 11,脉冲强度:10 kV/cm蛋白质结构部分展开,更加灵活,颗粒大小显著减少26.06%~70.34%[80]物理协同生物超声波协同酶法超声功率:350 W,10 min,植酸酶-酸性蛋白酶改变蛋白表面疏水性和亲水性平衡,改善溶解性提高68%[81]挤压协同酶法挤压温度:100 ℃,碱性蛋白酶,2 h原有结构破坏,且水解后的肽能够与水形成更强的氢键,更易溶于水提高约15%[82]化学协同生物糖基化协同酶法氨基葡萄糖盐酸盐,谷氨酰胺转胺酶,120 min羟基的亲水性可提高蛋白质溶解度,糖基发挥空间位阻效应,防止蛋白质分子聚集提高18.26%[83]酰化协同酶法中性蛋白酶,pH 7,120 min 6 000 U/mL,琥珀酸酐蛋白质极性亲水基团暴露提高约20%[84]
3.3 贮藏条件
蛋白质在贮运过程中易发生氧化,引发蛋白质聚集产生不溶性沉淀,溶解度是评价蛋白质质变的重要指标。一般情况下,随着贮藏时间的延长,蛋白质溶解度呈现下降趋势。ABUGOCH等[85]对5个月贮藏期内藜麦蛋白溶解度测定,发现其溶解度显著下降,可能氧化导致蛋白质分子之间交联,形成较大分子质量的聚集体,导致溶解度降低。高温贮藏会加速蛋白质溶解度的下降,低温贮藏可减缓蛋白质溶解度下降的趋势。相较室温贮藏,4 ℃贮藏后的绿豆球蛋白溶解度下降较小,低温延缓球蛋白氧化,抑制不溶性聚集体的生成[86]。但也存在溶解度上升的情况,赵卿宇等[87]研究发现在4 ℃下贮藏的“盐丰”大米蛋白,贮藏结束时溶解度显著上升,可能是由于长时间的贮藏导致蛋白质被氧化修饰,使蛋白质解聚而增溶。氧气作为蛋白质氧化的重要参与者,其形成自由基直接作用于蛋白质分子,并通过次生反应产生中间产物,再间接作用于蛋白质。研究表明,气调贮藏是延缓蛋白质溶解度下降的有效方法,绿豆在气调贮藏后,球蛋白的氧化作用受到抑制,延缓结构变化,溶解性下降不显著[86]。
4 结论
植物蛋白溶解度差是制约植物蛋白开发与应用关键技术瓶颈,蛋白质溶解性是由其独特的分子结构和溶解环境决定的,基于物理、化学、生物或复合手段改良植物蛋白分子结构和溶解环境是改变植物蛋白溶解性的重要模式,持续研发新型蛋白结构修饰技术是未来发展趋势。基于结构修饰提高植物蛋白溶解性的同时也提高了蛋白的乳化性、起泡性、胶凝性、成膜性、持水持油性、可塑性等加工特性,该结论可为植物蛋白类产品加工提供参考;通过功能修饰完成活性组分的分子包埋、靶向递送、稳态释放,可提高活性组分的吸收率及生物利用度,拓展植物蛋白产品应用范围,开发新型植物蛋白类功能产品。综上,改善植物蛋白溶解性是提高植物蛋白开发与应用的重要手段,应持续关注和研究。
[1] YANG S H, TAO G, YANG L, et al. Dietary phytochemical and metabolic disease prevention: Focus on plant proteins[J]. Frontiers in Nutrition, 2023, 10:1089487.
[2] 李梁宵. 我国四个品种核桃蛋白结构和功能特性的研究[D]. 北京: 北京林业大学, 2019.LI L X. Study on the structure and functional characteristics of four varieties of walnut protein in China[D]. Beijing: Beijing Forestry University, 2019.
[3] S A G A, LAURINDO J B, MORENO Y M F, et al. Influence of emerging technologies on the utilization of plant proteins[J]. Frontiers in Nutrition, 2022, 9:809058.
A G A, LAURINDO J B, MORENO Y M F, et al. Influence of emerging technologies on the utilization of plant proteins[J]. Frontiers in Nutrition, 2022, 9:809058.
[4] SIM S Y J, SRV A, CHIANG J H, et al. Plant proteins for future foods: A roadmap[J]. Foods, 2021, 10(8):1967.
[5] ZAYAS J F. Solubility of Proteins[M]. Heidelberg: Springer Berlin Heidelberg, 1997:6-75.
[6] 迟明梅, 马莺. 不同大米蛋白功能特性的对比研究[J]. 食品工业, 2004, 25(5):10-11.CHI M M, MA Y. Studies on comparison of different rice protein functionality[J]. The Food Industry, 2004, 25(5):10-11.
[7] 孙撬撬, 王凯强, 罗水忠, 等. 理化复合预处理对TGase改性小麦蛋白性质的影响[J]. 中国粮油学报, 2017, 32(6):15-20;26.SUN Q Q, WANG K Q, LUO S Z, et al. Effect of physicochemical pretreatments on transglutaminase-enhanced gelation of wheat gluten[J]. Journal of the Chinese Cereals and Oils Association, 2017, 32(6):15-20;26.
[8] 魏倩, 张莹莹, 阎欣, 等. 豆类蛋白和谷物蛋白的功能性对比[J]. 粮食加工, 2018, 43(1):36-41.WEI Q, ZHANG Y Y, YAN X, et al. Comparation of the functional properties between cereal protein and legume protein[J]. Grain Processing, 2018, 43(1):36-41.
[9] 潘牧, 彭慧元, 邓宽平, 等. 马铃薯蛋白的研究进展[J]. 贵州农业科学, 2012, 40(10):22-26.PAN M, PENG H Y, DENG K P, et al. Advances in potato protein[J]. Guizhou Agricultural Sciences, 2012, 40(10):22-26.
[10] NWACHUKWU I D, ALUKO R E. Physicochemical and emulsification properties of flaxseed (Linum usitatissimum) albumin and globulin fractions[J]. Food Chemistry, 2018, 255:216-225.
[11] SINGH T P, SOGI D S. Comparative study of structural and functional characterization of bran protein concentrates from superfine, fine and coarse rice cultivars[J]. International Journal of Biological Macromolecules, 2018, 111:281-288.
[12] WU Y M, ZHOU Y, XU L Q, et al. Difference analysis of the structure and functional properties among coix seed prolamin fractions (α-, β-, and γ-coixin)[J]. Journal of Food Science, 2023, 88(5):1969-1978.
[13] YUE J X, ZHU Z B, YI J H, et al. Structure and functionality of oat protein extracted by choline chloride-dihydric alcohol deep eutectic solvent and its water binary mixtures[J]. Food Hydrocolloids, 2021, 112:106330.
[14] 高晓莉, 王丽丽, 刘丽娅, 等. pH值和温度对燕麦蛋白溶解与聚集特性的影响[J]. 核农学报, 2020, 34(11):2492-2498.GAO X L, WANG L L, LIU L Y, et al. Effects of pH and temperature on the solubility and aggregation of oat protein[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(11):2492-2498.
[15] GROSSMANN L, MCCLEMENTS D J. Current insights into protein solubility: A review of its importance for alternative proteins[J]. Food Hydrocolloids, 2023, 137:108416.
[16] GUL O, GUL L B, BASK NC
NC T, et al. Influence of pH and ionic strength on the bulk and interfacial rheology and technofunctional properties of hazelnut meal protein isolate[J]. Food Research International, 2023, 169:112906.
T, et al. Influence of pH and ionic strength on the bulk and interfacial rheology and technofunctional properties of hazelnut meal protein isolate[J]. Food Research International, 2023, 169:112906.
[17] LI R N, XIONG Y L. Sensitivity of oat protein solubility to changing ionic strength and pH[J]. Journal of Food Science, 2021, 86(1):78-85.
[18] XU X F, LIU W, LIU C M, et al. Effect of limited enzymatic hydrolysis on structure and emulsifying properties of rice glutelin[J]. Food Hydrocolloids, 2016, 61:251-260.
[19] MUNE MUNE M A, SOGI D S, MINKA S R. Response surface methodology for investigating structure-function relationship of grain legume proteins[J]. Journal of Food Processing and Preservation, 2018, 42(2): e13524.
[20] LI Y H, CHENG Y, ZHANG Z L, et al. Modification of rapeseed protein by ultrasound-assisted pH shift treatment: Ultrasonic mode and frequency screening, changes in protein solubility and structural characteristics[J]. Ultrasonics Sonochemistry, 2020, 69:105240.
[21] 张文刚, 杜春婷, 杨希娟, 等. 不同加工方式对藜麦蛋白质结构与功能特性的影响[J]. 食品科学, 2022, 43(7):88-95.ZHANG W G, DU C T, YANG X J, et al. Effects of different processing methods on the structural and functional properties of quinoa proteins[J]. Food Science, 2022, 43(7):88-95.
[22] CIABOTTI S, SILVA A C, JUH SZ A, et al. Chemical composition, protein profile, and isoflavones content in soybean genotypes with different seed coat colors[J]. International Food Research Journal, 2016, 23:621-629.
SZ A, et al. Chemical composition, protein profile, and isoflavones content in soybean genotypes with different seed coat colors[J]. International Food Research Journal, 2016, 23:621-629.
[23] ZENG L, WANG Z J, HE Z Y, et al. Physicochemical and gel properties of pumpkin seed protein: A comparative study[J]. International Journal of Food Science &Technology, 2023, 58(3):1639-1651.
[24] 曲敏, 姜佩秀, 贾圆芳, 等. 热诱导下小麦蛋白结构与功能性质变化研究进展[J]. 食品安全质量检测学报, 2023, 14(15):11-19.QU M, JIANG P X, JIA Y F, et al. Research progress on structural and functional changes of wheat protein induced by heat[J]. Journal of Food Safety &Quality, 2023, 14(15):11-19.
[25] SZE-TAO K W C, SATHE S K. Walnuts (Juglans regia L.): Proximate composition, protein solubility, protein amino acid composition and protein in vitro digestibility[J]. Journal of the Science of Food and Agriculture, 2000, 80(9):1393-1401.
[26] 吴伟, 吴晓娟, 蔡勇建, 等. 过氧自由基氧化修饰对大米蛋白功能性质的影响[J]. 食品与机械, 2016, 32(6):5-8.WU W, WU X J, CAI Y J, et al. Effect of oxidative modification by peroxyl radical on functional properties of rice protein[J]. Food &Machinery, 2016, 32(6):5-8.
[27] 李红梅, 马兴胜. 蛋白酶酶解改性玉米蛋白的工艺优化[J]. 食品与发酵工业, 2010, 36(5):95-100.LI H M, MA X S. Optimization of corn protein modified by enzymatic hydrolysis of protease[J]. Food and Fermentation Industries, 2010, 36(5):95-100.
[28] CHAVAN U D, MCKENZIE D B, SHAHIDI F. Protein classification of beach pea (Lathyrus maritimus L.)[J]. Food Chemistry, 2001, 75(2):145-153.
[29] SINGLA P, SHARMA S, SINGH S. Amino acid composition, protein fractions and electrophoretic analysis of seed storage proteins in lupins[J]. Indian Journal of Agricultural Biochemistry, 2017, 30(1):33.
[30] SCHLEGEL K, LIDZBA N, UEBERHAM E, et al. Fermentation of lupin protein hydrolysates-effects on their functional properties, sensory profile and the allergenic potential of the major lupin allergen lup an 1[J]. Foods, 2021, 10(2):281.
[31] 王美玉, 粱亚萍, 王愈, 等. 燕麦蛋白组分分离提取及其SDS-PAGE电泳分析[J]. 粮油食品科技, 2018, 26(5):1-5.WANG M Y, LIANG Y P, WANG Y, et al. Separation and extraction of oat protein components and analysis by SDS-PAGE[J]. Science and Technology of Cereals, Oils and Foods, 2018, 26(5):1-5.
[32] 畅鹏, 杜鑫, 杨东晴, 等. 蛋白质热聚集行为机理及其对蛋白质功能特性影响的研究进展[J]. 食品工业科技, 2018, 39(24):318-325.CHANG P, DU X, YANG D Q, et al. Research progress on the mechanism of protein thermal aggregation behavior and its influence on functional properties of protein[J]. Science and Technology of Food Industry, 2018, 39(24):318-325.
[33] YANG J Q, LIU G Y, ZENG H B, et al. Effects of high pressure homogenization on faba bean protein aggregation in relation to solubility and interfacial properties[J]. Food Hydrocolloids, 2018, 83:275-286.
[34] KONG X Z, HUANG Z L, ZHANG C M, et al. Phenolic compounds in walnut pellicle improve walnut (Juglans regia L.) protein solubility under pH-shifting condition[J]. Food Research International, 2023, 163:112156.
[35] 张雪春, 茹月蓉, 程群, 等. 八种多酚与核桃蛋白相互作用的研究[J]. 食品与发酵工业, 2022, 48(12):97-104.ZHANG X C, RU Y R, CHENG Q, et al. Studies of interaction between eight polyphenols and walnut protein[J]. Food and Fermentation Industries, 2022, 48(12):97-104.
[36] YU J J, CHEN G Y, ZHANG Y F, et al. Enhanced hydration properties and antioxidant activity of peanut protein by covalently binding with Sesbania gum via cold plasma treatment[J]. Innovative Food Science &Emerging Technologies, 2021, 68:102632.
[37] LI Z Q, XI J, CHEN H M, et al. Effect of glycosylation with apple pectin, Citrus pectin, mango pectin and sugar beet pectin on the physicochemical, interfacial and emulsifying properties of coconut protein isolate[J]. Food Research International, 2022, 156:111363.
[38] 孔炜浩, 高琳, 周起, 等. 蛋白质提取分离纯化及特性研究进展[J/OL]. 中国食物与营养, 2023. DOI:10.19870/j.cnki.11-3716/ts.20230829.001.KONG W H, GAO L, ZHOU Q, et al. Research progress on protein extraction, separation, purification, and characteristics[J/OL].Chinese Food and Nutrition, 2023. DOI:10.19870/j.cnki.11-3716/ts.20230829.001.
[39] 孙雪, 赵晓燕, 朱运平, 等. 反胶束对植物蛋白的结构、功能性和应用的影响研究进展[J]. 中国粮油学报, 2020, 35(1):196-202.SUN X, ZHAO X Y, ZHU Y P, et al. Advances in studies on the effects of reverse micelles on the structure, function and application of plant proteins[J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(1):196-202.
[40] 陈玉婷. 反胶束制备核桃蛋白的工艺及结构与功能性研究[D]. 济南: 济南大学, 2017.CHEN Y T. Study on preparation technology, structure and function of walnut protein by reverse micelle[D]. Jinan: University of Jinan, 2017.
[41] 杨光胜. 反胶束萃取对大豆蛋白组成与功能特性影响机制研究[D]. 郑州: 河南工业大学, 2015.YANG G S. Study on the mechanism of reverse micelle extraction on the composition and functional characteristics of soybean protein[D]. Zhengzhou: Henan University of Technology, 2015.
[42] 孔令辉, 余科, 牟璐, 等. 低共熔溶剂提取魔芋飞粉蛋白质工艺优化及其溶解性研究[J]. 食品科技, 2023, 48(5):223-230.KONG L H, YU K, MOU L, et al. Optimization process of protein extracted from konjac flying powder by deep eutectic solvents and its solubility[J]. Food Science and Technology, 2023, 48(5):223-230.
[43] 姚知渊, 周浩鹏, 周静舫. 蛋白质分离纯化和蛋白质结晶的研究方法[J]. 企业技术开发, 2009, 28(10):46-48.YAO Z Y, ZHOU H P, ZHOU J F. Studies on separation and purification crystallization of protein[J]. Technological Development of Enterprise, 2009, 28(10):46-48.
[44] 万晨茜, 白文明, 高立城, 等. 不同提取方法对甜荞蛋白理化特性的影响[J]. 食品研究与开发, 2020, 41(24):160-167.WAN C X, BAI W M, GAO L C, et al. Effects of different extraction methods on physicochemical properties of common buckwheat protein[J]. Food Research and Development, 2020, 41(24):160-167.
[45] KALAYDZHIEV H, GEORGIEV R, IVANOVA P, et al. Enhanced solubility of rapeseed meal protein isolates prepared by sequential isoelectric precipitation[J]. Foods, 2020, 9(6):703.
[46] 李超, 马航, 吴冉, 等. 植物蛋白提取技术研究进展[J]. 现代食品, 2023, 29(11):12-19.LI C, MA H, WU R, et al. Research progress of plant protein extraction technology[J]. Modern Food, 2023, 29(11):12-19.
[47] CONDE J M, ESCOBAR M D, PEDROCHE JIMÉNEZ J J, et al. Effect of enzymatic treatment of extracted sunflower proteins on solubility, amino acid composition, and surface activity[J]. Journal of Agricultural and Food Chemistry, 2005, 53(20):8038-8045.
[48] BRASPAIBOON S, OSIRIPHUN S, PEEPATHUM P, et al. Comparison of the effectiveness of alkaline and enzymatic extraction and the solubility of proteins extracted from carbohydrate-digested rice[J]. Heliyon, 2020, 6(11): e05403.
[49] RESENDIZ-VAZQUEZ J A, ULLOA J A, UR AS-SILVAS J E, et al. Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus) seed protein isolate[J]. Ultrasonics Sonochemistry, 2017, 37:436-444.
AS-SILVAS J E, et al. Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus) seed protein isolate[J]. Ultrasonics Sonochemistry, 2017, 37:436-444.
[50] MIRANDA C G, SPERANZA P, KUROZAWA L E, et al. Lentil protein: Impact of different extraction methods on structural and functional properties[J]. Heliyon, 2022, 8(11): e11775.
[51] FATIMA K, IMRAN M, AHMAD M H, et al. Ultrasound-assisted extraction of protein from Moringa oleifera seeds and its impact on techno-functional properties[J]. Molecules, 2023, 28(6):2554.
[52] WANG F, ZHANG Y Z, XU L, et al. An efficient ultrasound-assisted extraction method of pea protein and its effect on protein functional properties and biological activities[J]. LWT, 2020, 127:109348.
[53] YANG X, LI Y L, LI S Y, et al. Effects of ultrasound-assisted α-amylase degradation treatment with multiple modes on the extraction of rice protein[J]. Ultrasonics Sonochemistry, 2018, 40:890-899.
[54] WANG Q, WANG Y, HUANG M G, et al. Ultrasound-assisted alkaline proteinase extraction enhances the yield of pecan protein and modifies its functional properties[J]. Ultrasonics Sonochemistry, 2021, 80:105789.
[55] DE SOUZA T S P, DIAS F F G, KOBLITZ M G B, et al. Effects of enzymatic extraction of oil and protein from almond cake on the physicochemical and functional properties of protein extracts[J]. Food and Bioproducts Processing, 2020, 122:280-290.
[56] KOYSUREN B, OZTOP M H, MAZI B G. Sesame seed as an alternative plant protein source: A comprehensive physicochemical characterisation study for alkaline, salt and enzyme-assisted extracted samples[J]. International Journal of Food Science &Technology, 2021, 56(11):5471-5484.
[57] OLALERE O A, GAN C Y. Extractability of defatted wheat germ protein and their functionalities in a deep eutectic solvent (DES)-Microwave extraction approach compared to conventional processing[J]. Sustainable Chemistry and Pharmacy, 2023, 32:101002.
[58] 姜梅, 董明盛, 芮昕, 等. 高压均质和热处理对豆乳蛋白质溶解性的影响[J]. 食品科学, 2013, 34(21):125-130.JIANG M, DONG M S, RUI X, et al. Effects of high pressure homogenization and heat treatment on protein solubility in soymilk[J]. Food Science, 2013, 34(21):125-130.
[59] ZHU Z B, ZHU W D, YI J H, et al. Effects of sonication on the physicochemical and functional properties of walnut protein isolate[J]. Food Research International, 2018, 106:853-861.
[60] KONG X Z, ZHANG L N, LU X, et al. Effect of high-speed shearing treatment on dehulled walnut proteins[J]. LWT, 2019, 116:108500.
[61] WANG C Y, WANG J N, ZHU D Y, et al. Effect of dynamic ultra-high pressure homogenization on the structure and functional properties of whey protein[J]. Journal of Food Science and Technology, 2020, 57(4):1301-1309.
[62] GULTEKIN SUBASI B, ![]() et al. Influence of non-thermal microwaveradiationon emulsifying properties of sunflower protein[J]. Food Chemistry, 2022, 372:131275.
et al. Influence of non-thermal microwaveradiationon emulsifying properties of sunflower protein[J]. Food Chemistry, 2022, 372:131275.
[63] LOPES C, AKEL FERRUCCIO C, DE ALBUQUERQUE SALES A C, et al. Effects of processing technologies on the antioxidant properties of common bean (Phaseolus vulgaris L.) and lentil (Lens culinaris) proteins and their hydrolysates[J]. Food Research International, 2023, 172:113190.
[64] 董新红, 赵谋明, 蒋跃明. 花生蛋白改性的研究进展[J]. 中国粮油学报, 2011, 26(12):109-117.DONG X H, ZHAO M M, JIANG Y M. Progress in modification of peanut protein property[J]. Journal of the Chinese Cereals and Oils Association, 2011, 26(12):109-117.
[65] HU Z Y, QIU L, SUN Y, et al. Improvement of the solubility and emulsifying properties of rice bran protein by phosphorylation with sodium trimetaphosphate[J]. Food Hydrocolloids, 2019, 96:288-299.
[66] 荣玉娟, 侯雨薇, 曹晓倩, 等. pH-偏移对麦谷蛋白结构的修饰及溶解性的提升[J]. 食品科学, 2023.RONG Y J, HOU Y W, CAO X Q, et al. The modification of glutenin structure and improvement of solubility by pH offset[J].Food Science, 2023.
[67] SEBII H, KARRA S, BCHIR B, et al. Effect of succinylation on the secondary structures, surface, and thermal properties of date palm pollen protein concentrate[J]. Journal of Food Science and Technology, 2021, 58(2):632-640.
[68] BOOSTANI S, AMINLARI M, MOOSAVI-NASAB M, et al. Fabrication and characterisation of soy protein isolate-grafted dextran biopolymer: A novel ingredient in spray-dried soy beverage formulation[J]. International Journal of Biological Macromolecules, 2017, 102:297-307.
[69] HUANG X, YAN C J, LIN M, et al. The effects of conjugation of walnut protein isolate with polyphenols on protein solubility, antioxidant activity, and emulsifying properties[J]. Food Research International, 2022, 161:111910.
[70] TIAN T, TONG X H, REN K Y, et al. Influence of protein ratios on the structure and gel properties of soybean-wheat co-precipitated proteins[J]. LWT, 2022, 170:114045.
[71] SHAHBAL N, JING X P, BHANDARI B, et al. Effect of enzymatic hydrolysis on solubility and surface properties of pea, rice, hemp, and oat proteins: Implication on high protein concentrations[J]. Food Bioscience, 2023, 53:102515.
[72] 张爱琴, 齐凤敏, 赵爱萍, 等. 谷氨酰胺转氨酶改性核桃谷蛋白的结构表征分析[J]. 中国粮油学报, 2019, 34(11):38-44.ZHANG A Q, QI F M, ZHAO A P, et al. Structural characterization of walnut gluten protein modified by glutamine transaminase[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(11):38-44.
[73] PÖRI P, NISOV A, NORDLUND E. Enzymatic modification of oat protein concentrate with trans- and protein-glutaminase for increased fibrous structure formation during high-moisture extrusion processing[J]. LWT, 2022, 156:113035.
[74] BEKIROGLU H, KARIMIDASTJERD A, OZMEN D, et al. Improvement of some techno-functional properties of aquafaba by pre-fermentation with Lactobacillus plantarum MA2[J]. Food Bioscience, 2023, 54:102807.
[75] SINGH A, SHARMA S, SINGH B. Effect of germination time and temperature on the functionality and protein solubility of Sorghum flour[J]. Journal of Cereal Science, 2017, 76:131-139.
[76] MASTANI S, BAHMANYAR F, SHOJAEE-ALIABADI S, et al. Effect of dual physical modifications on structural and functional properties of gluten and whey protein: Ultrasound and microwave[J]. Food Science and Technology International, 2024, 30(5):397-406.
[77] 毕爽, 马文君, 李杨, 等. 脉冲电场-超声波作用对黑豆球蛋白功能性质的影响[J]. 食品科学, 2016, 37(9):7-12.BI S, MA W J, LI Y, et al. Combined effect of pulse electric field and ultrasound on functional properties of black soybean globin[J]. Food Science, 2016, 37(9):7-12.
[78] HE M Y, LI L J, WU C L, et al. Effects of glycation and acylation on the structural characteristics and physicochemical properties of soy protein isolate[J]. Journal of Food Science, 2021, 86(5):1737-1750.
[79] 夏轩泽, 李言, 钱海峰, 等. 改性处理对豌豆蛋白结构和功能特性的影响[J]. 食品科学技术学报, 2021, 39(5):32-38;48.XIA X Z, LI Y, QIAN H F, et al. Effects of modification treatments on structural characteristics and functional properties of pea protein[J]. Journal of Food Science and Technology, 2021, 39(5):32-38; 48.
[80] WANG R, WANG L H, WEN Q H, et al. Combination of pulsed electric field and pH shifting improves the solubility, emulsifying, foaming of commercial soy protein isolate[J]. Food Hydrocolloids, 2023, 134:108049.
[81] 李婷婷, 赵彩红, 吴海波, 等. 适宜物理-酶联合改性提高酸性条件下大豆分离蛋白乳化性[J]. 农业工程学报, 2016, 32(18):291-298.LI T T, ZHAO C H, WU H B, et al. Physical-enzymatic modification methods improving emulsifying properties of soybean protein isolate under acidic conditions[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(18):291-298.
[82] MA W J, QI B K, SAMI R, et al. Conformational and functional properties of soybean proteins produced by extrusion-hydrolysis approach[J]. International Journal of Analytical Chemistry, 2018, 2018:9182508.
[83] WU S S, HAN W, CHENG Y F, et al. Transglutaminase-catalyzed glycosylation improved physicochemical and functional properties of Lentinus edodes protein fraction[J]. Foods, 2023, 12(9):1849.
[84] 王月, 张东杰. 中性蛋白酶酶解酰化大豆分离蛋白功能特性的研究[J]. 食品科学, 2011, 32(13):234-238.WANG Y, ZHANG D J. Optimization of process conditions for enzymatic modification of succinylated soybean protein isolate with neutral protease[J]. Food Science, 2011, 32(13):234-238.
[85] ABUGOCH L, CASTRO E, TAPIA C, et al. Stability of quinoa flour proteins (Chenopodium quinoa Willd.) during storage[J]. International Journal of Food Science &Technology, 2009, 44(10):2013-2020.
[86] 苗志文, 翟爱华, 张东杰, 等. 贮藏方式对绿豆球蛋白结构与溶解性的影响[J]. 食品工业科技, 2021, 42(24):16-23.MIAO Z W, ZHAI A H, ZHANG D J, et al. Effects of storage methods on the structure and solubility of mung bean globulin[J]. Science and Technology of Food Industry, 2021, 42(24):16-23.
[87] 赵卿宇, 林佳慧, 沈群. 储藏温度对大米蛋白功能特性的影响[J]. 食品科学, 2021, 42(13):200-207.ZHAO Q Y, LIN J H, SHEN Q. Effect of storage temperature on functional properties of rice protein[J]. Food Science, 2021, 42(13):200-207.