由于不良的生活习惯及运动不足,患有肥胖、高血压、高血脂等高危因素的人口迅速增加,而这又是诱导糖尿病、心脑血管等慢性疾病的主要因子[1]。现代医学研究发现,橙皮苷不仅有助于降低体脂、改善脂质代谢等健康指标,还在降低心血管疾病、神经系统疾病以及2型糖尿病风险等方面作用显著,已成为一种新的潜在治疗剂,对人体健康具有众多益处。而在运动领域,有研究报道橙皮苷能够改善肌肉功能和线粒体生物发生,并且由于其具有抗氧化、抗炎等作用,补充橙皮苷可能有助于在高强度运动中预防氧化应激和炎症。近年来,由于其安全稳定以及不含有兴奋剂违禁物质,受到运动员、训练爱好者和研究人员的广泛关注,逐渐成为运动科学领域研究的热点。但国内关于补充橙皮苷对运动影响的研究较少,仍有较大空白。本文通过文献检索法,选取“橙皮苷、运动、运动表现、身体成分、身体特征”及“hesperidin、citrus、performance、body composition”作为检索词,在知网、万方、PubMed、Web of Science和Elsevier等国内外数据库进行检索,从橙皮苷概况、补充橙皮苷对身体特征和运动表现的影响及其作用机理等方面进行综述,以期为后续橙皮苷的相关研究提供参考。
1 橙皮苷概况
1.1 橙皮苷的来源
橙皮苷又称陈皮苷、橘皮苷等,是陈皮、枳实、枳壳等中药材中的主要成分,主要存在于柑橘类水果中的天然黄酮类化合物,于1828年由法国化学家LEBRETON首次从橙皮内部分离得到[2]。不同品种的柑橘中橙皮苷含量有一定的差异,并且在柑橘的不同部位橙皮苷含量也不相同。新鲜柑橘果肉中橙皮苷含量为73 mg/kg,而果皮中的含量达到157 mg/kg,占果皮干重的2.5%~7.2%[3-4]。
1.2 橙皮苷的理化性质
橙皮苷属二氢黄酮类衍生物,其母核为2-苯基色原酮类化合物,C7位连接芸香糖,相对分子质量610.57,熔点和沸点分别为250 ~ 255 ℃和576.16 ℃,密度1.65 g/cm3,化学性质稳定可长期贮存[5-6]。橙皮苷的结构式见图1。橙皮苷分子中的酚羟基与Fe3+配合可抑制自由基引发剂生成,在一定程度上能够发挥抗氧化的作用[7]。分离提取的橙皮苷呈白色针状结晶,常温下极难溶于水,几乎不溶于丙酮、苯及氯仿,但微溶于甲醇或热冰醋酸,易溶于二甲基甲酰胺、吡啶及稀碱溶液[8]。
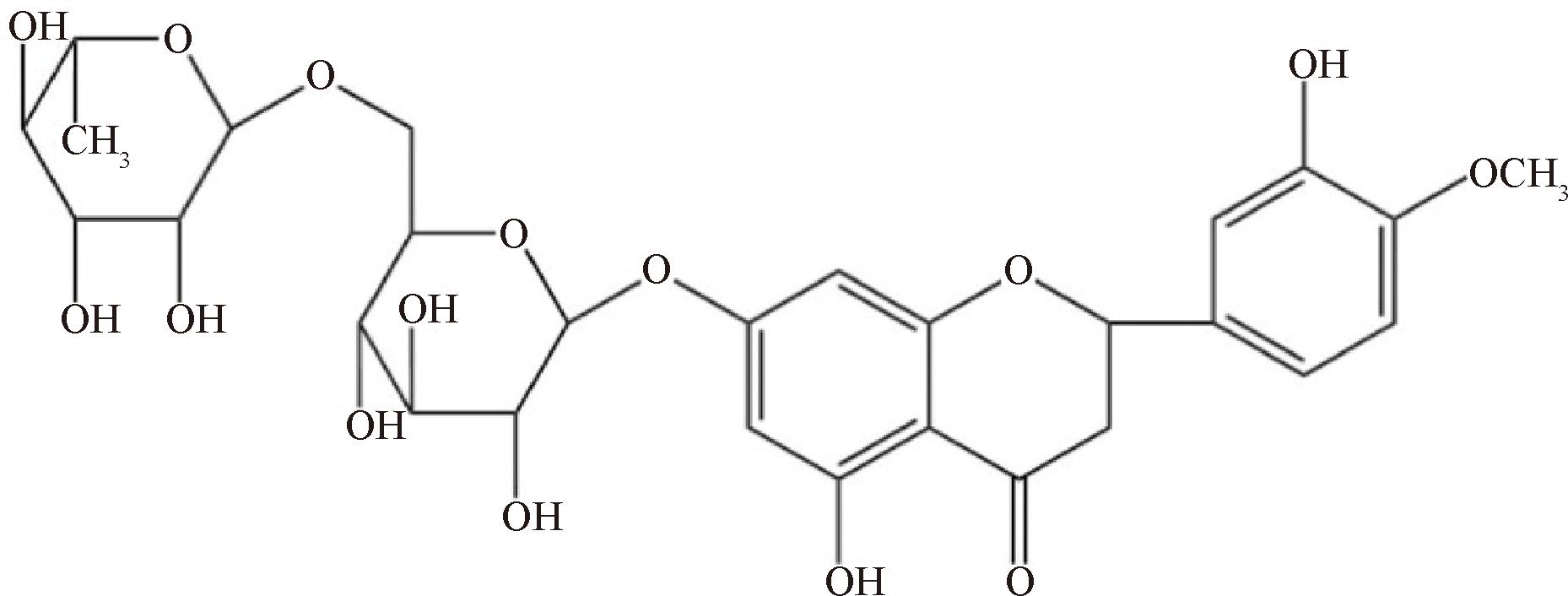
图1 橙皮苷化学结构式
Fig.1 Hesperidin chemical structure formula
2 补充橙皮苷对身体特征的影响及其作用机理
2.1 补充橙皮苷对身体特征的影响
橙皮苷已被证明对动物模型具备显著的降脂效果,使得脂肪含量降低[9-10],不过在临床实验中结果尚未完全统一。相关研究主要以体重、体脂、身体质量指数(body mass index,BMI)和肌肉量等指标来评价身体特征,在临床实验中橙皮苷补充剂量为200~1 000 mg/d,干预周期3~12周,受试人群包括健康人群、慢性病患者、肥胖人群和运动员等。在2021年的一篇有关补充橙皮苷对身体特征影响的Meta分析中发现,与对照组相比补充橙皮苷并不能改善身体特征,体重、体脂和腰围等指标均无显著变化[11]。但最新的Meta分析却有不同的结果,研究表示补充橙皮苷能够非常显著地降低体重,对腰围和BMI同样有一定效果,但无显著差异,并且橙皮苷具有抗炎和调节糖脂代谢的作用[12]。一项基于8 861名受试者为期3年的流行病学研究显示,长期摄入橙皮苷可减轻体重、降低总胆固醇和低密度脂蛋白胆固醇水平,与对照组相比肥胖的可能性降低21%,男性患代谢综合征的可能性降低36%[13]。
2.1.1 补充橙皮苷对脂肪和骨骼肌的影响
研究发现在运动训练过程中长期补充橙皮苷对增肌减脂有一定效果。MART NEZ NOGUERA等[14]认为长期补充橙皮苷有助于保留运动员骨骼肌含量,与对照组相比补充橙皮苷使下肢脂肪量减少15.5%,总脂肪量减少17.9%,并且在保证肌肉量不流失的同时出现一定量的增长。在受试对象为业余爱好者的另外2项研究中,虽然相关参数均无变化,但与肌肉力量和爆发力有关的指标显著提升,间接说明橙皮苷有助于提高人体骨骼肌含量[15-16]。因此,补充橙皮苷具备一定的改善脂肪和骨骼肌含量的作用。实验结果的部分异同可能是受试者个体背景、运动参数以及不同品种橙皮苷生物利用度的差异所导致的。
NEZ NOGUERA等[14]认为长期补充橙皮苷有助于保留运动员骨骼肌含量,与对照组相比补充橙皮苷使下肢脂肪量减少15.5%,总脂肪量减少17.9%,并且在保证肌肉量不流失的同时出现一定量的增长。在受试对象为业余爱好者的另外2项研究中,虽然相关参数均无变化,但与肌肉力量和爆发力有关的指标显著提升,间接说明橙皮苷有助于提高人体骨骼肌含量[15-16]。因此,补充橙皮苷具备一定的改善脂肪和骨骼肌含量的作用。实验结果的部分异同可能是受试者个体背景、运动参数以及不同品种橙皮苷生物利用度的差异所导致的。
2.1.2 补充橙皮苷对身体形态的影响
近年来,不断有研究探讨橙皮苷对肥胖、脂肪肝和代谢综合征等慢性病患者的治疗效果。YARI等[17-19]在3次实验中研究长期服用橙皮苷对久坐不动、运动量不足的慢性病患者身体形态的影响。研究人员让受试者按照规定的饮食和训练计划执行12周,并在干预前后测量身体形态、血压和血脂等生理指标。橙皮苷组和对照组干预后除腰臀比外,BMI、腰围、体重均低于干预前,并且橙皮苷组降低的程度更大,但无显著变化。在针对基线值、BMI和新陈代谢率的平均变化进行校正后,上述结果仍保持不变。此外,对糖脂代谢、脂肪肝变性和炎症同样有显著疗效,橙皮苷组肝脂肪变性降低的水平(≥40%)是对照组(22%)的2倍,肝纤维化减少,反映肝脏健康程度的指标(如丙氨酸氨基转移酶、γ-谷酰基转移酶等)均有下降[19]。由上述实验可知,橙皮苷对改善身体形态有一定的帮助,加之具备治疗相关慢性疾病的疗效。关于补充橙皮苷对身体影响的部分研究见表1。
表1 补充橙皮苷对身体特征的影响
Table 1 Effect of hesperidin supplementation on physical characteristics

实验对象样本量周期/周橙皮苷补充方案训练计划相关指标文献心肌梗死患者754600 mg/d日常训练计划体重、BMI、臀围、腰围↓,腰臀比-[20]2型糖尿病患者646500 mg/d日常训练计划体重、BMI-[21]业余自行车手408500 mg/d日常训练计划身体脂肪、体脂百分比↓∗,下肢脂肪量↓,肌肉量↑[14]运动爱好者394500 mg/d3次(30 min中高强度运动)/周体重-[16]肥胖人群100121.350 mg,2次/d2.140 mg,2次/d日常训练计划体重、BMI、腰围↓[22]代谢综合征患者243500 mg/d日常训练计划体重、腰围-[23]运动爱好者7981.400 mg/d2.500 mg/d日常训练计划体重-[15]代谢综合征患者4912500 mg/d30 min中等强度运动,5 次/周体重、腰围↓[17]代谢综合征患者4412500 mg/d30 min中等强度运动,5 次/周体重、腰围、BMI↓,腰臀比-[18]非酒精性脂肪肝患者5012500 mg,2次/d150 min中等强度有氧运动/周BMI、腰围↓,腰臀比-[19]
注:↑:提高;↓:降低;-:无明显变化;BMI:身体质量指数;*:P<0.05,橙皮苷组vs.安慰剂组(下同)。
2.2 补充橙皮苷改善身体特征的作用机理
橙皮苷能够通过多种途径对人体各成分产生有益影响,其作用机制较为复杂。具体作用机理可能包括:a)橙皮苷可以激活过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α, PPARα),有助于脂肪氧化分解。并且有研究表明PPARα可以升高高密度脂蛋白-胆固醇浓度,并降低血清甘油三酯水平,减少脂肪沉积[24-25]。b)橙皮苷通过抑制脂肪生成酶活性,减少烟酰胺腺嘌呤二核苷酸磷酸的生成来抑制脂肪酸合成酶,降低脂肪酸和甘油三酯的合成[26]。c)橙皮苷可以促进结肠内有益细菌(双歧杆菌属、嗜黏蛋白乳杆菌属、嗜黏蛋白阿克曼菌)的生长,间接增加短链脂肪酸的生成,有助于脂肪氧化和棕色脂肪组织活化,提升对血浆甘油三酯衍生的脂肪酸的利用[4,27]。另一方面,短链脂肪酸增强了过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)mRNA和蛋白质的表达,使PGC-1α磷酸化增加,间接促使线粒体生物发生,使脂肪酸氧化[28]。d)LI等[29]采用免疫印迹法发现橙皮苷可以激活单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase, AMPK),AMPK磷酸化使乙酰辅酶A羧化酶失活,进而导致其产物丙二酰辅酶A浓度下降,由于丙二酰辅酶A是肉碱棕榈酰基转移酶I的内源性抑制剂,所以补充橙皮苷可以促使肉碱棕榈酰基转移酶I介导的游离脂肪酸进入线粒体内,提高脂肪酸β氧化[30]。e)橙皮苷使AMPK磷酸化后,还可以抑制甾醇调节元件结合蛋白1表达,其不仅是调节合成脂肪酸的关键酶乙酰辅酶A羧化酶和脂肪酸合酶的转录因子,而且是PPARγ的正调控因子[31]。因此,抑制甾醇调节元件结合蛋白1可以减少肝脏脂肪合成、改善脂肪蓄积和减弱脂肪细胞分化能力。f)此外,AMPK磷酸化改变了NAD+/NADH值,并上调沉默信息调节因子1,进而通过去乙酰化部分转录因子,推动线粒体生物发生和脂肪酸氧化[32-33]。g)橙皮苷有利于成肌调节因子MyoD的核定位[12]。MyoD在调节成肌前体、诱导成肌细胞分化中起重要作用,并仅在骨骼肌块中表达。MyoD与靶基因启动子和转录因子的相互作用增强了MyoD介导的成肌基因转录和成肌分化,最终导致骨骼肌肥大。综上所述,橙皮苷能够提高脂肪分解和利用的能力,抑制脂肪分化和肝脏脂肪合成,对骨骼肌肥大同样有益。
3 补充橙皮苷对运动表现的影响及其作用机理
3.1 补充橙皮苷对运动表现的影响
3.1.1 补充橙皮苷对肌肉力量和爆发力的影响
补充橙皮苷可以显著提高肌肉力量和爆发力,对力量素质发展有明显效果。补充橙皮苷4周后绝对输出功率显著提高(5%),并且干预前后的差值是对照组的4倍,虽然峰值功率无显著变化,但初始的前3秒峰值功率呈明显的上升趋势[16]。由纳入的文献推测,橙皮苷对力量素质的影响可能与干预周期和橙皮苷摄入剂量有关。MART NEZ-NOGUERA等[34-35]先后对业余自行车手采用急性和长期干预实验,测试方法和橙皮苷补充剂量基本保持一致,测试结果发现,不论是急性还是长期补充橙皮苷,绝对功率和平均功率均显著提升,但有关峰值功率的结果却有所不同,补充8周橙皮苷后受试者峰值功率显著提升,而急性干预实验中没有变化。之后有学者对补充橙皮苷对爆发力的影响进行了更加细致的研究,实验分补充大剂量橙皮苷组(500 mg/d)、补充中等剂量橙皮苷组(400 mg/d)和对照组,干预周期8周,在第4周和第8周分别进行Wingate测试[15]。在第4周时平均功率均显著上升,峰值功率仅中等剂量组有显著差异;在第8周时平均功率大剂量组无显著差异,峰值功率均无显著差异。部分相关临床实验研究见表2。
NEZ-NOGUERA等[34-35]先后对业余自行车手采用急性和长期干预实验,测试方法和橙皮苷补充剂量基本保持一致,测试结果发现,不论是急性还是长期补充橙皮苷,绝对功率和平均功率均显著提升,但有关峰值功率的结果却有所不同,补充8周橙皮苷后受试者峰值功率显著提升,而急性干预实验中没有变化。之后有学者对补充橙皮苷对爆发力的影响进行了更加细致的研究,实验分补充大剂量橙皮苷组(500 mg/d)、补充中等剂量橙皮苷组(400 mg/d)和对照组,干预周期8周,在第4周和第8周分别进行Wingate测试[15]。在第4周时平均功率均显著上升,峰值功率仅中等剂量组有显著差异;在第8周时平均功率大剂量组无显著差异,峰值功率均无显著差异。部分相关临床实验研究见表2。
表2 补充橙皮苷对运动表现的影响(临床实验)
Table 2 Effects of hesperidin supplementation on exercise performance (clinical trial)

实验对象样本量周期/周橙皮苷补充方案(改成分组)训练计划测试方案相关指标文献业余自行车手16急性测试前后分别补充500 mg日常训练计划重复冲刺4×30 s平均功率、最大速度↑∗;峰值功率-[34]业余自行车手408500 mg/d日常训练计划递增负荷功率自行车测试、Wingate功能阈值功率、峰值功率、绝对和相对功率↑∗[35]男性训练爱好者394500 mg/d3次(30 min中高强度运动)/周递增负荷功率自行车测试绝对和相对功率↑∗、VO2max、峰值功率-[16]老年女性224100 mg,3次/d2~3次(50 min健身操+30 min中等强度有氧)/周递增负荷功率自行车测试VO2max、峰值功率-[37]训练爱好者7981.400 mg/d2.400 mg/d日常训练计划Wingate4周:平均功率↑∗;峰值功率a组↑∗,b组-8周:平均功率a组↑∗,b组-;峰值功率-[15]
注:VO2max:最大摄氧量。
综上,橙皮苷补充的剂量和补充周期对肌肉力量和爆发力的影响还有待明确。补充橙皮苷对改善炎症和氧化应激现象有一定作用,间接地提升运动表现,但可能存在剂量效应[17]。剂量过低可能无法引起足够的抗炎和抗氧化反应,不足以起到改善力量素质的作用,但值得注意的是,较高剂量的橙皮苷并没有进一步提高受试者肌肉力量和爆发力。可能原因是,补充较高剂量的橙皮苷使骨骼肌内活性氧(reactive oxygen species,ROS)浓度进一步降低,不利于肌肉收缩。而长期补充抗氧化剂可能钝化运动诱导的氧化还原信号,这可能对内源性抗氧化防御系统造成损害[36]。因此,橙皮苷的补充方法应根据个体训练背景、运动强度和年龄性别等做出调整。总体而言,补充橙皮苷对肌肉力量和爆发力具有积极影响。
3.1.2 补充橙皮苷对有氧耐力的影响
橙皮苷对有氧能力影响的人体实验较少,多数实验仍以动物为研究对象。在小鼠实验中发现,补充橙皮苷能够有效改善小鼠有氧耐力,运动持续时间延长,但可能受到干预周期以及运动强度的影响。在RUIZ-IGLESIAS等[40-41]依照不同运动强度测试的2次小鼠实验中发现,补充橙皮苷有助于提高中高强度的有氧耐力,小鼠运动持续时间延长,而当运动强度进一步提高达到某一强度范围时,补充橙皮苷对改善小鼠有氧运动能力无显著作用,这与另一项动物实验研究结果一致[39]。相关动物实验部分研究见表3。此外,在人体实验中同样发现补充橙皮苷有助于提高有氧耐力,在一项针对业余自行车运动员的实验中,经过8周的干预,受试者功能性阈值功率显著提升,表明运动员在一个小时内所能保持的最大平均输出功率上升[35]。研究还发现,随着运动强度不断提高,当对照组的主要供能来源逐渐由脂肪转化为碳水化合物时,实验组脂肪仍保持着较高的供能比例(相比对照组高15.1%),脂肪氧化率高,能够承受持续时间更长时间的有氧运动,证明补充橙皮苷对提高有氧耐力有着良好的效益。
表3 补充橙皮苷对运动表现的影响(动物实验)
Table 3 Effects of hesperidin supplementation on exercise performance (animal experiments)

实验对象样本量周期/周橙皮苷补充方案(改成分组)训练计划测试方案相关指标文献小鼠645200 mg/kg,3 次/周周一周五力竭测试,以上次测试60%最大速度(初始30 m/min)进行15 min,再每2 min增加6 m/min。周二、三、四以周一60%最大速度跑20、25、30 min递增负荷跑步机测试力竭时间↑[38]小鼠23250 mg/kg无准确说明恒定负荷跑步机测试低强度有氧耐力↑∗,高强度有氧耐力-[39]小鼠645200 mg/kg,3 次/周周一:60%最大速度奔跑15 min(初始30 m/min),再每2 min增加6 m/min;周二、三、四:以60%最大速度奔跑20、25、30 min递增负荷跑步机测试有氧耐力↑∗[40]小鼠606运动组:a)不补充;b)200 mg/kg久坐组:a)不补充;b)200 mg/kg周一:70%最大速度奔跑15 min(初始15 m/min),再每2 min增加3 m/min;周二、三、四:以70%最大速度奔跑25、30、40 min递增负荷跑步机测试有氧耐力-[41]小鼠245天0.03 mL/10 g0.06 mL/10 g0.1 mL/10 g无准确说明游泳有氧耐力↑∗[42]
最大摄氧量是一个衡量人有氧能力的可靠指标,而人体去脂体重和VO2max可能呈正相关,体脂低而肌肉量较高的运动员具有更强的有氧能力[43]。OVERDEVEST等[16]和PITTALUGA等[37]的研究中VO2max虽均无明显提升,但前者VO2max与输出功率的比值下降,说明消耗相同体积氧气可以产生更大的输出功率,从而具备更强的运动能力,这一结果表明橙皮苷除增加氧气运输速率外,可能还存在其他潜在作用;后者作为老年人群,身体各项机能逐渐衰弱,而补充橙皮苷抑制了这一趋势,提示橙皮苷作为一种补充剂能够缓解老年人肌肉流失和运动表现下降的情况。
与针对力量素质表现的研究相比,补充橙皮苷对有氧能力影响的研究较少。可能原因是橙皮苷联合一定的训练量对肌肉力量和爆发力的作用效果更加明显,使得学者更加关注力量素质的研究。补充橙皮苷有助于减少肌肉氧化应激损伤,提高脂肪利用率,直接或间接性地提升机体VO2max,延缓运动性疲劳的出现,进而对有氧能力的提升产生积极影响[14]。
3.2 补充橙皮苷改善运动表现的作用机理
3.2.1 改善内皮功能
内皮细胞在调节血液流向外周肌肉中起重要作用,对肌肉血流灌注至关重要。正常的动脉功能需要保持血管舒张和收缩之间的平衡,这对于在休息和运动时调节血流量和血管张力极为重要,而内皮细胞能够通过NO调节血管通透性,维持血管张力[44]。体外研究发现,采用1 mmol/L和10 mmol/L的橙皮苷处理牛主动脉内皮细胞10 min后,细胞内AMPK(Thr172)和Akt(Ser473)的水平急剧升高[23]。这2种激酶调节内皮型一氧化氮合酶的活性,导致NO生成数量增加。另有研究证实,橙皮苷(暴露时间30 min~24 h)具有刺激人脐静脉内皮细胞产生NO的作用[45]。NO可以促使血管扩张,从而提高运动和休息时人体的血液流动速度[46]。血液流动除输送氧气以外,还能将葡萄糖、脂质和其他营养物质输送到不同组织,并将组织内的代谢废物通过血液运输至特定器官排出体外,延缓运动疲劳的出现[47]。随着NO浓度增加,肌浆网的钙利用率和敏感性发生一定变化,使得肌肉收缩功能增强,提高骨骼肌代谢效率,并减少肌肉做功所需的能量[48]。骨骼肌收缩需要能量,无论是肌动蛋白和肌球蛋白之间的相互作用,还是肌浆网中的钙泵。NO可以减少肌浆网中钙离子的释放,并抑制钙泵活性,这使得运动员可以承受更长时间的高强度运动[49]。
当内皮功能受损时,NO的生成受到限制,内皮素-1活性增加,造成血管收缩和血流速度减慢,进而导致血液运输氧气和营养物质的能力减弱[50]。而运动过程中肌肉需要消耗大量氧气,氧气运输和相关线粒体功能被认为是有氧耐力的主要限制因素,因此保证内皮功能完善至关重要。橙皮苷除了对血管活性因子的影响之外,还可以减少TNF-α刺激的血管黏附分子(vascular cell adhesion molecule-1, VCAM-1)表达以及单核细胞黏附[23]。动脉粥样硬化会导致动脉内皮细胞损伤,而VCAM-1表达的增加是导致这一现象的主要原因[51]。总之,NO具有强大的扩张血管和抵抗炎症的能力,补充橙皮苷不仅能刺激内皮细胞释放更多NO,而且对受损的内皮细胞也有一定的修复作用,对加快血流速度和增强物质代谢能力有益,使运动能力得到提升。
3.2.2 抗氧化作用
抗氧化状态和内源性抗氧化能力是影响运动员成绩的关键因素。高强度或中至长时间的运动会导致氧化应激反应,ROS的产生可能通过多种途径来介导。由运动诱导产生的ROS会导致脂质过氧化,通过黄嘌呤氧化酶激活产生超氧阴离子,氧化/还原性谷胱甘肽值增加,对机体造成一系列危害[52]。而橙皮苷抑制ROS的产生和积累,抑制脂质过氧化,并调节抗氧化基因和Ⅱ相代谢酶编码基因的表达,如超氧化物歧化酶和谷胱甘肽过氧化物酶等[53-55]。通过缓解氧化应激,橙皮苷抑制了ROS诱导的DNA损伤,阻止Ca2+流入,降低细胞质中细胞色素c的含量,增加线粒体膜电位[56-58]。从而提高细胞抗氧化能力,增强细胞活性,促进细胞抗氧化酶的表达,减少自由基对肌肉细胞结构的破坏,有助于运动后更好的恢复[59]。
橙皮苷主要通过Keap1/NRF2/ARE通路调节细胞的抗氧化能力。NRF2是一种碱性亮氨酸拉链蛋白,也是调节氧化应激的转录因子。在沉默状态下,位于细胞质的NRF2与Keap1结合,被泛素连接酶降解[60]。当细胞遭受氧化应激时,NRF2与Keap1解离并转移到细胞核内,随后NRF2与其他拉链蛋白相互作用形成异二聚体,该异二聚体与ARE结合,激活抗氧化酶的表达[61]。橙皮苷对Keap1/NRF2通路的调控主要是促进NRF2的表达和核转运,促进ARE和抑制Keap1的表达。此外,LI等[53]的研究发现,PI3K或Akt抑制剂可抑制橙皮苷对NRF2的激活和核转运以及下游抗氧化蛋白谷氨酸半胱氨酸连接酶催化亚基和血红素氧合酶1的上调。表明,橙皮苷可以触发PI3K-Akt信号转导,导致NRF2的激活和NRF2下游抗氧化蛋白的上调,抑制氧化应激,从而提高运动表现。
3.2.3 抗炎作用
单次高强度运动能够诱导相当大程度的局部和全身炎症反应,可导致白细胞浸润和炎症因子水平升高[62]。运动诱导的炎症对刺激肌肉适应具有重要意义,但同样会对运动训练产生不利影响,可能导致运动能力下降[63]。如果没有提供足够的恢复时间,过度的炎症反应会导致肌肉收缩功能和力量受损[63]。此外,运动后的炎症会抑制肌肉功能的恢复,从而对短期恢复产生负面影响[64]。在橙皮苷影响巨噬细胞对炎症反应的体外实验中,橙皮苷可抑制脂多糖诱导的巨噬细胞中NO、前列腺素E2和环氧化酶2的基因表达[65]。在健康成人和患有慢性疾病(如代谢综合征、非酒精性脂肪肝)的个体中,长期补充一定量的橙皮苷有助于降低超敏C反应蛋白、白细胞介素6和TNF-α水平[44]。此外,动物实验中有相似发现。经由顺铂药物诱导的肾TNF-α增加的小鼠,在之后的10 d每日补充200 mg/kg橙皮苷,发现TNF-α下降,并且通过测定髓过氧化物酶活性,发现中性粒细胞浸润减少[66]。综上,橙皮苷通过降低促炎标志物的产生和血浆水平而显示出良好的抗炎特性,长期补充橙皮苷可显著降低炎性细胞因子(如超敏C反应蛋白、血清淀粉样蛋白A和可溶性黏附分子E-选择素),减轻炎症反应,抑制炎症信号通路[23,44]。因此,补充橙皮苷可以减少运动后诱发的炎症,缓解运动疲劳和促进肌肉损伤恢复,提高运动表现。
3.2.4 提高线粒体生物发生
当线粒体生物发生受损时,能量供应不足会导致人体疲劳、体能下降以及身体功能障碍,对运动表现产生不利影响。在2周时间内为小鼠每日补充50 mg/kg的橘皮苷,虽然线粒体数量没有改变,但提高了线粒体蛋白的表达和小鼠有氧耐力能力,当延长给药周期,线粒体数量增加[39,67]。因此,长期补充一定剂量的橙皮苷有助于提高骨骼肌中线粒体数量,延缓肌肉疲劳产生,延长运动持续时间。
在体内外实验中,橘皮苷激活了AMPK/PGC-1α/NRF1/TFAM通路,这是调控线粒体生物生成的主要途径[68]。AMPK可直接激活PGC-1α,而橙皮苷具备使AMPK磷酸化的能力,从而促进PGC-1α由细胞质转位至细胞核,导致NRF1表达上调[69]。在体内外实验中发现,橙皮苷通过调节参与线粒体DNA复制和转录的基因,增加了线粒体生物发生的正调节因子TFAM的表达[69]。在同一篇文献中还发现,橙皮苷可以激活线粒体标志蛋白复合物Ⅳ,这被认为是反映线粒体数量的重要指标之一[69]。此外,由于AMPK是AMP/ATP的重要感知器,所以AMP/ATP的变化均会对AMPK产生一定影响[70]。既往研究报道,橙皮苷可以调节ATP酶活性,使ATP浓度降低,提高AMP/ATP值,从而促进AMPK活化[71]。综上所述,橙皮苷可以通过激活AMPK/PGC-1α信号通路来改善线粒体生物发生,并有助于提高运动表现。图2综合体现了补充橙皮苷对提高运动表现的潜在作用机理。
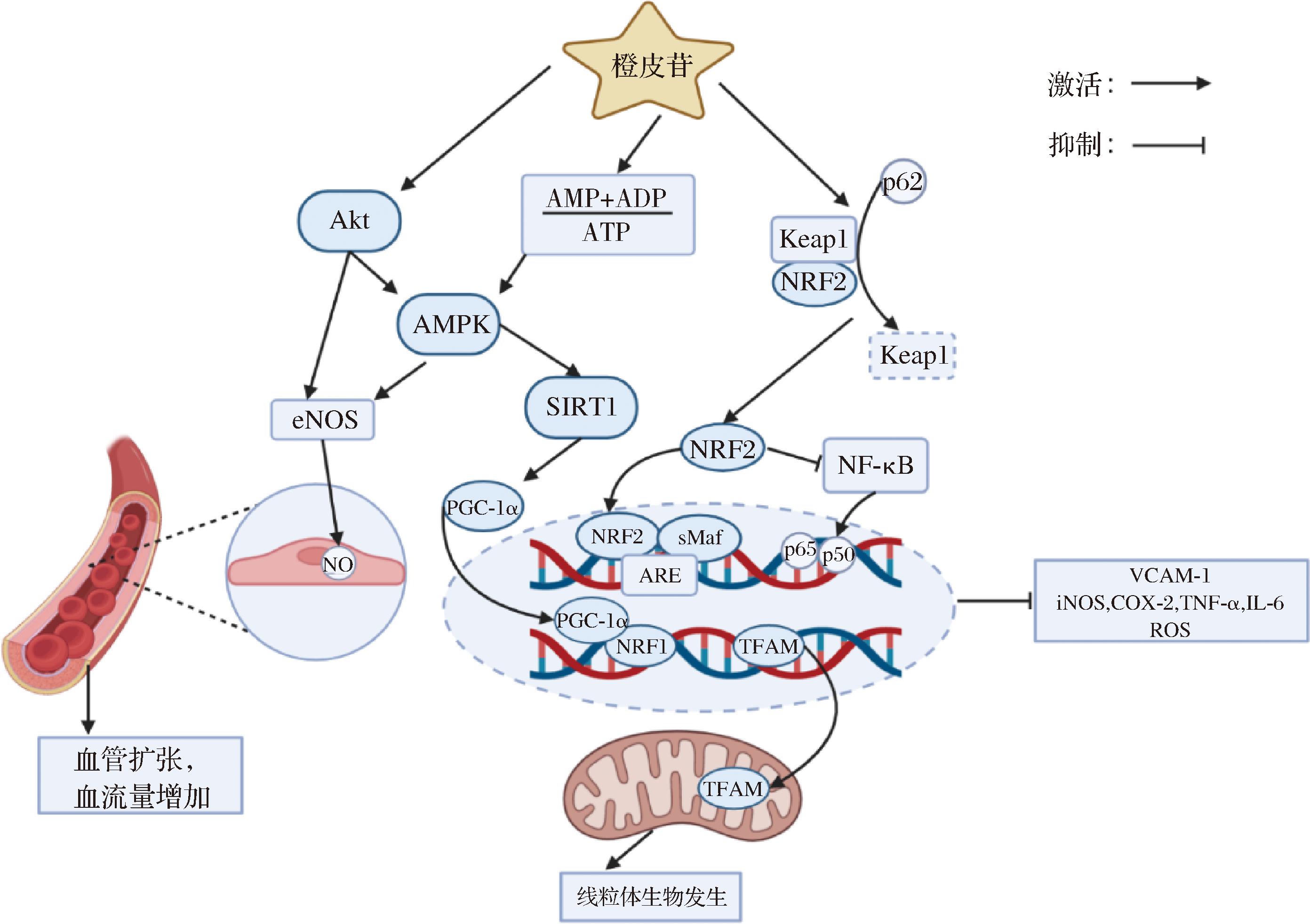
图2 补充橙皮苷对提高运动表现的潜在作用机理
Fig.2 Potential mechanism of hesperidin supplementation to improve sports performance
4 小结与展望
4.1 小结
橙皮苷除药典中提到的抗菌抗病毒等功效外,对于控制体脂、维持肌肉量一样有效,并且由于其安全稳定的特性,对慢性疾病患者无不良影响,使其在医学领域具有广阔的应用前景。在运动表现方面,补充橙皮苷使绝对和相对输出功率明显提高,有效地增强了肌肉力量和爆发力。橙皮苷对有氧耐力的作用有待继续研究,但能确定的是,补充橙皮苷有助于改善内皮功能以及提高线粒体生物发生,加快肌肉中氧气和营养物质的运输,因而对增强有氧耐力有一定作用。此外,补充橙皮苷还可以减轻ROS介导的肌细胞损伤和运动后诱发的炎症反应,促进训练期间的肌肉恢复和提高运动表现。部分研究结果的不一致可能与实验对象的个体差异、补充剂量与周期、训练方式和训练强度有关,需要进一步的研究得出结论。
4.2 展望
a)部分研究发现橙皮苷与其他营养补剂(如咖啡因、茶)之间可能存在协同效应,但目前相关研究较少,有待进一步探索。
b)橙皮苷摄入剂量和补充周期尚未有准确定论,未来有必要针对不同年龄、性别及个体背景(如专业运动员、青少年、慢性病患者等),制定精细化、个性化的补充方案,以期满足特定需求。
c)橙皮苷是一种由2个苯环通过中央三碳链相互连接形成的化合物,由于其结构的特殊性,不易通过细胞膜的磷脂层,无法以原有的形式被肠道吸收,需经过一系列的修饰才能在体内转运、吸收和利用,导致其生物利用率低。现有研究发现,通过去除橙皮苷中的鼠李糖可获得其类黄酮葡萄糖苷(橙皮素),口服利用度高,大大提高生物利用度,值得在未来的研究中深入探索。
[1] 张祖姣, 袁志辉, 何福林, 等. 芝麻素酚葡萄糖苷生理活性功能研究进展[J]. 食品与发酵工业, 2023, 49(21):313-320.ZHANG Z J, YUAN Z H, HE F L, et al. Advances in biological activities of sesaminol glucosides[J]. Food and Fermentation Industries, 2023, 49(21):313-320.
[2] 何邵平, 呙于明, 郭吉余. 橙皮苷的生理功能及在家禽生产中的应用[J]. 中国饲料, 2023(7):148-152.HE S P, GUO Y M, GUO J Y. Biological functions of hesperidin and its application in poultry production[J]. China Feed, 2023(7):148-152.
[3] 刘嘉丽, 刘德明, 王丹, 等. 湖南柑橘果皮总黄酮及橙皮苷含量分析[J]. 湖南农业科学, 2020(11):58-62.LIU J L, LIU D M, WANG D, et al. Analyses of the contents of total flavonoids and hesperidin in citrus peel[J]. Hunan Agricultural Sciences, 2020(11):58-62.
[4] MAS-CAPDEVILA A, TEICHENNE J, DOMENECH-COCA C, et al. Effect of hesperidin on cardiovascular disease risk factors: The role of intestinal microbiota on hesperidin bioavailability[J]. Nutrients, 2020, 12(5):1488.
[5] 王磊, 栗栖凤. 橙皮苷的生物活性及其在畜牧业中的应用[J]. 饲料研究, 2021, 44(1):147-150.WANG L, LI Q F. Biological activity of hesperidin and its application in animal husbandry[J]. Feed Research, 2021, 44(1):147-150.
[6] MAN M Q, YANG B, ELIAS P M. Benefits of hesperidin for cutaneous functions[J]. Evidence-Based Complementary and Alternative Medicine, 2019, 2019(1):2676307.
[7] 张风亭, 胡坦, 潘思轶. 橙皮苷生物学活性及其改性技术的研究进展[J]. 食品工业科技, 2022, 43(10):442-449.ZHANG F T, HU T, PAN S Y. Research progress on biological activity and modification technology of hesperidin[J]. Science and Technology of Food Industry, 2022, 43(10):442-449.
[8] 王幻. 橙皮素单葡萄糖苷的酶法合成、分离纯化及其应用[D]. 广州: 华南理工大学, 2019.WANG H. Enzymatic synthesis, purification and application of hesperidin monoglucoside[D]. Guangzhou: South China University of Technology, 2019.
[9] TUNG Y C, CHANG W T, LI S M, et al. Citrus peel extracts attenuated obesity and modulated gut microbiota in mice with high-fat diet-induced obesity[J]. Food &Function, 2018, 9(6):3363-3373.
[10] MONTALBANO G, MANIA M, GUERRERA M C, et al. Effects of a flavonoid-rich extract from Citrus sinensis juice on a diet-induced obese zebrafish[J]. International Journal of Molecular Sciences, 2019, 20(20):5116.
[11] DJAFARI F, SHAHAVANDI M, AMINI M R, et al. The effects of hesperidin supplementation or orange juice consumption on anthropometric measures in adults: A meta-analysis of randomized controlled clinical trials[J]. Clinical Nutrition ESPEN, 2021, 43:148-157.
[12] KHORASANIAN A S, FATEH S T, GHOLAMI F, et al. The effects of hesperidin supplementation on cardiovascular risk factors in adults: A systematic review and dose-response meta-analysis[J]. Frontiers in Nutrition, 2023, 10:1177708.
[13] O’NEIL C E, NICKLAS T A, RAMPERSAUD G C, et al. 100% orange juice consumption is associated with better diet quality, improved nutrient adequacy, decreased risk for obesity, and improved biomarkers of health in adults: National Health and Nutrition Examination Survey, 2003-2006[J]. Nutrition Journal, 2012, 11:107.
[14] MART NEZ NOGUERA F J, ALCARAZ P E, CARLOS VIVAS J, et al. 8 weeks of 2 S-hesperidin supplementation improves muscle mass and reduces fat in amateur competitive cyclists: Randomized controlled trial[J]. Food &Function, 2021, 12(9):3872-3882.
NEZ NOGUERA F J, ALCARAZ P E, CARLOS VIVAS J, et al. 8 weeks of 2 S-hesperidin supplementation improves muscle mass and reduces fat in amateur competitive cyclists: Randomized controlled trial[J]. Food &Function, 2021, 12(9):3872-3882.
[15] VAN IERSEL L E, STEVENS Y R, CONCHILLO J M, et al. The effect of citrus flavonoid extract supplementation on anaerobic capacity in moderately trained athletes: A randomized controlled trial[J]. Journal of the International Society of Sports Nutrition, 2021, 18(1):2.
[16] OVERDEVEST E, WOUTERS J A, WOLFS K H M, et al. Citrus flavonoid supplementation improves exercise performance in trained athletes[J]. Journal of Sports Science &Medicine, 2018, 17(1):24-30.
[17] YARI Z, MOVAHEDIAN M, IMANI H, et al. The effect of hesperidin supplementation on metabolic profiles in patients with metabolic syndrome: A randomized, double-blind, placebo-controlled clinical trial[J]. European Journal of Nutrition, 2020, 59(6):2569-2577.
[18] YARI Z, CHERAGHPOUR M, HEKMATDOOST A. Flaxseed and/or hesperidin supplementation in metabolic syndrome: An open-labeled randomized controlled trial[J]. European Journal of Nutrition, 2021, 60(1):287-298.
[19] YARI Z, CHERAGHPOUR M, ALAVIAN S M, et al. The efficacy of flaxseed and hesperidin on non-alcoholic fatty liver disease: An open-labeled randomized controlled trial[J]. European Journal of Clinical Nutrition, 2021, 75(1):99-111.
[20] HAIDARI F, HEYBAR H, JALALI M T, et al. Hesperidin supplementation modulates inflammatory responses following myocardial infarction[J]. Journal of the American College of Nutrition, 2015, 34(3):205-211.
[21] HOMAYOUNI F, HAIDARI F, HEDAYATI M, et al. Hesperidin supplementation alleviates oxidative DNA damage and lipid peroxidation in type 2 diabetes: A randomized double-blind placebo-controlled clinical trial[J]. Phytotherapy Research, 2017, 31(10):1539-1545.
[22] RANGEL-HUERTA O D, AGUILERA C M, MARTIN M V, et al. Normal or high polyphenol concentration in orange juice affects antioxidant activity, blood pressure, and body weight in obese or overweight adults[J]. The Journal of Nutrition, 2015, 145(8):1808-1816.
[23] RIZZA S, MUNIYAPPA R, IANTORNO M, et al. Citrus polyphenol hesperidin stimulates production of nitric oxide in endothelial cells while improving endothelial function and reducing inflammatory markers in patients with metabolic syndrome[J]. The Journal of Clinical Endocrinology and Metabolism, 2011, 96(5): E782-E792.
[24] DUVAL C, MÜLLER M, KERSTEN S. PPARalpha and dyslipidemia[J]. Biochimica et Biophysica Acta, 2007, 1771(8):961-971.
[25] ASSINI J M, MULVIHILL E E, HUFF M W. Citrus flavonoids and lipid metabolism[J]. Current Opinion in Lipidology, 2013, 24(1):34-40.
[26] JUNG U J, LEE M K, PARK Y B, et al. Effect of citrus flavonoids on lipid metabolism and glucose-regulating enzyme mRNA levels in type-2 diabetic mice[J]. The International Journal of Biochemistry &Cell Biology, 2006, 38(7):1134-1145.
[27] LI Z, YI C X, KATIRAEI S, et al. Butyrate reduces appetite and activates brown adipose tissue via the gut-brain neural circuit[J]. Gut, 2018, 67(7):1269-1279.
[28] GAO Z G, YIN J, ZHANG J, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice[J]. Diabetes, 2009, 58(7):1509-1517.
[29] LI H, LIU L L, CAO Z W, et al. Naringenin ameliorates homocysteine induced endothelial damage via the AMPKα/Sirt1 pathway[J]. Journal of Advanced Research, 2021, 34:137-147.
[30] MCGARRY J D, MILLS S E, LONG C S, et al. Observations on the affinity for carnitine, and malonyl-CoA sensitivity, of carnitine palmitoyltransferase I in animal and human tissues. Demonstration of the presence of malonyl-CoA in non-hepatic tissues of the rat[J]. Biochemical Journal, 1983, 214(1):21-28.
[31] BU S, YUAN C Y, CAO F L, et al. Concentrated extract of Prunus mume fruit exerts dual effects in 3T3-L1 adipocytes by inhibiting adipogenesis and inducing beiging/browning[J]. Food &Nutrition Research, 2021, 65:65.
[32] LIN S J, DEFOSSEZ P A, GUARENTE L. Requirement of NAD and SIR2 for life-span extension by calorie restriction in Saccharomyces cerevisiae[J]. Science, 2000, 289(5487):2126-2128.
[33] DING R B, BAO J L, DENG C X. Emerging roles of SIRT1 in fatty liver diseases[J]. International Journal of Biological Sciences, 2017, 13(7):852-867.
[34] MART NEZ-NOGUERA F J, MAR
NEZ-NOGUERA F J, MAR N-PAG
N-PAG N C, CARLOS-VIVAS J, et al. Acute effects of hesperidin in oxidant/antioxidant state markers and performance in amateur cyclists[J]. Nutrients, 2019, 11(8):1898.
N C, CARLOS-VIVAS J, et al. Acute effects of hesperidin in oxidant/antioxidant state markers and performance in amateur cyclists[J]. Nutrients, 2019, 11(8):1898.
[35] MART NEZ-NOGUERA F J, MAR
NEZ-NOGUERA F J, MAR N-PAG
N-PAG N C, CARLOS-VIVAS J, et al. Effects of 8 weeks of 2S-hesperidin supplementation on performance in amateur cyclists[J]. Nutrients, 2020, 12(12):3911.
N C, CARLOS-VIVAS J, et al. Effects of 8 weeks of 2S-hesperidin supplementation on performance in amateur cyclists[J]. Nutrients, 2020, 12(12):3911.
[36] DRÖGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1):47-95.
[37] PITTALUGA M, SGADARI A, TAVAZZI B, et al. Exercise-induced oxidative stress in elderly subjects: The effect of red orange supplementation on the biochemical and cellular response to a single bout of intense physical activity[J]. Free Radical Research, 2013, 47(3):202-211.
[38] ESTRUEL-AMADES S, MASSOT-CLADERA M, GARCIA-CERD P, et al. Protective effect of hesperidin on the oxidative stress induced by an exhausting exercise in intensively trained rats[J]. Nutrients, 2019, 11(4):783.
P, et al. Protective effect of hesperidin on the oxidative stress induced by an exhausting exercise in intensively trained rats[J]. Nutrients, 2019, 11(4):783.
[39] NAGAYAMA S, AOKI K, KOMINE S, et al. Improvement of low-intensity long-time running performance in rats by intake of glucosyl hesperidin[J]. Physiological Reports, 2023, 11(2): e15413.
[40] RUIZ-IGLESIAS P, ESTRUEL-AMADES S, CAMPS-BOSSACOMA M, et al. Influence of hesperidin on systemic immunity of rats following an intensive training and exhausting exercise[J]. Nutrients, 2020, 12(5):1291.
[41] RUIZ-IGLESIAS P, MASSOT-CLADERA M, PÉREZ-CANO F J, et al. Influence of diets enriched with flavonoids (cocoa and hesperidin) on the systemic immunity of intensively trained and exhausted rats[J]. Biomolecules, 2022, 12(12):1893.
[42] 侯克镇, 何芳, 焦惠尧, 等. 橙皮苷对小鼠耐缺氧能力的影响[J]. 中国当代医药, 2015, 22(24):8-11.HOU K Z, HE F, JIAO H Y, et al. Influence of hesperidin on hypoxia tolerance ability of mice[J]. China Modern Medicine, 2015, 22(24):8-11.
[43] YOSHIGA C C, HIGUCHI M. Oxygen uptake and ventilation during rowing and running in females and males[J]. Scandinavian Journal of Medicine &Science in Sports, 2003, 13(6):359-363.
[44] IMPERATRICE M, CUIJPERS I, TROOST F J, et al. Hesperidin functions as an ergogenic aid by increasing endothelial function and decreasing exercise-induced oxidative stress and inflammation, thereby contributing to improved exercise performance[J]. Nutrients, 2022, 14(14):2955.
[45] TAKUMI H, NAKAMURA H, SIMIZU T, et al. Bioavailability of orally administered water-dispersible hesperetin and its effect on peripheral vasodilatation in human subjects: Implication of endothelial functions of plasma conjugated metabolites[J]. Food &Function, 2012, 3(4):389-398.
[46] IKEMURA M, SASAKI Y, GIDDINGS J C, et al. Preventive effects of hesperidin, glucosyl hesperidin and naringin on hypertension and cerebral thrombosis in stroke-prone spontaneously hypertensive rats[J]. Phytotherapy Research, 2012, 26(9):1272-1277.
[47] CLEMENTS W T, LEE S R, BLOOMER R J. Nitrate ingestion: A review of the health and physical performance effects[J]. Nutrients, 2014, 6(11):5224-5264.
[48] BAILEY S J, WINYARD P, VANHATALO A, et al. Dietary nitrate supplementation reduces the O2 cost of low-intensity exercise and enhances tolerance to high-intensity exercise in humans[J]. Journal of Applied Physiology (Bethesda, Md.), 2009, 107(4):1144-1155.
[49] VINER R I, WILLIAMS T D, SCHÖNEICH C. Nitric oxide-dependent modification of the sarcoplasmic reticulum Ca-ATPase: Localization of cysteine target sites[J]. Free Radical Biology &Medicine, 2000, 29(6):489-496.
[50] CYR A R, HUCKABY L V, SHIVA S S, et al. Nitric oxide and endothelial dysfunction[J]. Critical Care Clinics, 2020, 36(2):307-321.
[51] CYBULSKY M I, IIYAMA K, LI H, et al. A major role for VCAM-1, but not ICAM-1, in early atherosclerosis[J]. Journal of Clinical Investigation, 2001, 107(10):1255-1262.
[52] MASTALOUDIS A, LEONARD S W, TRABER M G. Oxidative stress in athletes during extreme endurance exercise[J]. Free Radical Biology and Medicine, 2001, 31(7):911-922.
[53] LI J D, WANG T Q, LIU P P, et al. Hesperetin ameliorates hepatic oxidative stress and inflammation via the PI3K/AKT-Nrf2-ARE pathway in oleic acid-induced HepG2 cells and a rat model of high-fat diet-induced NAFLD[J]. Food &Function, 2021, 12(9):3898-3918.
[54] ALI M Y, ZAIB S, RAHMAN M M, et al. Didymin, a dietary citrus flavonoid exhibits anti-diabetic complications and promotes glucose uptake through the activation of PI3K/Akt signaling pathway in insulin-resistant HepG2 cells[J]. Chemico-Biological Interactions, 2019, 305:180-194.
[55] LI M, LIN X F, LU J, et al. Hesperidin ameliorates UV radiation-induced skin damage by abrogation of oxidative stress and inflammatory in HaCaT cells[J]. Journal of Photochemistry and Photobiology B: Biology, 2016, 165:240-245.
[56] LIU W Y, LIOU S S, HONG T Y, et al. Protective effects of hesperidin (citrus flavonone) on high glucose induced oxidative stress and apoptosis in a cellular model for diabetic retinopathy[J]. Nutrients, 2017, 9(12):1312.
[57] HWANG S L, YEN G C. Neuroprotective effects of the citrus flavanones against H2O2-induced cytotoxicity in PC12 cells[J]. Journal of Agricultural and Food Chemistry, 2008, 56(3):859-864.
[58] HWANG S L, YEN G C. Modulation of Akt, JNK, and p38 activation is involved in citrus flavonoid-mediated cytoprotection of PC12 cells challenged by hydrogen peroxide[J]. Journal of Agricultural and Food Chemistry, 2009, 57(6):2576-2582.
[59] SHUKLA K, SONOWAL H, SAXENA A, et al. Didymin prevents hyperglycemia-induced human umbilical endothelial cells dysfunction and death[J]. Biochemical Pharmacology, 2018, 152:1-10.
[60] LIU S N, PI J B, ZHANG Q. Signal amplification in the KEAP1-NRF2-ARE antioxidant response pathway[J]. Redox Biology, 2022, 54:102389.
[61] BELLEZZA I, GIAMBANCO I, MINELLI A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress[J]. Biochimica et Biophysica Acta. Molecular Cell Research, 2018, 1865(5):721-733.
[62] DE BARCELLOS L A M, GONÇALVES W A, ESTEVES DE OLIVEIRA M P, et al. Effect of physical training on exercise-induced inflammation and performance in mice[J]. Frontiers in Cell and Developmental Biology, 2021, 9:625680.
[63] CHENG A J, JUDE B, LANNER J T. Intramuscular mechanisms of overtraining[J]. Redox Biology, 2020, 35:101480.
[64] PEAKE J M, MARKWORTH J F, NOSAKA K, et al. Modulating exercise-induced hormesis: Does less equal more?[J]. Journal of Applied Physiology (Bethesda, Md.), 2015, 119(3):172-189.
[65] YANG H L, CHEN S C, SENTHIL KUMAR K J, et al. Antioxidant and anti-inflammatory potential of hesperetin metabolites obtained from hesperetin-administered rat serum: An ex vivo approach[J]. Journal of Agricultural and Food Chemistry, 2012, 60(1):522-532.
[66] SAHU B D, KUNCHA M, SINDHURA G J, et al. Hesperidin attenuates cisplatin-induced acute renal injury by decreasing oxidative stress, inflammation and DNA damage[J]. Phytomedicine, 2013, 20(5):453-460.
[67] BIESEMANN N, RIED J S, DING-PFENNIGDORFF D, et al. High throughput screening of mitochondrial bioenergetics in human differentiated myotubes identifies novel enhancers of muscle performance in aged mice[J]. Scientific Reports, 2018, 8(1):9408.
[68] MARIN T L, GONGOL B, ZHANG F, et al. AMPK promotes mitochondrial biogenesis and function by phosphorylating the epigenetic factors DNMT1, RBBP7, and HAT1[J]. Science Signaling, 2017, 10(464): eaaf7478.
[69] KOU G N, LI Z Q, WU C, et al. Citrus tangeretin improves skeletal muscle mitochondrial biogenesis via activating the AMPK-PGC1-α pathway in vitro and in vivo: A possible mechanism for its beneficial effect on physical performance[J]. Journal of Agricultural and Food Chemistry, 2018, 66(45):11917-11925.
[70] HERZIG S, SHAW R J. AMPK: Guardian of metabolism and mitochondrial homeostasis[J]. Nature Reviews. Molecular Cell Biology, 2018, 19(2):121-135.
[71] LIZCANO J M, GÖRANSSON O, TOTH R, et al. LKB1 is a master kinase that activates 13 kinases of the AMPK subfamily, including MARK/PAR-1[J]. The EMBO Journal, 2004, 23(4):833-843.