酿酒是人类最早从事的生物技术,也是人类最早掌握的微生物发酵技术。白酒是中国传统的发酵产品,具有悠久的历史,现代酿酒工业体系的建立使白酒发酵技术成为我国工业生物技术的重要组成部分。白酒酿造以自然接种、自然发酵的微生物群落为主,参与发酵的微生物在百种之上,微生物代谢形成千种以上丰富的风味化合物,丰富了白酒的感官特征。白酒酿造微生物来源于开放环境接种,酒曲、酒醅和窖泥等酿造区系孕育出丰富的微生物资源,因此除接种大曲[1]等发酵起始剂,生产原料、操作环境[2]、空气和发酵容器(如窖池)等均是酿造微生物的重要来源。研究表明,环境微生物驱动发酵过程的演替[3-5];本土环境的微生物也会增加发酵产品的风味典型性并对发酵产品的转化具有积极的贡献[6-7];但同时不理想的环境微生物往往导致发酵产品的缺陷或腐败。高通量测序技术增强了研究者对环境微生物群落的研究能力,研究工业微生物生态以及与发酵过程的相互联系,有助于提升发酵食品工业过程的可控性及产品品质的稳定性。
白酒发酵采用边糖化边发酵的生产方式[8],糖化主要是由霉菌产生的糖化酶和淀粉酶分解淀粉和蛋白质产生微生物可利用的小分子底物;发酵则主要由酵母利用葡萄糖代谢生成乙醇。因此白酒发酵过程中的真菌群落结构及来源对发酵成败具有关键的作用[9]。酱香型白酒是我国名优白酒,其生产采用独特的两阶段发酵法,堆积发酵和窖内发酵。堆积发酵在开放环境中进行,是环境微生物参与白酒发酵的“窗口”,也是酱香型白酒酿造工艺中最难掌握的关键环节[10]。堆积发酵又称其为“二次制曲”,已有研究表明,该过程主要是富集车间环境中的微生物,促进糖化发酵,对入窖发酵顺利进行具有决定性的作用[11]。20世纪60年代始,我国科研工作者通过堆积与不堆积的对比试验,对酱香型白酒堆积发酵的重要性和作用进行了初步探究[12],但未阐明不同发酵状态下的微生物群落结构及差异原因。后续研究通过可培养方法对得到了堆积不同时期可培养酵母、霉菌和细菌的数量消长规律[13-14]。也有研究者结合微生物培养和变性梯度凝胶电泳等技术分析酱香型白酒堆积过程中霉菌群落,发现优势功能微生物为Paecilomyces variotii和Aspergillus oryzae[15],为后续的强化应用奠定了基础。然而,由于堆积发酵的开放性和复杂性,目前对堆积发酵过程中酒醅的真菌多样性结构的动态演变规律还不清楚,对酵母及霉菌来源认识也不清楚,这阻碍了酱香型白酒堆积发酵管理和控制。因此,解析酱香型白酒堆积发酵过程中真菌多样性和群落演替规律是探究白酒酿造机理、控制白酒质量必不可少的环节。
本研究以酱香型白酒造沙轮次的堆积酒醅、大曲和环境样品为对象,通过高通量测序技术考察其微生物多样性及群落结构,进一步解析堆积过程中真菌菌群演替规律,确定酱香型白酒功能微生物的环境分布,同时通过比较不同类型样品的差异解析功能微生物的可能来源,为提高传统发酵过程的可控性和产品批次的稳定性提供重要依据。
1 材料与方法
1.1 酒醅、大曲及环境样品采集
1.1.1 酒醅样品的采集
酒醅样品采集自贵州某著名酱香型白酒厂酿酒车间,共取4个发酵班组(标记为A、B、C、D 4个班)作平行取样。堆积过程中每隔24 h对酒醅进行取样(标记为H0、H1、H2和H3),取样位点为距离堆表面0.5 m和1 m,这2个位置是工人师傅凭借经验判断发酵质量的关键位点,同一班组中每个时间点取2个样本。因此,本次取样共获得单个时间点的平行样本8个,4个时间点共32个样本。酒醅样品的采集方法采用三点取样法后混匀,具体参照SONG等方法[16]。
1.1.2 大曲及环境样品的采集
为了分析堆积发酵酒醅中微生物的来源,本研究采集了大曲(生产用曲粉)及厂区的环境样品(原料、工具、室内地面、室外地面等)。其中,大曲样品为生产用曲,从曲粉袋中随机取200~500 g作为一个样品,放入无菌自封袋中。原料采集高粱样品200~500 g。环境样品采集均为发酵操作前,用0.1 mol/L PBS缓冲液浸湿的无菌棉擦拭地面及工具表面,取样方法为随机选取6个取样点,之后混合成一个样品,将样品放入无菌自封袋中。以上每类样品各取3份作为平行,并保存于-80 ℃备用。
1.2 基因组提取
基因组提取采用间接提取法,首先通过0.1 mol/L PBS缓冲液(pH=7.3)重复洗涤大曲、酒醅及环境样品并收集菌体。DNA提取方法参照SONG等方法[16]。
1.3 Illumina Miseq高通量测序
通过真菌内转录间隔区(ITS) ITS2区研究真菌种群结构,以ITS3 (5′-GCATCGATGAAGAACGCAGC-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)[17]为引物对酒醅的基因组进行扩增。扩增产物回收、定量后按照所需数据深度进行文库制备,然后在Illumina Miseq平台上进行2×250 bp双端测序。测序由北京奥维森基因测序公司完成。
1.4 高通量数据分析
数据下机后,通过Qiime(v1.8.0)进行原始数据处理[18]。根据序列重叠区域序列拼接,根据Barcode将不同样品序列进行归类。去除序列中接头、标签及引物序列,通过split分析去除低质量序列(长度<150 bp、含有模糊碱基N、序列质量得分
1.5 微生物溯源分析
利用Qime中的SourceTracker(v0.9.8)[20]软件对堆积发酵酒醅中的微生物菌群来源进行预测。将A、B、C和D 4个班组的堆积发酵酒醅样品(H0)设置为被溯源对象。以原料、大曲和环境样品(空气、室内地面和室外地面样品等)设置为微生物来源。
2 结果与分析
2.1 酱香型白酒堆积酒醅的真菌群落多样性
通过基于Miseq平台的高通量测序技术对酱香型白酒发酵过程中的真菌群落结构进行分析,共检测32个酒醅样品。稀释曲线分析表明所有样品真菌ITS基因测序都达到或接近平台期(图1)。此外,各样本测序覆盖率均在0.99以上,说明本次测序可覆盖样本中绝大多数真菌的微生物种群信息,测序深度适合。
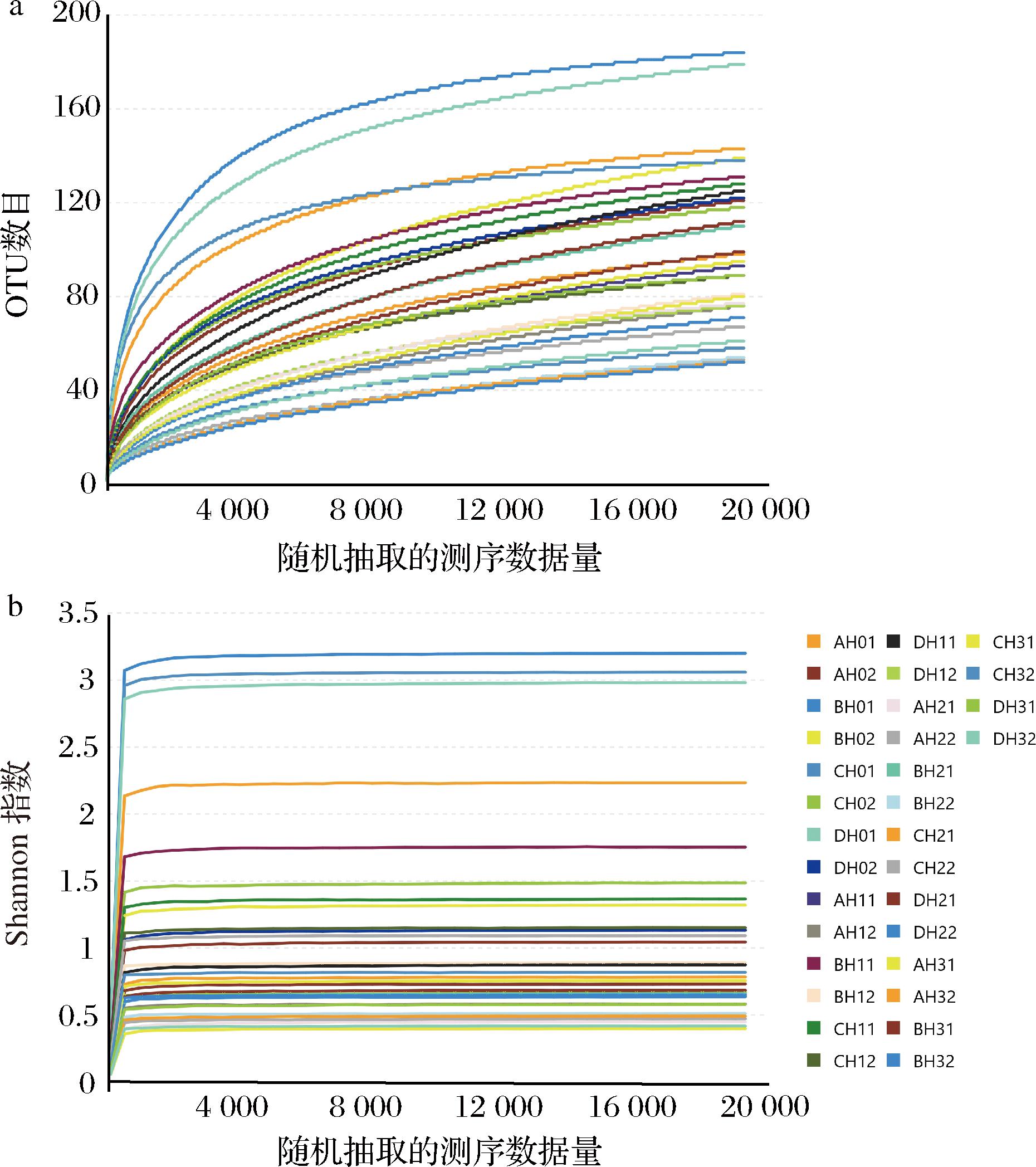
a-酒醅样品的稀释性曲线;b-酒醅样品的Shannon-Wiener曲线
图1 不同发酵时间样品稀释曲线
Fig.1 Rarefaction curve of samples taken from different fermentation time
注:A、B、C、D字母代表4个不同的班组;H0、H1、H2和H3代表堆积过程中0、1、2、3 d的酒醅样品。
基于真菌的Shannon指数和Observed species指数,分析酒醅样品中真菌群落的α多样性,以评价不同时间序列下发酵样品中真菌的物种丰富度变化。堆积发酵起始,大曲和环境来源的微生物共同接种于蒸煮过的酒醅中,导致堆积起始酒醅样品中微生物多样性较高(Shannon指数最高为3.6),堆积1 d多样性指数显著下降,至堆积结束时达到最低点(0.49~0.69)。真菌的Observed species指数同样表现出相同的显著下降趋势。以上结果表明,基于Shannon指数和Observed species指数的时间序列分析均表明堆积酒醅中的真菌多样性呈显著下降的趋势(图2)。此外,堆积起始各酒醅样品中不仅多样性高且差异较大,经过堆积过程的筛选作用,堆积终点时各样品多样性差异变小并趋于一致,这表明堆积过程对真菌的强烈、快速和稳定的选择作用。堆积发酵过程中微生物多样性降低可能与酒醅中微生物的生物热及醇、酸代谢物的积累等环境抑制有关[21]。以上结果表明,堆积过程中的环境微生态的选择作用对于发酵系统功能微生物群落构建及发酵群落稳定性具有重要作用。

a-堆积酒醅中真菌Shannon指数的变化趋势;b-堆积酒醅中真菌Observed species指数的变化趋势
图2 堆积过程中真菌群落多样性指数变化
Fig.2 The fungal diversity of samples taken from different fermentation time
2.2 酱香型白酒堆积发酵相关真菌群落结构分析
2.2.1 酱香型白酒堆积酒醅的优势真菌及演替规律
为探究导致真菌群落多样性随时间序列变化的微生物原因,进一步分析了堆积过程中微生物结构的演替规律。由图3可知,堆积过程中的优势真菌属(平均相对丰度>1%)有毕赤酵母属(Pichia,平均相对丰度82.75%)、酿酒酵母属(Saccharomyces,5.75%)、嗜热子囊菌(Thermoascus,2.75%)、曲霉属(Aspergillus,2.25%)和红曲霉属(Monascus,1.12%)等。毕赤酵母是酒类发酵过程中常见的非酿酒微生物,具有产酯的作用,对白酒的风味有重要贡献[22]。酿酒酵母是十分重要的乙醇产生工业微生物,直接关系到其发酵酒精的产量多少和质量的好坏。堆积过程中毕赤酵母和酿酒酵母的比例持续增加,堆积结束时毕赤酵母占据绝对优势(86.95%~94.98%)。以上结果暗示了非酿酒酵母对酱香型白酒造沙轮次的发酵群落构建起到重要作用[23]。此外,4个班组微生物演替的总体趋势一致,但仍存在明显差异(图3)。推测这可能是由于酱香型白酒目前仍然采用传统的酿造方式,各班组的工艺参数控制主要依靠工人师傅的生产经验,这也导致堆积酒醅理化指标的差异;这种由工艺参数控制引起的环境压力差异也会对堆积过程中不同来源的微生物筛选产生差异。因此,即使在酱香型白酒生产的核心产区,仍然出现酿造微生物的差异及发酵质量的波动。

图3 堆积过程中真菌群落结构及演替
Fig.3 Structure and succession of fungal community during heap fermentation
尽管堆积发酵过程中霉菌比例较低,但多样化的霉菌能够产生木聚糖酶、淀粉酶、蛋白酶及酯化酶等酶类[24],是酿酒生产前期降解发酵原料中淀粉等大分子物质的主要动力[25]。除此之外,霉菌生长代谢过程中还产生一些呈香物质,对产酒具有积极的贡献。但本研究中酵母菌的多样性低于与WU等[21]报道的关于酱香型白酒酵母菌多样性。推测产生这种差异的原因可能是本研究为酱香型白酒的造沙轮次,取样季节为冬季,较低的温度导致参与发酵的微生物种群多样性较低,也说明不同季节的环境微生物对酒醅中真菌种群结构都有较大影响[26]。基于酱香型白酒多轮次的发酵工艺,不同轮次的环境微生物群落特征还有待进一步解析,环境微生物如何影响不同轮次发酵质量也有待进一步研究。
2.2.2 酱香型白酒生产用大曲和环境真菌群落的结构分析
由环境样品的聚类图(图4)可知,大曲、室内环境(室内走廊、堆积地面、工具和窖池地面等)与室外环境(室外地面和车间窗台等)的真菌微生物群落分布具有明显的差异。其中,嗜热子囊菌属(Thermomyces)、嗜热丝孢菌属(Thermoascus)和曲霉菌属(Aspergillus)在大曲中占主导地位;而毕赤酵母(Pichia,<1%)和酿酒酵母(Saccharomyces,<0.1%)的相对丰度非常低,平均丰度均小于1%,属于稀有微生物种类。相比之下,毕赤酵母以工具表面和室内地面为主,其次是假丝酵母属(Candida)、有孢圆酵母属(Torulaspora)和威克汉姆酵母属(Wickerhamomyces)。从微生物分布来看,发酵相关真菌在不同环境中的分布更广泛和普遍,工人的微生物主要是假丝酵母属(Candida)和毕赤酵母属(Pichia);堆积地面和工具中含有较多的发酵相关的酵母类微生物,可能是环境影响发酵过程的关键类群。未鉴定的微生物和其他非发酵微生物在空气和室外地面样品的丰度更高。以上结果表明,环境样品中微生物的相对丰度存在较大的差异,进一步体现了发酵环境的复杂性和多变性。

图4 大曲及环境微生物真菌的相对丰度
Fig.4 Relative abundance of fungal community in Daqu and environment
2.3 酱香型白酒堆积酒醅、大曲及环境样品的真菌群落比较
2.3.1 酱香型白酒生产用大曲中显著富集的真菌微生物
进一步分析酱香型白酒堆积酒醅、大曲和环境样品中的真菌结构。图5-a展示了与环境样品相比,在大曲中显著富集的真菌微生物(大曲OTUs)。如图5所示,大曲中显著富集了70种真菌OTU(紫色圆圈),占优势的OTU归属于扣囊复膜孢酵母(Saccharomycopsis fibuligera)、紫色红曲霉(Monascus purpureus)、伯顿丝孢毕赤氏酵母(Hyphopichia burtonii)、丝毛红曲菌(Monascus pilosus)和Rasamsonia composticola等,表明大曲对这些微生物群落高度的选择。进一步计算了大曲中显著富集的OTU总相对丰度,结果揭示了这些微生物在堆积酒醅、大曲和环境样品的显著差异,大曲中显著富集的微生物在酒醅、环境和大曲中的平均相对丰度分别为3.10%、3.90%和44.19%(图5-b)。最后,解析了大曲中显著富集微生物的属水平分类信息(图5-c),结果表明大曲中显著富集的微生物包括扣囊复膜孢酵母属(Saccharomycopsis)、红曲霉属(Monascus)、嗜热子囊菌属(Thermoascus)以及曲霉属(Aspergillus)等。

a-堆积酒醅、大曲及环境样品中真菌OTU的三相图比较;b-在大曲及酒醅中显著富集的OTU的相对丰度;c-酒醅中显著富集的真菌OTU的属水平分类
图5 基于OTU水平的酒醅、大曲和环境样品的真菌结构比较
Fig.5 Enrichment of OTUs in heap fermented grains, Daqu, and environment
注:三相图中每个圆圈代表一个真菌OTU(平均出现频率>1);圆的大小代表相对丰度,位置代表相对于每种类型的相对丰度;紫色圆圈标记明在大曲中显著富集的OTU(P<0.05),绿色圆圈标记在堆积酒醅中显著富集的OTU(P<0.05),青色圆圈标记同时在两者中显著富集的OTU,灰色圆圈标记无显著差异。
2.3.2 酱香型白酒堆积酒醅中显著富集的真菌微生物
堆积发酵的酒醅同时从大曲和环境中富集真菌微生物。图5-a展示了堆积酒醅从环境和大曲中显著富集的真菌微生物共16种。这些显著富集的优势OUT归属为库德毕赤酵母(Pichia kudriavzevii)、酿酒酵母(Saccharomyces cerevisiae)、酿酒酵母/奇异酵母(Saccharomyces CF.cerevisiae/Paradoxus)和嗜热子囊菌(Thermoascus crustaceus)等。通过计算这些OTU的总相对丰度,发现他们在各类样品中的分布为大曲中9.05%,环境中14.43%,堆积酒醅中85.06%(图5-b)。进一步分析酒醅中显著富集的真菌OTU的属水平分类信息(图5-c),结果表明,这些微生物主要属于酵母类的微生物如毕赤酵母和酿酒酵母等,并且这些微生物在环境中的比例远远大于在大曲中的比例。以上结果表明酵母类的微生物主要通过环境自然接种并参与发酵过程,表明环境在酱香型白酒的固态发酵过程中起重要作用。
2.4 酱香型白酒堆积发酵酒醅微生物的溯源分析
使用贝叶斯概率工具SourceTracker [20]来计算发酵酒醅中的微生物的来源和比例。由图6可知,不同班组的堆积起始的酒醅中真菌微生物具有相似的来源,主要包括大曲(平均贡献比例33.14%)、堆积地面(平均贡献比例37.49%)和工具(平均贡献比例29.22%)等。但不同车间之间微生物来源的比例略有差异:大曲微生物对发酵酒醅的贡献比例为15%~47%,堆积地面贡献比例为27%~43%,而工具贡献比例为15%~41%。其他的环境类别包括室内地面、封窖泥、室外环境、原料、工人和空气等对堆积起始酒醅微生物结构的影响较小。
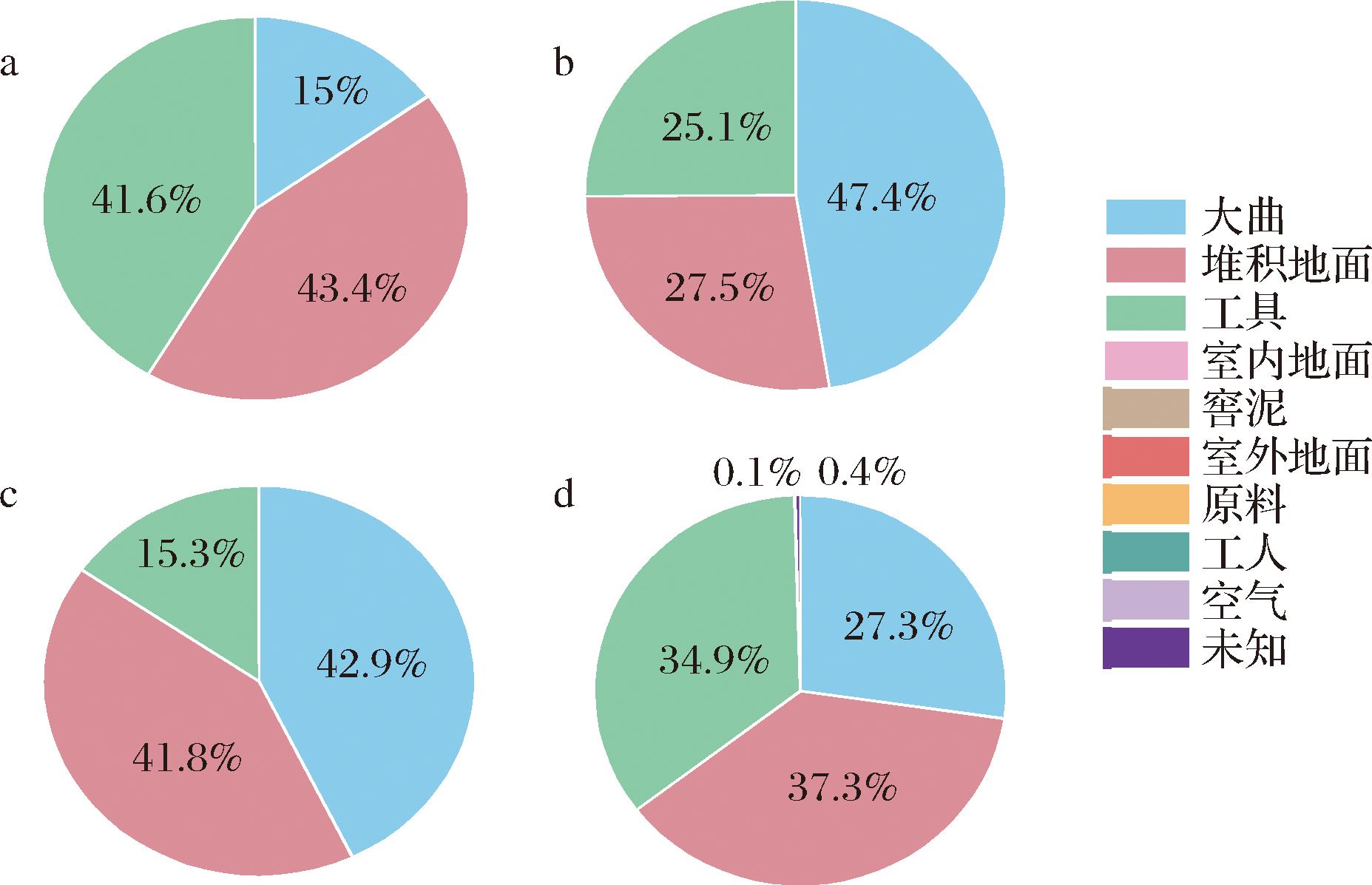
a-班组A堆积酒醅真菌群落的溯源分析;b-班组B堆积酒醅真菌群落的溯源分析;c-班组C堆积酒醅真菌群落的溯源分析;d-班组D堆积酒醅真菌群落的溯源分析
图6 酱香型白酒堆积酒醅真菌微生物的溯源分析
Fig.6 SourceTracker results of fungal communities in heap fermented grains
SourceTracker软件还预测了堆积发酵酒醅中功能真菌的来源(图7),其中堆积发酵酒醅中最丰富的酵母属最常见来源是堆积地面和工具。堆积发酵过程中富集了较多的毕赤酵母。Pichia kudriavzevii主要由堆积地面(18.6%~33.0%)和工具(9%~35%)共同贡献,贡献比例远大于大曲(2.5%~6.5%)。Saccharomyces cerevisiae主要来自于堆积地面(3%~6.6%)和工具(0.06%~3.5%)。作为非酿酒酵母,毕赤酵母已被证明对酱香型白酒微生物态的塑造具有重要的意义。本研究进一步揭示了酱香型白酒核心产区环境微生物对优质酱香型白酒发酵的独特贡献。
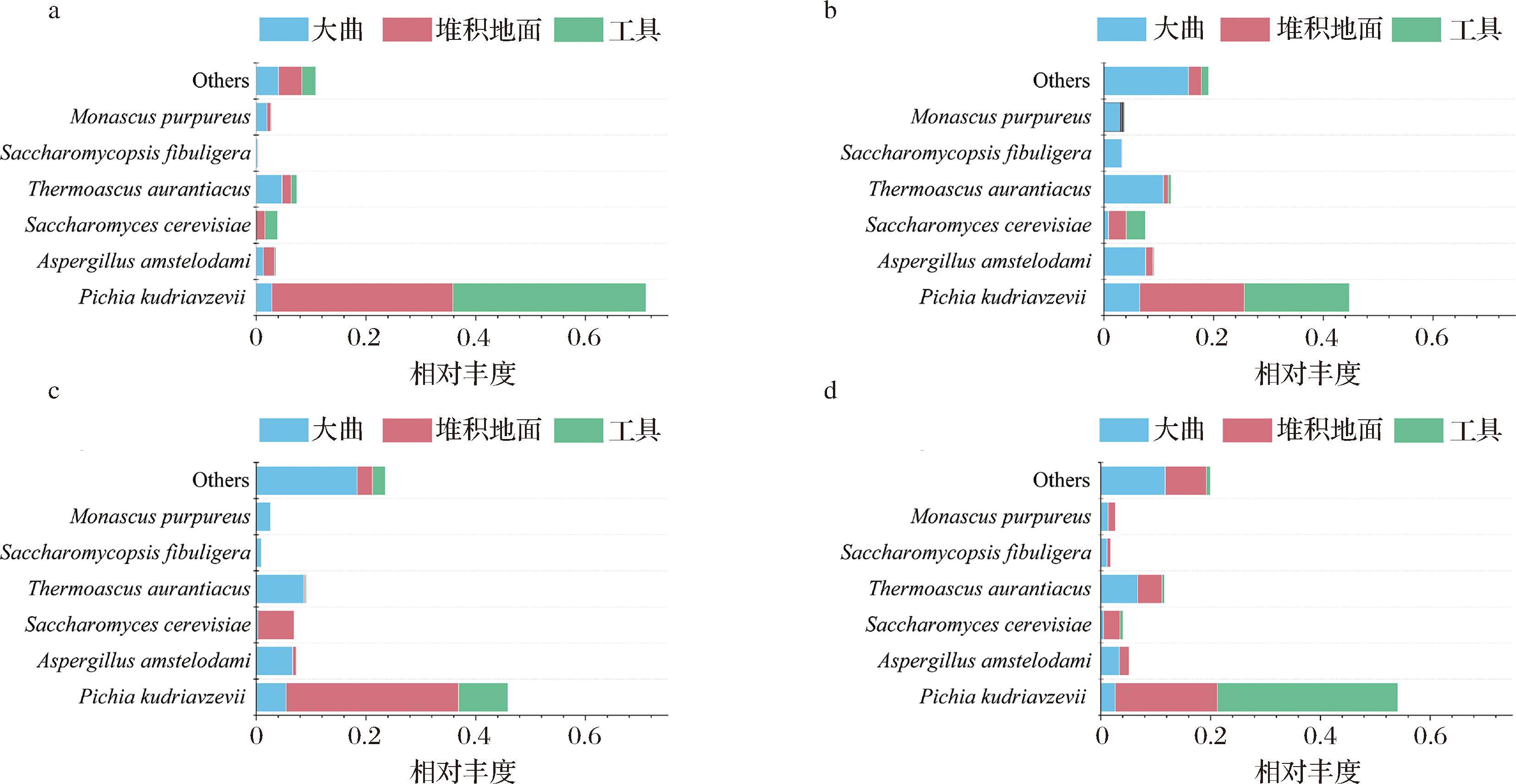
a-班组A堆积酒醅主要真菌的来源及比例;b-班组B堆积酒醅主要真菌的来源及比例;c-班组C堆积酒醅主要真菌的来源及比例;d-班组D堆积酒醅主要真菌的来源及比例
图7 基于SourceTracker软件的真菌来源分析
Fig.7 Analysis of fungal sources based on SourceTracker
除了酿造环境的接种作用,大曲是堆积酒醅中功能微生物的另一个重要来源。大曲对堆积酒醅主要贡献了嗜热子囊菌(Thermoascus aurantiacus、5%~10%)和阿姆斯特丹曲霉(Aspergillus amstelodami)。这些微生物可能对于堆积过程的糖化发酵起到重要作用,表明大曲贡献了堆积初始糖化的主要功能菌群。
3 结论
本研究利用高通量测序技术分析了造沙轮次堆积发酵过程中真菌群落的演替规律。造沙轮次堆积发酵结束时,毕赤酵母属是绝对优势微生物,毕赤酵母的结构比例较为稳定,可达86.95%~94.98%,这些结果可能暗示毕赤酵母在维持发酵酒醅群落稳定性方面起重要作用。
由于酱香型白酒发酵采用开放式生产,研究发酵过程中微生物来源、分布对堆积发酵及窖内发酵的顺利进行具有重要的价值。本研究针对堆积发酵的酒醅微生物种群结构,与大曲及环境微生物的比较,发现大曲为堆积发酵提供霉菌类微生物,是白酒发酵糖化力的重要来源;而堆积地面则提供较多的酵母类微生物,是白酒发酵力的重要来源。酱香型白酒的堆积发酵通过筛选大曲和环境微生物,为边糖化边发酵提供了必要的微生物基础。该研究为理性管理和调控酱香型白酒工业发酵微生态提供了理论指导。
[1] WU S L, DU H, XU Y.Daqu microbiota adaptability to altered temperature determines the formation of characteristic compounds[J].International Journal of Food Microbiology, 2023, 385:109995.
[2] WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology, 2018, 84(4):e02369-e02317.
[3] BOKULICH N A, OHTA M, LEE M, et al.Indigenous bacteria and fungi drive traditional Kimoto sake fermentations[J].Applied and Environmental Microbiology, 2014, 80(17):5522-5529.
[4] BOKULICH N A, MILLS D A.Facility-specific “house” microbiome drives microbial landscapes of artisan cheesemaking plants[J].Applied and Environmental Microbiology, 2013, 79(17):5214-5223.
[5] ZHANG J, DU R B, NIU J, et al.Daqu and environmental microbiota regulate fatty acid biosynthesis via driving the core microbiota in soy sauce aroma type liquor fermentation[J].International Journal of Food Microbiology, 2024, 408:110423.
[6] BOKULICH N A, LEWIS Z T, BOUNDY-MILLS K, et al.A new perspective on microbial landscapes within food production[J].Current Opinion in Biotechnology, 2016, 37:182-189.
[7] TAN Y W, DU H, ZHANG H X, et al.Geographically associated fungus-bacterium interactions contribute to the formation of geography-dependent flavor during high-complexity spontaneous fermentation[J].Microbiology Spectrum, 2022, 10(5):e0184422.
[8] JIN G Y, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science and Technology, 2017, 63:18-28.
[9] ZHANG H X, TAN Y W, WEI J L, et al.Fungal interactions strengthen the diversity-functioning relationship of solid-state fermentation systems[J].mSystems, 2022, 7(4):e0040122.[10] ZHANG H X, WANG L, WANG H Y, et al.Effects of initial temperature on microbial community succession rate and volatile flavors during Baijiu fermentation process[J].Food Research International, 2021, 141:109887.
[11] 尚柯. 酱香型白酒高温堆积工艺机理的初步研究 [D].乌鲁木齐:新疆农业大学, 2016.SHANG K.The study on the Moutai-flavor liquor high-temperature stacking process[D].Urumqi:Xinjiang Agricultural University, 2016.
[12] 周恒刚. 酱香型白酒生产工艺的堆积[J].酿酒科技, 1999, (1):5-7.ZHOU H G.The piling fermentation in the production technology of Maotai-flavour liquor[J].Liquor-Making Science &Technology, 1999, (1):5-7.
[13] 唐玉明, 任道群, 姚万春, 等.酱香型酒糟醅堆积过程温度和微生物区系变化及其规律性[J].酿酒科技, 2007(5):54-58.TANG Y M, REN D Q, YAO W C, et al.The change rules of temeprature and microflora during the stacking of Maotai-flavor fermenting grains[J].Liquor-Making Science &Technology, 2007(5):54-58.
[14] 王贵军, 沈才洪, 张洪远, 等.酱香型白酒糟醅堆积与窖内发酵工艺研究[J].酿酒科技, 2011 (5):36-37;41.WANG G J, SHEN C H, ZHANG H Y, et al.Investigation on accumulation &in-pit fermentation of distiller′s grains of Maotai-flavor liquor[J].Liquor-Making Science &Technology, 2011 (5):36-37;41.
[15] WU Q, CHEN B, XU Y.Regulating yeast flavor metabolism by controlling saccharification reaction rate in simultaneous saccharification and fermentation of Chinese Maotai-flavor liquor[J].International Journal of Food Microbiology, 2015, 200:39-46.
[16] SONG Z W, DU H, ZHANG Y, et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Frontiers in Microbiology, 2017, 8:1294.
[17] BJØRNSGAARD AAS A, DAVEY M L, KAUSERUD H.ITS all right Mama:Investigating the formation of chimeric sequences in the ITS2 region by DNA metabarcoding analyses of fungal mock communities of different complexities[J].Molecular Ecology Resources, 2017, 17(4):730-741.
[18] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336.
[19] SCHLOSS P D, GEVERS D, WESTCOTT S L.Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies[J].PLoS One, 2011, 6(12):e27310.
[20] KNIGHTS D, KUCZYNSKI J, CHARLSON E S, et al.Bayesian community-wide culture-independent microbial source tracking[J].Nature Methods, 2011, 8(9):761-763.
[21] WU Q, CHEN L Q, XU Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J].International Journal of Food Microbiology, 2013, 166(2):323-330.
[22] 唐洁, 王海燕, 徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报, 2012, 39(7):921-930.TANG J, WANG H Y, XU Y.Effect of mixed culture of Saccharomyces cerevisiae and Pichia anomala on fermentation efficiency and flavor compounds in Chinese Liquor[J].Microbiology China, 2012, 39(7):921-930.
[23] ZHANG H X, WANG L, TAN Y W, et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J].International Journal of Food Microbiology, 2021, 336:108898.
[24] 班世栋, 王晓丹, 陈孟强, 等.酱香型大曲中具产酶功能霉菌的分离筛选[J].酿酒, 2014, 41(4):31-36.BAN S D, WANG X D, CHEN M Q, et al.Screening and isolation of functional mold producing enzyme in Maotai-flavor Daqu[J].Liquor Making, 2014, 41(4):31-36.
[25] 徐佳, 邱树毅, 胡宝东, 等.酱香型白酒酿造过程中霉菌的功能性研究[J].酿酒, 2015, 42(5):32-38.XU J, QIU S Y, HU B D, et al.Research on functions of the mold in Maotai-flavor liquor brewing[J].Liquor Making, 2015, 42(5):32-38.
[26] PANG X N, HAN B Z, HUANG X N, et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Scientific Reports, 2018, 8(1):3396.