益生菌指活的微生物,当摄取足够数量时,对宿主健康有益[1]。研究表明益生菌具有多种有益的生理功能,能预防及治疗多种疾病,包括消化道、精神、心血管及代谢相关的多种疾病[2-5]。目前市售益生菌制剂类型包括粉剂(固体饮料)、硬胶囊、软胶囊、颗粒、微胶囊等,主要以粉剂和颗粒剂为主,产品中所含微生物的种类和数量均不相同。2019年,国家市场监督管理总局发布了《益生菌类保健食品申报与审评规定(征求意见稿)》,规定益生菌类保健食品在其保质期内每种菌的活菌数目不得少于106 CFU/mL(g)。国际上益生菌的推荐摄入量主要在107~1011 CFU/d[6]。益生菌类产品的生产加工及运输过程中的温度、湿度、氧气等不良因素,以及食用后宿主的消化环境等,都对其活性具有破坏甚至灭活作用,从而影响其益生行为[7-10]。同时,受进食状态以及食物的性质和总量等多种因素的影响,不同的消化环境对菌株的作用效果不同[11-15]。AZIZ等[16]对20种市售益生菌产品进行模拟消化实验,结果只有4种产品具有耐受性,且活菌数显著降低,剩余产品均无活菌检出。AZHAR等[17]对10种不同剂型的商业益生菌产品进行活性和胃酸体外耐受性测定,结果表明所有产品的活菌总数均高于107 CFU/mL(g),6种产品显示出比标签更高的活菌数量,其中4种产品能耐受胃部较低的pH环境。2001年,FAO/WHO联合工作组制定的《食品益生菌评价指南》将胃酸及胆汁酸耐受性作为益生菌体外筛选以及安全性评价的必需实验[1]。2020年,中国食品科学技术学会发布了《益生菌的科学共识(2020年版)》,明确了益生菌的3个核心特征,即:足够数量、活菌状态及有益健康功能[18]。因此,在选择益生菌产品时,除了健康功效,还需要考虑是否有足够数量的活菌到达肠道。
本研究以15种不同益生菌剂产品为研究对象,首先采用流式细胞术检测了15种产品的总菌及活菌含量;然后选择5种产品研究模拟胃消化过程中不同生理因素对菌株活性的影响;最后对其余10种产品进行模拟胃消化耐受性的检测。研究旨在了解市面益生菌产品的质量水平,为品质分析提供参考,同时为益生菌消化道耐受性的标准化评价提供理论基础。
1 材料与方法
1.1 材料与试剂
15种益生菌产品均购自在线平台,均为粉剂或颗粒剂,属于食品范畴,具体信息见表1,所有产品在检测前均贮存于4 ℃。为避免不必要的纠纷,15种产品用字母SA~SO表示。
表1 产品信息
Table 1 Products information

样品编号菌种包装克数/g标签活菌含量/(CFU/包)SA2种乳杆菌属+1种双歧杆菌属1.01.50×1010SB2种乳杆菌属+1种双歧杆菌属1.21.00×1010SC9种乳杆菌属+5种双歧杆菌属+1种嗜热链球菌属1.03.20×1010SD16种乳杆菌属+4种双歧杆菌属2.01.50×1010SE9种乳杆菌属+7种双歧杆菌属+1种嗜热链球菌属2.06.00×1010SF1种乳杆菌属+1种双歧杆菌属2.03.00×1010SG1种乳杆菌属+1种双歧杆菌属1.52.25×108SH2种乳杆菌属+1种双歧杆菌属2.02.20×1010SI2种乳杆菌属+1种双歧杆菌属2.03.80×1010SJ5种乳杆菌属+4种双歧杆菌属+1种嗜热链球菌属2.04.00×1010SK1种乳杆菌属+1种双歧杆菌属3.06.00×109SL8种乳杆菌属+3种双歧杆菌属3.06.00×1010SM2种乳杆菌属+2种双歧杆菌属2.03.00×1010SN9种乳杆菌属+6种双歧杆菌属+1种嗜热链球菌属2.03.00×1010SO9种乳杆菌属+7种双歧杆菌属+1种嗜热链球菌属1.03.20×1010
胃蛋白酶,上海源叶生物科技有限公司;MRS琼脂培养基、2.5 L/3.5 L厌氧产气包、厌氧指示剂,青岛海博生物技术有限公司;SYTO 9绿色核酸染料,美国Thermo Fisher Scientific公司;碘化丙啶(propidium iodide,PI)染料,北京博奥森生物科技有限公司。
1.2 仪器与设备
NV422ZH型电子天平,奥豪斯仪器有限公司;SN510C型立式压力蒸汽灭菌器、IC612C型高温恒温培养箱,重庆雅马拓生物有限公司;LSHW-500型立式恒温培养振荡器,北京亚泰科隆仪器技术有限公司;PHB-5型便携式pH计,上海仪电科学仪器股份有限公司;Class BSCⅡ型生物安全柜,太仓艺斯高医疗器械科技有限公司;BD Accuri C6型流式细胞仪,美国BD公司。
1.3 实验方法
1.3.1 样品预处理及活菌计数
取1条市售益生菌剂样品溶于0.85%(质量分数)的生理盐水并定容至100 mL,均质器10 次/秒拍打2 min,测量样品菌液pH值。
活菌计数方法依据GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》中乳杆菌、双歧杆菌和嗜热链球菌的计数方法,存活率的计算如公式(1)所示:
存活率![]()
(1)
式中:Ni为消化i h后的活菌数;N0为初始活菌数,即0 h的活菌数。
1.3.2 样品总菌及活菌含量测定
样品总菌及活菌含量的测定方法参照ISO 19344:2015《Milk and milk products-Starter cultures, probiotics and fermented products-Quantification of lactic acid bacteria by flow cytometry》及SN/T5436—2022《乳及乳制品发酵剂、发酵产品中乳酸菌计数 流式细胞仪法》进行,具体操作如下:将样品菌液浓度稀释到106~108 CFU/mL,取100 μL样品菌液用880 μL无菌PBS缓冲液稀释,加入10 μL SYTO 9和10 μL PI双染,混匀后37 ℃避光反应15 min;未染色的样品作为阴性对照,只加入10 μL SYTO 9或10 μL PI单染的样品作为单阳对照。FL1通道收集SYTO 9的绿色荧光,FL3通道收集PI的红色荧光,读取结果进行总菌及活菌含量的定量分析。
1.3.3 益生菌剂体外模拟胃消化
1.3.3.1 体外模拟胃液的配制
首先按照BRODKORB等[19]的方法配制模拟胃电解质溶液,配方见表2:分别配制电解质溶液A(pH 3.0)和B,121 ℃高压灭菌15~20 min。
表2 模拟胃电解质溶液组成 单位:g/L Table 2 Composition of simulated gastric electrolyte solution
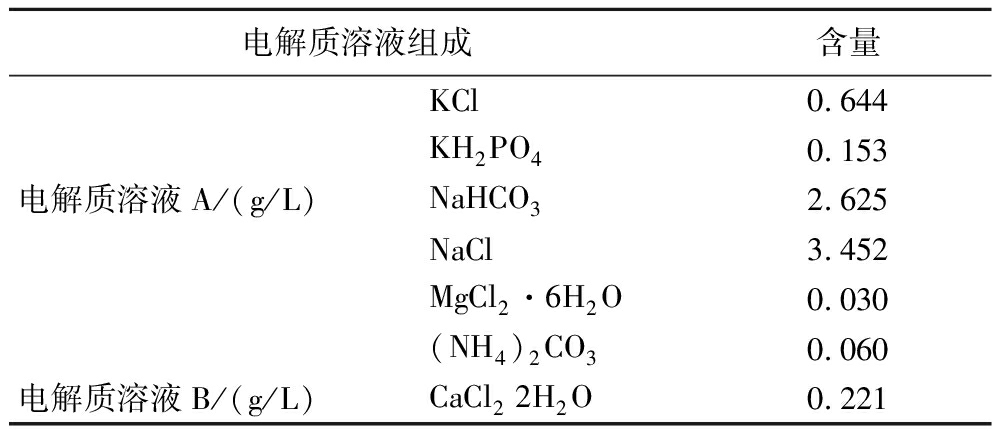
电解质溶液组成含量KCl0.644KH2PO40.153电解质溶液A/(g/L)NaHCO32.625NaCl3.452MgCl2·6H2O0.030(NH4)2CO30.060电解质溶液B/(g/L)CaCl2 2H2O0.221
将80 mL电解质溶液A和10 mL电解质溶液B混合,加入1.5 g胃蛋白酶,调节pH至相应的数值,定容到100 mL,过滤除菌,现配现用。
1.3.3.2 益生菌剂对不同模拟胃液pH值的耐受性
样品菌液(SA~SE)与不同pH值(2.0、2.5或3.0)的模拟胃液等体积(1∶1)混匀后测量混合液的pH值,37 ℃振荡培养(100 r/min),分别于0、1、2、3、4 h取样计算活菌数及存活率。
1.3.3.3 益生菌剂对不同胃蛋白酶浓度模拟胃液的耐受性
胃蛋白酶的酶活性测定参照BRODKORB等[19]的方法,计算如公式(2)所示:
胃蛋白酶活性![]()
(2)
式中:Δt为反应时间,10 min;X为胃蛋白酶粉末在最终反应体系(石英比色皿)中的质量浓度,mg/mL。
样品菌液(SA~SE)分别和添加或不添加胃蛋白酶的模拟胃液(pH 3.0)等体积(1∶1)混匀,37 ℃振荡培养(100 r/min),分别于0、1、2 h取样计算活菌数及存活率。
1.3.3.4 益生菌剂对不同模拟消化转速耐受性
样品菌液(SA~SE)与模拟胃液等体积混匀,37 ℃摇床振荡培养(100 r/min)或静置培养,分别于0、1、2 h取样计算活菌数及存活率。
1.3.3.5 益生菌剂对模拟胃消化耐受性
样品菌液(SF~SO)和不同pH值(2.0,3.0)的模拟胃液等体积混匀后测量混合液pH值,37 ℃摇床振荡培养(100 r/min),分别于0、1、2 h取样计算活菌数及存活率。
1.4 数据分析
采用SPSS软件分析实验数据。Origin软件作图,分析数据以“mean±SD”表示,实验均重复3次。
2 结果与分析
2.1 益生菌剂产品的活性检测
活菌数量不仅是益生菌发挥健康作用的前提,也是评价厂家生产能力、产品质量和抗逆性的关键指标。流式细胞术结合荧光标记是一种快速的单细胞定向多参数评估技术,既可以从样品中识别和计数微生物群体,也可以表征单个细胞的生理功能特性,实现了微生物实时定性和定量分析。因此,为了评估益生菌产品的质量,采用流式细胞技术对15种样品的总菌和活菌含量进行了快速定量分析,结果如图1所示。根据产品包装信息,13种样品标识菌种添加量高于1010 CFU/包,1种样品(SK)高于109 CFU/包,1种样品(SG)高于108 CFU/包。实验结果表明,15种样品总菌含量均高于109 CFU/包,但与标识存在差异,14种样品(除SD外)总菌含量均高于标识含量。在实际生产过程中,厂家为保证产品的活菌含量在保质期内符合其标注值,通常会添加超过标识含量的益生菌,实验结果与实际生产情况具有一致性。
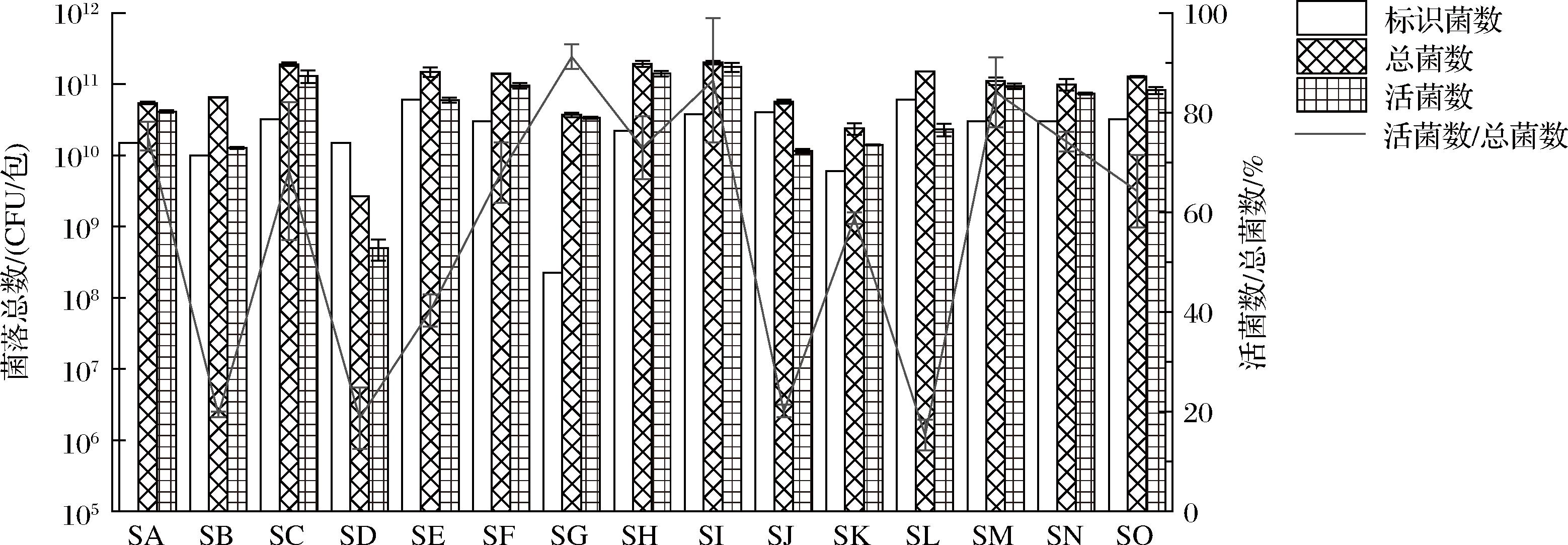
图1 十五种样品的包装标识菌数、总菌数、活菌数及活菌数占比
Fig.1 The number of labeled, total, viable bacteria and viability ratio in 15 samples
15种样品活菌含量均满足国家标准[≥106 CFU/mL(g)],其中3种样品(SC、SH、SI)活菌含量高于1011 CFU/包,11种样品活菌含量高于1010 CFU/包,1种样品(SD)高于108 CFU/包。但样品活菌数与标识存在差异,11种样品活菌含量高于其标识值,4种样品(SD、SE、SJ、SL)低于标识值。同时,15种样品的活菌占比为15.30%~91.18%,样品菌株活性明显降低且存在样品差异性,可以看出,益生菌类产品在制作、运输及贮存过程对菌株的活性有明显的损伤作用,同时生产厂家技术水平的高低导致了其产品菌株抵抗不良环境性能的差异性。
2.2 体外模拟胃消化
2.2.1 模拟胃液pH值对益生菌剂活性的影响
胃酸耐受性是益生菌体外筛选以及安全性评价的必需实验。人体禁食状态下胃部pH值为1.0~2.0;进食后,pH值上升到3.0~5.0,最高可达到pH 7.0[20-21]。如图2-a所示,样品SA、SC、SD原始菌液的pH值约为中性,样品SB、SE的pH值偏酸性;原始菌液与模拟胃液混合后,混合液的pH值随着模拟胃液pH值的降低而降低,且混合液与原始菌液变化趋势一致,可以看出原始菌液的pH值直接影响混合液的pH值。

a-菌液与模拟胃液混合后pH值;b-SA;c-SB;d-SC;e-SD;f-SE
图2 五种样品对不同pH值模拟胃液的耐受性
Fig.2 Tolerance of five samples to simulated gastric juice with different pH values
为探究pH值对益生菌剂活性的影响,5种样品在不同pH值的模拟胃液中消化4 h后的存活率及活菌总数如图2-b~图2-f所示。5种样品初始活菌总数约为108~1011 CFU/包,样品与pH 3.0的模拟胃液混合后,混合液pH值为3.45~4.54;模拟消化后,样品的存活率为38.90%~90.16%,活菌总数为108~1010 CFU/包,活菌总数下降值均小于1 lg CFU/包,保持在较高水平。样品与pH 2.5的模拟胃液混合后,混合液pH为3.04~3.94;模拟消化后,存活率为1.60%~90.51%,活菌总数为107~1010 CFU/包,活菌总数约下降0~2 lg CFU/包。样品与pH 2.0的模拟胃液混合后,混合液pH为2.44~2.63;模拟消化后,除样品SC和SE的存活率分别为9.52%和25.49%以外,其余3个样品的存活率均低于1%,活菌总数为104~1010 CFU/包,下降约0~5 lg CFU/包。
实验结果表明,样品的存活率随着模拟胃液pH值的降低而降低,样品模拟胃消化耐受性与混合液的pH值无明显对应关系。在pH 2.0环境下,样品活性显著降低,其中3种样品(SA、SB、SD)的存活率低于1%,活菌总数下降约2~5 lg CFU/pkg,样品中大部分菌株都失去了活性。益生菌菌株大多对低酸环境敏感,低酸会破坏其细胞结构的有序性和完整性,导致细胞内外电解质失衡,最终降解细胞中的碱性蛋白质并给细胞造成不可逆的损伤[22-24]。因此,筛选具有耐酸性的菌株并采取包埋等保护措施是益生菌类产品开发和生产过程中的重要步骤。
2.2.2 模拟胃液胃蛋白酶浓度对益生菌剂活性的影响
研究表明胃蛋白酶可能会影响益生菌的益生效果[25-26]。由于市售胃蛋白酶产品种类繁多且酶活的定义和测定方法不同,为了便于标准化的评价,本文首先参照BRODKORB等[19]的方法对购买的产品进行了酶活性测定,测得所购产品酶活性约为271.04 U/mg。为探究胃蛋白酶对益生菌剂活性的影响,5种样品与不同浓度的胃蛋白酶模拟胃液混合,模拟培养2 h后的样品存活率及活菌总数如图3所示。样品对胃蛋白酶的耐受性不同,随着胃蛋白酶浓度的升高,4种样品存活率降低5.12%~28.65%,样品SE的存活率升高5.38%,活菌总数差异均小于1 lg CFU/包,表明胃蛋白酶对益生菌菌株活性无明显损伤作用。该结果与前人研究结果一致,推测可能是消化过程中胃蛋白酶主要起分解食物蛋白质的作用,对菌株生长繁殖活性无明显影响[25]。
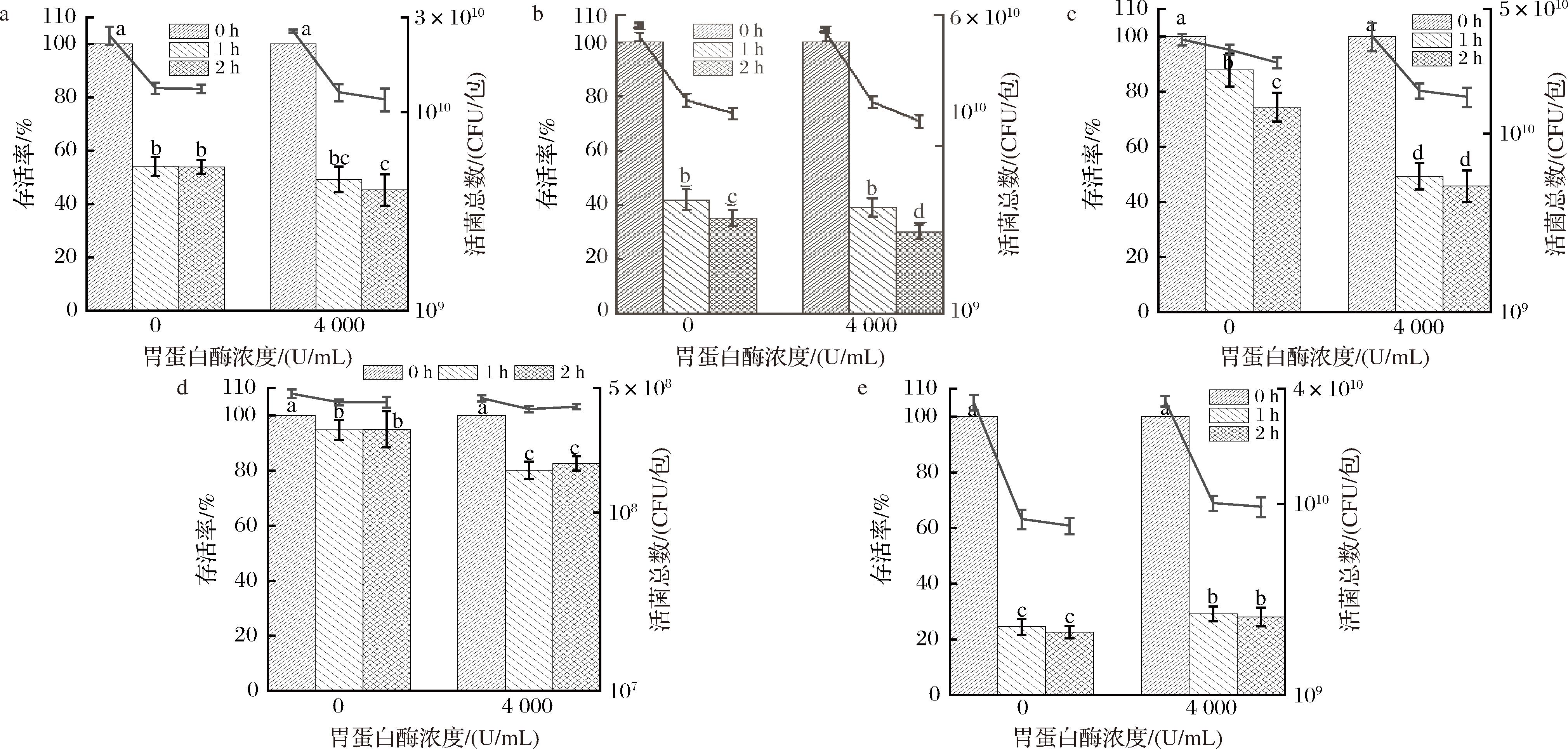
a-SA;b-SB;c-SC;d-SD;e-SE
图3 五种样品对不同胃蛋白酶浓度模拟胃液的耐受性
Fig.3 Tolerance of five samples to simulated gastric juice with different pepsin concentrations
注:不同小写字母表示显著性差异(P<0.05,n=3)(下同)。
2.2.3 模拟胃消化培养转速对益生菌剂活性的影响
为探究模拟消化转速对益生菌剂活性的影响,5种样品与模拟胃液混合,在不同转速条件下消化2 h后存活率及活菌总数如图4所示。5种样品对不同转速的耐受性不同,在高转速模拟消化培养下,样品SA、SB、SC、SD、SE存活率分别下降39.45%、1.60%、41.76%、8.80%、6.20%,活菌总数差异均小于1 lg CFU/包。该结果表明,高转速会不同程度地降低样品存活率。推测可能是高转速促进了样品与模拟胃液的充分混合,从而降低了样品存活率。由于人体消化过程中胃部存在蠕动现象,因此推荐模拟胃消化实验时摇床培养以贴近胃部消化真实环境[20]。

a-SA;b-SB;c-SC;d-SD;e-SE
图4 五种样品对不同模拟胃消化转速的耐受性
Fig.4 Tolerance of five samples to different simulated gastric digestion speeds
2.2.4 模拟胃消化对不同益生菌剂产品活性的影响
上述结果表明胃液pH值为影响益生菌剂活性的主要因素,模拟消化培养转速和胃蛋白酶浓度为次要因素。本文选择了10种样品进行相同条件的模拟胃消化实验以考察其胃消化耐受性,结果如图5所示。10种样品原始菌液pH值为5.04~7.23,产品SF、SH为弱酸性,其余产品均为中性;10种样品初始活菌总数约为108~1011 CFU/包。

a-菌液与模拟胃液混合后pH值;b-pH 2.0;c-pH 3.0
图5 十种样品模拟胃消化耐受性
Fig.5 Simulated gastric digestion tolerance of ten samples
10种样品与pH 3.0的模拟胃液混合后,混合液pH值为3.61~4.97,存活率为29.76%~96.18%,活菌总数为108~1011 CFU/包,活菌总数下降均少于1 lg CFU/包,样品SF耐受性最强,SK耐受性最弱。10种样品与pH 2.0的模拟胃液混合后,混合液pH值为2.40~3.89,存活率为0.01%~57.64%,活菌总数为105~1011 CFU/包,活菌总数下降约0~4 lg CFU/包,样品SI的耐受性最强,SK的耐受性最弱,活菌总数降至5.78 lg CFU/包。
实验结果表明,10种样品在相同模拟胃消化环境下的存活率差异较大,耐受性不同,其中样品SK的耐受性最低。造成此结果的原因可能是每种产品中添加的菌株种类和数量、辅料的种类、保护措施以及菌株辅料之间的协同效应不同,使得耐受性存在差异。同一样品对不同pH值的胃消化液耐受性不一致,高pH耐受性明显增强,因此建议饭后胃部pH值上升后服用益生菌类产品以保证其益生作用的发挥。
3 结论与讨论
人体的消化是一个动态复杂的过程,多种生理消化参数不断变化,与人群、身体状况、食物种类等多种因素相互关联,而不同的消化环境对菌株的活性影响不同[21,26-28]。人体胃液是强酸性的,对大多数益生菌菌株都有明显的损伤作用,因此本文评价了市售益生菌菌剂的初始活性及模拟胃消化耐受性,研究了模拟胃消化过程中不同生理因素对益生菌活性的影响。不同益生菌剂产品的初始活性分析表明,15种样品的活菌数量都达到发挥功效的最低菌量,但与标识数存在差异;胃液pH值为影响益生菌剂活性的主要因素,而模拟消化培养转速和胃蛋白酶浓度为次要因素;相同条件的模拟胃消化实验中,不同品牌益生菌剂产品的耐受性明显不同。
筛选具有消化道耐受性的菌株,或采用添加益生元、冷冻干燥、乳化包埋等菌体保护措施,以提高菌株对外界不良环境的抵抗能力并维持其代谢活性,是益生菌类产品开发的重要需求。由于现行法规标准不健全及市场监督管理力度不足等原因,市场上普遍存在商家过度宣传、生产操作流程混乱、产品信息标识不清及产品微生物污染等现象。益生菌的种类和数量是产品标签的关键信息,而菌株的耐受性能和益生性能是产品质量的关键特征,因此应加强市场管理力度,规范商家生产,以保障消费者权益。本研究初步探究了胃消化环境对益生菌剂活性的影响,后续需要进一步探究肠消化环境、胃肠消化环境以及不同人群进食不同的食物种类等多种因素的影响。本文通过检测益生菌剂产品的质量及胃消化过程中不同生理因素对其活性的影响,一方面能了解市场产品的质量,为消费者选择优质高效的产品提供参考;另一方面为进一步制定标准化的消化道耐受性体外评价方法提供依据,有利于完善相关法律法规及规范市场环境。
[1] 吴蜀豫, 冉陆.FAO/WHO食品益生菌评价指南[J].中国食品卫生杂志, 2003, 15(4):377-379.WU S Y, RAN L.FAO/WHO Guidelines for the evaluation of probiotics in food[J].Chinese Journal of Food Hygiene, 2003, 15(4):377-379.
[2] 阿热爱·巴合提, 武瑞赟, 肖梦圆, 等.益生菌的生理功能及作用机理研究进展[J].食品与发酵工业, 2020, 46(22):270-275.BAHATI A, WU R Y, XIAO M Y, et al.Research progress in physiological function and mechanism of probiotics[J].Food and Fermentation Industries, 2020, 46(22):270-275.
[3] CAMPANIELLO D, BEVILACQUA A, SPERANZA B, et al.A narrative review on the use of probiotics in several diseases.Evidence and perspectives[J].Frontiers in Nutrition, 2023, 10:1209238.
[4] DEMPSEY E, CORR S C.Lactobacillus spp.for gastrointestinal health:Current and future perspectives[J].Frontiers in Immunology, 2022, 13:840245.
[5] IBRAHIM S A, YEBOAH P J, AYIVI R D, et al.A review and comparative perspective on health benefits of probiotic and fermented foods[J].International Journal of Food Science &Technology, 2023, 58(10):4948-4964.
[6] 中国食品科学技术学会益生菌分会. 益生菌“量效关系”的科学综述[J].中国食品学报, 2022, 22(7):443-454.Probiotics Society of the Chinese Institute of Food Science and Technology.A scientific review of the ‘dose-response relationship’ of probiotics[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):443-454.
[7] 中国食品科学技术学会益生菌分会. 2021年我国益生菌产业发展十大焦点[J].中国食品学报, 2021, 21(5):383-388.Probiotics Society of the Chinese Institute of Food Science and Technology.Ten focuses on the development of China′s probiotic industry in 2021[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):383-388.
[8] CAPOZZI V, ARENA M P, RUSSO P, et al.Stressors and Food Environment:Toward Strategies to Improve Robustness and Stress Tolerance in Probiotics[M].Elsevier:Watson R R, Preedy V R, 2016:245-256.
[9] SUN Q Q, YIN S, HE Y X, et al.Biomaterials and encapsulation techniques for probiotics:Current status and future prospects in biomedical applications[J].Nanomaterials, 2023, 13(15):2185.[10] WU C D, ZHANG J, WANG M, et al.Lactobacillus casei combats acid stress by maintaining cell membrane functionality[J].Journal of Industrial Microbiology and Biotechnology, 2012, 39(7):1031-1039.
[11] HUR S J, LIM B O, DECKER E A, et al.In vitro human digestion models for food applications[J].Food Chemistry, 2011, 125(1):1-12.
[12] MULET-CABERO A-I, EGGER L, PORTMANN R, et al.A standardised semi-dynamic in vitro digestion method suitable for food-an international consensus[J].Food &Function, 2020, 11(2):1702-1720.
[13] SENSOY I.A review on the food digestion in the digestive tract and the used in vitro models[J].Current Research in Food Science, 2021, 4:308-319.
[14] SHANI-LEVI C, ALVITO P, ANDRÉS A, et al.Extending in vitro digestion models to specific human populations:Perspectives, practical tools and bio-relevant information[J].Trends in Food Science &Technology, 2017, 60:52-63.
[15] 李志涛. 新型仿生胃肠道生物反应器研制与应用[D].无锡:江南大学, 2021.LI Z T.Development and application of a novel bionic gastrointestinal tract bioreactor[D].Wuxi:Jiangnan University, 2021.
[16] AZIZ G, ZAIDI A, TARIQ M.Compositional quality and possible gastrointestinal performance of marketed probiotic supplements[J].Probiotics and Antimicrobial Proteins, 2022, 14(2):288-312.
[17] AZHAR M A, MUNAIM M S A, HASAN M, et al.Viability and gastrointestinal tolerance of commercial probiotic products[J].International Journal of Pharma Medicine and Biological Sciences, 2020, 9(3):117-121.
[18] 中国食品科学技术学会益生菌分会. 益生菌的科学共识(2020年版)[J].中国食品学报, 2020, 20(5):303-307.Probiotics Society of the Chinese Institute of Food Science and Technology.Scientific consensus on probiotics(2020)[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):303-307.
[19] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14:991-1014.
[20] 李志杰. 基于人的体外模拟胃消化系统的构建及评价[D].杭州:浙江工商大学, 2018.LI Z J.Study on dection method of pork freshness based on impedance spectroscopy[D].Hangzhou:Zhejiang Gongshang University, 2018.
[21] KALANTZI L, GOUMAS K, KALIORAS V, et al.Characterization of the human upper gastrointestinal contents under conditions simulating bioavailability/bioequivalence studies[J].Pharmaceutical Research, 2006, 23(1):165-176.
[22] STREIT F, DELETTRE J, CORRIEU G, et al.Acid adaptation of Lactobacillus delbrueckii subsp.bulgaricus induces physiological responses at membrane and cytosolic levels that improves cryotolerance[J].Journal of Applied Microbiology, 2008, 105(4):1071-1080.
[23] WU C D, ZHANG J, WANG M, et al.Lactobacillus casei combats acid stress by maintaining cell membrane functionality[J].Journal of Industrial Microbiology and Biotechnology, 2012, 39(7):1031-1039.
[24] 崔美岩, 张淼, 许宗为, 等.乳酸菌在极端条件下抗逆性的研究进展[J].中国乳品工业, 2016, 44(5):28-31.CUI M Y, ZHANG M, XU Z W, et al.Research progress of lactic acid bacteria resistance under extreme conditions[J].China Dairy Industry, 2016, 44(5):28-31.
[25] 郭佳. 膳食纤维微胶囊改善嗜酸乳杆菌NCFM存活能力的研究[D].北京:北京林业大学, 2008.GUO J.Application of dietary fiber-based microencapsules from wheat bran in improving the survival of Lactobacillus acidophilus NCFM[D].Beijing:Beijing Forestry University, 2008.
[26] 周倩玉, 郦萍, 王利君, 等.西藏干酪源植物乳杆菌产细菌素的分离纯化及特性研究[J].中国食品学报, 2023, 23(8):24-31.ZHOU Q Y, LI P, WANG L J, et al.Studies on separation and purification of a bacteriocin produced by Lactobacillus plantarum from Tibetan cheese and its characteristic[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(8):24-31.
[27] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food—An international consensus[J].Food Function, 2014, 5(6):1113-1124.
[28] PERSSON E M, NILSSON R G, HANSSON G I, et al.A clinical single-pass perfusion investigation of the dynamic in vivo secretory response to a dietary meal in human proximal small intestine[J].Pharmaceutical Research, 2006, 23(4):742-751.