柚子(Citrus maxima)属于柑橘类水果,主要种植于中国、美国、古巴、南非、巴西、阿根廷和日本等国,其中,我国的柚子主要产地分布于湖南、重庆、广东等地[1-2]。柚子皮是所有柑橘类水果中果皮最大和最厚的,占鲜果重量的30%[3]。研究表明,柚子皮含有果胶、类黄酮、膳食纤维和精油等多种活性成分[1],其中果胶含量丰富,约为干重的20%~30%[4]。目前,我国柚子行业以鲜食为主,柚子皮资源丰富,但大量柚子皮被丢弃,不仅造成资源的浪费,而且还会污染环境。因此有必要对柚子皮进行深加工,以便提高柚子皮附加值。
果胶是一种由糖醛酸构成的酸性多糖,具有胶凝、乳化和增稠作用,可作为食品添加剂或配料在食品工业中应用[5]。目前,商品果胶主要从柑橘皮和苹果渣中提取。果胶也可以从其他果皮废弃物中提取,如芒果皮、香蕉皮、西瓜皮、火龙果皮等[6]。值得注意的是,由于原料和提取技术的不同,果胶得率及其理化性质会有很大差异[1]。一般来说,工业上使用无机强酸(盐酸、硫酸等)溶液来提取果胶,这种方法耗时长、耗能大、效率低,而且存在设备腐蚀,环境污染问题,不符合绿色生产的理念[7]。目前,柠檬酸等有机酸被用来提取果胶,作为替代无机强酸的绿色提取方法。同时,人们也开发了许多新的提取技术来提取果胶,如超高压、微波、超声波、酶辅助和亚临界水提取[8]。超高压提取技术是一种新型非热提取技术,其利用压力变化加速溶剂的渗透和溶质的溶解,达到高效提取的目的,具有快速、高效、能耗小等诸多独特优势[9]。
柚子皮中果胶的提取已有相关报道,如LIEW等[10]采用柠檬酸加热萃取法、超声-微波辅助连续萃取法和动态亚临界水萃取法提取果胶;SUN等[1]将柠檬酸与超声法联合提取果胶。然而,截止目前,柠檬酸与超高压法联合提取柚子皮果胶(grapefruit peel pectin, GPP)鲜有报道。因此,本研究以柚子皮为原料,采用响应面法的Box-Behnken设计优化GPP提取工艺并评价果胶理化特性,以便为柚子皮果胶的规模化提取提供理论依据。
1 材料与方法
1.1 材料与试剂
沙田柚,广州市梅州郑记有机农场;商品柚子皮果胶,双赢食品配料有限公司;半乳糖醛酸、DPPH、福林酚,上海源叶生物科技有限公司;柠檬酸、FeSO4,水杨酸,天津市百世化工有限公司。
1.2 仪器与设备
TU-1810型紫外可见光分光光度计,北京普析通用仪器有限责任公司;LGJ-12A型真空冷冻干燥机,北京四环起航科技有限公司;OLK-D01型粉碎机,中山欧莱克电器有限公司;H1750R高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;PHS-3C型pH计,上海宁隆仪器有限公司;DHR-1型流变仪,美国TA仪器;HPP.L2-600/1型超高压设备,天津华泰森淼生物工程技术股份有限公司。
1.3 实验方法
1.3.1 GPP的提取工艺流程
GPP提取工艺流程如下:
柚子皮(去表皮)→45 ℃烘干→粉碎,过60目筛→超高压辅助柠檬酸提取→离心→抽滤→旋转蒸发浓缩→乙醇沉淀→抽滤→真空冷冻干燥→GPP
1.3.2 单因素试验
分别考察液料比(15∶1、20∶1、25∶1、30∶1、35∶1, mL∶g),pH(1.0、2.0、3.0、4.0、5.0),压力(100、200、300、400、500 MPa),保压时间(3、5、7、9、11 min)对GPP得率的影响。
1.3.3 响应面试验
根据单因素试验结果,以A(液料比)、B(pH)、C(压力)、D(保压时间)为试验因子,GPP得率(Y)为响应值,用响应面法的Box-Behnken进行设计。
表1 响应面试验因素与水平
Table 1 Response surface test factors and levels

水平因素A(液料比)(mL∶g)B(pH)C(压力)/MPaD(保压时间)/min-120∶112003025∶123005130∶134007
1.3.4 GPP得率的测定
采用重量法计算GPP得率,计算如公式(1)所示:
GPP得率![]()
(1)
1.3.5 果胶理化性质
根据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》的方法测定水分含量;根据GB 25533—2010《食品安全国家标准 食品添加剂 果胶》的方法测定酸不溶灰分含量;采用酸化法测定溶解度[11];采用咔唑比色法测定半乳糖醛酸含量[12];采用滴定法测定酯化度[13];采用Folin-Ciocalteu法测定总酚含量[14]。
1.3.6 表观黏度
参考TRAN等[15]方法,并加以修改。用蒸馏水将酸法提取的柚子皮果胶(acid-extracted grapefruit peel pectin, AGPP)、GPP和商品柚子皮果胶(commercial grapefruit peel pectin, CGPP)分别配制成0.5%、1.0%、1.5%、2.0%的果胶溶液。剪切速率1~200 s-1范围内测定果胶溶液在室温下的黏度。由流变软件收集数据。
1.3.7 DPPH自由基清除率
参考赵泽素等[16]方法,并加以修改。分别将2.5 mL 果胶溶液(2~10 mg/mL)与2.5 mL DPPH溶液(0.1 mg/mL)混合,避光反应30 min,测定517 nm处的吸光值。计算如公式(2)所示:
DPPH自由基清除能力![]()
(2)
式中:A1,果胶溶液的吸光度值;A2,无水乙醇代替DPPH溶液的吸光度值;A3,去离子水代替果胶溶液的吸光度值。
1.3.8 羟自由基清除率
参考文献CHEN等[17]的方法,并加以修改。分别将1 mL果胶溶液(2~10 mg/mL)与9 mmol/L FeSO4溶液、9 mmol/L水杨酸乙醇溶液、9 mmol/L H2O2溶液(各1 mL)混合,37 ℃水浴30 min后测定混合溶液在510 nm处的吸光值。计算如公式(3)所示:
羟自由基清除能力![]()
(3)
式中:A1,果胶溶液的吸光度值;A2,去离子水代替H2O2溶液的吸光度值;A3,去离子水代替果胶溶液的吸光度值。
1.4 统计分析
所有实验均重复3次(n=3)。结果以“平均值±标准差”表示。采用SPSS 20.0软件进行方差分析。Duncan法进行多重比较(P<0.05),Origin 2021软件进行图形绘制。
2 结果与分析
2.1 单因素试验结果
液料比对果胶得率的影响如图1-a所示。在液料比为25∶1(mL∶g)时,果胶得率达到最大,然后随着液料比继续增加,果胶得率显著下降。这是由于溶剂用量增加提高了溶剂与原料之间的接触面积,有利于果胶的溶出[18]。溶剂过多会使果胶在溶液中浓度过低,沉淀效果不佳,导致果胶得率降低[19]。
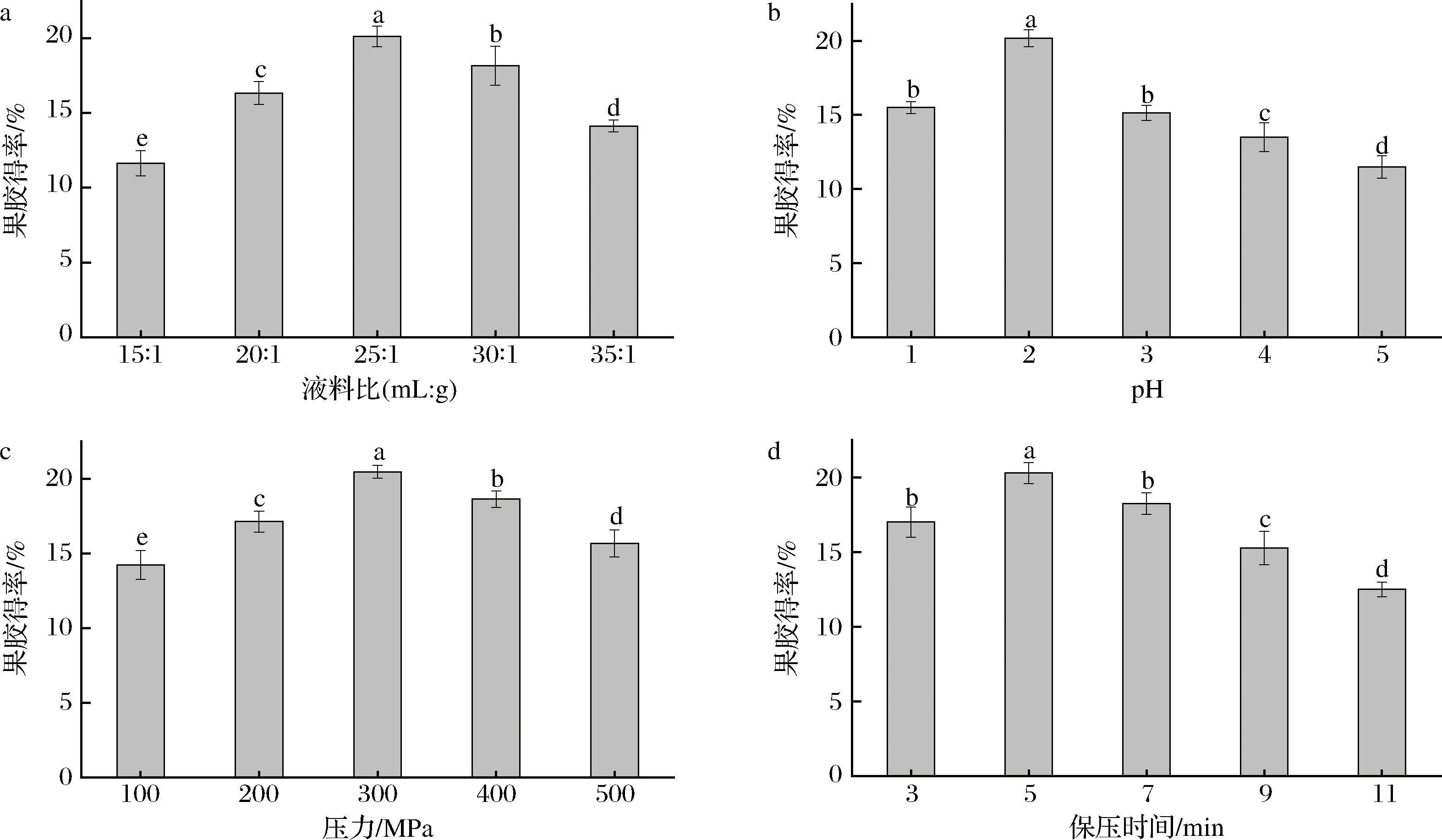
a-液料比;b-pH;c-压力;d-保压时间
图1 不同提取因素对果胶得率的影响
Fig.1 Effects of different extraction factors on the yields of pectin
注:不同小写字母表示数据差异显著(P<0.05)。
pH对果胶得率的影响如图1-b所示。果胶得率随pH的增加呈先增加后降低的趋势,在pH 2.0时达到最大值。这是因为在较高的酸性pH(1~2)下,不溶性和结合性果胶会水解为可溶性果胶[20],可提高果胶的得率。然而,pH值>2时会降低果胶的得率,这是由于酸度降低,果胶降解为低分子质量糖,导致它们在溶剂中聚集和沉淀,从而阻碍了果胶的释放[21]。
压力对果胶得率的影响如图1-c所示。在压力<300 MPa时,果胶得率随压力增加而显著升高,当压力为300 MPa时,果胶的得率达到最大。这可能是由于压力增加可引起细胞变形甚至破裂,提高传质速率以及溶剂在细胞内的渗透性[22],继续增加压力,反而有部分水溶性杂质释放出来,同时,果胶黏度提高,从而使扩散速率降低,因此果胶得率有所下降[23]。
保压时间对果胶得率的影响如图1-d所示。在保压时间为5 min时,果胶得率达到最大,然后随着保压时间继续延长,果胶得率显著下降。这是因为保压时间延长能够使果胶从原料颗粒中充分转移到提取溶剂中。当保压时间超过5 min后,部分果胶在长时间的高压下出现降解,进而使得率降低[24]。
2.2 Box-Behnken响应面试验结果
通过软件Design Expert 13对表2中数据进行拟合分析,得到线性回归方程:Y=21.54+1.04A-0.271 7B+1.08C-0.210 8D-0.977 5AB+0.735 0AC+0.682 5AD-0.665 0BC+0.412 5BD+0.372 5CD-1.72A2-3.26B2-2.99C2-2.60D2。由表3可知,模型的F值为119.00,P<0.000 1,失拟项P>0.05,差异不显著(P=0.424 6),说明该模型可靠。R2为![]() 说明该模型拟合性好且能解释98.33%响应值的变化。变异系数为1.84,表明该试验重现性和可行性良好。由F值可知,各个因素对果胶得率的影响顺序为:C>A>B>D,其中,一次项A、B、C和二次项A2、B2、C2、D2以及交互项AB、AC、AD、BC对果胶得率具有极显著影响(P<0.01),一次项D和交互项BD、CD对果胶得率具有显著影响(P<0.05)。
说明该模型拟合性好且能解释98.33%响应值的变化。变异系数为1.84,表明该试验重现性和可行性良好。由F值可知,各个因素对果胶得率的影响顺序为:C>A>B>D,其中,一次项A、B、C和二次项A2、B2、C2、D2以及交互项AB、AC、AD、BC对果胶得率具有极显著影响(P<0.01),一次项D和交互项BD、CD对果胶得率具有显著影响(P<0.05)。
表2 Box-Behnken响应面试验设计结果
Table 2 Box-Behnken response surface experimental design and results
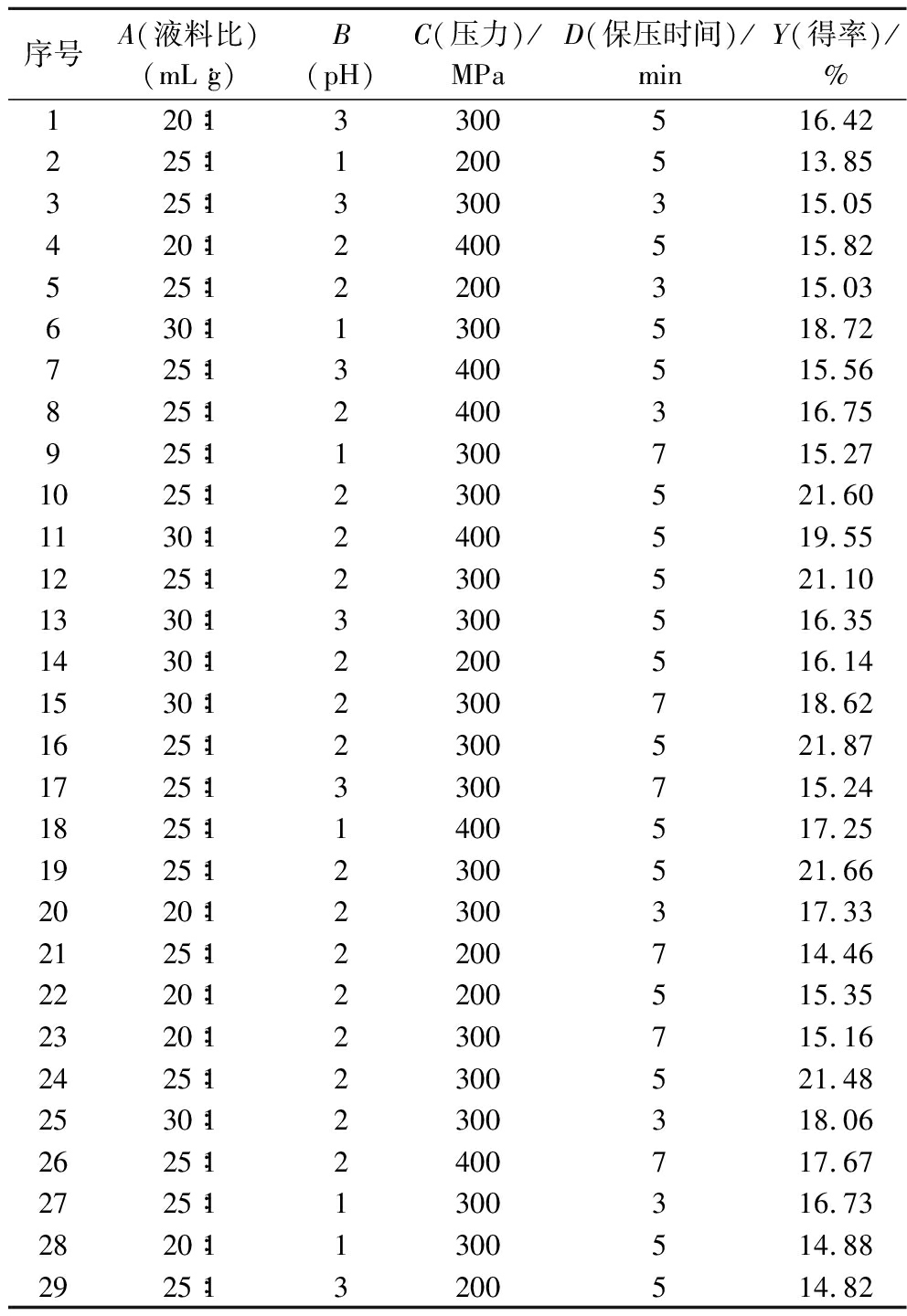
序号A(液料比)(mL∶g)B(pH)C(压力)/MPaD(保压时间)/minY(得率)/%120∶13300516.42225∶11200513.85325∶13300315.05420∶12400515.82525∶12200315.03630∶11300518.72725∶13400515.56825∶12400316.75925∶11300715.271025∶12300521.601130∶12400519.551225∶12300521.101330∶13300516.351430∶12200516.141530∶12300718.621625∶12300521.871725∶13300715.241825∶11400517.251925∶12300521.662020∶12300317.332125∶12200714.462220∶12200515.352320∶12300715.162425∶12300521.482530∶12300318.062625∶12400717.672725∶11300316.732820∶11300514.882925∶13200514.82
表3 回归模型方差分析
Table 3 Analysis of variance of regression model
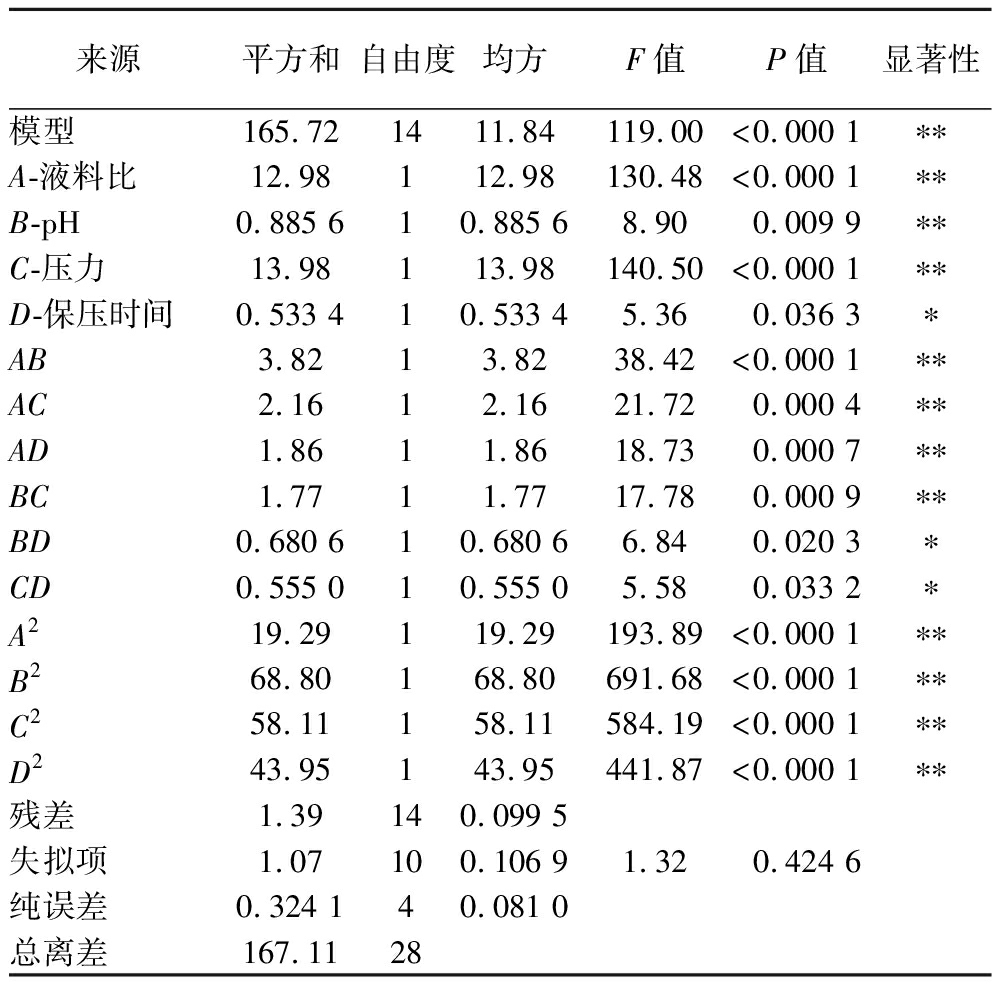
来源平方和自由度均方F值P值显著性模型165.721411.84119.00<0.000 1∗∗A-液料比12.98112.98130.48<0.000 1∗∗B-pH0.885 610.885 68.900.009 9∗∗C-压力13.98113.98140.50<0.000 1∗∗D-保压时间0.533 410.533 45.360.036 3∗AB3.8213.8238.42<0.000 1∗∗AC2.1612.1621.720.000 4∗∗AD1.8611.8618.730.000 7∗∗BC1.7711.7717.780.000 9∗∗BD0.680 610.680 66.840.020 3∗CD0.555 010.555 05.580.033 2∗A219.29119.29193.89<0.000 1∗∗B268.80168.80691.68<0.000 1∗∗C258.11158.11584.19<0.000 1∗∗D243.95143.95441.87<0.000 1∗∗残差1.39140.099 5失拟项1.07100.106 91.320.424 6纯误差0.324 140.081 0总离差167.1128
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。
图2反映了各因素(液料比、pH、压力和保压时间)之间的交互作用对果胶得率的影响。由图2可知,AB、AC、AD、BC、BD、CD的曲面坡度陡峭,等高线密集呈椭圆形,表示两两交互作用显著。
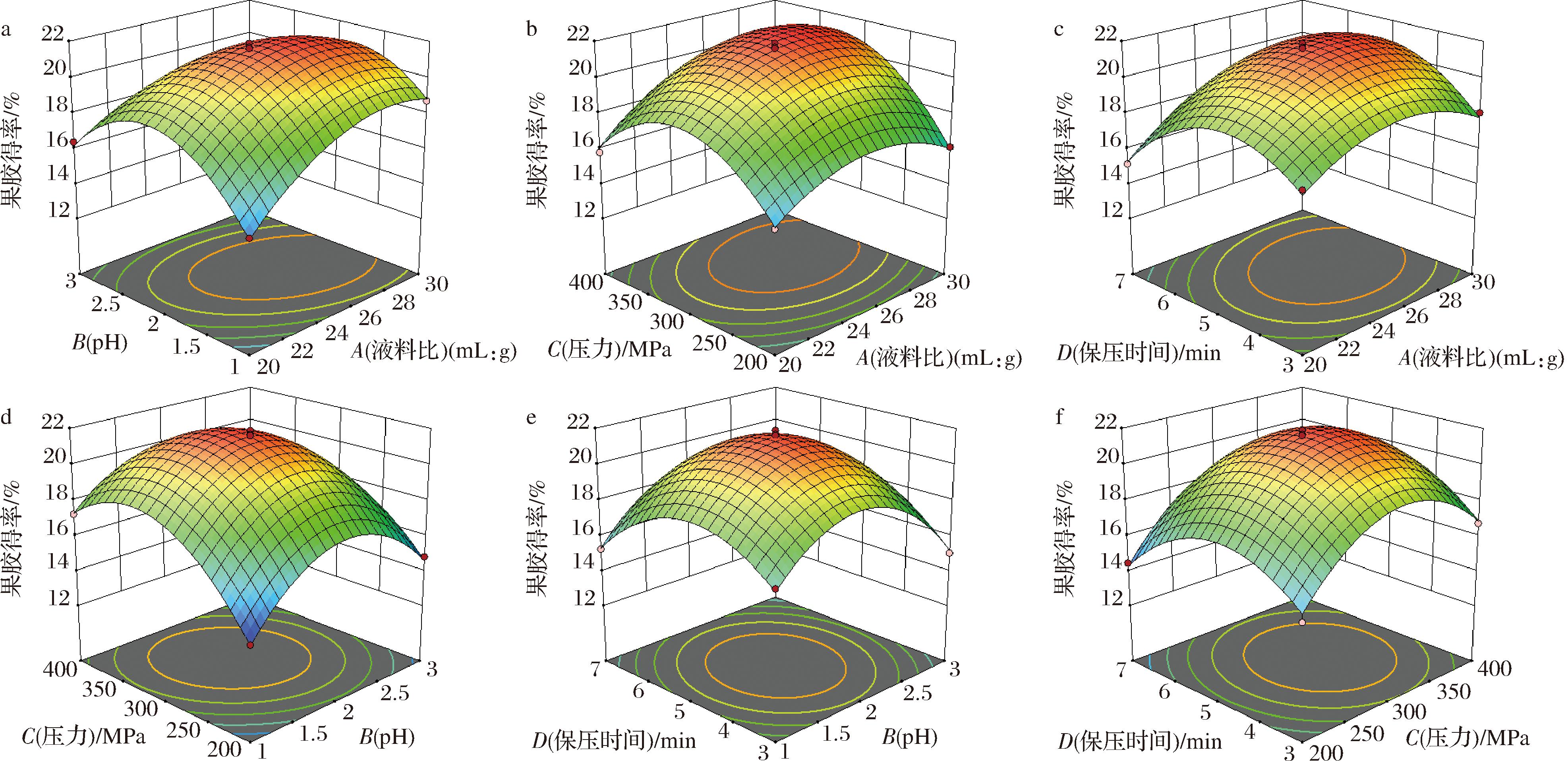
a-液料比与pH;b-液料比与压力;c-液料比与保压时间;d-pH与压力;e-pH与保压时间;f-压力与保压时间
图2 两因素间交互作用响应面图
Fig.2 The response surface plots of interaction between two factors
2.3 超高压最佳工艺参数及与其他方法的比较
运用Design-Expert 13.0软件由模型分析得出,超高压辅助柠檬酸提取GPP的最佳工艺参数为:液料比26.96∶1(mL∶g)、pH 1.88、压力324.35 MPa、保压时间5.04 min。此条件下果胶得率为21.89%。为了在实际中可操作,将最佳工艺参数调整为:液料比27∶1(mL∶g)、pH 1.9、压力324 MPa、保压时间5 min。
根据调整后的最佳工艺进行3次验证试验,果胶得率为21.56%,与理论预测值相对误差为1.5%,表明响应面法优化的提取工艺可行。与超声提取[液料比25∶1(mL∶g)、温度80 ℃、pH 1.5、超声时间8 min,得率12.56%]柚子皮果胶相比,超高压时间降低37.50%,得率提高71.66%[25]。与微波提取[液料比15∶1(mL∶g)、功率800 W、微波时间7 min,得率18.00%]柚子皮果胶相比,超高压时间降低28.57%,得率提高19.78%[26]。这说明超高压是一种更高效、更省时、得率更高的绿色果胶提取方法,为果胶工业化生产提供了一种新技术。
2.4 果胶理化性质
由表4可知,GPP的水分、酸不溶灰分、半乳糖醛酸含量均符合国家标准。AGPP、GPP和CGPP的水分含量分别为9.87%、9.49%、9.64%,三者差异不显著。GPP的酸不溶灰分含量为0.42%,显著低于AGPP(0.87%)和CGPP(0.68%),这表明超高压提取的GPP纯度较好。GPP的溶解度为81.25%,显著高于AGPP(75.62%)和CGPP(78.50%),这可能是由于超高压提取过程中对GPP结构改性有关。
表4 AGPP、CGPP和GPP的理化性质对比
Table 4 Physiochemical properties of AGPP, CGPP, and GPP
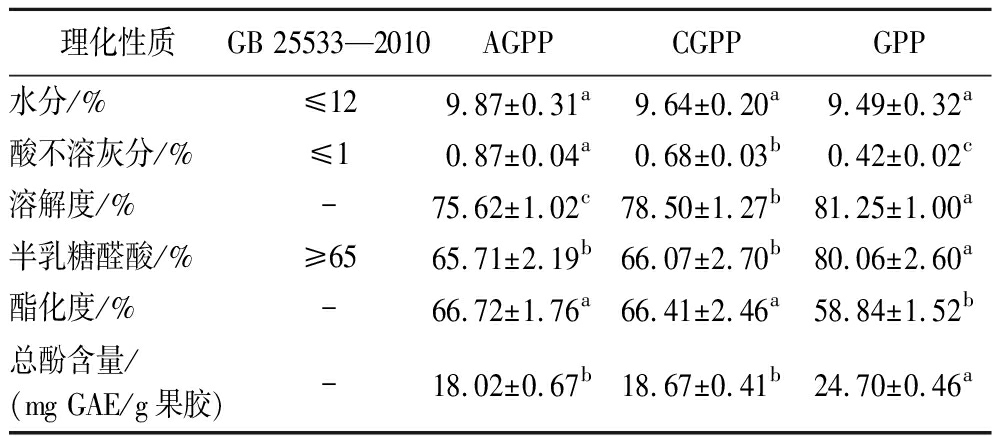
理化性质GB 25533—2010AGPPCGPPGPP水分/%≤129.87±0.31a9.64±0.20a9.49±0.32a酸不溶灰分/%≤10.87±0.04a0.68±0.03b0.42±0.02c溶解度/%-75.62±1.02c78.50±1.27b81.25±1.00a半乳糖醛酸/%≥6565.71±2.19b66.07±2.70b80.06±2.60a酯化度/%-66.72±1.76a66.41±2.46a58.84±1.52b总酚含量/(mg GAE/g果胶)-18.02±0.67b18.67±0.41b24.70±0.46a
注:GAE为没食子酸当量(gallic acid equivalent)。
半乳糖醛酸是果胶中最主要的组成部分,其含量代表了果胶的纯度[13]。GPP的半乳糖醛酸含量为80.06%,显著高于AGPP(65.71%)和CGPP(66.07%)。这可能是由于超高压破坏了细胞壁,从而使半乳糖醛酸释放量增多[9]。XIE等[27]也发现高压处理提高了马铃薯皮果胶的半乳糖醛酸含量。GPP的半乳糖醛酸含量(80.06%)远高于商品果胶的推荐值(65%),可作为食品添加剂使用。
酯化度是影响果胶性能的重要指标之一[28]。AGPP、CGPP和GPP的酯化度分别为66.72%、66.41%和58.84%,表明三者都属于高酯果胶(酯化度>50%)。GPP的酯化度较低可能是由于超高压处理过程中产生的机械力破坏了羧基的C—O[29]。XIE等[27]也发现高压处理降低了马铃薯皮果胶的酯化度。
总酚含量是影响果胶抗氧化活性的重要指标之一。GPP的总酚含量为24.70 mg GAE/g果胶,显著高于AGPP(18.02 mg GAE/g果胶)和CGPP(18.67 mg GAE/g果胶)。这可能是由于超高压处理破坏了细胞壁和细胞膜上的疏水键,增加了传质速率,从而导致酚类化合物可提取性增加[30]。本试验结果与CHEN等[9]报道的超高压辅助处理提高了火龙果皮果胶的总酚含量的结果相似。
2.5 表观黏度
图3展示了不同浓度(0.5%、1.0%、1.5%、2.0%)下AGPP、GPP和CGPP溶液的流动曲线。三者的表观黏度均随剪切速率的增加而降低,表现出剪切稀化现象。TRAN等[15]研究了从菠萝蜜皮中提取的不同浓度的果胶溶液的表观黏度,也报道了这种剪切稀化特性。果胶溶液的黏度受结构、分子质量大小、浓度等因素影响[31-32]。一般来说,果胶的黏度随浓度的增加而增加,这是因为提高果胶浓度,可以增强分子链间的相互作用,导致溶液黏度增加[33]。本研究结果与上述报道一致。此外,在0~200 s-1的剪切速率范围内,相同浓度下GPP的表观黏度明显优于AGPP和CGPP,可能是由电荷密度引起的。据报道,超高压处理使果胶分子侧链降解导致更多电荷暴露在溶液中,从而使黏度增加[27]。这一结果与庄远红等[34]发现的柚子各部位的黏度均优于商品果胶的结果类似。DUAN等[35]也证实超高压辅助柠檬酸提取的蜜橘皮果胶的表观黏度高于常规酸提取的蜜橘皮果胶。GPP的黏度特性表明其具有作为食品增稠剂和稳定剂的潜力。
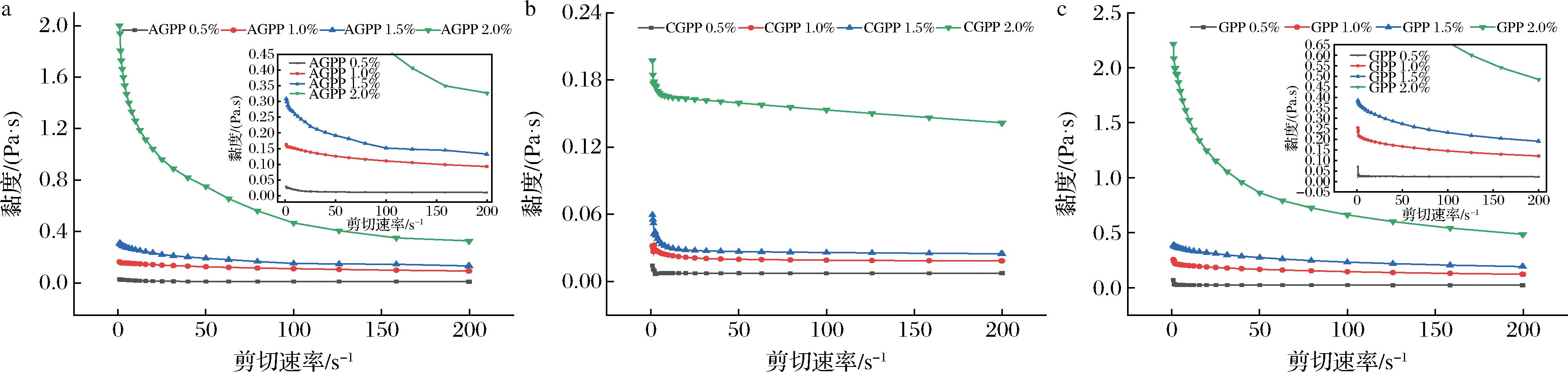
a-AGPP;b-CGPP;c-GPP
图3 果胶溶液流动曲线
Fig.3 Flow curves of pectin solutions
2.6 抗氧化性
DPPH自由基清除率、羟自由基清除率常用于评价物质的抗氧化能力[36]。由图4可以看出,AGPP、GPP和CGPP的DPPH自由基、羟自由基清除能力均呈浓度依赖性。在10 mg/mL时,GPP的DPPH自由基清除率、羟自由基清除率分别为58.22%、88.22%,显著高于AGPP的DPPH自由基清除率(50.39%)、羟自由基清除率(81.84%)和CGPP的DPPH自由基清除率(53.21%)、羟自由基清除率(84.38%)。超高压提取的GPP的抗氧化活性显著高于AGPP和CGPP,可能是由于GPP的总酚含量和半乳糖醛酸含量较高[9]。据报道,超高压处理破坏了细胞壁,从而使半乳糖醛酸释放量增加、酚类化合物提取性提高[9,30]。CHEN等[9]也发现超高压辅助提取对火龙果皮果胶的DPPH自由基、羟自由基清除能力有促进作用。本研究结果表明GPP具有较好的抗氧化能力。
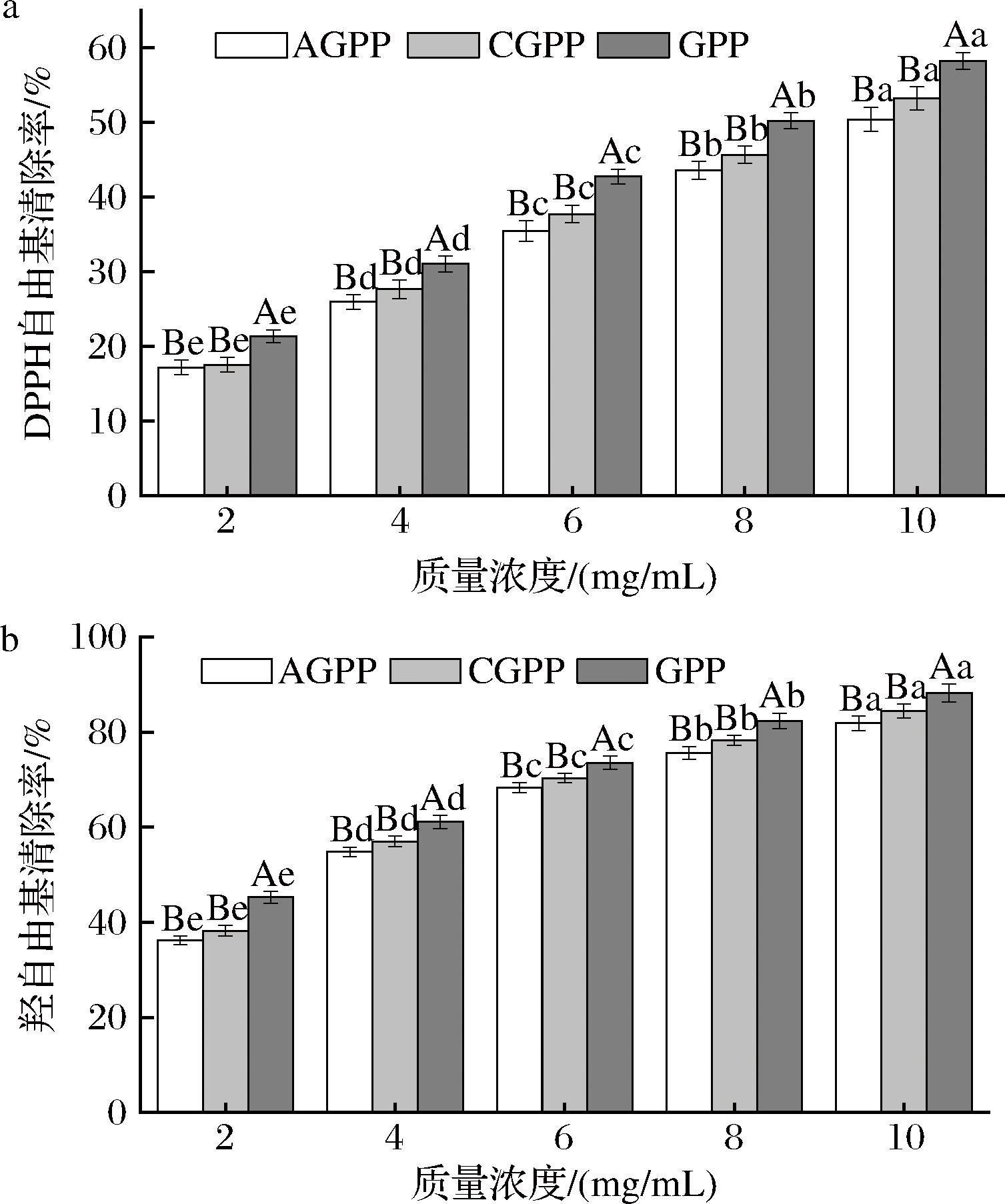
a-DPPH自由基清除活性;b-羟自由基清除活性
图4 DPPH自由基清除活性和羟自由基清除活性
Fig.4 DPPH radical scavenging activity, hydroxyl radical scavenging activity
注:不同小写字母表示组内差异显著,不同大写字母表示组间差异显著(P<0.05)。
3 结论
本研究采用响应面法的Box-Behnken设计,考察液料比、pH、压力和保压时间对果胶得率的影响。结果表明,在液料比27∶1(mL∶g)、pH 1.9、压力324 MPa、保压时间5 min的条件下,果胶得率为21.56%。所得果胶的水分、酸不溶灰分、半乳糖醛酸含量等理化性质均符合国家标准。此外,与AGPP和CGPP相比,GPP具有更高的表观黏度和抗氧化性。超高压辅助柠檬酸提取的GPP具有优良的性能,可作为食品添加剂在商业上加以利用。本研究可为柚子皮果胶的规模化提取提供理论依据。
[1] SUN Z H, WANG S, ZHOU C H, et al.Optimization of ultrasound assisted organic acid extraction of pectin from pomelo peel by response surface methodology and its preliminary characterization[J].Biomass Conversion and Biorefinery, 2023:1-13.
[2] 万苗苗. 柚皮果胶的提取、性质及应用研究[D].淮安:淮阴工学院, 2019.WAN M M.Study on extraction, properties and application of pectin from pomelo peel[D].Huai′an:Huaiyin Institute of Technology, 2019.
[3] TOCMO R, PENA-FRONTERAS J, CALUMBA K F, et al.Valorization of pomelo (Citrus grandis Osbeck) peel:A review of current utilization, phytochemistry, bioactivities, and mechanisms of action[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):1969-2012.
[4] 王华, 王莹, 詹长娟, 等.超声波辅助提取柚皮中的果胶[J].中国食品添加剂, 2016,27(10):102-106.WANG H, WANG Y, ZHAN C J, et al.Optimization of ultrasonic assisted extraction of pectin from pomelo peel[J].China Food Additives, 2016,27(10):102-106.
[5] 方园, 崔楠, 代银银, 等.制备方法对山楂果胶理化特性的影响[J].食品科学, 2021, 42(11):130-136.FANG Y, CUI N, DAI Y Y, et al.Effect of preparation methods on physicochemical properties of hawthorn pectin[J].Food Science, 2021, 42(11):130-136.
[6] PICOT-ALLAIN M C N, RAMASAWMY B, EMMAMBUX M N.Extraction, characterization, and application of pectin from tropical and sub-tropical fruits:A review[J].Food Reviews International, 2022, 38(3):282-312.
[7] HE C A, SAMPERS I, RAES K.Isolation of pectin from clementine peel:A new approach based on green extracting agents of citric acid/sodium citrate solutions[J].ACS Sustainable Chemistry &Engineering, 2021, 9(2):833-843.
[8] KHUBBER S, KAZEMI M, AMIRI SAMANI S A, et al.Structural-functional variability in pectin and effect of innovative extraction methods:An integrated analysis for tailored applications[J].Food Reviews International, 2023, 39(4):2352-2377.
[9] CHEN R Z, LUO S J, WANG C X, et al.Effects of ultra-high pressure enzyme extraction on characteristics and functional properties of red pitaya (Hylocereus polyrhizus) peel pectic polysaccharides[J].Food Hydrocolloids, 2021,121:107016.[10] LIEW S Q, TEOH W H, YUSOFF R, et al.Comparisons of process intensifying methods in the extraction of pectin from pomelo peel[J].Chemical Engineering and Processing-Process Intensification, 2019, 143:107586.
[11] 郭宗林. 西瓜皮果胶/植物多酚色素包装材料研究及在冷鲜肉保鲜中的应用[D].兰州:甘肃农业大学, 2022.GUO Z L. Study on watermelon peel pectin/plant polyphenol pigment packaging material and its application in fresh-keeping of cold meat[D]. Lanzhou: Gansu Agricultural University, 2022.
[12] 黎英, 刘夏蕾, 林娅新, 等.超声-微波协同提取百香果皮果胶的工艺研究[J].热带作物学报, 2020, 41(2):386-393.LI Y, LIU X L, LIN Y X, et al.Ultrasonic-microwave synergistic extraction of pectin from the peel of Passiflora edulis[J].Chinese Journal of Tropical Crops, 2020, 41(2):386-393.
[13] PANWAR D, PANESAR P S, CHOPRA H K.Ultrasound-assisted extraction of pectin from Citrus limetta peels:Optimization, characterization, and its comparison with commercial pectin[J].Food Bioscience, 2023, 51:102231.
[14] LI Q, WANG X Y, CHEN J, et al.Antioxidant activity of proanthocyanidins-rich fractions from Choerospondias axillaris peels using a combination of chemical-based methods and cellular-based assay[J].Food Chemistry, 2016, 208:309-317.
[15] TRAN N T K, NGUYEN V B, VAN TRAN T V, et al.Microwave-assisted extraction of pectin from jackfruit rags:Optimization, physicochemical properties and antibacterial activities[J].Food Chemistry, 2023, 418:135807.
[16] 赵泽素, 南木加, 刘双平, 等.西藏凹乳芹多糖的分离纯化、结构表征及抗氧化活性研究[J].食品与发酵工业, 2024, 50(1):163-169.ZHAO Z S, NAN M J, LIU S P.Isolation, purification, structure characterization, and antioxidant activity of polysaccharides from Vicatia thibetica de Boiss[J].Food and Fermentation Industries, 2024, 50(1):163-169.
[17] CHEN F, HUANG G L.Extraction, derivatization and antioxidant activity of bitter gourd polysaccharide[J].International Journal of Biological Macromolecules, 2019, 141:14-20.
[18] KAZEMI M, KHODAIYAN F, LABBAFI M, et al.Pistachio green hull pectin:Optimization of microwave-assisted extraction and evaluation of its physicochemical, structural and functional properties[J].Food Chemistry, 2019, 271:663-672.
[19] 陈怡君, 王晓慧, 陈艳萍, 等.响应面法优化超声波-微波协同辅助酸法提取猕猴桃皮果胶工艺及果胶理化性质分析[J].食品与发酵工业, 2022, 48(13):238-246.CHEN Y J, WANG X H, CHEN Y P, et al.Optimization of ultrasound-microwave assisted acid extraction of pectin from kiwifruit peel by response surface method and the analysis of physicochemical properties of pectin[J].Food and Fermentation Industries, 2022, 48(13):238-246.
[20] MARAN J P, PRIYA B, AL-DHABI N A, et al.Ultrasound assisted citric acid mediated pectin extraction from industrial waste of Musa balbisiana[J].Ultrasonics Sonochemistry, 2017, 35:204-209.
[21] SHIVAMATHI C S, MOORTHY I G, KUMAR R V, et al.Optimization of ultrasound assisted extraction of pectin from custard apple peel:Potential and new source[J].Carbohydrate Polymers, 2019, 225:115240.
[22] GAO W H, LIN P Z, ZENG X A, et al.Preparation, characterisation and antioxidant activities of Litchi (Litchi chinensis Sonn.) polysaccharides extracted by ultra-high pressure[J].International Journal of Food Science &Technology, 2017, 52(8):1739-1750.
[23] 王标诗, 黄澔杨, 谭文慧, 等.辣木籽多糖的超高压辅助提取工艺及其抗氧化活性分析[J].热带作物学报, 2022, 43(10):2132-2138.WANG B S, HUANG H Y, TAN W H, et al.Ultra-high pressure assisted extraction and antioxidant activity of polysaccharide from Moringa oleifera seeds[J].Chinese Journal of Tropical Crops, 2022, 43(10):2132-2138.
[24] 杨孝辉, 郭君.当归多糖超高压提取工艺优化研究[J].粮食与油脂, 2022, 35(5):112-115.YANG X H, GUO J.Optimization of ultra-high pressure extraction process of Angelica sinensis polysaccharide[J].Cereals &Oils, 2022, 35(5):112-115.
[25] 雷明馨. 超声波辅助提取柚子皮中果胶的工艺优化[J].福建农业科技, 2020,51(6):33-36.LEI M X.Optimization of ultrasonic-assisted extraction of pectin from grapefruit peel[J].Fujian Agricultural Science and Technology, 2020,51(6):33-36.
[26] 张秀芳, 王克冰, 闫晓霖, 等.微波辅助酸法提取柚皮果胶的工艺优化[J].南方农业学报, 2014, 45(11):2041-2045.ZHANG X F, WANG K B, YAN X L, et al.Optimization of acid-assisted microwave technology of extracting pectin from pomelo peel[J].Journal of Southern Agriculture, 2014, 45(11):2041-2045.
[27] XIE F, ZHANG W, LAN X H, et al.Effects of high hydrostatic pressure and high pressure homogenization processing on characteristics of potato peel waste pectin[J].Carbohydrate Polymers, 2018, 196:474-482.
[28] 吴韧, 刘爽, 马宽, 等.豆腐柴果胶多糖理化指标及乳化性质[J].食品与发酵工业, 2024,50(9):174-181.WU R, LIU S, MA K, et al.Physicochemical indexes and emulsification properties of pectin polysaccharide from Premna microphylla Turcz[J].Food and Fermentation Industries, 2024,50(9):174-181.
[29] ZHANG W, WEN J, LI L, et al.Physicochemical, structural and functional properties of pomelo spongy tissue pectin modified by different green physical methods:A comparison[J].International Journal of Biological Macromolecules, 2022, 222(PartB):3195-3202.
[30] LUO W, TAPPI S, WANG C F, et al.Effect of high hydrostatic pressure (HHP) on the antioxidant and volatile properties of candied Wumei fruit (Prunus mume) during osmotic dehydration[J].Food and Bioprocess Technology, 2019, 12(1):98-109.
[31] OLAWUYI I F, KIM S R, HAHN D, et al.Influences of combined enzyme-ultrasonic extraction on the physicochemical characteristics and properties of okra polysaccharides[J].Food Hydrocolloids, 2020, 100:105396.
[32] WANG C, LI J, CAO Y, et al.Extraction and characterization of pectic polysaccharides from Choerospondias axillaris peels:Comparison of hot water and ultrasound-assisted extraction methods[J].Food Chemistry, 2023, 401:134156.
[33] 袁敏. 南酸枣果胶的提取及性质的研究[D].南昌:南昌大学, 2017.YUAN M. Study on extraction and characterization of Choerospondias axillaries pectin[D]. Nanchang: Nanchang University, 2017.
[34] 庄远红, 谢彩斌.不同部位柚子果胶提取率与理化特性相关性研究[J].中国食品添加剂, 2022, 33(2):94-99.ZHUANG Y H, XIE C B.Study on the correlation between pectin extraction rate and physicochemical properties of pomelo in different parts[J].China Food Additives, 2022, 33(2):94-99.
[35] DUAN X K, ZHU Y, SHU C Y, et al.Extraction of pectin from satsuma mandarin peel:A comparison of high hydrostatic pressure and conventional extractions in different acids[J].Molecules, 2022, 27(12):3747.
[36] ZHANG T, LIU H P, BAI X Y, et al.Fractionation and antioxidant activities of the water-soluble polysaccharides from Lonicera japonica Thunb[J].International Journal of Biological Macromolecules, 2020, 151:1058-1066.