文冠果(Xanthoceras sorbifolium Bunge),别名文官果、温旦革子等,属无患子科,落叶灌木或者小乔木;果实近球形或阔椭圆形,是我国一种特有的珍稀木本油料树种,生态适应性极强[1]。文冠果种仁中油脂含量约为60%,蛋白质含量约为30%,提取油脂后的文冠果种粕蛋白含量更高[2]。因此,以文冠果种粕为原料开发蛋白质类产品,不仅可避免资源的浪费,还能够得到新型植物蛋白质产品。可见,文冠果种粕蛋白的开发和利用具有必要性。
目前,常用的文冠果种粕蛋白提取方法有酶解提取法、碱溶酸沉法;其中,碱溶酸沉法操作简便、设备简单,是最常用的植物蛋白质提取方法。为了进一步提高蛋白质的提取率,常采用超声波辅助技术[3]。超声技术是一种安全高效的新型非热物理加工技术,适用于不同来源的生物活性物质提取,特别是在蛋白质提取和改性领域应用广泛;其具有独特的优势,如溶剂用量少、蛋白质提取率高[4]。ZHU等[5]研究发现超声处理使核桃蛋白的结构发生明显改变,减小了核桃蛋白颗粒尺寸,其水溶性、乳化活性指数和乳化稳定性指数均有所提高。经超声处理后,青稞蛋白活性位点充分暴露体外消化率显著提升[6]。另外,有研究指出,超声辅助技术显著提高了金针菇菇脚蛋白[7]、啤酒糟蛋白[8]的提取率,且蛋白质乳化稳定性、起泡性等显著提高。而且,超声处理改变了大麻籽分离蛋白的二级和三级结构,增强了表面疏水性,减小了蛋白质聚集体的颗粒尺寸[9]。可见,适宜的超声辅助技术不仅可提高蛋白质的提取率,还可改善蛋白质性质。然而,超声辅助技术在文冠果种粕蛋白提取及性质改善方面的应用鲜有报道。
本研究采用超声辅助碱溶酸沉法提取文冠果种粕蛋白,通过单因素试验优化确定出文冠果种粕蛋白提取的最优工艺条件;进而探讨了不同超声时间处理下文冠果种粕蛋白的粒径、电位等结构变化规律;同时,还系统分析了超声时间对文冠果种粕蛋白乳化性、乳化稳定性、溶解性、发泡性等功能性质的作用规律。研究结果可为超声技术在文冠果种粕蛋白提取及改性中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
文冠果种粕,由高台宏晟油脂有限公司提供;盐酸,北京化工厂;氢氧化钠,上海沃凯生物技术有限公司;95%乙醇,天津市福晨化学试剂厂;石油醚,天津市百世化工有限公司;以上试剂均为分析纯。
1.2 仪器与设备
PrimacsSNC-100全自动碳氮分析仪,广州昌利信科学仪器有限公司;SFX550实验型密闭超声萃取仪,美国布兰森超声波公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司;AD500S-H均质机,上海昂尼仪器仪表有限公司;Nicolet iS50傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR),美国赛默飞世尔科技公司;BT-Zeta100纳米粒度分析仪,丹东百特仪器有限公司;DYY-6D型电泳仪,北京六一生物科技有限公司;UV-1780双光束紫外可见分光光度计、RF-5301PC荧光分光光度计,岛津仪器有限公司。
1.3 实验方法
1.3.1 文冠果种粕预处理
文冠果种粕粉碎,过80目筛,将粉末于石油醚(沸程30~60 ℃)中回流脱脂8 h,置于40 ℃烘箱中干燥12 h,得到文冠果种粕脱脂粉,4 ℃保存备用。
1.3.2 文冠果种粕蛋白的提取
参照尚晖岚[10]的方法并稍做修改。称取文冠果种粕脱脂粉末5.00 g置于烧杯中,按照料液比1∶15(g∶mL)与蒸馏水混合,将溶液pH值调至11,于45 ℃恒温磁力搅拌30 min后置于超声波处理器中进行超声预处理,水浴控温25 ℃,超声频率为20 kHz,振幅为40%,超声时间为9 min;之后将溶液于6 000 r/min离心20 min,取上清液为蛋白提取液;将沉淀按照上述料液比与蒸馏水混合,重复上述提取步骤,合并2次上清液,将其pH值调至4.6,静置30 min后于6 000 r/min下离心20 min,收集沉淀,进行冷冻干燥得到文冠果种粕蛋白粉,称重后在4 ℃下保存。
1.3.3 单因素试验
在上述提取方法下,设置料液比为1∶10、1∶15、1∶20、1∶25、1∶30,溶液pH值为8、9、10、11、12,提取温度为35、40、45、50、55、60 ℃,提取时间为30、40、50、60、70 min;超声预处理条件分别设置为超声振幅30%、35%、40%、45%、50%,超声时间0、3、6、9、12、15、18 min。以蛋白质提取率为依据获得文冠果种粕蛋白最佳提取工艺,并分析超声波预处理时间对蛋白结构及功能性质的影响。
1.3.4 文冠果种粕蛋白纯度及提取率测定
蛋白含量采用PrimacsSNC-100全自动碳氮分析仪进行测定,蛋白提取率及纯度的计算如公式(1)、(2)所示:
蛋白纯度![]()
(1)
蛋白提取率![]()
(2)
1.3.5 文冠果种粕蛋白结构测定
1.3.5.1 SDS-PAGE分析
在最佳提取条件下,采用不同超声时间预处理,以提取文冠果种粕蛋白,参照本团队前期的方法进行SDS-PAGE电泳试验[11]。取适量不同超声时间预处理下的文冠果种粕蛋白,溶于去离子水中,并用1 mol/L的NaOH溶液调节pH值为7.0,在40 ℃下磁力搅拌使其充分溶解,获得2 mg/mL文冠果种粕蛋白溶液,与上样缓冲液以2∶1的体积比混合均匀,水浴煮沸4 min,于4 000 r/min离心4 min;随后将7 μL混合液注入凝胶轨道并在130 V恒压下进行电泳。
1.3.5.2 FTIR测定
将文冠果种粕蛋白粉末置于衰减全反射(attenuated total reflection,ATR)元件,分辨率为4 cm-1,在透射模式下采用FTIR仪扫描500~4 000 cm-1的红外光谱。
1.3.5.3 粒径及Zeta-电位测定
配制2 mg/mL的文冠果种粕蛋白溶液。使用前将粒度仪进行清洗校零,水为分散剂,平衡时间120 s,样品折射率1.35,介质折射率1.33。
1.3.5.4 荧光光谱测定
配制2 mg/mL的文冠果种粕蛋白溶液,用荧光分光光度计在室温下测定荧光发射光谱,激发波长设置为300 nm,发射光谱采集范围为280~350 nm,激发波长与发射波长狭缝均为10 nm。
1.3.6 文冠果种粕蛋白功能性质的测定
1.3.6.1 溶解性测定
参考本团队前期研究方法[12],称取适量文冠果种粕蛋白,加入适量去离子水,用1 mol/L的NaOH溶液调节溶液pH值为7.0,在45 ℃下磁力搅拌2 h后定容,终质量浓度为10 mg/mL,室温放置2 h。将10.00 mL蛋白质溶液移入15 mL离心管中,于4 000 r/min离心10 min,弃去上清液,放入烘箱中于65 ℃烘干至恒重,称重干燥的蛋白质量并记为m1,10 mL溶液中蛋白总质量记为m0。溶解性按照公式(3)进行计算:
溶解性![]()
(3)
1.3.6.2 发泡性测定
参考ZHAO等[13]的方法,取30 mL 10 mg/mL的蛋白质样品溶液于50 mL烧杯中,在10 000 r/min条件下均质1 min,将均质前溶液的体积记为V0,均质后溶液和泡沫的总体积记为V1;将均质后的液体静置30 min,记录溶液和泡沫的总体积记为V2。发泡性及泡沫稳定性计算如公式(4)、公式(5)所示:
发泡性![]()
(4)
泡沫稳定性![]()
(5)
1.3.6.3 乳化性测定
参考本团队前期的方法[14],取24 mL 2 mg/mL的样品溶液与8 mL大豆油混合,在10 000 r/min条件下均质1 min,使其形成均匀的乳化液,分别在0、10、30 min时于烧杯底部取乳化液50 μL与5 mL 1 g/L的SDS溶液混匀,测量500 nm下的吸光值,以1 g/L SDS溶液做参比。乳化活性指数(emulsification activity index,EAI)和乳化稳定性指数(emulsification stability index,ESI)按照公式(6)、公式(7)、公式(8)进行计算:
(6)
(7)
(8)
式中:A0,0 min吸光值;A10,乳液静置10 min时的吸光度值;A30,乳液静置30 min时的吸光度值;D为稀释倍数,100;ρ,乳化液形成前溶液蛋白质的质量浓度,g/L;θ,乳状液中油相体积分数,0.25;φ,比色皿直径,0.01 m。
1.3.6.4 持水性和持油性测定
参考本团队前期的方法[15],称取0.5 g文冠果种粕蛋白样品于离心管中,记为m,称量离心管和蛋白质样品的总质量,记为m1;加入5 mL大豆油后采用涡旋混匀器于3 000 r/min下每隔10 min涡旋1 min,共涡旋30 min后于室温下静置2 h。之后,于4 000 r/min离心15 min,小心吸去油相,称量离心管与管中沉淀物的总质量,记为m2。将上述步骤中油替换为水,按照同样方法测定持水性。持油性和持水性按照公式(9)进行计算:
持油(水)性![]()
(9)
1.4 数据处理
所有实验重复3次,数据用平均数±标准偏差表示,用Origin 2018作图,用SPSS 24.0进行差异显著性分析,数据间差异显著分析采用Duncan法,以P<0.05为显著性差异。
2 结果与分析
2.1 文冠果种粕蛋白提取工艺优化
2.1.1 料液比对文冠果种粕蛋白提取率的影响
由图1可知,文冠果种粕蛋白的提取率随着料液比的增加先升高后降低,当料液比为1∶25时,提取率显著高于其他组(P<0.05)。料液比较小时,过高的溶液浓度影响物料的传质和传热效果,从而提取率较低;随着料液比逐渐增大,溶质的分散程度增强有利于可溶性蛋白的溶出,提取率随之增大;当料液比超过1∶25时提取率下降,是由于提取液的过量加入导致蛋白分子与水分子间相互作用加强,在酸沉过程中部分蛋白残留在上清液中,从而造成了蛋白的损失[16]。因此,选择1∶25为最优料液比。
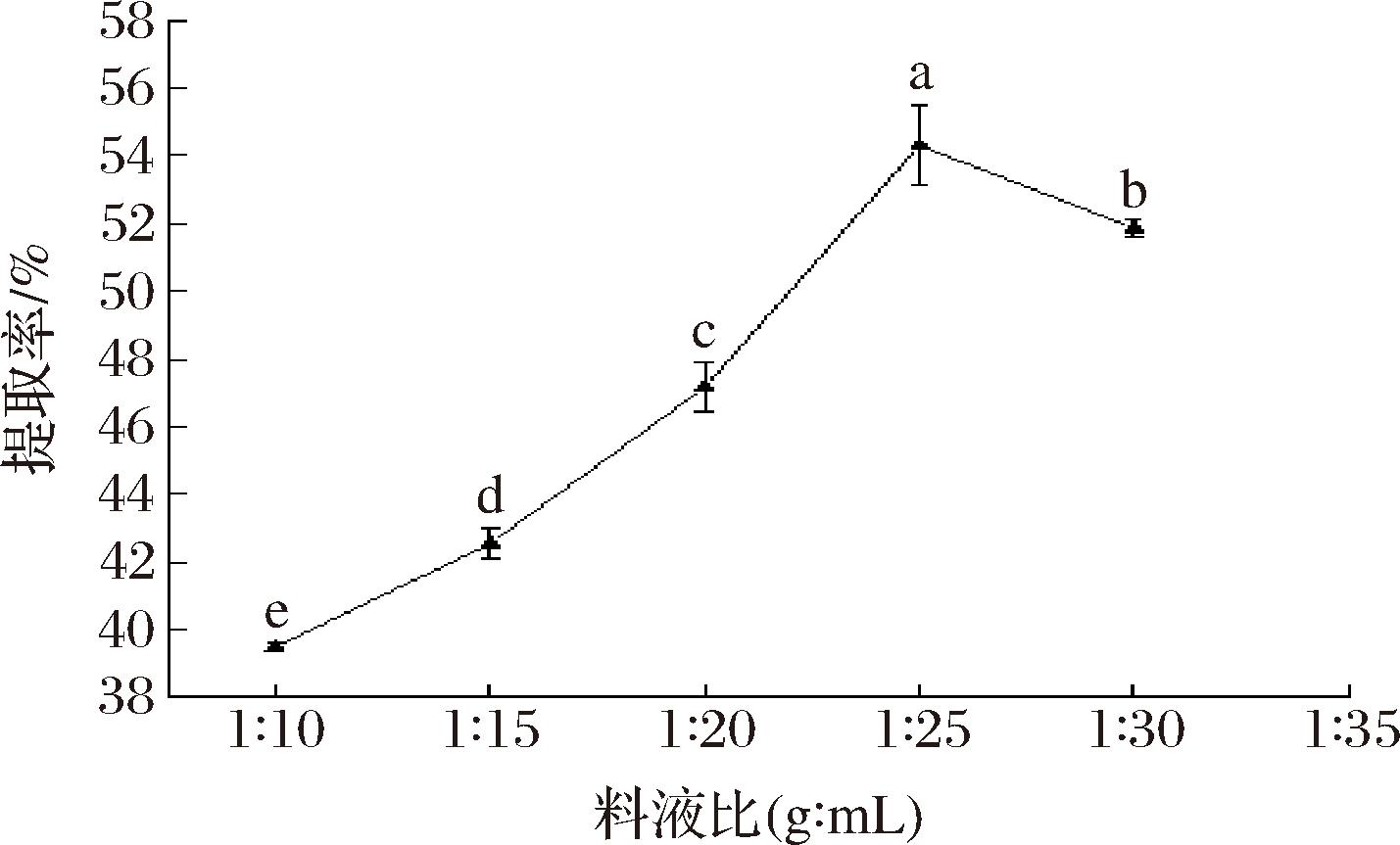
图1 料液比对文冠果种粕蛋白提取率的影响
Fig.1 Effect of the ratio of material to solvent on the extraction rate of Xanthoceras sorbifolium Bunge seeds meal protein
注:不同字母表示组间差异显著(P<0.05)(下同)。
2.1.2 pH值对文冠果种粕蛋白提取率的影响
由图2可知,随着pH值的增加,蛋白提取率先升高后降低;pH值为11时提取率最高。溶液pH值接近中性时,蛋白质分子间斥力较小,且蛋白质与其他大分子间斥力较小,不利于蛋白质的溶出和提取;当pH值进一步增大时,蛋白质在碱性条件下的溶解性增大,且分子间静电斥力较大,结构变得疏松,且蛋白质分子间及其与其他基质之间的氢键等次级键被破坏,更易于溶出,因此提取率增大;当pH值达到12时,部分蛋白质在强碱性环境中发生变性和水解,难以被沉淀,导致提取率降低[17]。曾琪等[18]研究发现,pH值过高会导致黑豆分离蛋白美拉德反应加剧,造成蛋白部分氨基酸的降解。因此,选择11为最优提取pH值。

图2 pH值对文冠果种粕蛋白提取率的影响
Fig.2 Effect of pH on the extraction rate ofXanthoceras sorbifolium Bunge seeds meal protein
2.1.3 提取温度对文冠果种粕蛋白提取率的影响
由图3可知,文冠果种粕蛋白的提取率随着温度的升高先迅速增加(P<0.05),在45 ℃时蛋白提取率最高;之后,随着温度的升高,蛋白质提取率降低。温度较低时,分子扩散运动较小,不利于蛋白质的溶出,因此提取率较低;随着温度的升高,分子扩散速率和分子碰撞概率迅速增大,促进了蛋白质分子的溶出,蛋白溶解性增大,提取率随之提高;当温度超过45 ℃后,蛋白质提取率呈下降趋势。文献指出,文冠果蛋白粉的起始变性温度为(49.4±2.74) ℃[19]。因此,温度超过45 ℃后导致蛋白质变性,且其他大分子在高温下溶出,致使蛋白质提取率下降。因此,选择45 ℃为最优提取温度。
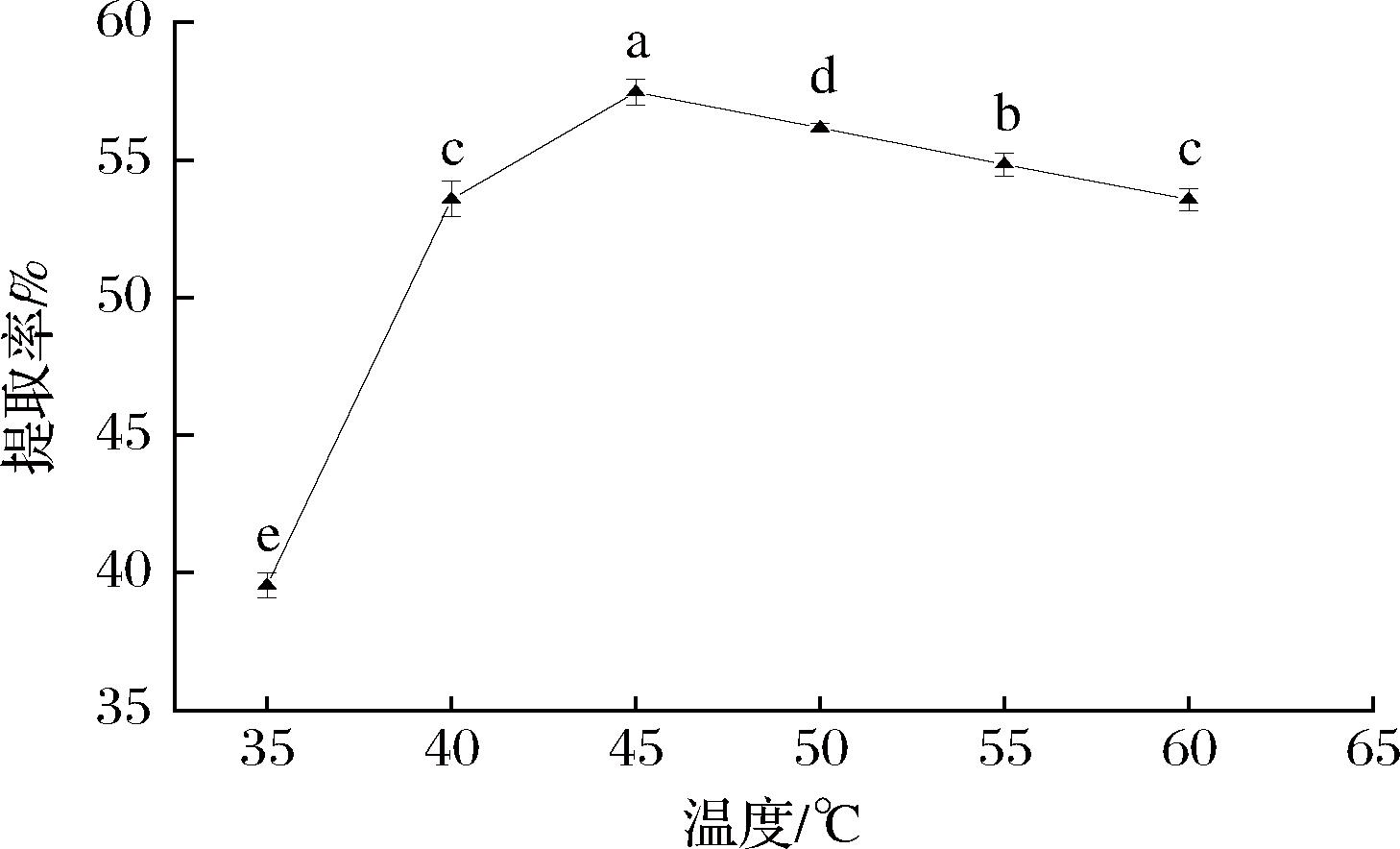
图3 提取温度对文冠果种粕蛋白提取率的影响
Fig.3 Effect of temperature on the extraction rate ofXanthoceras sorbifolium Bunge seeds meal protein
2.1.4 提取时间对文冠果种粕蛋白提取率的影响
由图4可知,随着提取时间的延长,提取率先升高后降低,60 min时提取率达到最高。由于蛋白质的溶出需要一定时间才能达到平衡状态,提取时间较短时,物料未充分溶解,造成蛋白溶出量有限,提取率较低;随着提取时间的延长,蛋白溶出量增加,60 min时蛋白在溶液中溶解量趋于饱和,处于平衡状态,提取率达到最大;但过度延长提取时间导致蛋白质长时间在碱性环境中发生水解和变性,出现不同程度的降解,溶液中的蛋白浓度降低,从而提取率减小[20]。因此,选择60 min为最佳提取时间。
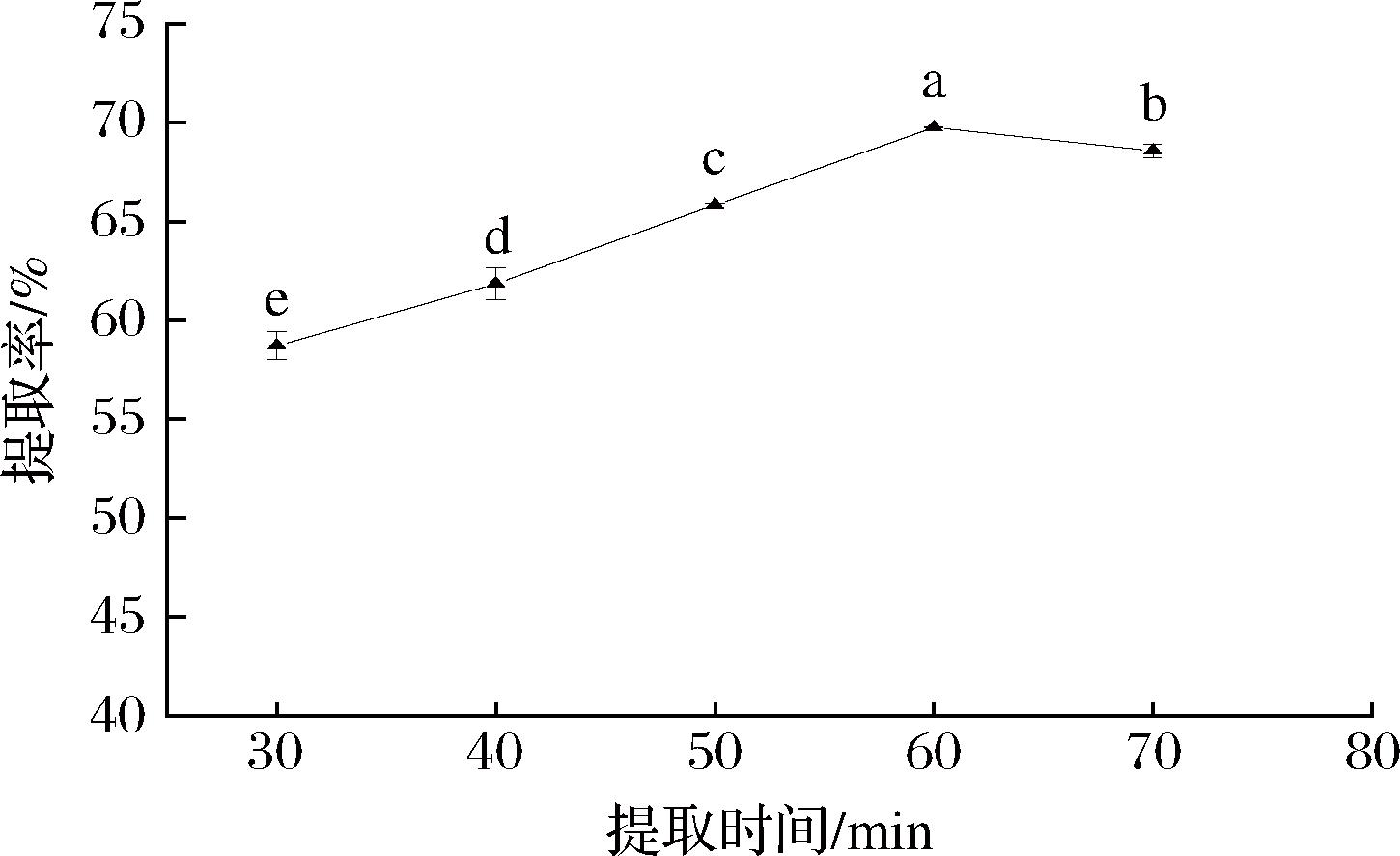
图4 提取时间对文冠果种粕蛋白提取率的影响
Fig.4 Effect of extraction time on the extraction rate ofXanthoceras sorbifolium Bunge seeds meal protein
2.1.5 超声振幅对文冠果种粕蛋白提取率的影响
由图5可知,随着超声振幅的增加,提取率先迅速升高后降低,超声振幅达到40%时提取率最大。超声能量较低时,空化作用和机械剪切力较小,文冠果种粕破碎程度低,蛋白流出困难,导致提取率低;随着超声振幅的不断增加,提取率显著提高(P<0.05),是由于超声振幅的增加导致空化作用加大,蛋白的溶解度提高,提取率增加[21]。此后,超声振幅继续增大至45%时,提取率下降,这是由于超声能量密度过高会导致其他分子的溶出,且有可能破坏蛋白质结构,致使其降解,从而降低了蛋白提取率[16]。因此,选择40%为最优超声振幅。
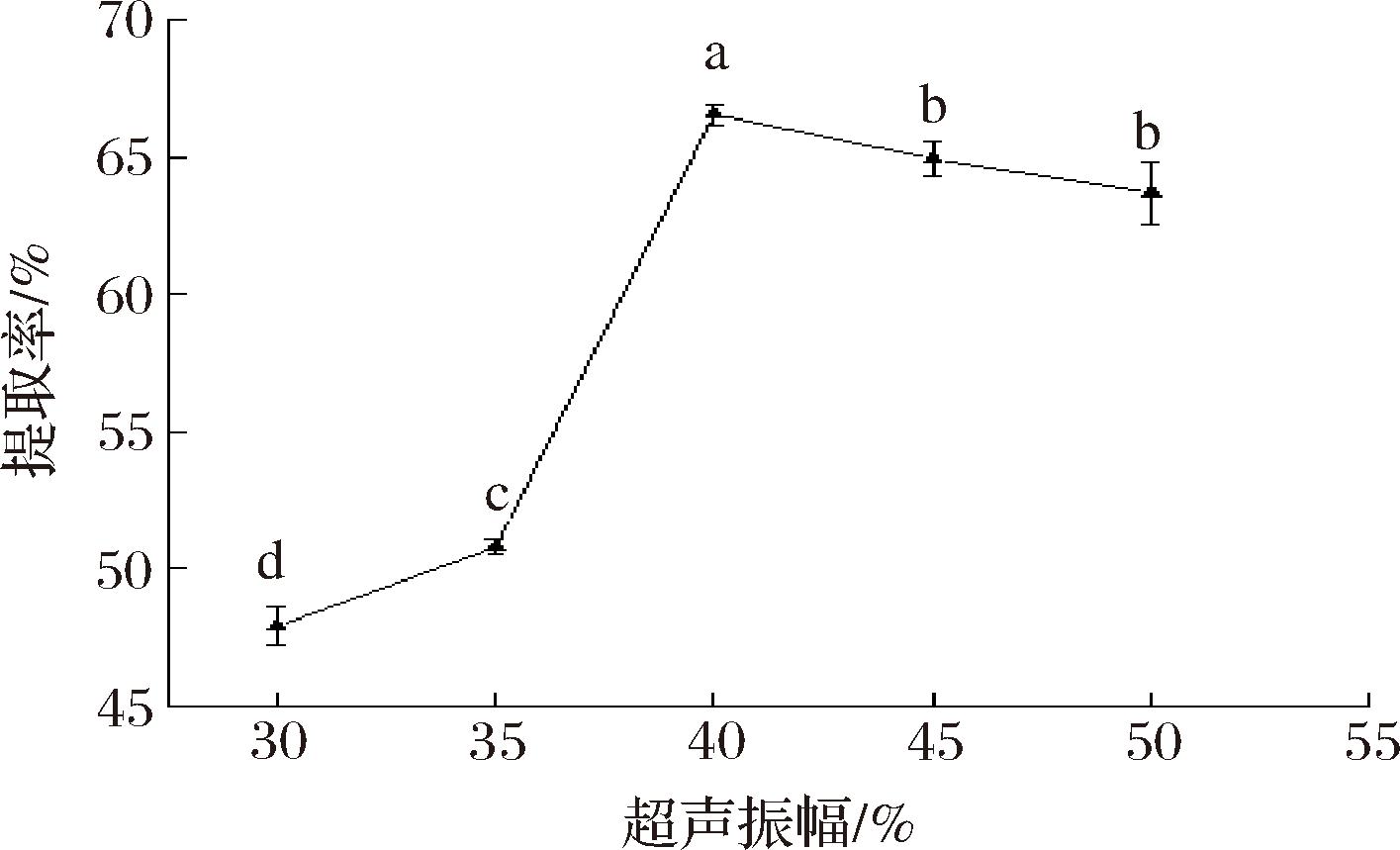
图5 超声振幅对文冠果种粕蛋白提取率的影响
Fig.5 Effect of ultrasound amplitude on the extraction rate ofXanthoceras sorbifolium Bunge seeds meal protein
2.1.6 超声时间对文冠果种粕蛋白提取率的影响
由图6可知,随着超声时间的延长,文冠果种粕蛋白提取率先升高后降低,在9~18 min差异不显著(P>0.05),15 min时达到最大;此后,随着超声时间的延长,蛋白提取率呈下降趋势。超声产生的空化作用可促使蛋白质分子结构变得松散,从而有利于可溶性蛋白的溶出,得到较高的蛋白提取率;超声时间较短时,溶剂未完全进入物料,可溶性蛋白得不到充分释放,提取率较低[16]。随着超声时间的延长,提取率迅速上升后趋于平缓,说明多数蛋白已溶出,延长超声时间对提取率的影响较小[22]。15 min后,继续延长超声时间,提取率下降,是因为超声持续时间过长,蛋白质分子间相互作用改变,内部疏水基团暴露出来,疏水残基相互作用形成网络结构,蛋白质难以溶出,蛋白提取率降低[21]。
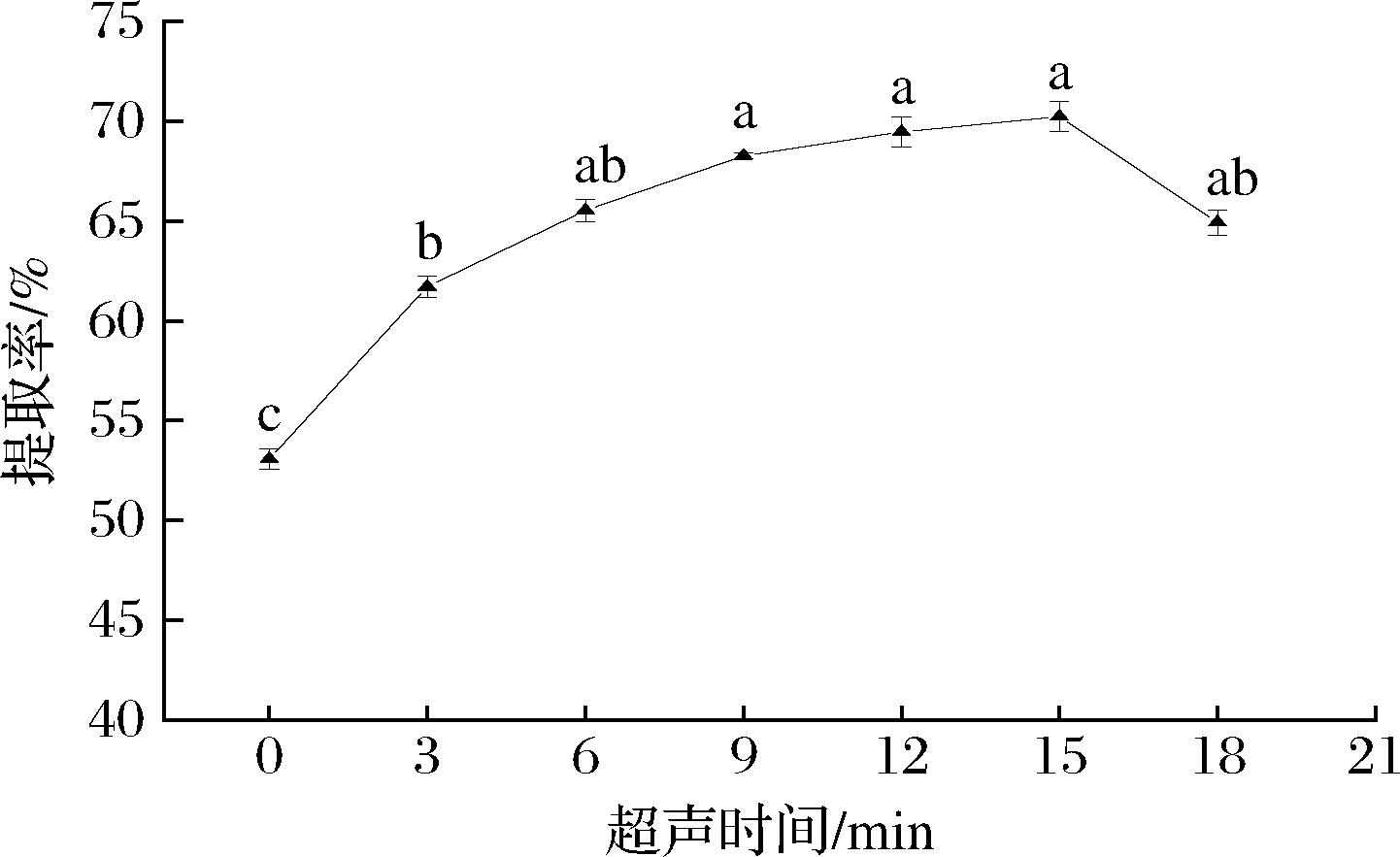
图6 超声时间对文冠果种粕蛋白提取率的影响
Fig.6 Effect of ultrasound time on the extraction rate ofXanthoceras sorbifolium Bunge seeds meal protein
2.2 文冠果种粕蛋白结构分析
2.2.1 SDS-PAGE分析
为了进一步评价超声处理时间对文冠果种粕蛋白结构及性质的影响,分析了不同超声时间下蛋白质样品的结构及性质,其SDS-PAGE电泳如图7所示,由图7可以看出,提取的文冠果种粕蛋白主要有两部分,其中含量最高的蛋白质分子质量集中在38 kDa,可见2个条带,为2种蛋白;另一部分分子质量约为25 kDa,有1个条带。另外,在分子质量为63 kDa附近出现系列较浅的条带。据报道,文冠果种子蛋白主要包含3个条带,分子质量分别为25.76、38.05、56.76 kDa,主要为谷蛋白和球蛋白[2,23]。由此可见,采用碱溶酸沉法提取的文冠果种粕蛋白主要为谷蛋白和球蛋白,而分子质量较大的醇溶蛋白较少。
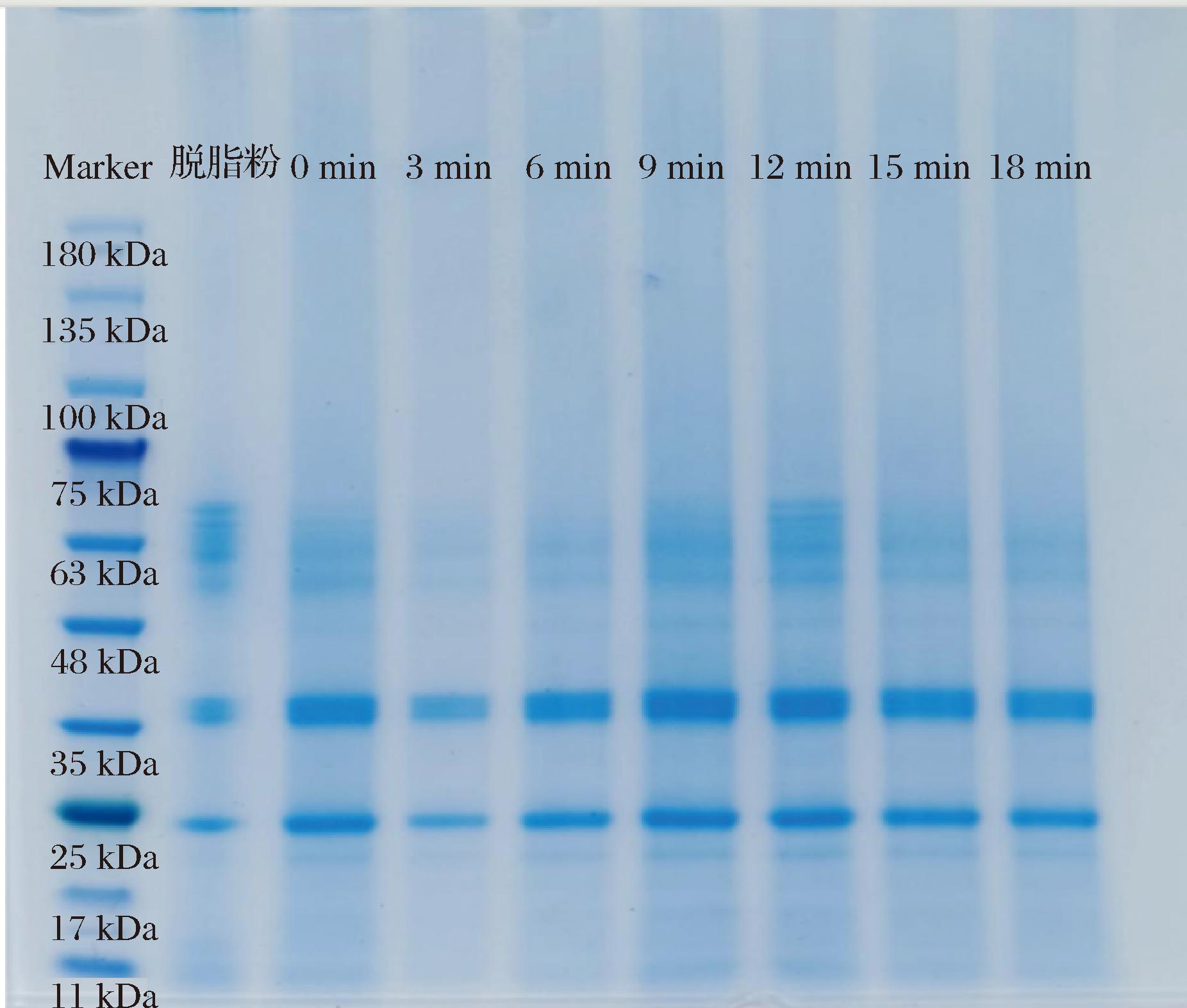
图7 不同超声时间下文冠果种粕蛋白的SDS-PAGE Fig.7 SDS-PAGE image of Xanthoceras sorbifolium Bunge seeds meal protein with different ultrasound time
随着超声处理时间的延长,分子质量为25、38 kDa处的条带颜色逐渐变深,在超声时间为9~12 min时颜色最深,说明此时蛋白质含量最高;之后,随着超声时间的延长,蛋白质条带变浅,与超声时间对蛋白质提取率的影响结果基本一致。由于超声的空化作用破碎了细胞,加速了蛋白质的溶出,使其提取率提高;超声时间过长,可导致蛋白质降解或与其他分子的交联,反而不利于蛋白质溶出[24]。
2.2.2 FTIR分析
不同超声时间处理下文冠果种粕蛋白的FTIR谱图如图8所示,其中3 277 cm-1附近的吸收峰为羟基伸缩振动、酰胺基团中的N—H的伸缩振动;2 921、2 851 cm-1附近的吸收峰为甲基、亚甲基中C—H的对称和反对称伸缩振动;1 750、1 632 cm-1附近处尖锐的吸收峰为酰胺Ⅰ带C![]() O伸缩振动;1 520、1 443 cm-1附近处为蛋白酰胺II带中N—H的弯曲振动;1 400、1 232 cm-1处吸收峰为酰胺Ⅲ带中C—N伸缩振动;1 050 cm-1处由C—O—C伸缩振动[25]。与未超声处理的蛋白质相比,随着超声时间在0~12 min内的延长,各特征峰变得尖锐,但没有明显的偏移,说明超声处理增加了蛋白质的溶出,使其部分基团暴露;当超声时间超过12 min时,部分特征峰透过率降低,说明样品中蛋白质可能出现降解或聚集,这与电泳实验结果一致。
O伸缩振动;1 520、1 443 cm-1附近处为蛋白酰胺II带中N—H的弯曲振动;1 400、1 232 cm-1处吸收峰为酰胺Ⅲ带中C—N伸缩振动;1 050 cm-1处由C—O—C伸缩振动[25]。与未超声处理的蛋白质相比,随着超声时间在0~12 min内的延长,各特征峰变得尖锐,但没有明显的偏移,说明超声处理增加了蛋白质的溶出,使其部分基团暴露;当超声时间超过12 min时,部分特征峰透过率降低,说明样品中蛋白质可能出现降解或聚集,这与电泳实验结果一致。
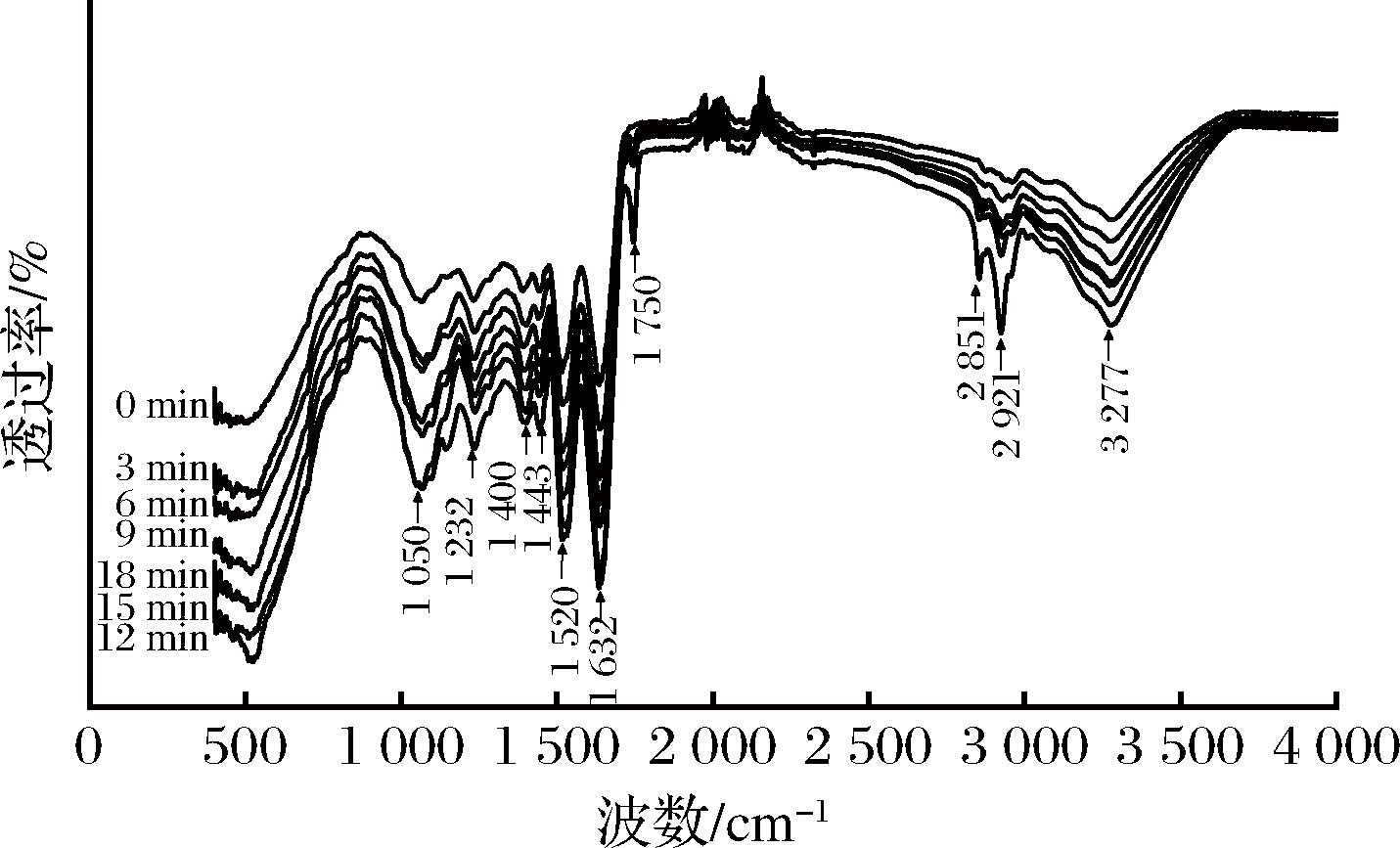
图8 不同超声时间下文冠果种粕蛋白的FTIR谱图
Fig.8 FTIR spectra of Xanthoceras sorbifolium Bunge seeds meal protein with different ultrasound time
2.2.3 荧光光谱分析
内源性荧光光谱法可以通过测定蛋白质中部分能产生荧光的氨基酸残基(色氨酸、酪氨酸、苯丙氨酸)来推测其构象的变化趋势,是表征蛋白质分子构象发生变化的手段[26]。不同超声时间处理后文冠果种粕蛋白的荧光光谱如图9所示。可以看出,文冠果种粕蛋白在298.8 nm处出现最大荧光强度,即最大发射波长为298.8 nm。样品的最大荧光强度随超声处理时间的延长呈降低的趋势,但最大发射波长未发生明显变化。超声3~9 min时,各样品最大荧光强度相近;超声12 min后,样品荧光强度下降明显。超声波产生的空化作用促使蛋白质溶出,结构改变,亲水基团暴露,从而荧光强度降低[27]。上述变化趋势与超声时间对蛋白质提取率的影响及电泳结果基本一致。
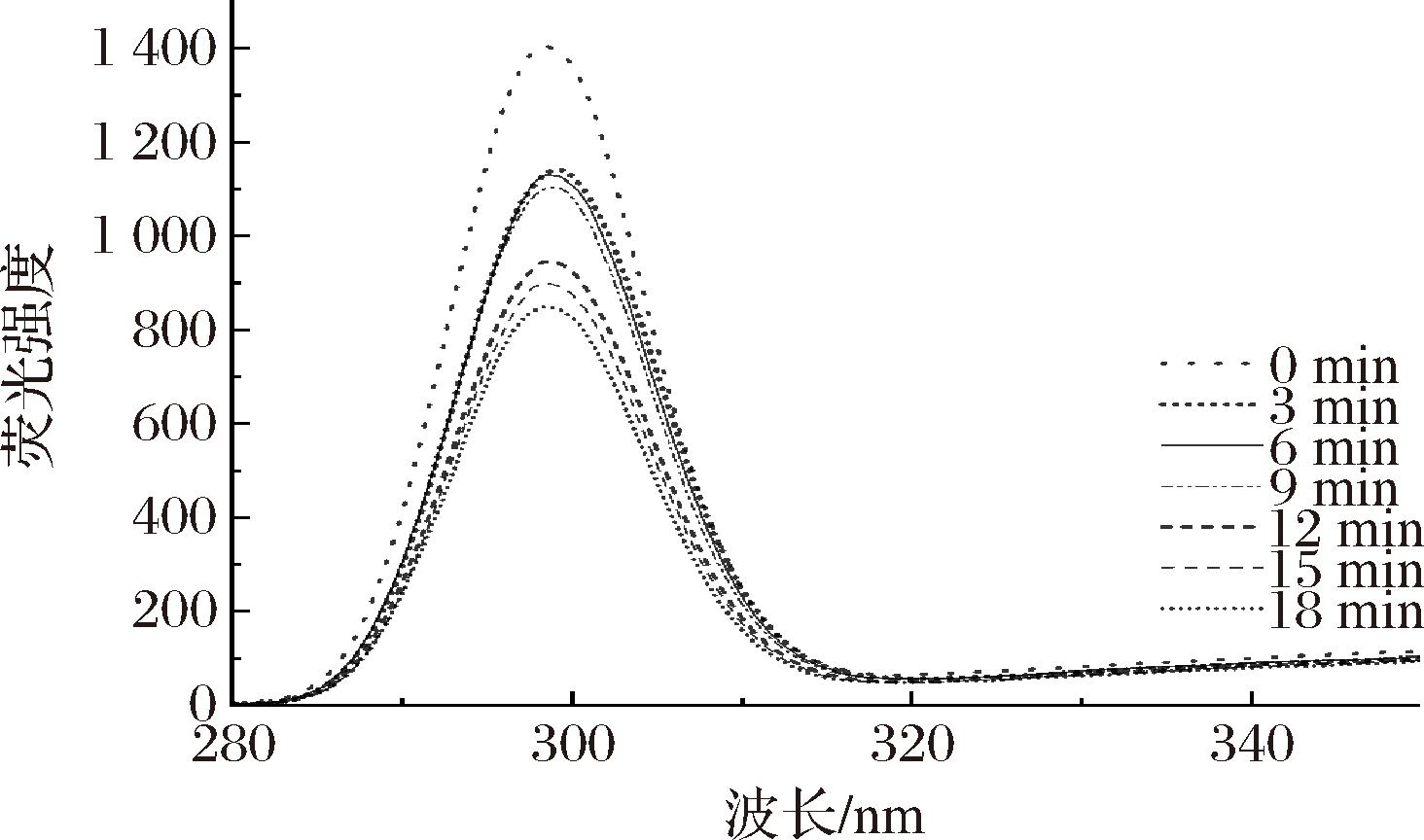
图9 不同超声时间下文冠果种粕蛋白的荧光光谱图
Fig.9 Fluorescence Spectra of Xanthoceras sorbifoliumBunge seeds meal protein with different ultrasound time
2.2.4 粒径与Zeta-电位分析
文冠果种粕蛋白经不同时间超声处理后的粒径和电位如图10所示。由图10-a可知,随着超声处理时间的延长,文冠果种粕蛋白的平均粒径迅速减小(P<0.05),之后随超声时间的延长变化不大(P>0.05)。经过12 min的超声处理后,蛋白的平均粒径从(1 026.73±14.76) nm降至(273.81±3.56) nm。文冠果蛋白的PDI与粒径变化趋势一致。超声处理6 min后,PDI均小于0.3,说明蛋白质粒度分布较为均匀。可见,6~18 min超声处理削弱了蛋白质的聚集,增大了其溶解性[28]。
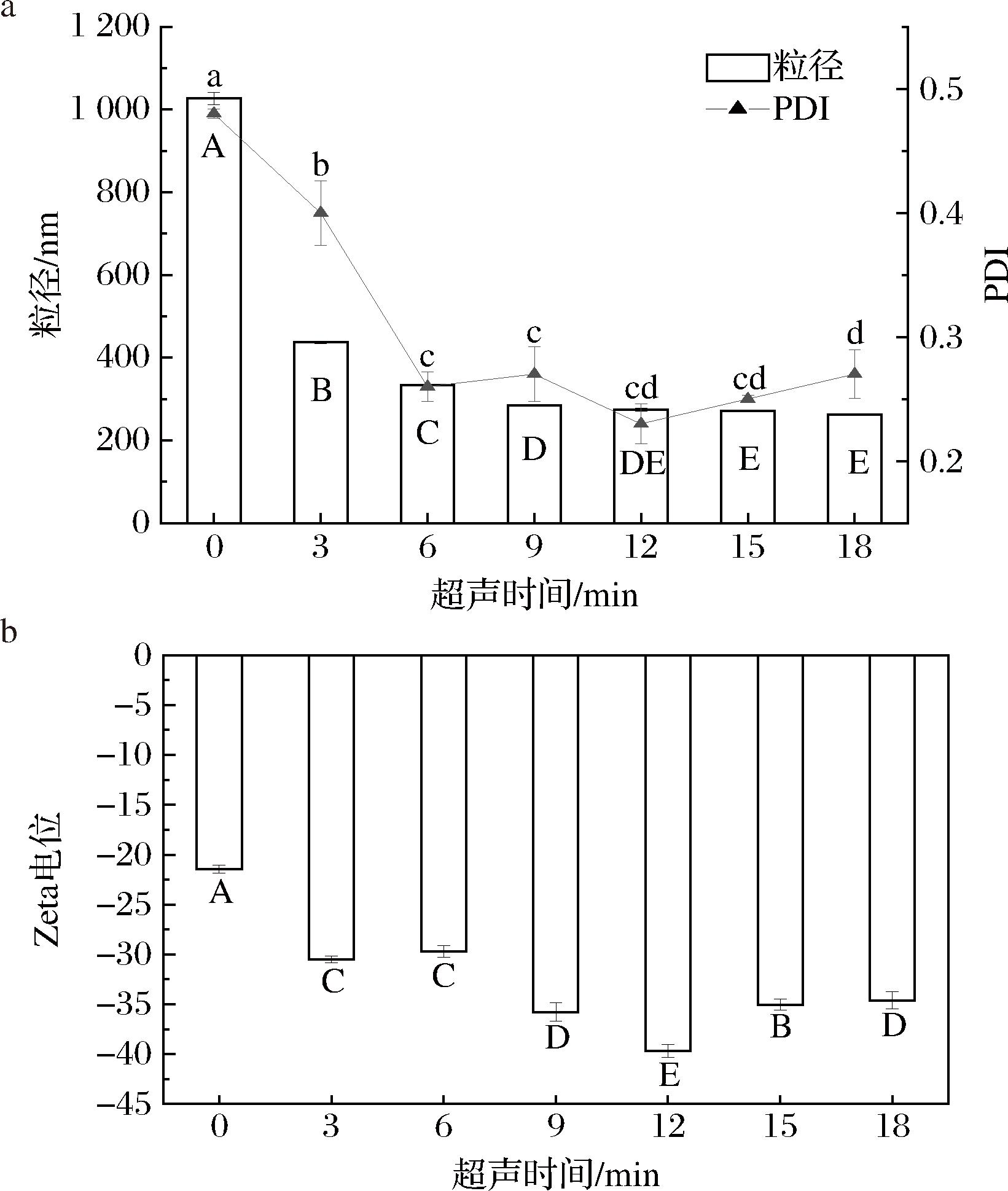
a-粒径;b-Zeta电位
图10 不同超声时间下文冠果种粕蛋白的粒径、PDI和Zeta电位
Fig.10 Particle size, PDI and Zeta-potential of Xanthocerassorbifolium Bunge seeds meal protein with different ultrasound time
由图10-b可以看出,文冠果种粕蛋白质样品的Zeta-电位为负,表明中性条件下蛋白表面净电荷为负值。当超声处理时间小于12 min时,蛋白质Zeta-电位的绝对值随超声时间的延长而增大,这是由于超声处理增大了蛋白质的提取率,削弱了蛋白质的聚集,使其带电基团充分暴露,负电荷增加,与荧光光谱分析结果一致;但是,超声时间超过12 min后,电位绝对值有所减小,这可能是由于过度超声导致蛋白降解或团聚,表面有效电荷减少[29]。蛋白质所带电荷越多,其稳定性越强,因此9~12 min超声处理有利于提高文冠果种粕蛋白的稳定性。
2.3 文冠果种粕蛋白功能性质分析
2.3.1 溶解性分析
蛋白质的溶解度可以反映蛋白质与水分子之间的水合能力,溶解度越高,水分子与蛋白质之间的水合能力越强,越有利于功能性质的发挥[30]。由图11可以看出,文冠果种粕蛋白的溶解性随超声处理时间的延长先上升后基本保持不变,在超声处理15 min后达到最大值(81.37±1.61)%,比未处理样品高12.57%。但当超声时间超过9 min后,溶解性变化不显著(P>0.05)。可见,9~15 min超声处理削弱了蛋白质的聚集,降低了蛋白质粒径,增大了蛋白质的负电荷,使其斥力增加,溶解性增大[31]。15 min后溶解性有所降低,可能是超声时间过长致使蛋白间发生了聚集,或与其他分子结合形成聚集物[32]。
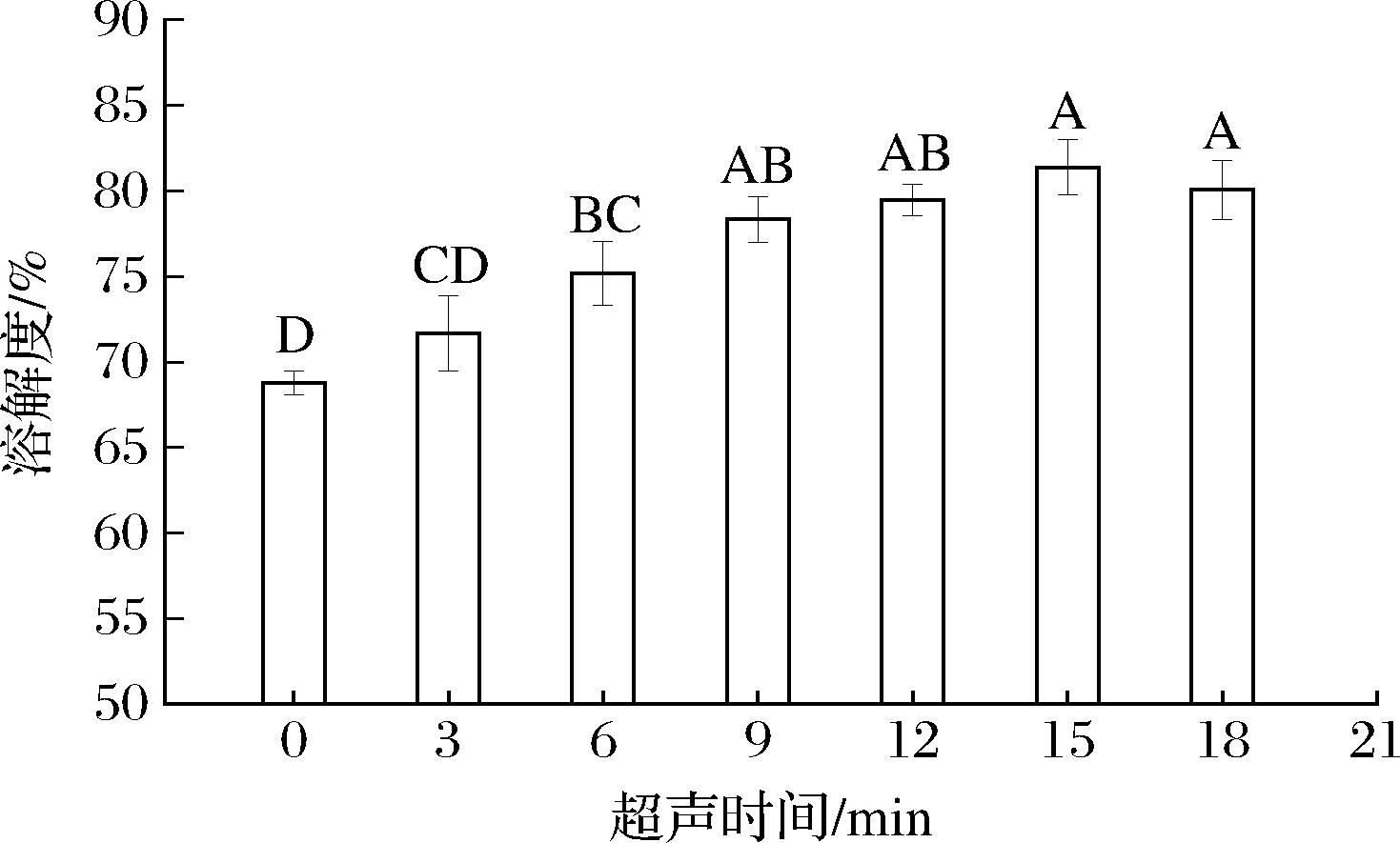
图11 不同超声时间下文冠果种粕蛋白的溶解性
Fig.11 Solubility of Xanthoceras sorbifolium Bunge seeds meal protein with different ultrasound time
2.3.2 发泡性分析
图12显示了超声处理时间对文冠果种粕蛋白发泡性和泡沫稳定性的影响。结果表明,发泡性随超声处理时间的延长先上升后趋于稳定,在15 min时发泡性达到最高值(56.16±0.20)%,与对照组相比提高了24.01%。超声产生的空化作用减少了蛋白质分子的聚集,使蛋白质疏松,溶解性增大,更容易吸附在气-水界面上,从而增加了蛋白质的发泡性[33]。文冠果种粕蛋白的泡沫稳定性则随时间的延长呈下降趋势,从(66.54±1.95)%下降到(62.38±0.99)%。蛋白质仅部分膨胀形成的泡沫比蛋白质完全膨胀形成的泡沫更稳定,完全膨胀的蛋白质形成的泡沫更容易由于空气膨胀而坍塌,从而降低了蛋白质在界面上的稳定性[34]。因此,超声处理时间过长,蛋白质结构伸展,溶解性增大,反而不利于泡沫的稳定。超声处理时间延长至12 min后,文冠果种粕蛋白发泡性和泡沫稳定性随超声时间的延长变化不显著(P>0.05),与溶解性测定结果一致。

图12 不同超声时间下文冠果种粕蛋白的发泡性及泡沫稳定性
Fig.12 Foaming property and foam stability of Xanthocerassorbifolium Bunge seeds meal protein with different ultrasound time
2.3.3 乳化性分析
乳化性是衡量蛋白质乳化能力的重要指标,乳化性越高,说明蛋白质能迅速吸附在油滴表面,形成油水界面;乳化稳定性指数则反映了蛋白质防止乳液分离的能力[35]。图13显示了不同超声处理时间对文冠果种粕蛋白乳化性和乳化稳定性的影响,可以看出,文冠果种粕蛋白的乳化性随着超声时间的延长先升高后降低。当超声处理15 min时,文冠果种粕蛋白的乳化性达到最大值(22.9±0.51) m2/g。乳化稳定性变化趋势与乳化性相似,在超声处理时间为12~18 min变化不显著(P>0.05)。这主要是因为超声作用促使文冠果种粕蛋白分子空间结构展开,粒径减小,溶解性增大,更多活性基团的暴露加速了蛋白质分子扩散到水油界面与油脂相互作用,形成稳定的网络结构,从而提高了蛋白的乳化性以及乳化稳定性[6]。
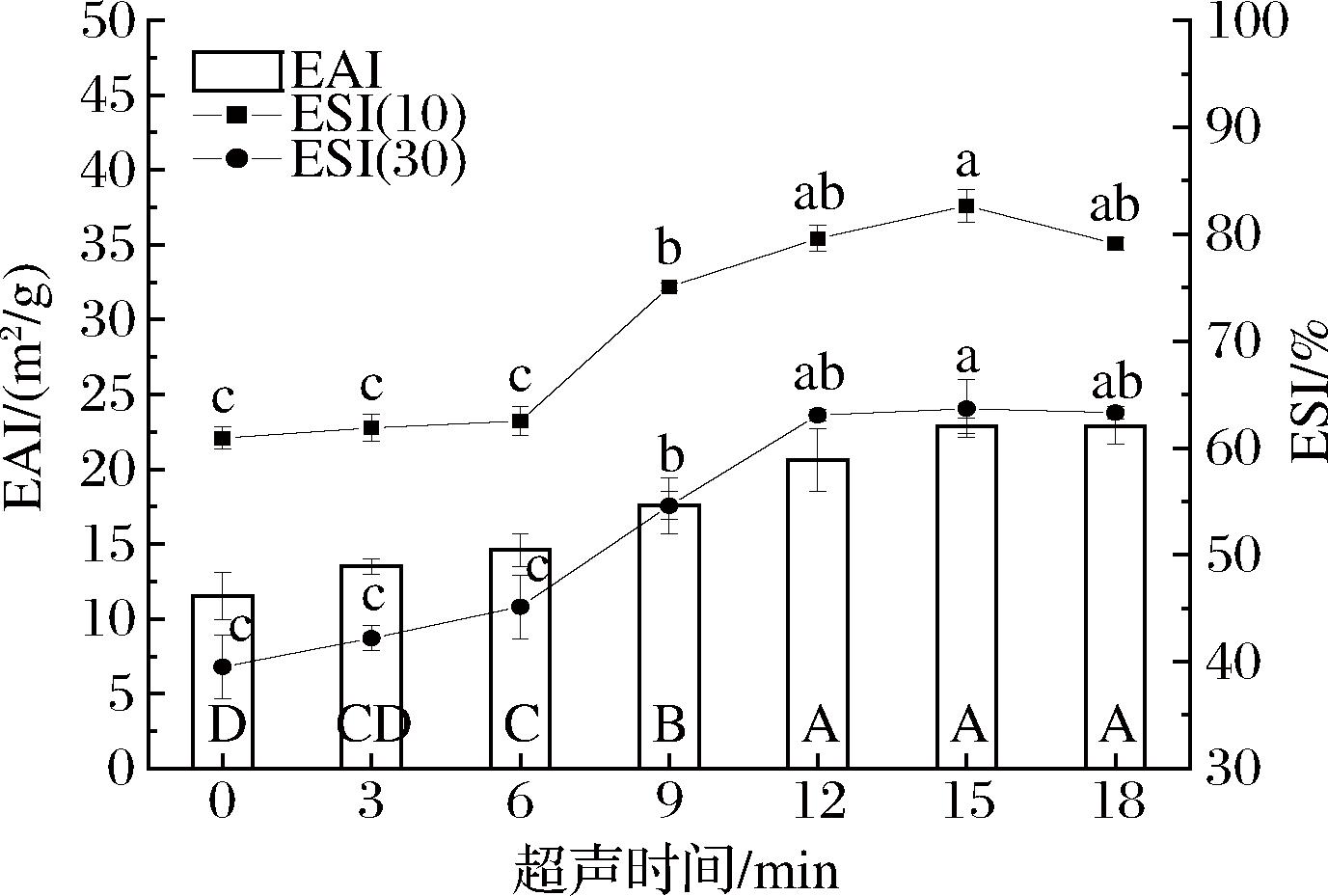
图13 不同超声时间下文冠果种粕蛋白的乳化性及乳化稳定性
Fig.13 Emulsifying property and emulsion stability of Xanthocerassorbifolium Bunge seeds meal protein with different ultrasound time
2.3.4 持水性和持油性分析
持水性和持油性是蛋白质在食品配方开发中的重要性质。蛋白质的持水性可影响食物的黏度,减少水分损失;持油性在改善食物的味道、风味和保质期方面非常重要[31]。如图14所示,文冠果种粕蛋白的持水性和持油性均随超声时间的延长先升高后下降,在超声15 min时达到最大值;其中持水性为(3.94±0.24) g/g,比未超声处理的蛋白质高27.5%;持油性为(3.01±0.01) g/g,比未超声处理高31.5%。这与蛋白质在该超声条件下具有最高溶解度(图11)有关。超声波处理会使蛋白质分子结构展开,粒径降低,提高了蛋白质的水、油结合能力[36]。

图14 不同超声时间下文冠果种粕蛋白的持水性及持油性
Fig.14 Water-holding capacity and oil-holding capacity ofXanthoceras sorbifolium Bunge seeds meal protein with different ultrasound time
3 结论
本文以文冠果种子榨油后的种粕为原料,采用碱溶酸沉法提取了蛋白质,系统分析了超声预处理时间对文冠果种粕蛋白结构及性质的影响规律,发现料液比1∶25、pH值为11、温度45 ℃、时间60 min、超声振幅40%、超声时间9~15 min条件下,蛋白质的提取率较高,可达到(78.87±0.59)%。当超声时间为0~12 min时,蛋白质粒径减小,负电荷增加,溶解性增大。当超声时间为15 min时,蛋白质的发泡性、乳化性、持水性和持油性均达到最大值。由此可见,9~15 min超声预处理可有效提高文冠果种粕蛋白质的提取率,并显著改善其功能性质。综上所述,超声预处理技术可用于辅助提取文冠果种粕蛋白,以有效改善其结构及性质。
[1] 徐春晖, 张芳荣, 陈方会, 等.响应面优化文冠果油超临界CO2脱酸工艺的研究[J].中国食品添加剂, 2023, 34(10):95-100.XU C H, ZHANG F R, CHEN F H, et al.Optimization of supercritical CO2 deacidification process of Xanthoceras sorbifolia Bunge oil by response surface methodology[J].China Food Additives, 2023, 34(10):95-100.
[2] 宋宏新, 刘娟, 薛海燕.文冠果种子蛋白质提取及组分分析[J].西北农业学报, 2018, 27(11):1645-1650.SONG H X, LIU J, XUE H Y.Protein extraction and composition analysis of Xanthoceras sorbifolia Bunge seeds[J].Acta Agriculturae Boreali-occidentalis Sinica, 2018, 27(11):1645-1650.
[3] AMPOFO J, NGADI M.Ultrasound-assisted processing:Science, technology and challenges for the plant-based protein industry[J].Ultrasonics Sonochemistry, 2022, 84(2):105955.
[4] 蔡路昀, 万江丽, 周小敏, 等.超声波技术在鱼类加工中的应用研究进展[J].食品科学技术学报, 2020, 38(2):114-120.CAI L J, WAN J L, ZHOU X M, et al.Advances in application of ultrasonic technology in fish processing[J].Journal of Food Science and Technology, 2020, 38(2):114-120.
[5] ZHU Z B, ZHU W D, YI J H, et al.Effects of sonication on the physicochemical and functional properties of walnut protein isolate[J].Food Research International, 2018, 106(4):853-861.
[6] 陈玉玉, 石梦梦, 王月琴, 等.超声对青稞蛋白理化性质和消化特性的影响[J].食品与发酵工业, 2024,50(8): 68-75.CHEN Y Y, SHI M M, WANG Y Q, et al.Effect of ultrasound on physicochemical properties and digestive characteristics of barley protein[J].Food and Fermentation Industries, 2024,50(8): 68-75.
[7] 贾明月, 贵香茹, 原秋艳, 等.不同提取方式对金针菇菇脚蛋白性质的影响[J].食品工业科技, 2024,45(8):119-126.JIA M Y, GUI X R, YUAN Q X, et al.Effect of different extraction methods on properties of Flammulina velutipes stembase proteins[J].Science and Technology of Food Industry, 2024,45(8):119-126.
[8] LI W Y, YANG H R, COLDEA T E, et al.Modification of structural and functional characteristics of brewer's spent grain protein by ultrasound assisted extraction[J].LWT, 2021, 139:110582.
[9] YAO S Y, LI W, WU Y, et al.The impact of high-intensity ultrasound-assisted extraction on the structural and functional properties of hempseed protein isolate (HPI)[J].Foods, 2023, 12(2):348.[10] 尚晖岚. 藏药小伞虎耳草化学成分和文冠果油粕蛋白质提取工艺及物理特性研究[D].兰州:兰州理工大学, 2020.SHANG H L. Study on the chemical constituents of Saxifraga parviflora and protein extraction technology and physical properties of Xanthoceras sorbifolia bunge oil meal [D]. Lanzhou: Lanzhou University of Technology, 2020.
[11] 郑杰, 杨敏, 甄晨波, 等.酪蛋白胶束与多元活性分子的相互作用及其复合物特性[J].食品科学, 2023, 44(14):8-19.ZHENG J, YANG M, ZHEN C B, et al.Interactions between casein micelles and various active molecules and properties of their complexes[J].Food Science, 2023, 44(14):8-19.
[12] 曾秋兵, 杨敏, 王裕成, 等.喷雾干燥工艺对胶束态酪蛋白结构及抗氧化性的影响[J].食品与发酵工业, 2020, 46(6):140-147.ZENG Q B, YANG M, WANG Y C, et al.Effect of spray-drying conditions on the structure and antioxidant activities of micellar casein[J].Food and Fermentation Industries, 2020, 46(6):140-147.
[13] ZHAO Y J, WEN C T, FENG Y Q, et al.Effects of ultrasound-assisted extraction on the structural, functional and antioxidant properties of Dolichos lablab L.protein[J].Process Biochemistry, 2021, 101:274-284.
[14] 牟全生, 杨敏, 王裕成, 等.脱脂牛乳体系中乳蛋白-葡萄糖美拉德反应程度及产物功能性质研究[J].食品工业科技, 2019, 40(12):1-6.MOU Q S, YANG M, WANG Y C, et al.Maillard reaction degree and product functional properties of proteins-glucose in skim milk system[J].Science and Technology of Food Industry, 2019, 40(12):1-6.
[15] YANG M, SHI Y, WANG P J, et al.Effect of succinylation on the functional properties of yak caseins:A comparison with cow caseins[J].Dairy Science and Technology, 2014, 94(4):359-372.
[16] 杨文敏, 杨冬, 任昊天.微波辅助提取巴旦木蛋白工艺优化及其功能性质研究[J].食品工业科技, 2021, 42(10):183-188.YANG W M, YANG D, REN H T.Microwave-assisted extraction technology and functional properties of protein from Amygdalus communis L.seed kernel[J].Science and Technology of Food Industry, 2021, 42(10):183-188.
[17] HE X F, WANG B, ZHAO B T, et al.Ultrasonic assisted extraction of Quinoa (Chenopodium quinoa Willd.) protein and effect of heat treatment on its in vitro digestion characteristics[J].Foods, 2022, 11(5):771.
[18] 曾琪, 胡淼, 王欢,等.pH值处理对黑豆分离蛋白结构、流变特性及乳化性能的影响[J].食品科学, 2020, 41(22):15-21.ZENG Q, HU M, WANG H, et al.Effect of pH treatment on structure, rheological properties and emulsifying properties of black bean protein isolate[J].Food Science, 2020, 41(22):15-21.
[19] 刘娟. 文冠果种子蛋白的提取及特性研究[D].西安:陕西科技大学, 2019.LIU J. Extraction, analysis and characteristics of Xanthoceras sorbifolia bunge seed protein[D]. Xi’an: Shaanxi University of Science &Technology, 2019.
[20] 王露露, 明佳佳, 杨涛, 等.基于神经网络和响应面法对比优化富硒绿豆芽蛋白提取工艺研究[J].食品与发酵工业, 2023,49(24):148-155.WANG L L, MING J J, YANG T, et al.Comparison and optimization of protein extraction from selenium-enriched mung bean sprouts based on an artificial neural network and a response surface method[J].Food and Fermentation Industries, 2023,49(24):148-155.
[21] HU G H, LI X T, SU R N, et al.Effects of ultrasound on the structural and functional properties of sheep bone collagen[J].Ultrasonics Sonochemistry, 2023, 95:106366.
[22] SUN X Y, ZHANG W, ZHANG L F, et al.Effect of ultrasound-assisted extraction on the structure and emulsifying properties of peanut protein isolate[J].Journal of the Science of Food and Agriculture, 2021, 101(3):1150-1160.
[23] 赵晨煊, 李瑞婷.文冠果油粕蛋白的分离及其酶解产物抗氧化性研究[J].农产品加工, 2020, 20(6):20-25.ZHAO C X, LI R T.Isolation of protein in oil meal of Xanthoceras sorbifolia Bunge and antioxidant activity of its enzymatic hydrolysates[J].Farm Products Processing, 2020, 20(6):20-25.
[24] 李颖畅, 师丹华, 赵淞民, 等.超声波辅助没食子酸对鲈鱼肌原纤维蛋白结构特性的影响[J].中国食品学报, 2023, 23(7):88-98.LI Y C, SHI D H, ZHAO S M, et al.Effect of ultrasound-assisted gallic acid on the structural properties of myofibrillar protein in sea bass[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(7):88-98.
[25] 刘容旭, 王语聪, 刘金阳,等.超高压辅助酶解对汉麻分离蛋白结构和抗氧化活性的影响[J].食品工业科技, 2024,45(4): 24-32.LIU R X, WANG Y C, LIU J Y Effects of ultra-high pressure assisted enzymatic hydrolysis on structure and antioxidant activity of hemp protein isolate[J].Science and Technology of Food Industry, 2024,45(4): 24-32.
[26] DONG Z Y, LI M Y, TIAN G, et al.Effects of ultrasonic pretreatment on the structure and functionality of chicken bone protein prepared by enzymatic method[J].Food Chemistry, 2019, 299(30):125103.
[27] XIONG T, XIONG W F, GE M T, et al.Effect of high intensity ultrasound on structure and foaming properties of pea protein isolate[J].Food Research International, 2018, 109:260-267.
[28] 叶钰, 高金燕, 陈红兵, 等.超声波加工对蛋清蛋白质结构和凝胶特性的影响[J].食品科学, 2018, 39(21):45-52.YE Y, GAO J Y, CHEN H B, et al.Effect of ultrasonic processing on protein structure and gel properties of egg white[J].Food Science, 2018, 39(21):45-52.
[29] 王子凌, 熊可心, 蒋景淳, 等.高强度超声处理时间对克氏原螯虾肌原纤维蛋白理化性质的影响[J/OL].食品科学, 2023.https://link.cnki.net/urlid/11.2206.TS.20230921.1327.032.WANG Z L, XIONG K X, JIANG J C, et al.Effect of high intensity ultrasonic treatment time on the physico-chemical properties of myofibrillar protein in Procambarus clarkia[J/OL].Food Science, 2023.https://link.cnki.net/urlid/11.2206.TS.20230921.1327.032.
[30] LI Y, XUE C Y, QUAN W, et al.Assessment the influence of salt and polyphosphate on proteinoxidation and Nε-(carboxymethyl)lysine and Nε-(carboxyethyl)lysine formation in roasted beef patties[J].Meat Science, 2021, 177(4):108489.
[31] KONG D W, HAN R W, YUAN M D, et al.Ultrasound combined with slightly acidic electrolyzed water thawing of mutton:Effects on physicochemical properties, oxidation and structure of myofibrillar protein[J].Ultrasonics Sonochemistry, 2023, 93:106309.
[32] 左硕静, 李逍燕, 刘晓涵,等.超声处理对牡蛎肌浆蛋白结构和溶解性的影响[J].食品研究与开发, 2023, 44(23):29-34;98.ZUO S J, LI X Y, LIU X H, et al.Effects of ultrasonic treatment on the structure and solubility of sarcoplasmic proteins from oyster[J].Food Research and Development, 2023, 44(23):29-34;98.
[33] 周欣雨, 佐兆杭, 王颖, 等.超声处理对芸豆蛋白理化性质及抗氧化能力的影响[J].食品工业科技, 2022, 43(20):107-112.ZHOU X Y, ZUO Z H, WANG Y, et al.Effects of ultrasound treatment on physicochemical properties and antioxidant ability of kidney bean protein[J].Science and Technology of Food Industry, 2022, 43(20):107-112.
[34] 康石花. 超声波处理对鹰嘴豆蛋白化学结构及功能特性的影响[D].石河子:石河子大学, 2022.KANG S H.Effect of ultrasonic treatment on chemical structure and functional properties of chickpea protein isolate[D].Shihezi:Shihezi University, 2022.
[35] 姚钢, 李冰, 孙福伟, 等.γ射线对胚芽米蛋白结构、乳化特性和食用品质的影响[J].食品科学技术学报, 2022, 40(2):62-71.YAO G, LI B, SUN F W, et al.Effects of γ-rays pretreatment on protein structure, emulsifying properties and edible quality of germ rice[J].Journal of Food Science and Technology, 2022, 40(2):62-71.
[36] 吴天昊,韩蕊,许志凌云, 等.超声改性蛋白对玉米淀粉凝胶结构及消化特性的影响[J].食品科学技术学报, 2022, 40(6):52-61.WU T H, HAN R, XU Z L Y, et al.Effect of ultrasonically modified protein on structure and digestive properties of corn starch gels[J].Journal of Food Science and Technology, 2022, 40(6):52-61.