乳糖不耐受症人群因对乳糖的胃痉挛及腹泻,限制了对乳制品的营养摄取[1]。β-半乳糖苷酶则可以有效降解乳制品中的乳糖,给乳糖不耐受症患者提供脱乳糖乳制品[2-3]。但是目前商用的游离乳糖酶却有种种不足,首先其最适反应温度往往仅有40 ℃,在工业生产中应用这种乳糖酶增加了乳制品生产过程中细菌污染的风险。其次游离乳糖酶具有稳定性差,最适pH偏酸性,无法重复利用等缺点。激烈热球菌来源的耐热乳糖酶(β-galactosidase,BgaS)最适pH值为7,最适温度在90 ℃,且具有优异的耐热稳定性[4],其相较于现存的商业化乳糖酶,使用该酶可以在乳制品生产过程中不降低温度,从而保证了最终产品的安全性,目前尚未有该酶在食品领域中应用的报道。
为了解决乳糖酶在乳制品生产中可重复利用率差的问题,酶固定化技术近年来引起了研究人员的重视。大量研究表示,采用材料固定化游离酶可以有效实现酶的高效分离,重复利用,并且对其耐热性、耐酸碱性和储藏稳定性都有所提高[5-7]。目前常见的固定化技术包括:吸附法、共价键结合法、交联法等。相较之下,吸附法固定酶分子的强度较低,酶分子易脱落,而共价键结合法虽然具有较高的稳定性但是成本较高且有可能造成酶分子活性的降低。交联法与上述两种方法相比,成本较低且能稳定阻止酶分子的泄露。目前交联法的常用载体为壳聚糖,其作为一种主要来源于甲壳动物外壳的碱性多糖,具有良好的生物相容性,且没有细胞毒性[8-10],目前作为酶固定化的一种主要材料已经引起了广泛关注。本实验对激烈热球菌来源的耐热乳糖酶采用生产安全菌株枯草芽孢杆菌WB800进行了异源表达,并采用壳聚糖微球为载体对其固定化。同时对固定化酶的酶学性质进行研究,旨在为其在生产脱乳糖牛奶的工业化应用提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
根据NCBI的报道,将编码BgaS(NCBI accession number:WP_011012349.1)的基因交由生工生物工程(上海)股份有限公司合成,并插入质粒pET24a(+),成功构建质粒pET24a-bgaS。本实验构建了大肠杆菌-枯草芽孢杆菌穿梭质粒pMA0911.1-bgaS及其对应的重组枯草芽孢杆菌WB800(pMA0911.1-bgaS)。其引物合成由生工生物工程(上海)股份有限公司完成见表1。宿主菌大肠杆菌DH5α、枯草芽孢杆菌WB800、质粒pMA0911.1均由本实验室保存。
表1 PCR引物
Table 1 PCR primer
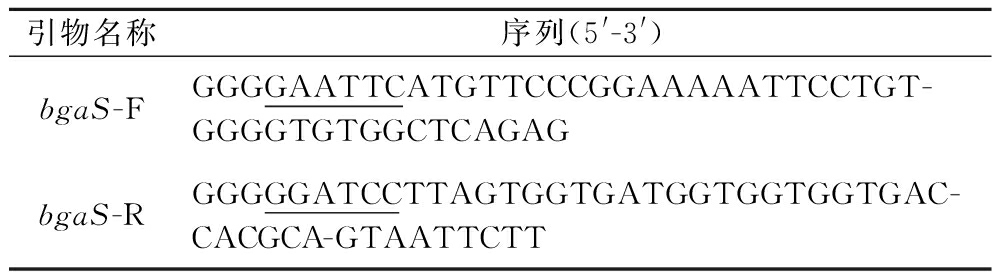
引物名称序列(5'-3')bgaS-FGGGGAATTCATGTTCCCGGAAAAATTCCTGT-GGGGTGTGGCTCAGAGbgaS-RGGGGGATCCTTAGTGGTGATGGTGGTGGTGAC-CACGCA-GTAATTCTT
1.1.2 培养基与化学试剂
LB培养基(g/L):蛋白胨10、NaCl 10和酵母提取物5,121 ℃灭菌20 min,用于重组菌株的培养。限制性核酸内切酶、T4 DNA连接酶、卡纳霉素、氨苄青霉素、酪蛋白氨基酸、改良型BCA蛋白浓度测定试剂盒,生工生物工程(上海)股份有限公司;琼脂糖凝胶回收试剂盒、质粒小量提取试剂盒,上海捷瑞有限公司。生牛乳,无锡天资乳业有限公司。邻硝基苯-β-D-半乳糖苷(2-nitrophenyl β-D-galactopyranoside,ONPG),上海阿拉丁生物股份有限公司;葡糖糖、MgSO4、CaCl2、硫代硫酸钠、壳聚糖、Na2HPO4、NaH2PO4、醋酸钠、无水碳酸钠,国药集团化学试剂有限公司;邻硝基苯酚,北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AR224CN型电子天平,奥豪斯仪器(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器,郑州豫华仪器制造有限公司;HL-2B型数显恒流泵、DBS-100自动部分收集器,上海沪西分析仪器厂;ZQZY-70B振荡培养箱,上海知楚仪器有限公司;Synergy H1多功能酶标仪,美国伯腾仪器有限公司;PB-10型pH计,德国赛多利斯股份有限公司;AKTA蛋白纯化系统,美国思拓凡公司。
1.3 实验方法
1.3.1 重组菌株构建
为了实现BgaS在枯草芽孢杆菌中的异源表达,本实验构建了大肠杆菌-枯草芽孢杆菌穿梭质粒pMA0911.1-bgaS。其构建过程如图1所示,首先通过PCR扩增的方法从载体pET24a-bgaS中得到C端带有6×His-tag的编码耐热乳糖酶BgaS的基因,并引入两端新的酶切位点。随后通过限制性位点插入到大肠杆菌-枯草芽孢杆菌穿梭质粒pMA0911.1的EcoR Ⅰ-BamH Ⅰ之间,成功构建pMA0911.1-bgaS。
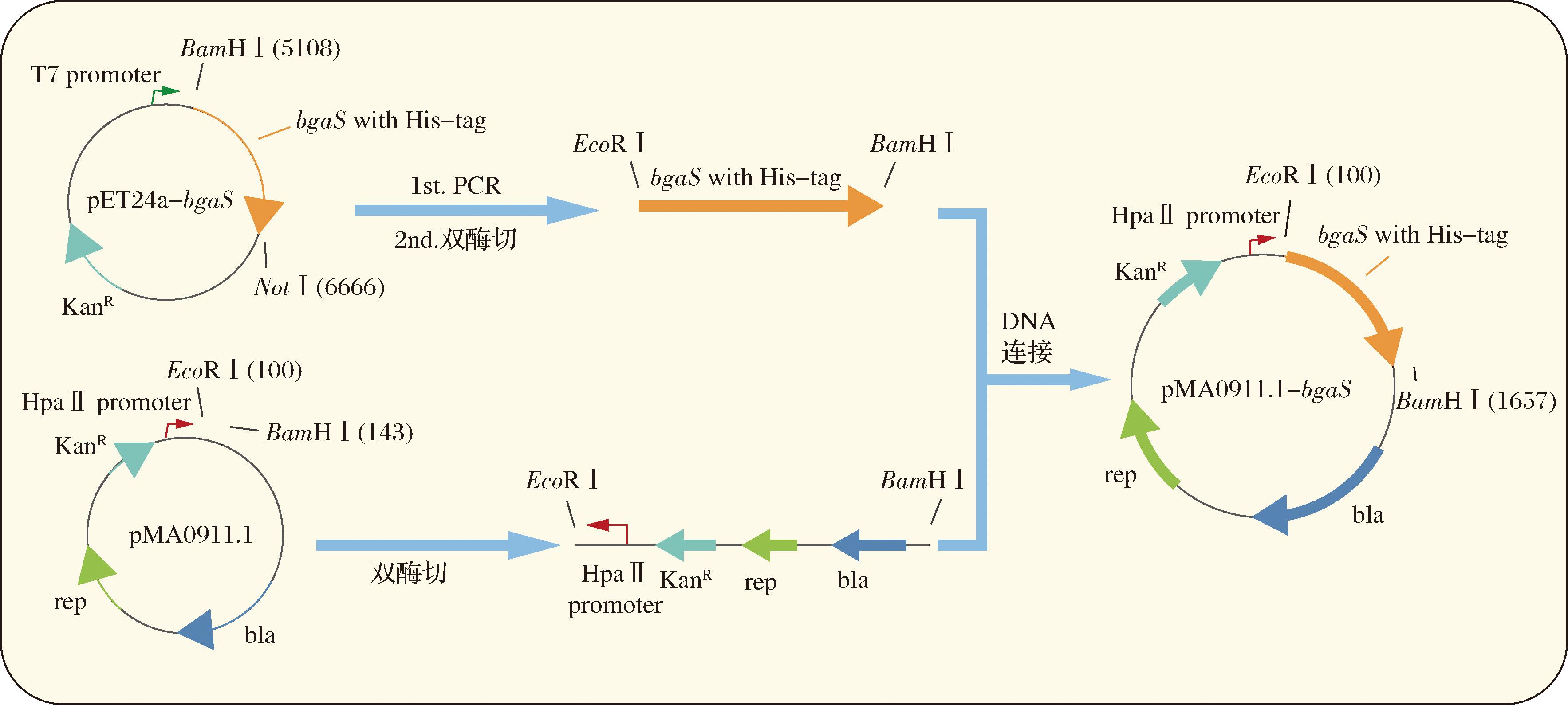
图1 重组质粒构建示意图
Fig.1 Scheme of recombinant plasmid construction
随后采用SPIZIZEN[11]的方法将其导入枯草芽孢杆菌WB800中,挑取阳性转化子接入带有卡那霉素抗性的LB液体培养基中过夜培养,抽提质粒。使用EcoR Ⅰ-BamH Ⅰ进行双酶切验证,验证成功后,将菌液送上海生工公司测序,保存测序结果正确的重组菌。
1.3.2 诱导表达与纯化
挑取验证成功的重组菌,接种到卡那霉素终质量浓度为50 μg/mL的LB培养液中,37 ℃,200 r/min,过夜培养,以1.0%(体积分数)的接种量转接至卡那霉素终质量浓度为50 μg/mL的500 mL LB培养基中进行表达。37 ℃,200 r/min培养20 h。管式离心机收集湿菌体后,生理盐水洗涤1次,使用pH值为7的磷酸缓冲液重悬菌体,使菌液质量浓度控制在100 mg/mL。按300 W,工作1 s,停2 s的破胞条件进行超声破胞15 min。随后12 000 r/min,4 ℃离心20 min,将上清液收集并在4 ℃下保存。取上述上清液进行SDS-PAGE蛋白验证。收集上述成功表达的破胞上清液通过蛋白纯化仪进行镍柱纯化。通过BCA蛋白浓度试剂盒测试纯酶液蛋白浓度。
1.3.3 壳聚糖微球合成
取一定量的壳聚糖粉末,使用体积分数1.5%乙酸作为溶剂,制备不同浓度的壳聚糖溶液。将这些溶液在磁力搅拌下混合,然后静置过夜,以确保壳聚糖充分溶解,形成无气泡均匀的溶液。配制好的壳聚糖溶液通过针筒逐滴滴加到等体积的1 mol/L NaOH和甲醇混合液(3∶1,体积比)中,从而形成壳聚糖凝胶微球。随后,将这些球体进行过滤,然后用去离子水反复洗净壳聚糖凝胶微球至中性。最后,将得到的微球保存在4 ℃的去离子水中,以备后续使用。
1.3.4 壳聚糖微球表征
通过扫描电镜对载体材料壳聚糖微球(CM)进行表征。取适量样品,粘到导电胶上,将胶带固定在样品台上,吹扫、涂抹均匀后,放入真空样品室进行分析。
1.3.5 乳糖酶固定化效率评价
使用分光光度法(GB/T 33409—2016)来检测酶活力。规定在合适反应条件下,每分钟催化邻硝基苯-β-吡喃半乳糖苷生成 1 μmol邻硝基苯酚所需的酶量定义为一个酶活力单位(U)。本试验以酶活力回收率和相对酶活为评价乳糖酶固定化的指标,具体计算如公式(1)、公式(2)所示:
酶活力回收率![]()
(1)
相对酶活力![]()
(2)
1.3.6 乳糖酶固定化条件优化
取上述凝胶微球,干燥去除多余水分,然后选用不同质量浓度的戊二醛溶液结合干燥的壳聚糖凝胶微球,室温180 r/min振荡反应交联一段时间,凝胶微球与戊二醛溶液按载体1∶10(g∶mL)溶液的比例混合,活化完全后用去离子水反复冲洗,得到壳聚糖凝胶微球戊二醛结合的产物或称载体。将载体浸入一定酶添加量的BgaS溶液中,于不同温度下固定化6 h。完成固定化后,过滤弃上清液,用pH值为7.0醋酸钠缓冲液洗涤固定化酶,至洗出液无酶残留,测试不同条件下的酶活力回收率。为了进一步提高固定化效率,以固定化酶的酶活力回收率为评价指标,对戊二醛质量浓度(5.3~37.1 g/L),交联温度(15~45 ℃),交联时间(1~4 h),酶添加量(1.98~9.90 U/mL)进行单因素试验,确定最佳固定化条件。
1.3.7 固定化乳糖酶的酶学性质
以ONPG为底物,分别在pH值范围5.0~8.0及梯度温度(75~100 ℃)下同时测试游离酶和固定化的相对酶活力,确定其各自最适反应温度及pH。
随机挑选1 g均匀饱满的固定化乳糖酶,将其分别在110、95、80、65 ℃下孵育一段时间。每30 min测试一次相对酶活力并与对应的游离酶对比,确定固定化乳糖酶的耐热性。
以10 mL生牛乳为底物,向反应体系中投入1 g大小均匀,颗粒饱满的固定化酶,于90 ℃恒温水浴中搅拌反应20 min,过滤回收固定化酶。使用37 ℃蒸馏水冲洗去除牛乳残留,再用磷酸盐缓冲液充分洗涤3遍,重复测试多次,以每次反应后的相对酶活力为指标,评价其重复利用率。选取约50颗形貌良好的固定化酶,将其投入20 mL牛乳中,90 ℃恒温水浴条件下搅拌反应3 h。过滤回收微球颗粒,并用磷酸盐缓冲液洗涤3次以后,观察微球形貌是否有破裂,评价其机械操作稳定性。采用赖-布二氏(Lineweaver-Burk)法[12]测定酶的表观动力学常数Km,以不同浓度ONPG为底物,加入等量酶稀释液,摇匀后在90 ℃水浴中准确保温10 min,测定其OD420值来测定其反应速度,计算酶的米氏常数Km。
1.3.8 乳糖降解能力验证
将10 g固定化酶投入含有100 mL牛乳的反应釜中,在最适条件下搅拌反应,用以模拟搅拌式反应器。采用碘量法[13]测定水解前后的乳糖含量。并对比与其相应的游离酶(75 mg)的乳糖水解能力。
2 结果与分析
2.1 pMA0911.1-bgaS琼脂糖凝胶电泳结果分析
使用EcoR Ⅰ-BamH Ⅰ对重组质粒进行双酶切并进行琼脂糖凝胶电泳验证,结果如图2所示,酶切得到的两条条带分别在1 551 bp和5 285 bp左右,双酶切后获得的2个条带大小分别符合载体质粒pMA0911.1和基因bgaS的预期大小。测序结果也与预期结果一致,证明重组质粒构建成功。
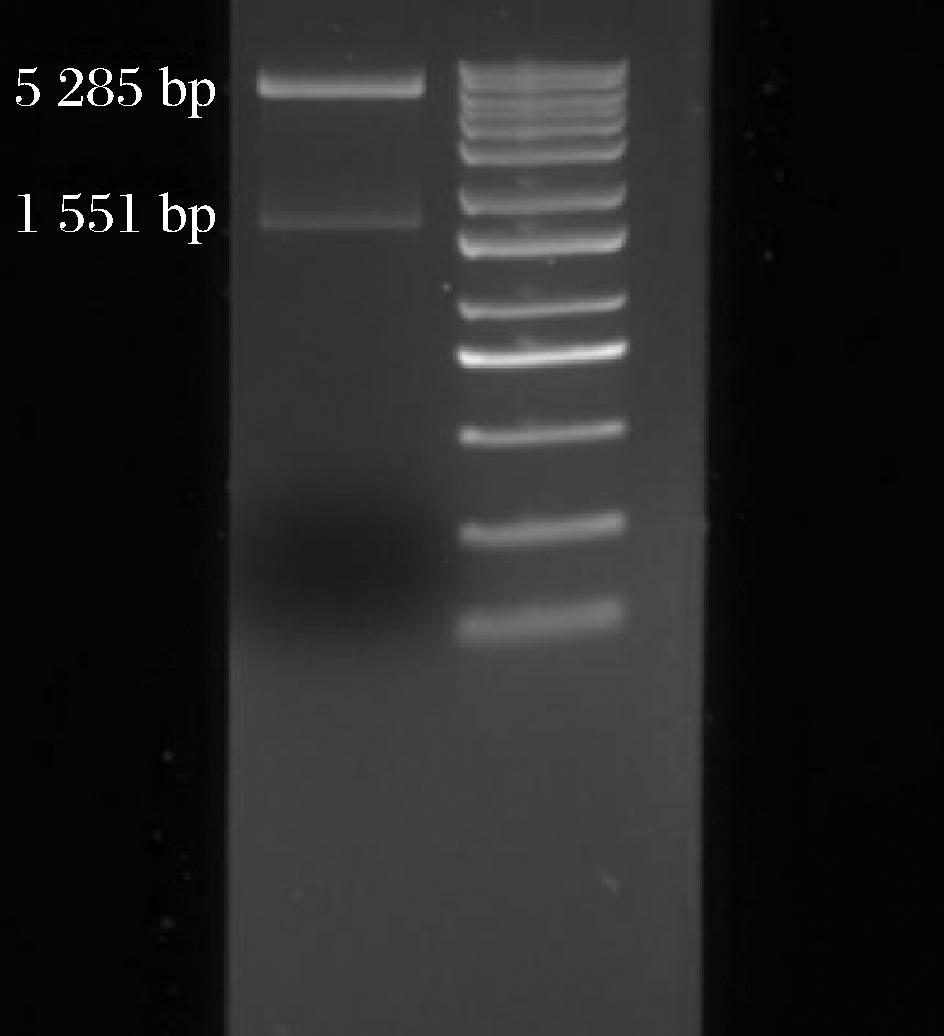
左:质粒pMA0911.1-bgaS的双酶切验证(EcoR Ⅰ-BamH Ⅰ);右:marker
图2 琼脂糖凝胶电泳验证图
Fig.2 Result of agarose gel electrophoresis
2.2 游离乳糖酶SDS-PAGE结果验证
通过图3的SDS-PAGE结果分析,明确看到重组枯草芽孢杆菌WB800(pMA0911.1-bgaS)的破胞上清液和纯化液在60 kDa左右有明显条带,与目的蛋白的分子质量大小一致,尽管空白对照在该位置也有类似条带,但是明显可以看到重组枯草芽孢杆菌WB800(pMA0911.1-bgaS)的破胞上清液更加明显,因此证明耐热乳糖酶BgaS成功在枯草芽孢杆菌内实现可溶性表达。L5为粗酶液经过镍柱纯化后的BgaS,可以看到与L2对应位置相同且与理论大小一致,测得蛋白质量浓度为0.75 mg/mL,酶活力为5.94 U/mL。纯化后的纯酶液将用作后续的固定化。
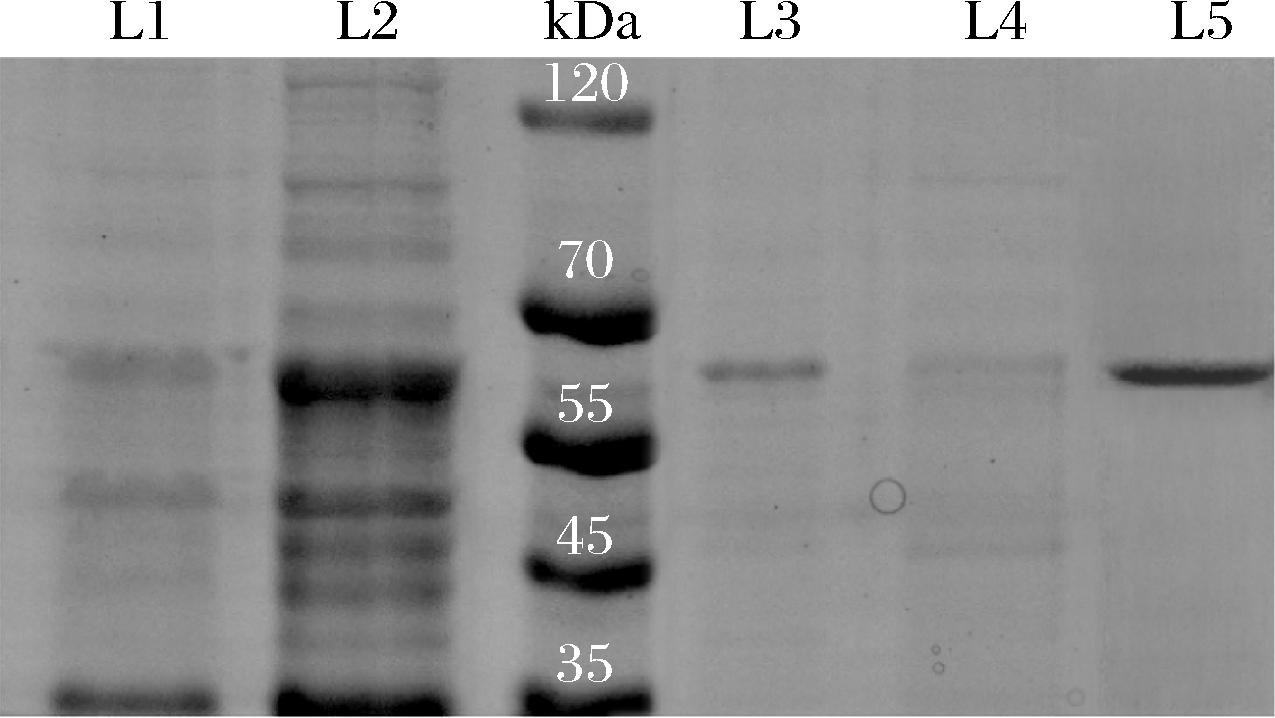
泳道L1、L2分别为重组枯草芽孢杆菌WB800 (pMA0911.1-bgaS)的破胞沉淀和破胞上清液;泳道L3、L4分别为枯草芽孢杆菌空白对照的破胞沉淀和破胞上清液;泳道L5为镍柱纯化后的纯酶液,目的蛋白分子质量均约为60 kDa
图3 重组枯草芽孢杆菌WB800的SDS-PAGE图
Fig.3 SDS-PAGE analysis of the recombinant Bacillus subtilis WB800
2.3 邻硝基苯酚标曲测定
首先制备7个不同梯度浓度的邻硝基苯酚(O-nitrophenol,ONP)溶液(0.02~0.14 mmol/L)。以去离子水作为空白,使用1 cm的石英比色皿,测定了每个稀释液在420 nm波长处的吸光度。每个浓度值都进行3次重复测试。然后,以邻硝基苯酚的浓度作为横坐标,以吸光度的平均值作为纵坐标,绘制了标准曲线(图4)。
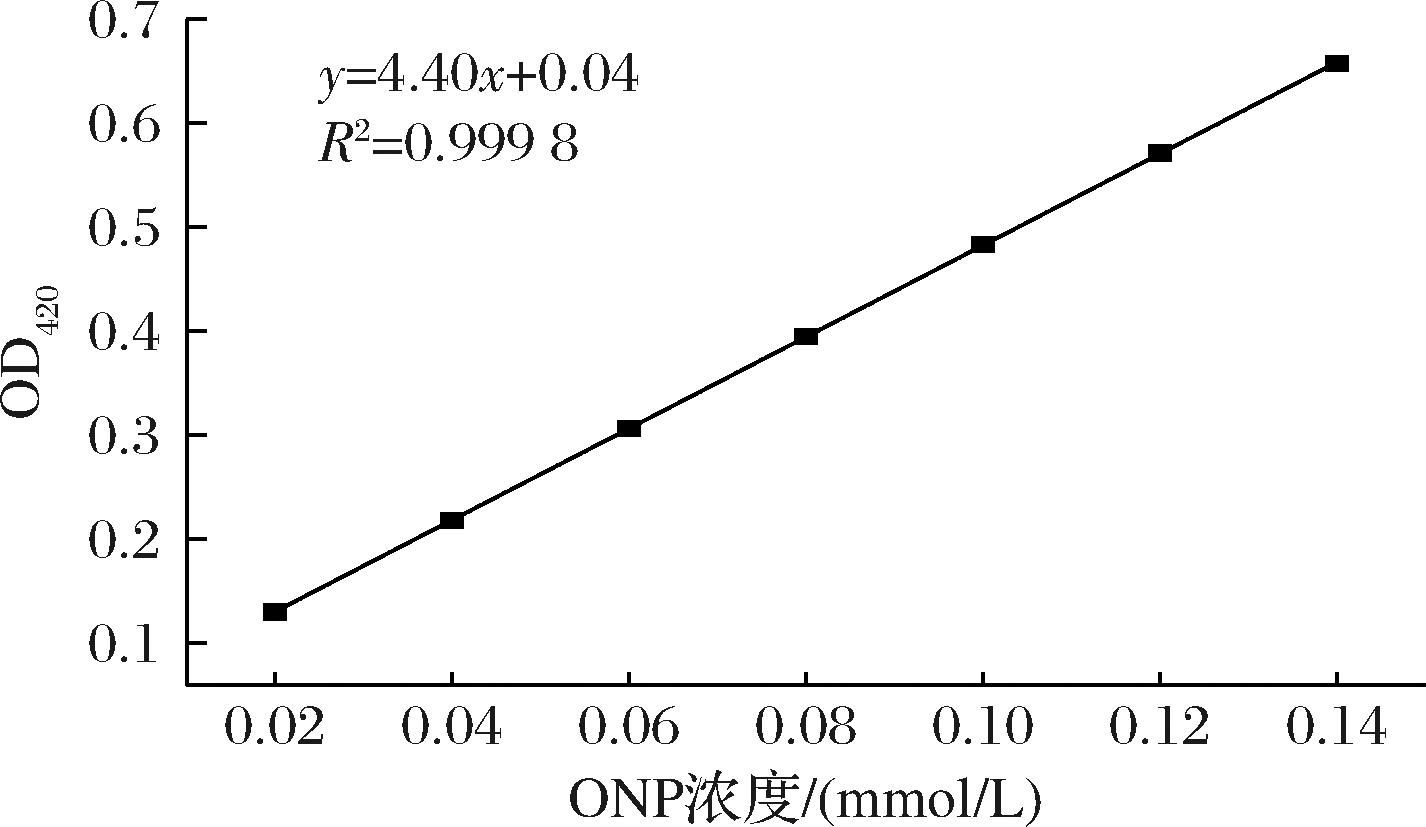
图4 ONP标准曲线
Fig.4 Standard curve of ONP
2.4 壳聚糖微球构建结果及表征
2.4.1 壳聚糖微球构建条件优化
不同质量浓度的壳聚糖对材料的成球效果影响不同,根据表2可以看到,当壳聚糖质量浓度过低的时候,材料无法成球。而当壳聚糖质量浓度升高到0.04 g/mL的时候,成球效果最好。综合考虑,确定壳聚糖质量浓度为0.04 g/mL。
表2 壳聚糖质量浓度对成球效果的影响
Table 2 Effect of chitosan concentration on spherification efficiency

壳聚糖质量浓度/(g/mL)成球效果0.01不易成球0.02可以成球,形状不规则,有拖尾0.03可以成球,形状不规则,有拖尾0.04易成球,形状规则,无拖尾
2.4.2 扫描电子显微镜(scanning electron microscope, SEM)结果分析
图5-a为壳聚糖微球在常规摄像机拍摄下的状态,图5-b为壳聚糖微球的SEM图,由下图可知,制成的壳聚糖微球形貌规整,球形较好,表明壳聚糖微球具有良好的机械强度和球形度。

a-壳聚糖微球;b-壳聚糖微球SEM结果(×1 000)
图5 壳聚糖质量浓度对成球效果的影响
Fig.5 Effect of chitosan concentration on spherical formation
2.5 乳糖酶固定化条件优化
2.5.1 交联最适戊二醛质量浓度确定
戊二醛作为交联剂,会分别和壳聚糖和酶分子的氨基发生醛胺缩合反应,从而在壳聚糖的表面固定酶分子。由图6-a所示,可知随着戊二醛质量浓度的提升,固定化酶活力回收率逐渐上涨达到52.01%。但是当戊二醛质量浓度超过26.50 g/L的时候,酶活力回收率反而下降,这可能是因为过高的戊二醛质量浓度聚合了溶液中的其他物质,从而导致了杂质与载体结合,继而导致了酶活力回收率的下降[14],而相对酶活力的变化同酶活力回收率的变化趋势相同,推测应该是回收率的变化导致了相对酶活力的改变。因此最终确立戊二醛的质量浓度为26.50 g/L。
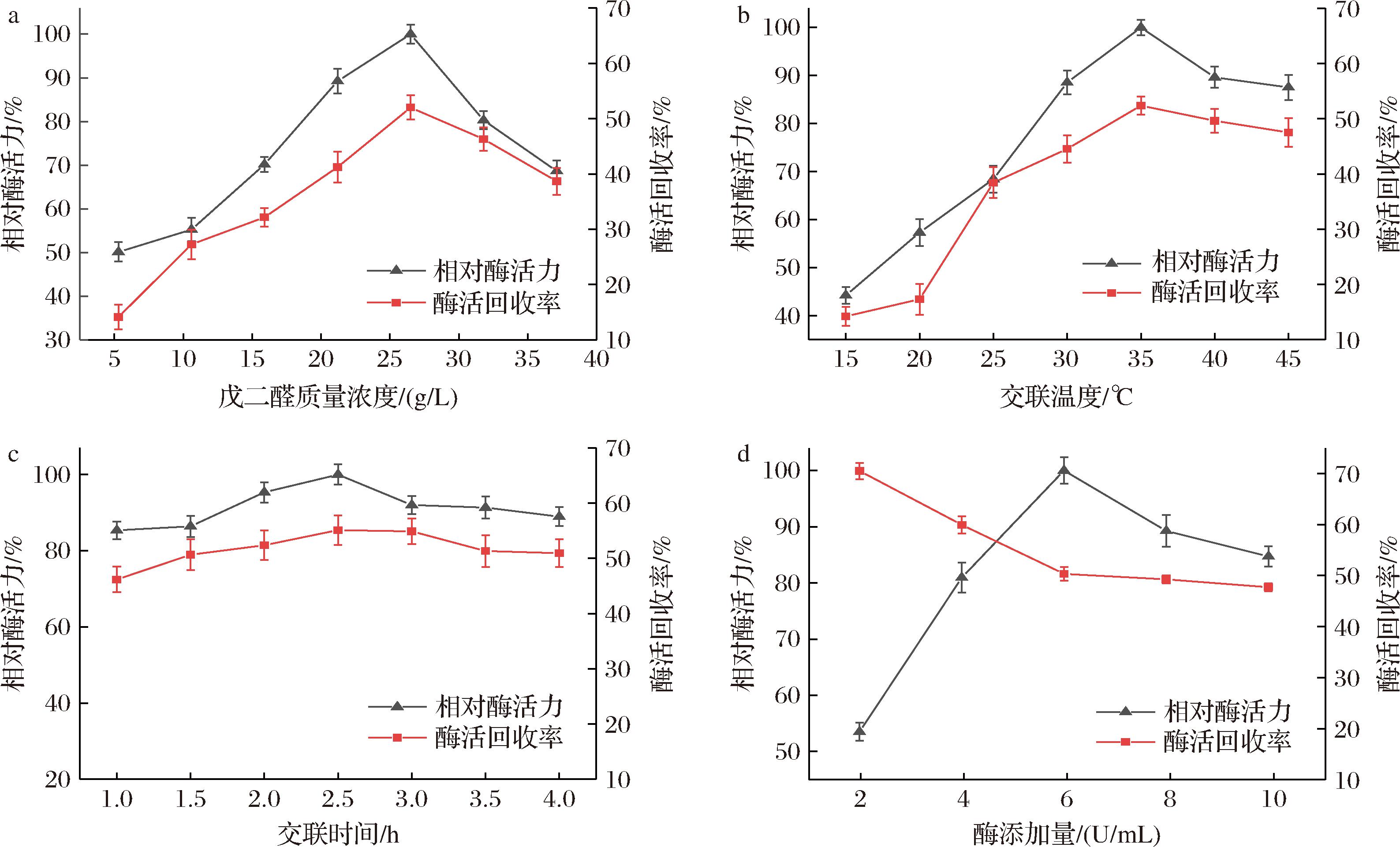
a-戊二醛质量浓度;b-交联温度;c-交联时间;d-酶添加量
图6 不同交联条件对交联效果的影响
Fig.6 Effect of various cross-linking conditions on cross-linking efficiency
2.5.2 交联最适温度确定
如图6-b所示,在15~20 ℃,由于温度过低导致交联反应中的戊二醛分子没有被充分激活,导致固定化的酶量较少,而随着温度的升高,戊二醛与壳聚糖和酶分子的醛胺缩合反应效率逐渐提高,固定化酶活力提高,当温度达到35 ℃时达到顶点,随后稍有下降,这可能是由于载体的结合位点已经达到饱和而进一步提高温度则导致酶分子的聚集与堆积从而影响酶活力回收率和相对酶活力。
2.5.3 交联最适时间确定
如图6-c所示,在交联时间较短的情况下,交联剂与载体的反应不充分,从而导致载体表面的能与酶分子结合的位点较少,酶活力相对较低。而随着交联的进行,酶分子的含量逐渐提升,其活力又略有下降,这可能是由于酶分子的堆积所导致的。不过可以看到整体而言,交联时间与酶活力回收率的对应曲线变化比较平稳,推测可能是因为在1 h左右交联反应就已经趋近于饱和,而在2.5 h时达到最大,而相对酶活力的变化也佐证了这一假设。
2.5.4 交联最适酶量确定
由图6-d所示,虽然随着酶添加量的上升,酶活力回收率逐步下降,但是相对酶活力则逐步上升,推测这是由于在初始阶段,体系中酶分子较少,所以载体能够交联较多比例的酶分子,而随着载体的逐渐饱和。进一步的增加酶量则可能导致载体上酶分子之间相互堆积,从而影响了其活性位点与底物的接触继而使得相对酶活力下降[15]。因此最终确立酶分子的添加量为5.94 U/mL。
2.6 固定化乳糖酶的酶学性质
2.6.1 固定化乳糖酶的最适pH、温度及其耐热性测试
由图7-a可知,游离酶和固定化酶的最适pH值都是7,而在非中性环境中的时候,由于酶分子与壳聚糖微球的结合提升了酶分子的刚性从而保护酶在不同pH的微环境中免于构象转变而带来的失活效应[16]。固定化乳糖酶的最适pH值为7,这与液态乳的pH相同,说明了其在工业化上的潜力。而由图7-b可知,游离酶和固定化酶的最适温度都为90 ℃,而在75~100 ℃,固定化酶的相对酶活力都显著好于游离酶,而在95 ℃时,固定化酶仍有95%左右的酶活力。这意味着固定化酶有着更宽的温度谱。
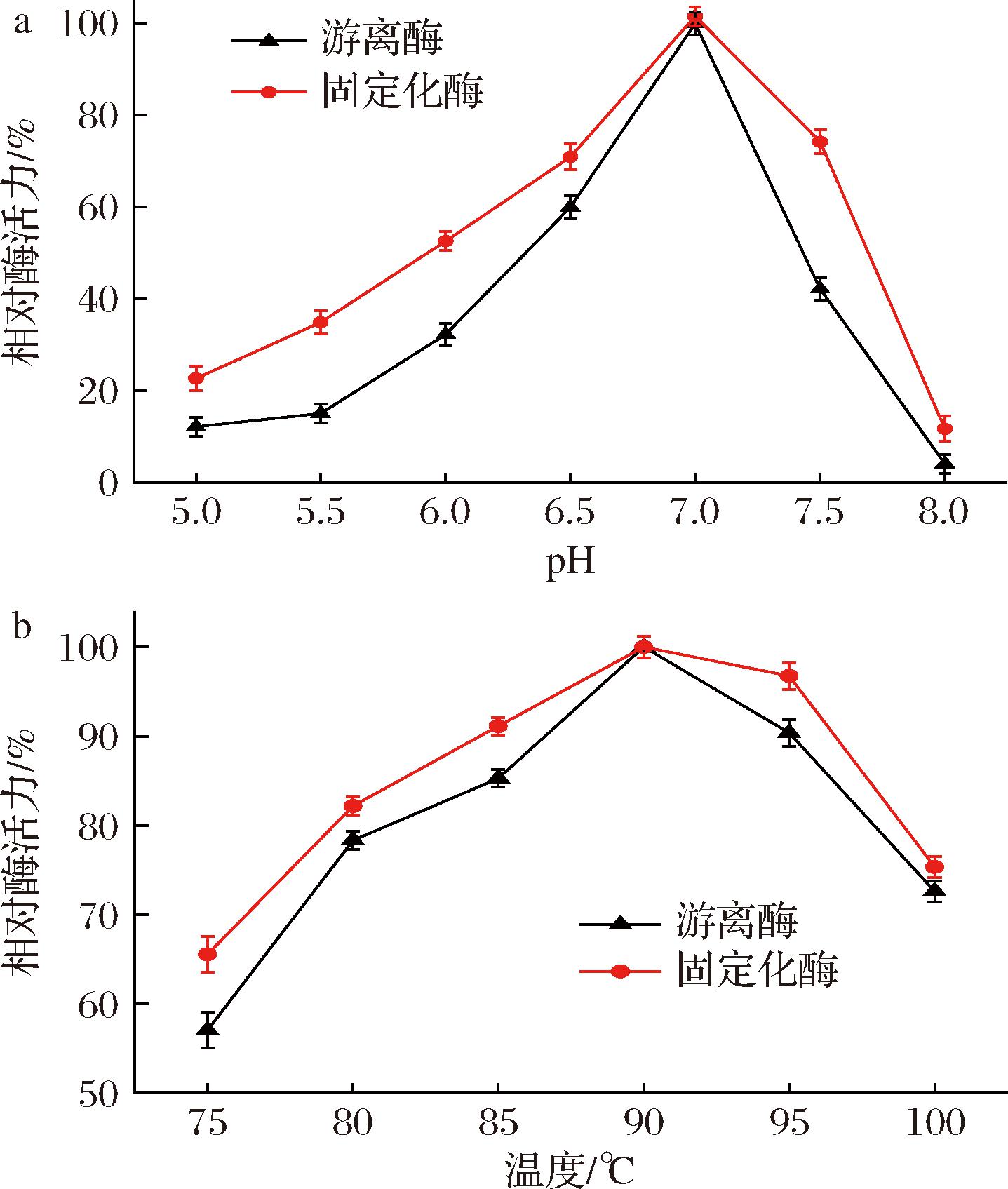
a-pH;b-温度
图7 pH及温度对相对酶活力的影响
Fig.7 Effect of pH and temperature on enzyme activity
固定化酶和游离酶都有着良好的耐热性,但是相较之下,由于固定化载体与酶分子之间存在多种作用力从而对酶分子的空间结构具有保护作用[12],如图8所示,无论是110、95、80 ℃还是65 ℃,固定化酶的相对酶活力都优于游离酶。在110 ℃和95 ℃下,相对酶活力在经过180 min的孵育后虽然都有明显的下降,但是可以看到,固定化酶在95 ℃孵育90 min仍保有80%以上的相对活性,较游离酶提升了11.31%,不过该温度远高于工业上乳制品可能长时间涉及的温度,因此实际应用意义不大,而在巴氏杀菌常用的80 ℃条件下,即使经过180 min的孵育,固定化酶仍然保有接近98%的相对酶活力。这为其工业化的应用创造了良好的条件。

a-110 ℃;b-95 ℃;c-80 ℃;d-65 ℃
图8 游离酶及固定化酶的耐热性测试
Fig.8 Thermostability of free and immobilized enzymes
2.6.2 固定化乳糖酶的重复使用能力
固定化酶的一大优势就是可以重复多次使用[17],在经过连续多次使用后,固定化酶仍能保有相当的活性。如图9所示,固定化酶的活性随着使用次数的增加,其活性缓慢降低。这可能是由于反复使用次数的增加,不可避免的破坏了载体的机械结构,使得酶分子流失。但是可以看到,在连续使用了5次以后,固定化酶的活力仍保持在80%以上,充分说明了其可重复利用率。并且在90 ℃下连续搅拌反应3 h以后,固定化酶仍未发生明显破裂,证明其有良好的机械操作稳定性。
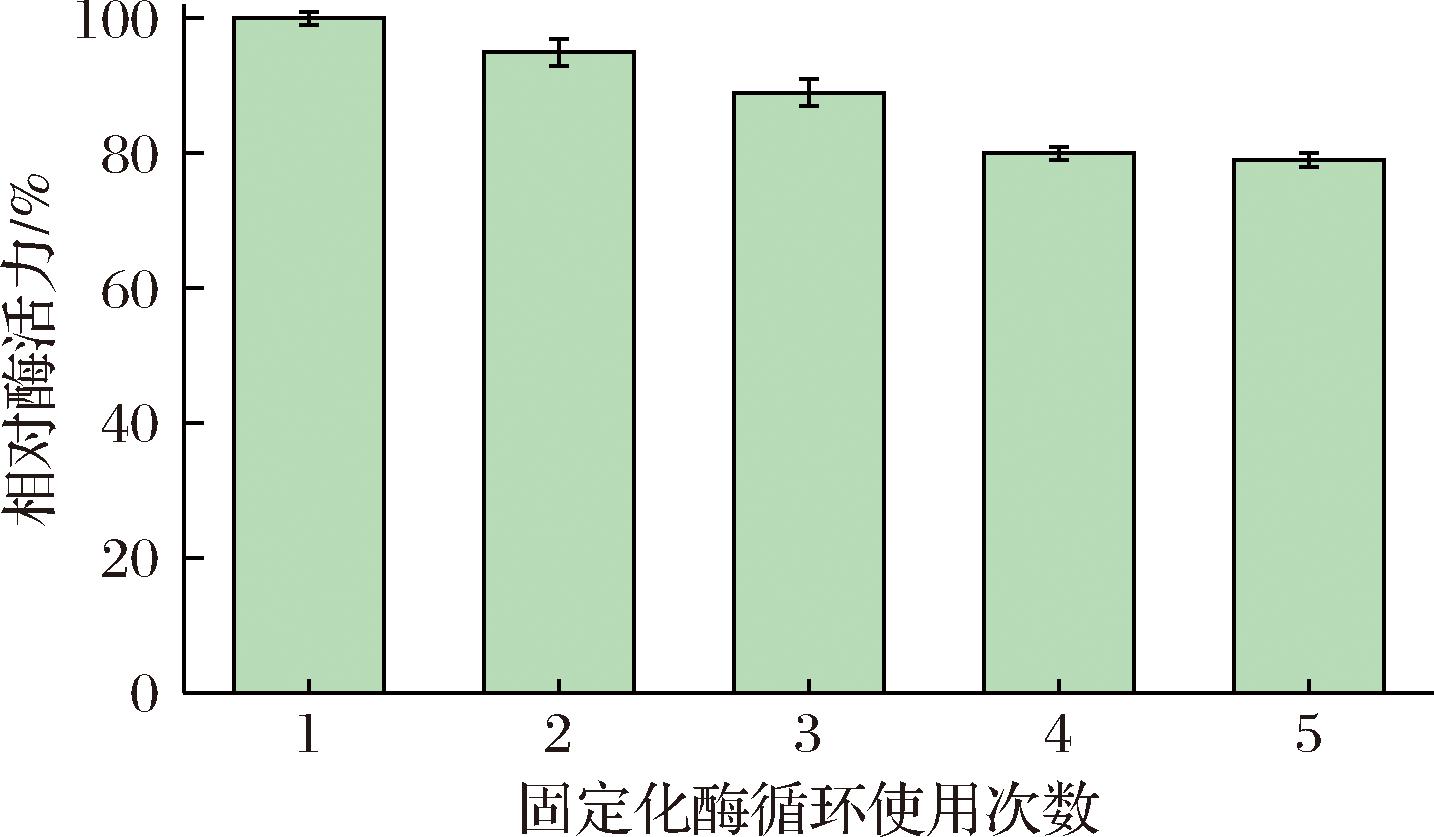
图9 固定化酶回收利用率
Fig.9 Recovery rate of immobilized enzyme
2.6.3 固定化乳糖酶的米氏常数
米氏常数(Km)是表征酶与底物亲和力的重要指标,而Km值越小越说明其与底物亲和力更高。根据方程1/V=(1/S)Km/Vmax + 1/Vmax,以1/S为横坐标,1/V为纵坐标绘制曲线如图10所示。根据计算线性方程得到固定化酶的Km为0.60,而游离酶的Km则为0.91。相较于前人的研究[12,18],本试验测定的结果与他们相似,但是本实验所用的游离酶和固定化酶的Km值都相对较高,这可能是由于,BgaS在底物亲和力反应速率等酶学性质上,较商业化的乳糖酶有所欠缺。同时推测之所以固定化酶较游离酶具有更小的Km值,可能是由于固定化载体的静电效应使壳聚糖微球对附近底物的吸附力增强,从而使固定化酶周围的底物浓度要比溶液中高,同时空间障碍和扩散限制有关阻碍了底物流失,致使固定化酶有相对较低的Km值。但是固定化酶的Vmax为0.06,而游离酶则为0.18,后续可以通过对壳聚糖载体进行改性,提高酶的负载量来进一步提升固定化酶的Vmax。
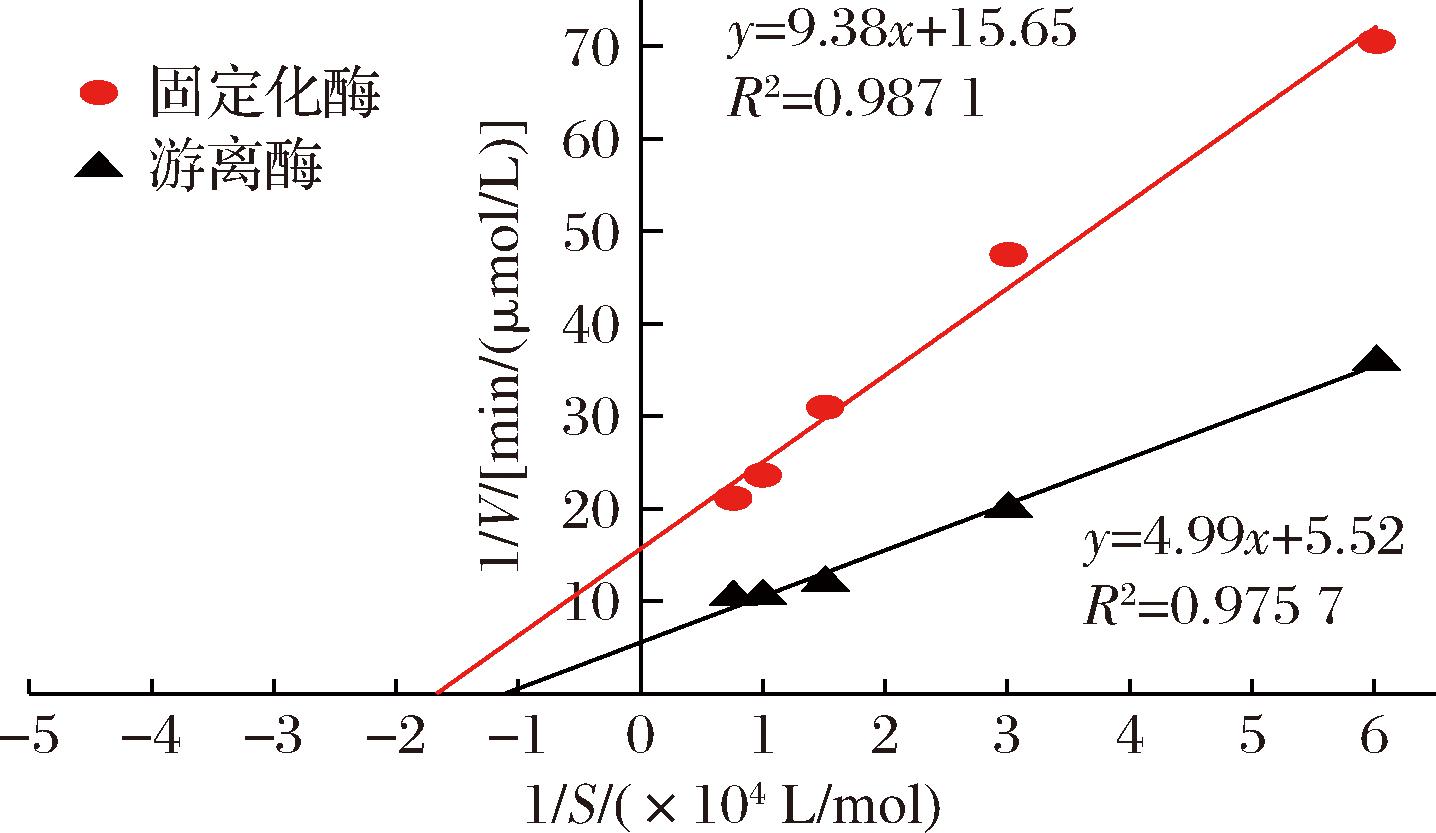
图10 以ONPG为底物时游离酶及固定化酶的Lineweaver-Burk图
Fig.10 Lineweaver-Burk plot of free and immobilized lactase with ONPG as substrate
2.7 固定化乳糖酶乳糖降解结果
以新鲜牛乳为底物来测定固定化酶对于牛乳的乳糖降解效果。其结果如表3所示。可以看到在最适条件下反应3 h之后,固定化酶成功水解乳糖,使牛乳达到了无乳糖水平(≤0.5%),并且在反应3 h之后其乳糖水解率达到最高为92.88%,以上结果说明固定化乳糖酶能够有效降解牛乳中的乳糖。相较之下,游离酶则需要4 h才能达到相同的效果,这充分说明了固定化载体可以增加酶与底物的亲和性,使反应效率提高[19],同时推测之所以固定化酶具有更快的水解能力,除去载体本身对底物的吸附和静电作用以外,同时材料的空间障碍和扩散限制阻碍了底物流失,致使有固定化酶有相对更高的水解效率。同时先前的实验证明,高温条件下的固定化酶相较游离酶有更高的相对酶活力,这同样有利于固定化酶对乳糖的水解。
表3 乳糖水解率
Table 3 Lactose hydrolysis rate
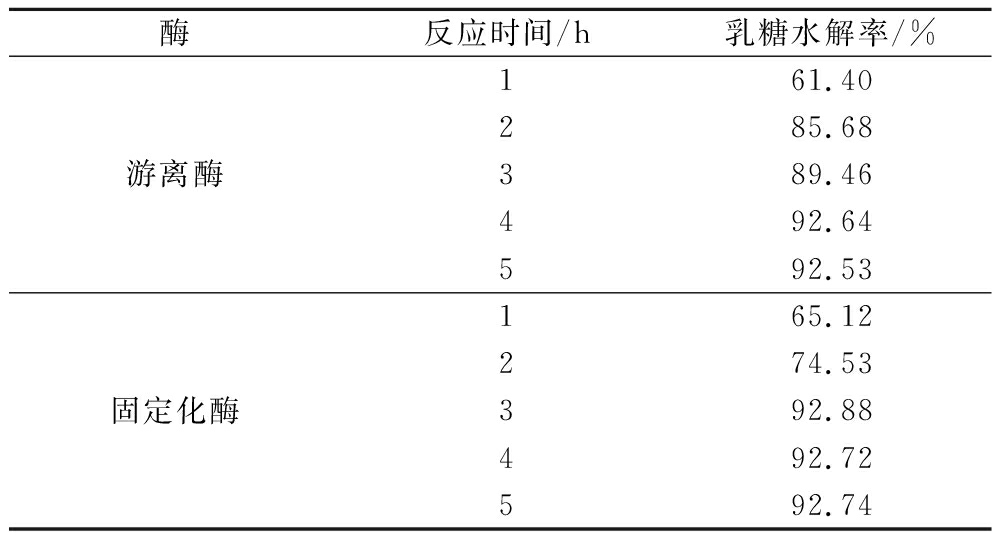
酶反应时间/h乳糖水解率/%游离酶161.40285.68389.46492.64592.53固定化酶165.12274.53392.88492.72592.74
注:100 mL生牛乳中乳糖含量为4.41 g。
3 结论与展望
本实验实现了BgaS在枯草芽孢杆菌中的异源表达,确保了酶生产来源的安全性,同时使用壳聚糖微球作载体对BgaS固定化以后进一步提高了其在脱乳糖产品生产领域的应用前景。固定化酶的最适温度和pH与游离酶相同,其最适pH值均为7,最适反应温度为90 ℃。而且相较于游离酶,固定化酶有更好的耐热性和pH稳定性。同时固定化酶具有更好的底物亲和性,在最适条件下3 h内即可实现生牛乳的乳糖降解,最大水解率为92.88%。固定化酶有效实现了乳糖酶的循环利用,降低了反应成本,实现了更为安全的生产,为耐高温乳糖酶在乳制品中的应用拓展了可能。但是本实验同时发现,该酶在高温条件下全部降解乳糖的耗时较长。目前已有大量报道可以通过定向进化的方法提高乳糖酶活性来提升乳糖降解效率[20-21],因此后续可以通过在乳糖酶活性口袋位点进行饱和突变尝试提高其反应效率。
[1] SILANIKOVE N, LEITNER G, MERIN U.The interrelationships between lactose intolerance and the modern dairy industry:Global perspectives in evolutional and historical backgrounds[J].Nutrients, 2015, 7(9):7312-7331.
[2] COSTA A, LOPEZ-VILLALOBOS N, SNEDDON N W, et al.Invited review:Milk lactose-Current status and future challenges in dairy cattle[J].Journal of Dairy Science, 2019, 102(7):5883-5898.
[3] SNEDDON N W, LOPEZ-VILLALOBOS N, HICKSON R E, et al.Dairy product production and lactose demand in New Zealand and Ireland under different simulated milk product-processing portfolios[J].Irish Journal of Agricultural and Food Research, 2016, 55(2):126-135.
[4] DONG Q, YAN X F, ZHENG M H, et al.Characterization of an extremely thermostable but cold-adaptive β-galactosidase from the hyperthermophilic archaeon Pyrococcus furiosus for use as a recombinant aggregation for batch lactose degradation at high temperature[J].Journal of Bioscience and Bioengineering, 2014, 117(6):706-710.
[5] DAMIN B I S, KOVALSKI F C, FISCHER J, et al.Challenges and perspectives of the β-galactosidase enzyme[J].Applied Microbiology and Biotechnology, 2021, 105(13):5281-5298.
[6] DUAN F Y, SUN T, ZHANG J W, et al.Recent innovations in immobilization of β-galactosidases for industrial and therapeutic applications[J].Biotechnology Advances, 2022, 61:108053.
[7] DE ALBUQUERQUE T L, DE SOUSA M, GOMES E SILVA N C, et al.β-Galactosidase from Kluyveromyces lactis:Characterization, production, immobilization and applications - A review[J].International Journal of Biological Macromolecules, 2021, 191:881-898.
[8] VERMA M L, KUMAR S, DAS A, et al.Chitin and chitosan-based support materials for enzyme immobilization and biotechnological applications[J].Environmental Chemistry Letters, 2020, 18(2):315-323.
[9] RAFIEE F, REZAEE M.Different strategies for the lipase immobilization on the chitosan based supports and their applications[J].International Journal of Biological Macromolecules, 2021, 179:170-195.
[10] RIBEIRO E S, DE FARIAS B S, SANT’ANNA CADAVAL JUNIOR T R, et al.Chitosan-based nanofibers for enzyme immobilization[J].International Journal of Biological Macromolecules, 2021, 183:1959-1970.
[11] SPIZIZEN J.Transformation of biochemically deficient strains of Bacillus subtilis by deoxyribonucleate[J].Proceedings of the National Academy of Sciences of the United States of America, 1958, 44(10):1072-1078.
[12] 原卉卉, 杨孝成, 葛武鹏, 等.Fe3O4@海藻酸钠-壳聚糖固定化乳糖酶技术及其酶学性质研究[J].中国乳品工业, 2023, 51(2):4-9;20.YUAN H H, YANG X C, GE W P, et al.Fe3O4@sodium alginate-chitosan immobilized lactase technology and its enzymatic properties[J].China Dairy Industry, 2023, 51(2):4-9;20.
[13] 刘乃齐, 刘立杰, 白英, 等.不同酸度乳清中乳糖质量分数的检测方法[J].中国乳品工业, 2017, 45(7):53-55.LIU N Q, LIU L J, BAI Y, et al.Study on detection method of lactose in whey with different acidity[J].China Dairy Industry, 2017, 45(7):53-55.
[14] 杨罡. 固定化酶酶解苦杏仁谷蛋白制备ACE抑制肽及分离纯化的研究[D].乌鲁木齐:新疆农业大学, 2021.YANG G.Study on preparation, separation and purification of ACE inhibitory peptide from almond gluten by immobilized enzyme[D].Urumqi:Xinjiang Agricultural University, 2021.
[15] 李晶, 王存芳.乳糖酶的固定化及其应用研究进展[J].乳业科学与技术, 2016, 39(6):29-32.LI J, WANG C F.Progress in the immobilization and application of lactase[J].Journal of Dairy Science and Technology, 2016, 39(6):29-32.
[16] SIM N-HERRERO C, NAGHDI M, TAHERAN M, et al.Immobilized laccase on polyimide aerogels for removal of carbamazepine[J].Journal of Hazardous Materials, 2019, 376:83-90.
N-HERRERO C, NAGHDI M, TAHERAN M, et al.Immobilized laccase on polyimide aerogels for removal of carbamazepine[J].Journal of Hazardous Materials, 2019, 376:83-90.
[17] T SRIWONG K, MATSUDA T.Recent advances in enzyme immobilization utilizing nanotechnology for biocatalysis[J].Organic Process Research &Development, 2022, 26(7):1857-1877.
[18] 李黎, 马力.磁性壳聚糖微球固定化乳糖酶及其酶学性质[J].中国组织工程研究, 2021, 25(4):576-581.LI L, MA L.Immobilization of lactase on magnetic chitosan microspheres and its effect on enzymatic properties[J].Chinese Journal of Tissue Engineering Research, 2021, 25(4):576-581.
[19] ÇALC E, ÖNAL S.Comparative affinity immobilization of α-galactosidase on chitosan functionalized with Concanavalin A and its useability for the hydrolysis of raffinose[J].Reactive and Functional Polymers, 2022, 172:105181.
E, ÖNAL S.Comparative affinity immobilization of α-galactosidase on chitosan functionalized with Concanavalin A and its useability for the hydrolysis of raffinose[J].Reactive and Functional Polymers, 2022, 172:105181.
[20] RENTSCHLER E, SCHWARZ T, STRESSLER T, et al.Development and validation of a screening system for a β-galactosidase with increased specific activity produced by directed evolution[J].European Food Research and Technology, 2016, 242(12):2129-2138.
[21] XIONG A S, PENG R H, ZHUANG J, et al.Directed evolution of beta-galactosidase from Escherichia coli into beta-glucuronidase[J].Journal of Biochemistry and Molecular Biology, 2007, 40(3):419-425.