阿瓦提慕萨莱思是以阿瓦提红(或和田红)葡萄为主要原料,经高温浓缩,自然发酵而成的一种酒精饮品[1]。2019年以前,由于“阿瓦提红”葡萄种植面积少,慕萨莱思生产大多从和田地区采购“和田红”作为原料,自2020年以来,阿瓦提县开始广泛种植阿瓦提红,到2021年种植面积已达5万亩,由于阿瓦提县的光照时间长、降水少、昼夜温差大、无霜期长等自然气候条件优越,使得阿瓦提红总体长势好、糖分高,为慕萨莱思的酿造提供了优质的原料[2-3]。
阿瓦提县位于塔克拉玛干大沙漠北缘,独特的地域环境和慕萨莱思传统酿造工艺,使得慕萨莱思酿造酵母种群多样[4-5]。酵母菌作为慕萨莱思酿造过程中主要的微生物,其广泛分布在葡萄果皮表面和土壤中[6]。不同生态环境筛选出的酵母菌具有不同的本土特性[7],近年来,国内外专家通过筛选不同地区、不同环境下的酵母菌,用于慕萨莱思的酿造,从而改善慕萨莱思的香气特征,提高了慕萨莱思的整体风味特色[8-9],如乔通通[10]从不同作坊和工厂中筛选得到的1株野生酵母菌,能够提高慕萨莱思焦糖香和果香,改善慕萨莱思的香气品质;杨创举等[11]以新疆各地葡萄中分离出的酵母菌为原材料,筛选出对慕萨莱思有着较强的降糖、降酸能力的酵母菌,证明生物降酸的可行性;张佳斌等[12]以分离于慕萨莱思酿造环境的酵母为材料,以不同菌株、不同比例及不同时序进行复配,最终获得适合新疆特色慕萨莱思酿造用的复配发酵剂,缩短了传统工艺发酵时间、提高成品品质。以上研究所需酵母菌株,有的来源于和田红葡萄,有的来源于酿造环境,但从阿瓦提红葡萄或果园中筛选酵母菌应用于慕萨莱思酿造的研究几乎未见报道。本研究从阿瓦提县葡萄园中采集阿瓦提红葡萄果实,从中筛选出优良酵母菌株并进行慕萨莱思发酵,为传统慕萨莱思工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
阿瓦提红葡萄,采自南疆阿克苏地区阿瓦提县(北纬39°31′~40°50′,东经79°45′~81°05′)。葡萄糖、酵母浸粉、蛋白胨、琼脂,北京奥博星生物技术有限责任公司;酵母基因组DNA快速提取试剂盒,北京庄盟国际生物基因科技有限公司;引物,新疆塔克蓝生物科技有限责任公司。
1.2 仪器与设备
LDZX-50L立式高压蒸汽灭菌器,上海申安医疗器械厂;GZX-9140MBE电热鼓风干燥箱,上海博讯仪器有限公司;GC-2014C气相色谱仪,日本岛津企业管理(中国)有限公司;BM1700生物显微镜,南京江南永新光学有限公司;LHS-100CH恒温培养箱,上海一恒科技有限公司。
1.3 实验方法
1.3.1 酵母菌的分离与纯化
YPD培养基参考王静尧等[13]方法制备。
准确称取25 g葡萄果实破碎后装于225 mL无菌水的锥形瓶中,充分振荡摇匀,并制备10-2、10-3、10-4、10-5、10-6、10-7的稀释样品液,吸取100 μL均匀涂布至YPD培养基上。于28 ℃的培养箱内倒置培养2 d挑取单菌落,采用划线分离法接种至新的YPD培养基,直至纯化出单一形态菌株,于生物显微镜下观察菌落形态并记录特征[14]。
1.3.2 酵母菌的分子生物学鉴定
将分离得到的疑似酵母菌株用YPD液体活化48 h,离心收集菌体沉淀,使用酵母基因组DNA快速提取试剂盒提取酵母菌基因组DNA,以提取的基因组DNA为模板,以正向引物ITS 1(5′-TCCGTAGGTGAACCTGCGG-3′),反向引物ITS 4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,对PCR扩增产物进行电泳检测并送至西安擎科生物科技有限公司进行测序。将测序结果在NCBI数据库进行BLAST比对,用MEGA 11的邻位连接法对选择的序列进行计算,构建系统发育树。
PCR反应体系(20 μL):ddH2O 13.7 μL,10 x Taq buffer 2.0 μL,Taq DNA 聚合酶0.1 μL,dNTP Mix 1.6 μL,正向引物0.8 μL,反向引物0.8 μL,模板1 μL。PCR反应条件:95 ℃预变性10 min;95 ℃变性0.5 min,58 ℃退火0.5 min,72 ℃延伸35 s,30个循环;72 ℃延伸10 min。
1.3.3 酵母菌产气性能测定
种子液的制备:将斜面保藏的酵母菌株接种于YPD液体培养基,28 ℃静置培养2 d,获得酵母菌种子液。
将种子液分别以2%(体积分数)的接种量接种于装有YPD液体培养基的杜氏小管内,28 ℃下静置培养,观察并记录杜氏管中酵母菌株的产气情况以及发酵液的气味[15]。
1.3.4 酵母菌的发酵性能测定
1.3.4.1 耐酒精性能实验
参考周桂珍等[15]的方法,将种子液以2%(体积分数)的接种量接种于5 mL YPD液体培养基中,分别加入无水乙醇,调整培养基初始酒精体积分数为6%、9%、12%、15%、18%,同时以商业酿酒酵母BV818作为对照,实验平行测定3次,并以未加酒精的YPD培养基作为空白对照。28 ℃恒温静置培养48 h,用酶标仪在600 nm波长条件下分别测OD值。
1.3.4.2 耐酸性能实验
参考周桂珍等[15]的方法,将种子液以2%(体积分数)的接种量接种于5 mL YPD液体培养基中,用柠檬酸调节pH,调节培养基中初始pH值为2.0、2.5、3.0、3.5、4.0,同时以商业酿酒酵母BV818作为对照,实验平行测定3次,并以未调节pH的YPD培养基作为空白对照。28 ℃恒温培养48 h,用酶标仪在600 nm波长条件下分别测OD值。
1.3.4.3 耐糖性能实验
参考周桂珍等[15]的方法,将种子液以2%(体积分数)的接种量接种于5 mL YPD液体培养基中,用葡萄糖调整初始糖质量浓度为300、350、400、450、500 g/L,同时以商业酿酒酵母BV818作为对照,实验平行测定3次,并以未额外添加葡萄糖的YPD培养基作为空白对照。28 ℃恒温培养48 h,用酶标仪在600 nm波长条件下分别测OD值。
1.3.4.4 耐SO2性能实验
参考周桂珍等[15]的方法,将种子液以2%(体积分数)的接种量接种于5 mL YPD液体培养基中,用偏重亚硫酸钾调整培养基中SO2质量浓度为70、140、210、280、350 mg/L,同时以商业酿酒酵母BV818作为对照,实验平行测定3次,并以未添加偏重亚硫酸钾的YPD培养基作为空白对照。28 ℃恒温静置培养48 h,用酶标仪在600 nm波长条件下分别测OD值。
1.4 酵母菌株在慕萨莱思发酵中的应用
1.4.1 慕萨莱思发酵试验
先将葡萄榨汁,葡萄皮渣与水混合进行熬煮,将所得汁液与阿瓦提红葡萄原汁混合继续熬煮,待浓葡萄汁糖度28 °Brix时终止熬煮。将浓缩好的葡萄汁装于无菌锥形瓶中,接入2%(体积分数)活化的菌液,并以无菌浓缩葡萄汁为空白于28 ℃条件下发酵。并对发酵液每天进行CO2失重、可溶性固形物的分析,最终对发酵产品进行酒精度、总糖、总酸的测定及感官评定。
1.4.2 理化指标的测定
CO2失重:通过失重法测定CO2失重量[10]。
可溶性固形物:采用PAL-1数字显示糖度计对发酵过程中的糖度变化进行测量。
总酸、总糖:按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的指示剂法进行测定。
酒精度:参照马鹏等[16]的方法对慕萨莱思发酵液中酒精度含量进行测定。
1.4.3 慕萨莱思感官评定
慕萨莱思感官评定方法参考Q/MSLS 0001 S—2022《发酵酒 (慕萨莱思)》,由10名具有评审慕萨莱思经验的人员组成感官评定小组,对慕萨莱思外观、香气、滋味、典型性进行评价,评分标准见表1,同时对产品特征进行描述。
表1 慕萨莱思感官评分标准表
Table 1 Musalais sensory rating scale

项目指标评分/分外观(20分)清澈透明、色泽诱人、无悬浮物12~20色泽正常、略有悬浮物,较清澈透明0~11香气(30分)酒香芳香味协调、浓郁、无异味15~30酒香芳香较淡、香味偏淡1~14滋味(40分)酸甜适中、口感清新、有杀口感20~40口感较清新协调,寡淡0~19典型性(10分)具有独特的酒香芳香味及醇香感5~10酒香芳香不明显、特有口感不足0~4
1.5 数据处理
利用Excel、Origin软件对数据进行处理及试验图片的绘制,利用MEGA 11对酵母菌序列进行分析对比,构建系统发育树。
2 结果与分析
2.1 酵母菌的形态鉴定
从阿瓦提红葡萄果实中分离得到疑似酵母菌株6株,对其进行编号为J、J1、J2、J3、J4、J5,并对分离得到的疑似酵母菌株进行菌落形态和显微形态的观察,如图1所示。

图1 酵母菌株的菌落形态及个体形态
Fig.1 Colony and cell morphology of yeast strains
由图1可知,菌株J、J2、J3、J4细胞形态为圆形,J1为卵圆形、J5为柠檬形,菌株J为乳白色,其余均为奶油色,6株菌落边缘整齐,表面主要为光滑形态,其中J为单端出芽,其余5株为两端或多端出芽,有些形成了成串的细胞,形如假丝。
2.2 分子生物学鉴定
将分离得到的疑似酵母菌株进行分子生物学鉴定,与BLAST相似性比对,结果显示,菌株J与酿酒酵母的ITS序列相似性高达100%,菌株J1、J2、J3、J4、J5与丝孢毕赤酵母属(Hyphopichia)相似性较高,用MEGA 11构建系统发育树,如图2所示,结果表明酵母菌株J与酿酒酵母(Saccharomyces cerevisiae)MZ 150869.1具有高度同源性,确定J为酿酒酵母(Saccharomyces cerevisiae),菌株J1、J2、J3、J4、J5均为Hyphopichia。
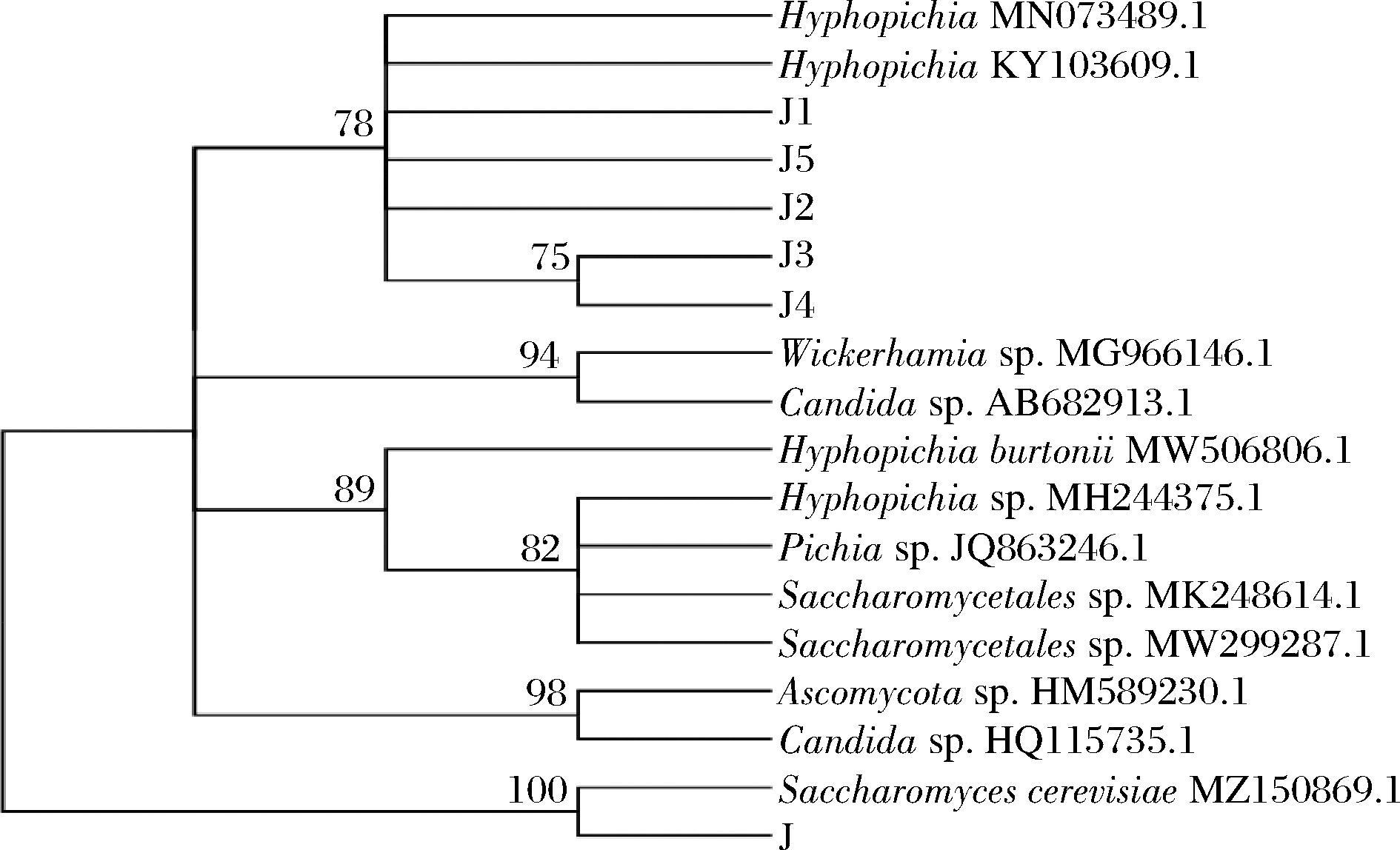
图2 酵母菌ITS序列系统发育进化树
Fig.2 Phylogenetic tree of yeast strains based on its ITS sequence
2.3 酵母菌发酵力测定
酵母菌株发酵力测定结果见表2。由表2可知,在28 ℃培养2 d后,与商业酵母BV818相比,菌株J2的产气较慢,菌株J4产气量一般,但沉淀情况均良好,具有一定的香气存在。菌株J、J1、J3、J5产气量大、沉淀现象良好、酒香味也相对较浓,其中产气量最大的是菌株J和J3,发酵酒香芳香最浓的是J,这可能是由于J为酿酒酵母,研究表明酿酒酵母有较好的发酵力和产香特性[17]。
表2 酵母菌株发酵力测定
Table 2 Determination of fermentation ability of yeast strains

菌株编号产气情况菌株凝聚性发酵液气味J++++沉淀良好酒香芳香较浓J1+++沉淀良好酒香味J2+沉淀良好香味较浓郁J3++++沉淀良好酒香味较浓J4++沉淀良好芳香味J5+++沉淀良好酒香味BV818++++沉淀良好酒香芳香较浓
注:+表示产气,+越多表示产气量越大。
2.4 酵母菌株发酵性能的测定结果
2.4.1 耐酒精性能实验
由表3可知,与商业酵母BV818相比,菌株J、J1、J2、J3在9%酒精体积分数的培养基中能够大量生长,而菌株J4、J5在9%酒精体积分数的培养基中只能明显生长,菌株J3、J4、J5在12%酒精体积分数的培养基中只能生长,J、J1、J2在12%酒精体积分数的培养基中能够明显生长,表明菌株J、J1、J2在不同体积分数酒精中的生长能力较强。非酿酒酵母相比于酿酒酵母耐酒精性能较差,但有研究表明有的毕赤酵母与酿酒酵母具有相似的耐酒精特征,可以耐受12%的酒精体积分数[18],本研究筛选的酿酒酵母J与毕赤酵母J1和J2具有类似的耐酒精特性,均可以用于酒精饮品或发酵酒的生产。
表3 酵母菌株耐酒精性能实验结果
Table 3 Determination of alcohol tolerance of yeast strains
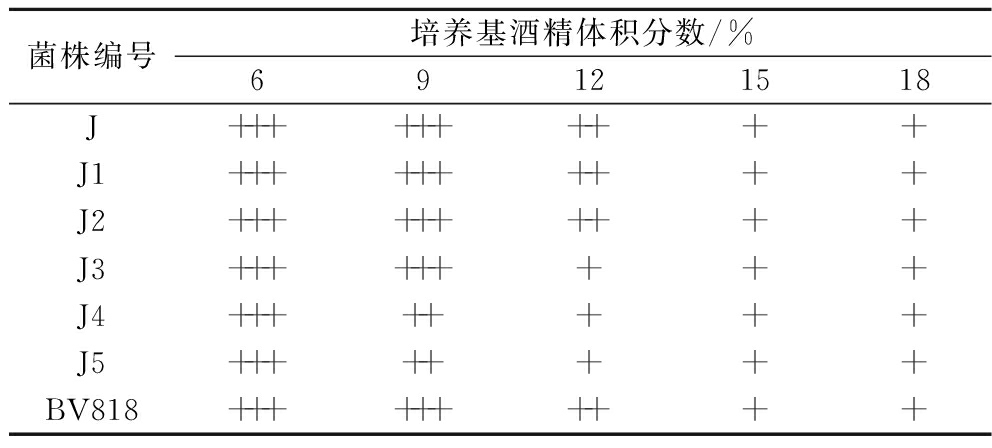
菌株编号培养基酒精体积分数/%69121518J++++++++++J1++++++++++J2++++++++++J3+++++++++J4++++++++J5++++++++BV818++++++++++
注:-:不生长,OD600≤0.1;*:微量生长,0.1
2.4.2 耐酸性能实验
由表4可知,与商业酵母BV818相比,当pH值是4时5株酵母菌均能够大量生长,随着pH值的降低,在2~2.5时5株酵母菌均只能微量生长,菌株J3、J4、J5在pH值为3.5时只能明显生长,pH值为3时只能生长,而菌株J在pH值为3~4的范围内均可大量生长,菌株J1、J2在pH值为3.5和4时能够大量生长,pH值为3时明显生长,说明菌株J、J1、J2在不同酸性条件下的生长能力相比于J3、J4、J5较强。研究表明毕赤酵母耐酸性可以达到pH值为2,但在酸性条件下的生长会受到明显抑制[19],本研究筛选的酿酒酵母和毕赤酵母菌株在pH值为2的条件下生长均受到严重抑制,但菌株J、J1、J2相比于菌株J3、J4、J5在pH值为3时生长良好,这可能是由于不同酵母菌菌种和生长环境的不同,导致对酸性条件适应能力不同[20],将耐酸性较高的酵母菌应用于慕萨莱思的发酵,对于解决酸度高的慕萨莱思现状具有重要意义[11]。
表4 酵母菌株耐酸性能实验结果
Table 4 Determination results of acid tolerance of yeast strains
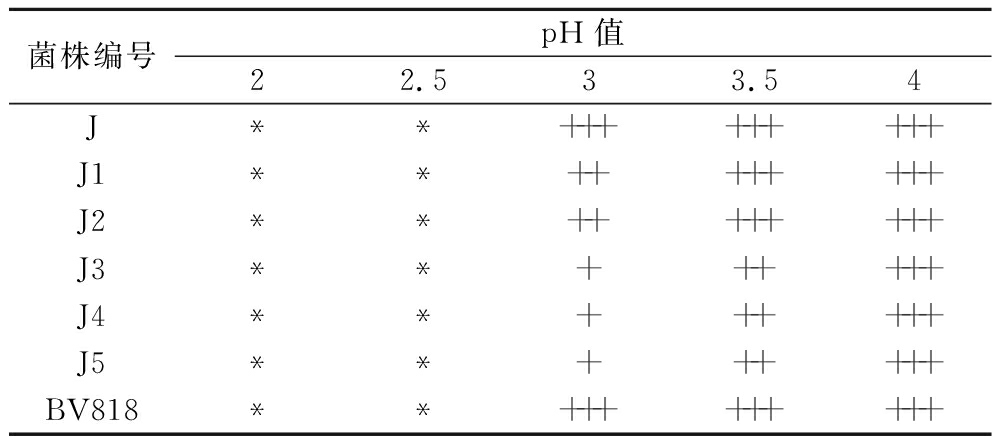
菌株编号pH值22.533.54J**+++++++++J1**++++++++J2**++++++++J3**++++++J4**++++++J5**++++++BV818**+++++++++
2.4.3 耐糖性能实验
由表5可知,与商业酵母BV818相比,菌株J、J2比其余菌株在300 g/L葡萄糖培养基中均能够大量生长,并且菌株J的生长能力与商业酵母BV818一致,其耐糖能力最强,可以耐受500 g/L的葡萄糖溶液,说明菌株J更适用于以浓缩葡萄汁为原料的慕萨莱思发酵。
表5 酵母菌株耐糖性能实验结果
Table 5 Determination of sugar tolerance of yeast strains
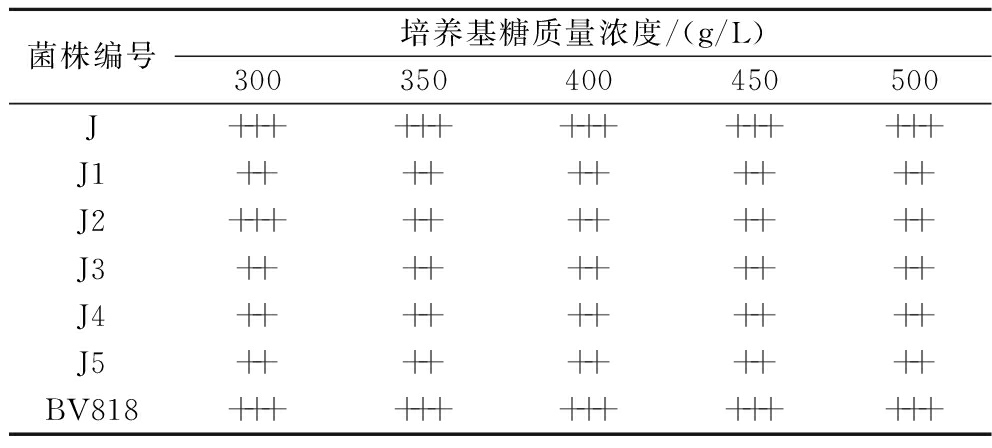
菌株编号培养基糖质量浓度/(g/L)300350400450500J+++++++++++++++J1++++++++++J2+++++++++++J3++++++++++J4++++++++++J5++++++++++BV818+++++++++++++++
2.4.4 耐SO2性能实验
耐SO2性能实验中,被测菌株在SO2质量浓度为70、140、210、280、350 mg/L的培养条件下,OD值均大于1.0,生长旺盛,说明被测菌株耐SO2能力与商业酵母BV818一致,本实验的6株菌均符合耐SO2性能的要求。
以上述发酵性试验结果为基础,筛选出发酵能力、耐糖、耐酒精相对较强的菌株J、J1、J2进行慕萨莱思酿造试验。
2.5 慕萨莱思发酵试验结果
2.5.1 慕萨莱思CO2失重、可溶性固形物的变化趋势
2.5.1.1 CO2释放比较
慕萨莱思CO2失重量结果见图3,由图可知菌株J、J1在第2天 CO2排放量达到最高,代谢的速率最快,菌数最多,而菌株J2 CO2排放量在第3天达到最高。由结果可知,菌株J在第2天的CO2排放量较强,说明菌株J发酵速率最快,这可能是由于菌株J为酿酒酵母,发酵速度快[21]。
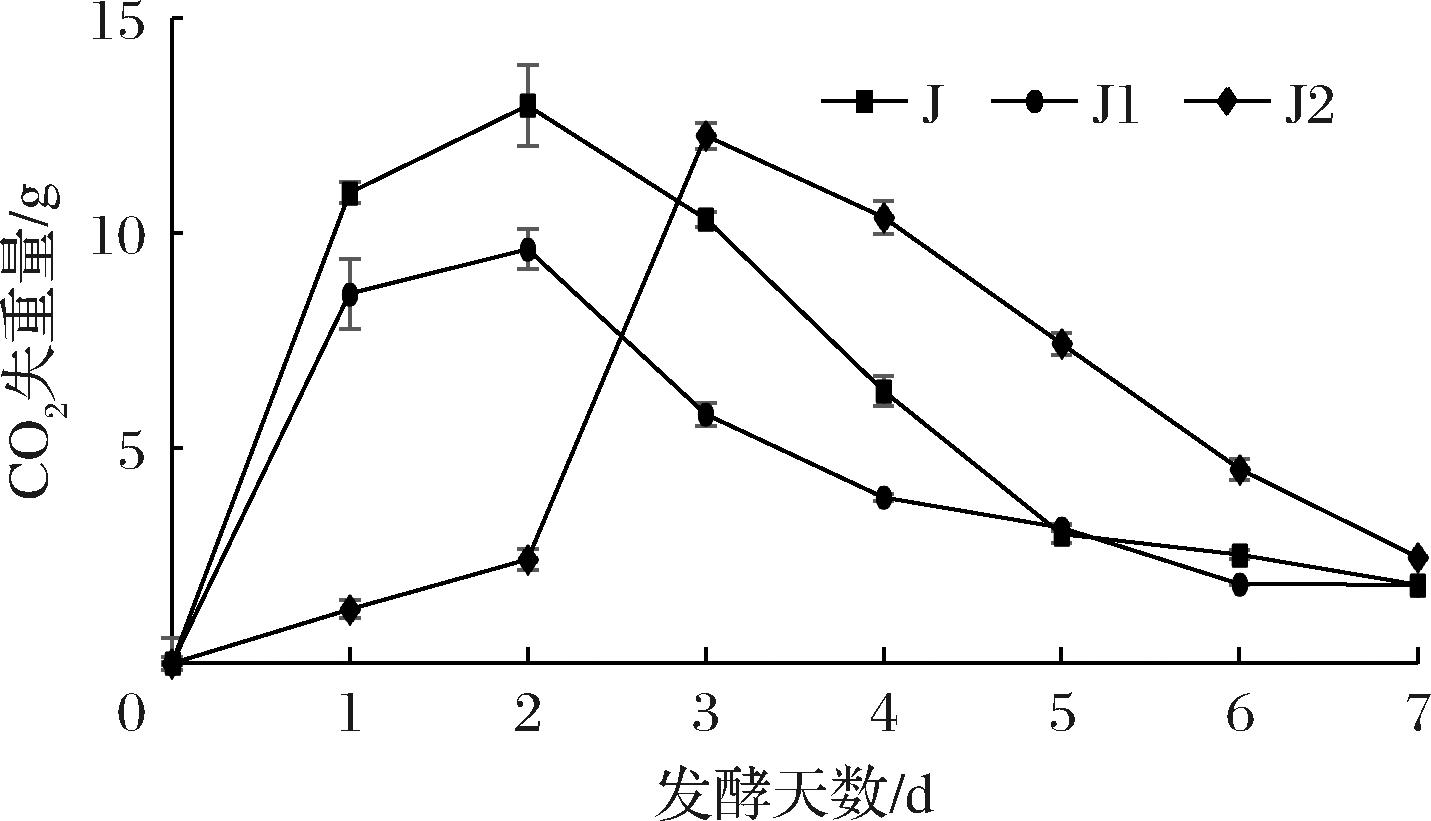
图3 三株菌发酵过程中CO2变化规律
Fig.3 Changes of CO2 during fermentation of three strains
2.5.1.2 可溶性固形物变化趋势
慕萨莱思可溶性固形物变化见图4,慕萨莱思可溶性固形物随着发酵时间的延长,均呈下降趋势,菌株J、J1发酵慕萨莱思可溶性固形物随着时间的下降趋势基本一致,菌株J2的可溶性固形物组分下降较慢,说明菌株J2的发酵能力较弱,糖消耗较慢,超过第4天后,3株菌发酵慕萨莱思可溶性固形物的下降趋势一致,综上,菌株J发酵慕萨莱思可溶性固形物能力最快且稳定,这可能是由于菌株J为酿酒酵母,所以发酵速度快,可溶性固形物下降较快[21]。
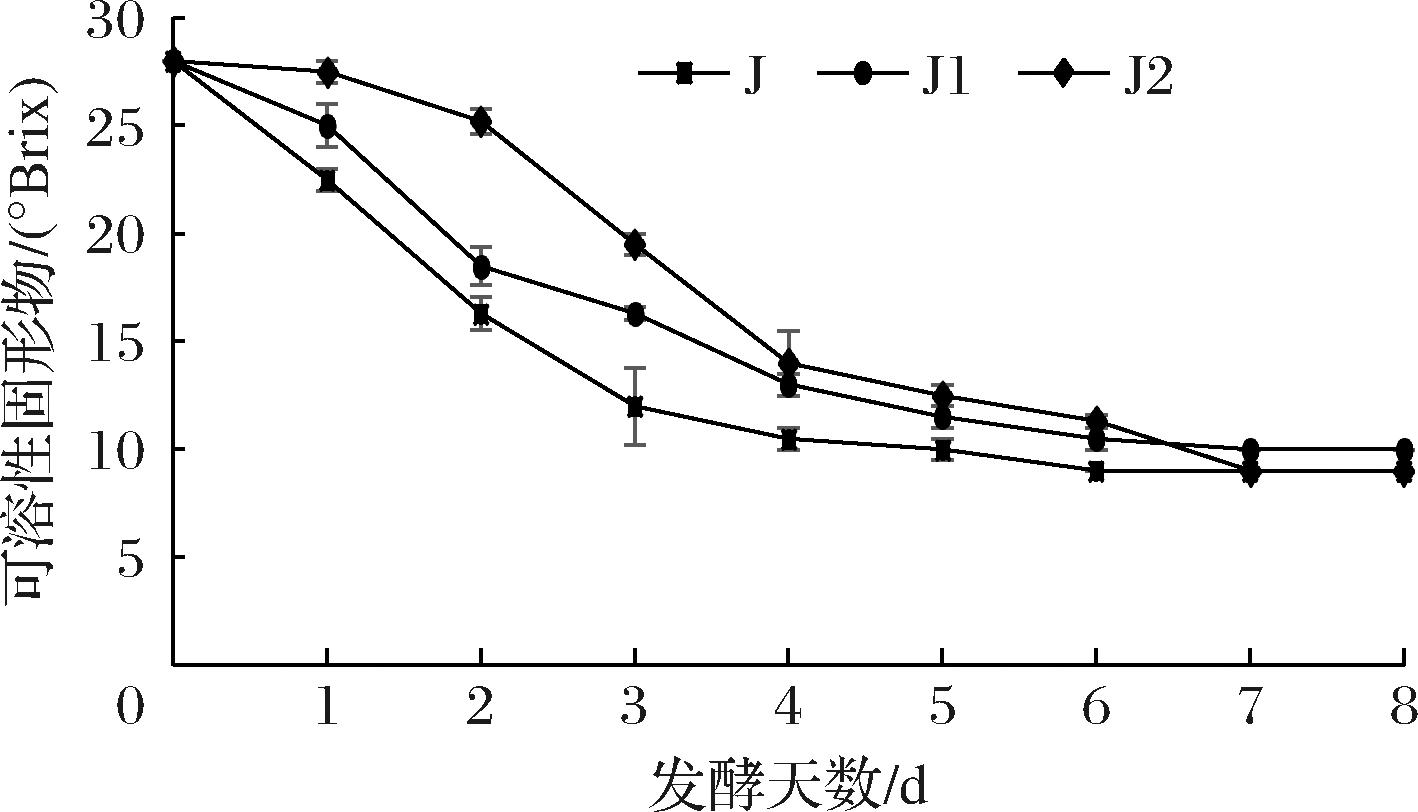
图4 三株菌发酵过程中可溶性固形物变化规律
Fig.4 Changes of soluble solids during fermentation of three strains
2.5.2 慕萨莱思的总酸、总糖、酒精度
由表6可知,菌株J1发酵慕萨莱思,总酸、总糖含量最高。菌株J发酵的慕萨莱思酒精度最高,总酸、总糖含量适中,说明菌株J消耗发酵液中糖分等物质比菌株J1、J2充分完全,产酒能力优于其他两株酵母菌,这可能是由于本研究筛选的酿酒酵母菌株J,具有更好的降糖、降酸和发酵产酒精的能力。
表6 三株酵母菌发酵慕萨莱思的成分比较
Table 6 Comparison of ingredients in the fermentation of Musalais by three strains of yeast

菌株编号总酸含量/(g/L)总糖含量/(g/L)酒精度/%volJ6.64±0.0541.7±2.3112.12±0.05J16.81±0.0543.5±3.3510.32±0.12J26.52±0.0336.4±1.7910.72±0.08
2.5.3 不同菌株发酵产品的感官评定结果
由10名具有评审慕萨莱思经验的人员对慕萨莱思进行感官评价,结果如表7所示,菌株J发酵的慕萨莱思感官评分最高,为(85.10±3.64)分,其酿造的慕萨莱思色泽澄清,焦香果香较浓郁,口感香味最佳。
表7 三株菌发酵慕萨莱思的感官分析
Table 7 Sensory analysis of Musalais by three strains

菌株外观香气滋味典型性总分/分J18.6±0.2525.3±1.5033.5±1.447.7±0.4585.10±3.64J113.3±0.3523.3±1.2427.0±1.387.4±0.5671.00±3.53J215.5±0.2821.6±1.4533.8±1.327.4±0.7578.30±3.80
3 结论
本研究以阿瓦提红葡萄果实为实验材料,经稀释涂布、划线分离筛选出6株酵母菌,经分子生物学鉴定出菌株J为酿酒酵母(Saccharomyces cerevisiae),菌株J1、J2、J3、J4、J5为丝孢毕赤酵母属(Hyphopichia),发酵性能试验结果显示,菌株J、J1、J2的酒精耐受性、耐酸能力较强,菌株J耐糖能力最强。将菌株J、J1、J2应用于发酵慕萨莱思,结果表明,菌株J发酵的慕萨莱思CO2排放量较强,发酵速率较快,糖分下降最快且稳定,总酸、总糖含量适中,酒精度最高,感官评分为85.10分,色泽美观、口感醇厚、酸甜可口,其理化和微生物指标均符合DB 65/T 2924—2008《慕萨莱思》,本研究筛选出的菌株J可为阿瓦提慕萨莱思工业化生产提供基础和理论参考,同时为进一步提升慕萨莱思的质量及品质奠定基础。
[1] 刘真. 降解5-羟甲基糠醛、高产焦糖香酵母菌筛选及其混菌发酵慕萨莱思的研究[D].阿拉尔:塔里木大学, 2021.LIU Z.Screening yeast strains with degradation of 5-hydroxymethylfurfural and high production of caramel compounds andfermentation Musalais by the co-inoculation of the screened strains[D].Alar:Tarim University, 2021.
[2] 谢志军. 阿瓦提县慕萨莱思葡萄酒产业化研究[D].石河子:石河子大学, 2020.XIE Z J.Study on industrialization of Musalles wine in awat county[D].Shihezi:Shihezi University, 2020.
[3] 赵叶. 乡村振兴背景下阿瓦提慕萨莱思品牌建设研究[D].阿拉尔:塔里木大学, 2023.ZHAO Y.Research on brand building of Avati Musales under the background of rural revitalization[D].Alar:Tarim University,2023.
[4] 冯姝.新疆慕萨莱思酵母菌分离鉴定及优势菌遗传多样性分析[D].阿拉尔:塔里木大学, 2013.FENG S.Yeast strains, isolation, identification and the of genetic diversity of dominant strains associated from Musalais in Xinjiang[D].Alar:Tarim University, 2013.
[5] 朱丽霞, 李红梅, 郭东起, 等.新疆慕萨莱思自然发酵过程中酵母菌表型多样性及优势菌分析[J].食品科学, 2012, 33(7):142-147.ZHU L X, LI H M, GUO D Q, et al.Phenotype diversity and dominant species of yeasts during spontaneous fermentation process of Musalais from Xinjiang[J].Food Science, 2012, 33(7):142-147.
[6] 陈丽花, 任丽霞, 李东娜, 等.甜酒曲中优质酵母菌的分离鉴定及其产香特性分析[J].食品科学, 2021, 42(6):142-149.CHEN L H, REN L X, LI D N, et al.Fermentation characteristics for flavor compounds production by quality yeast strains isolated from rice wine starters[J].Food Science, 2021, 42(6):142-149.
[7] 金博, 乔瑞芳, 张菁, 等.群体感应系统对发酵食品的影响[J].中国食品学报, 2023, 23(12):375-384.JIN B, QIAO R F, ZHANG J, et al.Effect of quorum sensing system on fermented food [J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(12):375-384.
[8] ZHU L X, XUE J L.Modern technology homogenizes enological traits of indigenous Saccharomyces cerevisiae strains associated with Msalais, a traditional wine in China[J].World Journal of Microbiology &Biotechnology, 2017, 33(3):63.
[9] 薛菊兰, 程玉来, 张佰清, 等.慕萨莱思酿酒酵母产果胶酶及β-葡萄糖苷酶定性分析[J].食品科学, 2013, 34(19):166-169.XUE J L, CHENG Y L, ZHANG B Q, et al.Qualitative analysis of pectinase and β-glucosidase secreted by Saccharomyces cerevisiae strains isolated from Musalais[J].Food Science, 2013, 34(19):166-169.
[10] 乔通通.慕萨莱思产关键香优良菌株的筛选与工艺优化[D].阿拉尔:塔里木大学, 2022.QIAO T T.Screening and process optimization of key fragrant and excellent strains in Msalais[D].Alar:Tarim University, 2022.
[11] 杨创举, 何新, 朱丽霞.慕萨莱思降糖、降酸优良酵母菌的筛选[J].食品与发酵科技, 2020, 56(3):22-30.YANG C J, HE X, ZHU L X.Selection of excellent yeasts for decreasing sugar and acid in Musalais [J].Food and Fermentation Technologies, 2020, 56(3):22-30.
[12] 张佳斌, 王冠群, 陈彤国, 等.慕萨莱思复配发酵剂的实验室研制[J].中国酿造, 2017, 36(3):115-120.ZHANG J B, WANG G Q, CHEN T G, et al.Laboratory-scale development of combined starter for Msalais production[J].China Brewing, 2017, 36(3):115-120.
[13] 王静尧, 王文华, 王丽玲, 等.酿酒酵母与2株非酿酒酵母混酿培养中的增香特性[J].食品研究与开发, 2023, 44(11):60-66.WANG J Y, WANG W H, WANG L L, et al.Aroma enhancement characteristics of Saccharomyces cerevisiae and two strains of non-Saccharomyces cerevisiae in mixed culture[J].Food Research and Development, 2023, 44(11):60-66.
[14] 徐易洁, 张红玉, 解修超, 等.甘蔗内生酵母菌的分离鉴定及发酵性能[J].食品研究与开发, 2023, 44(1):159-166.XU Y J, ZHANG H Y, XIE X C, et al.Isolation, identification and fermentation performance of endophytic yeast in sugarcane[J].Food Research and Development, 2023, 44(1):159-166.
[15] 周桂珍, 杨伟明, 杨建兴, 等.宁夏贺兰山东麓葡萄酒酵母菌的筛选及应用[J].微生物学通报, 2023, 50(2):553-572.ZHOU G Z, YANG W M, YANG J X, et al.Screening and application of wine yeasts at the eastern foot of Helan Mountain in Ningxia Hui Autonomous Region[J].Microbiology China, 2023, 50(2):553-572.
[16] 马鹏. 高酯化力、糖化力和液化力霉菌的筛选及强化大曲的研究[D].阿拉尔:塔里木大学, 2023.MA P.Screening of molds with high esterification power, saccharification power and liquefaction power and resaerch on strengthening Daqu[D].Alar:Tarim University, 2023.
[17] 胡江南, 高熳熳, 马立娟, 等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造, 2023, 42(7):43-50.HU J N, GAO M M, MA L J, et al.Screening, identification and application of superior yeast strains for wine fermentation [J].China Brewing, 2023, 42(7):43-50.
[18] 金红, 张小燕, 路宏科, 等.耐高渗酵母选育及其在葡萄酒中的应用研究[J].中国酿造, 2021, 40(6):192-195.JIN H, ZHANG X Y, LU H K, et al.Breeding of hyperosmotic yeasts and their application in wine[J].China Brewing, 2021, 40(6):192-195.
[19] 肖新云, 刘又嘉, 邓艳玲, 等.伯顿毕赤酵母菌在酸性及胆盐环境的抗逆性研究[J].中国微生态学杂志, 2016, 28(6):655-658.XIAO X Y, LIU Y J, DENG Y L, et al.Resistance of Pichia burtonii in acid and bile salt environment[J].Chinese Journal of Microecology, 2016, 28(6):655-658.
[20] 向丽萍, 范斌强, 杨志龙, 等.一株耐酸性酿酒酵母的筛选鉴定及特性[J].食品与机械, 2021, 37(6):51-55.XIANG L P, FAN B Q, YANG Z L, et al.Screening and identification of a strain of Saccharomyces cerevisiae and its characteristics[J].Food &Machinery, 2021, 37(6):51-55.
[21] 周枫, 曹蒙, 范玉飞, 等.酿酒酵母与毕赤酵母协同作用对山楂酒发酵的影响[J].食品科技, 2023, 48(8):1-6.ZHOU F, CAO M, FAN Y F, et al.Effect of synergistic of Saccharomyces cerevisiae and Pichia pastoris on the fermentation of hawthorn wine[J].Food Science and Technology, 2023, 48(8):1-6.