玉米须是我国传统中药材,富含多糖,黄酮,皂苷,有机酸,生物碱等活性物质[1]。研究表明,玉米须多糖具有抗氧化,降低血糖血脂,调节免疫,抗肿瘤等功效。现有玉米须多糖的提取方式大多以热水提取法、酸碱辅助提取法、超声波辅助提取法等为主,采用微生物发酵法提取玉米须多糖鲜有报道,仅有胡楠楠等[2]采用黑木耳发酵制备玉米须多糖,但未深入研究发酵玉米须多糖的体内抗氧化活性。
微生物发酵法是一种生物转化的方法,研究发现经微生物发酵处理后的中草药有效成分能被充分提取,更好地发挥药效。酵母菌作为一种天然发酵剂,在自身生长代谢过程中会产生胞内酶和胞外酶,可以增加多糖溶出率,并且提高多糖的生物活性[3]。郭欣等[4]采用酵母发酵法测得黑木耳多糖提取率为17.65%,明显高于热水提取法(5.12%)和超声波提取法(11.95%)。李万丛等[5]利用酿酒酵母CCTCC M 2016373发酵获得发酵人参多糖,发现发酵多糖得率为15.2%,较未发酵人参多糖(9.4%)提高61.70%,并显著增强对羟自由基(·OH)和超氧阴离子自由基的清除能力。刘迎欣等[6]通过对比布拉氏酵母发酵前后山药多糖发现,相较于未发酵山药多糖[(383.03±12.57) mg/g],发酵山药多糖中的多糖含量得到显著提高[(480.71±5.93) mg/g],并且发酵山药多糖的促RAW264.7细胞增殖活性和免疫活性优于未发酵山药多糖。
本研究旨在探究酿酒酵母发酵后玉米须多糖得率、结构、以及抗氧化活性,为玉米须多糖的开发提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 原料与菌种
玉米须,安徽亳州中药材批发市场。高活性干酵母菌(酿酒酵母属),湖北安琪酵母股份有限公司。
1.1.2 主要试剂
1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、鼠李糖、甘露糖、木糖、阿拉伯糖、葡萄糖、半乳糖、半乳糖醛酸标准品,德国Sigma公司;DPPH,梯希爱化成工业发展有限公司;ABTS,山东西亚化学股份有限公司;葡萄糖、无水乙醇、苯酚、硫酸、水杨酸、过氧化氢、硫酸亚铁、过硫酸钾、甲醇、氯仿等试剂均为国产分析纯;酵母膏、琼脂粉、蛋白胨,均为国产生化试剂。
1.1.3 主要仪器
M3酶标仪,美谷分子仪器有限公司;LG10-2.4A,北京京立离心机有限公司;SJ-CJ-2D 超净工作台,苏州苏洁净化设备有限公司;PYX-DHS-500BS隔水电热培养箱,北京市永光明医疗仪器厂;HZQ-F160恒温摇床,北京东联哈尔仪器制造有限公司;PRIMAIDE高效液相色谱,日立科学仪器有限责任公司;BD-61T体式显微镜,博视达光学仪器有限公司;Zebralab 3.3 Viewpoint斑马鱼行为记录仪,诺达思信息技术有限责任公司。
1.2 实验方法
1.2.1 原料预处理及菌种培养
将玉米须除杂烘干,粉碎至250 μm以下,将其与体积分数80%乙醇按1∶20(g∶mL)的比例于60 ℃水浴1.5 h脱脂,减压过滤,置于通风处蒸干溶剂后得到脱脂原料,储存在干燥器中备用。
将酿酒酵母接入YEPD液体培养基中,于30 ℃进行活化培养,活化后涂布至固体培养基上,待平板长出菌落后,制成种子液备用。
1.2.2 FCSP的制备
称取一定质量的玉米须粉,按料液比1∶20(g∶mL)加入蒸馏水充分混合,121 ℃高压蒸汽灭菌15 min,灭菌完成后,待培养基温度降至室温接入种子液,发酵条件为:发酵时间48 h,接种量1%,初始pH 6,葡萄糖添加量1.0%,转速130 r/min,发酵结束后以5 000 r/min离心20 min,收集上清液并浓缩至一定体积,加入无水乙醇,4 ℃醇沉过夜。次日离心,保留沉淀,复溶烘干,即为发酵法玉米须粗多糖(fermented corn silk polysaccharides,FCSP)。
水提法玉米须多糖采用水提醇沉法,按料液比1∶20(g∶mL),95 ℃热水浸提2 h,其余步骤同发酵组,得到水提法玉米须粗多糖(water extracted corn silk polysaccharide,WCSP)。
玉米须粗多糖得率按照公式(1)计算:
粗多糖得率![]()
(1)
1.2.3 化学组成测定
采用苯酚-硫酸法测定样品中的多糖含量。以葡萄糖为标准品绘制标准曲线,得到回归方程:y=0.006 8x-0.002 8,相关系数R2=0.999 8。
多糖得率按照公式(2)计算:
多糖得率/%=总糖含量×粗多糖得率
(2)
采用杜马斯燃烧定氮法测定样品中蛋白质含量。
1.2.4 分子质量测定
参考杜国丰等[7]方法,采用液相凝胶色谱法测定。
1.2.5 单糖组成测定
参考宫春宇等[8]方法,采用PMP柱前衍生高效液相色谱法测定。
1.2.6 体外抗氧化能力评估
配制不同浓度的样品溶液,参照王俊龙等[9]的方法测定羟自由基(·OH)清除能力,参照张馨月等[10]的方法测定DPPH自由基清除活性,参考侯敏娜等[11]的方法测定ABTS阳离子自由基清除活性。
1.2.7 FCSP体内抗氧化能力评估
1.2.7.1 实验动物
实验动物为野生型AB品系斑马鱼,由齐齐哈尔大学食品与生物工程学院斑马鱼实验室提供。本动物实验经齐齐哈尔大学科技伦理委员会制批准实施。将成年斑马鱼饲养于斑马鱼系统中,控制循环养殖水温为(28±0.5) ℃,水质pH值为6.5~7.5,电导率为450~550 μS,自动计时器控制昼夜周期为14 h/10 h(光照/黑暗)交替循环,每日上午9点和下午4点各喂食1次丰年虾卵。
1.2.7.2 斑马鱼胚胎收集
实验前一晚,按照雌雄1∶2比例,随机捞选成熟斑马鱼置于交配缸中进行配对产卵,中间放置挡板隔开雌雄斑马鱼,次日9点给予光照并撤去挡板。斑马鱼自然产卵,1 h后收集胚胎,用养殖水洗净,收集健康胚胎备用。
1.2.7.3 斑马鱼氧化损伤模型
根据本实验室前期实验结果选择H2O2浓度为5 mmol/L作为氧化应激诱导浓度。将发育正常胚胎随机分为空白组、模型组、多糖保护组。随机选取受精后7~8 h(7-8 hours post fertilization,7-8 hpf)发育正常胚胎转移至6孔板中,每孔15个胚胎,加入不同浓度多糖溶液进行保护孵育,1 h后用5 mmol/L H2O2进行氧化损伤至24 hpf,随后用新鲜胚胎水冲洗胚胎,培养至96 hpf,每隔12 h更换1次培养水。
1.2.7.4 胚胎发育指标
(1)对死亡率的影响
参照1.2.7.3节对斑马鱼胚胎进行分组给药,从胚胎发育7 hpf观察至96 hpf,期间以卵黄囊凝集、心脏无收缩、无法自主运动等特征[12]作为判定胚胎死亡的标准并按照公式(3)计算死亡率。
死亡率![]()
(3)
(2)对心率的影响
待斑马鱼胚胎发育至96 hpf,利用体式显微镜观察,随机从各组中挑选10尾幼鱼,对其心率计数,每次20 s,每尾幼鱼计数3次取平均值。
(3)对形态发育的影响
从48 hpf开始,每隔24 h记录各组胚胎发育情况,直至96 hpf。利用体式显微镜观察并拍照记录斑马鱼胚胎心包囊肿、卵黄囊水肿、鱼鳔发育不良、体节弯曲等畸形情况。
1.2.7.5 神经发育指标
(1)自主运动水平评估
采用Zebralab 3.3 Viewpoint斑马鱼行为系统对斑马鱼自主运动水平进行检测。数据采集总时长为120 min,运用Zeblab分析软件生成原始数据,计算斑马鱼的总运动距离。
(2)光暗刺激运动水平评估
参考徐嫣艺[13]的方法,采用斑马鱼行为系统对斑马鱼幼鱼的行为进行监测和评估,通过幼鱼光照/黑暗刺激下产生的行为效应,分析其对光暗刺激的反应度及活动性。
1.3 实验方法
本研究所有数据均为3次测定的平均值,结果用“平均值±标准差”(mean±SD)表示。实验数值采用SPSS 26.0和GraphPad Prism 8.0 进行相关统计分析,采用Origin 2019b 进行绘图。
2 结果与分析
2.1 FCSP和WCSP的化学组成
由表1可知,FCSP的多糖得率高于WCSP,约提高了18.64%,推测是在发酵过程中酵母菌自身酶系破坏玉米须细胞壁纤维之间的酯键,发生剥皮反应[2],使得多糖溶出率提高,除此以外,FCSP中总糖含量较WCSP有所提高,而蛋白质含量下降,表明FCSP的纯度提高,这可能是由于酵母在生长代谢过程中优先利用还原糖、氨基酸等小分子营养物质进行生长繁殖[14],间接去除了一部分杂质,对粗多糖有一定的纯化效果。
表1 多糖得率及化学组成 单位:%
Table 1 Main compositions and yields of polysaccharide fractions

多糖种类粗多糖得率多糖得率总糖含量蛋白质含量FCSP3.70±0.351.40±0.0137.84±0.2116.90±0.18WCSP3.33±0.071.18±0.0135.28±0.2220.30±0.57
2.2 玉米须粗多糖的相对分子质量分析
如图1所示,FCSP和WCSP的HPLC图谱具有相似的保留时间,以不同分子质量的葡聚糖标准品建立标准曲线,得到回归方程y=-1.142 7x+14.438,R2=0.996 4,并计算出FCSP和WCSP的相对分子质量见表2,确定玉米须多糖的相对分子质量范围为1.33×104~1.42×104 Da,说明酿酒酵母发酵提取玉米须中的多糖,不会导致大分子多糖的降解,从而影响分子质量。
表2 FCSP和WCSP的相对分子质量
Table 2 Relative molecular mass of FCSP and WCSP
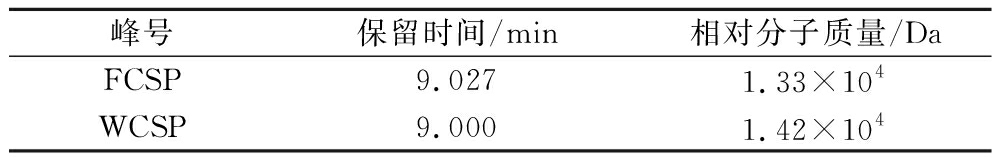
峰号保留时间/min相对分子质量/DaFCSP9.0271.33×104WCSP9.0001.42×104
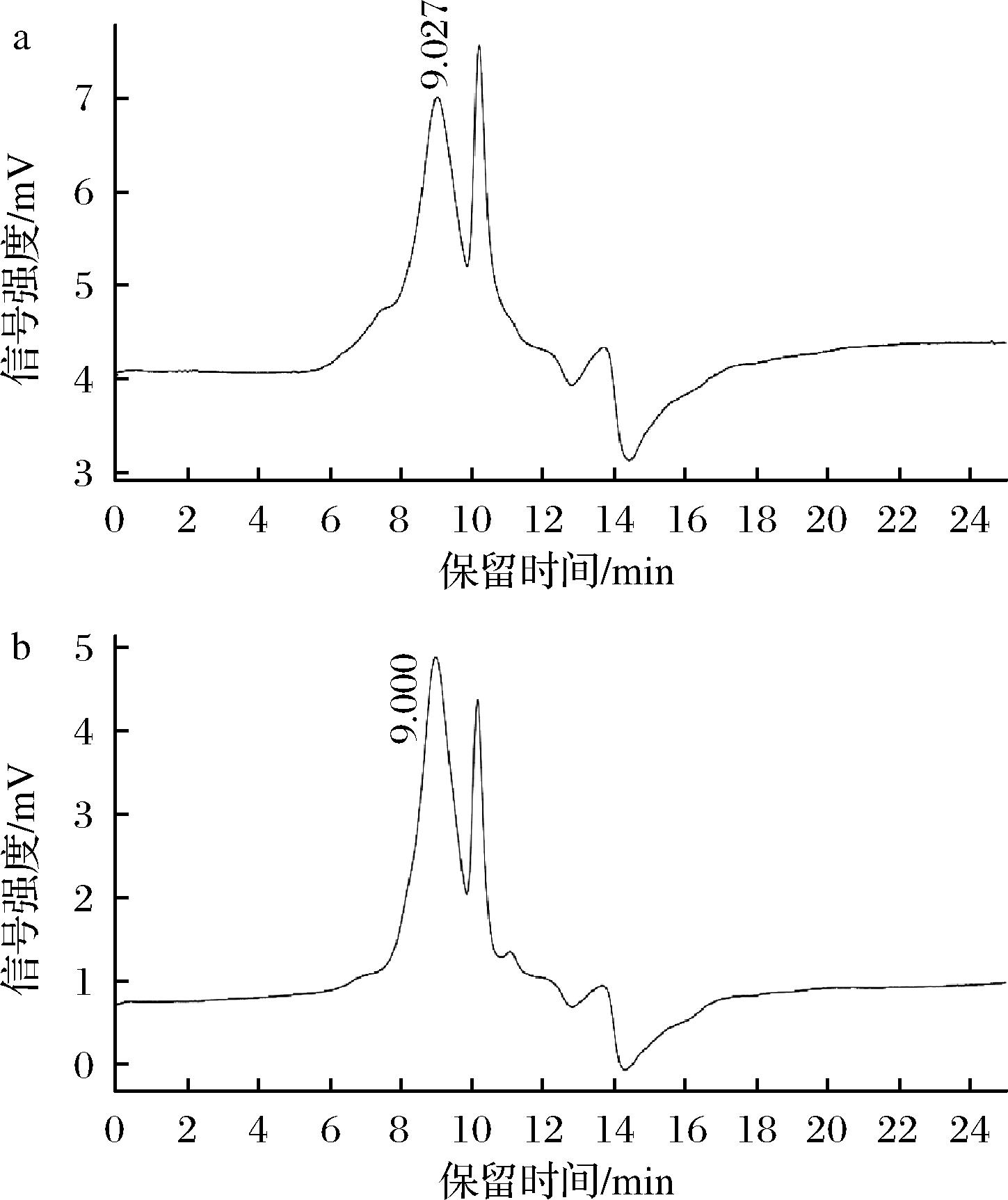
a-FCSP;b-WCSP
图1 FCSP和WCSP的HPLC图
Fig.1 HPLC chart of FCSP and WCSP
2.3 玉米须粗多糖的单糖组成分析
有研究报道,经微生物发酵后,植物多糖的单糖组成会发生变化[15]。FCSP和WCSP中的单糖组成如图2所示。对比图2-b和图2-c可以看出,FCSP和WCSP的单糖种类没有明显变化,但其比例发生了较大改变。FCSP主要由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖7种单糖组成,其摩尔比为1.18∶1.13∶0.45∶1.65∶1.04∶1.00∶0.85,此外还存在少量葡萄糖醛酸;WCSP的单糖组成与FCSP相似,其摩尔比为0.75∶0.85∶2.20∶1.57∶1.96∶1.00∶1.41。与WCSP相比,FCSP中甘露糖、鼠李糖、葡萄糖的摩尔比有所提高,这可能与微生物产胞外酶及其胞外多糖等因素有关[16],而半乳糖醛酸、半乳糖、阿拉伯糖含量大幅下降,这与蔡泓滢等[17]的研究结果类似,与发酵前相比,利用米曲霉发酵提取的马尾藻多糖发酵中半乳糖醛酸和半乳糖含量均明显下降。除此以外,FCSP和WCSP均存在一个未知糖X,通过对比,发现与采用相同实验方法的刘鹏等[18]的实验结果相似,出峰顺序一致,因此推测该未知糖为果糖。
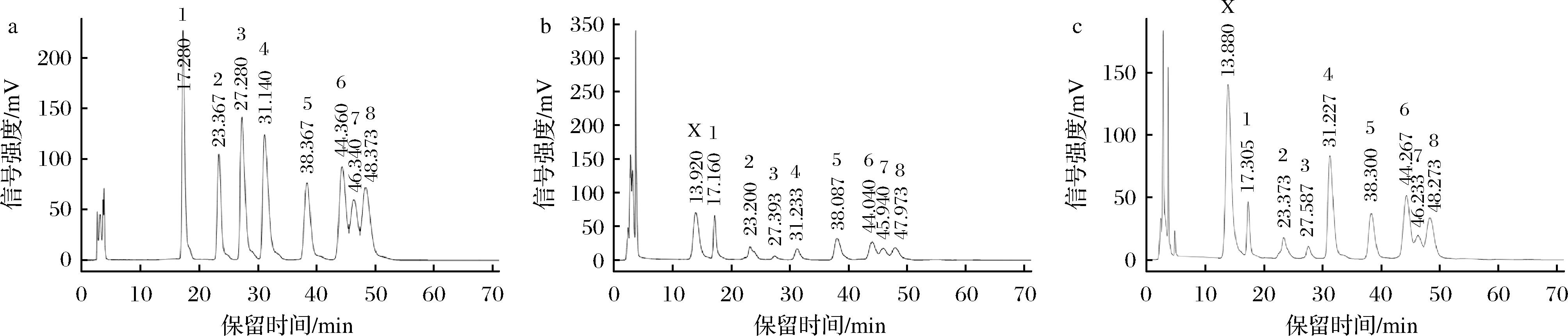
a-单糖标准品;b-FCSP;c-WCSP
图2 单糖组成结果
Fig.2 Results of monosaccharide composition
注:X-未知糖;1-甘露糖;2-鼠李糖;3-葡萄糖醛酸;4-半乳糖醛酸;5-葡萄糖;6-半乳糖;7-木糖;8-阿拉伯糖。
2.4 玉米须粗多糖的体外抗氧化活性分析
采用了·OH、DPPH自由基和ABTS阳离子自由基清除模型,以维生素C作为阳性对照测定其体外抗氧化能力。
2.4.1 ·OH清除能力分析
由图3-a可知,FCSP与WCSP均表现出了较强的清除·OH的活性,且在试验质量浓度范围内清除能力随着多糖质量浓度的增加而增强。与WCSP相比,同质量浓度下FCSP对·OH的清除率都有所增加,结合图3-d,其IC50值为(4.42±0.03) mg/mL,与WCSP[IC50值为(4.90±0.03) mg/mL]相比,降低了9.80%,这说明FCSP清除·OH的能力强于WCSP,可能是因为经过发酵,FCSP供氢能力增强,易于结合·OH,成为稳定的自由基,这与李万丛等[5]的研究结果一致。

a-·OH清除能力;b-DPPH自由基清除能力;c-ABTS阳离子自由基清除能力;d-不同自由基的IC50值
图3 玉米须多糖体外抗氧化活性。
Fig.3 Antioxidant activity of corn silk polysaccharide in vitro
注:“***”表示差异显著(P<0.001),“****”表示差异极显著(P<0.000 1)。
2.4.2 DPPH自由基清除能力分析
由图3-b可知,两种多糖样品对DPPH自由基的清除率,在试验质量浓度范围内均呈现剂量依赖性增加,但均低于维生素C。如图3-d所示,与WCSP相比,FCSP清除DPPH自由基的能力显著提高,其IC50值为(59.30±0.23) μg/mL,降低了11.61%,说明FCSP对DPPH自由基的清除能力强于WCSP。
2.4.3 ABTS阳离子自由基清除能力分析
由图3-c可知,多糖样品均表现出清除ABTS阳离子自由基的能力,且与多糖质量浓度呈正相关,但都低于阳性对照维生素C的清除效果,结合图3-d,FCSP的IC50值为(12.43±0.25) μg/mL,较WCSP[(15.99±0.33) μg/mL]下降了22.26%,说明FCSP清除ABTS阳离子自由基能力强于WCSP。
综合WCSP和FCSP对·OH、DPPH自由基以及ABTS阳离子自由基的清除效果,可见FCSP的体外抗氧化活性更强,推测可能是因为多糖含量提高,也可能是发酵过程中,微生物修饰多糖乙酰基,硫酸根含量提高引起的[19],需进行进一步的探究。
2.5 FCSP的体内抗氧化活性
与体外抗氧化活性研究相比,动物实验更能真实模拟体内环境,为了更全面地展现FCSP的抗氧化活性,利用H2O2诱导斑马鱼产生氧化应激反应,并通过观察记录斑马鱼的死亡率、心率、形态等发育情况以及神经发育情况,来评价FCSP对氧化损伤的保护作用。
2.5.1 FCSP对氧化应激斑马鱼发育的保护作用
2.5.1.1 对斑马鱼孵化过程中胚胎死亡率的影响
胚胎死亡率是斑马鱼孵化过程中的重要指标之一。由图4可知,与空白组相比,经5 mmol/L H2O2处理后的胚胎96 hpf死亡率显著升高,达到10%;而与模型组比,随着FCSP浓度的升高,多糖保护组胚胎的死亡率呈浓度依赖性显著降低,最高降低了96.7%,与空白组无异(P>0.05)。说明FCSP可以有效降低H2O2对斑马鱼胚胎的氧化损伤。
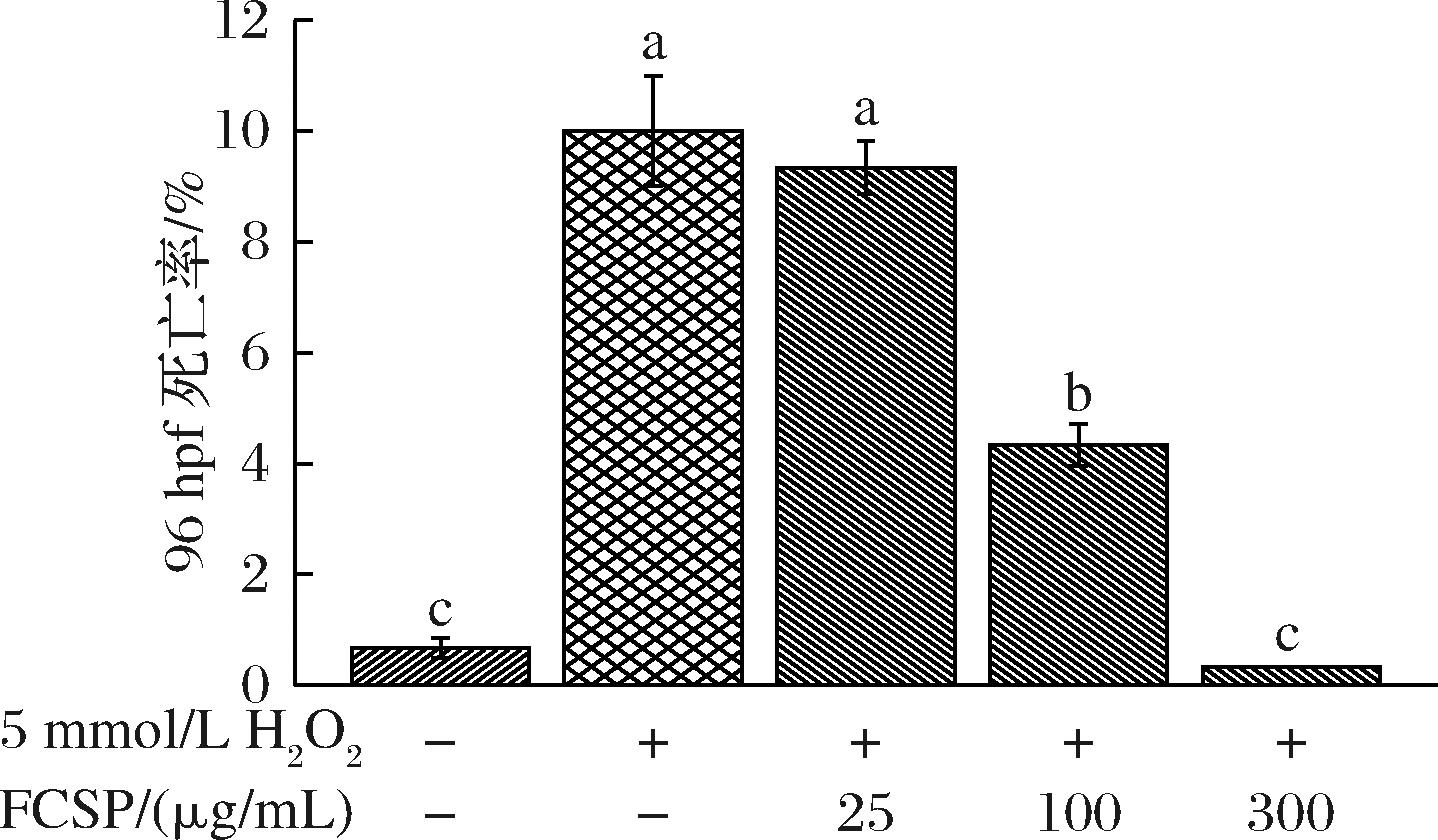
图4 FCSP对氧化损伤斑马鱼幼鱼死亡率的影响
Fig.4 Effects of FCSP on the mortality of oxidatively damaged zebrafish larvae
注:a~c不同字母表示不同组间存在着显著差异(P<0.05)(下同)。
2.5.1.2 对斑马鱼心率的影响
由图5可知,正常96 hpf斑马鱼幼鱼心率为59次/20 s。与空白组相比,在5 mmol/L H2O2诱导下,斑马鱼幼鱼心率急增,呈现出显著差异(P<0.05),这可能是因为氧化损伤导致斑马鱼心包囊肿,使得射血分数降低导致的心率过速[20]。而经不同质量浓度FCSP处理后的斑马鱼幼鱼,除了低质量浓度组没有明显改善,其余2个质量浓度均呈现显著下降趋势,并且存在剂量依赖性,这与WANG等[21]的结果一致,说明FCSP有改善H2O2导致的幼鱼心脏发育异常的作用。
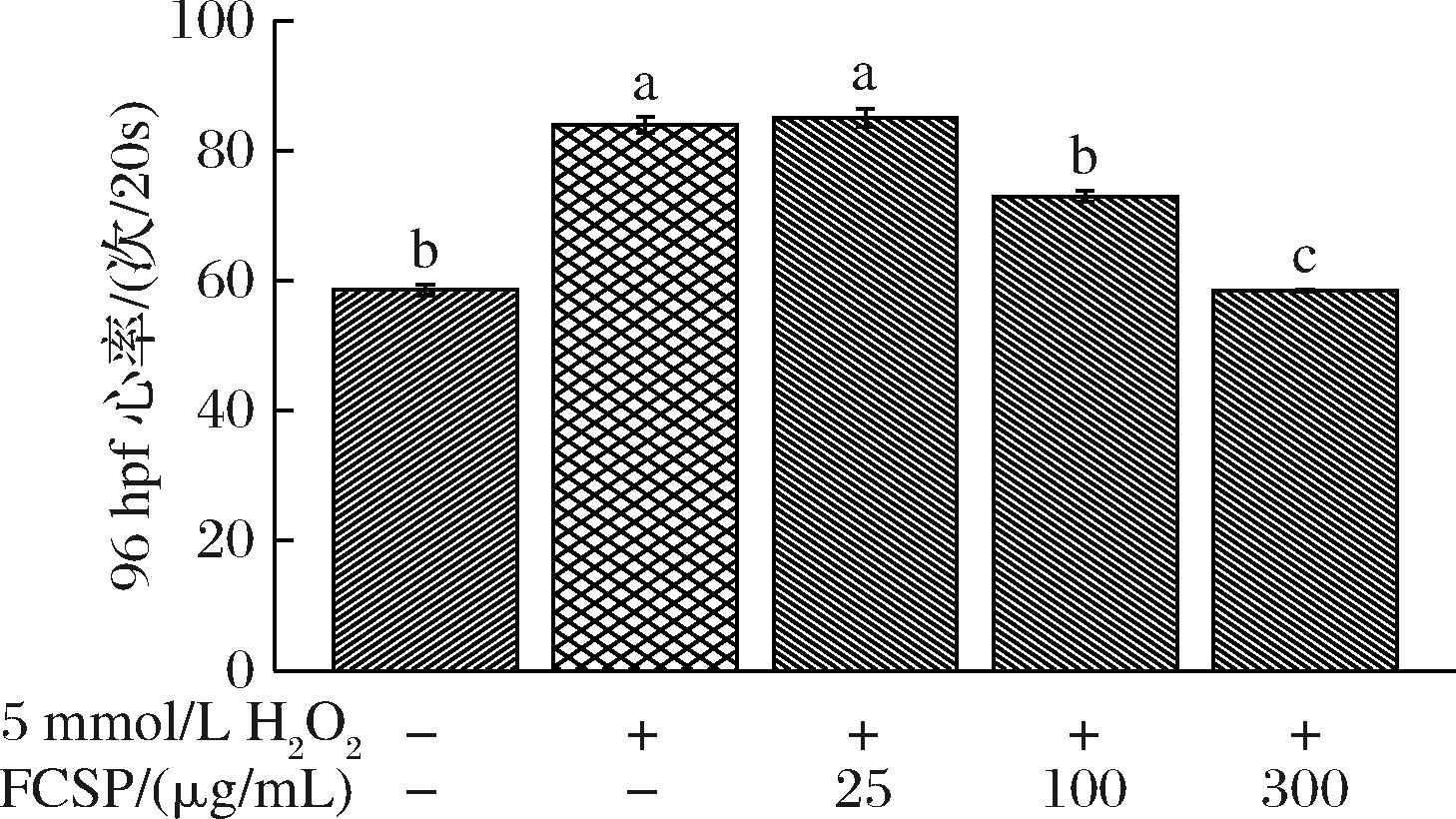
图5 FCSP对氧化损伤斑马鱼幼鱼心率的影响
Fig.5 Effects of FCSP on heartbeat rate of oxidatively damaged zebrafish larvae
2.5.1.3 对斑马鱼形态发育的影响
斑马鱼的形态变化是反映氧化损伤程度的直观指标,由图6可知,斑马鱼幼鱼在5 mmol/L H2O2的作用下,生长发育及表型出现明显的变化,斑马鱼幼鱼出现心包囊肿(pericardial edema, PE)、卵黄囊水肿(yolk sac edema, YSE)、脊柱弯曲(curved spine, CS)、尾部弯曲(curved tail, CT)、鱼鳔发育不良(swim bladder deficiency, SBD)、眼睛缩小(eyes shrink, ES)等明显的畸形表型,而空白组幼鱼在整个实验期间均表现出良好的发育状态。与模型组相比,多糖质量浓度为25 μg/mL时,幼鱼形态仍出现明显的物理畸形,这可能是因为FCSP质量浓度过低,没有到达作用有效剂量;当质量浓度增加到100 μg/mL时,幼鱼形态发育畸形的现象得到明显改善,卵黄囊水肿、鱼鳔未发育完全等情况减少;而当多糖质量浓度为300 μg/mL时,幼鱼形态与空白组无异,这说明FCSP对H2O2诱导的氧化应激造成的形态发育异常具有保护作用。
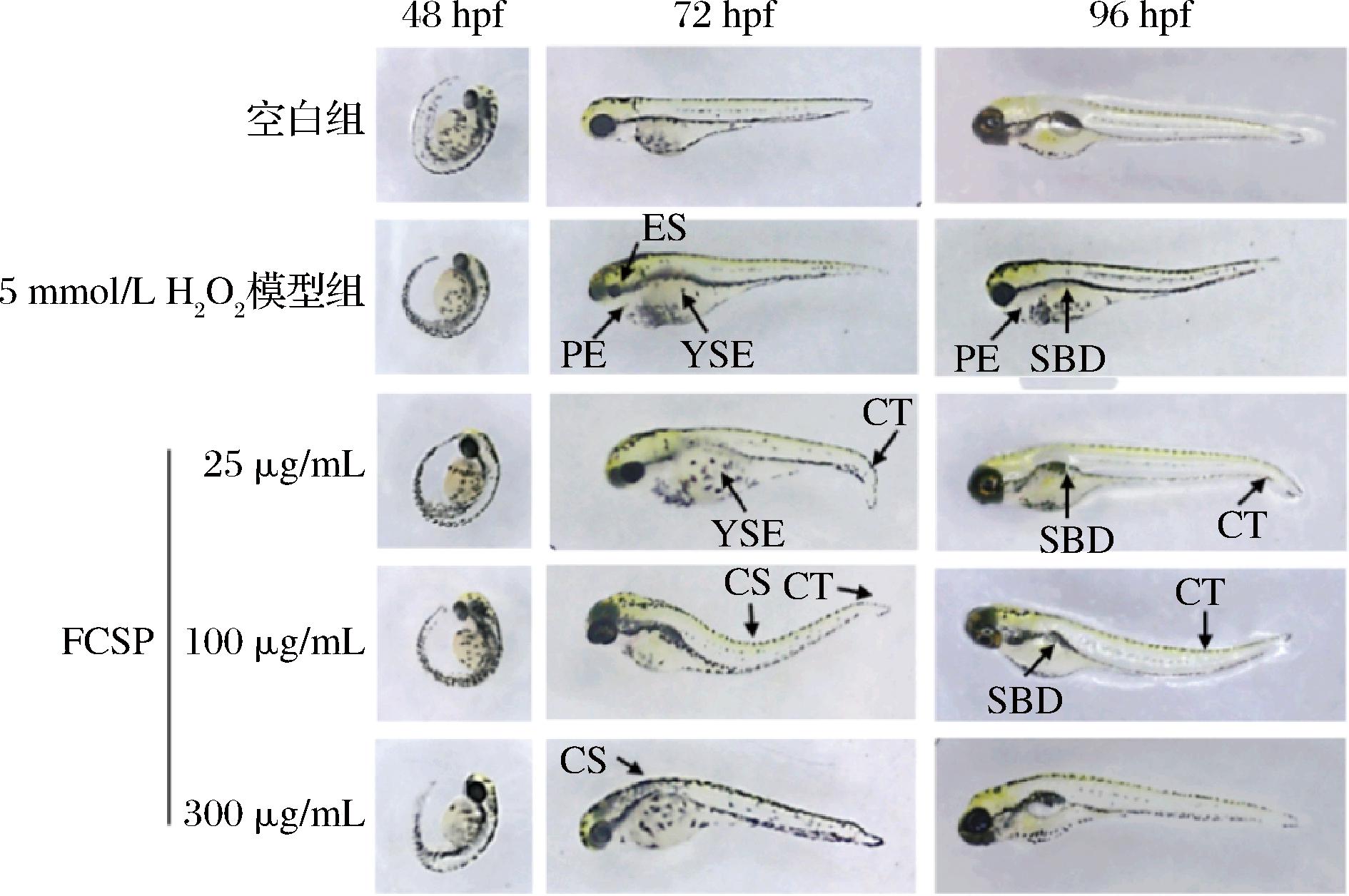
图6 FCSP对斑马鱼形态发育的影响
Fig.6 Effects of FCSP on morphological development of zebrafish
2.5.2 FCSP对氧化应激斑马鱼神经毒性的保护作用
研究发现,氧化应激或抗氧化保护机制失调会对神经元细胞造成损伤,从而导致中枢神经系统发育异常,这通常是引起斑马鱼行为改变的重要原因之一[22],因此,可以通过斑马鱼的运动行为特征反映斑马鱼的神经发育情况。
2.5.2.1 自主泳动水平评估
由图7可知,经5 mmol/L H2O2氧化损伤后,斑马鱼在2 h内的运动总距离为(950.27±108.72) cm,与空白组[(2 241.96±168.85) cm]相比,运动能力明显下降(P<0.05)。与模型组相比,FCSP组斑马鱼的总运动距离随着多糖浓度的升高而增加,治疗了幼鱼因氧化损伤造成的行动迟缓,其中当质量浓度为300 μg/mL时,FCSP-300组斑马鱼的总运动距离为(2 291.96±213.89) cm,恢复至空白组水平。

图7 FCSP对氧化损伤斑马鱼幼鱼自主运动的影响
Fig.7 Effects of FCSP on the autonomic movement of oxidatively damaged zebrafish larvae
2.5.2.2 光暗刺激运动水平评估
对间歇性光暗刺激的应激反应能力可以体现斑马鱼幼鱼的神经发育状况[23],突然的黑暗或者光照刺激会造成斑马鱼运动行为的改变,表现出正常的运动节律和周期性变化,而神经发育异常的斑马鱼,会偏离正常的运动轨迹。从图8可以看出,与空白组相比,模型组对光暗刺激反应敏感度下降,活动度明显降低,其平均速度减少了36.72%(P<0.05),其中,在光照条件下的平均速度下降了57.30%,而黑暗条件下的速度降低了23.64%,表明斑马鱼神经系统的发育可能受到损伤。除FCSP-25组未表现出对斑马鱼运动的促进作用,其余两组斑马鱼均变得活泼,运动速度分别提高了29%和53%。这些结果表明在紧急的光暗刺激状态下,H2O2暴露会降低斑马鱼幼鱼的反应能力,导致幼鱼不活泼,但经过多糖处理的斑马鱼,其对光暗刺激的反应力和平均移动速度在一定程度上均有所恢复,且呈现剂量依赖性。
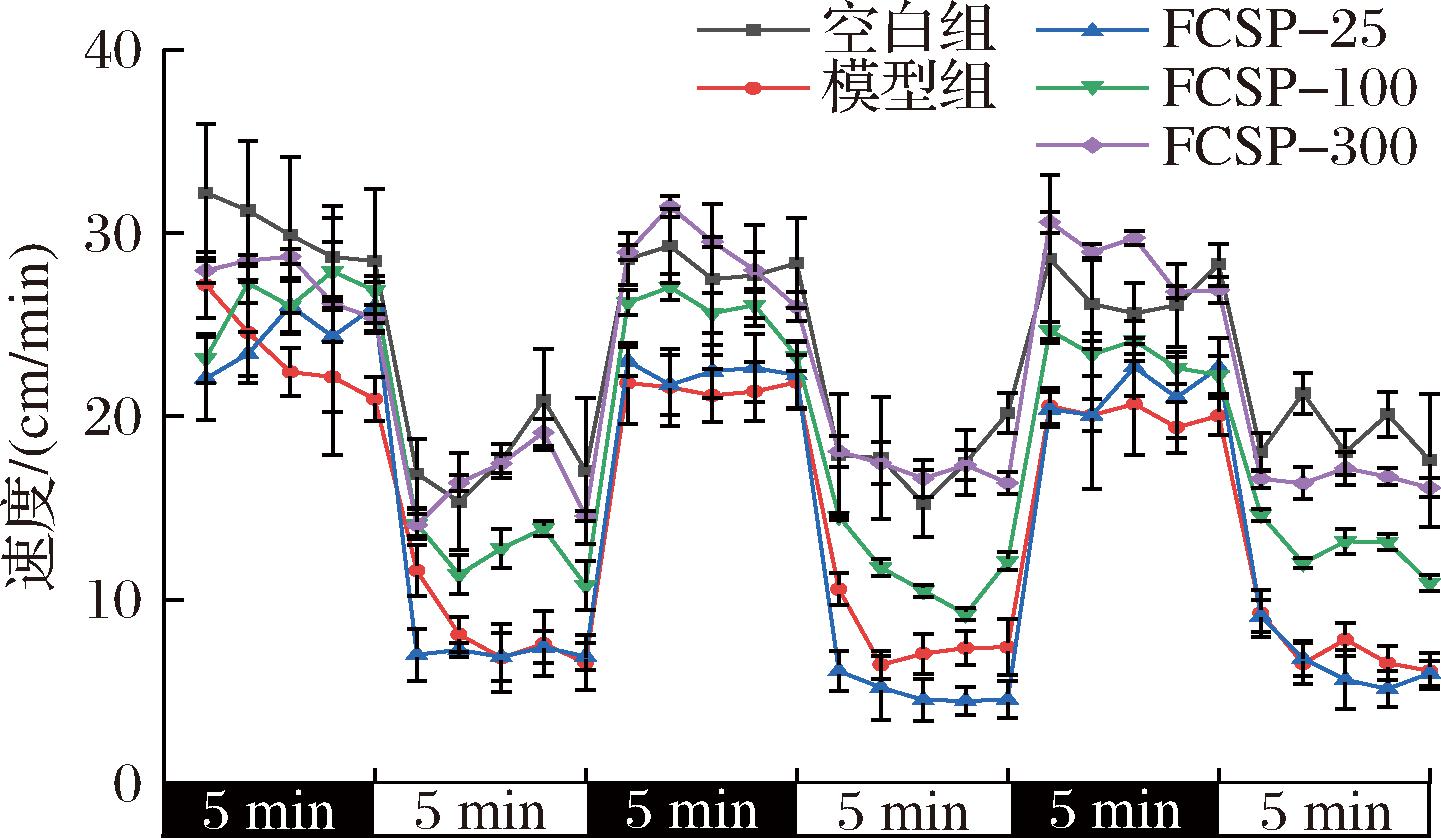
图8 FCSP对氧化损伤斑马鱼幼鱼在光暗刺激时运动的影响
Fig.8 Effects of FCSP on the movement of oxidatively damaged zebrafish larvae under light and dark stimulation
结合斑马鱼自主水平以及光暗刺激应激状态下的运动表现,可以得出,H2O2诱导斑马鱼氧化应激,会影响斑马鱼幼鱼的运动行为,整体呈抑制趋势,可能是因为5 mmol/L H2O2对斑马鱼的神经发育造成损伤,导致斑马鱼对刺激的反应力下降[24],而可以通过FCSP的保护来减轻H2O2造成的损伤,恢复斑马鱼的正常运动,并且在实验质量浓度范围内呈现剂量依赖性。
3 结论与讨论
本研究发现,通过发酵法制备FCSP,其提取率为(1.40±0.01)%,比水提法(1.18±0.01)%提高18.64%,说明微生物发酵可以提高多糖得率。分析发现,FCSP中总糖含量为(37.84±0.21)%,较WCSP提高,而蛋白质含量(16.90%)有所下降;FCSP的单糖组成以葡萄糖、甘露糖、鼠李糖、半乳糖、木糖、阿拉伯糖为主,其摩尔比为1.18∶1.13∶1.65∶1.04∶1.00∶0.85,与WCSP相比,甘露糖、鼠李糖、葡萄糖的摩尔比有所提高,而半乳糖醛酸、半乳糖、阿拉伯糖则大幅下降,说明微生物发酵会影响多糖的单糖组成;同时分析两者相对分子质量发现,发酵法对分子质量影响不大。
体外抗氧化实验中,FCSP表现出良好的·OH、DPPH自由基以及ABTS阳离子自由基的清除效果,其IC50分别为4.42 mg/mL、59.30 μg/mL、12.43 μg/mL,相较于WCSP分别降低了10.86%、11.61%、22.26%,说明微生物发酵可以提高多糖的体外抗氧化活性。
通过斑马鱼体内实验发现,100 μg/mL和300 μg/mL 的FCSP可以显著降低斑马鱼死亡率、缓解斑马鱼异常心率、改善形态畸形、恢复运动活力以及对光刺激的反应力,表明FCSP可以对由H2O2诱导造成的氧化损伤起到保护作用,是潜在的天然抗氧化剂。后续可深入研究FCSP对氧化应激斑马鱼保护的作用机制,为发酵玉米须多糖在食品、医药领域的应用进一步提供理论依据。
[1] 赵文竹, 于志鹏, 于一丁, 等.玉米须多糖的研究进展[J].食品科学, 2010, 31(11):289-292.ZHAO W Z, YU Z P, YU Y D, et al.Research progress of polysaccharides from stigma maydis[J].Food Science, 2010, 31(11):289-292.
[2] 胡楠楠, 亓伟华, 尤丽新, 等.玉米须多糖发酵工艺优化及其抗氧化活性研究[J].中国酿造, 2022, 41(10):159-164.HU N N, QI W H, YOU L X, et al.Optimization of fermentation technology and antioxidant activity of Stigma maydis polysaccharide[J].China Brewing, 2022, 41(10):159-164.
[3] 郭羽, 刘必旺, 徐荣芳, 等.酵母发酵技术对黄芪中多糖含量的影响[J].山西中医学院学报, 2012, 13(3):63-65.GUO Y, LIU B W, XU R F, et al.Influence of yeast fermentation technology on content of Astragalus polysaccharide in Radix asteagali[J].Journal of Shanxi College of Traditional Chinese Medicine, 2012, 13(3):63-65.
[4] 郭欣, 郭萌.酵母发酵法提高黑木耳多糖溶出率的工艺优化[J].盐城工学院学报(自然科学版), 2020, 33(1):67-73.GUO X, GUO M.Process optimization for improving the dissolution rate of Auricularia auricula polysaccharide by yeast fermentation method[J].Journal of Yancheng Institute of Technology (Natural Science Edition), 2020, 33(1):67-73.
[5] 李万丛, 艾芷伊, 游颖, 等.酿酒酵母CCTCC M 2016373发酵对人参多糖组分及抗氧化能力的影响[J].食品科技, 2019, 44(8):1-5.LI W C, AI Z Y, YOU Y, et al.Effects of Saccharomyces cerevisiae CCTCC M 2016373 fermentation on the composition and antioxidant capacity of ginseng polysaccharides[J].Food Science and Technology, 2019, 44(8):1-5.
[6] 刘迎欣, 伊娟娟, 邵怡雯, 等.布拉氏酵母发酵山药多糖的分离鉴定与体外生物活性探究[J].食品工业科技, 2023, 44(14):154-162.LIU Y X, YI J J, SHAO Y W, et al.Isolation, identification and biological activity of fermented Chinese yam polysaccharides by Saccharomyces boulardii[J].Science and Technology of Food Industry, 2023, 44(14):154-162.
[7] 杜国丰, 尹梦琪, 梁飞龙, 等.微波辅助H2O2/VC降解制备低分子量浒苔多糖的研究[J].食品工业科技, 2023, 44(12):37-44.DU G F, YIN M Q, LIANG F L, et al.Preparation of low-molecular-weight Enteromorpha polysaccharides by microwave-assisted degradation with H2O2/VC[J].Science and Technology of Food Industry, 2023, 44(12):37-44.
[8] 宫春宇, 徐硕, 徐先梅, 等.超滤分离制备玉米须粗多糖及其促益生菌增殖活性研究[J].食品与发酵工业, 2021, 47(17):166-171.GONG C Y, XU S, XU X M, et al.Structure and components of crude polysaccharide separated by ultrafiltration from Stigma maydis and its activity for promoting probiotics proliferation[J].Food and Fermentation Industries, 2021, 47(17):166-171.
[9] 王俊龙, 蔺永刚, 陈凤霞, 等.弯萼金丝桃总黄酮提取及抗氧化、降糖活性[J].精细化工, 2024, 41(5):1050-1059; 1083.WANG J L, LIN Y G, CHEN F X, et al.Total flavonoids from Hypericum benthamii:Extraction, antioxidant and hypoglycemic activity[J].Fine Chemicals, 2024, 41(5):1050-1059; 1083.
[10] 张馨月, 赵思毅, 吴明阳, 等.紫马铃薯花色苷提取工艺优化及稳定性、抗氧化活性分析[J].食品工业科技, 2024, 45(5):187-196.ZHANG X Y, ZHAO S Y, WU M Y, et al.Optimization of extraction process of anthocyanins from purple-fleshed potatoes and its stability and antioxidant activity[J].Science and Technology of Food Industry, 2024, 45(5):187-196.
[11] 侯敏娜, 李永梅, 辛新.响应曲面法优化超声-辅助提取玉米须多糖的工艺研究[J].世界中医药, 2017, 12(8):1923-1926;1932.HOU M N, LI Y M, XIN X.Optimization of ultrasonic assisted extraction of polysaccharides from corn silk by response surface methodology[J].World Chinese Medicine, 2017, 12(8):1923-1926;1932.
[12] 李圣日. 氚水对斑马鱼生长发育的毒性作用及机制研究[D].苏州:苏州大学, 2021.LI S R.Study on the toxicity and mechanism of tritiated water on the growth and development of zebrafish[D].Suzhou:Soochow University, 2021.
[13] 徐嫣艺. 环境镉暴露对斑马鱼的神经发育毒性效应及机制研究[D].兰州:兰州大学, 2023.XU Y Y.Developmental neurotoxic effects and mechanisms of environmental cadmium exposure in zebrafish[D].Lanzhou:Lanzhou University, 2023.
[14] 朱双杰, 向玉勇, 罗侠, 等.酵母发酵法提取石耳粗多糖工艺优化[J].北京农学院学报, 2012, 27(1):65-68.ZHU S J, XIANG Y Y, LUO X, et al.Technology optimization in extracting Umbilicaria esculenta polysaccharide by yeast fermentation[J].Journal of Beijing University of Agriculture, 2012, 27(1):65-68.
[15] HUANG F, HONG R Y, ZHANG R F, et al.Physicochemical and biological properties of Longan pulp polysaccharides modified by Lactobacillus fermentum fermentation[J].International Journal of Biological Macromolecules, 2019, 125:232-237.
[16] 朱伟林. 微生物发酵对龙眼多糖结构以及免疫活性的影响[D].广州:华南农业大学, 2020.ZHU W L.The Effect of microbial fermentation on structure and immunomodulatory activity of longan polysaccharide[D].Guangzhou:South China Agricultural University, 2020.
[17] 蔡泓滢, 李瑞, 汪卓, 等.真菌发酵对马尾藻可溶性膳食纤维结构、功能特性和抗氧化活性的影响[J].食品科学, 2023, 44(12):132-140.CAI H Y, LI R, WANG Z, et al.Effect of fungal fermentation on the structure, functional properties and antioxidant activity of soluble dietary fiber from Sargassum hemiphyllum[J].Food Science, 2023, 44(12):132-140.
[18] 刘鹏, 李静静, 乔彦良, 等.黄芩多糖的提取及结构表征[J].中国畜牧兽医, 2023, 50(6):2518-2530.LIU P, LI J J, QIAO Y L, et al.Extraction and structure characterization of Scutellaria baicalensis polysaccharide[J].China Animal Husbandry &Veterinary Medicine, 2023, 50(6):2518-2530.
[19] 罗游. 番石榴叶多糖活性分析及分离鉴定与发酵提升[D].广州:华南理工大学, 2020.LUO Y.Bioactivity evaluation, isolation, identification and fermentation promotion of polysaccharides from guava leaves[D].Guangzhou:South China University of Technology, 2020.
[20] 邵育朋. 萝卜硫素通过Sirt1通路减少H2O2诱导的斑马鱼幼鱼凋亡损伤[D].长春:吉林大学, 2023.SHAO Y M.Sulforaphane acts through Sirt1 to prevent H2O2-induced apoptosis in zebrafish larvae[D].Changchun:Jilin University, 2023.
[21] WANG L, LEE W W, YANG H W, et al.Protective effect of water extract of Citrus pomace against AAPH-induced oxidative stress in vitro in vero cells and in vivo in zebrafish[J].Preventive Nutrition and Food Science, 2018, 23(4):301-308.
[22] 李昕桐, 丁平, 孙雅楠, 等. 微塑料对斑马鱼的毒性效应及机制研究进展[J]. 环境化学, 2024, 43(6):1792-1804.LI X T, DING P, SUN Y N, et al. Research status of microplastics for zebrafish on the toxicity and mechanism[J]. Environmental Chemistry, 2024, 43(6):1792-1804.
[23] D’AMORA M, GIORDANI S.The utility of zebrafish as a model for screening developmental neurotoxicity[J].Frontiers in Neuroscience, 2018, 12:976.
[24] 韩晓雯, 徐婕妤, 王伟伟, 等.内分泌干扰物三氯生和双酚A对斑马鱼神经毒性的健康风险研究[J/OL].中国环境科学, 2023.DOI:10.19674/j.cnki.issn1000-6 923.20230908.001.HAN X W, XU J Y, WANG W W, et al.Health risk investigation of endocrine disruptors triclosan and bisphenol A on zebrafish neurotoxicity[J/OL].China Environmental Science, 2023.DOI:10.19674/j.cnki.issn1000-6923.20230908.001.