传统的干腌肉制品主要是通过自然发酵加工的。碳水化合物、蛋白质和脂肪等大分子物质在微生物和内源酶的共同作用下被降解,形成干腌肉制品特有的风味前体物质[1]。宣威火腿是中国的传统肉制品,生产历史悠久。它在冬天的低温下腌制,以乌金猪后腿为原料,经过修割定形、上盐腌制、堆码翻压、洗晒整形、上挂风干、发酵管理等工序,在特定气候条件下风干成熟,形成独特风味。火腿具有肉质紧实、色泽红白分明、风味独特、便于携带运输、耐储藏等特点[2]。由于自然发酵过程受地理环境、气候、微生物群落等因素的影响,干腌肉制品易产生风味不稳定、缺乏特色香气、生产周期长、易受杂菌污染等问题,产品质量难以保证。
有研究报道,宣威火腿中的一些葡萄球菌、微球菌和霉菌共同作用,对火腿独特风味的形成起着重要作用。相比于细菌类发酵剂,霉菌类发酵剂很少用于肉制品发酵,但霉菌对肉制品的品质亦起着重要的作用[3]。一方面,霉菌生长代谢产生的多种酶可以降解蛋白质和脂肪,产生更多风味物质,丰富发酵肉制品的风味,提高产品质量[4];另一方面,霉菌还可以减少肉制品的水分挥发,提高水分活度。霉菌生长需要氧气,可以通过隔绝氧气,抑制氧化反应的产生,防止酸败。火腿上的霉菌直接关系到火腿的色、香、味的形成。
目前青霉菌是用于肉制品发酵的主要霉菌,包括Penicillium hrysgenum(产黄青霉菌)、Penicillium nalgiovense(纳地青霉)、Penicillium cundidum(白地青霉)和Penicillium roqueforti(娄地青霉)等[5]。陈杰等[6]将纳地青霉发酵剂接种到火腿中,以自然发酵火腿为对照,研究霉菌生长对火腿品质的影响,结果表明接种霉菌的样品风味和品质均有明显改善。李开雄等[7]发现无论从感官评定还是丙二醛(malondialdehyde, MDA)含量来看,添加霉菌的发酵香肠的品质都好于无霉菌的发酵香肠。因此在确保不产真菌毒素的前提下,利用现代微生物技术制备发酵剂,实现对肉类发酵过程的人工控制,不仅能提高食品的安全性和产品的风味质量,而且能克服自然发酵过程长且不可控的缺点。
因此,本研究以云南宣威猪后腿肉为宣威火腿的模拟体系,发酵100 d制得干腌肉块。以水分活度、颜色、pH、剪切力、硫代巴比妥酸值(thiobarbituric acid reactive substances, TBARS)、蛋白降解指数(proteolysis index, PI)、挥发性风味化合物含量,电子鼻和电子舌味觉特征为指标探究不同霉菌发酵剂对干腌肉块品质的影响,旨在阐明霉菌发酵剂对宣威火腿品质的影响机理,为改善肉制品风味提供了新的思路。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉,云南宣威农贸市场;1,2-二氯苯、三氯乙酸(trichloroacetic acid, TCA)、4,6-二羟基-2-巯基嘧啶、CHCl3、荧光胺、丙酮、NaCl、NaOH、KCl(均为分析纯),国药集团化学试剂有限公司;正构烷烃(C5~C25)标准品,美国Sigma公司;马铃薯葡萄糖琼脂培养基、酸性蛋白酶活性检测试剂盒、中性蛋白酶活性检测试剂盒、脂肪酶活性检测试剂盒,索莱宝公司。
1.2 仪器与设备
ICTHI-450发酵箱,施都凯仪器设备有限公司;恒温培养箱,上海齐欣科学仪器有限公司;酶标仪、荧光酶标仪,赛默飞世尔科技有限公司;水分活度仪,美国Aqua Lab公司;雷磁PHS-3C型pH计,上海仪电科学仪器股份有限公司;CR-410型色差仪,日本柯尼卡美能达公司;TA-XT2i型质构仪,英国Stable Micro Systems公司;CH260R高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;TQ8040型气质联用仪,日本岛津公司;电子鼻,上海保圣实业发展有限公司;SA402B电子舌系统,日本INSENT公司。
1.3 实验方法
1.3.1 发酵剂的制备
从市售宣威火腿中分离到鲁本斯青霉(Penicillium rubens)W10-1、鲁本斯青霉(P. rubens)W12-2和褐藻青霉(Penicillium fuscoglaucum)V8。各菌株均用18 S核糖核酸测序法进行鉴定,并在使用前保存于-80 ℃。将菌株涂抹于马铃薯葡萄糖琼脂平板,28 ℃培养5 d。培养结束后,用无菌去离子水收集培养基上的孢子,通过血球计数和无菌去离子水稀释,将菌悬液的浓度调节为107 CFU/mL,作为鲁本斯青霉和褐藻青霉的单菌种。将单一发酵剂悬浮液按1∶1或1∶1∶1比例混合制成混合菌悬液。
1.3.2 干腌肉块的制备
从当地市场购买检验合格的猪后腿肉(每块约500 g),用刀修割肉上的疏松结缔组织,削去两边多余的肥肉和腿皮。将体积分数5%的盐由下而上,由皮面到肉面,均匀涂抹揉搓在后腿肉肉块上进行腌制,排除血水。上盐后将肉块堆叠于温度为4 ℃,相对湿度为80%~90%的腌制室内腌制3 d。腌制完成后将肉块表面清洗干净,去除表面盐分和污物后,将肉块悬挂于温度为10~15 ℃,相对湿度为45%~60%的风干室内风干3 d。将风干完成后的肉块置于温度为15~25 ℃,相对湿度为55%~70%的发酵室中发酵15 d;将制备的霉菌发酵剂(鲁本斯青霉W10-1+褐藻青霉V8组、鲁本斯青霉W10-1组、褐藻青霉V8组、鲁本斯青霉W12-2组、鲁本斯青霉W12-2+褐藻青霉V8组、鲁本斯青霉W10-1+鲁本斯青霉W12-2+褐藻青霉V8组)均匀喷淋涂抹在发酵前期结束后肉块的表面后,置于温度为25~30 ℃,相对湿度为70%~80%的发酵室发酵60 d;将发酵中期结束后的肉块置于温度为10~25 ℃,相对湿度为60%~70%的发酵室中发酵20 d至成熟,得到干腌肉制品。接种组接种量为猪肉样品质量的2%,接种组样品在室温下放置1 h,以便于接种的霉菌附着。未接种的样品作为自然发酵组(对照组)。每组样品在单独的发酵室中发酵,以避免空气污染。
1.3.3 青霉菌蛋白酶和脂肪酶活性的测定
蛋白酶活性的测定:根据试剂盒说明书的方法进行测定。
脂肪酶活性的测定:根据试剂盒说明书的方法进行测定。
1.3.4 干腌肉块理化性质的测定
1.3.4.1 水分活度(aw)的测定
采用水分活度仪进行测定,计算样品的水分活度。将肉末样品(约5 g)放入仪器内进行检测,记录样品的aw,实验平行6次取平均值。
1.3.4.2 颜色的测定
取样后立即进行颜色测定以防止氧化导致颜色退化。将样品切片后,使用色差仪测定干腌肉块的颜色。数值用亮度(L*)、红度(a*)、黄度(b*)表示。色差仪用标准白校准板校准后,从每个样品的不同位置测量样品颜色,取平均值进行统计分析。
1.3.4.3 pH的测定
将肉末样品(5 g)加入50 mL 质量分数0.75%的KCl溶液,用高速分散器匀浆1 min。用纱布过滤浆液后,用pH计测量pH值,实验平行6次取平均值。
1.3.4.4 剪切力的测定
将样品切成规则的形状(2.0 cm×2.0 cm×2.0 cm),借助质构仪测定剪切力。采用矩形刀头HDP/BSK垂直于肌纤维的方向进行剪切测试,记录最大作用力。实验参数:测试前速度2 mm/s,测试速度1 mm/s,测试后速度2 mm/s,触发力5 g,剪切深度30 mm。每组样品设置6个平行。
1.3.4.5 TBARS值的测定
根据DOM NGUEZ等[8]的方法进行测定。取2 g肉末,加入3 mL 4,6-二羟基-2-巯基嘧啶溶液和17 mL TCA溶液,在沸水浴中加热30 min,冷却至室温。取4 mL上清液与4 mL CHCl3混合均匀后,4 ℃、3 000 r/min离心10 min。测定上清液在532 nm处的吸光值,并用CHCl3进行校正。TBARS以1 kg脂质氧化样品MDA质量(mg)表示。其计算如公式(1)所示:
NGUEZ等[8]的方法进行测定。取2 g肉末,加入3 mL 4,6-二羟基-2-巯基嘧啶溶液和17 mL TCA溶液,在沸水浴中加热30 min,冷却至室温。取4 mL上清液与4 mL CHCl3混合均匀后,4 ℃、3 000 r/min离心10 min。测定上清液在532 nm处的吸光值,并用CHCl3进行校正。TBARS以1 kg脂质氧化样品MDA质量(mg)表示。其计算如公式(1)所示:
(1)
式中:A532,溶液的吸光值;m,样品的质量;9.48为常数。
1.3.4.6 PI的测定
参考ZHOU等[9]的方法,并作适当修改。基于荧光的方法测定等电点,以评估干腌肉块的蛋白质降解强度。取0.7 g样品与7 mL蒸馏水混匀并在8 000 r/min条件下均质30 s,用BCA试剂盒测定均质液的总蛋白浓度(B)。取150 μL上清液,加入600 μL 12.5%(质量分数)TCA溶液使蛋白沉淀,4 ℃、2 000 r/min离心10 min。取300 μL上清液,加入300 μL 2 mmol/L NaOH溶液中和,使得溶液最终pH为9.0,加入180 μL 0.6 mg/mL荧光胺-丙酮溶液,25 ℃避光反应1 h。用96孔板荧光仪测量混合物的荧光强度,分别以375 nm和475 nm作为激发和发射波长。用TCA处理前的原液浓度为基准,测定氨基酸N端α-氨基的水平(A)。其计算如公式(2)所示:
(2)
式中:A,氨基酸N端α-氨基的水平,B,均质液的总蛋白浓度。
1.3.4.7 干腌肉块中挥发性风味物质的测定
采用顶空固相微萃取结合气相色谱-质谱联用对干腌肉块中的挥发性化合物进行萃取和检测,采用内标法对干腌肉块中挥发性风味化合物含量进行定量。
取3 g混合均匀的样品放入20 mL顶空瓶中,加入3 μL 1,2-二氯苯溶液作为内标后迅速密封。将顶空瓶放入45 ℃水浴中平衡10 min。将DVB/CAR/PDMS萃取头插入顶空瓶中距离样品1 cm处,45 ℃水浴中萃取30 min,然后置于气相色谱-质谱联用仪器中解析5 min。
GC条件:色谱柱DB-WAX(30 m×0.25 mm×0.25 μm),载气He,流速1.5 mL/min,不分流;升温程序:起始温度40 ℃,保持3 min;5 ℃/min升温到90 ℃,然后以10 ℃/min的速率升温到230 ℃,保持7 min;汽化室温度230 ℃。
MS条件:电子电离源,电子能量70 eV,灯丝发射电流200 μA,离子源温度200 ℃,接口温度230 ℃,检测器电压1 000 V,扫描质量范围40~400 amu。
在相同条件下,测定正构烷烃(C5~C25)的保留指数。根据LYU等[10]的方法,使用NIST 2011版谱库进行检索分析并结合保留指数值来鉴定挥发性化合物。气味活性值(odor activity value, OAV)按公式(3)计算:
(3)
式中:C,挥发性化合物的浓度;OT,挥发性化合物的气味阈值。
1.3.4.8 电子鼻的测定
将3 g样品置于玻璃瓶中,室温放置1 h。实验前,以1 L/min的空气流速校准传感器信号60 min。测试前设备清洗时间1 800 s,测试后设备清洗时间1 800 s。单次测试时,测量样品120 s,清洗时间120 s,并始终保持1 L/min的空气流速。每组样品设置6个平行,记录平均值。
1.3.4.9 电子舌的测定
参考WANG等[11]的方法,取10 g样品与100 mL超纯水混合,在冰浴中匀浆10 000 r/min、30 s(10 s/次,共3次),静置30 min,将悬浮液用滤纸过滤,然后将收集的滤液在4 ℃、8 000 r/min离心10 min。离心后,上清液再次用滤纸过滤,采用电子舌分析样品的鲜味、咸味、酸味、丰富度、苦味,每组样品设置6个平行。
1.4 数据分析
数据结果使用Excel和Origin 2021处理并绘图。采用SPSS软件对数据进行单因素方差分析(analysis of variance, ANOVA),P<0.05时表示数据存在显著性差异。
2 结果与分析
2.1 青霉菌蛋白酶和脂肪酶活力分析
如图1所示,就酸性蛋白酶而言,其最适pH值为2.5~6.0,青霉菌对该范围的pH耐受能力较弱,虽然生长旺盛但酶活力较低,其中鲁本斯青霉W10-1+褐藻青霉V8组的酸性蛋白酶活性最高。中性蛋白酶最适pH值为6.5~8.5,中性蛋白酶酶活力大小顺序为鲁本斯青霉W10-1+褐藻青霉V8组>鲁本斯青霉W12-2+褐藻青霉V8组>鲁本斯青霉W10-1+鲁本斯青霉W12-2+褐藻青霉V8组>鲁本斯青霉W10-1组>鲁本斯青霉W12-2组>褐藻青霉V8组。其中鲁本斯青霉W10-1+褐藻青霉V8组的中性蛋白酶活力显著高于其他组,这可能是由于该组合菌株能产生分子质量较高、能作用于肉制品上的蛋白酶,有促进蛋白质降解的潜力[12]。本实验中干腌肉块的pH值为6.3~6.8,均在中性偏酸性范围内,因此产酸性、中性蛋白酶的青霉菌均适用于发酵干腌肉制品。
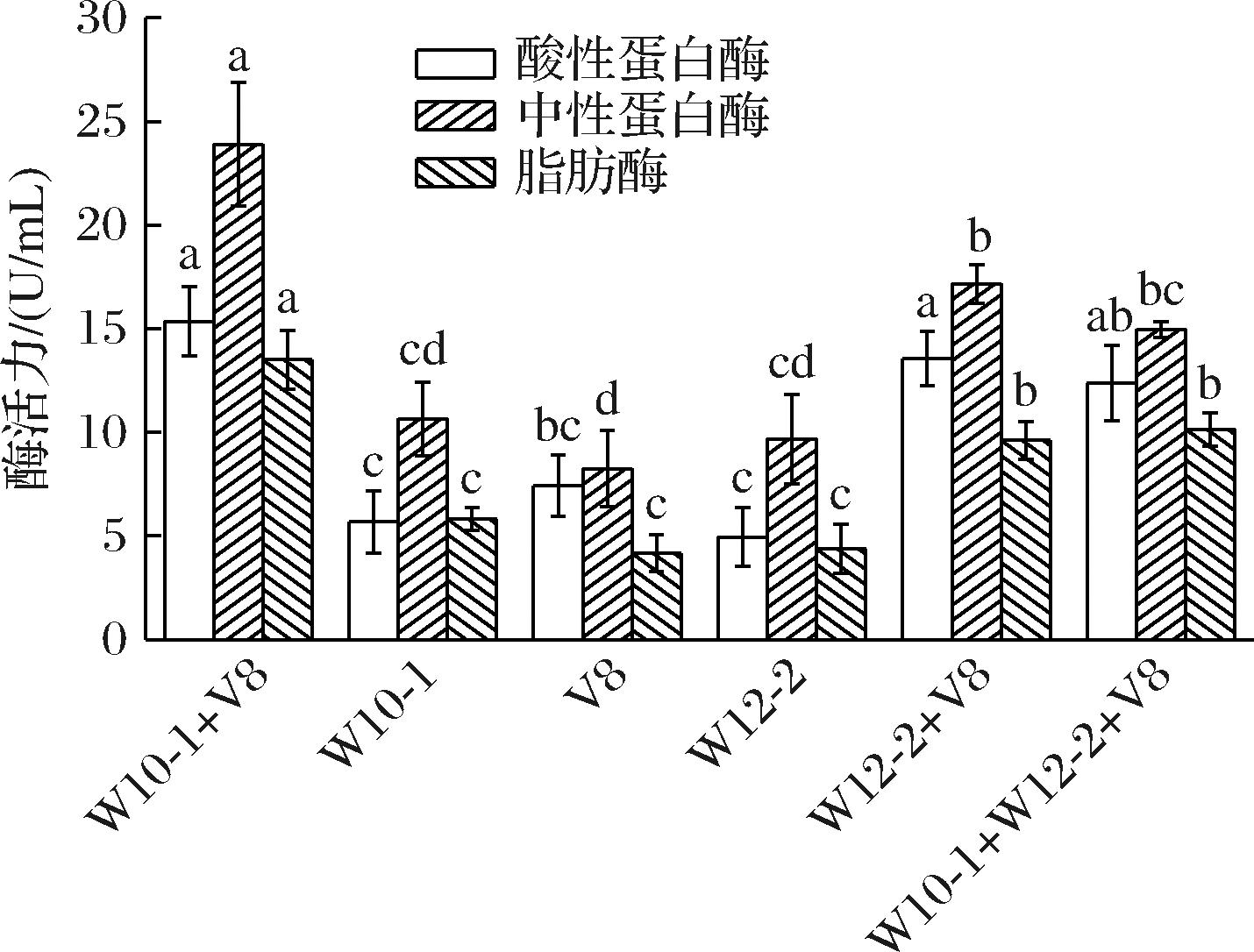
图1 不同发酵剂蛋白酶和脂肪酶活力
Fig.1 Enzyme activity of protease and lipase of different mold starter cultures
注:同一种酶不同小写字母代表存在显著差异(P<0.05)。
脂肪酶在肉制品的生产中具有重要作用。已有研究,通过将脂肪酶添加至肉制品中,来改善和强化肉制品的风味[13]。在肉制品生产加工过程中,一些有益的霉菌在其发酵过程中起着关键作用,能够形成多肽、氨基酸、脂肪酸等易被消化吸收的活性小分子物质,促进风味形成。由图1可知组合菌的脂肪酶活性显著高于单一菌株,这可能是由于菌株的协同作用,其中鲁本斯青霉W10-1+褐藻青霉V8组的脂肪酶活性最高。
2.2 干腌肉块的理化性质分析
2.2.1 水分活度
水分活度是评价肉制品水分自由度的重要指标。一般情况下,干腌肉制品的Aw约为0.750[14],Aw太高,微生物越容易生长,从而导致肉制品腐败变质;而Aw太低,则会加速脂肪的氧化酸败。
如图2所示,鲁本斯青霉菌W10-1+褐藻青霉V8组、鲁本斯青霉菌W10-1组和褐藻青霉V8组具有较高的水分活度(0.732~0.735),显著高于其他处理组及自然发酵组。其中,自然发酵组水分活度最低为0.704。接种组水分活度高于自然发酵组原因可能是霉菌在肉块表面的生长有效地减缓了肉块水分的散失,进而延缓了水分活度下降。黎明[15]也指出喷洒了纳地青霉和白地霉的发酵火腿水分活度较高,说明霉菌具有延缓水分活度降低的作用。而鲁本斯青霉W10-1+褐藻青霉V8组、鲁本斯青霉W10-1组和褐藻青霉V8组的水分活度较鲁本斯青霉W12-2组、鲁本斯青霉W12-2+褐藻青霉V8组、鲁本斯青霉W10-1+鲁本斯青霉W12-2+褐藻青霉V8组高,这可能是由于鲁本斯青霉W12-2+褐藻青霉V8,鲁本斯青霉W10-1+鲁本斯青霉W12-2+褐藻青霉V8之间的生长发生拮抗作用,抑制了微生物的生命活动。
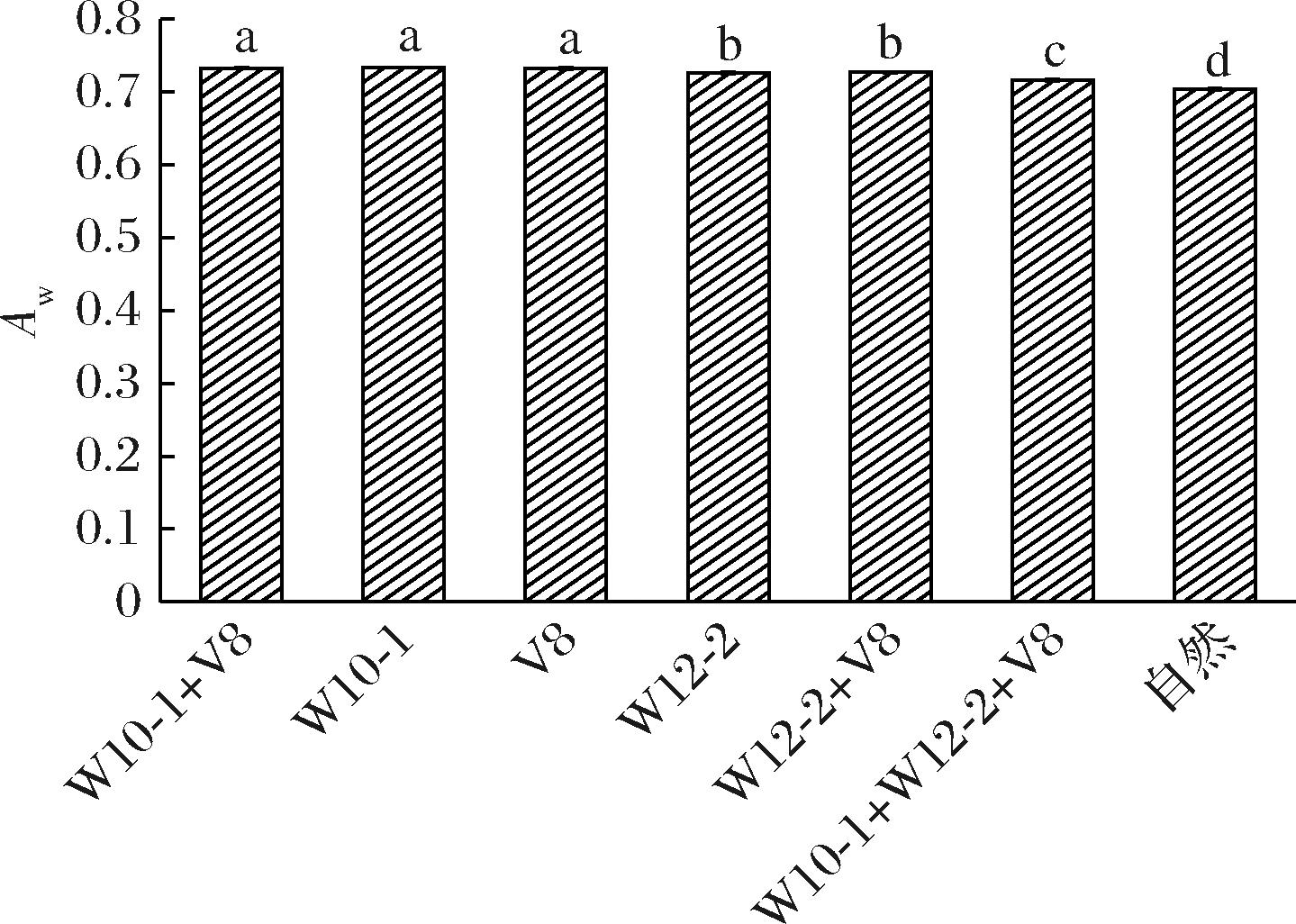
图2 接种不同发酵剂干腌肉块的水分活度Aw
Fig.2 Aw of dry-cured pork prepared with different mold starter cultures
注:上标小写字母不同表示差异显著(P<0.05)(下同)。
2.2.2 颜色
肉制品的颜色会影响消费者的认知和购买决策。通常,干腌肉制品的颜色会随着发酵的进行而加深[16]。由表1可知,接种组的亮度值(L*)和红度值(a*)显著高于自然发酵组,说明霉菌的添加能提升干腌肉块的亮度和红度。
表1 接种不同发酵剂干腌肉块的颜色
Table 1 Color of dry-cured pork prepared with different mold starter cultures
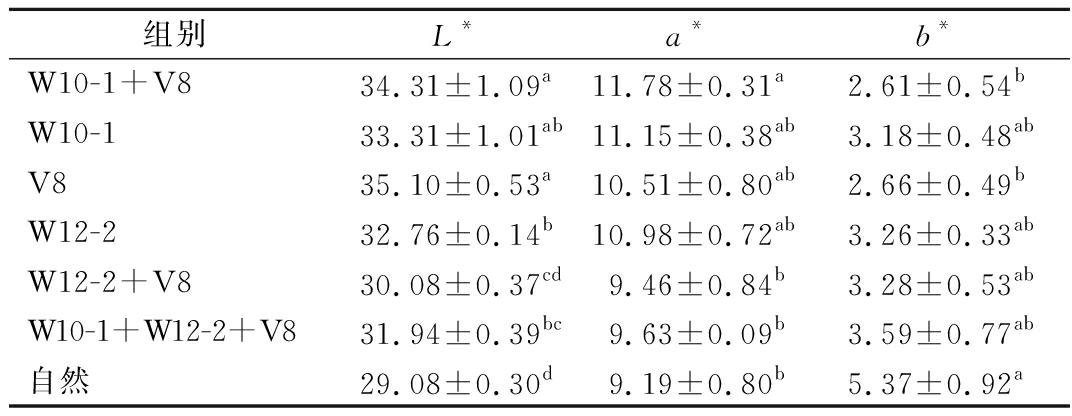
组别L*a*b*W10-1+V834.31±1.09a11.78±0.31a2.61±0.54bW10-133.31±1.01ab11.15±0.38ab3.18±0.48abV835.10±0.53a10.51±0.80ab2.66±0.49bW12-232.76±0.14b10.98±0.72ab3.26±0.33abW12-2+V830.08±0.37cd9.46±0.84b3.28±0.53abW10-1+W12-2+V831.94±0.39bc9.63±0.09b3.59±0.77ab自然29.08±0.30d9.19±0.80b5.37±0.92a
注:同一列不同字母上标代表存在显著差异。
2.2.3 pH
pH值是衡量肉制品品质的重要指标,其对肉制品颜色、水分活度以及硬度具有显著影响。如图3所示,接种组pH高于自然发酵组,这是由于霉菌产生的蛋白酶促进肌肉蛋白质水解产生了一些碱性游离氨基酸和含氮化合物,促使pH值上升[17]。如图1所示,鲁本斯青霉菌W10-1+褐藻青霉V8组的蛋白酶活性较高,导致其pH也最高。LARANJO等[18]的研究也指出,霉菌通过产生蛋白酶降解蛋白质,从而提高了肉制品的pH值。
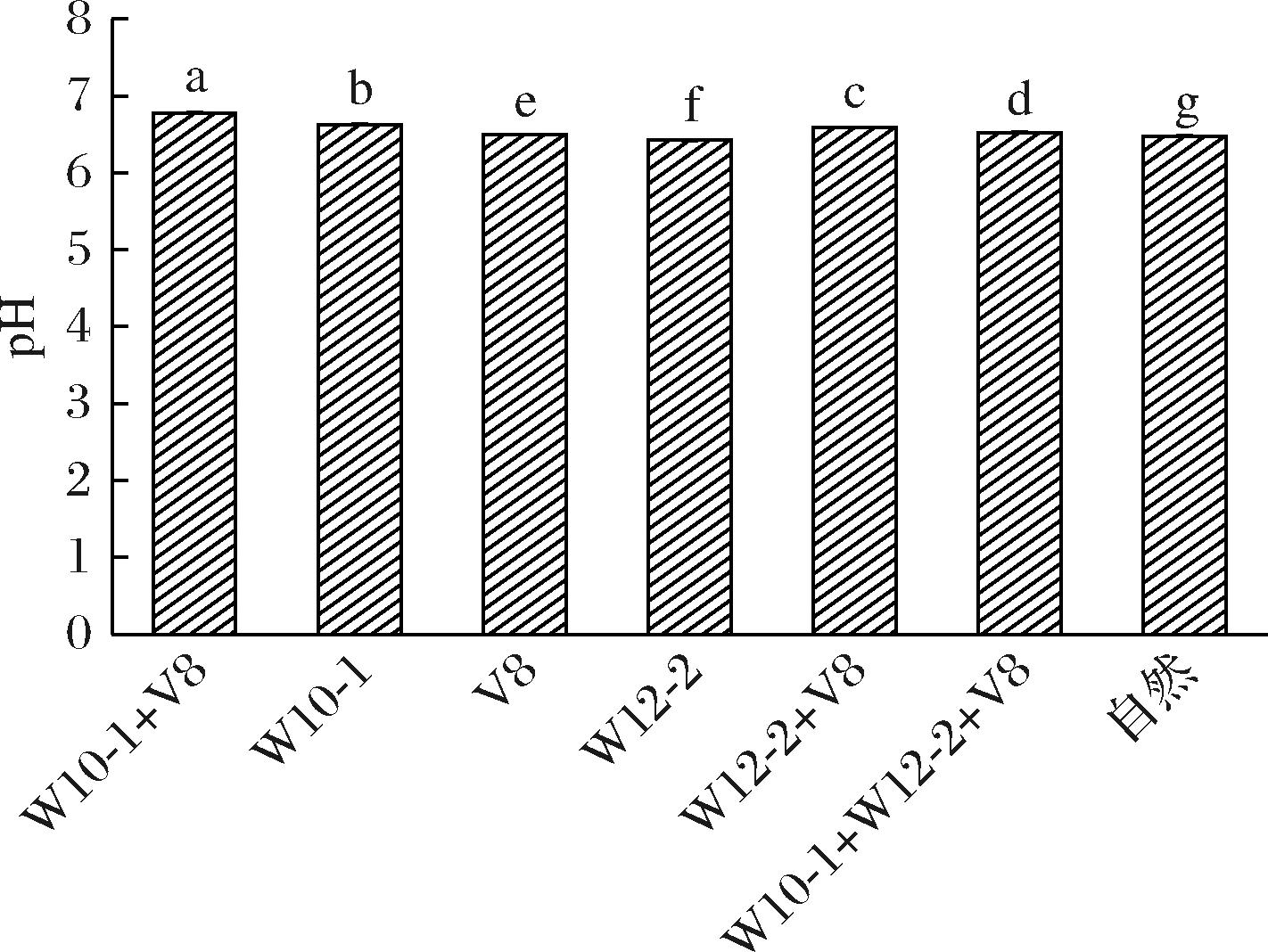
图3 接种不同发酵剂干腌肉块的pH值
Fig.3 pH of dry-cured pork prepared with different mold starter cultures
2.2.4 剪切力
剪切力是衡量肉制品质构和口感的重要指标,剪切力越大,肉的硬度越大。由图4可知,与自然发酵组(475 N)相比,接种了霉菌发酵剂的处理组干腌肉块的剪切力显著降低至315~410 N。各接种组剪切力大小顺序为鲁本斯青霉W10-1+褐藻青霉V8组>褐藻青霉V8组>鲁本斯青霉W10-1组>鲁本斯青霉W12-2组>鲁本斯青霉W12-2+褐藻青霉V8组>鲁本斯青霉W10-1+鲁本斯青霉W12-2+褐藻青霉V8组。接种发酵剂的干腌肉块剪切力显著低于自然发酵组的原因是接种组霉菌生长旺盛,产生了蛋白酶,提高了干腌肉块的蛋白质降解程度,破坏了肌肉结构蛋白的完整性,肌肉间相互作用力减小,降低剪切力,从而影响干腌肉块的质地,这一结果与刘功明等[19]的结果一致。
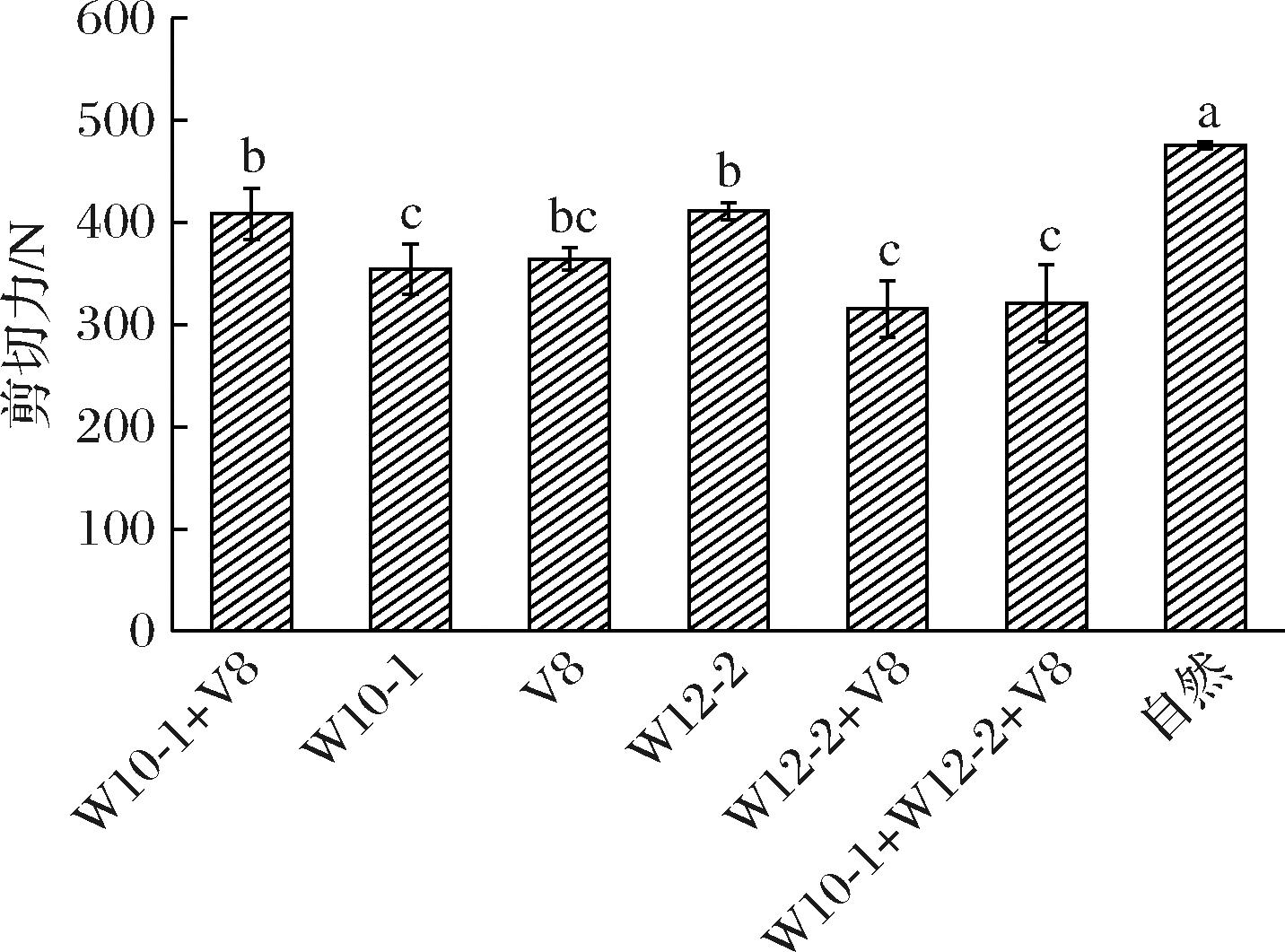
图4 接种不同发酵剂干腌肉块的剪切力
Fig.4 Shear force of dry-cured pork prepared with different mold starter cultures
2.2.5 TBARS值
TBARS是反映肉制品脂肪氧化程度的重要指标,也是肉制品在加工和储存过程中质量的评价标准之一。在肉制品的成熟过程中,会不断发生脂肪的氧化,脂肪氧化水解后产生的挥发性物质形成了肉制品独特的风味。国家标准规定TBARS值≤1 mg/kg,脂肪氧化程度较轻,肉制品品质较好。如图5所示,接种组的TBARS值为0.74~0.85,显著低于自然发酵组(1.28),说明接种霉菌发酵剂能显著抑制脂肪氧化,这可能是由于霉菌生长繁殖形成一层菌丝,在肉制品的表面形成一层“保护膜”,阻隔了氧气,抑制氧化反应,进而延缓脂肪氧化。
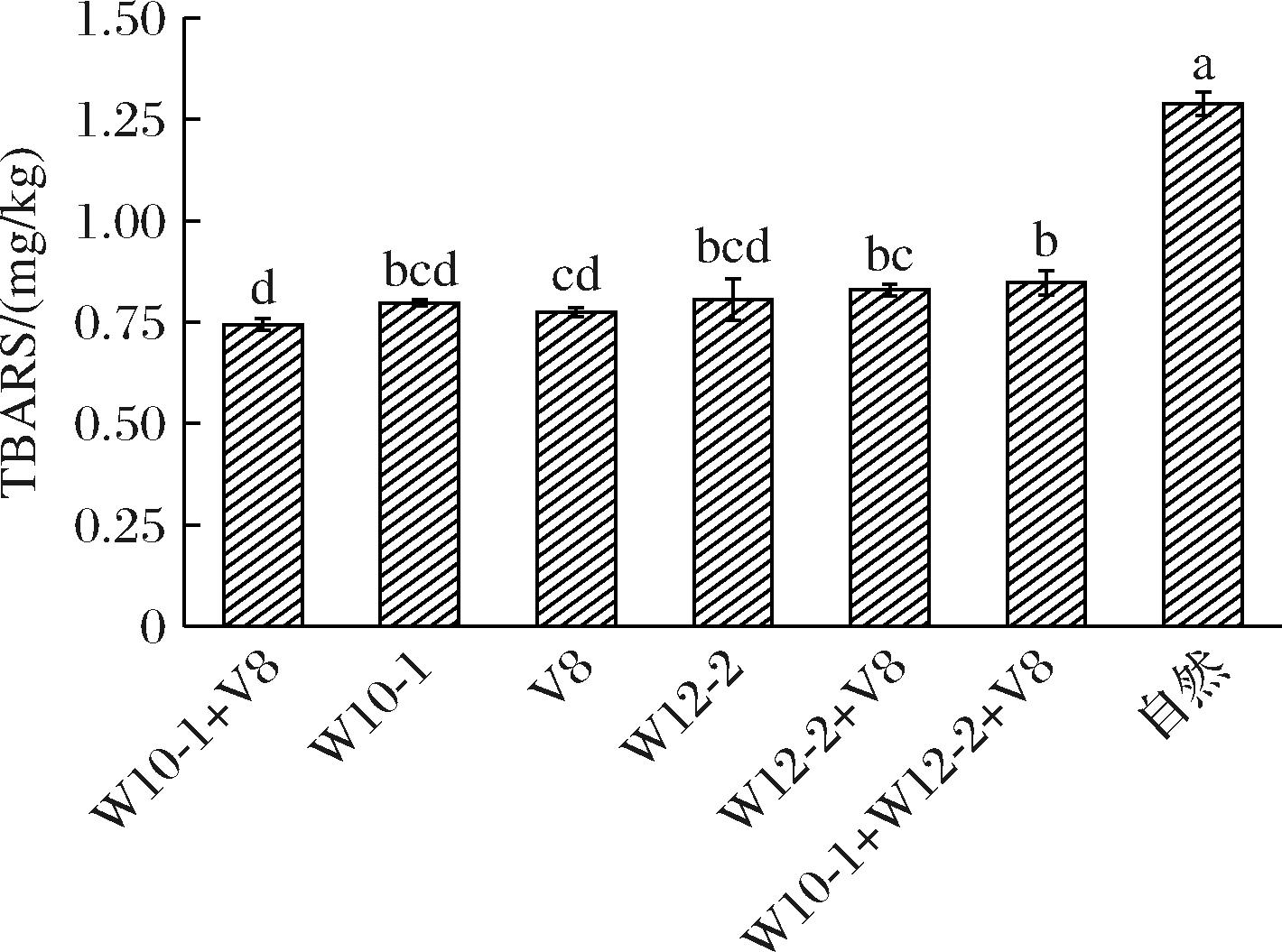
图5 接种不同发酵剂干腌肉块的TBARS
Fig.5 TBARS of dry-cured pork prepared with different mold starter cultures
2.2.6 PI
PI是反映肉制品蛋白质水解度的重要指标。随着加工过程的进行,PI不断增加,说明蛋白质的水解度越来越高。当蛋白质水解度过低时,产生的氨基酸、小肽等风味物质较少,不利于产品风味的形成,会影响肉制品风味,降低肉制品质量;而蛋白质水解度过高会使肉制品质地变软,此外,还可能会出现苦味和金属味,影响肉制品的整体感官品质。
一般情况下,优质意大利和西班牙干腌火腿的PI值在22%~30%和33%~36%[20],而金华火腿的PI值在14%~20%[21]。在本研究中,接种组的PI值均在8%~11%,均高于自然发酵组(7%),其中前5组显著高于自然发酵组(图6),说明霉菌的加入更有利于干腌肉块中蛋白质的水解。蛋白质降解程度的加深可能是由于微生物在整个发酵过程中引起的,在这个过程中,细菌、酵母类微生物在组织内部繁殖,而霉菌类微生物在组织外部生长,产生了各种有助于发酵过程中蛋白质降解的酶。微生物在发酵过程中产生的蛋白酶将蛋白质水解成多肽和氨基酸,部分分解肌原纤维,促进蛋白质水解,这与周慧敏[22]的结果一致。由于干腌肉块的制备时间短,蛋白质没有足够的时间降解,PI值相较于干腌火腿小。
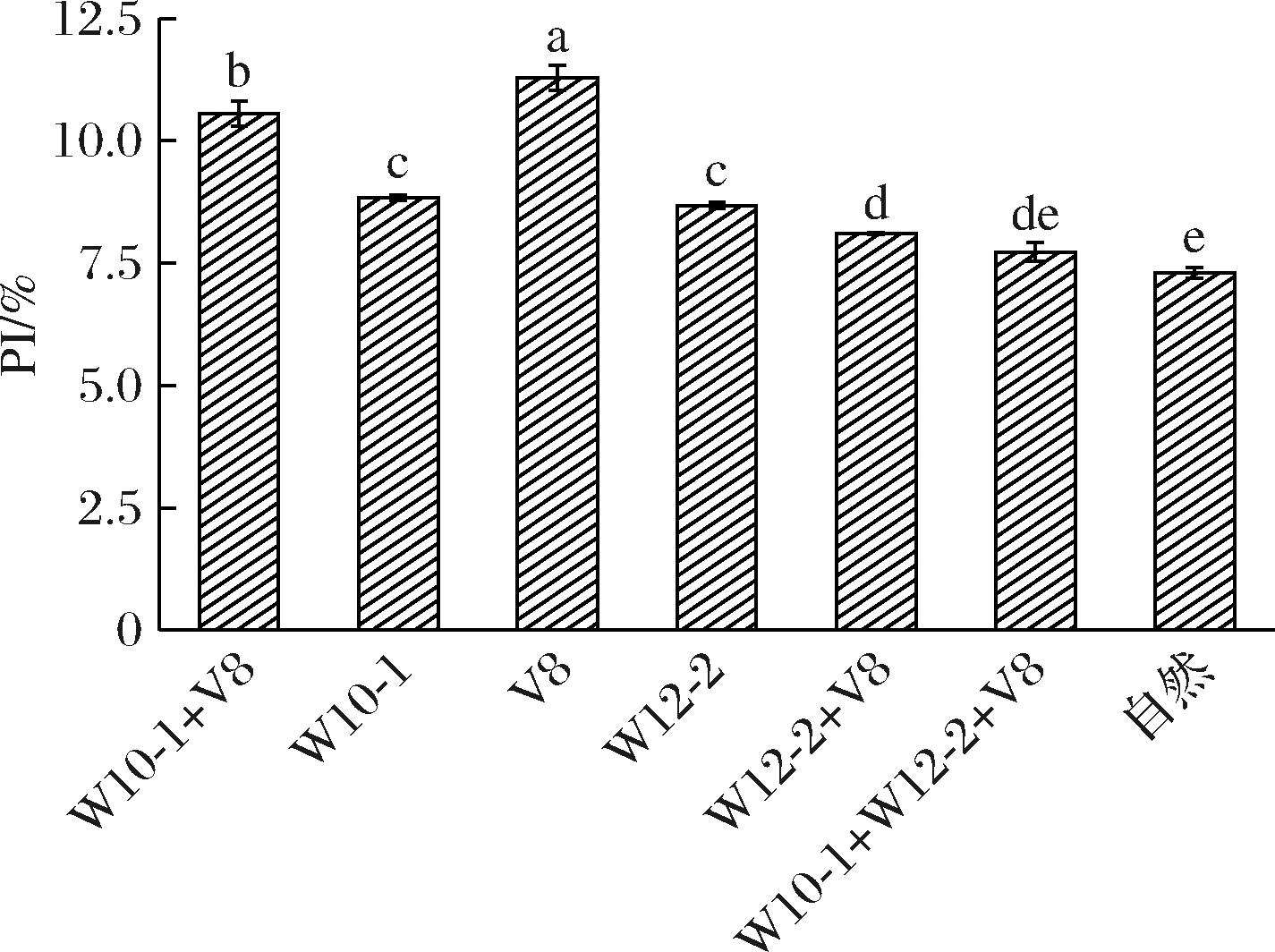
图6 接种不同发酵剂干腌肉块的PI
Fig.6 PI of dry-cured pork prepared with different mold starter cultures
2.3 挥发性化合物分析
干腌火腿中挥发性化合物的形成极其复杂,其种类和含量决定了最终产品的风味特征。采用GC-MS检测干腌肉块中挥发性风味化合物,具体化合物种类和含量如电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.038345)和图7所示。与自然发酵组相比,接种组干腌肉块的挥发性物质在种类上有所增加。自然发酵组中的挥发性化合物共有49种。其中,醛类14种、醇类8种、酯类8种、酮类5种、苯环类5种、呋喃类1种、烷烃类6种、其他类1种。接种组干腌肉块中检测到的挥发性化合物共有67种,其中醛类13种、醇类9种、酯类11种、酮类8种、苯环类5种、呋喃类3种、酸类2种、吡嗪类3种、烷烃类9种、烯烃类1种、其他类3种。总体来说,接种组的风味化合物种类多于自然发酵组,这可能是由于青霉菌在肉制品发酵中,通过发达的酶系分解蛋白质、脂肪,产生小分子肽、氨基酸和脂肪酸,形成挥发性物质的前体。
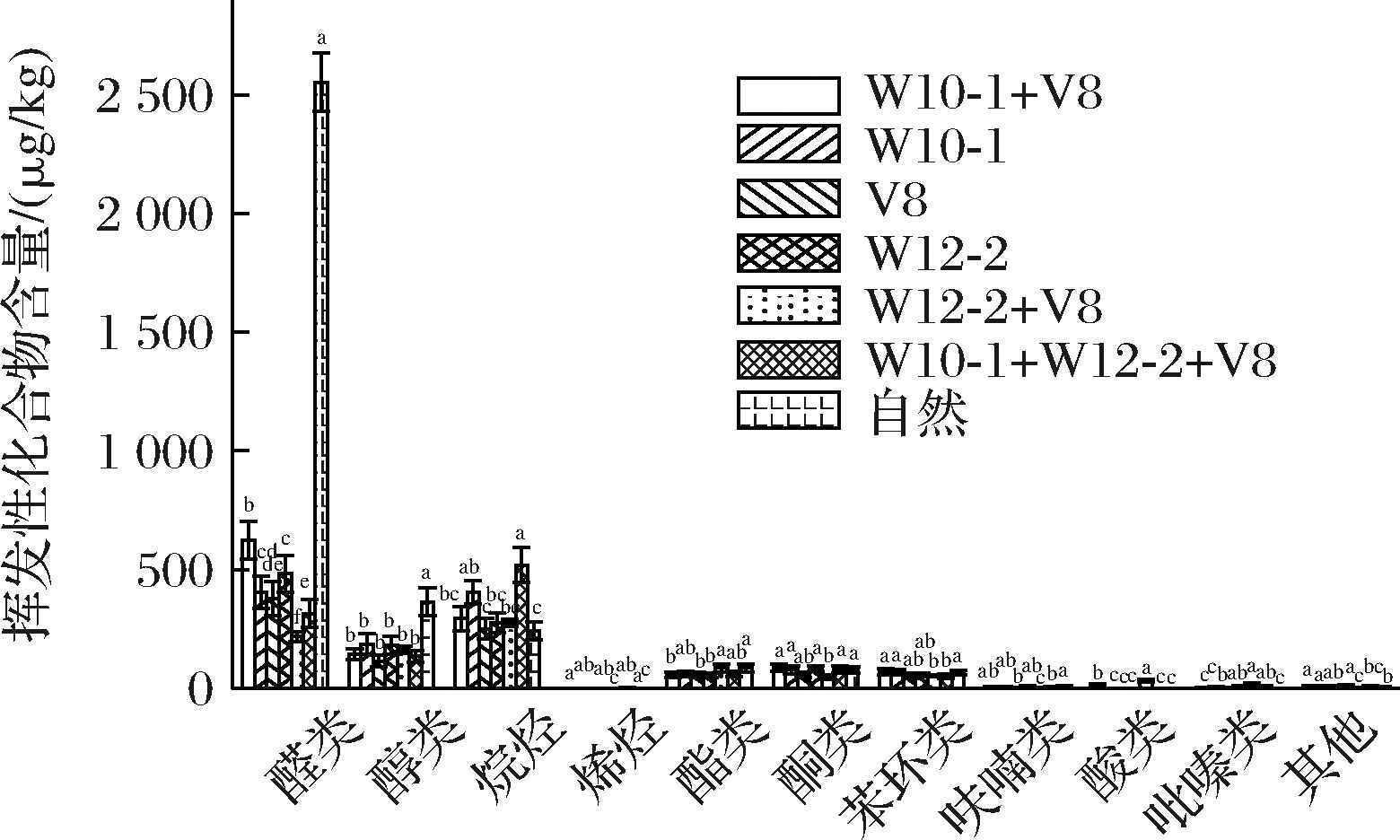
图7 接种不同发酵剂干腌肉块的挥发性化合物含量
Fig.7 Volatile compounds of dry-cured pork prepared with different mold starter cultures
接种不同发酵剂干腌肉块OAV>1的挥发性化合物和挥发性化合物见电子增强出版附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.038345)。
香气感受不仅与挥发性物质的含量有关,还和它们的阈值有关。OAV>1的挥发性化合物可能是产品风味的主要贡献者。在本研究中,19种OAV>1的化合物被认为是主要的风味物质(增强出版附表2),包括10种醛(己醛、辛醛、壬醛、异戊醛、2-甲基丁醛、戊醛、庚醛、(E)-2-庚烯醛、反-2-辛烯醛,(E,E)-2,4-壬二烯醛),2种醇(1-辛烯-3-醇、1-庚醇),1种酮(2-戊酮),1种酯(正己酸乙酯),1种呋喃(2-戊基呋喃),2种酸(异戊酸和丁酸)和2种其他类化合物(二甲基二硫和三甲基二硫)。这些物质都可能是影响干腌肉块风味形成的主要因素,由于含量不同,导致了干腌肉块样品之间感官特性的差异。
醛类化合物是干腌肉块风味形成的主要因素,因为它们的气味阈值较低。在干腌肉块中检测到醛类在所有风味化合物中占比最高,包括直链醛(己醛、壬醛、庚醛、辛醛)和支链醛(异戊醛)等。醛类是亚油酸的氧化产物,是脂肪氧化的重要指标,其中己醛具有脂肪味和清新的水果味;壬醛具有青草香、水果香和脂肪香气;庚醛具有脂肪香;辛醛具有果香和橙香味;异戊醛具有愉快的麦芽香气和水果香气。醇类是常见的真菌代谢产物,在脂质降解过程中形成[23]。值得关注的是,在所有干腌肉块(接种组和自然发酵组)中均检测到脂肪氧化的产物1-辛烯-3-醇,具有类似蘑菇的香气。此外,1-辛烯-3-醇已在金华、如皋和三川火腿中被描述到,有助于干腌火腿的感官特征[24]。
源自脂肪氧化产生的香气物质是肉制品的特征香气。本研究中OAV>1的醛类、醇类均来源于脂肪氧化,并且接种组醛醇类挥发性化合物含量显著低于自然发酵组(增强出版附表1),可见霉菌在发酵过程中产生了作用,延缓了脂肪氧化,这与TBARS(图5)结果一致。
酮类化合物大多是多不饱和脂肪酸受热氧化降解的产物。发酵结束时,所有接种组样品中均检测到2-戊酮,自然发酵组中未检出。2-戊酮具有酒香味,可见经霉菌发酵后,微生物通过对游离脂肪酸的氧化降解,此类物质明显增多。
酯类化合物是由羧酸和醇的酯化反应而成。在本研究中发现了大量的酯类化合物,但仅在接种组发现了相对含量较高的具有酒香和果香的己酸乙酯,这可能是由于在干腌肉块加工过程中,脂肪易受微生物等因素的影响发生氧化和降解,产生游离脂肪酸。微生物能将酸和醇类酯化,赋予干腌肉块浓郁的酯香特征。因此,己酸乙酯是区别接种组与自然发酵组的化合物之一。
酸类可能来源于脂肪氧化降解[25]。在本研究中仅在接种组检测到2种OAV>1的酸,即异戊酸和丁酸,异戊酸具有不愉快的酸味,丁酸具有奶酪味和酸味。这是由于微生物能够发酵碳水化合物产生乙酸、丁酸等酸类物质,而它们是形成酯类物质的前体,对干腌肉块的风味形成有积极的影响,而高浓度的酸可能与令人不快的感官属性密切相关[26]。而本研究中丁酸含量较低(1.85 μg/kg)不会影响干腌肉块的特征气味感知。
呋喃是重要的美拉德反应产物。据报道,2-戊基呋喃是肉制品中的一种重要香气化合物。在本研究接种组和自然发酵组中均检测到具有肉香味的2-戊基呋喃,其相对含量无显著差异,表明其是肉类产品的重要风味物质。
此外,干腌肉块中还鉴定出的其他挥发性风味化合物,如硫化物和吡嗪类。虽然这些物质的含量不高,但被认为是肉制品最重要的风味物质。例如,气味阈值低的硫化物可以赋予干腌肉块一种蘑菇的香味,二甲基二硫和二甲基三硫是本研究中发现的主要硫化物,含硫化合物主要来源于含硫氨基酸的降解,如甲硫氨酸和半胱氨酸[27]。美拉德反应产物能够与其他脂质氧化产物相互作用,形成吡嗪类和硫醇类[28]等物质,接种组均检测到2,6-二甲基吡嗪,表明添加微生物有助于干腌肉块肉香、烘烤食品香气、坚果香气的产生。
2.4 电子鼻
电子鼻可以模仿人类的嗅觉,与感官评估相比,能够更好地识别样品之间的细微差异。如图8所示,自然发酵组和接种组气味轮廓差异较大,由于自然发酵组氧化程度较高,使得总体上自然发酵组传感器响应值较接种组大,其中在S2、S6、S9、S18传感器的响应值差别较大,即醛类、醇类、酯类和酮类物质差异较大,这与GC-MS(增强出版附表1)结果一致。
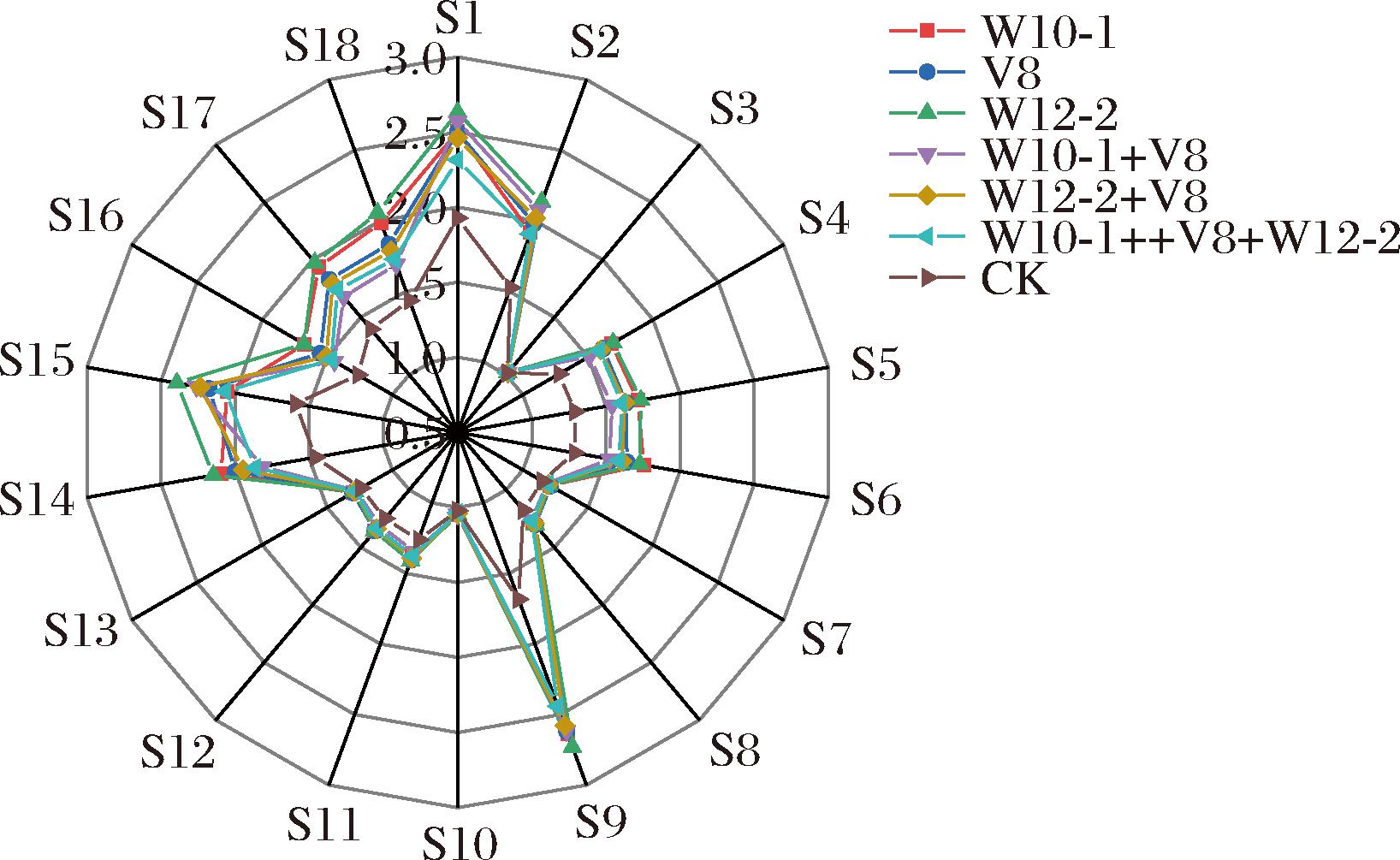
图8 接种不同发酵剂干腌肉块的电子鼻雷达图
Fig.8 Electronic nose radar map of dry-cured pork prepared with different mold starter cultures
主成分分析(principal component analysis,PCA)可以将高维数据转换为低维表示,同时尽可能保留数据的信息,有助于理解数据的结构和分布,并且便于数据的可视化。如图9所示,PC1的贡献率为83.6%,PC2的贡献率为8.4%,累计占系统总方差的92%,说明该PCA模型有效地反映了干腌肉块整体气味特征的变化。样品A、G位于第一象限,相比于样品A,样品B、D、F位于第四象限,样品C、E位于第二、三象限,表明电子鼻可以将样品区分开来。样品G更靠近传感器1(烷烃类)、2(醇类、醛类)、15(酮类),表明其氧化程度更严重。样品B、D部分重叠,表明其风味特征相似。样品C、E位于PC1负轴方向,说明其在气味属性上与其他组样品差异较大。因此,接种霉菌发酵剂可以在一定程度上缓解脂质过度氧化,与雷达图结果一致。

图9 接种不同发酵剂干腌肉块的电子鼻PCA图
Fig.9 Electronic nose PCA of dry-cured pork prepared with different mold starter cultures
2.5 电子舌
采用电子舌雷达图可以反映不同发酵剂对干腌肉块滋味的影响。由图10可知,接种组和自然发酵组存在显著差异。接种组在鲜味、丰富度上均高于自然发酵组,这可能是由于霉菌生长代谢产生的酶类物质分解蛋白质后生成的游离氨基酸等[29]有助于肉制品风味的形成,提升了味觉的鲜味和丰富度。咸度的增加可能归因于水分含量的降低,导致盐含量增加。
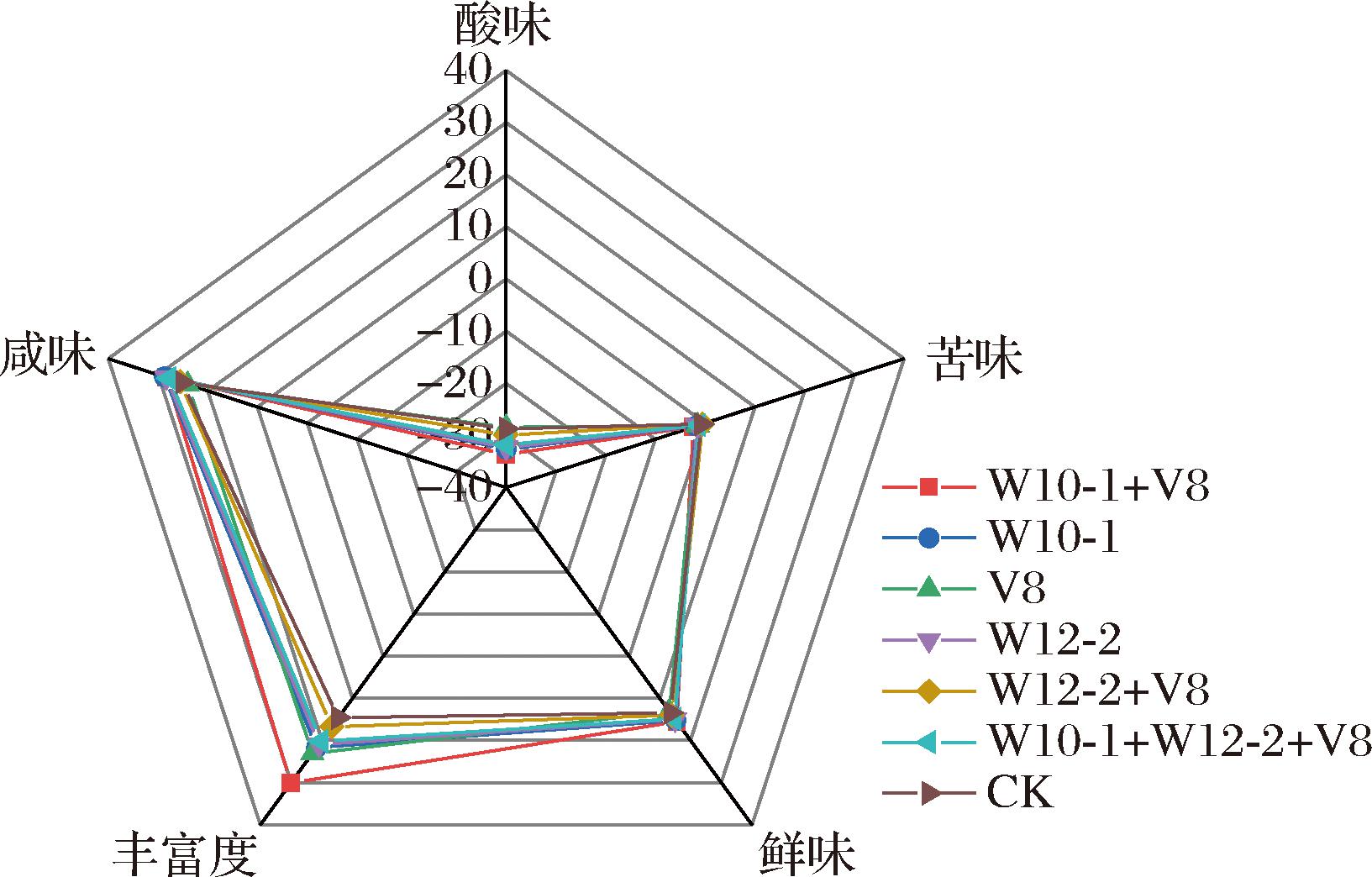
图10 接种不同发酵剂干腌肉块的电子舌雷达图
Fig.10 Electronic tongue radar map of dry-cured pork prepared with different mold starter cultures
另外,接种组和对照组均表现出一定苦味,有研究表明适当苦味对肉制品风味有益[30]。接种组相比对照组苦味值增加,但值较低,对干腌肉块的滋味无不良影响。自然发酵组酸味显著高于接种组,这可能是由于接种组pH较自然发酵组高,减少了样品酸味的产生。
为了进一步表示各组滋味值之间是否存在差异,采用PCA,由图11可知,PC1的贡献率为80.1%,PC2的贡献率为17.5%,可以代表样品整体的滋味特征。样品B、D、E在第一象限,样品A在第四象限,样品F、G在第二象限,样品C在第三象限,表明不同样品间差异显著,这表明电子舌可以进行有效区分。样品B、D和E距离接近,均靠近鲜味、咸味传感器,表明滋味差异较小,滋味特征的相似性较高;样品A靠近丰富度传感器,与其他处理组间距较远,滋味差异较大;样品F、G靠近苦味、酸味传感器,其酸味和苦味较为突出,表明发酵剂对肉块产生了显著影响,促进了鲜味、咸味和丰富度,减少了不良气味的产生。
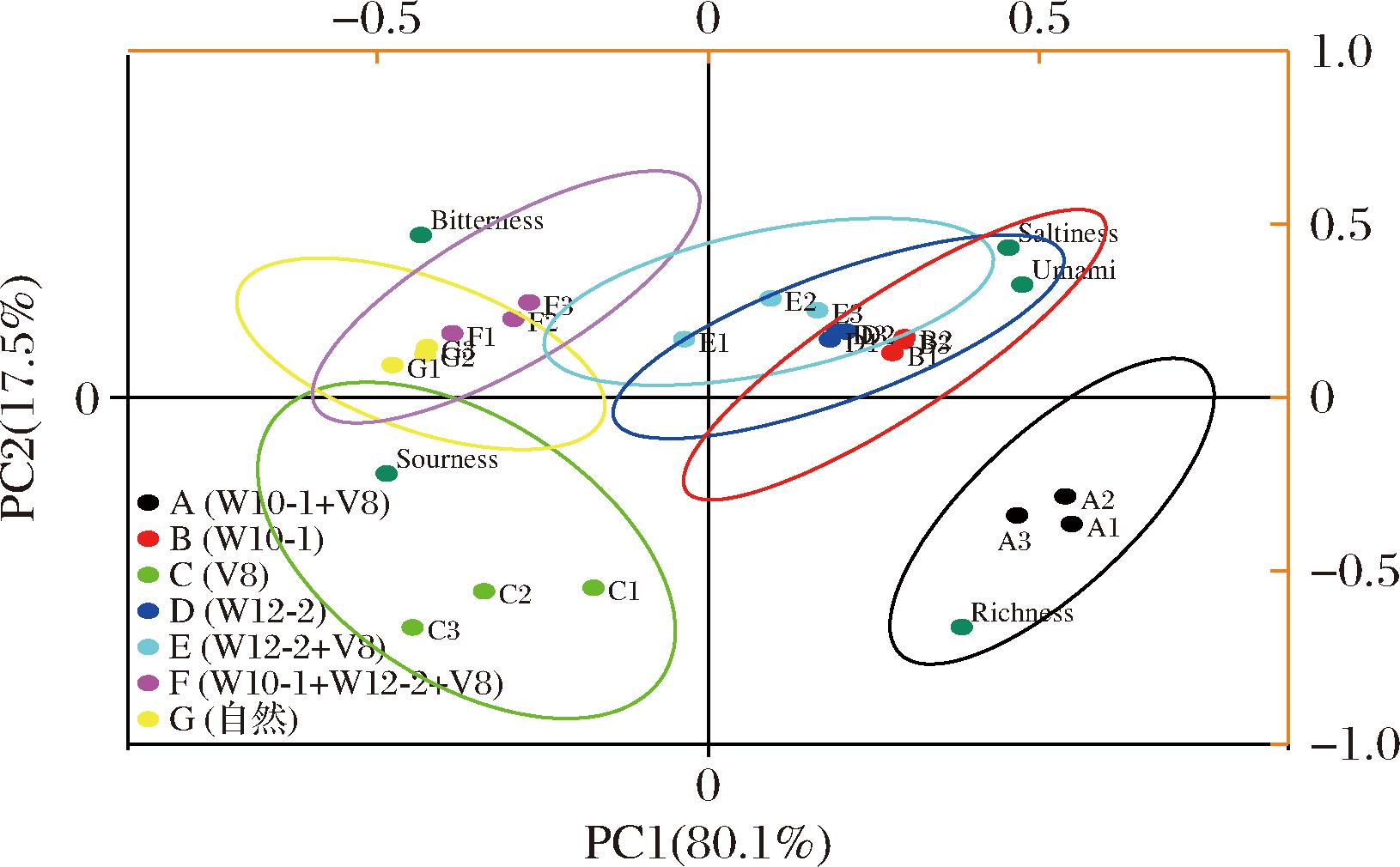
图11 接种不同发酵剂干腌肉块的电子舌PCA图
Fig.11 Electronic tongue PCA of dry-cured pork prepared with different mold starter cultures
3 结论
本文对接种不同霉菌发酵剂处理的模拟宣威火腿生产体系的干腌肉块的理化指标进行分析。结果发现,接种鲁本斯青霉W10-1和褐藻青霉V8干腌肉块的水分活度、pH和PI显著高于自然发酵组,并提升了干腌肉块的红度和亮度。另外,接种鲁本斯青霉W10-1和褐藻青霉V8干腌肉块的TBARS值更低,减轻了脂肪氧化,并提高了干腌肉块中的挥发性风味物质含量,效果优于其他接种组。通过电子鼻和电子舌结合PCA分析发现,接种鲁本斯青霉W10-1和褐藻青霉V8干腌肉块的丰富度更为突出,醛酮类物质显著低于自然发酵组,脂肪氧化程度较轻。因此采用鲁本斯青霉W10-1和褐藻青霉V8这两株菌株的组合作为霉菌发酵剂更有益于提高宣威火腿的品质。然而,还需要进一步研究确定两株霉菌的最佳混合比例,以开发每株菌株的有益特性,以便在干腌肉块上进一步应用霉菌发酵剂。
[1] WANG Z L, WANG Z X, JI L L, et al.A review:Microbial diversity and function of fermented meat products in China[J].Frontiers in Microbiology, 2021, 12:645435.
[2] LIU S Y, WANG G Y, XIAO Z C, et al.1H-NMR-based water-soluble low molecular weight compound characterization and free fatty acid composition of five kinds of Yunnan dry-cured hams[J].LWT, 2019, 108:174-182.
[3] 龙正玉, 邹金浩, 杨怀谷, 等.肉制品发酵技术对肉品品质的调控及应用研究进展[J].食品工业科技, 2024, 45(3):354-362.LONG Z Y, ZOU J H, YANG H G, et al.Research progress on the regulation of meat quality and application of fermentation technology for meat products[J].Science and Technology of Food Industry, 2024, 45(3):354-362.
[4] GUO L P, LI Y, DING S C, et al.Effect of fermentation with two molds on characteristics of chicken meat[J].Journal of Food Quality, 2021, 2021(1):8845552.
[5] 孙萍, 王梦曼, 王淑玲, 等.娄地青霉和纳地青霉对发酵鸭肉制品理化特性和微观结构的影响[J].轻工学报, 2022, 37(4):18-25.SUN P, WANG M M, WANG S L, et al.Effect of fermentation with enicilium roqueforti and penicilium nalgiovense on physicochemical properties and microstructure of duck meat products[J].Journal of Light Industry, 2022, 37(4):18-25.
[6] 陈杰, 孟岳成.金华火腿成熟过程中霉菌生长与其品质关系[J].食品与发酵工业, 2009, 35(8):138-142.CHEN J, MENG Y C.Studies on the relationship between moulds and quality of Jinhua ham during ripening[J].Food and Fermentation Industries, 2009, 35(8):138-142.
[7] 李开雄, 蒋彩虹, 唐明翔, 等.霉菌在发酵香肠中的应用[J].肉类工业, 2004(12):33-36.LI K X, JIANG C H, TANG M X, et al.Application of mold in fermented sausage[J].Meat Industry, 2004(12):33-36.
[8] DOM NGUEZ R, G
NGUEZ R, G MEZ M, FONSECA S, et al.Effect of different cooking methods on lipid oxidation and formation of volatile compounds in foal meat[J].Meat Science, 2014, 97(2):223-230.
MEZ M, FONSECA S, et al.Effect of different cooking methods on lipid oxidation and formation of volatile compounds in foal meat[J].Meat Science, 2014, 97(2):223-230.
[9] ZHOU C Y, WANG C, TANG C B, et al.Label-free proteomics reveals the mechanism of bitterness and adhesiveness in Jinhua ham[J].Food Chemistry, 2019, 297:125012.
[10] LYU J, YANG Z X, XU W H, et al.Relationships between bacterial community and metabolites of sour meat at different temperature during the fermentation[J].International Journal of Food Microbiology, 2019, 307:108286.
[11] WANG X W, FENG T T, WANG X J, et al.Microwave heating and conduction heating pork belly:Non-volatile compounds and their correlation with taste characteristics, heat transfer modes, and matrix microstructure[J].Meat Science, 2022, 192:108899.
[12] 万文结, 薛芷筠, 张泽文, 等.一株产碱性蛋白酶菌株的筛选鉴定及酶学特性研究[J].微生物学报, 2017, 57(5):737-747.WAN W J, XUE Z J, ZHANG Z W, et al.Isolation and identification of an alkaline protease producing strain and study on enzymatic properties[J].Acta Microbiologica Sinica, 2017, 57(5):737-747.
[13] 徐伟良, 特格希巴雅尔, 李春冬, 等.蒙古族发霉奶豆腐中霉菌的分离鉴定与产脂肪酶活性研究[J].中国酿造, 2023, 42(7):109-113.XU W L, TE G, LI C D, et al.Isolation and identification and lipase activity of mold in Mongolian Hurood[J].China Brewing, 2023, 42(7):109-113.
[14] 乔发东. 宣威火腿标准化生产与品质改良技术研究[D].北京:中国农业大学, 2004.QIAO F D.Studies on the standardized production and technology of quality improving of Xuanwei ham[D].Beijing:China Agricultural University, 2004.
[15] 黎明. 复配发酵剂发酵对冕宁火腿品质的影响研究[D].成都:成都大学, 2023.LI M.Effect of mixed starter fermentation on quality of Mianning ham[D].Chengdu:Chengdu University, 2023.
[16] OBUZ E, AKKAYA L, GÖK V, et al.Effects of blade tenderization, aging method and aging time on meat quality characteristics of Longissimus lumborum steaks from cull Holstein cows[J].Meat Science, 2014, 96(3):1227-1232.
[17] LEE C W, LEE J R, KIM M K, et al.Quality improvement of pork loin by dry aging[J].Korean Journal for Food Science of Animal Resources, 2016, 36(3):369-376.
[18] LARANJO M, ELIAS M, FRAQUEZA M J.The use of starter cultures in traditional meat products[J].Journal of Food Quality, 2017, 2017(1):9546026.
[19] 刘功明, 孙京新, 李鹏, 等.纳地青霉发酵对鸡肉质构、游离氨基酸及挥发性物质变化的影响[J].现代食品科技, 2015, 31(9):289-295.LIU G M, SUN J X, LI P, et al.Texture, free amino acid content, and volatile compounds of chicken meat fermented by Penicillium nalgiovense[J].Modern Food Science and Technology, 2015, 31(9):289-295
[20] L PEZ-PEDROUSO M, PÉREZ-SANTAESCOL
PEZ-PEDROUSO M, PÉREZ-SANTAESCOL STICA C, FRANCO D, et al.Comparative proteomic profiling of myofibrillar proteins in dry-cured ham with different proteolysis indices and adhesiveness[J].Food Chemistry, 2018, 244:238-245.
STICA C, FRANCO D, et al.Comparative proteomic profiling of myofibrillar proteins in dry-cured ham with different proteolysis indices and adhesiveness[J].Food Chemistry, 2018, 244:238-245.
[21] ZHOU G H, ZHAO G M.Biochemical changes during processing of traditional Jinhua ham[J].Meat Science, 2007, 77(1):114-120.
[22] 周慧敏, 张顺亮, 赵冰, 等.木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学, 2018, 39(22):32-38.ZHOU H M, ZHANG S L, ZHAO B, et al.Effect of starter culture mixture of Staphylococcus xylosus and S.carnosus on the quality of dry-cured meat[J].Food Science, 2018, 39(22):32-38.
[23] CARRAPISO A I, GARC A C.Iberian ham headspace:Odorants of intermuscular fat and differences with lean[J].Journal of the Science of Food and Agriculture, 2004, 84(15):2047-2051.
A C.Iberian ham headspace:Odorants of intermuscular fat and differences with lean[J].Journal of the Science of Food and Agriculture, 2004, 84(15):2047-2051.
[24] LI F Y, FENG X, ZHANG D N, et al.Physical properties, compositions and volatile profiles of Chinese dry-cured hams from different regions[J].Journal of Food Measurement and Characterization, 2020, 14(1):492-504.
[25] 李素, 周慧敏, 张顺亮, 等.不同加水量腌制酱牛肉中挥发性风味物质变化[J].食品科学, 2019, 40(10):199-205.LI S, ZHOU H M, ZHANG S L, et al.Changes of volatile flavor compounds in spiced beef marinated with different water contents[J].Food Science, 2019, 40(10):199-205.
[26] ZHOU C Y, XIA Q, DU L H, et al.Recent developments in off-odor formation mechanism and the potential regulation by starter cultures in dry-cured ham[J].Critical Reviews in Food Science and Nutrition, 2023, 63(27):8781-8795.
[27] 吴鸣, 吴浚滢, 范琦琦, 等.食品风味物质的合成机理及检测方法的研究进展[J/OL].食品科学, 2024.https://link.cnki.net/urlid/11.2206.TS.20231010.0933.044.WU M, WU J Y, FAN Q Q, et al.Research progress on synthesis mechanism and detection methods of food flavor substances[J/OL].Food Science, 2024.https://link.cnki.net/urlid/11.2206.TS.20231010.0933.044.
[28] BASSAM S M, NOLETO-DIAS C, FARAG M A.Dissecting grilled red and white meat flavor:Its characteristics, production mechanisms, influencing factors and chemical hazards[J].Food Chemistry, 2022, 371:131139.
[29] CHEN Q, HU Y Y, WEN R X, et al.Characterisation of the flavour profile of dry fermented sausages with different NaCl substitutes using HS-SPME-GC-MS combined with electronic nose and electronic tongue[J].Meat Science, 2021, 172:108338.
[30] 刘春丽. 新型腌制对发酵里脊火腿品质影响及蛋白质组学的研究[D].贵阳:贵州大学, 2020.LIU C L.Effect of new curing on quality and proteomics of fermented loin ham[D].Guiyang:Guizhou University, 2020.