浓缩乳清蛋白(whey protein concentrate,WPC)是从乳清中超滤而来的,蛋白质含量为35%~80%的蛋白混合物[1],包括β-乳球蛋白 (β-lactoglobulin, β-LG)、α-乳白蛋白 (α-lactalbumin, α-LA)、牛血清白蛋白和免疫球蛋白等成分[2]。乳清蛋白是公认的人体优质蛋白质补充剂,但却存在着一些过敏蛋白,如α-LA和β-LG,其中几个表位与牛奶过敏患者的特异性免疫球蛋白E(immune globulin E,IgE)结合,会引起IgE介导的不良反应[3],影响皮肤(特应性皮炎或湿疹、血管水肿或荨麻疹)、呼吸系统(鼻炎、哮喘加重、喘息、肺部渗出或急性鼻结膜炎)和胃肠道(呕吐、反复腹泻、腹痛、绞痛或食道反流)[4]。β-LG是牛乳清蛋白中的主要蛋白质,也是牛奶中引起过敏最多的蛋白质,约占乳清蛋白的43.6%,人乳、啮齿类动物乳中均不存在β-LG,研究显示,乳蛋白过敏的人群中,有82%的人对β-LG过敏[5]。因此,开发一种β-LG抗原性较低的乳清蛋白肽显得尤为关键。乳清蛋白肽具有多种有益的功能,如抗高血压、抗氧化性、免疫调节和抗菌作用[6],乳清亲水肽和游离氨基酸也被认为具有促胰岛素特性[7]。
相关研究表明,高压、脉冲电场、微波辐射、超声、冷等离子体、电流体动力学等理化处理和发酵、酶解等生物技术都可以降低蛋白致敏性[3]。其中,酶水解主要利用蛋白酶部分或深度水解过敏原破坏线性表位,转化为肽和氨基酸,从而降低蛋白致敏性。其中,乳清蛋白肽等致敏性降低主要与蛋白酶种类和工艺条件 (如pH、温度、水解程度和酶-底物比)有关。目前,关于乳清蛋白肽深度水解制备的研究较多,但是仍然存在致敏原残留或风味影响严重等问题。近年来,蛋白质谷氨酰胺酶(protein glutaminase, PG, EC 3.5.1.44) 因其可以改善蛋白溶解度和乳化性,得到广泛关注。研究表明,PG在针对小麦蛋白中的谷氨酰胺特异性脱酰胺,在促进蛋白结构松散的同时降低蛋白质过敏原[8],但目前针对PG在乳清蛋白酶解的作用研究较少。
为了探究PG在乳清蛋白酶解中作用效果,本研究以浓缩乳清蛋白粉 8010 (whey protein concentrate 8010,WPC 8010)作为酶解原料,水解度(degree of hydrolysis,DH)、得率、分子质量分布和抗原性为主要指标,评价PG预处理对乳清蛋白酶水解的影响。筛选β-LG抗原性较低的酶解产物进行氨基酸检测,建立WPC高效酶解工艺,为低致敏乳清蛋白的制备提供参考。
1 材料与方法
1.1 实验试剂
浓缩乳清蛋白 (WPC 8010,蛋白质质量分数为71.97%),美国Hilmar公司;碱性蛋白酶、中性蛋白酶、风味蛋白酶,诺维信(中国)生物技术有限公司;菠萝蛋白酶,深圳市夏盟生物科技有限公司;PG、Peptidase R、Prote AXH,天野酶制剂(江苏)有限公司;牛β-LG ELISA试剂盒,德国拜发R-Biopharm公司;甲醇、乙腈、三氟乙酸,均为色谱纯,美国TEDIA公司;十水合四硼酸钠、十二烷基硫酸钠 (sodium dodecyl sulfate, SDS)、邻苯二甲醛 (o-phthalaldehyde, OPA)、二硫代苏糖醇 (dithiothreitol, DTT)、L-丝氨酸、NaOH、KOH、四氢呋喃、三乙胺、盐酸、结晶乙酸钠、三氟乙酸,均为分析纯,生工生物工程(上海)股份有限公司;1 nmol/μL的17种氨基酸标准品(天门冬氨酸、组氨酸、谷氨酸、丝氨酸、甘氨酸、苏氨酸、丙氨酸、精氨酸、酪氨酸、胱氨酸、缬氨酸、蛋氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸、脯氨酸)、细胞色素C (Mw 12 384 Da)、抑肽酶 (Mw 6 500 Da)、杆菌肽 (Mw 1 422 Da)、乙氨酸—乙氨酸—酪氨酸—精氨酸 (Mw 451 Da)、乙氨酸—乙氨酸—乙氨酸 (Mw 189 Da),美国Sigma公司;邻苯二甲醛 (o-phthalaldehyde,OPA)、芴甲氧羰酰氯 (fluorene methoxycarbonyl chloride,FMOC),美国安捷伦公司。
1.2 仪器与设备
HD2010W司乐立式电动搅拌器,诺尔泰仪器仪表公司;冷冻离心机、紫外分光光度计、自动移液器,德国Eppendorf公司;pH计,美国Ohaus公司;分析天平,梅特勒-托利多(上海)有限公司;真空冷冻干燥机,宁波新芝生物科技股份有限公司;高效液相色谱仪,日本岛津公司;漩涡混合器,美国赛洛捷克公司;K9860全自动凯氏定氮仪,山东海能科学仪器有限公司;Synergy H1/Synergy2酶标仪,南京拜尔沃克智能科技有限公司。
1.3 实验方法
1.3.1 乳清蛋白酶解
配制质量浓度为5 g/100 mL的WPC 8010溶液,在50 ℃下搅拌,充分水合,用1% (质量分数)的PG预处理乳清蛋白溶液,在Na+、K+允许添加量范围内使用NaOH、KOH调整初始溶液pH 7.5,选择碱性蛋白酶、中性蛋白酶、菠萝蛋白酶、风味蛋白酶、Peptidase R、Prote AXH等进行单酶或复合酶解,以加酶量为1% (质量分数)加入蛋白酶,酶解时间2 h,85 ℃下加热10 min灭酶,冷却后在10 000 r/min下离心10 min。将上清液真空冷冻干燥后-40 ℃贮藏,得到水解乳清蛋白 (hydrolyzed whey protein,HWP)冻干粉。
1.3.2 DH测定
参照NIELSEN等[9]的方法,配制OPA试剂,首先准确称量7.620 g十水合四硼酸钠和200 mg SDS,继续将这些称量的化合物溶解在150 mL去离子水中,直到它们完全稀释。同时,称取160 mg OPA,并将其完全溶解在4 mL无水乙醇中。一旦完全溶解,OPA溶液应转移到之前制备的十水合四硼酸钠和SDS的溶液中,并用去离子水冲洗。随后,称量176 mg DTT加入上述溶液中,用去离子水反复冲洗,后用去离子水定容至200 mL,此试剂现配现用。丝氨酸标准溶液的配制:称取50 mg丝氨酸,并将其溶解在500 mL去离子水中。该溶液中Serine—NH2约为0.951 6 meqv/L。样品溶液:将1 g样品溶解在100 mL去离子水中,然后将其稀释100倍备用。
丝氨酸标准溶液测定:加入400 μL丝氨酸溶液,再加入3 mL OPA试剂,然后在黑暗环境中静置2 min,立即在340 nm的波长下测量吸光度;空白测试:将400 μL去离子水与3 mL OPA试剂混合在试管中,黑暗环境中静置2 min,立即在340 nm处读取吸光度;样本测试:将400 μL样品溶液与3 mL OPA试剂在试管中混合,黑暗环境中静置2 min,后在340 nm处读取吸光度。
DH按公式(1)~公式(3)计算:
(1)
式中:Serine NH2,meqv serine NH2/g protein;0.1,0.1 L (样品体积/L);100,稀释倍数;m,样品质量,g;P,蛋白质含量,%。
(2)
式中:h,水解反应后样品的水解程度,meqv/g protein;由于乳清蛋白未经检验,因此估计α和β分别为1.00和0.40[10]。
(3)
式中:一般乳清蛋白中htot取8.8。
1.3.3 多肽分子质量分布测定
参考GB/T 22492—2008《大豆肽粉》修改,通过高效液相色谱完成,并稍作改动。首先制备10 mg/mL的WPC 8010酶解液,并使用0.45 μm的膜过滤器进行过滤。采用TSK gel 2000 SWXL色谱柱,色谱柱尺寸为300 mm×7.8 mm,确保了高效液相色谱所需的条件。流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=36∶64∶0.1。柱温维持在30 ℃,进样量为10 μL,流速在1 mL/min,检测波长205 nm。整个洗脱过程在15 min内进行。标准物质包括细胞色素C(12 384 Da)、抑肽酶 (6 500 Da)、杆菌肽 (1 422 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸 (451 Da)和乙氨酸-乙氨酸-乙氨酸 (189 Da)。
1.3.4 水解乳清蛋白得率测定
得率计算如公式(4)所示:
得率![]()
(4)
式中:mHWP,水解乳清蛋白质量,g;mWPC,初始投放WPC 8010的质量,10 g。
1.3.5 β-LG抗原性测定
使用间接竞争酶联免疫吸附法测定水解乳清蛋白中β-LG的抗原性,将乳清蛋白肽的浓度配为2 mg/mL。 首先,在特殊酶标板的每个孔中加入50 μL乳清蛋白多肽和抗体溶液,确保它们完全混合。然后将混合物在室温下孵化2 h,弃去溶液并彻底清洗酶标板3次,每孔使用250 μL清洗液振荡清洗,之后拍干;接着,在每个孔中加入100 μL酶连接物,充分混合;将混合物在室温下孵育30 min。再次清洗酶标板3次,并拍干。随后,在酶标板上的每个孔中分别依次加入50 μL的底物和50 μL的发色剂,确保它们充分混合后在室温黑暗条件下孵育15 min,最后加入100 μL反应终止液,充分混合并在确保在加入反应终止液后10 min内于450 nm处测量吸光度。使用试剂盒附带的计算软件来计算抗原含量,过敏原降解率按公式(5)计算:
过敏原降解率/%=
(5)
式中:WPC 8010(β-LG含量),乳清蛋白β-LG含量,mg/kg;HWP(β-LG含量),水解乳清蛋白β-LG含量,mg/kg。
1.3.6 氨基酸测定
TAA的测定采用OPA柱前衍生化-反相高效液相色谱-紫外检测相结合的方法。通过采用这种方法,在分析过程中既保持了准确性,又保持了科学的严谨性。该方法利用了2个特殊的流动相,均保持在pH值为7.2。流动相A由27.6 mmoL/L醋酸钠、三乙胺和四氢呋喃组成,体积比为500∶0.11∶2.5。流动相B为80.9 mmol/L醋酸钠、甲醇和乙腈组成,体积比为1∶2∶2。色谱柱为Agilent Hypersil ODS柱,柱径为4 mm×250 mm,粒径为5 μm。此外,我们采用了梯度洗脱程序,从初始分钟内8%的流动相B开始,到第17 min上升到50%,20 min达到100%,最后在24 min恢复到0%。流动相的流速保持在1 mL/min,柱温保持在40 ℃。使用特定波长为338 nm的紫外检测器(variable wavelength detector,VWD),在262 nm处检测脯氨酸。最后,使用外标法对氨基酸含量进行定量。
为了准确分析WPC/HWP中的氨基酸含量,必须先进行酸水解,在酸水解过程中,0.1 g WPC/HWP被精确称重并放置在水解管中。添加8 mL 6 mol/L HCl,然后向试管中充入N2 3 min后将试管严密密封,放入120 ℃恒温的烘箱中开始水解,持续22~24 h。水解后,再进行碱中和,加入4.8 mL 10 mol/L NaOH溶液,然后用蒸馏水定容至25 mL,接着使用双层滤纸进行过滤,取1 mL滤液,于1.5 mL离心管以15 000 r/min的速度离心30 min,之后测定。
1.3.7 蛋白质含量测定
称取一定质量的蛋白粉样品与3.2 g催化剂(mCuSO4∶mK2SO4=1∶15)一同移入500 mL干燥的消化管中,再添加10 mL硫酸,摇匀后放入自动消煮仪进行消化处理;将消化好的样品冷却至常温后,通过自动凯氏定氮仪进行蛋白质含量的测定。
1.4 数据统计与分析
实验数据结果以平均值±标准差表示。利用Origin 2018与SPSS 26.0软件对数据进行统计和方差分析,用Duncan法进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 蛋白酶的筛选与复配
基于目前报道的不同蛋白酶的作用位点,选择了6种内切酶、外切酶作用于乳清蛋白酶解,所选蛋白酶信息如表1所示。综合6种酶的水解条件,选择在温度50 ℃,初始pH维持在7.5,酶与底物比固定在1%(质量分数)去进行单酶酶解反应,然后根据内切酶与外切酶的特性进行两两组合复配酶解。具体酶解流程如图1所示,整个酶解反应均在1 200 r/min搅拌下进行。
表1 蛋白酶信息
Table 1 Information of protease used

蛋白酶类型蛋白酶种类酶作用位点来源酶活水解条件内切酶碱性蛋白酶主要催化由疏水性氨基酸的羧基形成的酰胺键,Ala、Val、Gly、Leu、Ile、Phe、Trp、Met、Pro地衣芽孢杆菌2.4AU-A/g50~60 ℃, pH 7.0~11.0中性蛋白酶含Tyr、Try、Phe等芳香族氨基酸残基的肽键解淀粉芽孢杆菌> 6.5 AU-N/g45~55 ℃, pH 5.5~7.5菠萝蛋白酶巯基蛋白酶,无特异性作用位点菠萝2 400 GDU/g50~55 ℃, pH 4.5~8.0外切酶风味蛋白酶主要水解短肽末端的疏水性氨基酸米曲霉1 100 LAPU/g-Peptidase RArg, Ala, Lys, Phe, Leu[10]米根霉420 U/g30~55 ℃, pH 6.0~9.0Prote AXHGln,Ser,Thr,Met>Arg>Ala,Lys,Phe,Leu[10]米曲霉>1 400 U/g50~75 ℃, pH 6.0~9.0
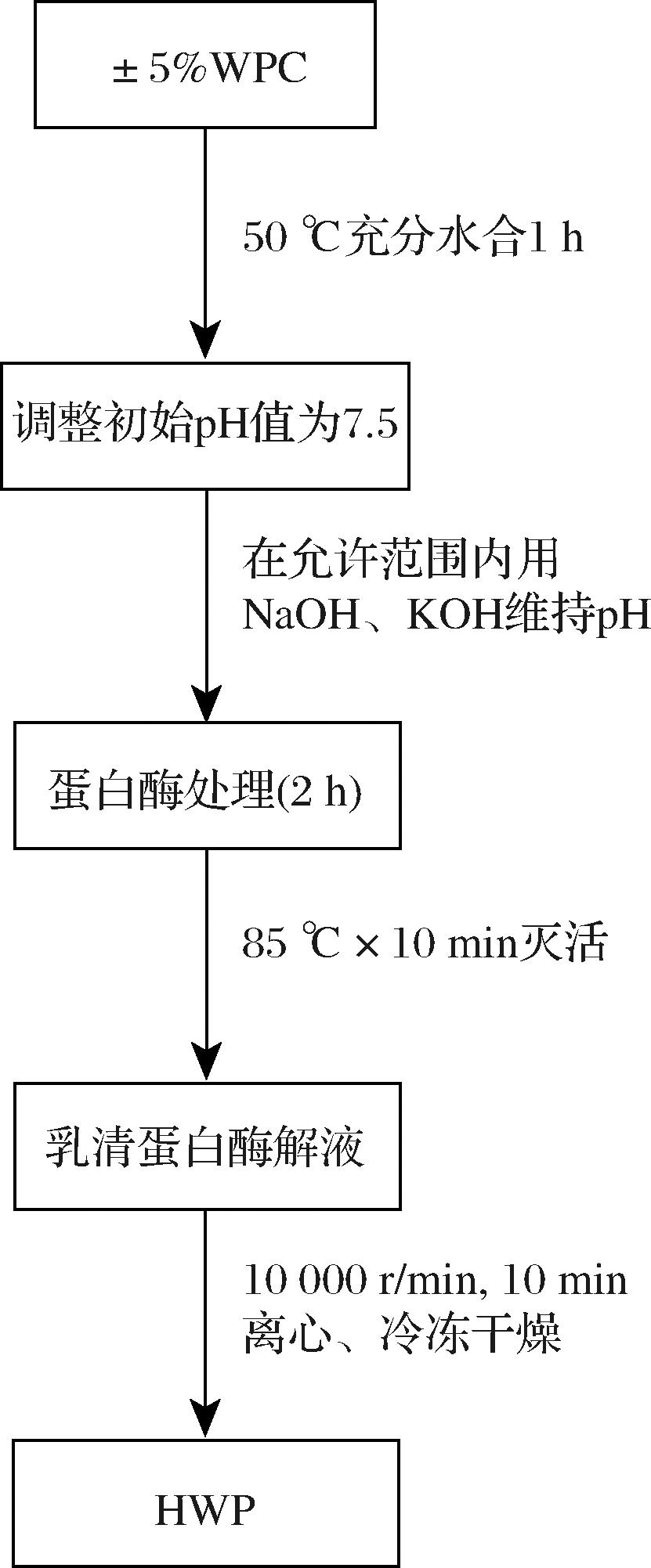
图1 乳清蛋白酶解流程图
Fig.1 Flow chart of enzymatic hydrolysis of whey protein
2.1.1 DH测定
蛋白质DH为裂解的多肽键的百分比,是监测反应的关键参数[9]。如图2-a所示,在不同单酶的作用下,DH不同。说明在不同蛋白酶水解过程中,裂解出的肽链所占比例不同:Prote AXH>风味蛋白酶>碱性蛋白酶>中性蛋白酶>菠萝蛋白酶>Peptidase R。其中,最高的是由外切酶Prote AXH作用的酶解物,DH达到31.01%;其次是风味蛋白酶作用下的酶解物,DH为22.97%。而对于所选的3种内切酶来说,DH差距并不大,碱性蛋白酶、中性蛋白酶、菠萝蛋白酶DH分别为17.72%、14.36%、12.89%。6种蛋白酶DH出现差异的原因,主要是由于蛋白酶对肽键的切割位点特异性不同,蛋白酶的酶切位点越多,则酶水解效率越高,产物中肽链所占比例也越高,进而DH越高[11]。

a-单酶酶解DH;b-双酶复配酶解DH
图2 酶解DH
Fig.2 DH of enzyme hydrolysis
注:不同字母表示差异显著(P<0.05)(下同)。
复配酶解DH如图2-b所示,在不同外切酶的作用下,DH都有所提高,其中风味蛋白酶和Prote AXH复配辅助效果最好,DH都在25%以上,最佳复配为:碱性蛋白酶+Prote AXH,水解度为29.96%。但与Prote AXH单酶水解相比,双酶复配反而降低了DH,可能的原因是2种蛋白酶在酶解过程中影响彼此的活性[12]。
2.1.2 分子质量分布
如图3所示,图3-a为不同单酶酶解物多肽分子质量占比,斜线图部分为分子质量<3 000 Da占比。其中,碱性蛋白酶、菠萝蛋白酶、Prote AXH处理后的样品均有较高比例的低分子质量多肽,占比分别为75.81%、73.96%、77.84%,但是与DH相关性较差。图3-b为分子筛色谱图,其中分子质量大的多肽会首先被洗脱出来。结合DH与分子质量分布分析,碱性蛋白酶、菠萝蛋白酶、Prote AXH在酶解乳清蛋白中发挥主要作用,产物小分子质量多肽占比较高,但碱性蛋白酶和菠萝蛋白酶的DH并没有很高。因此,蛋白酶水解效果主要由两方面决定,一方面是水解大分子肽段的效率,通过多肽分布体现,水解大分子肽段的效率越高,小分子多肽占比越高;另一方面是由酶作用位点决定,酶作用位点越广泛,产物肽链所占比例越高,其DH越高。因此,将两方面进行综合分析后发现,风味蛋白酶作为外切酶在水解大分子蛋白及多肽内肽键方面能力较弱,但随着酶解进行,可以在多肽末端高效剪切,提升DH;Prote AXH具有高效水解大分子多肽的能力,获得水解产物的低分子质量多肽比例较高;而Peptidase R作为一种风味肽酶,具有脱苦的效果,有利于水解液风味的改善,因此也作为后续复配组分。
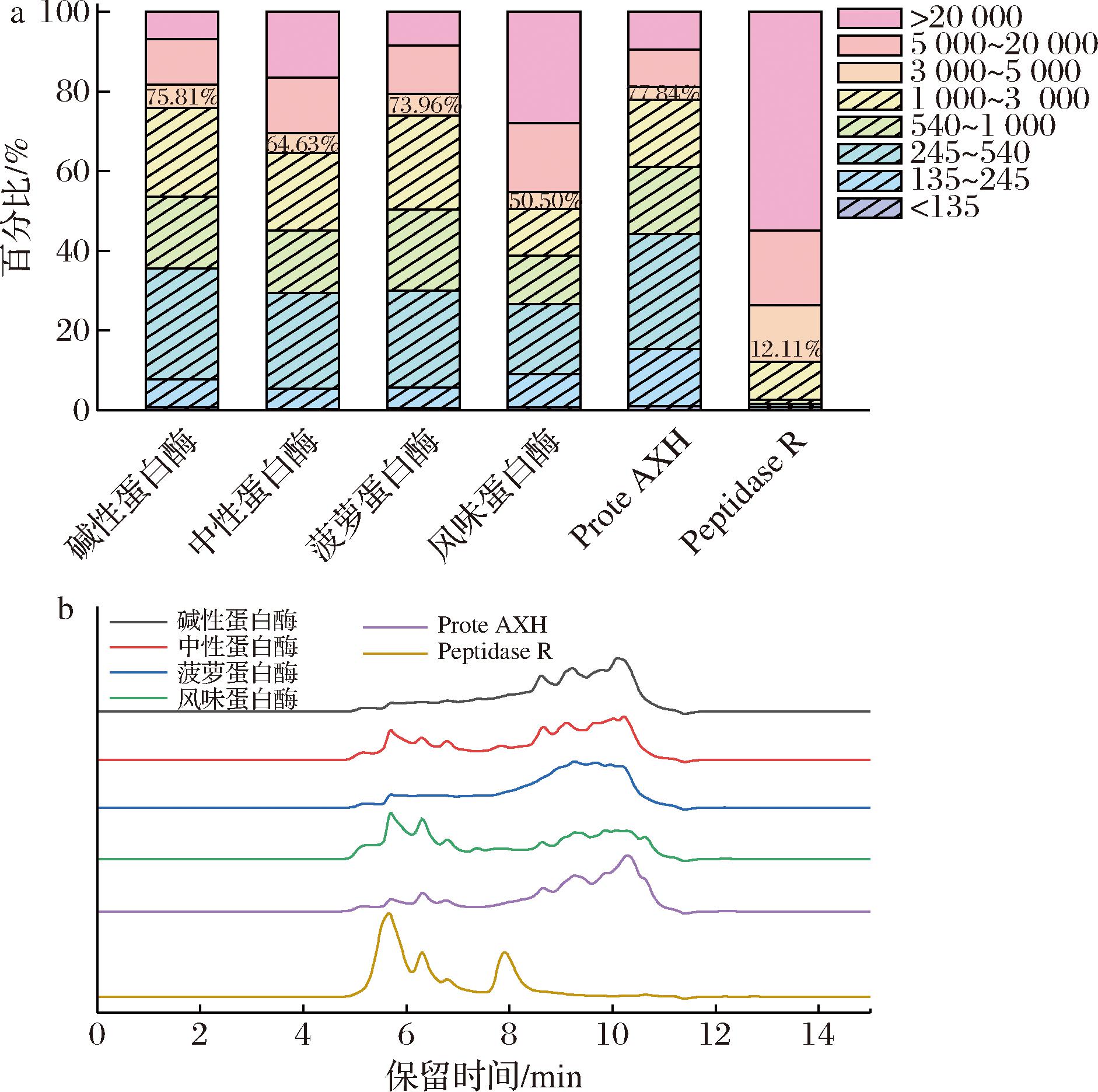
a-单一蛋白酶酶解产物分子质量分布;b-单一蛋白酶酶解产物分子筛色谱图
图3 单一蛋白酶酶解分子质量分布
Fig.3 Molecular weight distribution of whey protein by single protease hydrolysis
复配酶解多肽分子质量分布如图4所示,在不同外切酶的作用下,分子质量<3 000 Da占比都有所提高,其中风味蛋白酶和Prote AXH复配辅助效果最好,分子质量<3 000 Da占比都在72%以上,其中最佳复配为:碱性蛋白酶+Prote AXH,分子质量<3 000 Da占比达到92.69%。上述结果表明在碱性蛋白酶存在的情况下会抑制Prote AXH部分外切能力,但碱性蛋白酶与Prote AXH双酶复配,可以促使大分子多肽被降解,得到小分子多肽。因此,综合分析,碱性蛋白酶+Prote AXH组合较其他酶组合更优。
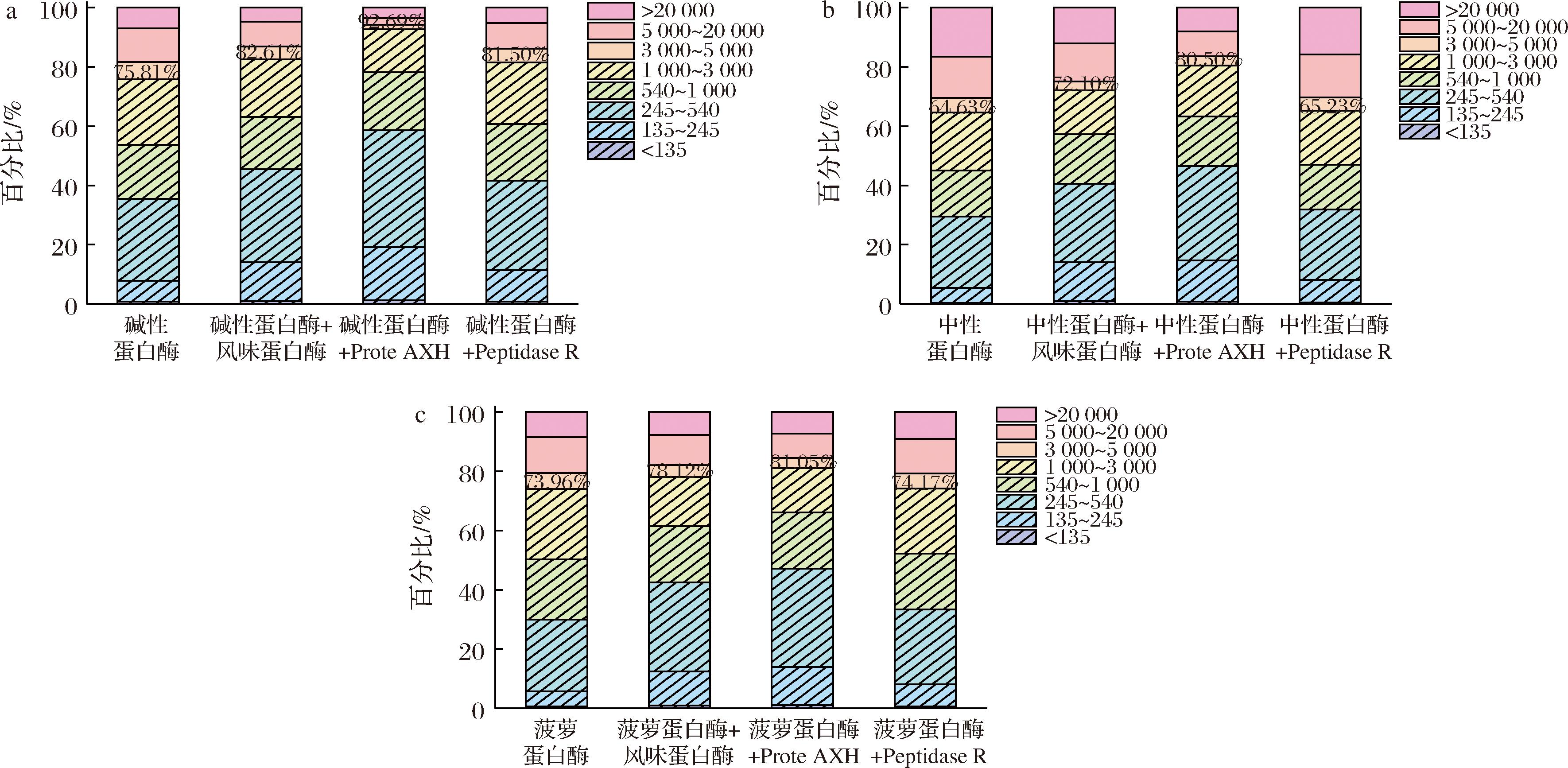
q-碱性蛋白酶组合分子质量分布;b-中性蛋白酶组合分子质量分布;c-菠萝蛋白酶组合分子质量分布
图4 双酶酶解分子质量分布
Fig.4 Molecular weight distribution of double enzyme hydrolysis
2.1.3 得率测定
酶解产品得率是评价蛋白水解效果的重要参数,本研究评价了不同酶解条件下的HWP的得率。单酶酶解得率如图5-a所示,得率最高的是菠萝蛋白酶酶解物,可以达到95.9%,Peptidase R酶解得率最低,为86.9%,因此,水解程度在一定程度上影响得率水平,但单酶水解并没有发现具体的得率规律,或许与酶本身作用位点有关。这一点在复配酶解中得到证实,如图5-b所示,菠萝蛋白酶本身具有较高的得率,但在其他酶辅助下,只有与风味蛋白酶组合可以得到较高的得率,但这一组合在DH和多肽分布方面都没有突出的表现。对于水解程度较好的碱性蛋白酶组合来说,整体得率较低,在其他酶辅助下,得率变化不大,值得注意的是,在Peptidase R影响下,得率明显下降,说明碱性蛋白酶与Peptidase R组合酶解产物不溶性蛋白较多,与2种酶作用位点有很大的关系;中性蛋白酶组合整体得率较高,并且在其他酶的辅助下中性蛋白酶得率都有提高。因此,得率主要与不同酶的作用位点特异性有关,同时在复配反应体系中,2种蛋白酶之间也会存在相互影响。
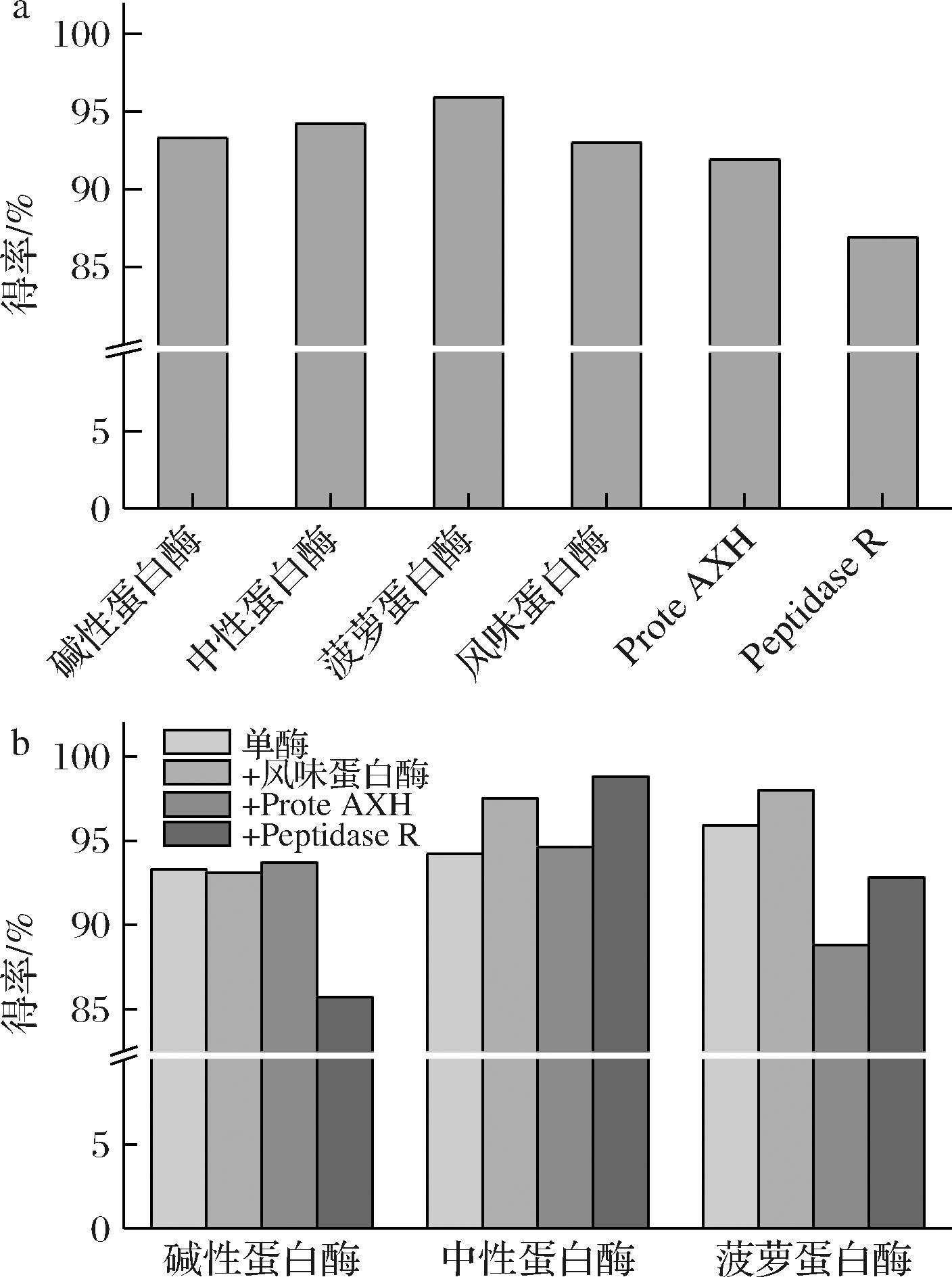
a-单酶酶解产物得率;b-双酶酶解产物得率
图5 酶解得率
Fig.5 Yield of whey protein by enzyme hydrolysis
2.2 PG在乳清蛋白肽酶解中应用
PG是一种新型的蛋白质脱酰胺酶,能促进蛋白质或多肽中的谷氨酰胺残基转化为谷氨酸,修饰蛋白结构与功能[13]。此外,PG作用于单一底物,不会作用于食物中的其他成分,并且与化学方法相比,酶法脱酰胺法具有高特异性、温和的反应条件和食品安全性[14]特点。谷氨酰残基的负电荷增加导致等电点(isoelectric point,pI)降低有助于蛋白质的静电排斥,使得蛋白质在弱酸性pH值下更容易溶解,还可以改善其在食品基质中的风味特性、致敏性等食品功能属性[14-16]。但目前对于PG的应用主要是对植物蛋白质的改性,还缺乏其对乳清蛋白酶解及致敏性影响的研究。因此,基于前期建立的乳清蛋白酶解工艺,增加PG辅助酶解,从而探究PG对乳清蛋白酶解中水解度、多肽分布、得率、过敏原降解率的影响。
2.2.1 DH测定和分子质量分布
如图6-a、图6-b所示,碱性蛋白酶组合与中性蛋白酶组合中,PG添加并没有明显的影响乳清蛋白DH。但在菠萝蛋白酶组合中,PG对其DH的影响较为明显,如图6-c所示,菠萝蛋白酶+风味蛋白酶、菠萝蛋白酶+Peptidase R,在PG添加后DH都有提高,可能的原因是PG处理后有利于菠萝蛋白酶作用位点的暴露,从而促进蛋白酶解作用。值得注意的是,菠萝蛋白酶+Prote AXH组合在PG加入后,DH反而下降,如图6-d所示,结合单酶与复配的DH可以发现,Prote AXH单酶酶解DH最高,但是小分子质量肽段占比较低,而随着其他酶的添加,Prote AXH相关组合的DH皆呈下降趋势,因此推测在多酶复配反应中,Prote AXH的部分外切活性易受到其他酶抑制。
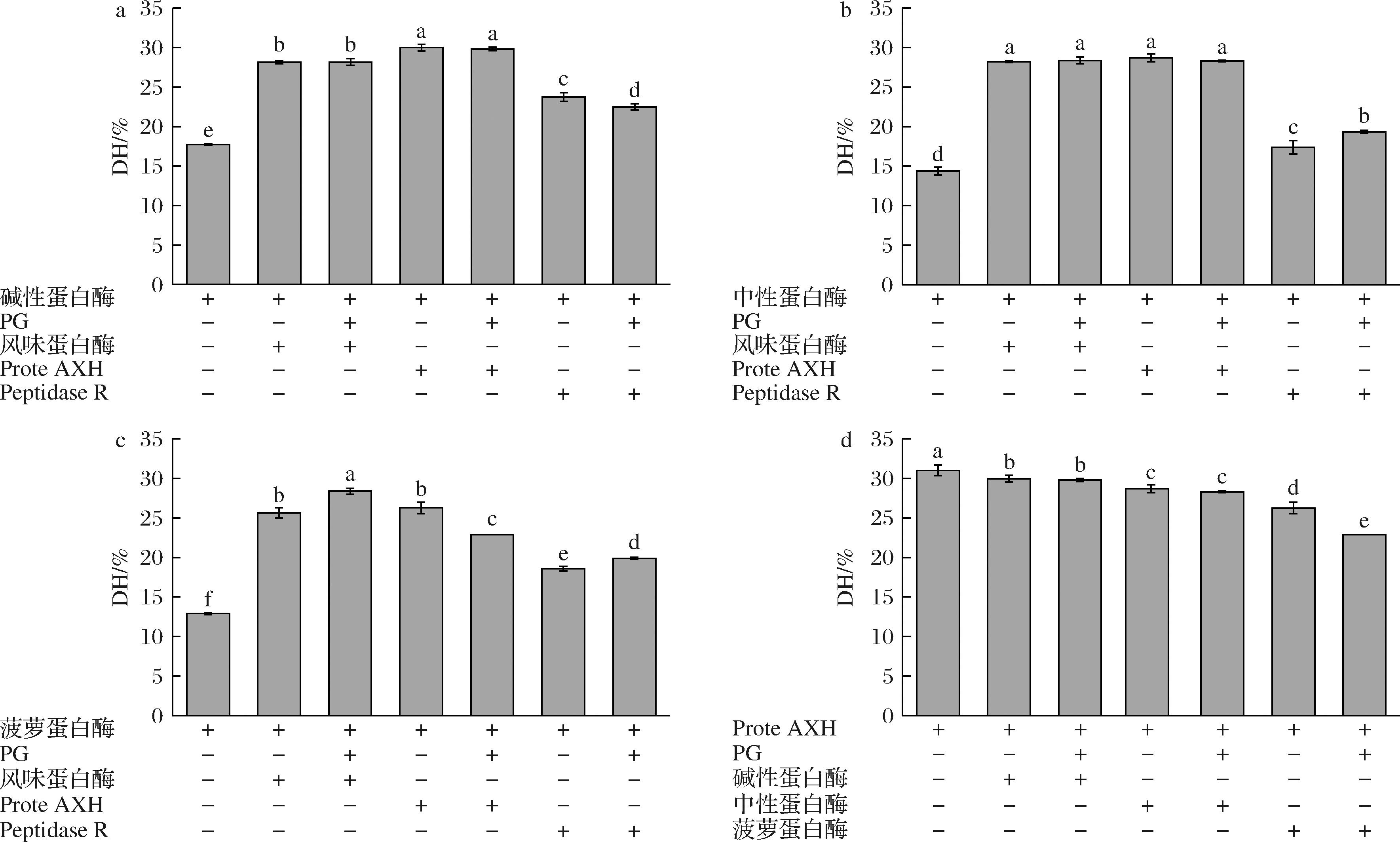
a-PG预处理后碱性蛋白酶组合DH比较;b-PG预处理后中性蛋白酶组合DH比较;c-PG预处理后菠萝蛋白酶组合DH比较;d-Prote AXH组合DH比较
图6 PG辅助的乳清蛋白酶解DH比较
Fig.6 DH of whey protein by PG assisted enzymatic hydrolysis
如图7所示,在PG处理后,大部分组合酶解后乳清蛋白肽分子质量分布没有明显差异。其中,与不加PG的组合相比,PG处理后多肽分子质量<245 Da的占比略有减小,因此配合PG处理可以避免其他酶处理引起的过度水解[17],从而提高产品的功能性。

a-PG预处理后碱性蛋白酶组合分子质量分布比较;b-PG预处理后中性蛋白酶相关分子质量分布比较;c-PG预处理后菠萝蛋白酶组合分子质量分布比较
图7 PG辅助的乳清蛋白酶解分子质量分布
Fig.7 Molecular weight of distribution whey protein by PG assisted enzymatic hydrolysis
2.2.2 得率与过敏原降解率
如图8-a所示,大部分酶组合在PG处理后得率都得到了显著提升,是因为谷氨酰残基的负电荷增加导致pI降低有助于静电排斥,使得乳清蛋白及多肽在弱酸性pH下更容易溶解,得率更高。在评估牛奶水解物中的残留抗原活性方面,ELISA法被广泛使用并高度敏感,它依赖于抗原特异性与IgG或IgE结合而进行检测[18]。图8-b是利用竞争性ELISA法测定的酶解物中β-LG过敏原降解情况。其中,碱性蛋白酶组合过敏原降解率皆在95%以上,碱性蛋白酶+Prote AXH组合过敏原降解率为95.4%,PG+碱性蛋白酶+Prote AXH组合可达到过敏原降解率97.47%,显著优于其他酶解组合。整体趋势与分子质量<3 000 Da占比有很大关系,分子质量<3 000 Da占比情况:碱性蛋白酶组合>菠萝蛋白酶组合>中性蛋白酶组合,过敏原降解率同样碱性蛋白酶组合>菠萝蛋白酶组合>中性蛋白酶组合,其中中性蛋白酶组合由于过敏原降解不明显,已超过试剂盒测量范围。结果表明,PG的加入对于大部分酶组合是有利的,但也有相反情况出现,这是因为PG的加入可能导致新表位的形成,使过敏性略有增加[19]。

a-PG预处理后双酶复配得率比较;b-PG预处理后双酶复配过敏原降解率比较
图8 酶解物得率与过敏原降解率
Fig.8 Yield and allergen degradation rate of enzyme hydrolysate
2.3 酶解乳清蛋白粉的氨基酸组成分析
综合分析,最佳酶组合为PG+碱性蛋白酶+Prote AXH(以下HWP代替),水解产物的氨基酸成分及含量如表2所示,其中氨基酸总量为 72.36 g/100 g,必需氨基酸含量为 33.4 g/100 g,占总氨基酸的46.16%。
表2 HWP总氨基酸含量
Table 2 TAA composition of HWP
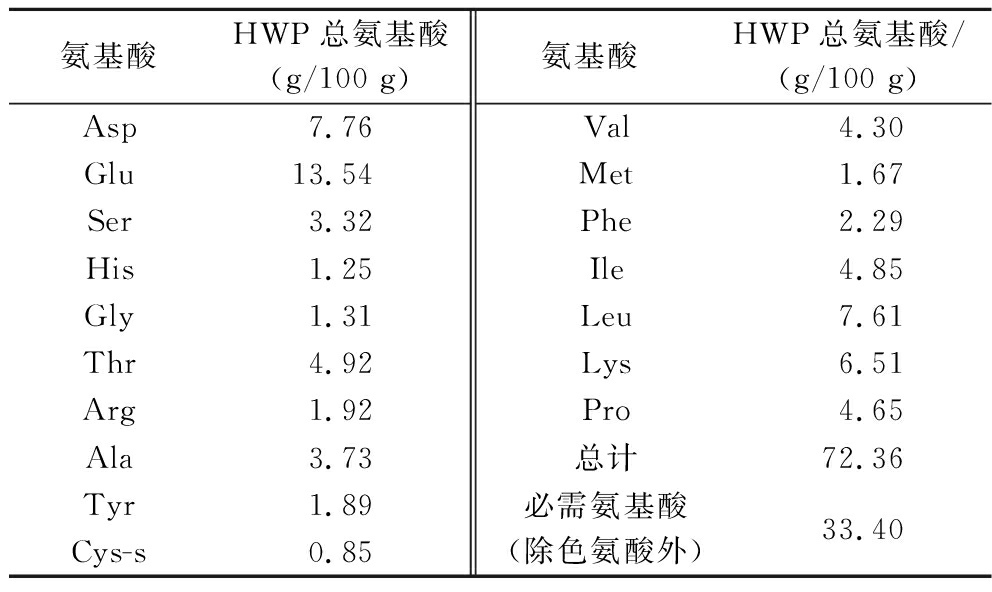
氨基酸HWP总氨基酸(g/100 g)氨基酸HWP总氨基酸/(g/100 g)Asp7.76Glu13.54Ser3.32His1.25Gly1.31Thr4.92Arg1.92Ala3.73Tyr1.89Cys-s0.85Val4.30Met1.67Phe2.29Ile4.85Leu7.61Lys6.51Pro4.65总计72.36必需氨基酸(除色氨酸外)33.40
3 结论与讨论
通过研究表明,PG的添加在一定程度上有利于提高酶解产物得率,促进过敏原降解。主要原因可能是在大多数的β-LG抗原表位上有谷氨酰胺的存在[20],而PG可以特异性地将蛋白质或多肽中的谷氨酰胺残基脱酰胺为谷氨酸。前期也有研究表明,小麦蛋白致敏性抗原结合位点富含谷氨酰胺(Gln-Gln-Gln-Pro-Pro),而针对谷氨酰胺的特异性修饰可以有效降低小麦蛋白的致敏性[21],因此,PG修饰蛋白可以作为降低蛋白质致敏性的潜在策略。结合本研究的结果,推测PG对β-LG抗原表位修饰也有类似的作用。同时谷氨酰残基的负电荷增加导致pI降低,有助于蛋白质的静电排斥,从而减少分子内和分子间的氢键相互作用,最终削弱分子的聚集能力,一方面可以增加蛋白质及多肽在弱酸性pH下的溶解度,另一方面,蛋白质结构在PG处理后更加松散[9],这也可能促使蛋白酶更容易发挥酶切作用,提高水解效果,最终提高其得率。此外,通过DH和多肽分子质量分布比较分析,多肽分子质量分布更能反映出蛋白质的水解程度,与过敏原降解率有极大地相关性,是因为过敏原的降低依赖于大分子质量肽段比例的减少,而DH是由酶活和酶作用位点决定,仅能表示出蛋白水解产物的肽链所占比例,无法表征大分子质量肽段的比例,因此,DH检测操作简单,在蛋白酶筛选及酶解工艺条件优化上便于应用。在后续对水解乳清蛋白样品中过敏原降低分析中,进一步配合多肽分子质量分布,可以更高效、低成本优化低致敏的乳清蛋白肽制备工艺。
本研究以WPC为研究对象, 以DH、分子质量分布、得率、过敏原降解率以及风味为指标, 确定最佳酶解组合——PG+碱性蛋白酶+Prote AXH,获得的水解乳清蛋白液的β-LG的降解率为97.47%,得率为93.5%,必需氨基酸占比为46.16%,为低敏乳清蛋白肽等高效制备提供一定的理论和技术参考。
[1] RYAN M P, WALSH G.The biotechnological potential of whey[J].Reviews in Environmental Science and Bio/Technology, 2016, 15(3):479-498.
[2] PEREIRA P C.Milk nutritional composition and its role in human health[J].Nutrition, 2014, 30(6):619-627.
[3] KHAN M U, LIN H, AHMED I, et al.Whey allergens:Influence of nonthermal processing treatments and their detection methods[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(5):4480-4510.
[4] VILLA C, COSTA J, OLIVEIRA M B P P, et al.Bovine milk allergens:A comprehensive review[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(1):137-164.
[5] FRITSCHÉ R, ADEL-PATIENT K, BERNARD H, et al.IgE-mediated rat mast cell triggering with tryptic and synthetic peptides of bovine beta-lactoglobulin[J].International Archives of Allergy and Immunology, 2005, 138(4):291-297.
[6] ZHAO C H, ASHAOLU T J.Bioactivity and safety of whey peptides[J].LWT, 2020, 134:109935.
[7] MADADLOU A, ABBASPOURRAD A.Bioactive whey peptide particles:An emerging class of nutraceutical carriers[J].Critical Reviews in Food Science and Nutrition, 2018, 58(9):1468-1477.
[8] LIU X, WANG C, ZHANG X W, et al.Application prospect of protein-glutaminase in the development of plant-based protein foods[J].Foods, 2022, 11(3):440.
[9] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science, 2001, 66(5):642-646.
[10] CHEUNG L K Y, ALUKO R E, CLIFF M A, et al.Effects of exopeptidase treatment on antihypertensive activity and taste attributes of enzymatic whey protein hydrolysates[J].Journal of Functional Foods, 2015, 13:262-275.
[11] MORAIS H A, SILVESTRE M P C, SILVA M R, et al.Enzymatic hydrolysis of whey protein concentrate:Effect of enzyme type and enzyme:Substrate ratio on peptide profile[J].Journal of Food Science and Technology, 2015, 52(1):201-210.
[12] CHIZOBA EKEZIE F G, CHENG J H, SUN D W.Effects of nonthermal food processing technologies on food allergens:A review of recent research advances[J].Trends in Food Science &Technology, 2018, 74:12-25.
[13] MIWA N, YOKOYAMA K, NIO N, et al.Effect of enzymatic deamidation on the heat-induced conformational changes in whey protein isolate and its relation to gel properties[J].Journal of Agricultural and Food Chemistry, 2013, 61(9):2205-2212.
[14] MIWA N, YOKOYAMA K, WAKABAYASHI H, et al.Effect of deamidation by protein-glutaminase on physicochemical and functional properties of skim milk[J].International Dairy Journal, 2010, 20(6):393-399.
[15] HAMADA J S.Deamidation of food proteins to improve functionality[J].Critical Reviews in Food Science and Nutrition, 1994, 34(3):283-292.
[16] NIKBAKHT NASRABADI M, SEDAGHAT DOOST A, MEZZENGA R.Modification approaches of plant-based proteins to improve their techno-functionality and use in food products[J].Food Hydrocolloids, 2021, 118:106789.
[17] CHEN X, FU W Y, LUO Y C, et al.Protein deamidation to produce processable ingredients and engineered colloids for emerging food applications[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4):3788-3817.
[18] M KINEN-KILJUNEN S, PALOSUO T.A sensitive enzyme-linked immunosorbent assay for determination of bovine beta-lactoglobulin in infant feeding formulas and in human milk[J].Allergy, 1992, 47:347-352.
KINEN-KILJUNEN S, PALOSUO T.A sensitive enzyme-linked immunosorbent assay for determination of bovine beta-lactoglobulin in infant feeding formulas and in human milk[J].Allergy, 1992, 47:347-352.
[19] 何萌. 酶法制备低抗原性乳清蛋白及产品中试设计[D].烟台:烟台大学, 2020.HE M.Enzymatic preparation of low antigenic whey protein and product pilot design[D].Yantai:Yantai University, 2020.
[20] TSUJI N M, KURISAKI J I, MIZUMACHI K, et al.Localization of T-cell determinants on bovine β-lactoglobulin[J].Immunology Letters, 1993, 37(2-3):215-221.
[21] JIANG Z Q, SONTAG-STROHM T, SALOVAARA H, et al.Oat protein solubility and emulsion properties improved by enzymatic deamidation[J].Journal of Cereal Science, 2015, 64:126-132.