微量元素缺乏被称为一种隐性饥饿状态,可能导致许多健康问题,包括贫血、能量代谢障碍、免疫损伤等。文献报道,以盐和金属螯合肽的形式添加铁来强化食物,可对抗微量元素缺乏症[1]。与盐相比,金属螯合肽具有生物利用度高、吸收性好和结构稳定性等优势[2]。研究指出,肽分子中的组氨酸、谷氨酸、天冬氨酸和半胱氨酸等氨基酸可以与金属形成可溶性复合物,提高金属的吸收率[3-5]。
利用酶水解食物蛋白可以释放出能够与金属螯的具有不同生物活性的生物肽[1, 6]。大豆浓缩蛋白作为食品工业常见的原料,具有加工成本低,生物效价高等特点。研究发现,大豆蛋白可促进机体内微量元素的吸收[7]。由此可见,大豆蛋白肽可作为金属螯合的理想载体原料。
本研究以大豆浓缩蛋白为原料,使用蛋白酶解技术将其酶解为小肽,测定分子质量以确定最佳酶解时间,得到适合参与螯合反应的分子质量区间的肽段。以锌螯合蛋白肽为模板,确定最优工艺流程,并基于此模板使用不同金属盐与大豆蛋白肽进行螯合反应,测定相关指标,制备最优工艺流程的蛋白螯合铜/蛋白螯合铁/蛋白螯合锌/蛋白螯合锰,使用红外光谱和扫描电镜表征和对比分析不同金属盐与大豆蛋白肽的结合模型及结构特征,为大豆蛋白肽-微量元素螯合物的应用提供结构学数据支撑。
1 材料与方法
1.1 材料与试剂
大豆浓缩蛋白,青岛银海和益国际贸易有限公司;复合蛋白酶,南宁东恒华道生物科技有限责任公司;ZnSO4·7H2O、FeSO4·H2O、CuSO4·5H2O、MnSO4·H2O,上海麦克林生化科技股份有限公司。
1.2 仪器与设备
AA240FS原子吸收分光光度计,美国安捷伦公司;TESCAN MIRA LMS扫描电子显微镜,捷克泰思肯公司;Nexus 470红外光谱仪,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 大豆蛋白肽-金属螯合物的制备
本实验制备过程包括酶解和螯合两部分,将大豆蛋白25 g溶解于150 mL去离子水中,70 ℃搅拌15 min,使蛋白充分溶胀,待蛋白液降温至50 ℃后,将0.162 5 g复合蛋白酶加入蛋白液中,NaOH/HCl调节pH至7.5,开始酶解;酶解完成后,加入金属盐(ZnSO4·7H2O 40 g;FeSO4·H2O 30 g;CuSO4·5H2O 35 g;MnSO4·H2O 28 g),调节pH至4.5,50 ℃螯合60 min;螯合结束后,升温至85 ℃,灭酶15 min,烘干,粉碎。
工艺流程:投料(蛋白)→溶解溶胀蛋白→酶解→投料(金属盐)→螯合→灭酶→干燥→粉碎
1.3.2 酶解后多肽的分子质量测定
利用分子质量数据表征酶解效果,分别取3~8 h内的酶解液样液,严格按照现行国家标准GB/T 22492—2008《大豆肽粉》使用凝胶色谱法测定酶解后多肽的分子质量以确定酶解效果。
1.3.3 大豆蛋白肽-金属螯合物的金属含量及螯合率测定
金属含量按照GB/T 13885—2017《饲料中钙、铜、铁、镁、锰、钾、钠和锌含量的测定 原子吸收光谱法》中的方法使用原子吸收分光光度计测试。乙醇洗脱未螯合金属离子后,按公式(1)计算螯合率:
螯合率![]()
(1)
式中:m1,螯合物中的金属含量,mg;m2,反应体系中的金属总量,mg。
1.3.4 傅里叶红外光谱表征大豆蛋白肽-金属螯合物
使用KBr对所制备的蛋白锌/蛋白铜/蛋白铁/蛋白锰进行预处理,以100∶1(KBr∶样品)的比例混合样品,使用压片机压片,测试400~4 000 cm-1波长范围内的红外吸收。
1.3.5 扫描电镜表征大豆蛋白肽-金属螯合物
取微量样品/块体/薄膜样品直接黏到导电胶上,并使用溅射镀膜仪喷金45 s,喷金为10 mA;随后使用扫描电镜拍摄样品形貌。
1.3.6 数据处理
所有实验重复3次,使用Origin软件进行数据处理及可视化。
2 结果与分析
2.1 大豆蛋白肽-微量元素螯合工艺选择
本实验的螯合工艺主要包括酶解和螯合两部分,酶解效果通过分子质量大小表征,<1 000 Da为小肽,证明酶解效果好,分子质量越低表明其螯合位点越多[8]。螯合效果由螯合率表征,计算方法同1.3.3节。
2.1.1 酶解时间对螯合效果的影响
浓缩大豆蛋白中大部分为完整折叠的蛋白,金属结合位点少,将其酶解为短肽后,金属结合位点随着分子质量减少而变多,更易形成螯合体系。因此,本实验选择大豆复合蛋白酶作为酶解工具,对大豆蛋白进行酶解。具体方案为:大豆浓缩蛋白用量25 g,复合蛋白酶0.162 5 g,为保证充分酶解,酶解留样起始时间设置为3 h,分别在酶解至3~8 h时留样测试分子质量(图1)。在酶解5 h以后,大豆蛋白肽的分子质量下降到1 000 Da以下,确定为适合进行肽-金属螯合反应的分子质量区间。
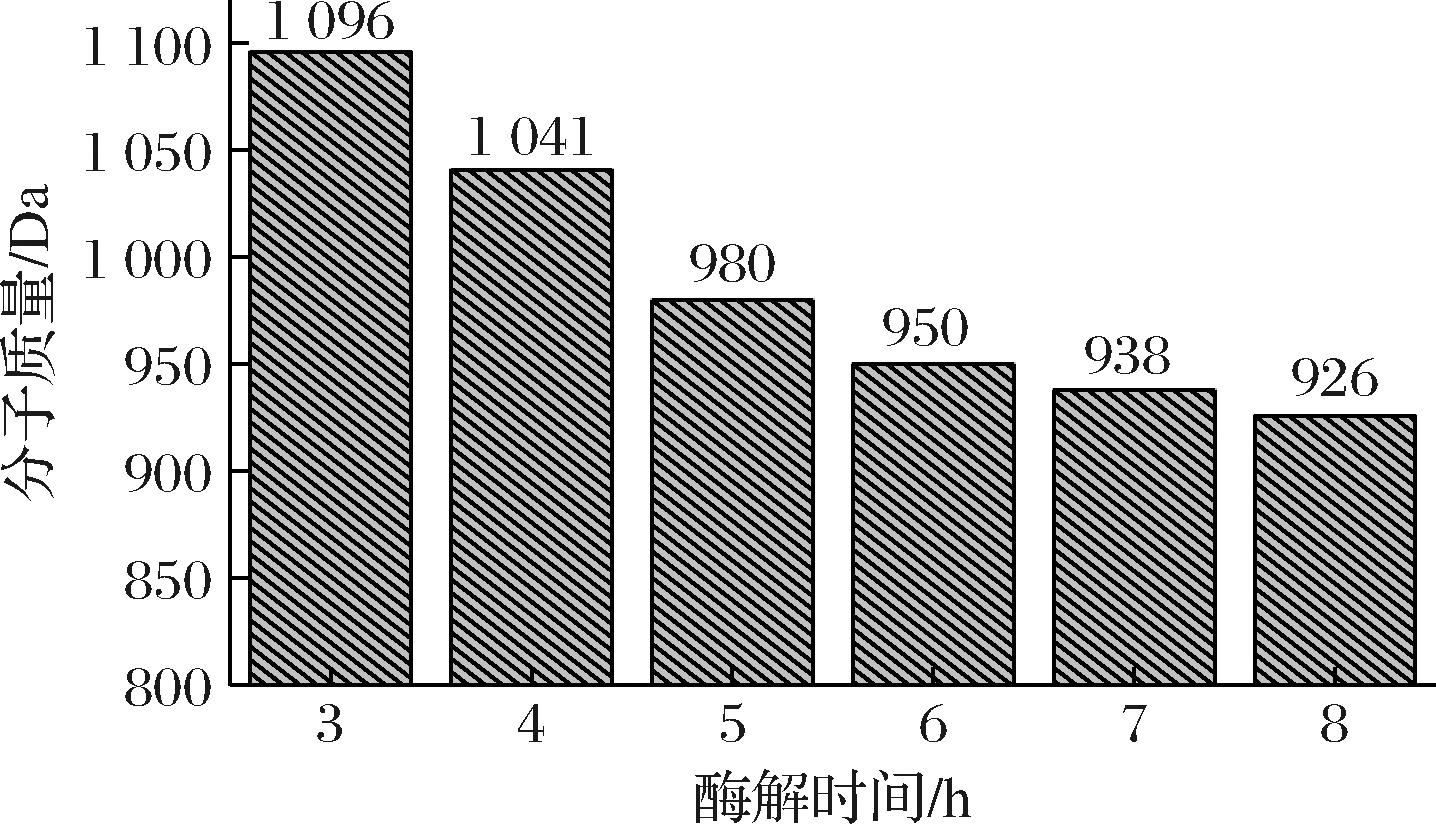
图1 不同酶解时间大豆蛋白肽的分子质量区间
Fig.1 Molecular weight interval of soybean protein peptides at different enzymatic hydrolysis times
使用不同酶解时间的大豆蛋白肽进行微量元素螯合(螯合锌盐:ZnSO4·7H2O 40 g;螯合时间:1 h),结果如图2所示。不同酶解时间也导致了螯合率的变化,即酶解肽时间越长螯合率越低,大豆蛋白肽的分子质量在酶解6 h以后保持稳定。因此,考虑到工艺的实际生产应用,选择5 h作为最佳酶解时间,既保证了蛋白的充分酶解,也保证了最终螯合物的纯度。
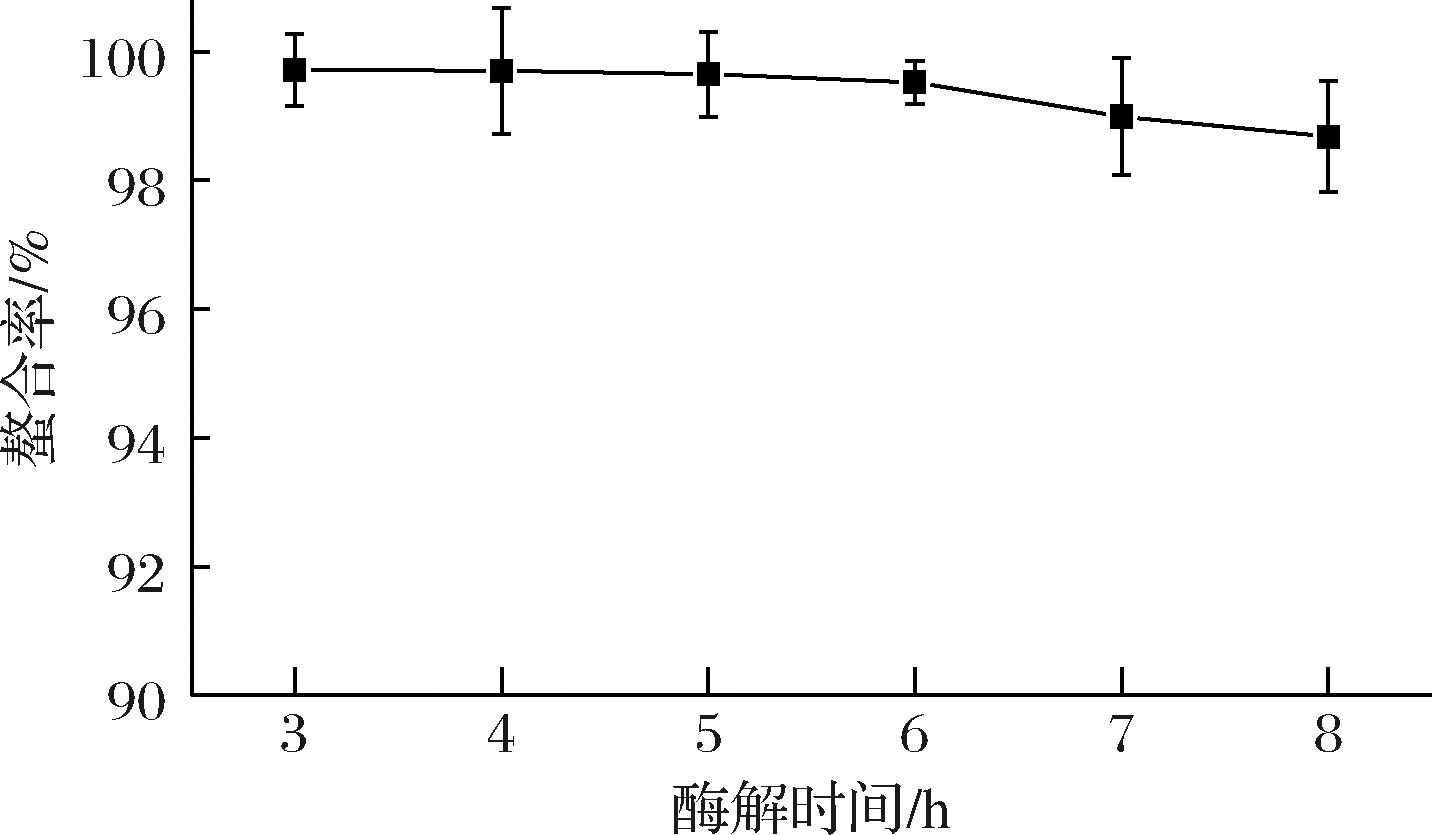
图2 不同酶解时间大豆蛋白肽-金属的螯合率变化
Fig.2 Chelation rate of soybean protein peptide metal at different enzymolysis times
2.1.2 不同金属盐对大豆蛋白肽-锌螯合物螯合率的影响
确定酶解时间后,我们分别使用不同的金属盐进行螯合实验(螯合时间1 h),以确定合适的金属盐作为螯合配体。本实验分别使用ZnCl2及ZnSO4·7H2O进行螯合实验[9],如图3所示,ZnSO4·7H2O的螯合性能远高于ZnCl2,因此,选择硫酸盐作为后续螯合的螯合配基。
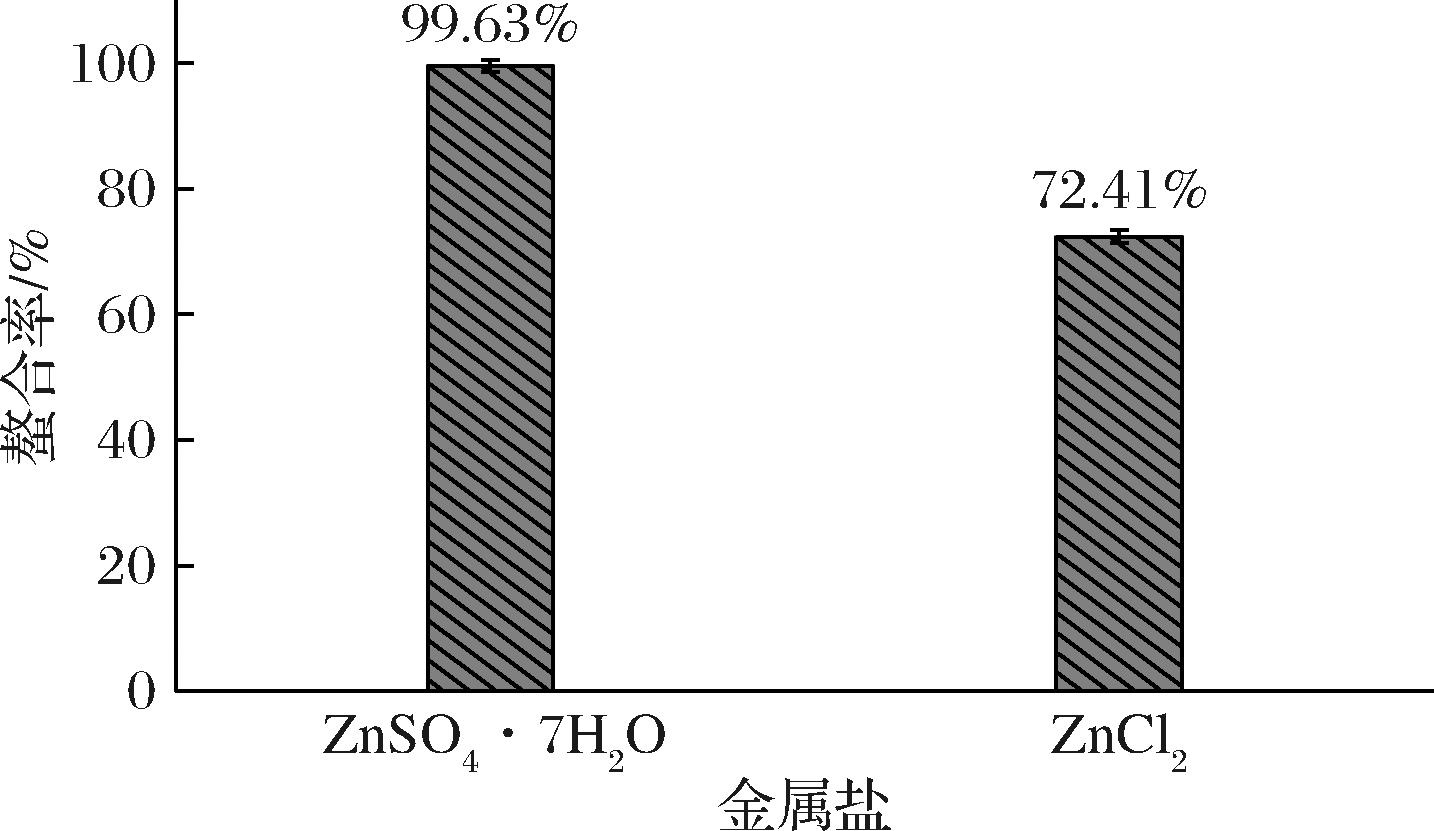
图3 加入不同锌盐对螯合率的影响
Fig.3 Effect of adding different zinc salts on the chelation rate
此外,本实验还测试了不同pH对螯合率的影响。结果发现pH对螯合率的影响不大,均在95%以上。基于工业生产的可能性,降低pH调节剂的用量,防止螯合液对工业螯合罐的过分腐蚀,本实验最终选择最佳螯合pH为4.5。
2.2 大豆蛋白肽-微量元素螯合工艺确定
以大豆蛋白肽-锌的工艺流程为模板,最终确定了大豆蛋白肽-铜、大豆蛋白肽-铁、大豆蛋白肽-锰、大豆蛋白肽-锌螯合物的工艺流程,按1.3.1节工艺制备。
制备的大豆蛋白肽-微量元素如图4所示,所有样品均为细腻粉末状,室温下性质稳定,无结块和融化。表观特性分别为:大豆蛋白肽-铜呈暗绿色,大豆蛋白肽-铁呈深棕色,大豆蛋白肽-锰显示了浅棕色,大豆蛋白肽-锌呈浅黄色。

a-大豆蛋白肽-铜;b-大豆蛋白肽-铁;c-大豆蛋白肽-锰;d-大豆蛋白肽-锌
图4 大豆蛋白肽-微量元素螯合物
Fig.4 Soybean protein peptide trace element complex
如表1所示,所制备的大豆蛋白肽-微量元素螯合物金属含量>14%,粗蛋白含量>28%,螯合率均高于98%。以上数据表明大豆蛋白肽-金属螯合物螯合纯度高,形成的有机态螯合物,将有利于生物体吸收利用。
表1 大豆蛋白肽-微量元素螯合物各项指标实测数据
Table 1 Measured data of various indexes of soybean protein peptide trace element chelate
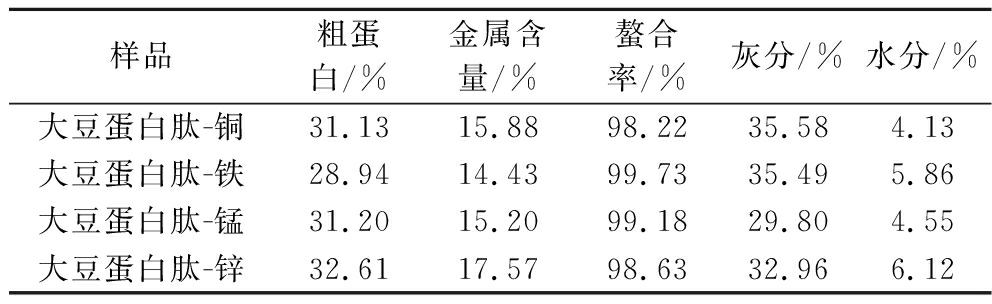
样品粗蛋白/%金属含量/%螯合率/%灰分/%水分/%大豆蛋白肽-铜31.1315.8898.2235.584.13大豆蛋白肽-铁28.9414.4399.7335.495.86大豆蛋白肽-锰31.2015.2099.1829.804.55大豆蛋白肽-锌32.6117.5798.6332.966.12
2.3 大豆蛋白肽-微量元素螯合物扫描电镜分析
扫描电镜作为常用的分析手段,常被用来观察和分析物质的形态学表征和元素组成[2,10]。如图5-a所示,大豆浓缩蛋白的原始样品表面呈现略有皱缩的形态,整体形貌连续无杂质。酶解后,其表面形态有较为明显的变化(图5-b),表现为表面变粗糙,变化原因可能为大豆蛋白被酶解为小肽后(1 000 Da以下),二级结构被破坏,分子间重排导致截然不同的分子形貌;在大豆蛋白肽与金属元素螯合后,分子的表面形貌进一步发生变化,粗糙程度和表面吸附的颗粒物有着明显变化,说明螯合具有一定的吸附作用,吸附的颗粒物可能是金属离子[11]。表观形态方面,锌(图5-c)和铁(图5-f)的螯合对大豆蛋白肽的表观形态有较大的影响,铜(图5-e)次之,变化最小的是大豆蛋白肽-锰螯合物(图5-d)。其中,锌的加入导致大豆蛋白肽表面出现规则的泡状突起,与铁螯合后,大豆蛋白肽-铁表面粗糙,为致密的颗粒集合体,这可能是在锌和铁与大豆蛋白羧基之间的螯合过程中形成的“桥接作用”导致的[12]。大豆蛋白肽-铜螯合物较原大豆蛋白表面出现了波浪形起伏,说明铜对大豆蛋白肽的结构也有一定影响。大豆蛋白肽-锰螯合物的扫描电镜图则显示了与原大豆蛋白相似的表观结构。

a-大豆浓缩蛋白;b-大豆浓缩蛋白水解物;c-大豆蛋白肽-锌螯合物;d-大豆蛋白肽-锰螯合物;e-大豆蛋白肽-铜螯合物;f-大豆蛋白肽-铁螯合物
图5 扫描电镜图
Fig.5 Scanning electron microscope images
因此,在相似的螯合条件下,不同的金属会对大豆蛋白肽的微观形貌产生截然不同的影响,本实验的研究结果为金属-肽的相互作用提供新的理论见解。
2.4 大豆蛋白肽-微量元素螯合物红外图谱分析
傅里叶红外光谱作为常用的结构分析手段,常被用于分析物质组成和官能团表征,因此我们使用红外光谱技术检测了大豆蛋白肽及其螯合物的结构变化[13-14]。如图6-a所示,大豆蛋白酶解物的红外谱图与原大豆浓缩蛋白的红外谱图相比有较大变化,表现为酰胺Ⅰ带的双峰降低,峰形改变,酰胺Ⅲ带峰强增强并伴随着并峰现象。红外光谱这两个酰胺带常被用来分析蛋白质的二级结构[15],这些变化归因于蛋白质被酶解成小肽后发生分子重排整体结构被破坏。大豆蛋白肽中3 291.37 cm-1代表N—H键,1 121.27 cm-1的峰代表—COO键[16]。在与锌螯合后,1 121.27 cm-1处的峰位移至1 100.44 cm-1,3 291.37 cm-1处的强峰未发生显著位移,预示着螯合位点在蛋白质谷氨酸的—COO基团上,低波数处出现新的峰(526 cm-1)代表着COO平面外弯曲,蛋白质羧基参与了配位结合;大豆蛋白肽-锰的红外图谱中,1 121.27 cm-1处的峰位移至1 128.70 cm-1,3 291.37 cm-1处的强峰位移至3 368.23 cm-1处,表明大豆蛋白肽的—COO基团和N—H基团均参与了金属离子的结合,锰对N—H基团的亲和能力较强(红外特征峰位移:76.86 cm-1);大豆蛋白肽-铁的红外图谱中,1 121.27 cm-1处的峰位移至1 136.14 cm-1,3 291.37 cm-1处的强峰位移至3 371.11 cm-1处,515.75 cm-1处出现新峰,可能为β-FeOOH键,为铁的配位键[17],结合其他部分的位移变化,铁在—COO基团和N—H基团处均有配位结合;大豆蛋白肽-铜的红外图谱中,1 121.27 cm-1处的峰位移至1 043.84 cm-1,3 291.37 cm-1处的强峰位移至3 286.83 cm-1处,同样说明大豆蛋白肽-铜螯合物中—COO键和N—H键均参与了结合。根据3 291.37和1 121.27 cm-1两处强峰的整体化学位移变化,可推测出各金属盐对大豆蛋白肽的亲和能力及变构程度,根据红外光谱数据,金属盐对大豆蛋白肽的亲和能力可能遵循以下顺序:铁(位移数:94.61 cm-1)>锰(位移数:84.29 cm-1)>铜(位移数:81.97 cm-1)>锌(位移数:20.94 cm-1)。结合先前的扫描电镜分析发现,化学键的变化似乎与物质表面形态并无关联。本研究实验结果为不同金属盐与蛋白副产物的相互作用提供见解。

a-大豆浓缩蛋白与大豆蛋白肽;b-大豆蛋白肽-金属螯合物
图6 傅里叶红外谱图
Fig.6 Fourier infrared spectrogram
3 结论与讨论
本实验选择不同的酶解时间和金属盐制备了大豆蛋白肽-铜、大豆蛋白肽-铁、大豆蛋白肽-锰、大豆蛋白肽-锌螯合物,制备的大豆蛋白肽-微量元素螯合物金属含量>14%,粗蛋白含量>28%,螯合率均高于98%。螯合产物具有纯度高、有机态、利于生物体吸收等特征。扫描电镜结果表明,几种微量元素均改变了大豆蛋白肽的表面形态,其中锌和铁对大豆蛋白肽形态的影响最大,锰和铜对大豆蛋白肽的影响最小。红外光谱结果表明,大豆蛋白肽中的N—H键和—COO键参与了微量元素的配位结合,金属盐对大豆蛋白肽的亲和能力可能遵循以下顺序:铁(位移数:94.61 cm-1)>锰(位移数:84.29 cm-1)>铜(位移数:81.97 cm-1)>锌(位移数20.94 cm-1)。本研究结论对未来理解不同金属对蛋白水解物的亲和关系具有重要作用。
[1] 王子怀, 胡晓, 李来好, 等.肽-金属离子螯合物的研究进展[J].食品工业科技, 2014, 35(8):359-363.WANG Z H, HU X, LI L H, et al.Research progress in peptide-mineral ion complexes[J].Science and Technology of Food Industry, 2014, 35(8):359-363.
[2] WU W F, LI B F, HOU H, et al.Identification of iron-chelating peptides from Pacific cod skin gelatin and the possible binding mode[J].Journal of Functional Foods, 2017, 35:418-427.
[3] SWAIN J H, TABATABAI L B, REDDY M B.Histidine content of low-molecular-weight beef proteins influences nonheme iron bioavailability in Caco-2 cells[J].The Journal of Nutrition, 2002, 132(2):245-251.
[4] 单冬丽. 有机微量元素在健康养猪业上的研究与应用进展[J].广东饲料, 2013, 22(2):23-26.SHAN D L.Research and application progress of organic trace elements in healthy pig industry[J].Guangdong Feed, 2013, 22(2):23-26.
[5] GARZON-RODRIGUEZ W, YATSIMIRSKY A K, GLABE C G.Binding of Zn(II), Cu(II), and Fe(II) ions to Alzheimer’s Aß peptide studied by fluorescence[J].Bioorganic &Medicinal Chemistry Letters, 1999, 9(15):2243-2248.
[6] ZHANG C, DU B W, SONG Z H, et al.Antioxidant activity analysis of collagen peptide-magnesium chelate[J].Polymer Testing, 2023, 117:107822.
[7] LV Y, LIU Q, BAO X L, et al.Identification and characteristics of iron-chelating peptides from soybean protein hydrolysates using IMAC-Fe3+[J].Journal of Agricultural and Food Chemistry, 2009, 57(11):4593-4597.
[8] 张智, 刘慧, 刘奇, 等.玉米肽-锌螯合物结构表征及抗氧化活性分析[J].食品科学, 2017, 38(3):131-135.ZHANG Z, LIU H, LIU Q, et al.Structural characteristics and antioxidant activity of corn peptide-Zn complex[J].Food Science, 2017, 38(3):131-135.
[9] 柯枭, 胡晓, 杨贤庆, 等.罗非鱼皮胶原蛋白肽-锌螯合物的制备及结构表征与体外消化分析[J].食品与发酵工业, 2021, 47(14):38-44.KE X, HU X, YANG X Q, et al.Preparation, structure characterization and in vitro gastrointestinal digestion of tilapia skin collagen peptide-zinc chelate[J].Food and Fermentation Industries, 2021, 47(14):38-44.
[10] ZHANG Y J, DING X J, LI M Q.Preparation, characterization and in vitro stability of iron-chelating peptides from mung beans[J].Food Chemistry, 2021, 349:129101.
[11] LI C, BU G H, CHEN F S, et al.Preparation and structural characterization of peanut peptide-zinc chelate[J].CyTA - Journal of Food, 2020, 18(1):409-416.
[12] LI B, HE H, SHI W, et al.Effect of duck egg white peptide-ferrous chelate on iron bioavailability in vivo and structure characterization[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1834-1841.
[13] HU S J, LIN S Y, LIU Y, et al.Exploration of iron-binding mode, digestion kinetics, and iron absorption behavior of Antarctic Krill-derived heptapeptide-iron complex[J].Food Research International, 2022, 154:110996.
[14] YUAN B, ZHAO C, CHENG C, et al.A peptide-Fe(II) complex from Grifola frondosa protein hydrolysates and its immunomodulatory activity[J].Food Bioscience, 2019, 32:100459.
[15] WU D, DUAN R, TANG L, et al.Binding mechanism and functional evaluation of quercetin 3-rhamnoside on lipase[J].Food Chemistry, 2021, 359:129960.
[16] LIU X Y, WANG Z X, YIN F W, et al.Zinc-chelating mechanism of sea cucumber (Stichopus japonicus)-derived synthetic peptides[J].Marine Drugs, 2019, 17(8):438.
[17] 崔洁芬, 杜春影, 迟永洲, 等.浒苔多糖铁的制备工艺优化及其结构表征[J].食品工业科技, 2018, 39(5):161-165;170.CUI J F, DU C Y, CHI Y Z, et al.Optimization of preparation process of Enteromorpha prolifera polysaccharide-iron and its structure characterization[J].Science and Technology of Food Industry, 2018, 39(5):161-165;170.