苦味肽是蛋白质在发酵、老化水解过程中产生的一种风味肽,具有提高免疫、抗氧化、抗炎和抗菌等多种功能[1],可在功能性食品和保健食品中作为健康营养成分。然而苦味肽的高苦味会严重影响食品风味,降低消费者的接受度,使其难以在食品领域得到广泛运用。ALIM等[2]通过感官评价测定苦味肽氨基酸水溶液的苦味阈值,发现造成苦味的氨基酸在0.5~3.0 g/L 时便会产生强烈苦味,严重影响消费者感官体验。因此,在食品工业中需采用一定措施掩盖苦味肽的不良风味,提高苦味肽的应用价值。通过木糖醇、麦芽糊精、环糊精、聚磷酸盐等食品添加剂的组合,是常见的掩盖蛋白质水解产物苦味的方式[3]。贾聪等[4]通过两步酶解法成功降低芝麻血管紧张素Ⅰ转换酶的苦味,但酶处理脱苦具有实验条件严格、操作复杂、成本高等缺点,目前尚未在食品工业当中大规模应用;LIU等[5]发现美拉德反应肽的形成可以掩盖苦味,改善多肽的口感,但该反应同时伴随多肽结构的改变,从而影响其生物活性。
食品包封法[6]可以避免苦味肽直接暴露于口腔环境中与苦味受体结合,是一种掩蔽蛋白水解物苦味的合适方法。与其他消除苦味的方法相比,采用食品运载体包封苦味肽可以通过物理屏障掩盖苦味,减少多肽损失并提高其稳定性,适用于工业大规模生产。常见的食品运载包埋技术包括脂质体[7]、乳液[8]、双重乳液[9]、微胶囊[10]等。其中,双重乳液载体具有风味掩蔽、控制活性成分释放以及保护不稳定成分等特点[11]。但双重乳液自身结构的不稳定特性[12]使其产品货架期短,易造成包封活性成分的泄漏。为了方便运输贮藏和实现活性成分稳定封装的目的,可以采用微胶囊技术将液体双重乳液转化为固体微胶囊颗粒[13]。胡丽萍等[14]以乳清蛋白和海藻糖为壁材,通过pH诱导法实现槲皮素与益生菌的共微囊化,微胶囊化后益生菌在胃肠道消化过程中的耐受力显著提高。酪蛋白酸钠是一种安全无害的水溶性乳化剂,有助于形成平衡、稳定乳状液,增进脂肪和水的保持力,防止乳液脱水收缩,并有助于食品加工。
本文以苦味肽水溶液作为内水相(W1),棕榈油、山茶油溶液作为油相,酪蛋白酸钠溶液作为外水相(W2),通过两步乳化法构建W1/O/W2 双重乳液。在此基础上,以麦芽糊精、糖浆、低聚果糖、明胶溶液作为壁材,通过微囊化技术制备了包封苦味肽的微胶囊并评估其理化特性。微胶囊的比表面积等结构特性通过扫描电子显微镜(scanning electron microscope,SEM)、单点BET法等进行表征分析;进一步通过粒径变化、物理稳定性等方式评价微胶囊复原乳的稳定性;采用小组感官评价实验探究双重乳液微胶囊载体对苦味肽的苦味掩蔽能力。相关的研究结果为苦味肽的苦味掩蔽提供了一种新策略,并且为具有不良风味的功能性成分的产品开发提供了一种新思路。
1 材料与方法
1.1 材料与试剂
苦味肽(源自小麦谷朊粉,分子质量<1 000 Da),郑州梦辰生物科技有限公司;山茶油,江西广恩和药业股份有限公司;棕榈油(食品级,熔点50 ℃),广州郎枫化工有限公司;聚甘油蓖麻醇酸酯(polyglyceryl-polyricinoleate,PGPR),河南明瑞集团有限公司;酪蛋白酸钠(食品级),郑州万搏化工产品有限公司;糖浆(玉米糖浆)、低聚果糖、明胶(食品级),江西福美泰生物技术有限公司;硼酸、NaOH等试剂均为分析级,西陇化工股份有限公司。
1.2 仪器与设备
M-110EH30动态高压微射流,美国Microfluidic公司;ULTRA TURRAX® T18 digital分散机,德国IKA集团;MasterSizer 300 0马尔文微米粒度仪,英国马尔文仪器有限公司;CKX41光学显微镜,日本Olympus公司;AL204电子分析天平,上海梅特勒-拉利多仪器有限公司;C-MAG HS 7磁力搅拌器,德国IKA集团;827 pH计,上海梅特勒-拉利多仪器有限公司;LUMiSizer稳定分析仪,德国LUM GmbH有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;比表面及孔隙度测试仪,北京精微高博有限公司;电热恒温鼓风干燥箱,上海柏欣仪器设备厂;小型喷雾干燥仪,瑞士Büchi公司。
1.3 实验方法
1.3.1 苦味肽双重乳液微胶囊产品配方及工艺流程
产品配方:油相由5%(质量分数,下同)PGPR、15%棕榈油、0.5%柠檬精油、0.02%脂溶性抗氧化剂TBHQ及山茶油组成,内水相由为60%苦味肽、1%明胶组成,外水相由2.5%酪蛋白酸钠溶液组成。
工艺流程:初级油包水乳液(W1/O)以油水比6∶4(质量比)经超高速分散机 12 000 r/min 均质3 min,然后经高压微射流于90 MPa 均质2次→外水相(W2)与初级油包水乳液(W1/O)以6∶4(质量比)经超高速分散机11 000 r/min 均质2 min得到苦味肽双重乳液→以麦芽糊精∶糖浆∶低聚果糖∶明胶=5∶1∶10∶0.1为填充壁材,母液固形物含量为50%→通过喷雾干燥微囊化技术制备双重乳液微胶囊产品,喷雾干燥条件为:进风温度165 ℃,出风温度90 ℃,泵速7 mL/min。
1.3.2 苦味肽双重乳液微胶囊微观形貌
通过扫描电镜(scanning electron microscope,SEM)观察微胶囊微观形貌。取少量粉末样品置于样品台上,对样品进行喷金操作,使用TESCAN MIRA4扫描电镜观察粉末样品的微观结构。
1.3.3 苦味肽双重乳液微胶囊的孔隙率与比表面积
称取100 mg微胶囊固体粉末,采用单点BET方法测定微胶囊的比表面积。采用气体吸附法通过比表面及孔隙率测试仪测定吸附剂的比表面积与孔隙度。通过比表面及孔隙度测试仪进行测定。
1.3.4 苦味肽双重乳液微胶囊物理性质测定
1.3.4.1 苦味肽双重乳液微胶囊的水分含量
参考国家标准GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。
1.3.4.2 苦味肽双重乳液微胶囊的溶解度
准确称取0.5 g固体粉末样品,溶解在15 mL蒸馏水中搅拌均匀,于室温下离心(1 500 r/min, 20 min)后,取15 mL上清液至提前恒重的玻璃培养皿中,放置于105 ℃烘箱干燥至恒重,根据公式(1)计算固体粉末样品的溶解度:
X/%=(m1-m3+m2)/m1×100
(1)
式中:X,苦味肽双重乳液微胶囊的溶解度,%;m1,固体粉末的质量,g;m2,干燥前玻璃器皿的质量,g;m3,干燥后玻璃器皿与样品的总质量,g。
1.3.4.3 苦味肽双重乳液微胶囊的润湿性
准确称取0.1 g固体粉末样品分散至100 mL蒸馏水表面,静置,记录粉末样品完全浸没所用的时间。
1.3.4.4 苦味肽双重乳液微胶囊的表面油脂及总油脂含量测定
参考QB/T 4791—2015《植脂末》的测定方法并略有修改。准确称取1.5 g固体粉末于100 mL锥形瓶中,加入50 mL石油醚并于室温下振荡混匀后过滤,然后用20 mL石油醚分3次将锥形瓶内壁及滤纸上的样品冲洗干净,过滤后合并滤液至恒重的烧瓶中,之后先于60~70 ℃水浴旋转蒸发液体,而后置于真空干燥箱中干燥至恒重(即两次称量前后质量差≤2 mg),称量含油的烧瓶质量,重复3次测量。根据公式(2)计算固体粉末的表面油脂含量:
(2)
式中:Y,固体粉末的表面油脂含量,%;m1,固体粉末的质量,g;m2,干燥前空烧瓶的质量,g;m3,干燥后烧瓶的总质量,g。
准确称取1.0 g固体粉末样品置于分液漏斗当中,加入10 mL蒸馏水(60 ℃)使样品完全溶解,待冷却至室温后,加入1.25 mL氨水,混合均匀,再加入10 mL乙醇、25 mL乙醚混合均匀,振荡1 min后放气,之后再加入25 mL石油醚,充分振荡1 min后放气。然后将分液漏斗放置于漏斗架上静置等待其分层。收集分液漏斗中上层液体转移至恒重的烧瓶中,于60~70 ℃水浴旋转蒸发液体,将烧瓶置于真空干燥箱中干燥至恒重,称量并记录干燥后的烧瓶质量。根据公式(3)计算固体粉末的总油脂含量:
(3)
式中:Z,固体粉末的总油脂含量,%;m1,固体粉末的质量,g;m2,干燥前空烧瓶的质量,g;m3,干燥后烧瓶的总质量,g。
1.3.5 复原乳的微观形貌与粒径分布
通过光学显微镜观察复原乳微观结构,取5.0 g微胶囊粉末与蒸馏水按照1∶1比例溶解复原乳,滴1滴复原乳于载玻片上,盖上盖玻片后置于光学显微镜下观察,物镜放大倍数为40×,目镜放大倍数为10×。参照ZHU等[15]的测定方法,采用马尔文粒度仪测定不同乳液的粒径分布。测定参数如下:蒸馏水和油相溶液的折射率依次为1.33和1.46,遮光率为3%~8%,以表面加权平均直径(D3,2)来表示乳液最终的平均粒径大小。
1.3.6 复原乳的物理稳定性
复原乳的物理稳定性通过LUMiSizer稳定性分析仪对加速模拟样品的不稳定现象进行测定,参考LI等[16]的方法略有修改。将1.3.5节中的制备的复原乳装入样品池中,采用近红外光作为光源,光源与透射光检测器和背散射光检测器组成测量探头,探头从样品池的底部到样品池的顶部每40 μm测量1次,完成样品池从底部到顶部的测量称为1次扫描。具体设置参数为25 ℃,3 000 r/min,2 h。
1.3.7 苦味肽双乳微胶囊氧化稳定性
微胶囊固体粉末的氧化稳定性用初级氧化反应衡量,测定贮藏过程中过氧化值(peroxide value,POV)的变化。将样品放置在40 ℃的环境下贮存加速氧化90 d,每隔30 d测定1次。具体测定方法参照MELGOSA等[17]的实验方法并略有修改。准确称取5.0 g固体粉末于5 mL蒸馏水中,搅拌均匀直至完全溶解,制备得粗乳液。取0.3 g乳液于小离心管中,加入15 mL异辛烷和异丙醇的混合物[V(异辛烷)∶V(异丙醇)=3∶1],充分振荡(10 s,3次),然后进行离心(5 000 r/min,2 min),取有机层(上清液)200 μL,加入到2.8 mL 2∶1(体积比)混合的甲醇和丁醇混合物中,然后再分别加入15 μL 3.94 mol/L的NH4SCN和15 μL Fe2+溶液(0.132 mol/L BaCl2溶液和0.144 mol/L FeSO4溶液以1∶1的比例混合,过0.22 μm滤膜),反应20 min后,于510 nm波长下测定吸光度值,通过异丙苯氢过氧化物标准曲线计算样品中过氧化物浓度。
1.3.8 苦味掩蔽效果评价
双重乳液微胶囊样品苦味强度的测定参考ISO 8589—2007《感官分析.试验室设计的一般指南》,以验证其苦味掩蔽效果。从实验室招募11名具有感官分析方法系统研究经验的评估员(年龄在21~29岁)组成小组进行苦味评价。制备不同浓度的苦味肽溶液作为苦味标准品,将纯水、2.5%苦味肽溶液、5%苦味肽溶的苦味强度分别指定为0、5、10分,随后以标准品苦味肽含量相同的复原乳作为对照样品进行评分。训练评价成员对标准品进行打分以使得评价成员经培训后均能分辨出不同苦味强度的样品且评价标准相对一致。所有测试均在受试者参与研究之前知情且自愿同意的前提下开展,尊重并确保了每个参与者的权利和隐私。感官分析实验在室温下、日光下和单独的感官测试室中进行,感官评价成员每次感官评价前先用蒸馏水漱口,将5 mL评价样品含在口腔中15 s,充分感受苦味,吐掉后用蒸馏水漱口并对样品苦味程度进行打分。2个样品评价之间用蒸馏水漱口并间隔5 min休息时间,以保持口腔清洁减少样品之间的影响。
1.4 数据结果与分析
每个实验重复3次,采用SPSS 26.0对数据进行统计学分析,结果表示为平均值±标准偏差,不同字母表示指标之间的显著差异性(P<0.05),采用Origin 9.0作图。
2 结果与分析
2.1 苦味肽双乳微胶囊的微观形态
图1展示了苦味肽双重乳液微胶囊在SEM下的微观形貌。可以看到所制备的微胶囊呈现出大小均匀的球形结构,表面较为光滑平整。在图1-c高放大倍数下观察到微胶囊油滴表面无破裂、无明显裂缝,这说明苦味肽被有效封装在微胶囊内部。微胶囊的形态完整性通常与制备过程中的进出风温度、进样速度等制备条件有关。说明本实验选择的制备条件可以制备出具有较为完整形态结构的微胶囊粉末。有研究表明,壁材材料会影响颗粒表面的光滑性和平整度[18],本实验选用麦芽糊精、糖浆、低聚果糖和明胶按一定合适比例组合作为壁材能够形成光滑平整的微胶囊颗粒。

a-100×;b-200×;c-500×
图1 双重乳液微胶囊的微观结构
Fig.1 Microstructure of double emulsion microcapsules
2.2 苦味肽双乳微胶囊的孔隙率与比表面积
苦味肽双重乳液微胶囊孔的尺寸主要分布在10~50 nm,平均孔径大小为(21.121±0.001 2) nm,比表面积为(0.155±0.002 3) m2/g,孔体积为(0.002±0.000 6) cm3/g。微胶囊固体粉末具有较为光滑平整的表面,且其单位质量的样品凹陷现象较少出现,泄漏风险低[19]。说明该结构是优良的苦味肽包封载体。这一结果与SEM观察结果一致。
2.3 苦味肽双乳微胶囊的物理性质
水分含量通过干燥法实验计算得到为3.67%±0.15%,符合QB/T 4791—2015 《植脂末》行业执行标准要求中水分含量≤ 5.0%的要求;苦味肽双乳微胶囊粉末的溶解度为(93.65±0.95)%,说明微胶囊固体粉末基本都可以溶于水中,复水性优异;微胶囊的润湿时间经测定为(185±0.07) s,即可形成均一的复原乳。植脂末执行标准中规定微胶囊固体粉末中总油脂含量应≥3.0%;且表面油脂含量占脂肪的比例 ≤ 5%。经过测定得本实验制备的固体粉末总油脂含量为(22.7±0.26)%;表面油含量为(0.8±0.06)%,约占脂肪含量的3.5%,符合相关标准的规定。上述基本性质数据表明采用双重乳液微胶囊包封的苦味肽具有良好的固体粉末物理性质。
2.4 微胶囊复原乳的表征
微胶囊复原乳的性质测定用于反映微胶囊溶于水后的结构完整性,从而确保苦味肽的苦味掩蔽效果。图2 是微胶囊粉末与蒸馏水按质量比1∶1溶解得到复原乳在光学显微镜下的视野。观察可得,视野内分布着许多大小液滴,大液滴中包含有许多均匀的小液滴,说明复原乳依旧具有双重乳液的典型特征[20]。同时图2也表明喷雾干燥微囊化技术并没有破坏原乳液的双重结构,内水相中的苦味肽被完整地包裹在大液滴内部的小液滴当中。苦味肽双重乳液微胶囊复原乳的粒径如图3所示,复原乳粒径呈现出单峰分布,液滴尺寸主要分布在10.5~19.5 μm,其D3,2平均值为(16.8±0.53) μm,这也与图2观察到的液滴尺寸相符。URSICA等[21]的研究发现壁材种类可以影响喷雾干燥复原乳的粒径大小。实验结果也表明麦芽糊精、糖浆、低聚果糖和明胶按一定合适比例组合作为壁材可以形成复原乳液滴尺寸均匀的微胶囊粉末。
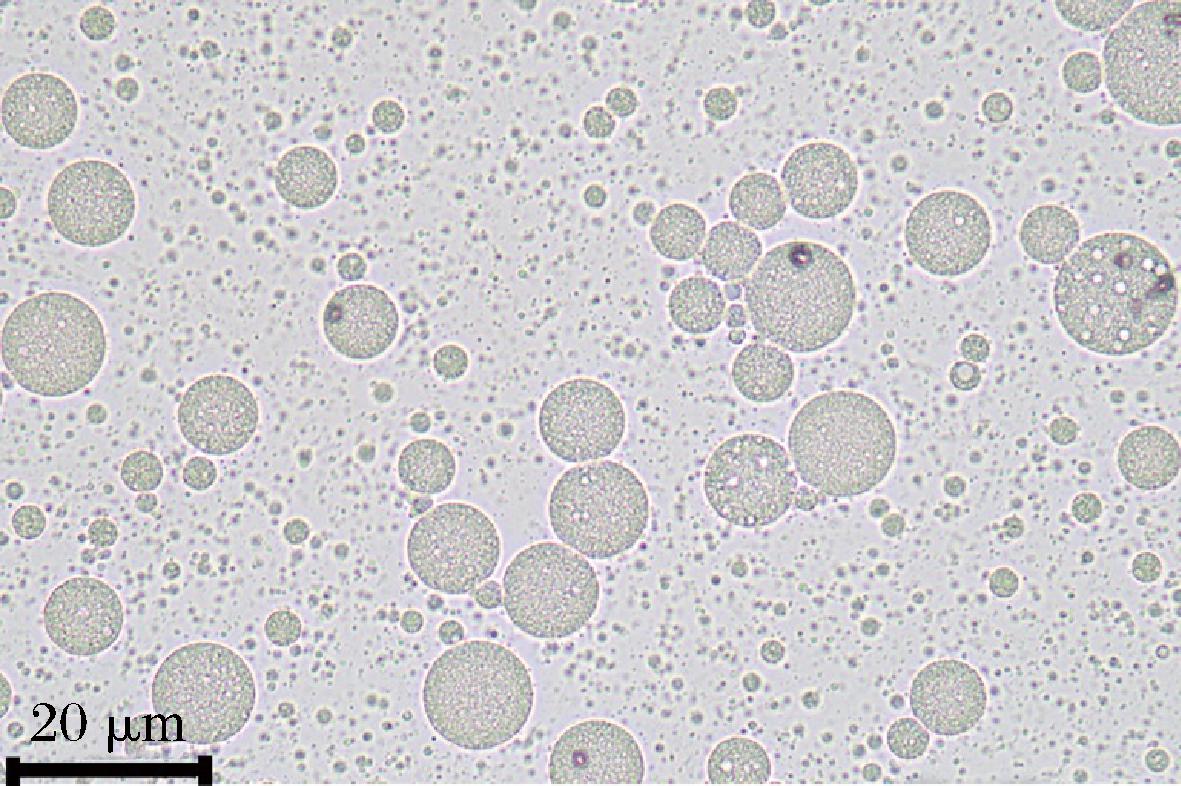
图2 复原乳的微观结构
Fig.2 Microstructure of reconstituted emulsion
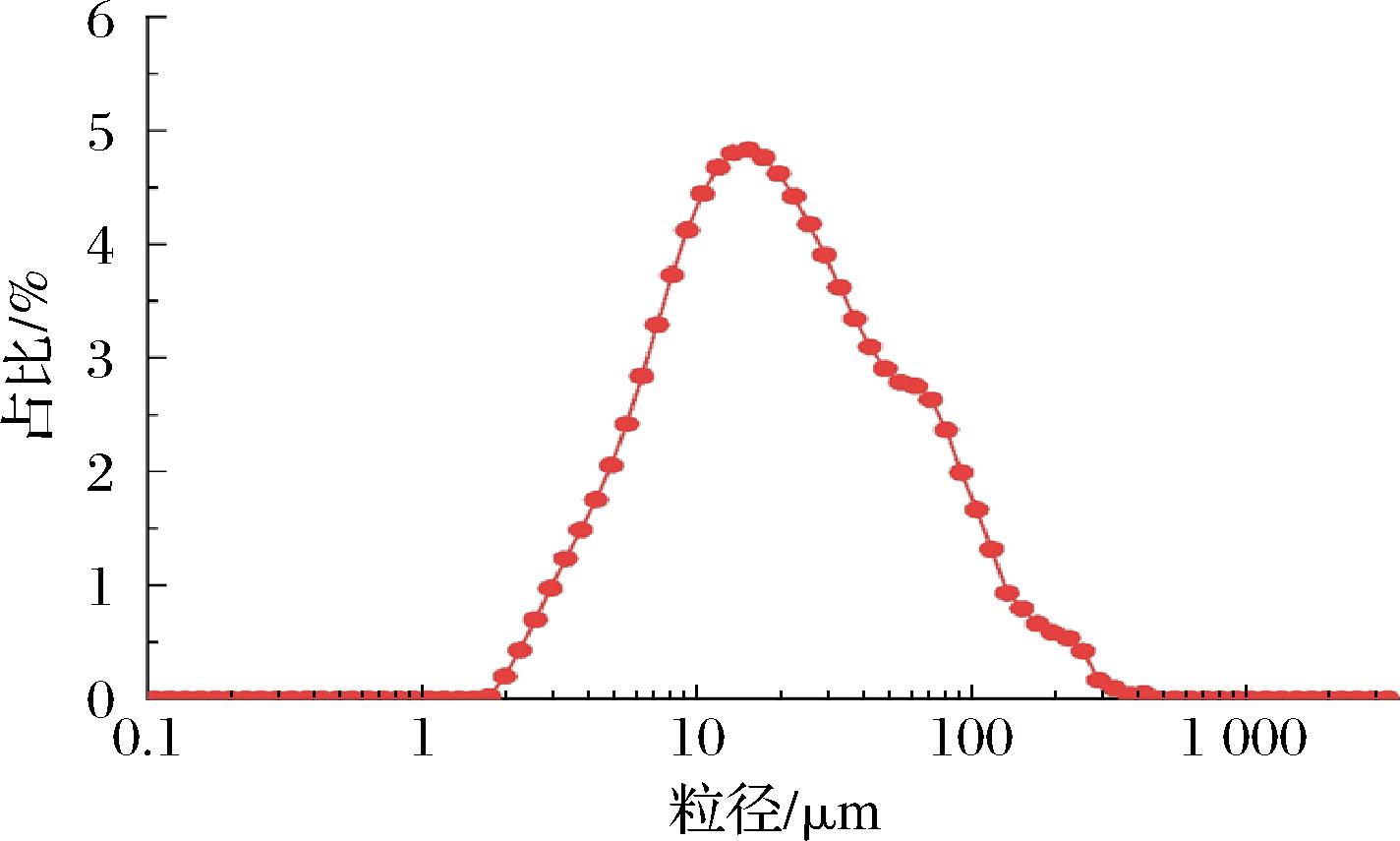
图3 复原乳的粒径分布
Fig.3 Particle size distribution of reconstituted emulsion
2.5 微胶囊复原乳的物理稳定性
微胶囊复原乳的物理稳定性可用以评价该体系的苦味肽包埋效果[22],以免其在应用场景中泄漏并感受到苦味。苦味肽双重乳液微胶囊复原乳的物理稳定性通过LUMiSizer稳定性分析仪对其进行测定,测试条件为温度25 ℃,转速3 000 r/min,测试时间2 h。通过对3批次相同制备工艺条件下的苦味肽双重乳液微胶囊进行取样与复原乳配制,分别测得不稳定指数为0.117、0.084和0.095。结果证实该不稳定指数数值较低,均值为0.099±0.017,且批次间差异不大,工艺条件及配方较为稳定。通过图4复原乳离心过程中的透射率与样品高度变化的指纹图谱可知,复原乳液滴在测定后期发生了迁移。离心结束的透光曲线并不是水平的,这也表示复原乳中的油相与水相未出现完全分离现象,说明复原乳仍具有较高的离心稳定性,复原乳中的苦味肽不易泄漏,苦味掩蔽效果好。
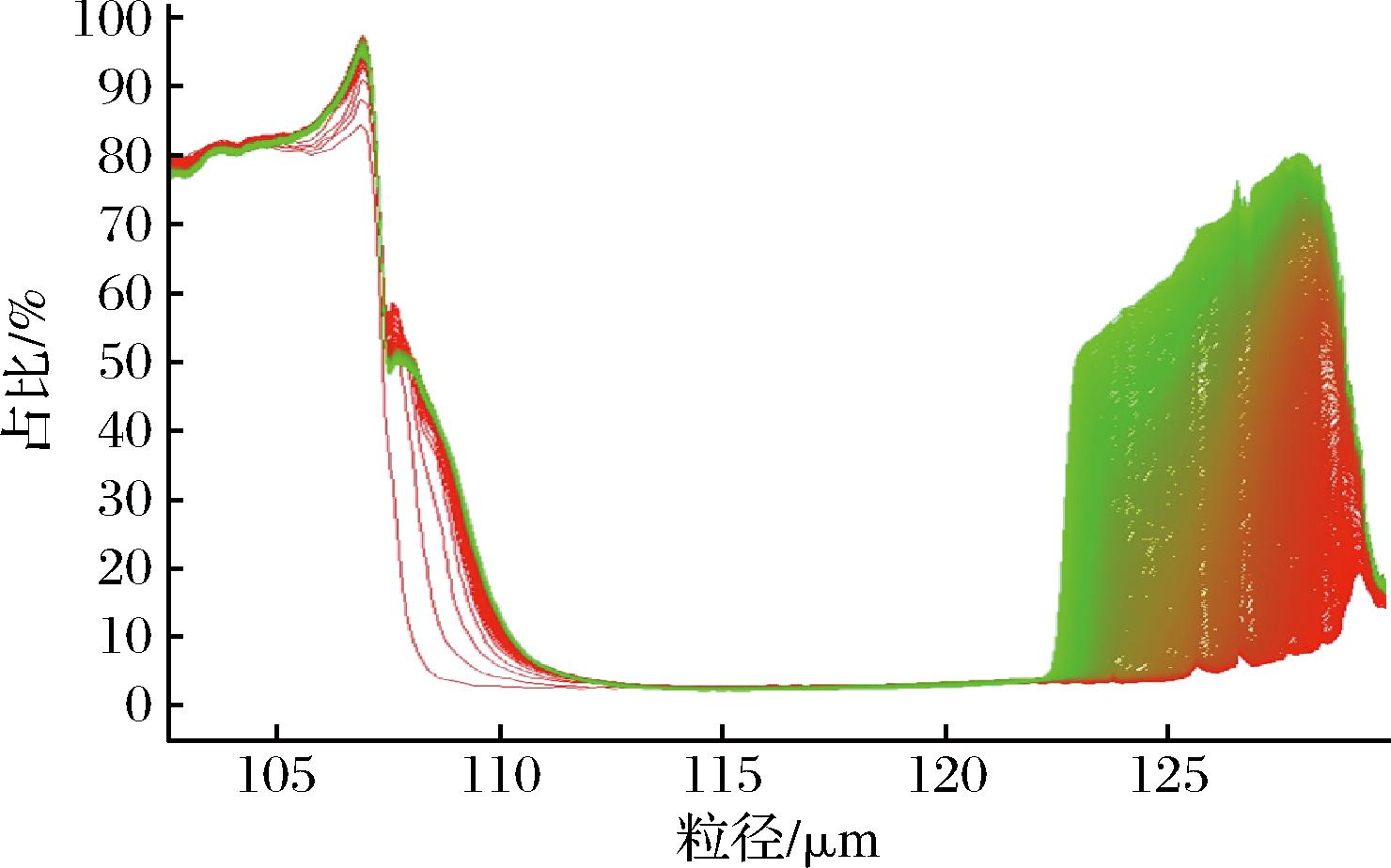
图4 复原乳样品透射率与样品高度分布图
Fig.4 The transmittance and sample height distribution of reconstituted emulsion samples
2.6 苦味肽双乳微胶囊的氧化稳定性
微胶囊中含有脂质,可能会在贮藏期间受到温度、水分、氧气等氧化变质,从而影响微胶囊货架期质量,并产生不良风味,降低感官体验[23]。图5反映了微胶囊贮藏期间氧化初级产物POV的变化趋势。贮藏期间,每隔30 d对苦味肽双重乳液微胶囊中的脂质氧化进行测定,其POV整体呈现逐渐增加的趋势,说明在贮藏期间微胶囊粉末中的脂质发生了氧化反应,脂质开始氧化产生过氧化物。前30 d增长趋势较为缓慢,数据浮动不大,增长速率为0.001 3;30~60 d增长幅度加大,增长速率为0.012;60~90 d增长速率0.014;90 d加速贮藏后,POV为0.085 g/100 g,远低于QB/T 4791—2015 《植脂末》中POV的要求0.25 g/100 g, 符合理化指标的标准要求。该指标说明用双重乳液微胶囊包封苦味肽具有良好的氧化稳定性。
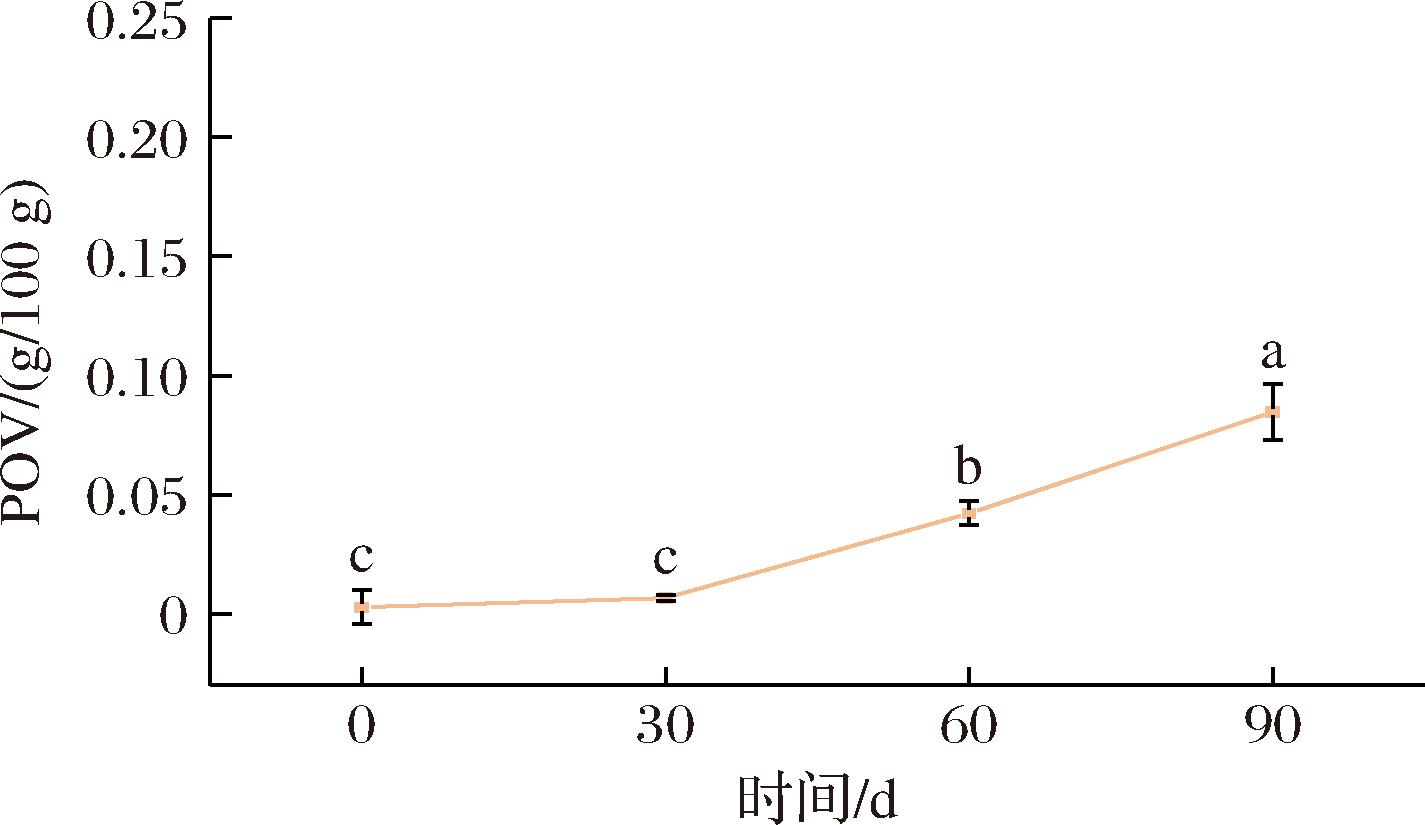
图5 双重乳液微胶囊的氧化稳定性
Fig.5 Oxidation stability of double emulsion microcapsules
2.7 苦味掩蔽效果感官评价
食物的感官风味会影响消费者的接受度。苦味是一种公认会令人产生不快体验的风味,食物中的苦味会影响消费者对食物的选择[24]。通过统计11名感官评价小组成员重复3次评价的数据,得到图6的感官评价结果。苦味肽水溶液的苦味强度随肽浓度的增加而增加。相比之下,含有不同肽浓度的微胶囊复原乳的感知苦味强度很低,苦味强度评分差异小。即使在最高肽浓度(5%)下,也只有轻微的苦味,这可能来自复原乳在口腔中受到的唾液作用导致一小部分肽的泄漏。苦味肽水溶液样品与微胶囊复原乳样品之间存在一定的苦味强度差异,其中含量为5%苦味肽组的得分差异最大,苦味强度评分降低(86.8±1.17)%。说明微胶囊复原乳样品对苦味具有更好的掩盖效果,相比苦味肽水溶液接受程度更高。
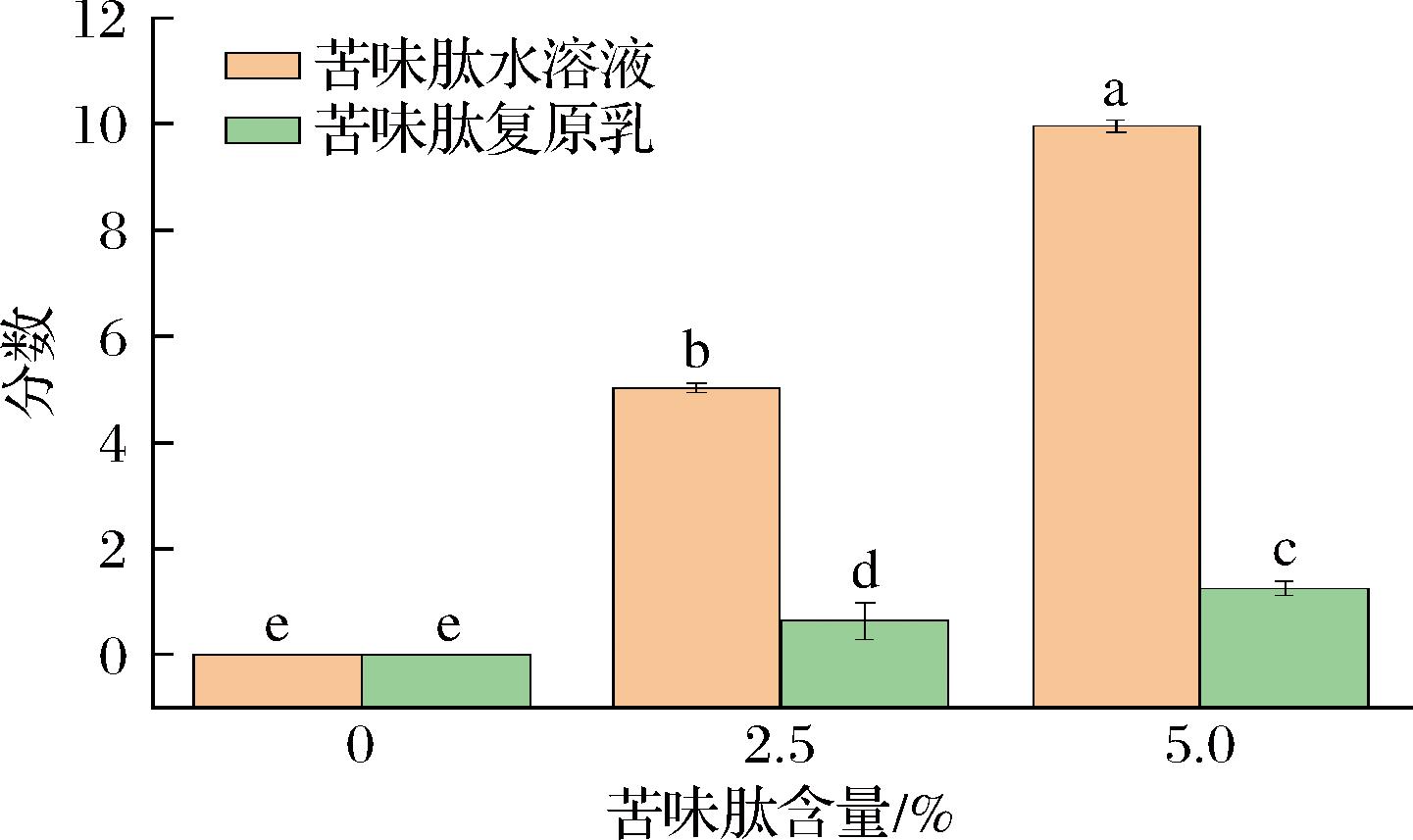
图6 感官评价小组苦味强度评分
Fig.6 Sensory evaluation group bitterness intensity score
注:不同小写字母代表差异显著,P<0.05。
3 结论
本研究成功地将苦味肽封装在双重乳液微胶囊体系中,达到了掩蔽苦味的效果。在扫描电镜下,双重乳液微胶囊粉末表面光滑平整,呈现出大小均匀的球形结构。其孔隙率及比表面积数值小,基本性质的测定结果均符合食品固体微胶囊粉末的物理性质指标。微胶囊具有较好的水复溶性,微胶囊复原乳保留了双重乳液的结构,具有良好的物理稳定性。感官评价结果也证实双重乳液微胶囊化可以对苦味肽自身的不良风味起到良好的掩蔽作用。上述相关研究结论可为苦味肽作为营养强化剂以及其在多功能食品和特殊膳食开发提供指导,为满足人们的营养健康需求提供途径。
[1] AKBARBAGLU Z, TAMJIDI F, SARABANDI K, et al.Physicochemical characteristics and antioxidant stability of spray-dried soy peptide fractions[J].Food Science &Nutrition, 2023, 11(7):3949-3958.
[2] ALIM A, SONG H L, YANG C, et al.Changes in the perception of bitter constituents in thermally treated yeast extract[J].Journal of the Science of Food and Agriculture, 2019, 99(10):4651-4658.
[3] BERTELSEN A S, LAURSEN A, KNUDSEN T A, et al.Bitter taste masking of enzyme-treated soy protein in water and bread[J].Journal of the Science of Food and Agriculture, 2018, 98(10):3860-3869.
[4] 贾聪, 孟醒, 游静, 等.低苦味芝麻ACE抑制肽的制备及氨基酸组成和结构分析[J].食品与发酵工业, 2021, 47(17):172-178.JIA C, MENG X, YOU J, et al.Preparation, amino acid composition and structure analysis of low bitterness sesame ACE inhibitory peptides[J].Food and Fermentation Industries, 2021, 47(17):172-178.
[5] LIU J B, LIU M Y, HE C C, et al.Effect of thermal treatment on the flavor generation from Maillard reaction of xylose and chicken peptide[J].LWT - Food Science and Technology, 2015, 64(1):316-325.
[6] MIRZAPOUR-KOUHDASHT A, MCCLEMENTS D J, TAGHIZADEH M S, et al.Strategies for oral delivery of bioactive peptides with focus on debittering and masking[J].NPJ Science of Food, 2023, 7(1):22.
[7] ENSIGN L M, CONE R, HANES J.Oral drug delivery with polymeric nanoparticles:The gastrointestinal mucus barriers[J].Advanced Drug Delivery Reviews, 2012, 64(6):557-570.
[8] MCCLEMENTS D J.Encapsulation, protection, and release of hydrophilic active components:Potential and limitations of colloidal delivery systems[J].Advances in Colloid and Interface Science, 2015, 219:27-53.
[9] XIA T H, XUE C H, WEI Z H.Physicochemical characteristics, applications and research trends of edible Pickering emulsions[J].Trends in Food Science &Technology, 2021, 107:1-15.
[10] 龙海涛, 毕阳, 张慧秀, 等.冷冻干燥制备番茄红素微胶囊及其缓释性能研究[J].食品与发酵工业, 2016, 42(12):125-131.LONG H T, BI Y, ZHANG H X, et al.Microcapsulation of lycopene by freeze-drying method and its slow-release performance[J].Food and Fermentation Industries, 2016, 42(12):125-131.
[11] CHOI S J, DECKER E A, MCCLEMENTS D J.Impact of iron encapsulation within the interior aqueous phase of water-in-oil-in-water emulsions on lipid oxidation[J].Food Chemistry, 2009, 116(1):271-276.
[12] 蒲晓璐. w/o/w双乳结构调控及在益生菌递送中的应用进展[J].食品与发酵工业, 2023, 49(11):280-287.PU X L.A review in the structure manipulation of w/o/w double emulsions and applications in probiotics delivery[J].Food and Fermentation Industries, 2023, 49(11):280-287.
[13] DESAI K G H, JIN PARK H.Recent developments in microencapsulation of food ingredients[J].Drying Technology, 2005, 23(7):1361-1394.
[14] 胡丽萍, 李辉玉, 林嘉欣, 等.基于喷雾干燥法益生菌-槲皮素的共微囊化及其耐消化性研究 [J/OL].食品与发酵工业, 2023.DOI:10.13995/j.cnki.11-1802/ts.036942.HU L P, LI H Y, LIN J X, et al.Co-microencapsulation of probiotic-quercetin based on spray-drying and its digestibility resistance study[J/OL].Food and Fermentation Industries, 2023.DOI:10.13995/j.cnki.11-1802/ts.036942.
[15] ZHU Y Q, CHEN X, MCCLEMENTS D J, et al.pH-, ion- and temperature-dependent emulsion gels:Fabricated by addition of whey protein to gliadin-nanoparticle coated lipid droplets[J].Food Hydrocolloids, 2018, 77:870-878.
[16] LI X, WANG X, XU D X, et al.Influence of calcium-induced droplet heteroaggregation on the physicochemical properties of oppositely charged lactoferrin coated lutein droplets and whey protein isolate-coated DHA droplets[J].Food &Function, 2017, 8(8):2748-2759.
[17] MELGOSA R, BENITO-ROM N
N  , SANZ M T, et al.Omega-3 encapsulation by PGSS-drying and conventional drying methods.Particle characterization and oxidative stability[J].Food Chemistry, 2019, 270:138-148.
, SANZ M T, et al.Omega-3 encapsulation by PGSS-drying and conventional drying methods.Particle characterization and oxidative stability[J].Food Chemistry, 2019, 270:138-148.
[18] SHEU T Y, ROSENBERG M.Microstructure of microcapsules consisting of whey proteins and carbohydrates[J].Journal of Food Science, 1998, 63(3):491-494.
[19] LOCALI PEREIRA A R, GONÇALVES CATTELAN M, NICOLETTI V R.Microencapsulation of pink pepper essential oil:Properties of spray-dried pectin/SPI double-layer versus SPI single-layer stabilized emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2019, 581:123806.
[20] GAO Y, LI X Q, XIE Y F, et al.Encapsulation of bitter peptides in diphasic gel double emulsions:Bitterness masking, sustained release and digestion stability[J].Food Research International, 2022, 162:112205.
[21] URSICA L, TITA D, PALICI I, et al.Particle size analysis of some water/oil/water multiple emulsions[J].Journal of Pharmaceutical and Biomedical Analysis, 2005, 37(5):931-936.
[22] DAMMAK I, DO AMARAL SOBRAL P J.Effect of different biopolymers on the stability of hesperidin-encapsulating O/W emulsions[J].Journal of Food Engineering, 2018, 237:33-43.
[23] TAN C, WANG J, SUN B G.Biopolymer-liposome hybrid systems for controlled delivery of bioactive compounds:Recent advances[J].Biotechnology Advances, 2021, 48:107727.
[24] LU H, WANG J, HUANG M G, et al.Bitterness-masking assessment of luteolin encapsulated in whey protein isolate-coated liposomes[J].Food &Function, 2023, 14(7):3230-3241.