新橙皮苷二氢查尔酮(neohesperidin dihydrochalcone, NHDC)是一种半天然的非营养型甜味剂,分子式为C28H36O15,化学性质稳定,无气味,白色粉末状固体,微溶于水,易溶于甲醇等有机溶剂。结构上,NHDC属于二氢查尔酮类化合物,具有多种生物活性,包括降血糖作用、抗炎及抗氧化、神经保护活性、肝保护作用等[1-3]。作为高效甜味剂,NHDC的甜度约为蔗糖的1 500~1 800倍,口感佳,几乎无热量,无致龋性,具有屏蔽苦味、降低辛辣味的作用;现有研究表明NHDC安全性高、无毒副作用[4];因此NHDC的应用十分广泛,除被添加于非酒精饮料、果酱、甜点面包和糖果等食品中外,也在动物饲料、医学药物中应用[5]。
NHDC的来源有植物提取、微生物酶转化、化学合成等。苦塞维利亚橙(Citrus aurantium L)等天然植物中的NHDC含量极低,提取不易[6],且成本较高。生物酶法以橙皮苷为原料,利用葡萄糖基转移酶、鼠李糖基转移酶的生物酶活性作用,将橙皮苷的水解产物转化为新橙皮苷[7],目前多由实验室小规模的重组蛋白质工程获取鼠李糖基转移酶Cm1, 2RhaT,该酶获取难度较大且未能量产,因此生产受限。NHDC最初由HOROWITZ和GENTILI通过化学方法合成[8-9]。化学合成法是以柚皮苷经碱性水解得到根皮乙酰苯-4′-新橙皮苷(phloroacetophenone-4′-neohesperidoside, PN),常用NaOH、KOH催化水解反应,HOROWITZ等[8]采用KOH水溶液提供碱性环境,但产率较低。PN与异香草醛通过羟基与醛基的缩合反应制备新橙皮苷。最后新橙皮苷在碱液中催化氢化合成NHDC,Pd/C为常用的加氢催化剂,但价格昂贵。NHDC化学合成通常直接以新橙皮苷为原料,一步法经碱液开环、Pd/C催化加氢得到,成本高。目前的研究中,柚皮苷合成PN收率为77.58%,PN制备新橙皮苷的收率为92.48%,Pd/C催化氢化合成NHDC的收率为93.92%,三步总收率67.38%[10]。总体看来产率仍有提升空间。
肥胖问题逐步成为全球关注的健康问题,全球的肥胖人数不断增加,无糖食品、无糖饮料越来越受欢迎,非营养型甜味剂替代营养型甜味剂渐渐成为一种趋势。NHDC由于其高倍甜度、无热量、安全等特点,具有很高的商业价值。胰脂肪酶(pancreatic lipase,PL)是人体内脂质吸收起关键作用的酶[11],胰脂肪酶抑制剂可以降低PL活性从而起到减少脂质吸收、治疗肥胖的作用。目前市场上的减肥药物奥利司他存在较多副作用,天然、低毒的胰脂肪酶抑制剂越来越受关注。因此,本研究以降低成本、提升产率为目标,以柚皮苷为原料进一步对NHDC合成工艺、反应条件进行改进。并通过体外胰脂肪酶抑制实验、荧光猝灭实验综合评估NHDC在调控脂质代谢方面的活性及作用类型,为其在减肥、降脂产品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
柚皮苷(≥98%)、NaOH、KOH、异香草醛(≥98%)、吡咯烷、雷尼镍、Pd/C(Pd质量分数为10%)、4-硝基苯丁酸酯(4-nitrophenyl butyrate,p-NPB)、对硝基苯酚(p-nitrophenol,PNP)、二甲基亚砜(dimethyl sulfoxide,DMSO)、三羟甲基氨基甲烷[Tris (hydroxymethyl) aminomethane,Tris]、磷酸盐缓冲液(phosphate buffer solution,PBS),上海麦克林生化科技有限公司;乙酸、浓盐酸,成都市科隆化学品有限公司;氘代甲醇、氘代DMSO,安诺论生物科技有限公司;无水甲醇、无水乙醇、二氯甲烷、乙酸乙酯、蒸馏水、NaCl、无水CaCl2,广州市光华科技股份有限公司;PL,上海阿拉丁生化科技股份有限公司。其余试剂为市售分析纯。
1.1.2 仪器与设备
AVANCE Ⅲ型核磁共振波仪,瑞士布鲁克公司;X500R Q/TOF型高分辨质谱,上海爱博才思分析仪器贸易有限公司;LC-40D高效液相色谱仪,日本岛津公司;DHP-200恒温培养箱,金坛市万华实验仪器厂;高速离心机,Thermo Fisher科技(中国)有限公司;Infinite M200Pro多功能酶标仪,瑞士Tecan公司;荧光分光光度计,安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 合成路线
NHDC的总合成路线见图1。柚皮苷的黄酮母核B环在热的NaOH溶液中水解,开环形成2′-羟基查尔酮,加热会导致查尔酮α位的C—C键进一步断裂,得到分解产物PN;纯化后的PN进一步与异香草醛在催化剂吡咯烷与乙酸的共同作用下发生Claisen-Schmidt缩合反应,合成中间产物新橙皮苷;新橙皮苷在NaOH溶液中开环形成新橙皮苷查尔酮,在催化剂的作用下发生加氢反应,最终得到氢化产物NHDC。
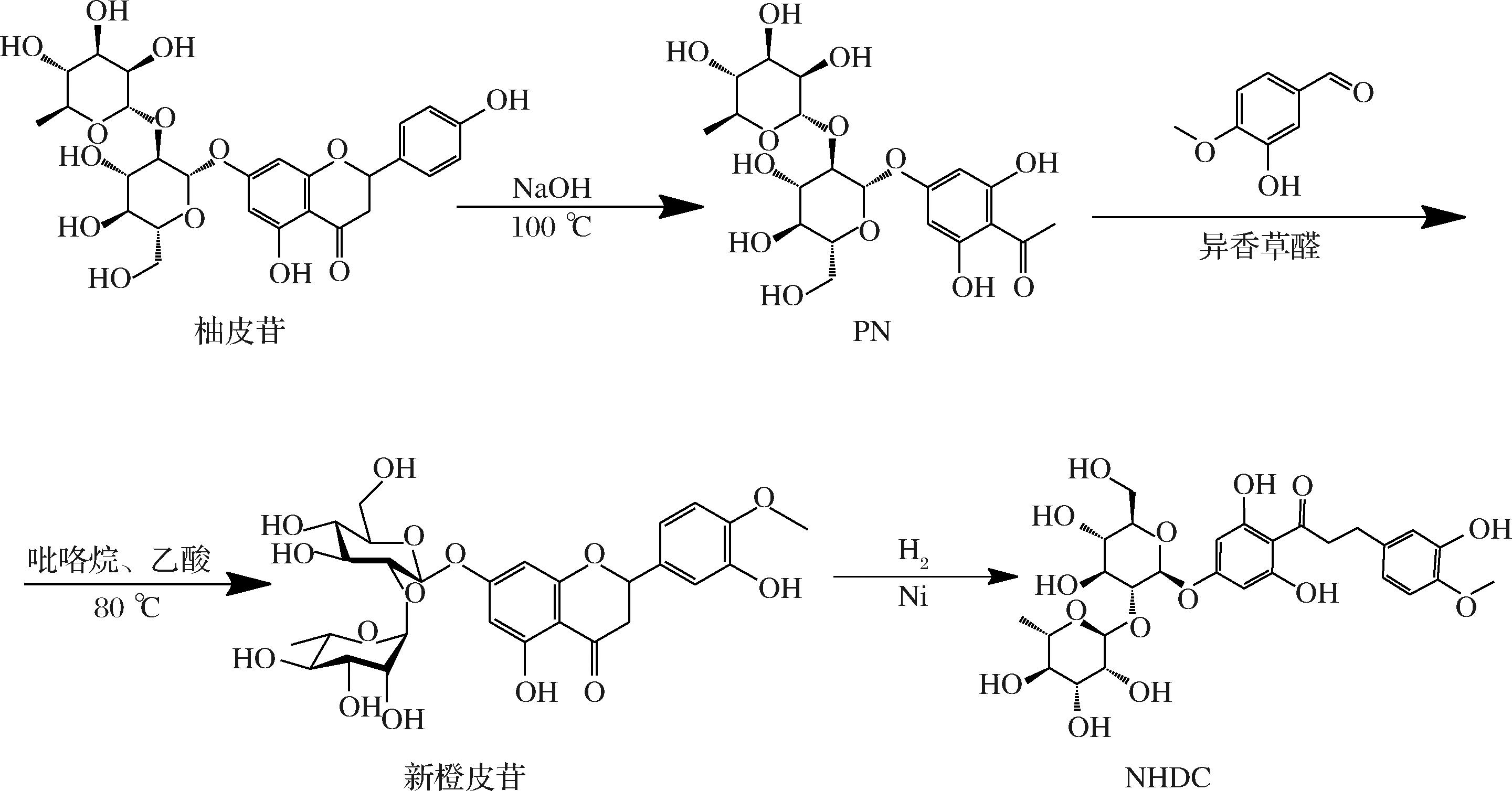
图1 新橙皮苷二氢查尔酮的合成路线
Fig.1 Synthesis route of neohesperidin dihydrochalcone
1.2.2 合成方法
1.2.2.1 PN的合成
室温下,向250 mL圆底烧瓶中加入蒸馏水(12 mL)、NaOH(1.7 g),充分溶解并加热至100 ℃,再投入柚皮苷(1.0 g, 1.72 mmol),磁力搅拌溶解,开始反应,回流反应2 h。薄层层析监测反应进程[thin-layer chromatography(TLC):V二氯甲烷∶V乙酸乙酯=3∶1],反应结束后用浓盐酸中和反应液(pH 6.0),4 ℃冰箱中静置2 h等待PN固体析出。产物用砂芯漏斗抽滤,烘箱干燥(50 ℃),76 ℃蒸馏水重结晶,得到白色固体产物PN(0.662 g, 1.39 mmol),产率为80.7%。
1.2.2.2 新橙皮苷的合成
在250 mL圆底烧瓶中加入PN(10.0 g, 0.021 mol)与异香草醛(3.194 g, 0.021 mol),无水乙醇(100 mL)作溶剂,搅拌溶解,N2保护,使用注射器向反应瓶中加入吡咯烷(3.45 mL, 0.042 mol)及乙酸(1.21 mL, 0.021 mol),加热至80 ℃冷凝回流,反应10 h,冷却至室温,白色固体产物析出,抽滤,用少量无水乙醇冲洗,干燥后得到白色略带微黄色固体产物新橙皮苷(11.224 g, 0.018 4 mol),收率为87.5%。
1.2.2.3 NHDC的合成
向500 mL圆底烧瓶中加入150 mL NaOH溶液(质量分数7%),新橙皮苷(10 g, 0.016 4 mol)。N2保护,加入2 g雷尼镍,通入H2置换N2,室温下反应8~10 h,TLC监测。反应结束后用浓盐酸调节反应液的pH值为5~6,于4 ℃冰箱静置2 d以上,待固体析出后,抽滤、干燥产物,用79 ℃的蒸馏水重结晶,干燥后得到纯白色固体NHDC(10.046 g, 0.016 4 mol),产率为100.0%。
1.2.3 NHDC对胰脂肪酶的抑制作用
1.2.3.1 NHDC对PL的抑制率
根据文献中的方法[12-13]并加以修改。PL溶液(0.5 mg/mL):将PL溶解在PBS中,高速离心(8 000 r/min,10 min)取上清液。Tris-HCl缓冲液(100 mmol/L):3.027 5 g Tris,0.731 g NaCl,0.555 g CaCl2,蒸馏水溶解、定容(250 mL),浓盐酸调节pH值为8,高压灭菌后使用。p-NPB底物溶液(10 mmol/L):现用现配,p-NPB用DMSO(体积分数5%)初溶,补充Tris-HCl缓冲液,定容。NHDC样品液配制:称取NHDC固体用DMSO(体积分数5%)初溶,补加Tris-HCl缓冲液配成不同浓度的NHDC溶液。
将PL溶液添加到96孔板中(50 μL/孔),再加入不同浓度的NHDC溶液(20 μL/孔)。在37 ℃恒温培养箱中预孵育15 min。每孔加入100 μL的p-NPB底物溶液,空白对照组用Tris-HCl缓冲溶液替代(20 μL/孔)。酶促反应条件为37 ℃、15 min。反应结束后用酶标仪测定405 nm处的吸光度(OD)。抑制率按公式(1)计算:
抑制率![]()
(1)
式中:A,无抑制剂的酶与底物混合溶液的OD值;C,无抑制剂的阴性对照,即不含PL与NHDC的p-NPB底物溶液的OD值;B,含抑制剂的酶与底物混合溶液的OD值;D,含抑制剂的阴性对照,即无PL但有NHDC的p-NPB底物溶液的OD值。
1.2.3.2 NHDC对PL的抑制类型
可逆性研究:向96孔板中加入60 μL的PL溶液(0、0.5、1.0、1.5、2.0、2.5 mg/mL)与30 μL的NHDC溶液(0、1.0、2.0、4.0 mg/mL),混匀,37 ℃预孵育15 min。加入80 μL p-NPB(3 mmol/L)启动反应。用酶标仪测定每分钟增加的OD值,测定条件:波长405 nm,温度37 ℃。反应速率通过每分钟内PNP的生成量(μmol/L)表示。实验中,PNP的标准曲线方程为Y=0.022 3X-0.005 4,R2=0.999 9,Y为OD值,X为PNP的浓度。
双倒数Lineweaver-Burk曲线绘制:在96孔板中将PL溶液(60 μL),分别与30 μL不同浓度NHDC溶液(0、1.0、2.0、4.0 mg/mL)混合,37 ℃预孵育15 min,加入80 μL不同浓度的p-NPB底物溶液(1、2、3、4、5 mmol/L)启动反应,酶促反应15 min,使用酶标仪测定OD值,测定方法和条件同上。以反应速率的倒数为纵坐标,以底物浓度的倒数为横坐标,绘制双倒数Lineweaver-Burk图,并计算米氏常数(Km)、最大速度(Vmax),据此判断抑制模式。抑制常数(Ki)由动力学方程计算。
1.2.3.3 荧光猝灭实验
根据文献[14-15]报道的方法,将2.8 mL的PL酶溶液(0.5 mg/mL)和700 μL的NHDC溶液(0.05、0.10、0.20、0.30、0.40、0.50、0.60 mmol/L)混匀,分别在20 ℃和37 ℃下反应20 min,反应结束后测定荧光发射光谱,测定条件:激发波长280 nm、波长范围300~450 nm,激发和发射狭缝宽设为5 nm,根据F0/F-Q函数关系,利用荧光的最大强度绘制得到Stern-Volmer图。F0和F分别是未加入NHDC、加入NHDC后PL酶的荧光强度。[Q]为NHDC浓度。
1.2.4 数据处理
采用Chemdraw 20.0绘制化合物结构,通过MestReNova对化合物的NMR图谱进行解析,每组实验重复3次,结果以平均值±标准差表示,使用Microsoft Excel 2016处理数据、Origin 2018进行差异显著性检验及绘图。
2 结果与分析
2.1 PN的结构表征与合成条件优化
产物PN的HPLC纯度为99.75%。1H NMR (600 MHz, Methanol-d4),δ:6.05 (s, 2H), 5.26 (d, J=1.7 Hz, 1H), 5.03 (d, J=7.6 Hz, 1H), 3.95~3.86 (m, 3H), 3.70 (dd, J=12.1, 5.4 Hz, 1H), 3.65~3.57 (m, 3H), 3.43 (s, 1H), 3.42~3.37 (m, 2H), 2.63 (s, 3H), 1.31 (d, J=6.2 Hz, 3H)。13C NMR (151 MHz, DMSO-d6) δ 203.43, 163.91, 163.11, 105.57, 100.66, 97.11, 94.69, 77.19, 76.87, 76.64, 71.88, 70.55, 70.44, 69.47, 68.37, 60.32, 32.70, 18.18。ESI-MS,m/z:C20H28O13[M-H]-,理论值476.426 0,实测值476.145 7。
柚皮苷合成PN的关键在于黄酮母核开环,NaOH的用量是重要影响因素。NaOH浓度越高,水解程度越大,低浓度的NaOH无法使查尔酮α位的C—C键断裂从而形成PN,而过高浓度的NaOH则会进一步破坏黄酮母核结构,使PN产量不升反降。此外,NaOH的用量越多,中和所需的盐酸消耗量越大,成本上升。从产率、经济性、工业化需求考虑,固定柚皮苷投料不变,合成方法同上所述,探究其最佳反应条件,结果如表1所示。最佳条件下PN收率为80.7%,高于文献[10]报道的77.58%。
表1 NaOH用量对化合物PN产率的影响
Table 1 Effect of sodium hydroxide dosage on the yield of compound PN

指标NaOH/g1.41.51.61.71.81.9PN的产率/%30.844.962.680.773.867.6
2.2 新橙皮苷的结构表征与合成条件优化
产物的HPLC纯度为99.04%。1H NMR (600 MHz, DMSO-d6) δ 12.04 (d, J=7.8 Hz, 1H), 9.12 (d, J=3.8 Hz, 1H), 6.94 (s, 2H), 6.89 (s, 1H), 6.10 (d, J=13.8 Hz, 2H), 5.50 (s, 1H), 5.30 (s, 1H), 5.12 (d, J=9.6 Hz, 3H), 4.72 (s, 1H), 4.66 (s, 1H), 4.58 (s, 1H), 4.47 (d, J=5.8 Hz, 1H), 3.78 (s, 3H), 3.67 (s, 3H), 3.44 (d, J=11.8 Hz, 4H), 3.28 (d, J=41.7 Hz, 2H), 3.20 (d, J=4.7 Hz, 2H), 2.78 (s, 1H), 1.16 (s, 3H)。13C NMR (151 MHz, DMSO-d6) δ 197.04, 164.86, 162.93, 162.60, 147.99, 146.50, 130.91, 117.82, 114.13, 112.02, 103.34, 100.39, 97.41, 96.27, 95.18, 78.42, 77.14, 76.91, 76.07, 71.82, 70.47, 70.39, 69.58, 68.29, 60.43, 55.69, 42.17, 18.05。ESI-MS,m/z:C28H34O15[M+H]+,理论值610.559 0,实测值610.197 0。
新橙皮苷的合成关键在于PN上的酮羰基与异香草醛的醛基之间的Claisen-Schmidt缩合反应。本文采用吡咯烷+乙酸的组合催化合成新橙皮苷。吡咯烷使反应物烯醇化,乙酸起脱水缩合作用帮助成环,二者的比例会直接影响新橙皮苷的收率。吡咯烷呈碱性,碱性太弱不能使PN羰基的α-C完全去质子化,碱性太强导致副反应、产生副产物。不同比例的吡咯烷与乙酸组合催化剂之间的pH差异较大,探究其比例对新橙皮苷收率的影响,结果见表2。当吡咯烷与乙酸的摩尔比为2∶1时,新橙皮苷收率最高。此催化剂廉价易得,用量少,不易造成污染,且能以较高收率制备新橙皮苷,具有工业化价值。
表2 吡咯烷与乙酸的摩尔比对化合物新橙皮苷产率的影响
Table 2 Effect of molar ratio of pyrrolidine to acetic acid on the yield of compound neohesperidin
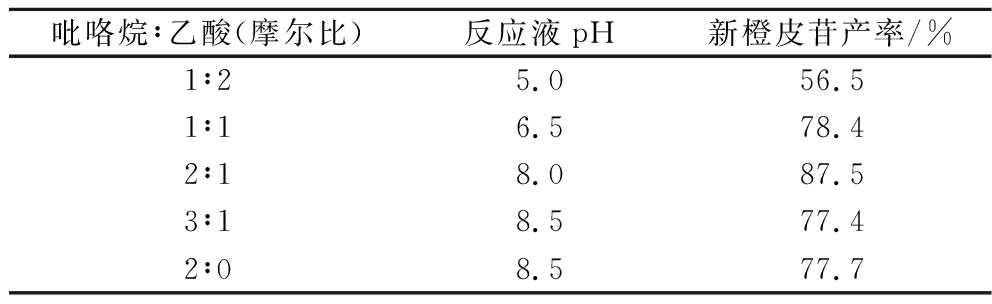
吡咯烷∶乙酸(摩尔比)反应液pH新橙皮苷产率/%1∶25.056.51∶16.578.42∶18.087.53∶18.577.42∶08.577.7
2.3 NHDC的结构表征与合成条件优化
NHDC的HPLC纯度为99.78%。1H NMR (600 MHz, DMSO-d6) δ 12.30 (s, 2H), 8.80 (s, 1H), 6.81 (s, 1H), 6.63 (d, J=34.0 Hz, 2H), 6.01 (s, 2H), 5.30 (s, 1H), 5.16~4.99 (m, 3H), 4.66 (d, J=13.2 Hz, 2H), 4.56 (s, 1H), 4.47 (s, 1H), 3.72 (s, 6H), 3.46 (d, J=36.7 Hz, 3H), 3.35 (s, 1H), 3.31 (s, 1H), 3.26 (s, 2H), 3.20 (s, 2H), 2.75 (s, 2H), 1.17 (d, J=6.1 Hz, 3H)。13C NMR (151 MHz, DMSO-d6) δ 205.45, 164.22, 163.37, 146.78, 146.31, 134.54, 119.18, 116.17, 112.83, 105.75, 101.08, 97.56, 95.27, 77.63, 77.31, 77.04, 72.31, 70.98, 70.87, 69.90, 68.80, 60.75, 56.16, 45.92, 29.85, 18.61。ESI-MS,m/z:C28H36O15[M+H]+,理论值612.575 0,实测值612.212 7。
新橙皮苷开环的关键因素为碱的浓度,碱浓度太低不足以使黄酮母核的B环打开变成查尔酮结构,碱性太强则会进一步破坏母核结构,产生副反应及副产物。因此考察不同NaOH质量分数下反应进行10 h后的NHDC产率测定,结果见表3。随着NaOH质量分数增大,反应正向进行,产率增加;当浓度过高时中间体查尔酮结构被破坏,产生副产物,产率下降,盐酸消耗量增加。最佳NaOH质量分数为7%,TLC监测原料反应较完全,NHDC产率最高。
表3 NaOH质量分数对NHDC产率的影响
Table 3 Effect of sodium hydroxide concentration on NHDC yield
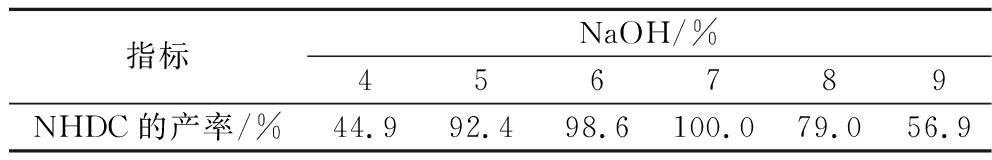
指标NaOH/%456789NHDC的产率/%44.992.498.6100.079.056.9
原料开环后暴露出C![]() C双键,直接催化加氢,使不饱和双键被还原,得到NHDC。由于Pd/C价格昂贵,远高于雷尼镍价格,考察雷尼镍替代Pd/C催化氢化反应。探究Pd/C不同添加量(以新橙皮苷的质量为基准)对NHDC产率的影响,结果见表4,添加量为25%时NHDC产率最高,为93.2%。探究雷尼镍用量(以新橙皮苷的质量为基准)对收率的影响,结果见表5,添加量为20%时,NHDC产率为100%。实验结果表明,雷尼镍的催化效果整体优于Pd/C。由于雷尼镍的骨架为金属铝,催化剂本身呈弱碱性,耐受碱性环境,有助于H2与金属镍直接接触氢化,利于反应正向进行;而Pd/C骨架为活性炭,在强碱性溶液中长时间反应后形变受损,使得Pd的催化活性逐渐减弱。因此,优选雷尼镍作为反应的催化剂,最佳用量为20%。与现有研究[10]相比,雷尼镍价格低廉,与Pd/C同等用量下,即可实现100%的转化率,有效降低成本同时提升了NHDC产率,具有工业化应用潜力。
C双键,直接催化加氢,使不饱和双键被还原,得到NHDC。由于Pd/C价格昂贵,远高于雷尼镍价格,考察雷尼镍替代Pd/C催化氢化反应。探究Pd/C不同添加量(以新橙皮苷的质量为基准)对NHDC产率的影响,结果见表4,添加量为25%时NHDC产率最高,为93.2%。探究雷尼镍用量(以新橙皮苷的质量为基准)对收率的影响,结果见表5,添加量为20%时,NHDC产率为100%。实验结果表明,雷尼镍的催化效果整体优于Pd/C。由于雷尼镍的骨架为金属铝,催化剂本身呈弱碱性,耐受碱性环境,有助于H2与金属镍直接接触氢化,利于反应正向进行;而Pd/C骨架为活性炭,在强碱性溶液中长时间反应后形变受损,使得Pd的催化活性逐渐减弱。因此,优选雷尼镍作为反应的催化剂,最佳用量为20%。与现有研究[10]相比,雷尼镍价格低廉,与Pd/C同等用量下,即可实现100%的转化率,有效降低成本同时提升了NHDC产率,具有工业化应用潜力。
表4 Pd/C对NHDC产率的影响
Table 4 Effect of Pd/C on NHDC yield
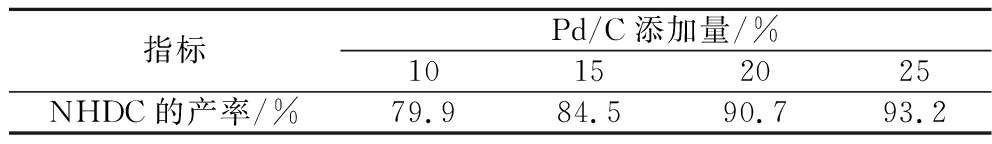
指标Pd/C添加量/%10152025NHDC的产率/%79.984.590.793.2
表5 雷尼镍对NHDC产率的影响
Table 5 Effect of Raney nickel on NHDC yield

指标雷尼镍添加量/%10152025NHDC的产率/%76.791.5100100
2.4 NHDC对PL的抑制能力
2.4.1 抑制率
抑制PL的活性从而抑制脂肪的水解、减少人体对脂质的吸收被认为是治疗肥胖的有效方法[11]。如图2所示,NHDC对PL的抑制效果表现出剂量依赖性,随NHDC浓度的增大,抑制效果增强。1.0 mg/mL的NHDC对PL的抑制率达到80%以上。半数抑制浓度(half maximal inhibitory concentration,IC50)即酶的抑制率为50%时所对应的抑制剂浓度,NHDC对PL的IC50值为0.71 mg/mL。结果表明NHDC对PL具有抑制作用。在黄酮类化合物对PL的抑制效果上,枸杞叶黄酮的IC50值为0.910 mg/mL,桑叶黄酮的IC50值为1.19 mg/mL,市售的茶多酚的IC50值为1.16 mg/mL[16]。Orlistat对PL的抑制率如图3所示,IC50为3.93 μg/mL,抑制效果虽优于NHDC,但Orlistat有许多副作用,且作为药物只能短期、少量地使用。半天然的合成化合物NHDC相比于Orlistat则更加温和安全。因此,相较于其他黄酮类化合物和Orlistat,NHDC拥有更为广阔的应用前景。
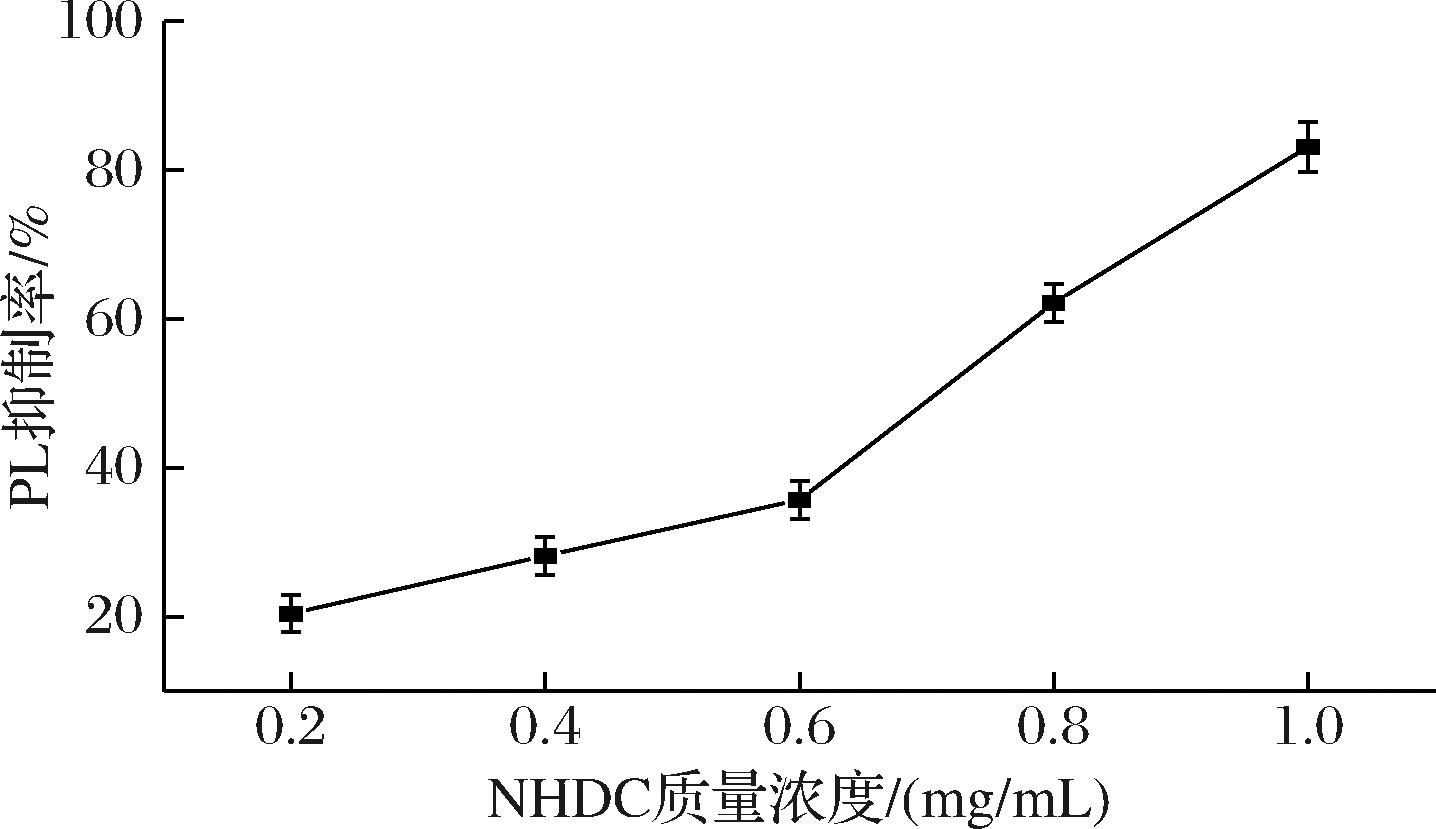
图2 NHDC对胰脂肪酶的抑制率
Fig.2 Inhibition of pancreatic lipase by NHDC
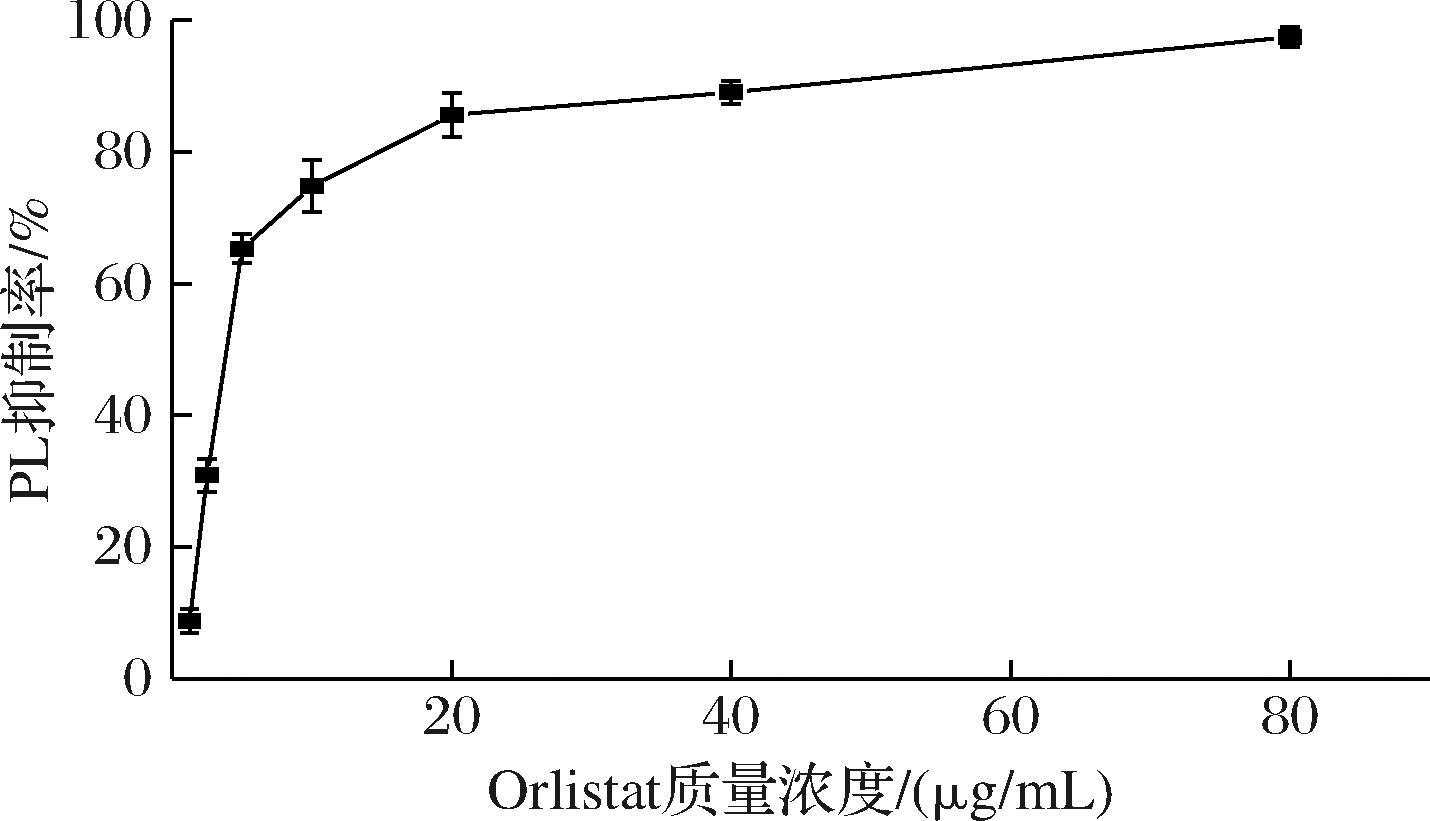
图3 Orlistat对胰脂肪酶的抑制率
Fig.3 Inhibition of pancreatic lipase by Orlistat
2.4.2 抑制类型
抑制类型分为可逆抑制与不可逆抑制,可逆抑制根据动力学特征分为竞争性抑制、非竞争性抑制以及反竞争性抑制。抑制类型曲线图中(图4-a),2条直线都过原点,且添加NHDC后直线斜率变小,表明NHDC对PL为可逆性抑制[17]。即NHDC通过非共价键与PL结合,抑制了PL的活性,但不会减少有效酶的数量[18]。
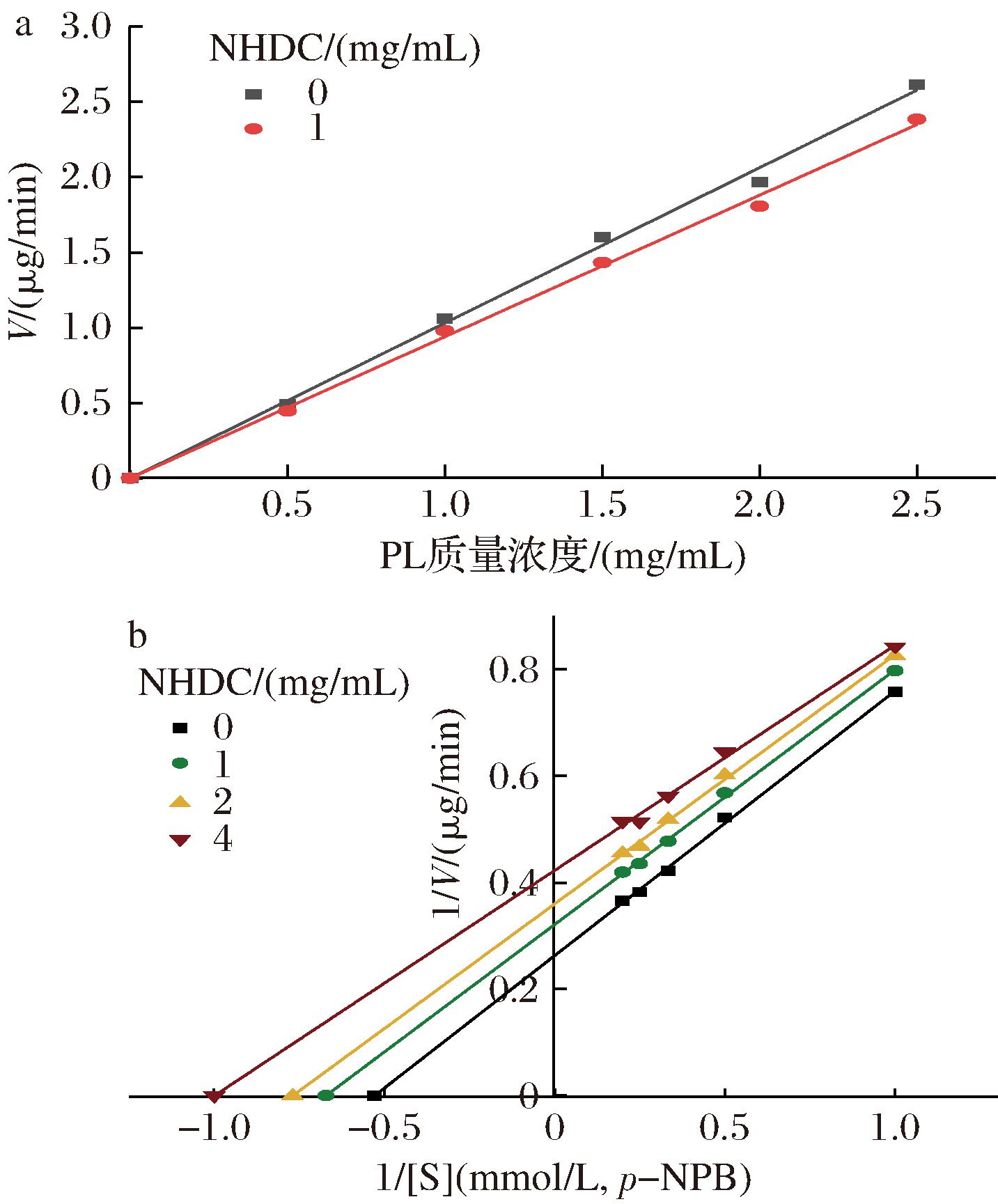
a-抑制类型;b-双倒数Lineweaver-Burk曲线
图4 NHDC对胰脂肪酶的抑制类型
Fig.4 Type of inhibition of pancreatic lipase by NHDC
如图4-b所示,Lineweaver-Burk图中直线呈现近乎平行的状态,NHDC浓度逐渐增大,动力学参数Km和Vmax均渐小,而Vmax/Km值近似保持不变,这表明NHDC对PL的抑制模式为反竞争性抑制[19,20]。即:NHDC仅与酶-底物复合物结合,结合后无法分解,从而阻碍了PL正常发挥作用[21]。
动力学参数按照公式(2)(3)计算:
(2)
(3)
式中:B,Lineweaver-Burk曲线的截距;[I],抑制剂NHDC的浓度;Vmax,PL的最大反应速率;Km,米氏常数;Ki,抑制常数;[S],底物p-NPB的浓度。
不同质量浓度NHDC存在时PL的动力学参数(Km、Vmax和Ki)的计算结果如表6所示。
表6 NHDC抑制PL的动力学参数
Table 6 Kinetic parameters of PL inhibition by NHDC
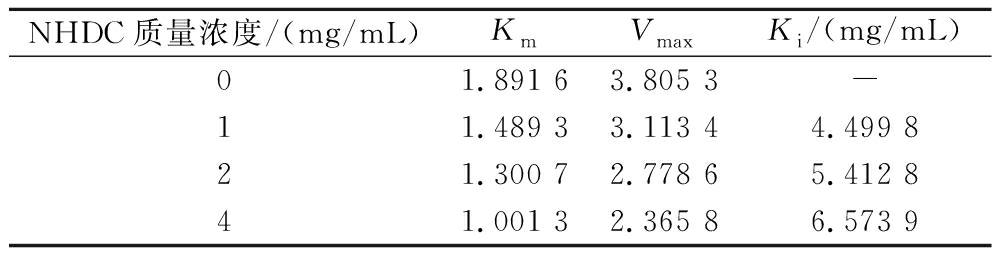
NHDC质量浓度/(mg/mL)KmVmaxKi/(mg/mL)01.891 63.805 3-11.489 33.113 44.499 821.300 72.778 65.412 841.001 32.365 86.573 9
2.4.3 荧光光谱分析NHDC对PL的结合作用
PL中色氨酸(Trp)残基可在特定激发波长下发出荧光,根据图5可知,NHDC对PL有很强的荧光猝灭作用,随着NHDC浓度增大,荧光强度大幅下降,不同温度下(20 ℃和37 ℃)均表现出相同趋势,且最大发射波长均发生蓝移(351 nm→345 nm)。酶蛋白中的Trp残基所在环境的极性如果发生改变,就会导致红移或蓝移现象[22]。这说明NHDC与PL结合后,PL的Trp残基向更疏水的微环境中移动[23],使得酶蛋白的三级结构发生变化,Trp残基暴露在溶剂中的部分减少,导致酶的催化活性下降。

a-293 K;b-310 K
图5 PL在不同浓度的NHDC存在下的荧光发射光谱
Fig.5 Fluorescence emission spectra of pancreatic lipase in different concentrations of NHDC
如图6所示,Stern-Volmer曲线呈弯曲向上状,表明NHDC对PL的荧光猝灭类型为动态与静态猝灭构成的混合猝灭[16]。当NHDC的浓度范围为0.4~0.6 mmol/L时,Stern-Volmer方程呈直线型线性关系,温度升高,曲线斜率随之增大,属于动态猝灭。这表明,NHDC浓度较高时,对于PL的混合猝灭过程,动态猝灭占主导地位。
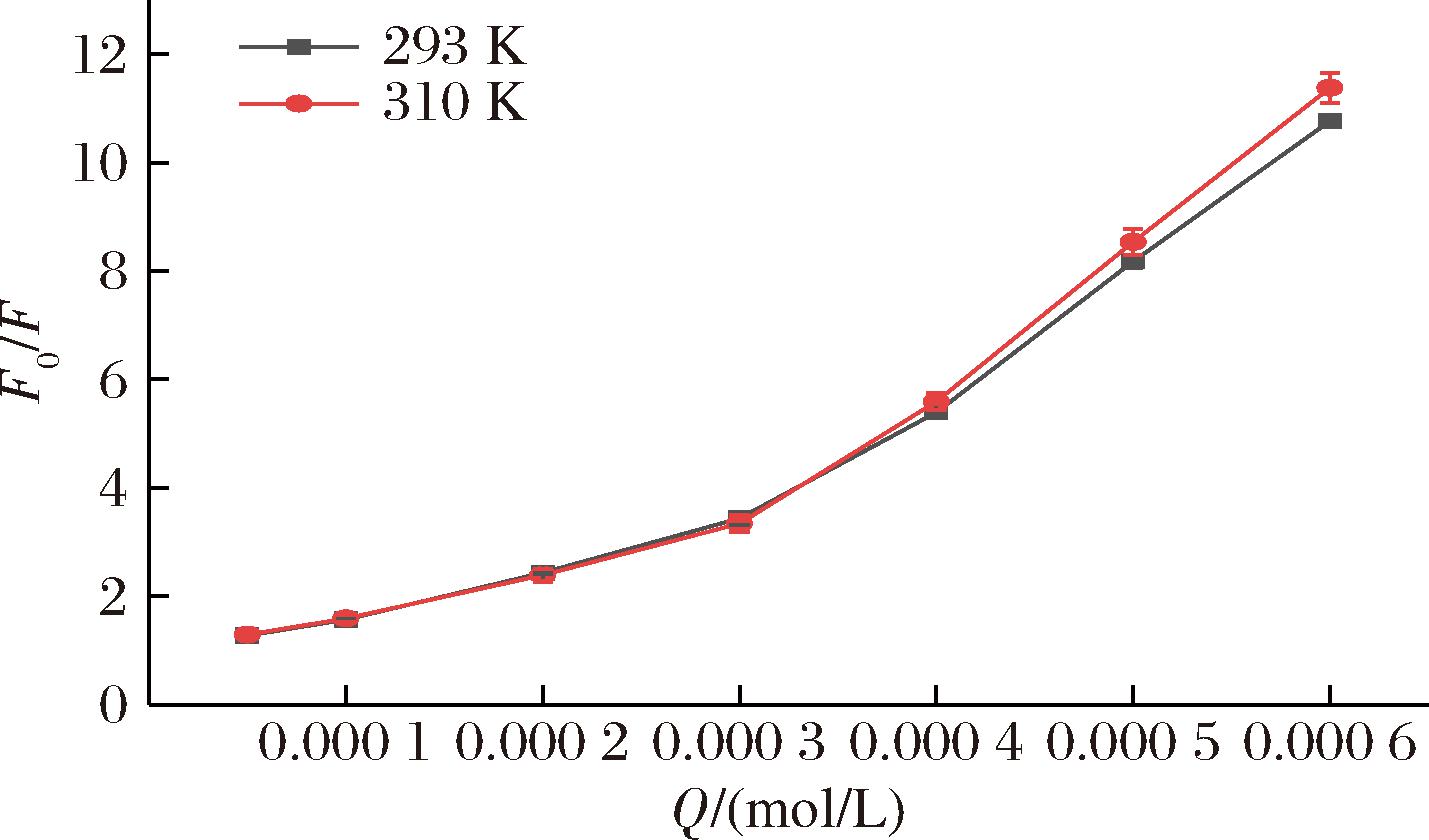
图6 Stern-Volmer曲线图
Fig.6 Stern-Volmer plot
3 结论
以柚皮苷为原料,经开环水解、羟醛缩合、催化氢化三步反应合成了NHDC,对每一步反应条件改进后,PN的产率达到80.7%,新橙皮苷的产率达到87.5%,以廉价的雷尼镍替代昂贵的Pd/C,氢化反应合成NHDC产率达到100%。三步反应NHDC的总产率达到70.6%,工艺稳定,具有工业化潜力。对PL的体外抑制实验表明,NHDC具有抑制PL作用,IC50为0.71 mg/mL,抑制类型为可逆、反竞争性抑制。荧光光谱结果表明,NHDC能显著猝灭PL蛋白内源荧光,通过混合猝灭改变酶结构、降低酶活性。该结果初步表明NHDC具有体外降脂活性或可为降脂食品开发提供依据。
[1] TAO F Y, WANG P, DAI Z R, et al.Neohesperidin dihydrochalcone improves hyperglycemia and insulin resistance in diabetic zebrafish[J].ACS Food Science &Technology, 2023, 3(9):1548-1558.
[2] AHMED M, DAVIS J, AUCOIN D, et al.Structural conversion of neurotoxic amyloid-beta(1-42) oligomers to fibrils[J].Nature Structural &Molecular Biology, 2010, 17(5):561-567.
[3] XIA X M, FU J L, SONG X F, et al.Neohesperidin dihydrochalcone down-regulates MyD88-dependent and-independent signaling by inhibiting endotoxin-induced trafficking of TLR4 to lipid rafts[J].Free Radical Biology &Medicine, 2015, 89:522-532.
[4] YOUNES M, AQUILINA G, CASTLE L, et al.Re-evaluation of neohesperidine dihydrochalcone (E 959) as a food additive[J].EFSA Journal, 2022, 20(11):e07595.
[5] TOM S-BARBER
S-BARBER N F A, CLIFFORD M N.Flavanones, chalcones and dihydrochalcones - nature, occurrence and dietary burden[J].Journal of the Science of Food and Agriculture, 2000, 80(7):1073-1080.
N F A, CLIFFORD M N.Flavanones, chalcones and dihydrochalcones - nature, occurrence and dietary burden[J].Journal of the Science of Food and Agriculture, 2000, 80(7):1073-1080.
[6] DWIVEDI R S.Dihydrochalcones Flavonoid Super Sweet Principles[M].Singapore:Springer Nature Singapore, 2022.
[7] FRYDMAN A, WEISSHAUS O, HUHMAN D V, et al.Metabolic engineering of plant cells for biotransformation of hesperedin into neohesperidin, a substrate for production of the low-calorie sweetener and flavor enhancer NHDC[J].Journal of Agricultural and Food Chemistry, 2005, 53(25):9708-9712.
[8] HOROWITZ R M, GENTILI B.Flavonoids of Citrus—VI:The structure of neohesperidose[J].Tetrahedron, 1963, 19(5):773-782.
[9] HOROWITZ R M, GENTILI B.Taste and structure in phenolic glycosides[J].Journal of Agricultural and Food Chemistry, 1969, 17(4):696-700.
[10] 钟艺琼. 从柚皮苷制新橙皮苷二氢查尔酮的研究[D].厦门:厦门大学, 2022.ZHONG Y Q.Preparation of neohesperidin dihydrochalcone from naringin[D].Xiamen:Xiamen University, 2022.
[11] YUN J W.Possible anti-obesity therapeutics from nature:A review[J].Phytochemistry, 2010, 71(14-15):1625-1641.
[12] FRANCO R R, MOTA ALVES V H, RIBEIRO ZABISKY L F, et al.Antidiabetic potential of Bauhinia forficata Link leaves:A non-cytotoxic source of lipase and glycoside hydrolases inhibitors and molecules with antioxidant and antiglycation properties[J].Biomedicine &Pharmacotherapy, 2020, 123:109798.
[13] DU X P, BAI M L, HUANG Y, et al.Inhibitory effect of astaxanthin on pancreatic lipase with inhibition kinetics integrating molecular docking simulation[J].Journal of Functional Foods, 2018, 48:551-557.
[14] CARDULLO N, MUCCILLI V, PULVIRENTI L, et al.Natural isoflavones and semisynthetic derivatives as pancreatic lipase inhibitors[J].Journal of Natural Products, 2021, 84(3):654-665.
[15] YU B, TANG Q M, FU C X, et al.Effects of different particle-sized insoluble dietary fibre from Citrus peel on adsorption and activity inhibition of pancreatic lipase[J].Food Chemistry, 2023, 398:133834.
[16] 廖家乐, 方甜, 范艳丽.枸杞叶黄酮对胰脂肪酶活性的抑制作用[J].中国食品学报, 2022, 22(5):43-53.LIAO J L, FANG T, FAN Y L.Inhibitory effects of Lycium barbarum leaves flavonoids on pancreatic lipase activity[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):43-53.
[17] 纪慧杰, 朱彩平.石榴皮多糖的提取及组成、体外降脂活性研究[J].食品与发酵工业, 2023, 49(4):161-168.JI H J, ZHU C P.Study on the extraction and composition of pomegranate peel polysaccharide and hypolipidemic activity in vitro[J].Food and Fermentation Industries, 2023, 49(4):161-168.
[18] CHEN M C, LIU T T, WANG J P, et al.Strong inhibitory activities and action modes of lipopeptides on lipase[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2020, 35(1):897-905.
[19] 郑丽婷, 周鸿, 刘奕明, 等.黄柏碱对α-葡萄糖苷酶的体外抑制作用[J].南京中医药大学学报, 2020, 36(6):853-858.ZHENG L T, ZHOU H, LIU Y M, et al.Inhibitory effect of phellodendrine on α-glucosidase in vitro[J].Journal of Nanjing University of Traditional Chinese Medicine, 2020, 36(6):853-858.
[20] 高航, 单雪玉, 高延芬, 等.莲子红衣多酚对α-葡萄糖苷酶的抑制作用[J].食品科学技术学报, 2016, 34(6):36-40; 45.GAO H, SHAN X Y, GAO Y F, et al.Inhibitory effect on α-glucosidase activity of polyphenol from red-skin of Lotus seed[J].Journal of Food Science and Technology, 2016, 34(6):36-40; 45.
[21] URBIZO-REYES U, LICEAGA A M, REDDIVARI L, et al.Enzyme kinetics, molecular docking, and in silico characterization of canary seed (Phalaris canariensis L.) peptides with ACE and pancreatic lipase inhibitory activity[J].Journal of Functional Foods, 2022, 88:104892.
[22] DAS S, HAZARIKA Z, SARMAH S, et al.Exploring the interaction of bioactive kaempferol with serum albumin, lysozyme and hemoglobin:A biophysical investigation using multi-spectroscopic, docking and molecular dynamics simulation studies[J].Journal of Photochemistry and Photobiology B:Biology, 2020, 205:111825.
[23] LI Y Q, YANG P, GAO F, et al.Probing the interaction between 3 flavonoids and pancreatic lipase by methods of fluorescence spectroscopy and enzymatic kinetics[J].European Food Research and Technology, 2011, 233(1):63-69.