γ-氨基丁酸(γ-aminobutyric acid, GABA)是一种广泛存在于动植物体内的非蛋白氨基酸,普遍存在于植物组织中[1-2]。通常,植物组织中的GABA含量较低,只有植物在遭受机械损伤、高温、低温等逆境条件时才会大量合成,协助植物体抵抗外界逆境伤害[3]。据报道,大豆在发芽过程中GABA含量升高,尤其是在温度胁迫(高温、低温)、盐胁迫等逆境条件下,可进一步提高大豆组织中的GABA含量[4-6]。通过环境胁迫促进植物中的GABA含量,是有效提高食物功能性的途径。
GABA是新型食品活性因子,在人体中参与多种代谢活动,对人类具有降压、降糖、抗疲劳、抗焦虑、改善睡眠等多种营养保健功效[7-10]。GABA作为抑制神经递质,可降低神经元活性,缓解人的焦虑情绪,但其作为食物进入人体后,经过复杂的消化、吸收和代谢后才能被人体利用,整个过程可能会引起较大损失。作为新型食品原料,关于GABA吸收特性的报道较少,食物运载体系对其吸收特性及生理功能的影响尚不清晰。
综上,本试验旨在系统研究促进大豆在发芽过程中富集GABA的胁迫条件,建立大豆中GABA的富集工艺。通过构建Caco-2细胞模型,研究富含GABA的植物基饮品中GABA的转运吸收特性,分别构建PC12细胞和斑马鱼的焦虑模型,研究富含GABA植物基饮品的抗焦虑功效。
1 材料与方法
1.1 材料与试剂
GABA标准品,美国Sigma-Aldrich公司;4-二甲基胺基偶氮苯-4-磺酰氯、1-(3-氯苯基)哌嗪盐酸盐,上海阿拉丁生化科技股份有限公司;人体结肠癌细胞株(Caco-2)、大鼠肾上腺嗜铬细胞瘤细胞(PC12),中国科学院上海生物化学与细胞生物学研究所; DMEM(dulbecco’s modified eagle medium),中科迈晨科技有限公司;胎牛血清(fetal bovine serum, FBS),美国Gibco Life Technologies;IP裂解液、二甲基亚砜(dimethyl sulfoxide,DMSO),上海麦克林生化科技有限公司;GABA试剂盒,黄石市艾恩斯生物科技有限公司;Cell Counting Kit-8(CCK-8)试剂盒、乳酸脱氢酶细胞毒性检测试剂盒、胰蛋白酶,碧云天生物技术研究所;艾司唑仑,山东信谊制药有限公司;乙醇、谷氨酸钠、NaCl、CaCl2、NaHCO3、三水合乙酸钠等,均为分析纯,上海麦克林生化科技股份有限公司;斑马鱼,杭州环特生物科技股份有限公司,试验动物管理已得到杭州环特生物科技股份有限公司动物试验委员会的批准,并遵循动物福利伦理(编号:IACUC-2022-5280-01)要求。
1.2 仪器与设备
CKX53倒置生物显微镜,日本Olympus公司;MCO-20AIC CO2培养箱,日本松下公司;Spectra Max i3酶标仪,美国MD公司;GL-20G-Ⅱ高速冷冻离心机,上海安亭科学仪器厂;LC-20A高效液相色谱仪,日本Shimadzu公司;Millicell ERS-2上皮细胞跨膜电阻测量仪,世界精密仪器商贸(上海)有限公司;Scepter手持细胞计数器,密理博中国有限公司。
1.3 实验方法
1.3.1 大豆胁迫发芽富集GABA与植物基饮品制备
1.3.1.1 环境胁迫处理
选取粒径均匀无污染的大豆分别置于35 ℃蒸馏水、25 ℃谷氨酸钠溶液(1.1 mmol/L)、25 ℃盐溶液(2.2 mmol/L CaCl2,100 mmol/L NaCl)中浸泡处理,然后将浸泡后的大豆转移至发芽器中,分别用25 ℃蒸馏水、25 ℃谷氨酸钠溶液(1.1 mmol/L)、25 ℃盐溶液(2.2 mmol/L CaCl2,100 mmol/L NaCl)循环喷淋、避光发芽24 h。以未进行浸泡处理的大豆作为对照。
1.3.1.2 大豆浸泡工艺优化
选取粒径均匀无污染的大豆置于蒸馏水中进行浸泡,浸泡时间分别为0、1、2、3、4、5、6、7 h。浸泡完成后,取出大豆,用干纱布擦去大豆表面的水分,记录大豆浸泡前后的重量,计算吸水率。其计算如公式(1)所示:
吸水率/%=(浸泡后重量-浸泡前重量)/浸泡前重量×100
(1)
1.3.1.3 大豆发芽工艺优化
选取粒径均匀无污染的大豆置于蒸馏水中进行浸泡,浸泡温度为35 ℃,浸泡时间为4 h,然后将大豆转移至发芽器中,循环水喷淋、25 ℃避光发芽,发芽时间为0、6、12、18、24 h,测定大豆中的GABA含量。
1.3.1.4 大豆品种的筛选
以实验室育种的7种大豆作为试验原料,代号分别为A、B、C、D、E、F、G,将7种大豆置于35 ℃蒸馏水中浸泡4 h,然后将大豆转移至发芽器中,循环水喷淋、25 ℃避光发芽24 h,测定大豆中的GABA含量。
1.3.1.5 植物基饮品的制备
将大豆用去离子水煮沸5 min,脱去豆皮。将脱皮豆用胶体磨研磨5 min,过80目筛,在滤液中加入谷物粉、木糖醇等配料,充分搅拌溶解,然后将料液在35 MPa条件下进行均质,制得植物基饮品半成品,最后用超高温瞬时杀菌进行灭菌(137 ℃,15 s)和无菌灌装,制得植物基饮品。
1.3.1.6 GABA的测定方法
参照NY/T 2890—2016《稻米中γ-氨基丁酸的测定 高效液相色谱法》中的方法进行提取和测定。
1.3.2 植物基饮品对GABA的消化吸收特性研究
1.3.2.1 体外模拟消化
参照INFOGEST 2.0提出的体外模拟消化模型[11]并稍作修改,配制模拟胃液和模拟肠液。称取适量样品置于溶出仪的溶出杯,加入模拟胃液,于200 r/min、37 ℃条件下旋转孵育2 h,立即加入2 mol/L NaOH溶液调节pH为7.0以停止胃模拟消化。加入模拟小肠液,在200 r/min、37 ℃条件下继续旋转孵育3 h,吸取样品消化液进行灭酶处理,得到实验样品。
1.3.2.2 不同样品消化液对Caco-2的细胞毒活性
参考文献[12]的方法并稍作修改。取96孔培养板,每孔加100 μL含有3×105个/mL的Caco-2细胞悬液,5%的CO2,37 ℃培养24 h后弃去培养液,每孔加入含不同浓度GABA的消化液各100 μL,培养24 h后除去培养液,加入CCK-8于37 ℃培养箱中避光孵育2 h。用酶标仪在450 nm处测定吸光值。
1.3.2.3 不同样品消化液中GABA在Caco-2细胞的转运与吸收
取24孔Transwell插入式培养皿,将生长到对数期的Caco-2细胞传代,细胞浓度约为5×105个/mL,吸取细胞混悬液100 μL加入到Transwell每孔上室,下室加入500 μL新鲜培养基培养。当细胞培养板Transwell上的Caco-2细胞TEER值超过400 Ω·cm2时,可形成极化的单层,并有良好的紧密连接性,即可模拟人体肠道上皮吸收屏障[13]。Caco-2细胞在24孔Transwell板上培养到21 d后,小心弃去培养基,上室和下室分别用预热好的PBS洗2遍,然后在上室加入500 μL的样品,下室加入无样品的PBS缓冲液。37 ℃下孵育2 h后,PBS缓冲液小心清洗细胞表面以除去未与细胞键合的游离钙。用IP裂解液收割细胞,并用ELISA试剂盒检测细胞中GABA的含量,即GABA的储留量;小心吸取下室缓冲液,测定其中GABA的含量,即GABA的转运量。GABA的吸收量、储留率、转运率和吸收率的计算如公式(2)~公式(5)所示:
GABA的吸收量=GABA的储留量+GABA的转运量
(2)
GABA的储留率/%=GABA的储留量/GABA的加入量
(3)
GABA的转运率/%=GABA的转运量/GABA的加入量
(4)
GABA的吸收率/%=GABA的吸收量/GABA的加入量
(5)
1.3.3 植物基饮品的抗焦虑作用研究
1.3.3.1 PC12神经细胞损伤模型的构建
皮质酮(corticosterone, CORT)诱导的PC12神经细胞损伤可模拟焦虑症[14]。取96孔培养板,每孔加100 μL含有1.2×105个/孔,37 ℃培养24 h后弃去培养液,每孔加入CORT终浓度为200、400、600、800 μmol/L 的1640培养基100 μL,以无CORT的相同培养基孵育细胞为对照,培养24 h后每孔加CCK-8溶液于37 ℃避光孵育2 h。用酶标仪在450 nm处测定吸光度值。
1.3.3.2 植物基饮品消化产物和GABA对PC12的细胞毒活性
分别研究0.1、0.2、0.5、1、2 mg/mL的植物基饮品消化产物样品和1、2、5、10、20、50、100 μmol/L的GABA对PC12细胞增殖的影响,实验方法同1.3.3.1节。
1.3.3.3 植物基饮品消化产物对PC12神经细胞损伤的预保护作用
利用PC12细胞焦虑模型评估植物基饮品消化产物对皮质酮诱导的神经细胞损伤的预保护作用。取96孔培养板,每孔加100 μL细胞悬液,细胞数量为1.2×105个/孔,37 ℃培养24 h后弃去培养液,加入不同的处理液。细胞分组为对照组(纯培养基)、模型组(CORT组)以及实验组(提前加入植物基饮品的消化产物/GABA预孵育12 h,再与模型组一致加入CORT)。分别通过CCK-8细胞毒理学实验(实验方法同1.3.5节)和细胞内LDH活性检测实验(实验方法参考试剂盒),研究植物基饮品消化产物对PC12神经细胞损伤的预保护作用。
1.3.3.4 植物基饮品缓解斑马鱼焦虑功效的浓度筛选
随机选取年龄为受精4 d后的野生型AB品系斑马鱼于6孔板中,每孔均处理30尾斑马鱼(实验组)。给予不同浓度的植物基饮品(冻干粉),同时设置正常对照组,每孔容量为3 mL。28 ℃处理24 h后,通过死亡率与斑马鱼表型观测,筛选植物基饮品缓解斑马鱼焦虑功效的适宜浓度。
1.3.3.5 植物基饮品缓解斑马鱼焦虑功效
随机选取年龄为受精后4 d的野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。水溶给予不同浓度的植物基饮品(冻干粉),阳性对照艾司唑仑质量浓度为5.00 μg/mL,同时设置正常对照组和模型对照组,每孔容量为3 mL。28 ℃培养箱孵育24 h后,将斑马鱼转移至96孔板中,200 μL/尾,1尾/孔,除正常对照组之外,其余实验组均水溶给予1-(3-氯苯基)哌嗪盐酸盐建立斑马鱼焦虑模型。用行为分析仪检测斑马鱼的总运动距离,评价植物基饮品缓解焦虑功效。
1.4 数据处理与分析
实验结果以平均值±标准差表示,每组实验进行3次重复。采用SPSS软件进行LSD和Duncan检验,且P<0.05为差异显著。
2 结果与分析
2.1 大豆胁迫发芽富集GABA与植物基饮品制备
2.1.1 环境胁迫促进大豆GABA富集
环境胁迫可引发植物的应激反应,改变植物代谢模式,促进植物组织中GABA的积累[1]。大豆发芽过程中,对其施加热胁迫、谷氨酸钠胁迫、盐胁迫等诱发大豆产生应激反应,促进大豆中GABA的富集。结果如图1所示,热胁迫、谷氨酸钠胁迫和盐胁迫均可促进大豆中GABA的富集,分别较对照组提高了243%、123%和136%。热胁迫处理可预先激活大豆中的酶系,提高大豆在发芽过程中代谢速率,促进GABA的富集[15];谷氨酸钠是植物合成GABA的底物,补充谷氨酸钠可提高GABA合成;盐胁迫可为大豆提供Ca2+,提高大豆中的谷氨酸脱羧酶(glutamate decarboxylase,GAD)活性,促进GABA积累[16-17],综上所述,环境刺激可有效促进大豆发芽过程中GABA的富集,且热胁迫处理效果最为显著。
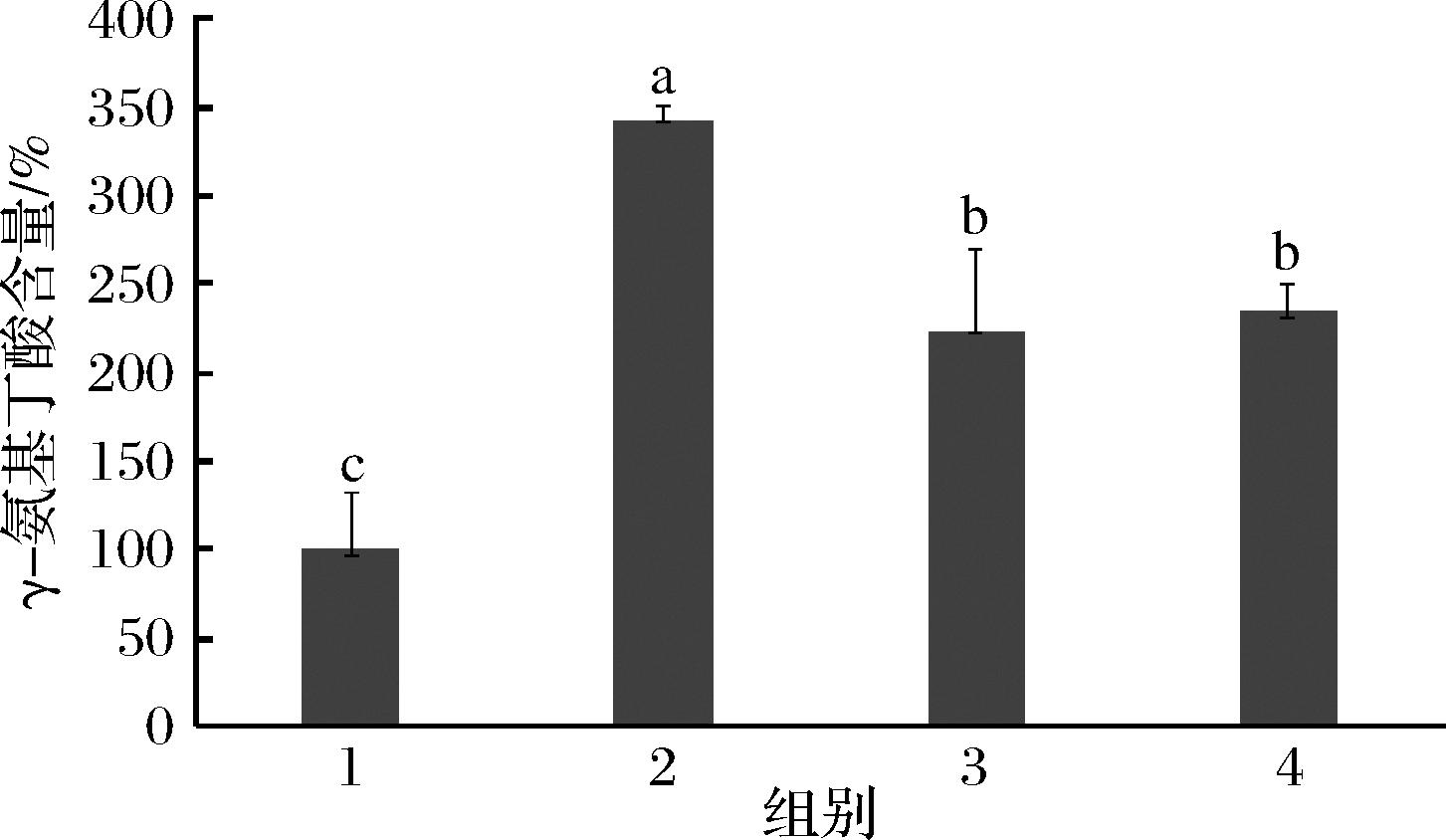
1-对照(25 ℃循环水喷淋、避光发芽24 h);2-高温胁迫(35 ℃浸泡4 h,25 ℃循环水喷淋、避光发芽24 h);3-谷氨酸钠[25 ℃谷氨酸钠溶液(1.1 mmol/L)喷淋、避光发芽24 h];4-盐胁迫[25 ℃循环培养液(2.2 mmol/L CaCl2, 100 mmol/L NaCl)喷淋、避光发芽24 h]
图1 环境刺激促进大豆发芽富集GABA
Fig.1 Environmental stimulation promoted GABA enrichment in soybean germination
注:不同小写字母代表差异显著,P<0.05(下同)。
2.1.2 大豆发芽工艺优化
为进一步提高大豆中GABA的含量,本研究对大豆的发芽过程中的工艺参数进行了优化。发芽过程中,浸泡可为大豆提供一个快速吸收水分的环境,但也会使大豆处于厌氧状态,浸泡时间可能会影响大豆的发芽和GABA的富集。结果如图2-a所示,随着浸泡时间延长,大豆迅速吸水,吸水速率随时间延长逐渐减慢,浸泡4 h后大豆的吸水率达到80%,浸泡7 h后大豆吸水率达到106%。为保证大豆在浸泡过程中尽可能地吸水分,同时又防止浸泡时间过长影响大豆的发芽率,将浸泡时间控制在4 h以内。
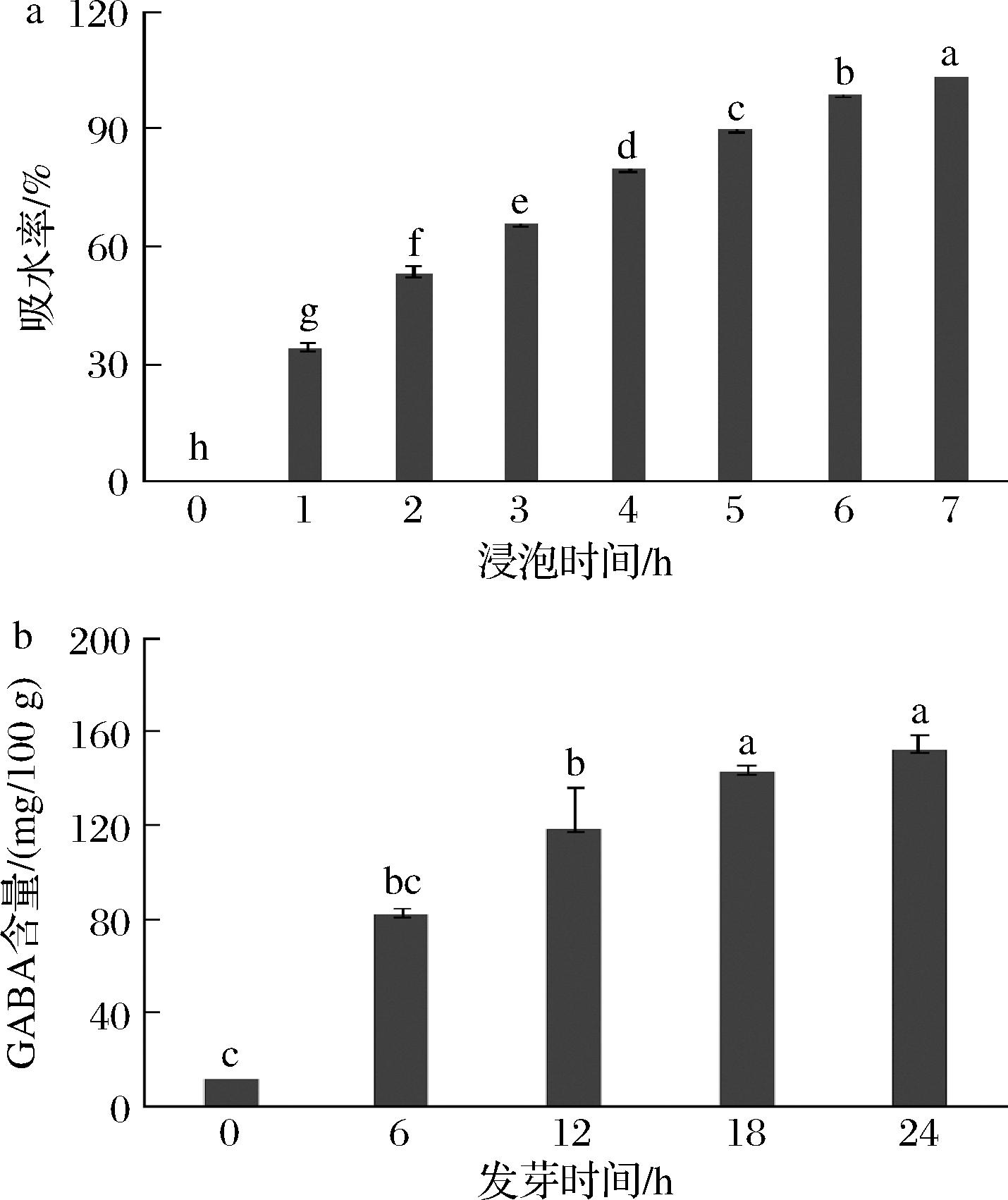
a-浸泡时间对大豆吸水率(大豆初始重量为100%)的影响;b-发芽时间对大豆GABA富集的影响
图2 大豆发芽富集GABA的工艺优化
Fig.2 Optimization of GABA enrichment process for soybean germination
将大豆在35 ℃条件下浸泡4 h,在25 ℃循环水喷淋、避光条件下进行发芽,发芽时间分别为0、6、12、18、24 h。结果如图2-b所示,随着发芽时间延长,大豆中的GABA含量呈上升趋势,发芽24 h后大豆中的GABA含量可达到152.1 mg/100 g,约为发芽前的10倍。有研究显示,大豆发芽5 d后,GABA含量可达到发芽前的36.7倍[18]。但由于大豆发芽24 h以上会产生草腥味和豆腥味,影响植物基饮品的口感,因此将大豆发芽时间控制在24 h以内。
2.1.3 大豆品种对GABA富集的影响
不同大豆品种在发芽过程中富集GABA的能力不同。本研究采用实验室育种的7种大豆开展GABA富集试验,分别将大豆在35 ℃水中浸泡4 h,在25 ℃循环水喷淋、避光条件下发芽24 h。发芽后大豆中的GABA含量如图3所示,7种大豆发芽后的GABA含量分布在106.0~153.5 mg/100 g,其中B组大豆中GABA含量最高,因此选用B组大豆作为富含GABA植物基饮品的大豆品种。WANG等[18]发现,大豆品种对GABA富集影响较大,3种大豆中GABA富集4~6 d后达到峰值,含量分别为102、153、328 mg/100 g,但该3种大豆在发芽时间为24 h时,GABA含量均接近50 mg/100 g,低于本研究所选定的大豆品种,说明本研究所筛选的大豆品种和发芽工艺更有利于GABA的富集。
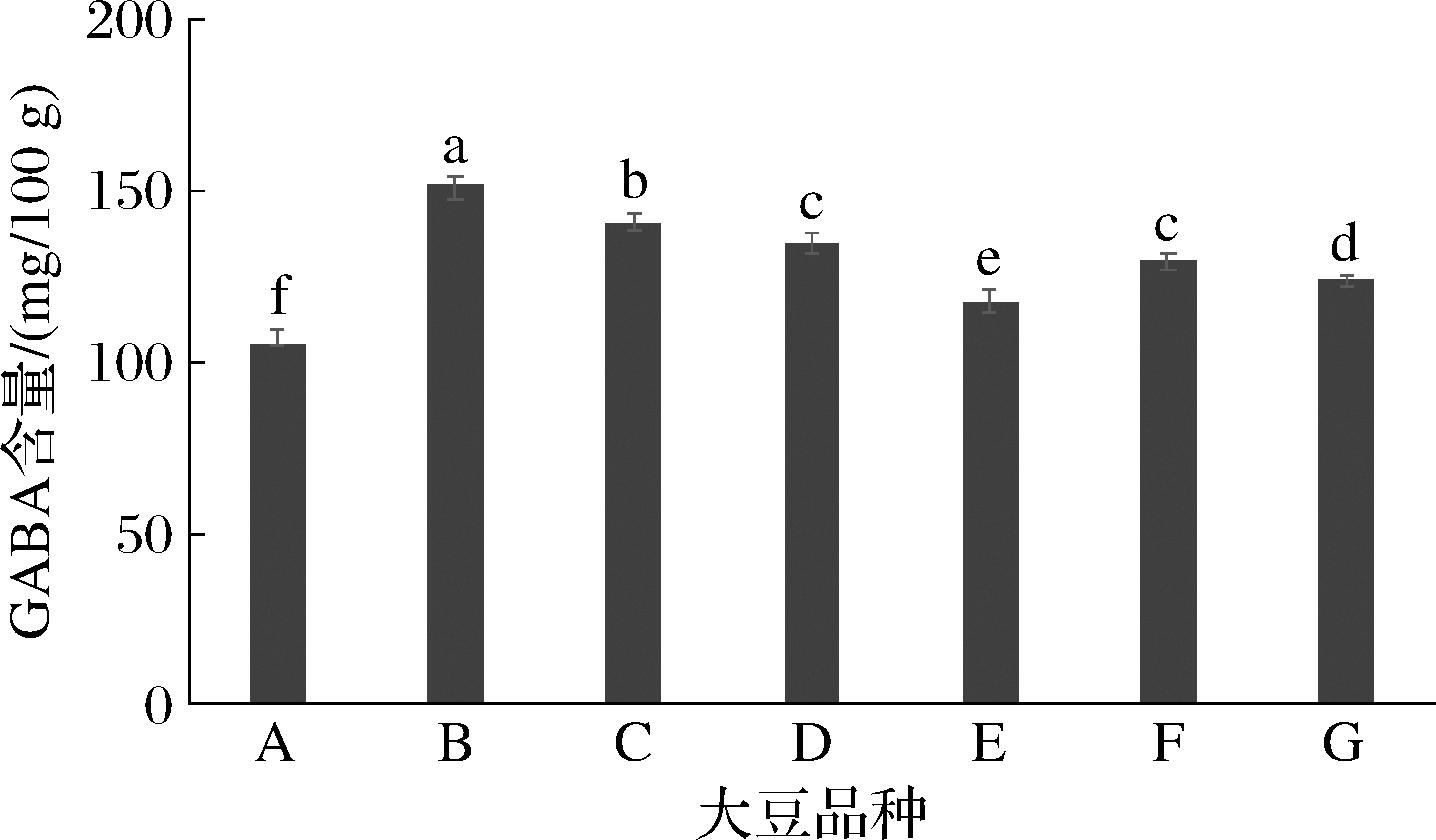
图3 大豆品种对发芽富集GABA的影响
Fig.3 Effect of soybean varieties on GABA enrichment during germination
2.1.4 植物基饮品制备工艺对GABA的影响
如图4所示,大豆原料、过筛后料液、均质后料液、植物基饮品中的GABA含量分别为9.75、7.60、7.42、7.46 mg。植物基饮品加工过程中,导致GABA损失的关键工艺为过筛,过筛过程中有部分GABA随豆渣被脱除。高压、高温等因素不会导致GABA出现显著损失,说明GABA在加工过程中具有较好的稳定性。
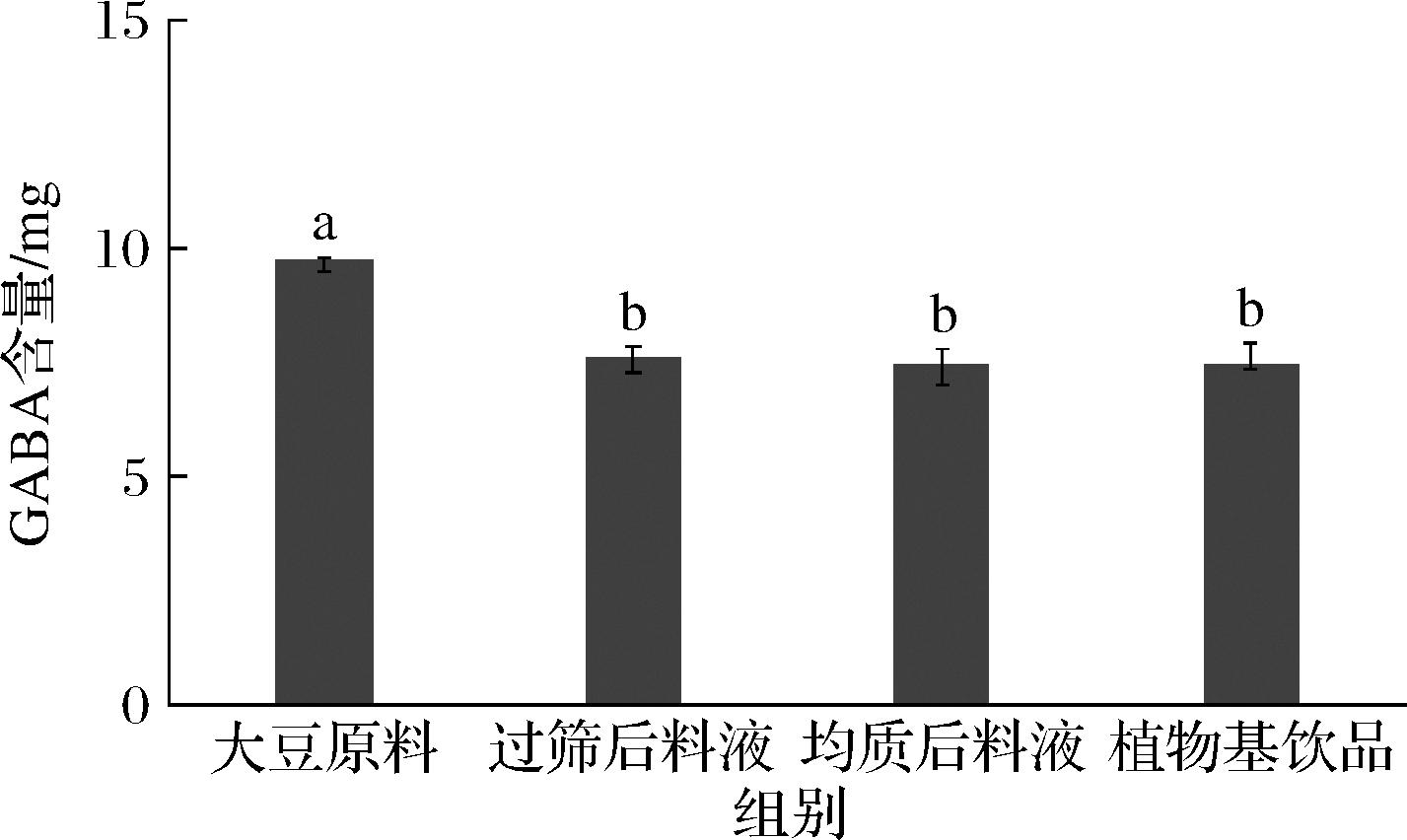
图4 植物基饮品加工工艺对GABA含量的影响
Fig.4 Effect of processing technology of plant-based drinks on GABA content
注:植物基饮品中的大豆添加量为6.5 g/100 g,各工艺步骤中的GABA含量按6.5 g大豆进行计算。
2.2 植物基饮品对GABA消化吸收特性的影响
2.2.1 植物基饮品消化前后的GABA含量
如表1所示,在3款豆类产品中,植物基饮品经消化前后GABA的含量最高,分别为7.46、5.20 mg/100 g。市售产品1消化前GABA的含量为1.69 mg/100 g,消化后未检测到GABA。市售产品2消化前后均未检测到GABA。消化前后的差异可能是由于消化过程中GABA发生了化学修饰或成分转化。上述结果表明,大豆品种筛选和GABA富集工艺优化,有效提高了植物基饮品消化前后的GABA含量。
表1 植物基饮品及相关产品消化前后的GABA含量变化 单位:mg/100 g
Table 1 Changes in GABA content before and after digestion of plant-based drinks and related products

产品名称消化前GABA含量消化后GABA含量植物基饮品7.465.20市售产品11.69ND市售产品2NDND
注:ND表示未检出。
2.2.2 植物基饮品对Caco-2细胞转运吸收GABA的影响
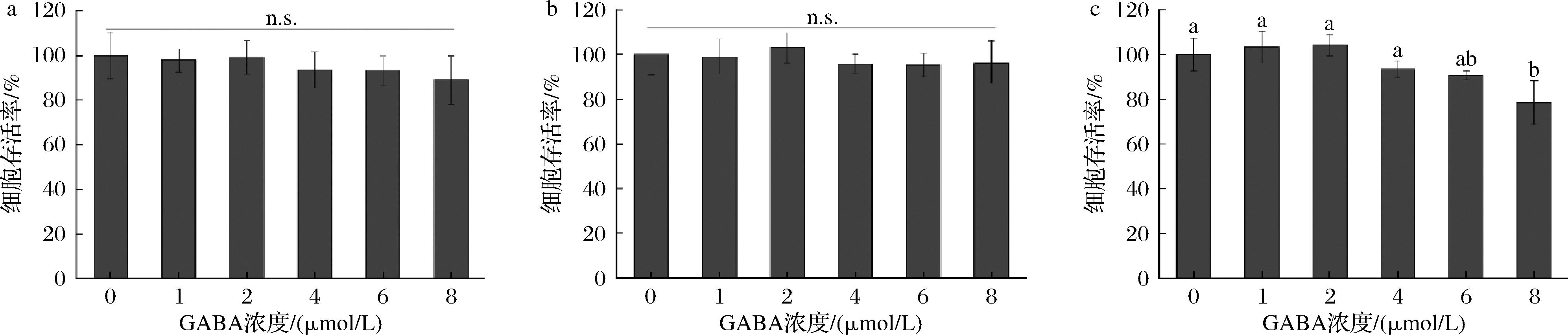
小肠是人体吸收营养物质的主要部位,有研究表明Caco-2细胞的生化作用与人体小肠极为类似,可在模拟人体代谢情况下测定食品/药物的跨膜转运规律[19],并且基于Caco-2细胞的体外转运模型的食品/药物的透过情况与人体口服后在体内的吸收和代谢有良好的相关性,所以研究人员将其用作探究小肠吸收的模型[20]。将外源GABA分别添加至植物基饮品及相关产品的体外消化液,其对Caco-2细胞的细胞毒活性影响如图5所示。植物基饮品消化液和市售产品1消化液在GABA浓度为1~8 μmol/L时对细胞增殖均无显著影响(图5-a和图5-b),市售产品2消化液在GABA浓度为1~6 μmol/L时对细胞增殖无显著影响(图5-c),这可能与Caco-2细胞对不同产品表现出的敏感性存在差异有关,表明植物基饮品对小肠上皮细胞的潜在危害显著低于市售产品2。因此,选取3款消化液在GABA浓度为6 μmol/L进行Caco-2细胞的转运吸收特性研究。
a-植物基饮品消化液;b-市售产品1消化液;c-市售产品2消化液
图5 不同产品消化液复合GABA对Caco-2细胞的细胞毒活性
Fig.5 Cytotoxic activity of digestive juices of different products combined with GABA on Caco-2 cells
Caco-2细胞单层的紧密性和完整性是研究营养物质吸收转运的保证,Caco-2细胞培养21 d后分化成一层单细胞膜,其TEER值已达到784 Ω·cm2,表明此时可利用此模型进行转运实验。3种样品对GABA转运吸收的结果如图6所示。植物基饮品消化液中GABA的储留率、转运率和吸收率均显著高于其它样品,市售产品2消化液中的GABA吸收率次之,市售产品1消化液中的GABA储留率、转运率和吸收率最低。上述结果表明,植物基饮品消化液更有利于GABA的转运吸收。因此,在细胞毒理学和促进GABA转运吸收方面,植物基饮品综合水平优于市售产品。
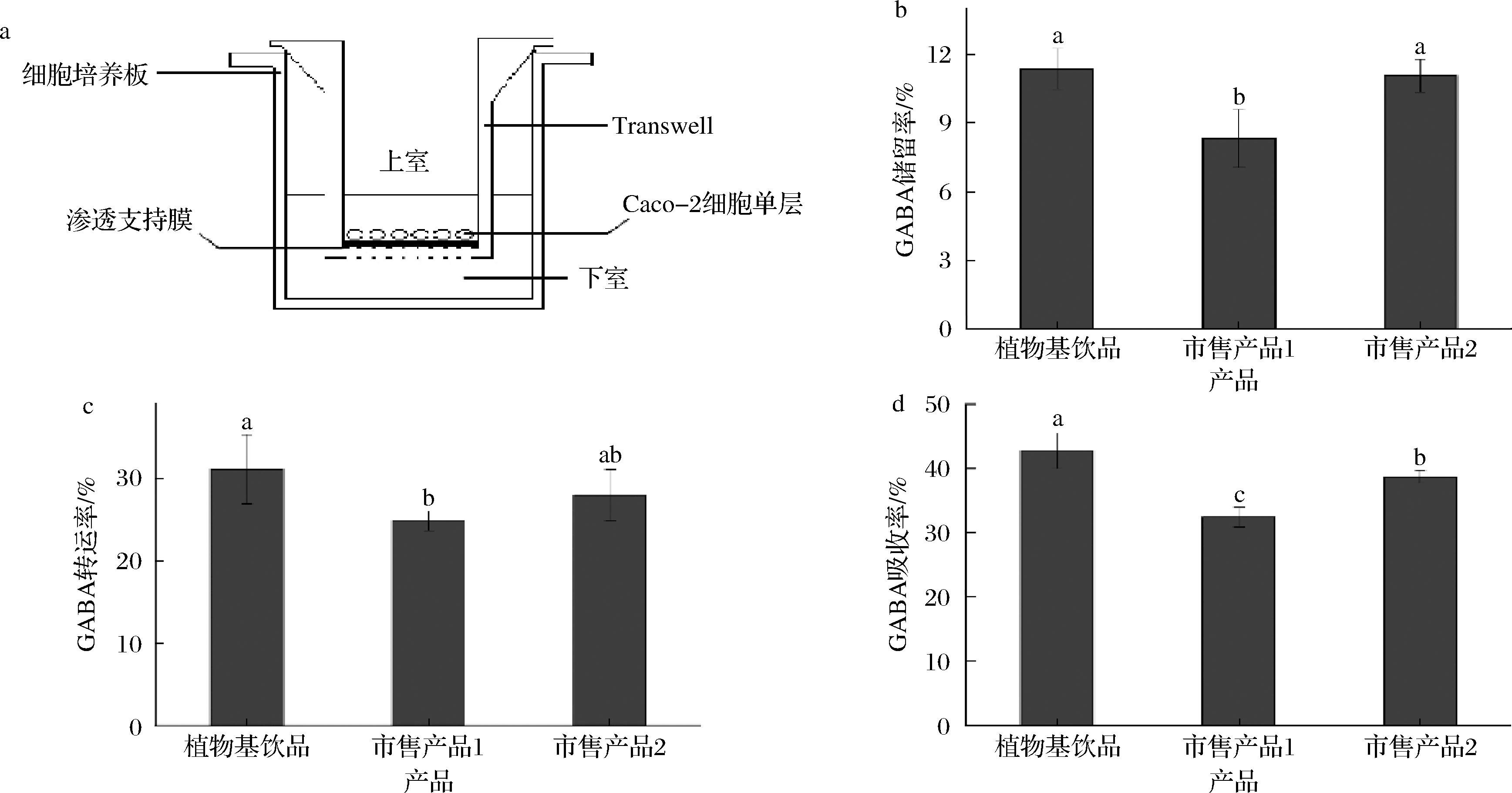
a-转运吸收装置;b-储留率;c-转运率;d-吸收率
图6 不同产品消化液对GABA转运吸收的影响
Fig.6 Effects of digestive juices of different products on GABA transport and absorption
2.3 植物基饮品的抗焦虑作用
2.3.1 植物基饮品消化产物缓解PC12细胞焦虑作用
CORT诱导的PC12神经细胞损伤可模拟焦虑症。通过细胞毒理学实验,筛选构建焦虑症细胞模型的CORT适宜浓度,以及研究植物基饮品消化液和GABA抗焦虑作用的适宜浓度。从图7可以看出,随着CORT浓度的增大,PC12细胞存活率逐渐降低,当CORT浓度为400 μmol/L时,PC12细胞存活率约为50%,因此,选取400 μmol/L作为CORT构建PC12神经细胞损伤模型的浓度,这与马家乐等[21]的研究结果一致。研究植物基饮品消化产物对PC12细胞毒性影响,在质量浓度为0.1~0.5 mg/mL时,植物基饮品消化产物均不影响PC12细胞的活力,对细胞增殖无明显影响(P>0.05);质量浓度超过1 mg/mL时,显著抑制细胞增殖。因此,选取低剂量(0.1 mg/mL)、中剂量(0.2 mg/mL)和高剂量(0.5 mg/mL)研究其抗焦虑作用。GABA在浓度为1~100 μmol/L时均不影响PC12细胞的活力,对细胞增殖无明显影响(P>0.05)。基于文献中GABA浓度一般选取10 μmol/L作为阳性对照,研究其对神经细胞损伤模型的调节作用[22],因此,后续实验各组中GABA浓度均选择10 μmol/L。

a-皮质酮;b-植物基饮品;c-GABA
图7 皮质酮、植物基饮品消化液和GABA浓度对PC12细胞的细胞毒活性
Fig.7 Cytotoxic activity of corticosterone, digestive juices of plant-based drinks and concentration of GABA on PC12 cells
各组细胞经过处理后所检测到的PC12细胞毒活性如图8所示。与对照组相比,皮质酮模型组细胞存活率约为对照组的1/2。当植物基饮品消化产物质量浓度为0.2 mg/mL和0.5 mg/mL时,细胞存活率有明显的提高(P<0.05),说明植物基饮品消化产物可有效缓解皮质酮引起的PC12神经细胞的损伤(P<0.05)。阳性对照GABA展现出较好的神经保护作用,且GABA与0.5 mg/mL植物基饮品消化产物复合样品组的细胞存活率显著高于单独GABA处理组(P<0.05),说明植物基饮品消化产物可以促进GABA更好的发挥神经保护作用,即抗焦虑作用。这可能是由于GABA缓解了皮质酮引起的氧化应激诱导的PC12细胞损伤[14,22]。LDH渗漏是细胞膜损伤的细胞毒性研究的经典生物标志物,当细胞损伤时,发生细胞凋亡或坏死而造成细胞膜结构破坏,导致细胞膜通透性改变,导致细胞质内的LDH释放到培养液中,因此,培养基中LDH的水平常被用来间接判断化合物对细胞的毒性[23-24]。各组细胞经过处理后检测到的PC12细胞中LDH活性如图8所示,与细胞毒活性结果基本一致,同样说明植物基饮品消化产物可以促进GABA更好地发挥抗焦虑作用。
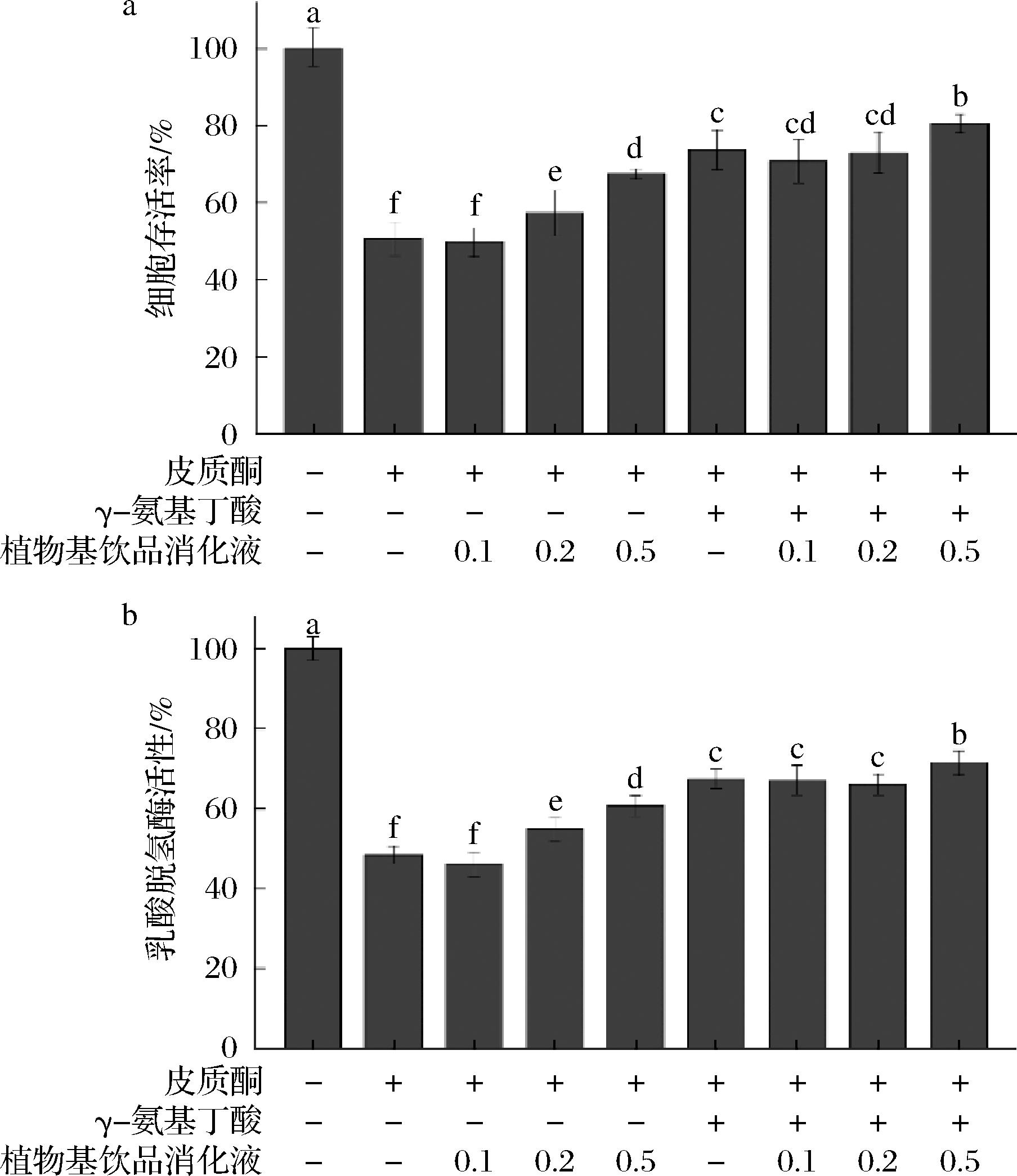
图8 不同浓度植物基饮品消化液/GABA对皮质酮诱导PC12神经细胞损伤的保护作用
Fig.8 Protective effect of different concentrations of plant-based drink digestive solution/GABA on corticosterone-induced PC12 cell damage
2.3.2 植物基饮品缓解斑马鱼焦虑作用
采用1-(3-氯苯基)哌嗪盐酸盐构建斑马鱼焦虑模型[25]。首先,通过研究不同浓度植物基饮品对斑马鱼死亡率和表型的影响,筛选植物基饮品的适宜浓度,结果如表2所示,植物基饮品质量浓度分别为1 250、2 500、5 000、7 500 μg/mL时,斑马鱼的死亡率为0,表型与正常对照组状态相似。因此,选取5 000 μg/mL 和7 500 μg/mL作为植物基饮品缓解斑马鱼焦虑的作用浓度。植物基饮品处理后斑马鱼总运动距离结果如图9所示,模型对照组显著高于正常对照组,艾司唑仑组显著低于模型对照组,说明1-(3-氯苯基)哌嗪盐酸盐构建的斑马鱼焦虑模型可以用于研究植物基饮品是否具有缓解焦虑功效。5 000 μg/mL 和7 500 μg/mL植物基饮品干预的斑马鱼的总运动距离显著低于模型对照组,但显著高于艾司唑仑组,说明植物基饮品能够显著缓解斑马鱼焦虑,但改善效果次于艾司唑仑药物。
表2 植物基饮品(冻干粉)缓解斑马鱼焦虑功效浓度的筛选(n=30)
Table 2 Concentration screening of plant-based drink (freeze-dried powder) for anxiety relief in zebrafish (n=30)
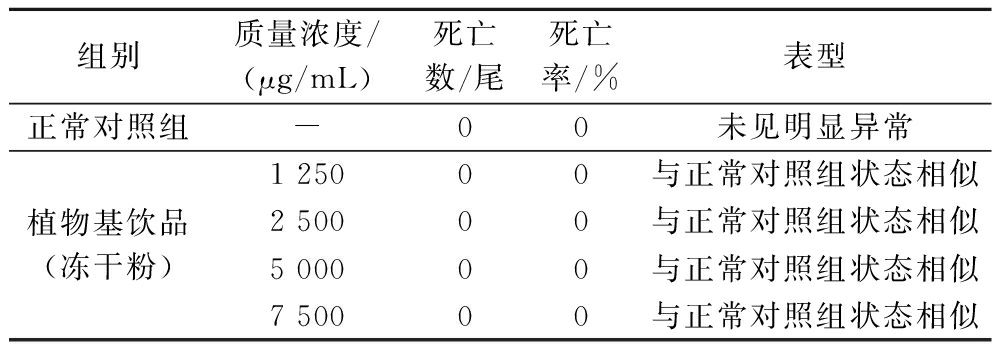
组别质量浓度/(μg/mL)死亡数/尾死亡率/%表型正常对照组-00未见明显异常植物基饮品(冻干粉)1 25000与正常对照组状态相似2 50000与正常对照组状态相似5 00000与正常对照组状态相似7 50000与正常对照组状态相似
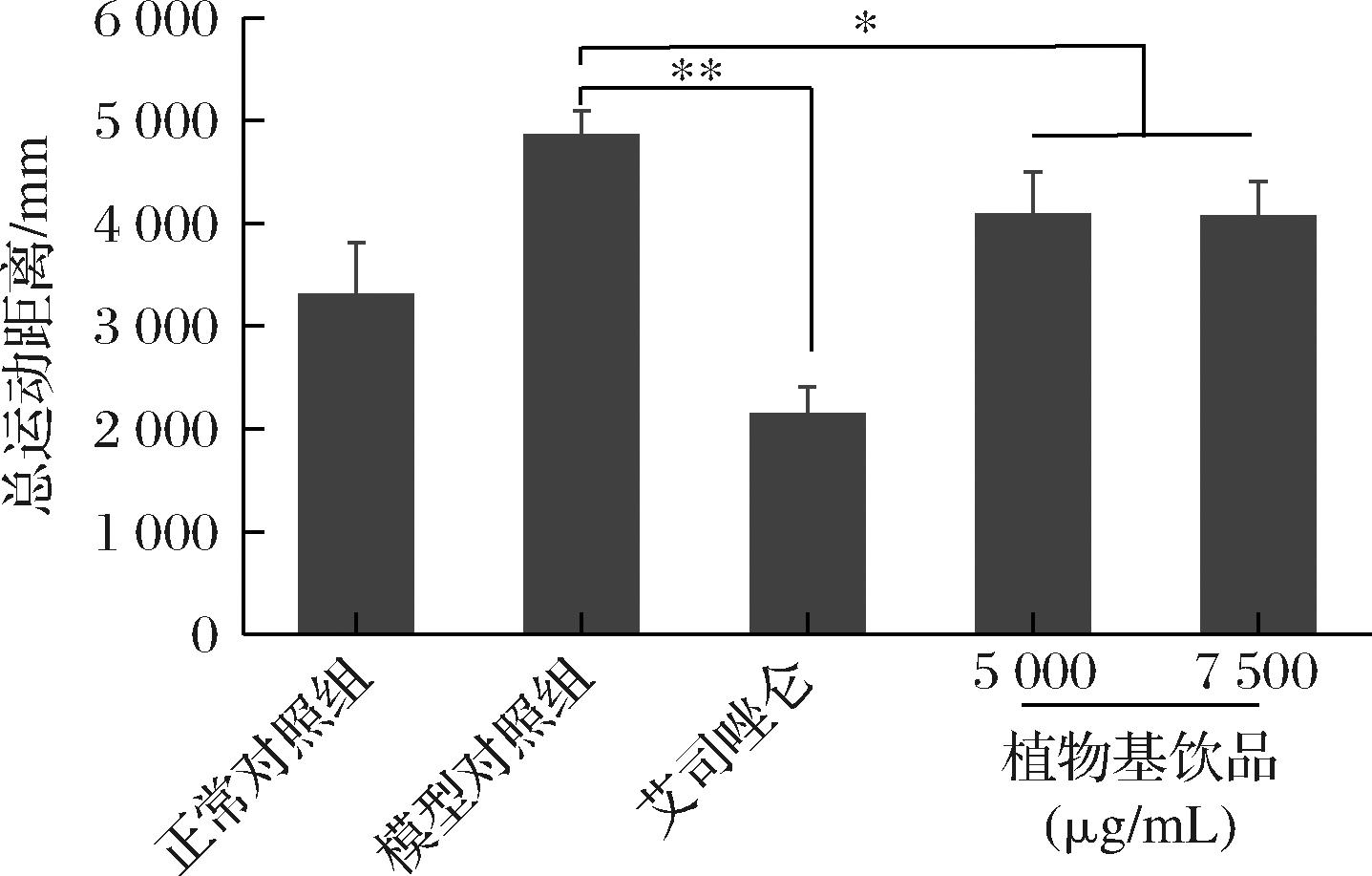
图9 不同浓度植物基饮品对斑马鱼焦虑模型的缓解作用
Fig.9 Mitigating effects of plant-based drinks of different concentrations on zebrafish anxiety models
3 结论
本研究对大豆胁迫发芽的GABA富集工艺,以及制备的富含植物基饮品的消化吸收特性、抗焦虑作用进行了系统研究。在大豆发芽过程中,高温胁迫、谷氨酸钠胁迫和盐胁迫均可有效提高大豆中的GABA含量,最佳大豆发芽工艺为:浸泡4 h,25 ℃循环水喷淋、避光发芽24 h。大豆富集GABA的能力与大豆品种密切相关。经体外消化前后的植物基饮品中GABA含量以及GABA的转运吸收率显著高于其他市售相关产品,具有缓解PC12神经细胞和斑马鱼焦虑症功效,其作用机制有待进一步研究。
[1] 王姗姗, 刘小娇, 胡赟, 等.植物中γ-氨基丁酸的代谢及富集机制[J].安徽农业科学, 2020, 48(24):9-12.WANG S S, LIU X J, HU B, et al.Metabolism and enrichment mechanism of γ-aminobutyric acid in plants[J].Journal of Anhui Agricultural Sciences, 2020, 48(24):9-12.
[2] 雷玲钰, 王耀, 王莉平, 等.浅析药用植物中的γ-氨基丁酸[J].化工设计通讯, 2021, 7(2):1-2.LEI L Y, WANG Y, WANG L P, et al.Analysis of γ-aminobutyric acid in medicinal plants[J].Chemical Engineering Design Communications, 2021, 7(2):1-2.
[3] 何梦秀, 陈芳艳, 钟杨生, 等.γ-氨基丁酸富集方法的研究进展[J].安徽农业科学, 2015, 43(15):15-17;77.HE M X, CHEN F Y, ZHONG Y S, et al.Research progress of γ-aminobutyric acid enrichment methods[J].Journal of Anhui Agricultural Sciences, 2015, 43(15):15-17;77.
[4] 毛健, 马海乐.大豆发芽富集γ-氨基丁酸的工艺优化[J].食品科学, 2009, 30(24):227-231.MAO J, MA H Y.Optimization of technological conditions on γ-aminobutyric accumulation in germinated soybean[J].Food Science, 2009, 30(24):227-231.
[5] YANG R Q, FENG L, WANG S F, et al.Accumulation of γ-aminobutyric acid in soybean by hypoxia germination and freeze-thawing incubation[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2090-2096.
[6] 江迪, 张紫晋, 杨婷, 等.青稞麦麸γ-氨基丁酸的制备条件优化[J].中国食品学报, 2023, 23(7):259-266.JIANG D, ZHANG Z J, YANG T, et al.Optimization of γ-aminobutyric acid preparing conditions using highland barley bran[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(7):259-266.
[7] INOUE K, SHIRAI T, OCHIAI H, et al.Blood-pressure-lowering effect of a novel fermented milk containing γ-aminobutyric acid (GABA) in mild hypertensives[J].European Journal of Clinical Nutrition, 2003, 57(3):490-495.
[8] MARQUES T M, PATTERSON E, WALL R, et al.Influence of GABA and GABA-producing Lactobacillus brevis DPC 6108 on the development of diabetes in a streptozotocin rat model[J].Beneficial Microbes, 2016, 7(3):409-420.
[9] SUWANMANON K, HSIEH P C.Effect of γ-aminobutyric acid and nattokinase-enriched fermented beans on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J].Journal of Food and Drug Analysis, 2014, 22(4):485-491.
[10] YAMATSU A, YAMASHITA Y, PANDHARIPANDE T, et al.Effect of oral γ-aminobutyric acid (GABA) administration on sleep and its absorption in humans[J].Food Science and Biotechnology, 2016, 25(2):547-551.
[11] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[12] MARTELLI CHAIB SALIBA A S, GIOVANINI DE OLIVEIRA SARTORI A, SOUZA BATISTA P, et al.Simulated gastrointestinal digestion/Caco-2 cell transport:Effects on biological activities and toxicity of a Brazilian propolis[J].Food Chemistry, 2023, 403:134330.
[13] 陈锐, 丁国芳, 杨最素, 等.鳕鱼皮胶原蛋白肽在Caco-2细胞单层模型中的吸收机制[J].食品科学, 2018, 39(19):154-161.CHEN R, DING G F, YANG Z S, et al.Absorption mechanism of cod skin collagen peptide in Caco-2 cell monolayer model[J].Food Science, 2018, 39(19):154-161.
[14] ZHOU Y Z, LI X, GONG W X, et al.Protective effect of isoliquiritin against corticosterone-induced neurotoxicity in PC12 cells[J].Food &Function, 2017, 8(3):1235-1244.
[15] PRIYA M, SHARMA L, KAUR R, et al.GABA (γ-aminobutyric acid), as a thermo-protectant, to improve the reproductive function of heat-stressed mungbean plants[J].Scientific Reports, 2019, 9(1):7788.
[16] AL-QURAAN N A, SARTAWE F A B, QARYOUTI M M.Characterization of γ-aminobutyric acid metabolism and oxidative damage in wheat (Triticum aestivum L.) seedlings under salt and osmotic stress[J].Journal of Plant Physiology, 2013, 170(11):1003-1009.
[17] YANG R Q, GUO Y X, WANG S F, et al.Ca2+ and aminoguanidine on γ-aminobutyric acid accumulation in germinating soybean under hypoxia-NaCl stress[J].Journal of Food and Drug Analysis, 2015, 23(2):287-293.
[18] WANG F Z, WANG H F, WANG D H, et al.Isoflavone, γ-aminobutyric acid contents and antioxidant activities are significantly increased during germination of three Chinese soybean cultivars[J].Journal of Functional Foods, 2015, 14:596-604.
[19] 吴朝花, 何丽, 肖婷, 等.艳山姜挥发油自乳化释药系统的毒性及对Caco-2细胞单层细胞旁转运与P-糖蛋白的影响[J].中草药, 2023, 54(11):3568-3577.WU C H, HE L, XIAO T, et al.Toxicity and effects of essential oil of Fructus Alpinia zerumbet-self-emulsifying drug delivery system on paracellular transport in Caco-2 cell monolayer and P-glycoprotein[J].Chinese Traditional and Herbal Drugs, 2023, 54(11):3568-3577.
[20] INOTSUKA R, UCHIMURA K, YAMATSU A, et al.γ-Aminobutyric acid (GABA) activates neuronal cells by inducing the secretion of exosomes from intestinal cells[J].Food &Function, 2020, 11(10):9285-9290.
[21] 马家乐, 符昭君, 王鑫玉, 等.沉香提取物对皮质酮诱导PC12细胞损伤的保护作用及机制研究[J].中草药, 2022, 53(4):1093-1099.MA J L, FU Z J, WANG X Y, et al.Protective effect and mechanism of aquilariae lignum resinatum extract on corticosterone induced PC12 cells injury[J].Chinese Traditional and Herbal Drugs, 2022, 53(4):1093-1099.
[22] HOU C W.Pu-Erh tea and GABA attenuates oxidative stress in kainic acid-induced status epilepticus[J].Journal of Biomedical Science, 2011, 18(1):75.
[23] 班龄尹, 王笑园, 庞思成, 等.朝鲜蓟茎叶中脂溶性提取物对神经细胞的保护作用[J].中国食品学报, 2021, 21(5):31-40.BAN L Y, WANG X Y, PANG S C, et al.Protective effect of lipophilic extracts from the stems and leaves of global artichoke on nerve cells[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):31-40.
[24] DING Z J, DA H H, OSAMA A, et al.Emodin ameliorates antioxidant capacity and exerts neuroprotective effect via PKM2-mediated Nrf2 transactivation[J].Food and Chemical Toxicology, 2022, 160:112790.
[25] KIRLA K T, GROH K J, POETZSCH M, et al.Importance of toxicokinetics to assess the utility of zebrafish larvae as model for psychoactive drug screening using meta-chlorophenylpiperazine (mCPP) as example[J].Frontiers in Pharmacology, 2018, 9:414.