植物多酚是一类广泛存在植物根、皮和叶中的具有多个酚羟基的重要次生代谢产物,包括酚酸类、二苯乙烯类、黄酮、黄烷醇、黄酮醇、花色苷、原花色素(又称缩合单宁)、水解单宁和木质素等,具有抗氧化、抗炎、抑菌、预防心脑血管疾病、抗癌、抗凝血以及抗病毒等活性[1]。因此,植物多酚在食品、医药、化妆品和保健品等领域有广泛应用[2]。
弯萼金丝桃(Hypericum curvisepalum)是一种灌木类藤黄科金丝桃属植物,该属包括500多个种,在世界各地均有分布,其中我国包括55个种8个亚种。该属化学成分主要有黄酮类、二蒽酮类、氧杂蒽酮类、萜类及间苯三酚衍生物类等,在国内外用于抗菌、抗抑郁、抗病毒、抗氧化、肝保护、抗肿瘤等。目前关于弯萼金丝桃的研究较少,本课题组早期研究显示,弯萼金丝桃提取物石油醚、乙酸乙酯和甲醇3个部位对枯草芽孢杆菌的最小抑菌浓度(minimal inhibitory concentration,MIC)范围为1.95~31.25 μg/mL[3],其中石油醚部位中oxepahyperforin和furoadhyperforin对肝癌SMMC-7721细胞和MGC-803细胞表现出较强的细胞毒活性[4],何秋映[5]研究表明,弯萼金丝桃乙酸乙酯部位中含有大量氧杂蒽酮类,且对紫色素杆菌(Chromobacterium violaceum ATCC 12472)群感效应具有抑制作用,当质量浓度为250 μg/mL时,其不抑制细菌生长但抑制色素产生。HE等[6]分离到的部分氧杂蒽酮类成分对SMMC-7721人肝癌细胞表现出细胞毒性,半抑制浓度(IC50)值为43.8~120.8 μmol/L。孙明霞等[7]从弯萼金丝桃中分离出16个化合物,包括间苯三酚类、萜类和黄酮类等,其中mysorenone D为新化合物。YE等[8]从弯萼金丝桃中分离了5个笼状元宝草类间苯三酚衍生物,其中hypercurpalone A具有新骨架(八氢-2,5-甲烷基环己烯骨架),且对心血管疾病具有抑制作用。通过文献调研和前期研究发现,弯萼金丝桃化学成分丰富,生物活性多样。目前尚未见对总多酚(total polyphenol,TP)提取工艺及生物活性研究,因此具有较大的研究空间。
本研究以提高TP提取率为目标,采用多种不同提取方法结合单因素试验和响应面优化TP提取制备方法,采用UPLC对TP进行定性、定量分析,并通过体外抗氧化实验和降糖实验研究其抗氧化、降糖能力。本研究可为经济、科学、高效地提取TP提供实验依据,也为弯萼金丝桃在医药等领域高值化产品的开发提供实验基础。
1 材料与方法
1.1 试剂与药物
本实验样品采摘于云南省普洱市镇沅县,经伊犁师范大学张维教授鉴定为弯萼金丝桃(Hypericum curvisepalum),粉碎过50目筛,放置-4 ℃冰箱冷藏备用。色谱甲醇,苏州欧特化工有限公司;无水乙醇、双氧水及其他试剂均为分析纯,北京雷根生物技术有限公司。
1.2 仪器与设备
PRI24ZH/E电子天平,奥豪斯仪器(常州)有限公司;TDZ5-WS多管架自动平衡离心机,湘仪离心机;1510-01137全波长酶标仪,美国Thermo科技公司;XH-2008D电脑智能温控低温超声波合成率取仪,北京祥鹄科技发展有限公司;UV-2550紫外分光光度计,岛津仪器制造有限公司;ACQUITY UPLC H-CLass全自动纯化超高效液相质谱仪,美国Waters公司;7500F扫描电镜,日本Jeol有限公司。
1.3 实验方法
1.3.1 提取方法的筛选
精密称取5份1.0 g弯萼金丝桃样品,分别采用冷浸醇提法、热水浸提法、酸解法、酶解法、超声提取法进行TP的提取,所有方法均复提2次,合并滤液待用。采用扫描电镜观察不同提取方法下弯萼金丝桃细胞的破损程度,选择最佳提取方法。
冷浸醇提法:称取弯萼金丝桃1.0 g,加入100 mL体积分数为60%乙醇溶液,于室温中静置1 d。
热水浸提法:准确称取1.0 g弯萼金丝桃,加入100 mL的50 ℃的蒸馏水,摇晃使样品完全浸湿,立即移入50 ℃水浴锅中,水浴60 min(中途振荡2~3次)。
酸提取法:参考文献[9]中的方法并修改。称取弯萼金丝桃1.0 g,加入100 mL体积分数为60%乙醇溶液,pH值为5.0,于50 ℃水浴中浸提60 min。
酶解法:参考文献[10]中的方法并修改。称取弯萼金丝桃1.0 g,添加蒸馏水100 mL,纤维素酶33.8 mg、pH值为5.0,于50 ℃酶解60 min。
超声提取法:参考文献[11]中的方法并稍加改动。称取弯萼金丝桃1.0 g,加入体积分数为60%乙醇溶液100 mL,于300 W超声处理60 min。
1.3.2 标准曲线绘制及TP提取率测定
通过福林酚法测定。制备质量浓度不同(0、40、80、120、160、200、240 mg/L)的没食子酸标准溶液。向试管中分别移取1 mL不同质量浓度的没食子酸标准溶液,并依次加入1 mL福林酚试剂和5 mL质量分数为7.5%的Na2CO3溶液。混匀并定容至25 mL,于40 ℃的水浴中加热30 min,在765 nm波长处测定吸光值,绘制标准曲线,得回归方程为Y=0.114 33X+0.072 15,其中纵坐标(Y)为吸光值,横坐标(X)为没食子酸质量浓度,标准曲线R2=0.995 80,线性关系良好。根据标准曲线计算TP质量浓度,实验重复3次,计算如公式(1)所示:
(1)
式中:Y,TP提取率,%;ρ,TP质量浓度,mg/L;v,提取液的体积,mL;n,稀释倍数;m,弯萼金丝桃粉质量,g。
1.3.3 提取工艺优化
1.3.3.1 单因素试验
以TP提取率为评价指标,提取温度(A)(30、40、50、60、70、80、90 ℃)、提取时间(B)(10、20、30、40、50、60、70 min)、乙醇体积分数(C)(30%、40%、50%、60%、70%、80%、90%)、液料比(D)(20∶1、30∶1、40∶1、50∶1、60∶1、70∶1、80∶1,mL∶g)为影响因素进行单因素试验。
1.3.3.2 响应面实验设计
在单因素试验的基础上,利用Design Expert 13软件Box-Behnken优化TP提取的最佳条件,设计4因素[提取温度(A)、提取时间(B)、乙醇体积分数(C)、液料比(D)]三水平(-1、0、1)共29组实验。并对实验结果进行回归拟合,建立数学模型,进行方差分析和P值显著性检验,预测最优提取条件。响应面实验因素与水平见表1。
表1 Box-Behnken设计因素与水平
Table 1 Box-Behnken design factors and levels
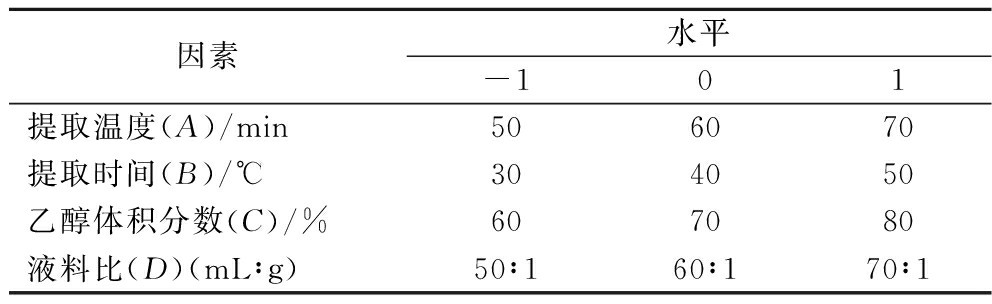
因素水平-101提取温度(A)/min506070提取时间(B)/℃304050乙醇体积分数(C)/%607080液料比(D)(mL∶g)50∶160∶170∶1
1.3.4 弯萼金丝桃TP定性定量分析
制作不同质量浓度(10.0、8.0、6.0、4.0、2.0、1.0、0.5 g/mL)混合标准曲线(原儿茶酸、丁香酸、咖啡酸、2-丙基苯-β-D-吡喃葡萄糖苷、槲皮素、儿茶素没食子酸酯、槲皮苷、柚皮素、橙皮素等)。用UPLC对弯萼金丝桃TP进行定性、定量分析。检测条件:色谱柱:ACQUITY UPLC BEH C18 Column (130 Å, 1.7 μm, 2.1 mm×100 mm);流速0.3 mL/min;柱温37 ℃;检测波长280 nm;进样量1 μL;流动相A为去离子水,流动相B为色谱甲醇;梯度洗脱(0~10 min,25%~37% B;10~45 min,37%~55% B;45~55 min,55%~75% B;55~65 min,75%~100% B;65~80 min,100% B)。
1.3.5 TP的抗氧化、降糖能力的测定
分别移取0.05、0.1、0.2、0.4、0.6、0.8、1.0 mL最佳提取工艺提取的TP,用体积分数为60%的乙醇溶液定容至25 mL,得到不同质量浓度的样品溶液,用于活性测定。
1.3.5.1 DPPH自由基清除能力
参考张慢等[12]的方法并修改,准确称取0.02 g DPPH自由基溶液,用无水乙醇稀释至0.2 mmol/L。分别移取1.3.5节中不同质量浓度样品溶液和DPPH溶液各100 μL到96孔板中,充分混匀后避光反应30 min,利用酶标仪在517 nm处测定吸光值。以等体积无水乙醇代替DPPH溶液为A对照,以等体积无水乙醇代替样品溶液为A空白,以维生素C作为阳性对照,阳性对照与样品组的质量浓度保持一致,所有样品做3组平行实验。自由基清除率的计算如公式(2)所示:
清除率![]()
(2)
1.3.5.2 ABTS阳离子自由基清除能力
参考夏雨弘等[13]的方法并修改,分别吸取等体积7 mmol/L的ABTS溶液和1.4 mmol/L过硫酸钾溶液,混匀避光反应24 h,用蒸馏水调节吸光度值为0.7±0.02获得工作液。分别移取150 μL工作液和1.3.5节中不同质量浓度样品50 μL于96孔板中,混合均匀后避光反应6 min,使用酶标仪在734 nm波长处测定吸光度值。以等体积双蒸水代替样品溶液为A空白,以等体积双蒸水代替工作液为A对照,维生素C作为阳性对照,阳性对照与样品组的质量浓度保持一致,所有样品做3组平行实验。ABTS阳离子自由基清除率的计算如公式(2)所示。
1.3.5.3 羟自由基(·OH)清除率测定
参考王莹等[14]的方法并修改,分别向试管中加入1.3.5节中不同质量浓度样品溶液、9 mmol/L的FeSO4溶液和水杨酸溶液各1 mL,摇匀静置10 min,再加入8.8 mmol/L H2O2溶液1 mL,采用紫外-可见分光光度计于510 nm处测定吸光度。以等体积蒸馏水代替H2O2溶液为A对照,等体积蒸馏水代替样品溶液为A空白,以维生素C作为阳性对照,阳性对照与样品组的质量浓度保持一致,所有样品做3组平行实验。·OH清除率的计算如公式(2)所示。
1.3.5.4 铁还原/抗氧化能力(ferric reducing antioxidant power,FRAP)测定
参考王莹等[14]的方法并修改,向试管中分别吸取1.3.5节中不同质量浓度样品溶液1 mL,PBS(pH值为6.6)和质量分数为1%的K3Fe(CN)6溶液各2.5 mL,混匀后于50 ℃水浴反应20 min,再加入体积分数为10%的三氯乙酸2.5 mL,混合均匀后3 000 r/min离心10 min,分别向各试管中取2.5 mL上清液于新试管中,再分别加入0.5 mL质量分数为0.1% FeCl3溶液、2.5 mL蒸馏水,摇匀后在700 nm处测定吸光度(所有试剂现配现用)。维生素C作为阳性对照,阳性对照与样品组的质量浓度保持一致,所有样品做3组平行实验。FRAP还原力的计算如公式(3)所示:
还原力![]()
(3)
式中:A空白,FRAP还原力吸光值;A样品,加入试样后FRAP还原力吸光值。
1.3.5.5 TP降糖能力测定
参考刘馥源[15]的方法并修改,向试管中分别加入1.3.5节中不同质量浓度的样品溶液、1.5 U/mg的α-葡萄糖苷酶溶液各0.5 mL,在37 ℃水浴反应10 min,然后加入1 mmol/L对硝基苯-α-D-吡喃葡萄糖苷(PNPG)溶液0.5 mL再反应15 min,再加2 mL 1 mol/L Na2CO3溶液混匀,用PBS定容至5 mL,沸水浴反应5 min后立即冷却,在405 nm处检测吸光度。Ai为TP、酶和PNPG混合液的吸光值,Aj为TP、缓冲液和PNPG混合液的吸光值,A0为缓冲液、酶和PNPG混合液的吸光值。阿卡波糖作为阳性对照,阳性对照与样品组的质量浓度保持一致,所有样品做3组平行实验,降糖能力的计算如公式(4)所示:
抑制率![]()
(4)
2 结果与分析
2.1 不同提取方法对弯萼金丝桃TP提取率的比较
如图1所示,不同提取方法下,弯萼金丝桃TP提取率不同,按TP提取率由多到少排序为:超声提取法>酶解法>酸解法>醇提法>热水浸提法。其中超声提取率最高为18.51%。
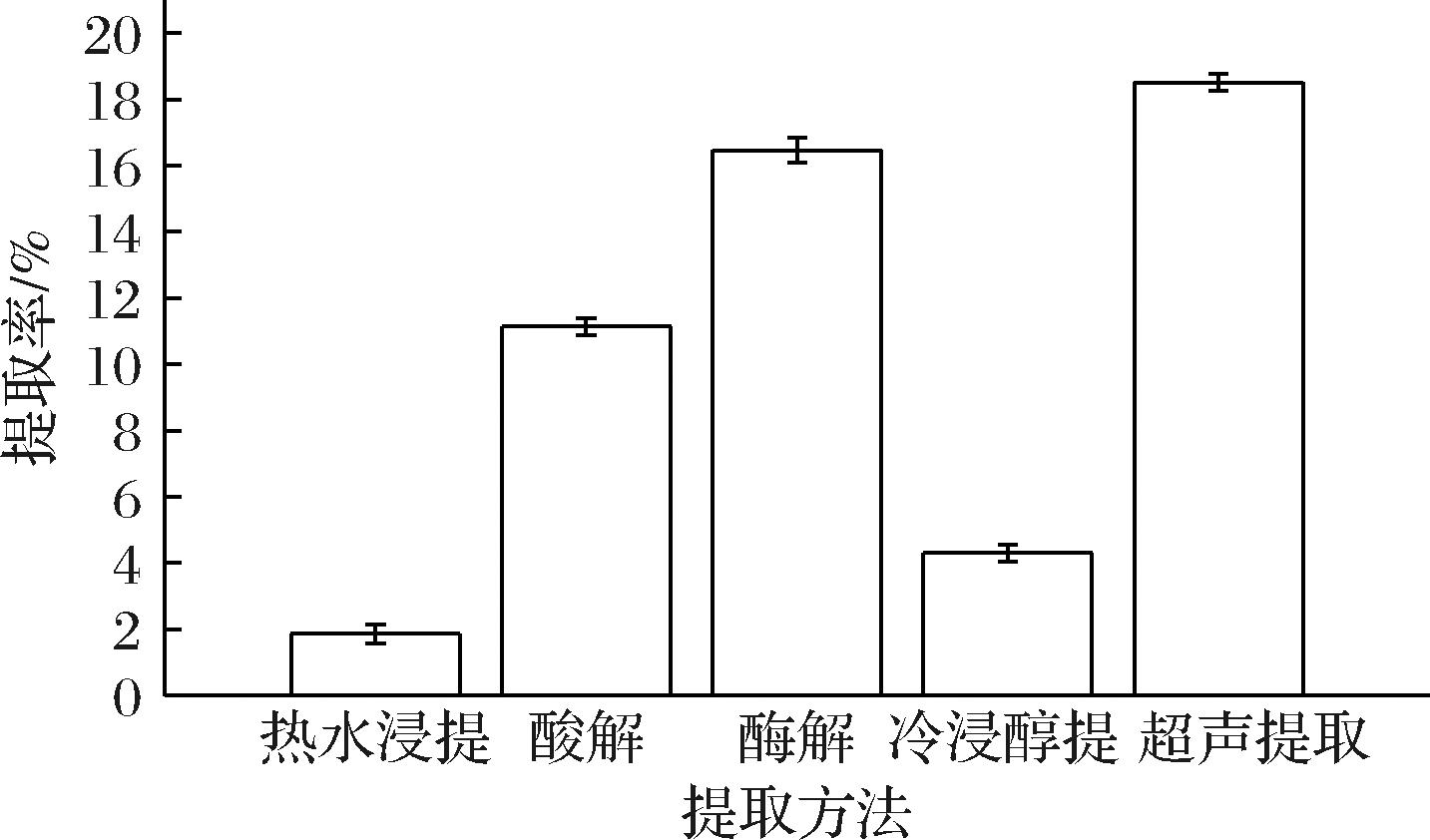
图1 不同提取方法TP提取率
Fig.1 Extraction rates of TP by different methods
2.2 提取前后弯萼金丝桃形态观察
如图2所示,与提取前样品形态相比,经不同提取方法处理后的滤渣表现出了不同的微观表征,同时引起一定程度的表面损伤。热水浸提法(图2-a)提取后的滤渣表面呈现轻微的损伤,没有显著的大裂纹,但出现了褶皱的现象。这种褶皱可能是由于细胞内化合物在传质过程中发生了收缩所导致的[16]。冷浸醇提(图2-b)与提取前滤渣相比表面形态无明显差异,酸解法(图2-c)破坏细胞壁,使细胞内物质外泄,团块状消失不见,细胞表面皱缩,细胞内的蛋白质发生变性,生成沉淀,因此表面出现较多不规则块状颗粒。纤维素酶酶解(图2-e)后细胞破裂,细胞内的物质流出,团块状消失不见,细胞表面皱缩。超声波萃取(图2-f)后的残渣表层褶皱程度明显增大,原料结构破裂得更彻底,主要由于超声波损伤了样品表面细胞壁,细胞内的产物更好地溶于乙醇溶液,直观地表明超声波萃取法能够促进细胞内酚类化合物的溶出与释放。通过比较弯萼金丝桃粉末在不同提取条件下形态图对比分析,使用超声提取其微观结构差异明显,这说明超声提取对弯萼金丝桃TP的提取具有较好的效果,与2.1节结果一致。

a-热水浸提;b-冷浸醇提;c-酸解法;d-未提取;e-酶解法;f-超声提取
图2 弯萼金丝桃残渣的扫描电镜图
Fig.2 SEM photographs of H.curvisepalum residue
2.3 单因素试验
2.3.1 提取温度
如图3-a所示,TP的提取率随温度升高呈先升后降趋势。升高温度,分子运动速率加快[17],细胞壁软化程度增大,细胞膜的通透性改变,促进胞内酚类物质溶出,从而提高TP提取率。当温度达到60 ℃时,TP提取率最大为19.15%,但温度过高会导致溶液中杂质溶出量增加、部分多酚类物质分解或变性[18],并且乙醇挥发,使多酚类物质无法稳定溶出,导致提取率降低。
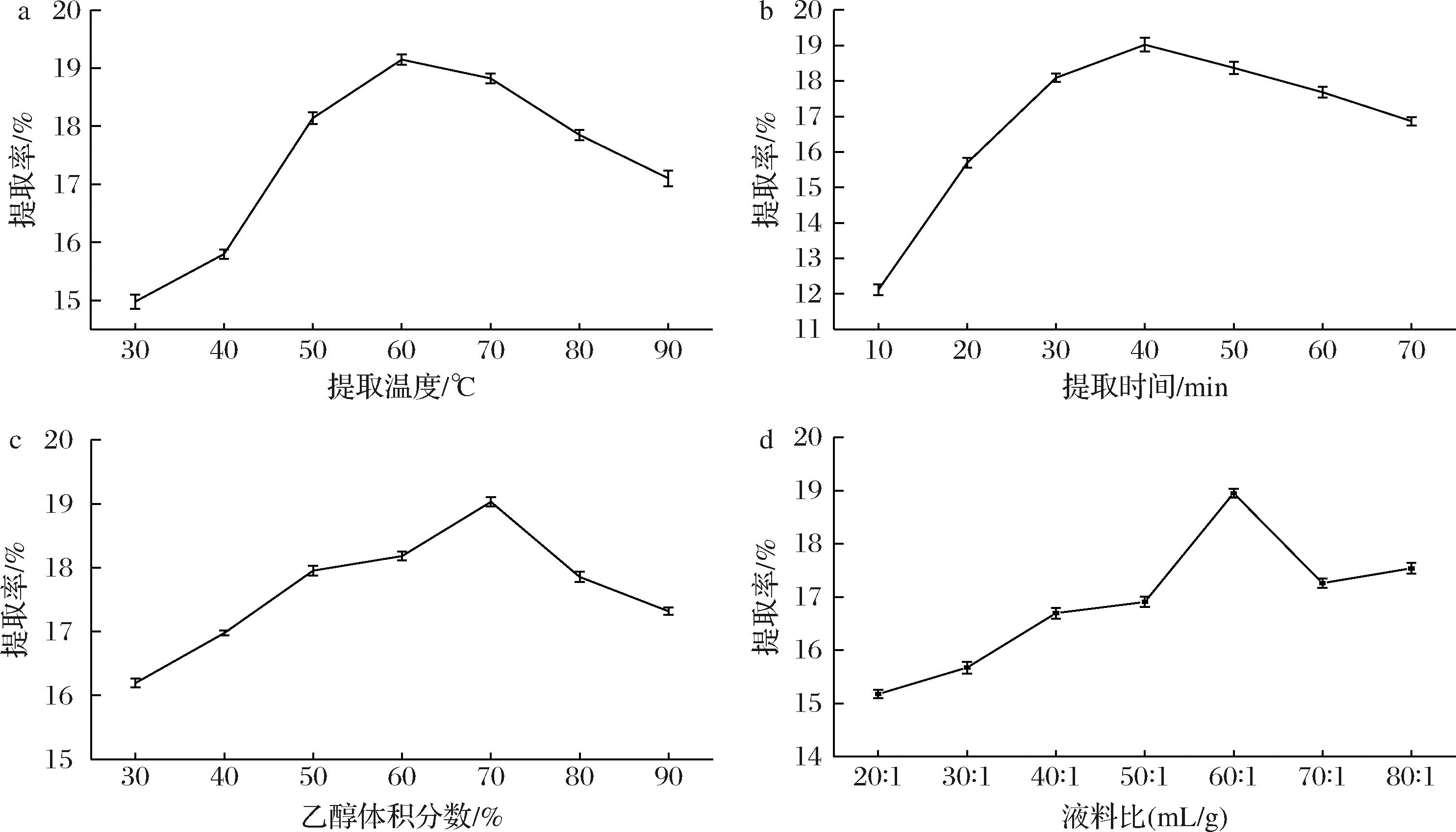
a-提取温度;b-提取时间;c-乙醇体积分数;d-液料比
图3 单因素对TP提取率的影响
Fig.3 Effect of single factor on the extraction rate of TP
2.3.2 提取时间
如图3-b所示,TP提取率随着提取时间的延长呈先上升后降的趋势,当提取时间达到40 min时,TP提取率最大为19.02%,当提取时间过大时,TP溶出已达饱和,其他杂质相继溶出导致提取率下降[19]。
2.3.3 乙醇体积分数
如图3-c所示,TP提取率随着乙醇体积分数的增加呈先增加后降低趋势,当乙醇体积分数达到70%时,TP的提取率最高为19.03%。可能是TP类物质中部分结合肽多酚与植物蛋白质结合形成结合肽存在于植物体内,当乙醇体积分数过高时,蛋白质变性变质,阻碍TP物质向溶剂中扩散[20]。
2.3.4 液料比
如图3-d所示,TP提取率随着液料比的增加呈先增加后降低趋势,当液料比为60∶1(mL∶g)时,溶液中TP含量达到饱和,此时TP提取率最高为18.95%,继续增大液料比后TP提取率整体呈不规整降低趋势,其原因可能是继续增加提取液使更多的醇溶性杂质溶出,酚类浓度减小,导致提取率降低。
2.4 响应面优化TP提取工艺
2.4.1 响应面实验分析
根据单因素试验结果,选取提取温度(A)、提取时间(B)、乙醇体积分数(C)、液料比(D)对多酚提取率影响显著的因素进行4因素3水平响应面实验,结果见表2。通过Design-Expert 13软件对表3进行拟合,得到回归方程:Y=19.646 9+0.023 083 3A+1.286B-1.246 5C-0.980 583D+1.330 25AB-0.038AC+0.225 75AD+0.368BC+0.441 344BD+0.142 25CD-0.803 96A2-0.759 724B2-1.575 84C2-1.094 85D2。
表2 响应面实验设计与结果
Table 2 Response surface experimental design and results
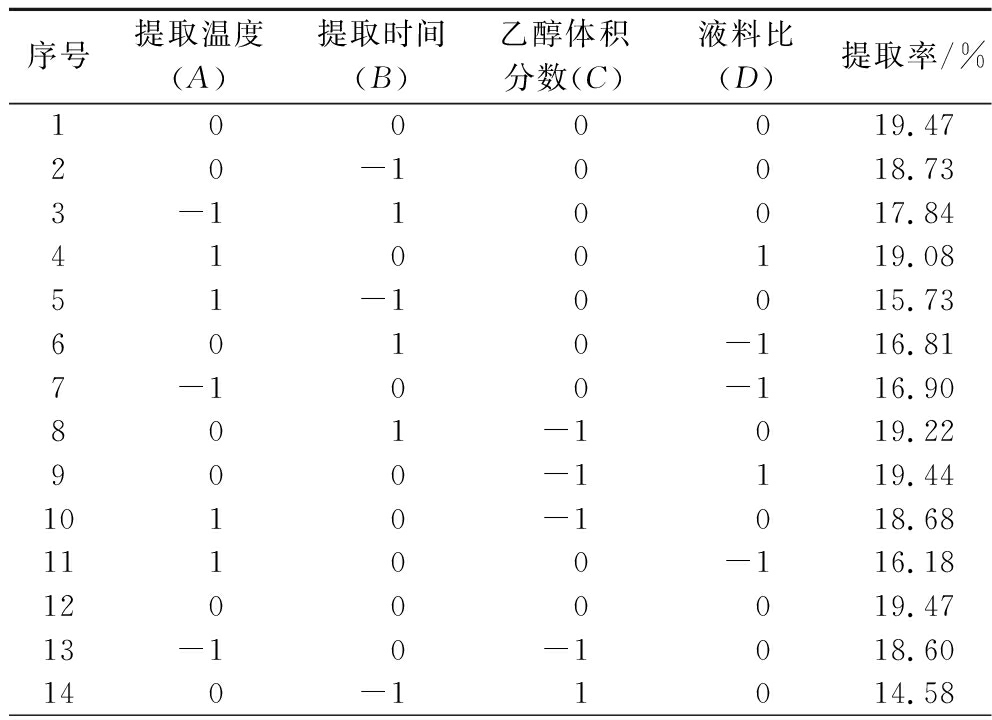
序号提取温度(A)提取时间(B)乙醇体积分数(C)液料比(D)提取率/%1 0 0 0 019.4720-10018.733-110017.844100119.0851-10015.736010-116.817-100-116.90801-1019.22900-1119.441010-1018.6811100-116.1812000019.4713-10-1018.60140-11014.58
续表2
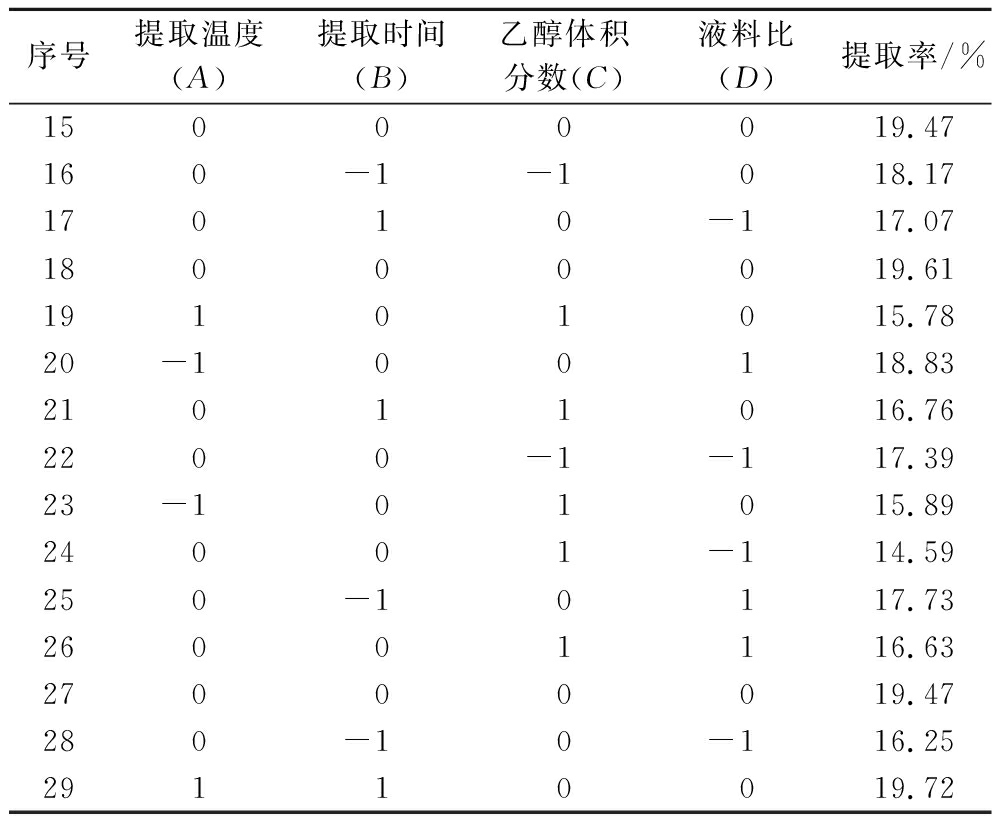
序号提取温度(A)提取时间(B)乙醇体积分数(C)液料比(D)提取率/%15000019.47160-1-1018.1717010-117.0718000019.6119101015.7820-100118.8321011016.762200-1-117.3923-101015.8924001-114.59250-10117.7326001116.6327000019.47280-10-116.2529110019.72
2.4.2 响应面回归模型方差分析
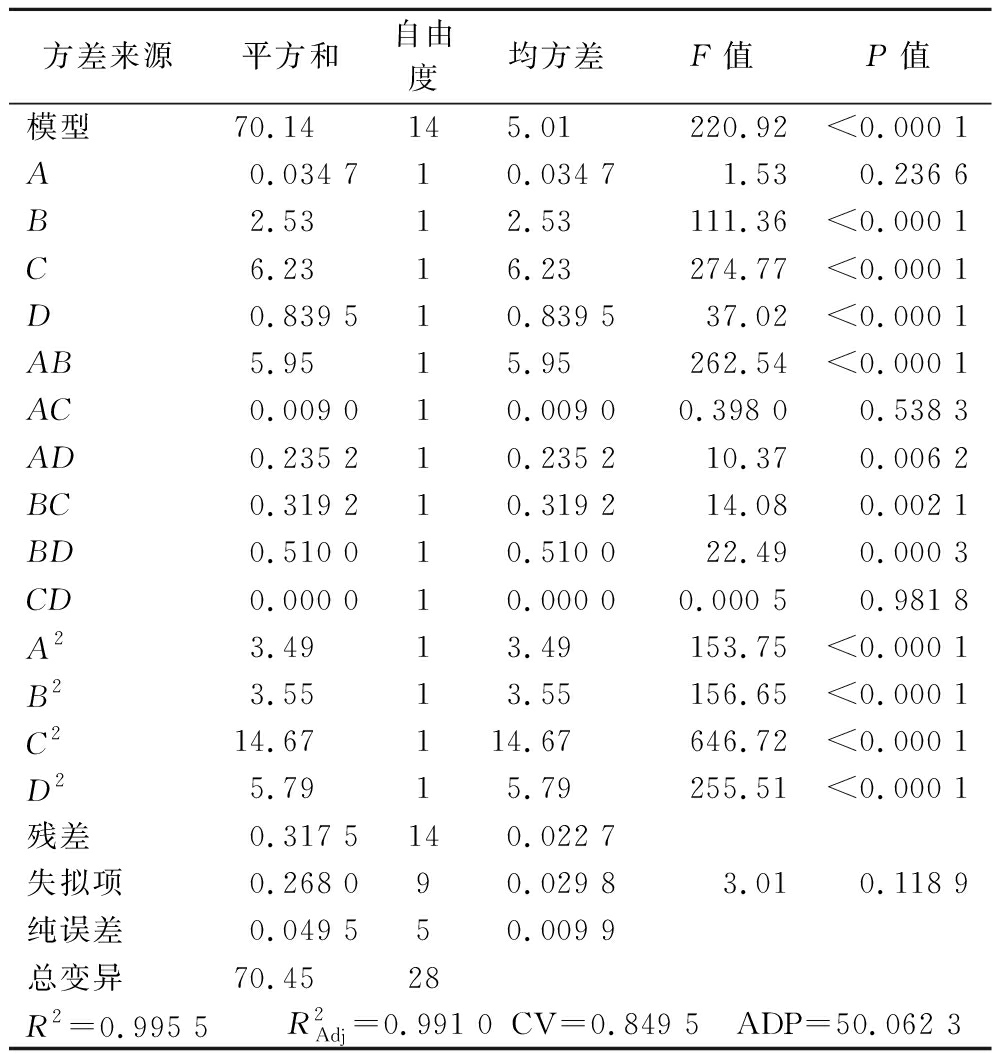
表3为Design-Expert 13软件进行方差分析结果。由表可知,模型极显著(P<0.000 1),失拟项P=0.118 9>0.05,不显著,表明实验数据和模型较为符合,误差较小,实验较可靠[21]。由F值大小可知,各因素对TP提取率影响顺序大小为C(乙醇体积分数)>B(提取时间)>D(液料比)>A(提取温度)。
表3 回归模型的方差分析
Table 3 Analysis of variance for regression models
方差来源平方和自由度均方差F值P值模型70.14 145.01 220.92<0.000 1A0.034 710.034 71.530.236 6B2.5312.53111.36<0.000 1C6.2316.23274.77<0.000 1D0.839 510.839 537.02<0.000 1AB5.9515.95262.54<0.000 1AC0.009 010.009 00.398 00.538 3AD0.235 210.235 210.370.006 2BC0.319 210.319 214.080.002 1BD0.510 010.510 022.490.000 3CD0.000 010.000 00.000 50.981 8A23.4913.49153.75<0.000 1B23.5513.55156.65<0.000 1C214.67114.67646.72<0.000 1D25.7915.79255.51<0.000 1残差0.317 5140.022 7失拟项0.268 090.029 83.010.118 9纯误差0.049 550.009 9总变异70.4528R2=0.995 5R2Adj=0.991 0CV=0.849 5ADP=50.062 3
注:差异极显著,P<0.01;差异显著,P<0.05。
表3列出了TP提取率的拟合二次多项式模型的方差分析(ANOVA)。失拟项F值为220.92,且P<0.000 1,表明该模型达到极显著水平[22]。模型的相关系数R2=0.995 5,表示模型能够解释响应值的99.55%变化。![]() 表明模型对数据的拟合和预测能力较好,并且观测数据与预测数据之间的关联性较高。表3中CV值为0.849 5%,表明模型具有较好的精确度和可靠性。精密度值ADP值为50.062 3,远高于4.0。说明Box-Behnken是优化TP提取率的理想模型。
表明模型对数据的拟合和预测能力较好,并且观测数据与预测数据之间的关联性较高。表3中CV值为0.849 5%,表明模型具有较好的精确度和可靠性。精密度值ADP值为50.062 3,远高于4.0。说明Box-Behnken是优化TP提取率的理想模型。
2.4.3 响应面分析
从图4可知,响应面图均为凸起的曲面,说明提取率随自变量,提取温度(A)、提取时间(B)、乙醇体积分数(C)和液料比(D)的增加呈先增后减的趋势。由图4-a、图4-b可知,随着提取时间不断延长,TP提取率逐渐增加,但提取率增幅较小,而随着乙醇体积分数不断增大,TP提取率增幅较大,表明乙醇体积分数与提取温度交互作用更为明显。由图4-c、图4-e可知,随着温度不断增加,TP提取率逐渐增加,但增幅较小,而随时间的不断增加,总提取率增幅较大,表明时间与液料比相互作用更明显。由图4-d、图4-f可知,BC、CD交互作用的等高线图均为椭圆形,但BD交互作用更显著,与方差分析结果一致。

a-提取时间与提取温度;b-乙醇体积分数与提取温度;c-液料比与提取温度;d-乙醇体积分数与提取时间;e-液料比与提取时间;f-液料比与乙醇体积数
图4 实验因素对TP提取率的响应面图
Fig.4 Response surface plot of the extraction rate of TP in response to various experimental factors
2.4.4 取参数的优化和模型的验证
通过Design-Expert 13软件得到最优工艺条件为:提取温度(A)62.41 ℃、提取时间(B)47.60 min、乙醇体积分数(C)67.17%、液料比(D)64.23∶1,模型预测的TP提取率为20.16%,考虑到实验操作可行性,将其修改为提取温度(A)62 ℃、提取时间(B)48 min、乙醇体积分数(C)67%、液料比(D)64∶1。3次平行试验后,测定TP提取率为(19.78±0.03)%,与模型预测值接近(误差为0.15%),表明模型稳定可靠。
2.5 弯萼金丝桃TP定性定量分析
通过UPLC对弯萼金丝桃中TP物质进行定性定量分析,结果如图5和表4所示。从弯萼金丝桃TP中鉴定出9种主要的多酚类化合物,分别为原儿茶酸、咖啡酸、槲皮素、2-丙基苯-β-D-吡喃葡萄糖苷、丁香酸、儿茶素没食子酸酯、槲皮苷、柚皮素、橙皮素。弯萼金丝桃中含量最高的TP化合物为槲皮素、原儿茶酸和咖啡酸,分别为4.725、2.745、1.064 mg/g。槲皮素可通过清除活性氧自由基、减少氧化损伤、抑制相关酶活性等机制实现抗氧化活性[23],也可通过血清DPP-IV靶向作用显著改善胰岛素敏感性,从而起到降血糖作用[24]。咖啡酸也具有类似的作用,包括清除自由基、促进自噬作用、抑制炎症反应等[25]。橙皮素不仅能够有效抑制幽门螺杆菌的生长,还能抑制幽门螺杆菌的复制、转录和表达[26]。槲皮苷含量虽少,但其能够显著改善原发性糖尿病大鼠的体脂量和空腹血糖水平,同时提高空腹C肽水平,改善糖耐量异常[27]。因此,弯萼金丝桃中TP是重要的生物活性成分来源,在药品、保健品、护肤品等领域发挥着重要的作用。

图5 TP的液相色谱图
Fig.5 HPLC chromatogram of TP
表4 TP中各化合物含量
Table 4 Content of various compounds in TF

编号成分出峰时间/min回归方程相关系数(R2)含量/(mg/g)1原儿茶酸3.927y=0.037 845 6x+124.3130.999 22.7452咖啡酸34.834y=0.009 543 7x+95.372 20.999 71.0643槲皮素38.366y=0.123 258 4x+323.4900.999 84.72542-丙基苯-β-D-吡喃葡萄糖苷42.476y=0.003 987 2x+87.255 10.999 50.6455丁香酸44.224y=0.002 754 6x+59.237 40.999 40.5976儿茶素没食子酸酯45.327y=0.065 544 5x+44.754 30.999 60.5437槲皮苷50.784y=0.058 438 2x+39.256 50.999 80.4278柚皮素55.107y=0.034 645 8x+27.354 50.999 50.5519橙皮素62.947y=0.084 538 4x+97.438 40.999 10.557
2.6 TP抗氧化能力分析
通过最佳提取工艺条件提取TP,测定其吸光度,并按照1.3.2节中公式(1)计算出提取液的质量浓度为10.650 6 mg/L,按1.3.5节方法稀释后,得用于测定活性的样品质量浓度分别为0.021 3、0.042 6、0.085 2、0.170 4、0.255 6、0.340 8、0.426 0 mg/L。
2.6.1 TP对DPPH自由基清除能力分析
如图6-a所示,TP和维生素C对DPPH自由基清除能力,在实验范围内与质量浓度呈正相关,当质量浓度为0.426 0 mg/L时,弯萼金丝桃TP和维生素C对DPPH自由基清除能力最强,分别为90.8%和96.03%。表明TP具有一定的DPPH自由基清除能力,但效果低于维生素C。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-·OH清除率;d-还原率
图6 TP和维生素C对DPPH自由基、ABTS阳离子自由基、·OH清除能力及总还原力
Fig.6 Scavenging abilities of TP on DPPH free radicals, ABTS cationic radical, and ·OH, and total reducing power
2.6.2 TP对ABTS阳离子自由基清除能力分析
如图6-b所示,维生素C具有极强的ABTS阳离子自由基清除能力,在实验测定浓度范围内,清除率均接近于100%。TP的ABTS阳离子自由基的清除能力随着浓度的增加逐渐递增,但始终低于维生素C的清除能力,当质量浓度为0.426 0mg/L时,TP的ABTS阳离子自由基清除率达到73.91%。
2.6.3 TP对·OH清除能力分析
如图6-c所示,TP的清除率随着质量浓度的增加逐步递增,并最终趋于平稳。当质量浓度为0.426 0 mg/L时,TP的·OH清除率达到60.73%。与之相比,维生素C的·OH清除能力在不同质量浓度下变化不明显,最高清除率达到98.37%。
2.6.4 TP还原力能力分析
如图6-d所示,当质量浓度在0.021 3~0.462 0 mg/L时,TP和维生素C的还原力随着质量浓度的增加逐步递增,最终趋于平稳。表明TP具有较好的还原力,但与维生素C相比还存在一定差距。
2.7 TP体外降血糖能力分析
由图7可知,TP对α-葡萄糖苷酶抑制率随着质量浓度增加而增大。当质量浓度为0.170 4 mg/L时,TP和阿卡波糖的α-葡萄糖苷酶抑制率十分接近,这说明TP具有较强的降血糖能力,在质量浓度为0.426 0 mg/L时,TP的α-葡萄糖苷酶抑制率达到98%,高于阿卡波糖对α-葡萄糖苷酶的抑制。
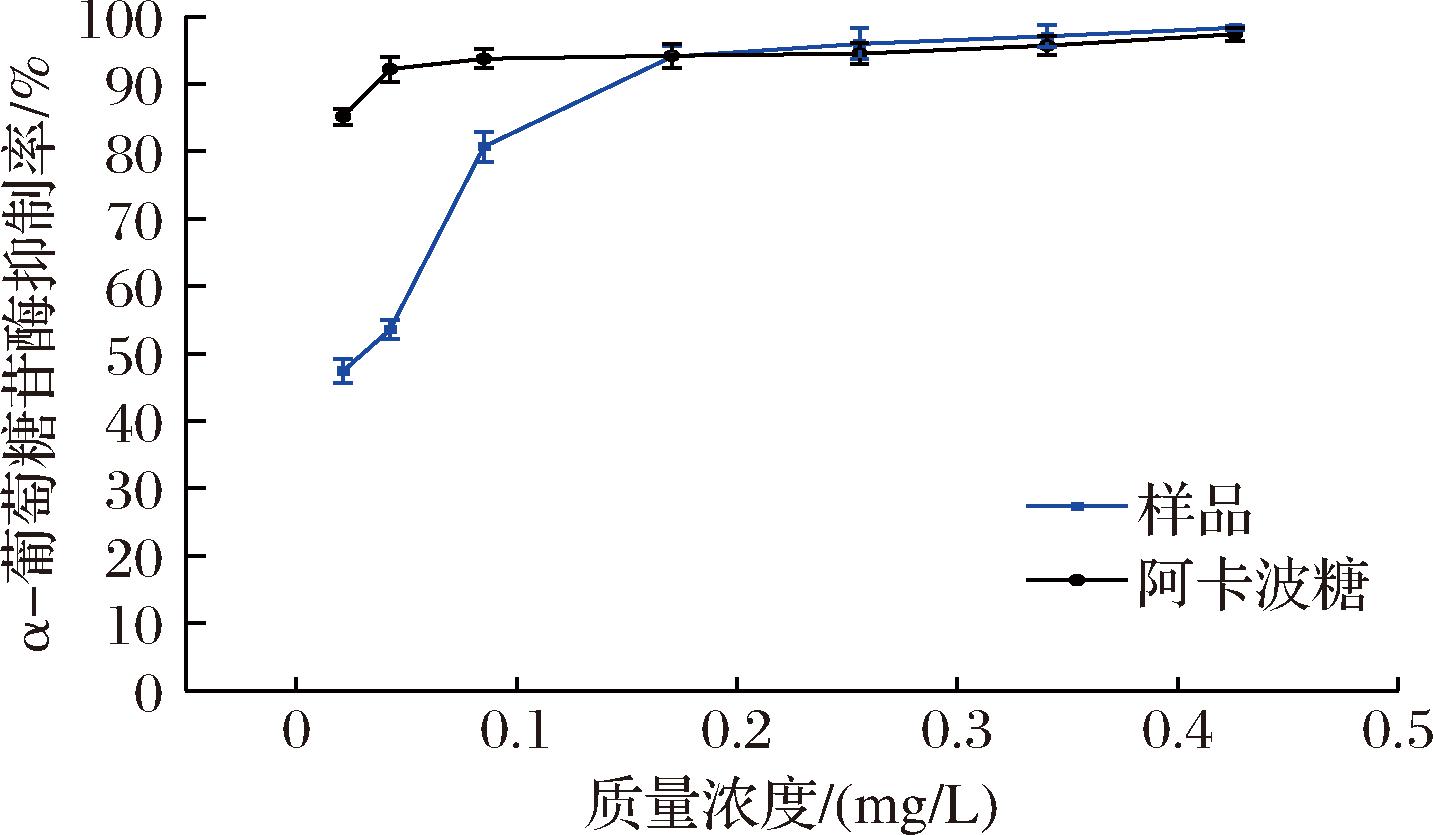
图7 TP对α-葡萄糖苷酶的抑制
Fig.7 Inhibition of α -glucosidase by TP of H.curvisepalum
3 结论与讨论
5种提取工艺中超声提取TP提取率最高。本研究获得的超声提取TP的最佳工艺条件为:提取温度(A)62 ℃、提取时间(B)48 min、乙醇体积分数(C)67%和液料比(D)64∶1(mL∶g),TP提取率为(19.78±0.03)%,与理论预测值(20.16%)接近,表明模型稳定可靠。
UPLC鉴定出9种主要多酚苷元,分别是原儿茶酸、咖啡酸、槲皮素、2-丙基苯-β-D-吡喃葡萄糖苷、丁香酸、儿茶素没食子酸酯、槲皮苷、柚皮素、橙皮素,其中槲皮素(4.725 mg/g)含量最高。抗氧化实验结果表明,TP具有良好的抗氧化活性,但始终低于维生素C,在一定质量浓度范围内,抗氧化活性与TP的质量浓度呈剂量依赖性关系,当TP质量浓度为0.046 2 mg/L时,对DPPH、ABTS阳离子和·OH的清除率分别为90.81%、73.91%、60.73%,并且具有一定还原能力。此外,在体外降糖实验中,当质量浓度为0.170 4 mg/L时,TP和阿卡波糖的α-葡萄糖苷酶抑制率十分接近,在质量浓度为0.426 0 mg/L时,TP的α-葡萄糖苷酶抑制率达到98%,高于阿卡波糖对α-葡萄糖苷酶的抑制,表明TP具有较强的降糖活性。
综上所述,超声提取能够显著提高TP提取率,TP是抗氧化剂和降血糖剂的潜在药物来源,本研究可为弯萼金丝桃在医药等领域高值化产品的开发提供科学依据。
[1] 李玲玲, 刘雪, 邱泽天, 等.植物多酚的微生物合成[J].生物工程学报, 2021, 37(6):2050-2076.LI L L, LIU X, QIU Z T, et al.Microbial synthesis of plant polyphenols[J].Chinese Journal of Biotechnology, 2021, 37(6):2050-2076.
[2] 李颖畅. 植物多酚类化合物及其应用[M].北京:化学工业出版社, 2021.LI Y C.Polyphenolic Compounds From Plants and Their Applications[M].Beijing:Chemical Industry Press, 2021.
[3] 时文盼. 弯萼金丝桃间苯三酚衍生物及其抑菌活性研究[D].阿拉尔:塔里木大学, 2020.SHI W P.Research on phloroglucinol derivatives and their antibacterial activity of Hypericum curvisepalum[D].Alaer:Tarim University, 2020.
[4] ZHOU Z B, SHI W P, ZENG H, et al.Two new polycyclic polyprenylated acylphloroglucinols from Hypericum curvisepalum N.Robson[J].Phytochemistry Letters, 2022, 48:43-46.
[5] 何秋映. 弯萼金丝桃氧杂蒽酮类分离鉴定及抑制群感效应活性研究[D].阿拉尔:塔里木大学, 2022.HE Q Y.Study on the separation and identification of xanthones from Hypericum curvisepalum and their quorum sensing inhibiting activity[D].Alaer:Tarim University, 2020.
[6] HE Q Y, ZENG H, ZHANG Q L, et al.Cytotoxic phenyl polyketides from Hypericum curvisepalum N.Robson[J].Natural Product Research, 2023, 37(22):3815-3820.
[7] 孙明霞, 王雪, 李晓秀, 等.弯萼金丝桃的化学成分研究[J].中国中药杂志, 2021, 46(15):3859-3864.SUN M X, WANG X, LI X X, et al.Chemical constituents from Hypericum curvisepalum[J].China Journal of Chinese Materia Medica, 2021, 46(15):3859-3864.
[8] YE Y S, LIU R, JIANG N N, et al.Caged polycyclic polyprenylated acylphloroglucinols as Cav 3.2 low voltage-gated Ca2+ channel inhibitors from Hypericum curvisepalum[J].Chemical Communications, 2022, 58(94):13135-13138.
[9] 王钊, 李长滨, 李凤娇, 等.酸法提取黑蒜多酚及抗氧化性研究[J].中国食品添加剂, 2021, 32(10):15-22.WANG Z, LI C B, LI F J, et al.Acid extraction and antioxidant activity of black garlic polyphenol[J].China Food Additives, 2021, 32(10):15-22.
[10] 谢勇, 郑佳颖, 孙昕, 等.响应面法优化茉莉花茶酶解提取茶多酚工艺研究[J].福建农业科技, 2022, 53(11):17-23.XIE Y, ZHENG J Y, SUN X, et al.Process optimization of enzymatic extraction of tea polyphenols from jasmine scented tea by response surface methodology[J].Fujian Agricultural Science and Technology, 2022, 53(11):17-23.
[11] 李晓强, 胡坤, 龚玉石, 等.不同产地、不同提取方法对余甘子多酚含量及抗氧化活性的影响[J].食品工业科技, 2023, 44(2):317-323.LI X Q, HU K, GONG Y S, et al.Effects of different producing areas and extraction methods of polyphenols from Phyllanthus emblica L[J].Science and Technology of Food Industry, 2023, 44(2):317-323.
[12] 张慢, 邢苏徽, 千春录, 等.7种食用菌的营养成分及抗氧化性分析[J].食品科技, 2022, 47(6):120-126.ZHANG M, XING S H, QIAN C L, et al.Analysis of the nutritional components and antioxidant properties of seven species of edible mushrooms[J].Food Science and Technology, 2022, 47(6):120-126.
[13] 夏雨弘, 刘颖, 周茗, 等.小二仙草总黄酮提取工艺的优化及其抗氧化活性分析[J].食品工业科技, 2023, 44(18):244-250.XIA Y H, LIU Y, ZHOU M, et al.Extraction process optimization and antioxidant activity of total flavonoids from Haloragis micrantha (Thunb.) R.brown[J].Science and Technology of Food Industry, 2023, 44(18):244-250.
[14] 王莹, 朱鑫燕, 曾祥辉, 等.响应面法优化迷迭香脂溶性抗氧化成分提取工艺及抗氧化活性研究[J].中国食品添加剂, 2022, 33(11):148-154.WANG Y, ZHU X Y, ZENG X H, et al.Optimization of extraction technology and antioxidant activity of lipid-soluble antioxidant components from Rosmarinus officinalis by response surface methodology[J].China Food Additives, 2022, 33(11):148-154.
[15] 刘馥源. 香菇多酚提取工艺、生物活性及残渣利用研究[D].南昌:江西农业大学,2021.LIU F Y.Study on extraction technology, biological activity of lentinus edodes polyphenols and residue utilization[D].Nanchang:Jiangxi Agricultural University, 2021.
[16] 陈雁, 胡文忠, 侯梦阳, 等.雪莲果皮多酚提取工艺及其抗氧化、抑菌活性的研究[J].食品科技, 2022, 47(1):219-225.CHEN Y, HU W Z, HOU M Y, et al.Extraction optimization, evaluation of antioxidant and antibacterial activities of polyphenols from Smallanthus sonchifolius peel[J].Food Science and Technology, 2022, 47(1):219-225.
[17] 郑佳, 王军茹, 张根生, 等.花楸果多酚物质提取及抗氧化性的研究[J].中国林副特产, 2023(1):9-14.ZHENG J, WANG J R, ZHANG G S, et al.Extraction technology and its oxidantion resistance of polyphenols of rowan fruit[J].Forest by-Product and Speciality in China, 2023(1):9-14.
[18] 李晓君, 张梅, 张建丰, 等.小米糠多酚提取工艺的研究[J].中国粮油学报, 2021, 36(5):43-49.LI X J, ZHANG M, ZHANG J F, et al.The extraction technology of polyphenols from millet bran[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(5):43-49.
[19] 崔巧玉, 沈雯娟, 孙小璐, 等.郁金香总多酚提取工艺优化及其抗氧化活性研究[J].中成药, 2022, 44(6):1918-1922.CUI Q Y, SHEN W J, SUN X L, et al.Study on extraction technology and antioxidant activity of total polyphenols from Tulipa gesneriana L[J].Chinese Traditional Patent Medicine, 2022, 44(6):1918-1922.
[20] 赵珂, 程守前, 刘小双, 等.番木瓜叶多酚提取工艺的优化及抗氧化活性研究[J].食品与药品, 2023, 9(2):109-114.ZHAO K, CHENG S Q, LIU X S, et al.Research on optimization of extraction technology and antioxidant activity of polyphenols from Papaya leaves[J].Food and Drug, 2023, 9(2):109-114.
[21] GHASEMZADEH A, JAAFAR H Z E, RAHMAT A, et al.Optimization of microwave-assisted extraction of zerumbone from Zingiber zerumbet L.rhizome and evaluation of antiproliferative activity of optimized extracts[J].Chemistry Central Journal, 2017, 11:5.
[22] 朱芙蓉, 王霜秀, 毛德源, 等.超声辅助提取芒果核中芒果苷的工艺优化[J].食品工业科技, 2024, 45(2):161-167.ZHU F R, WANG S X, MAO D Y, et al.Optimization of ultrasound assisted extraction of mangiferin in mango(Mangifera indica L.)kernel[J].Science and Technology of Food Industry, 2024, 45(2):161-167.
[23] 王亚茹, 袁满, 张丽, 等.槲皮素抗氧化作用及相关机制研究进展[J].营养学报, 2022, 44(2):204-208.WANG Y R, YUAN M, ZHANG L, et al.Research progress on antioxidant actions and related mechanisms of quercetin[J].Acta Nutrimenta Sinica, 2022, 44(2):204-208.
[24] ZHANG L, PAN M Y, LI T, et al.Study on optimal extraction and hypoglycemic effect of quercetin[J].Evidence-Based Complementary and Alternative Medicine:ECAM, 2023, 2023:8886503.
[25] 赖睿, 刘淇, 李吻吻, 等.咖啡酸对糖尿病肾病的保护作用及其机制研究进展[J].海南医学, 2022, 33(10):1338-1342.LAI R, LIU Q, LI W W, et al.Research progress on protective effect and mechanism of caffeic acid in the treatment of diabetic nephropathy[J].Hainan Medical Journal, 2022, 33(10):1338-1342.
[26] KIM H W, WOO H J, YANG J Y, et al.Hesperetin inhibits expression of virulence factors and growth of Helicobacter pylori[J].International Journal of Molecular Sciences, 2021, 22(18):10035.
[27] 汤小平, 施宁川, 丁志山, 等.槲皮苷对原发性糖尿病大鼠血糖的作用研究[J].中国药师, 2016, 19(8):1449-1451;1454.TANG X P, SHI N C, DING Z S, et al.Effect of quercitrin on blood sugar of rats with primary diabetes[J].China Pharmacist, 2016, 19(8):1449-1451;1454.