牛乳富含蛋白质、脂肪、糖类和矿物质等营养组分[1]。蛋白质占比约3.5%(质量分数,下同),在营养方面具有重要作用,影响牛乳的起泡性、复溶性与稳定性[2],是牛乳最重要的组分。牛乳主要碳水化合物是3.6%~5.5%含量的乳糖[3],摄入后被乳糖酶水解为单糖后由肠道吸收进入血液,缺乏乳糖酶人群摄入乳糖会引发肠鸣、腹痛和腹泻等乳糖不耐症状[4]。
随着科技的发展及消费需求的提升,牛乳的运输、贮存、脱敏及标准化等是乳制品行业的研究热门。牛乳蛋白浓缩物(milk protein concentrate,MPC)是浓缩牛乳获得的高浓度蛋白溶液,可降低运输成本、延长保质期并浓缩营养组分[5]。浓缩过程中降低乳糖浓度可生产无乳糖MPC,去除乳糖可有效避免乳制品引起的乳糖不耐或婴幼儿过敏等症状[6]。传统的MPC制备方法主要包括以加热蒸发为机理的闪蒸法[7]、单效蒸发法[8]和多效蒸发法等[9],虽能有效提高蛋白浓度,但具有高能耗、蛋白质变性[10]、无法同时去除乳糖[11]等缺陷。传统无乳糖产品是以添加乳糖酶为基础生产的,通过酶解反应将乳糖分解为单糖,工艺复杂且对牛乳的风味有不良影响[12]。
膜技术操作简单、成本低、无污染、无相变且条件温和,符合食品加工的要求。超滤分离技术以孔径筛分为机理,可在去除乳糖的同时实现牛乳浓缩,以脱脂乳为原料制备无乳糖MPC[13]。目前关于超滤膜制备无乳糖MPC的研究主要集中在降低乳糖浓度、提高蛋白含量和提高分离效率等方面[14]。IB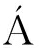
 EZ等[15]通过超滤浓缩牛乳以控制MPC中的乳糖含量用于乳制品组分的标准化,研究表明通过将MPC的乳糖与蛋白质的质量比降至0.9可有效改善乳制品的感官与物理性能。PURI等[16]研究了超滤脱脂乳在5、20和50 ℃操作温度下的产品性能与分离效率,结果表明在50 ℃操作温度下膜通量最高,但与5和20 ℃相比膜污染更为严重。GAVAZZI-APRIL等[17]使用卷式有机超滤膜生产MPC并研究了分离精度为10 kDa和50 kDa的超滤膜对膜污染程度的影响,研究表明2种分离精度的平均通量一致,而分离精度为10 kDa的超滤膜选择性更高,最终选定分离精度为10 kDa的超滤膜生产MPC。
EZ等[15]通过超滤浓缩牛乳以控制MPC中的乳糖含量用于乳制品组分的标准化,研究表明通过将MPC的乳糖与蛋白质的质量比降至0.9可有效改善乳制品的感官与物理性能。PURI等[16]研究了超滤脱脂乳在5、20和50 ℃操作温度下的产品性能与分离效率,结果表明在50 ℃操作温度下膜通量最高,但与5和20 ℃相比膜污染更为严重。GAVAZZI-APRIL等[17]使用卷式有机超滤膜生产MPC并研究了分离精度为10 kDa和50 kDa的超滤膜对膜污染程度的影响,研究表明2种分离精度的平均通量一致,而分离精度为10 kDa的超滤膜选择性更高,最终选定分离精度为10 kDa的超滤膜生产MPC。
目前国内膜法浓缩牛乳主要使用陶瓷或有机超滤膜。施正学等[18]利用膜分离技术结合酶水解法,以最高6 L/(m2·h)的通量制备了总蛋白质产率92%、乳糖浓度为9.1 g/L的低乳糖牛乳。叶俊华[19]设计了纳滤/超滤组合膜系统对牛乳组分进行优化,以6.14 L/(m2·h)的通量实现了44%的脱乳糖率及61%的Na+、K+脱除率。吴士业等[20]使用陶瓷超滤膜制备低乳糖乳粉的预浓缩液,在优化的工艺参数下以12.29%的乳糖截留率、92.5%的蛋白截留率制备了低乳糖牛乳蛋白浓缩物。
为提高无乳糖MPC的生产效率和产品质量,本研究采用分离精度为10 kDa的聚醚砜(polyethersulfone,PES)中空纤维超滤膜以脱脂乳为原料制备无乳糖MPC,研究了洗滤模式与操作条件对分离效率与产品性能的影响,优化了超滤制备无乳糖MPC的工艺路线与操作参数。
1 实验部分
1.1 实验试剂与设备
脱脂牛乳,内蒙古蒙牛乳业股份有限公司;四水合酒石酸钾钠、ZnSO4、Ba(OH)2、次甲基蓝、甲醇、次氯酸钠,均为分析纯,天津市科密欧化学试剂有限公司;乳糖,分析纯,上海玻尔化学试剂有限公司;SDS-PAGE凝胶试剂盒,江苏凯基生物技术股份有限公司;蛋白质分子质量标准品、2×蛋白质电泳上样缓冲液、考马斯亮蓝R-250 染液,北京天根生化科技有限公司;三羟甲基氨基甲烷,分析纯,上海阿拉丁生化科技股份有限公司。
TU-1901型紫外可见分光光度计,北京普析通用仪器有限责任公司;FA2204B型分析天平,上海精密科学仪器有限公司;pHS-3C型pH计,梅特勒-托利多集团;101型电热恒温干燥箱,余姚市亚泰仪表有限公司;WT600-2J-A型蠕动泵驱动器,保定兰格恒流泵有限公司;H1850型台式高速离心机,长沙市湘仪离心机仪器有限公司;Tanon-1600型凝胶成像仪,上海天能科技有限公司;JY600C型电泳仪,北京君意东方电泳设备有限公司;DDBJ-350型便携式电导率仪,上海欧史拓尔实业有限公司。
1.2 超滤分离系统
1.2.1 PES中空纤维超滤膜组件
本研究采用实验室自制PES中空纤维超滤膜组件如图1所示,具体制作方法为:取PES中空纤维超滤膜丝套入膜组件管,两端黏合于树脂底座露出中空纤维膜内孔。膜组件参数如下:分离精度为10 kDa,有效膜面积为0.3 m2。本研究使用的PES中空纤维超滤膜由天津鼎芯膜科技有限公司制造。
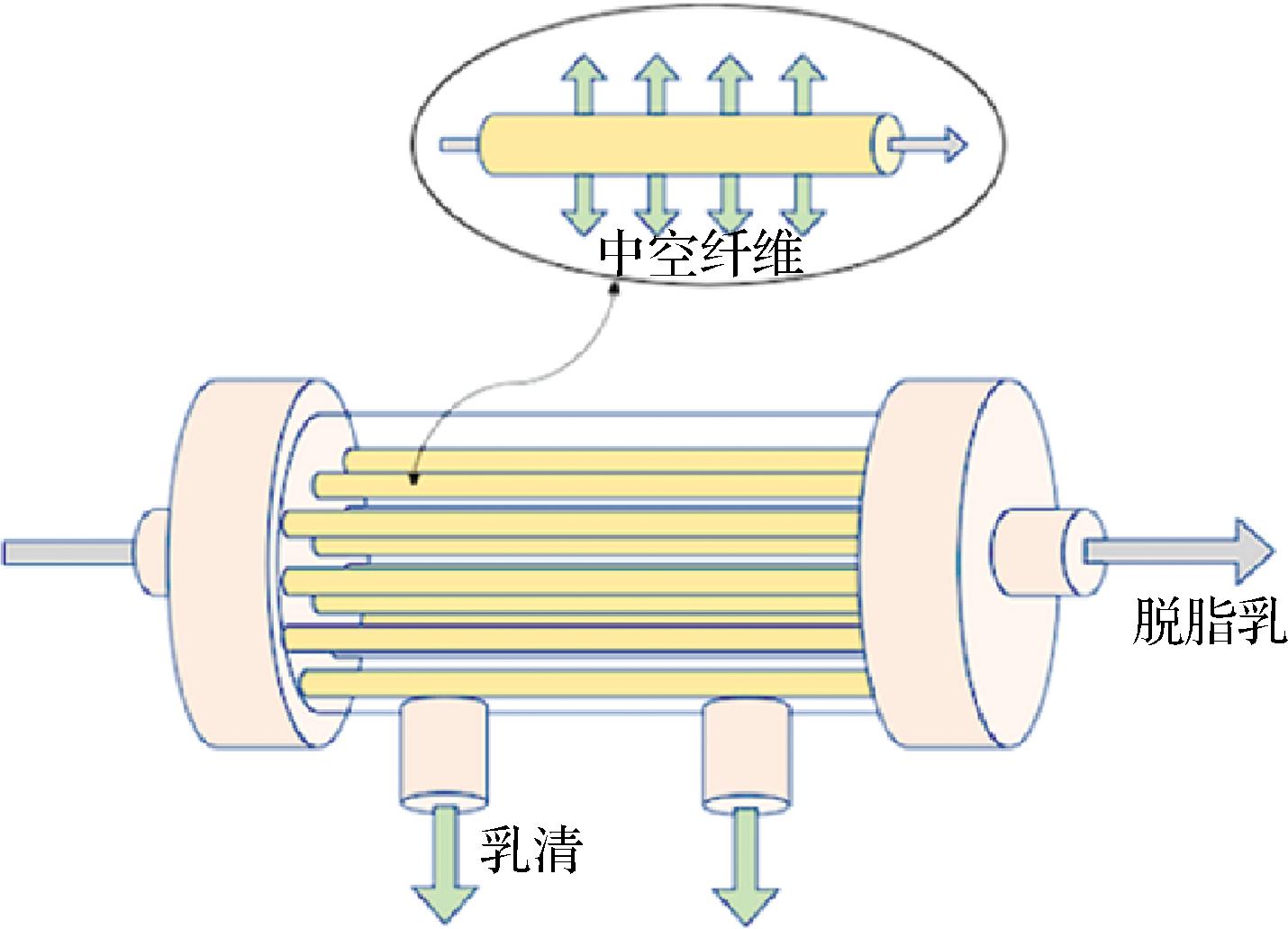
图1 PES中空纤维超滤膜组件示意图
Fig.1 Schematic diagram of PES hollow fiber ultrafiltration membrane module
1.2.2 PES中空纤维超滤分离系统
本研究使用的自制膜分离系统如图2所示,主要包括原料槽、透过液槽、膜组件、阀门、压力表、蠕动泵及管路构成,通过调节阀门可以切换膜分离系统的过滤模式与洗滤模式。
a-膜分离系统的过滤模式;b-膜分离系统的洗滤模式
图2 膜分离系统示意图
Fig.2 Schematic diagram of membrane separation system
膜分离系统的过滤模式如图2-a所示:原料槽中恒温的脱脂乳被蠕动泵输送至PES中空纤维膜内表面,通过阀门调节操作压力以驱动浓缩物中的水、盐、乳糖等物质透过中空纤维膜进入透过液槽,浓缩物持续循环至需要的浓缩倍数。
膜分离系统的洗滤模式如图2-b所示,纯水在操作压力驱动下由中空纤维膜外表面渗入中空纤维膜内表面并循环回原料槽中,直至浓缩液恢复原体积重新过滤至需要的洗滤次数。
1.3 实验方法
1.3.1 洗滤模式
在膜分离过程中,对添加溶剂后的浓缩液重复过滤,使小分子与溶剂不断被去除的工序称为洗滤,中空纤维膜的洗滤模式主要包括直接补水洗滤和反洗补水洗滤[21]。直接补水洗滤是在浓缩物达到目标浓缩倍数后,将纯水直接注入浓缩物槽稀释至原体积后经多次重复过滤以达到纯化目的。反洗补水洗滤是将膜分离系统切换为洗滤模式,纯水从透过液出口进入PES中空纤维膜组件后在压力驱动下透过中空纤维膜表面并进入浓缩物槽将浓缩物稀释至原有体积,再切换膜分离系统为过滤模式进行多次过滤实现纯化目的。通过研究PES中空纤维超滤膜制备无乳糖MPC过程中洗滤模式对分离效率和产品理化指标的影响,以选定适当的洗滤模式。
1.3.2 洗滤条件
洗滤次数与浓缩倍数是影响洗滤效果的关键条件。洗滤次数影响分离效率与生产成本。高浓缩倍数意味着达到目标纯度所需的洗滤次数减少,但可能导致膜污染加剧及蛋白变性影响产品质量。本研究在其他工艺参数不变的条件下分别取1 L牛乳,研究2倍(样品体积浓缩至初始体积的1/2)、3倍(样品体积浓缩至初始体积的1/3)、4倍(样品体积浓缩至初始体积的1/4)浓缩倍数对PES中空纤维超滤膜制备无乳糖MPC的分离效率与产品理化指标的影响,选定适当的浓缩倍数并根据产品理化指标要求确定洗滤次数。
1.3.3 操作条件
PES中空纤维超滤膜制备无乳糖MPC的操作条件主要包括操作温度和操作压力。在其他条件不改变的情况下取1 L脱脂乳,分别研究PES中空纤维超滤膜在操作温度为20、25、30、35、40、45、50 ℃;操作压力为0.05、0.1、0.15 MPa的操作条件对分离效率和产品理化指标的影响,选定适当的操作条件。
1.4 化学分析
1.4.1 样品组分
采用考马斯亮蓝法测定样品蛋白浓度[22]。游离态考马斯亮蓝呈红色,与蛋白质的酰胺基通过静电作用络合后变为蓝色,并在595 nm波长下具有最大吸光度且与蛋白浓度成正比,因此可以测定包括酪蛋白胶束在内的牛乳总蛋白浓度。配制不同浓度的牛血清蛋白标准液绘制标准曲线,在PBS溶液稀释后的样品中加入考马斯亮蓝溶液反应5 min后在595 nm波长下测定其吸光度并根据标准曲线计算浓度;采用GB5009.8—2016《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中的酸水解-莱因-埃农氏法测定样品乳糖浓度[23];样品pH值与电导率分别使用pHS-3C型pH计与DDBJ-350型便携式电导率仪测定。
1.4.2 蛋白种类分析
采用SDS-PAGE分析样品蛋白种类[24],实验步骤如下:a)制样:分别取脱脂乳、透过液、浓缩物样品50 μL,加入等体积的2×蛋白电泳缓冲液,煮沸5 min备用。b)电泳:按照试剂盒配方配制12%分离胶和15%浓缩胶滴入电泳装置槽中,待凝胶凝固后,在样品槽间隔中滴加20 μL蛋白样品,配制电极缓冲液灌入电泳装置中进行电泳。电泳起始电压为90 V,待凝胶条带进入分离胶时调节电压至180 V后直至条带迁移至凝胶下端2 cm处停止。c)染色:将完成电泳的凝胶取下,加入超纯水加热至沸腾后;加入考马斯亮蓝R-250快速染液浸没凝胶,加热至沸腾1 min,在水平摇床上摇动10 min完成染色;加入超纯水浸没凝胶,煮沸后完成脱色。d)成像分析:使用Tanon 1600型凝胶成像仪对染色后的凝胶进行分析。
1.5 分离性能
膜分离效率:制备过程中污染层逐渐覆盖膜表面,膜通量随时间逐渐下降后趋于稳定,二者变化关系体现了膜分离效率。将分析天平放在透过液槽下,每15 s称重并记录,结合膜面积与过滤时间绘制通量随时间变化关系图。膜通量计算如公式(1)所示:
(1)
式中:J,膜通量,L/(m2·h);V,渗透液体积,L;A,膜的有效过滤面积,m2;t,透过时间,h。
采用相对通量表征洗滤后膜通量恢复程度,相对通量计算如公式(2)所示:
相对通量![]()
(2)
式中:JA,洗滤后通量,L/(m2·h);JB,过滤通量,L/(m2·h)。
采用蛋白截留率(P)表征膜分离性能,计算如公式(3)所示:
(3)
式中:CP,透过液蛋白含量,g;CM,脱脂乳蛋白含量,g;P,蛋白截留率,%。
采用蛋白收率(R)表征生产效率,计算如公式(4)所示:
(4)
式中:CN,浓缩乳蛋白含量,g;R,蛋白收率,%。
使用电导率仪测量样品电导率,脱盐率计算如公式(5)所示:
(5)
式中:DR,脱盐率,%;Xi,初始电导率,mS/cm;Xf,最终电导率,mS/cm。
1.6 数据处理方法
采用Design-Expert 8.0.6 软件对数据进行分析,试验结果用作图软件Origin 2021绘图。
2 结果与分析
2.1 洗滤模式
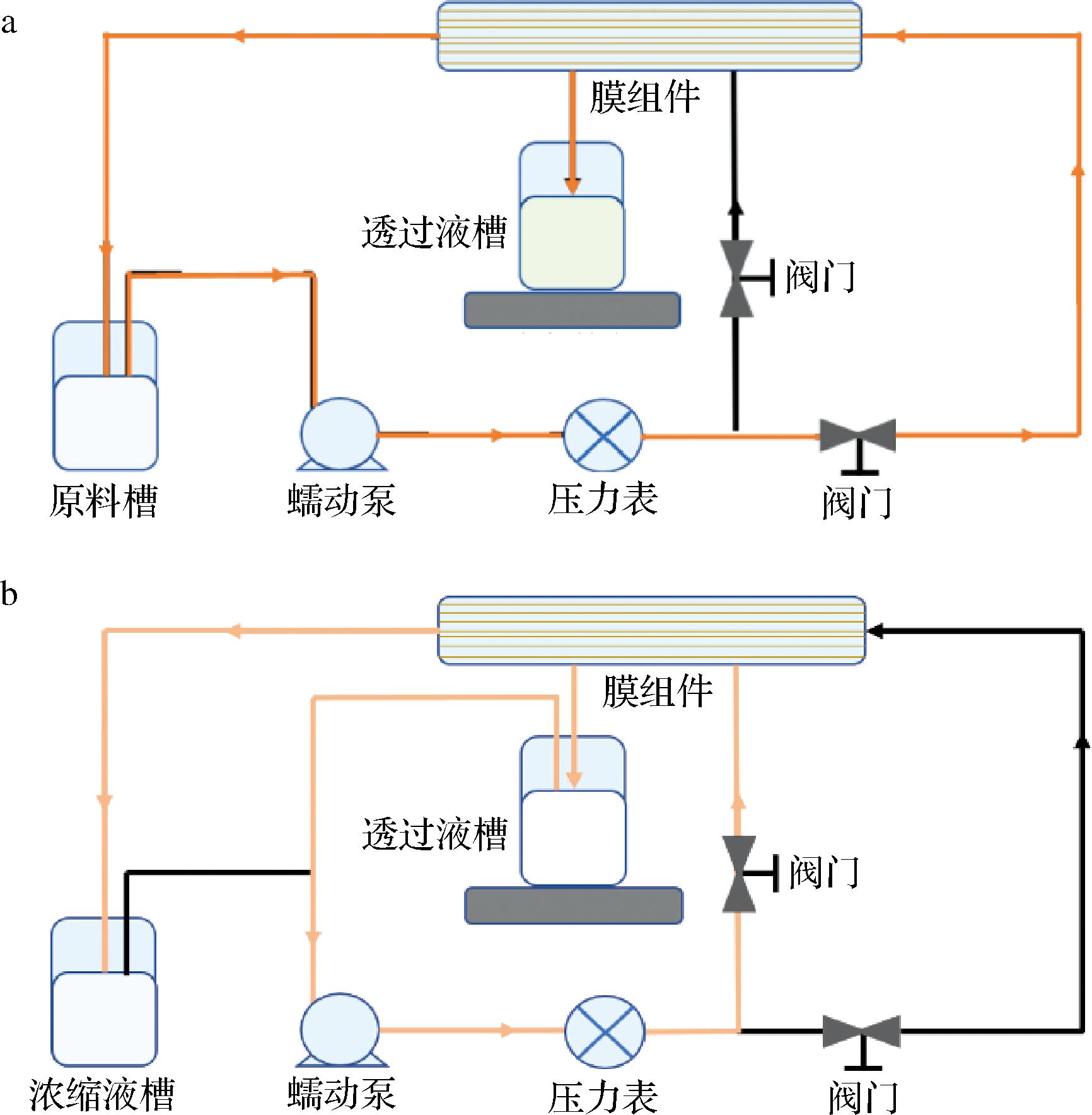
洗滤模式对超滤膜性能的影响如图3所示,直接补水后料液浓度降低导致通量逐次增高,第1次洗滤后料液的稳定通量为9.41 L/(m2·h),第2次洗滤后料液的稳定通量为10.34 L/(m2·h)。反洗补水第1次洗滤后料液的稳定通量为10.35 L/(m2·h),第2次洗滤后的稳定通量为13.12 L/(m2·h)。反洗补水洗滤模式的初始通量及稳定通量均随料液浓度降低而逐次增大,且增幅远高于直接洗滤。这是由于反洗补水洗滤破坏了膜表面的浓差极化层,对膜污染的清洁效果优于直接补水洗滤,使通量变化规律近似于过滤阶段,呈现高初始通量随时间降低后趋于平稳的现象。结果表明反洗补水洗滤具有更高的膜分离效率,且反洗过程通过破坏膜表面污染层有效缓减了膜污染。
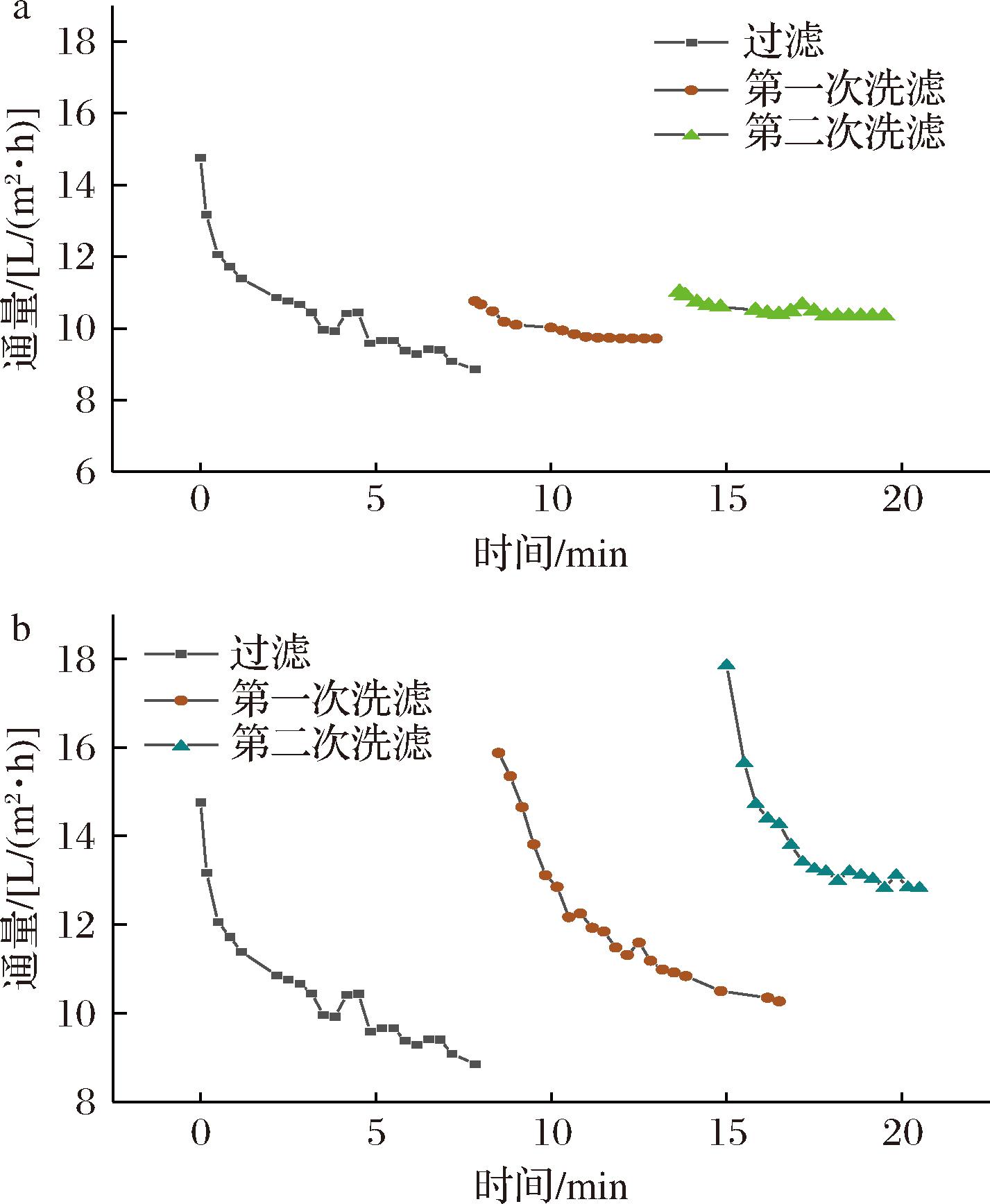
a-直接补水模式;b-反洗补水模式
图3 洗滤模式对超滤膜性能的影响
Fig.3 Effect of washing and filtration modes on the performance of ultrafiltration membranes
洗滤模式对超滤相对通量和蛋白收率的影响如图4所示,反洗补水洗滤后的通量较过滤阶段提升了85.3%、蛋白收率为94.0%,均优于直接补水洗滤。综合以上结果本研究采用反洗补水的洗滤模式。

图4 洗滤模式对超滤相对通量和蛋白收率的影响
Fig.4 Effects of washing modes on ultrafiltration relative flux and protein yield
2.2 洗滤条件
浓缩倍数对超滤膜性能的影响如图5所示,不同浓缩倍数下的通量随时间的变化规律一致,通量随着浓缩倍数逐渐增大从11.64 L/(m2·h)降至6.27 L/(m2·h)。
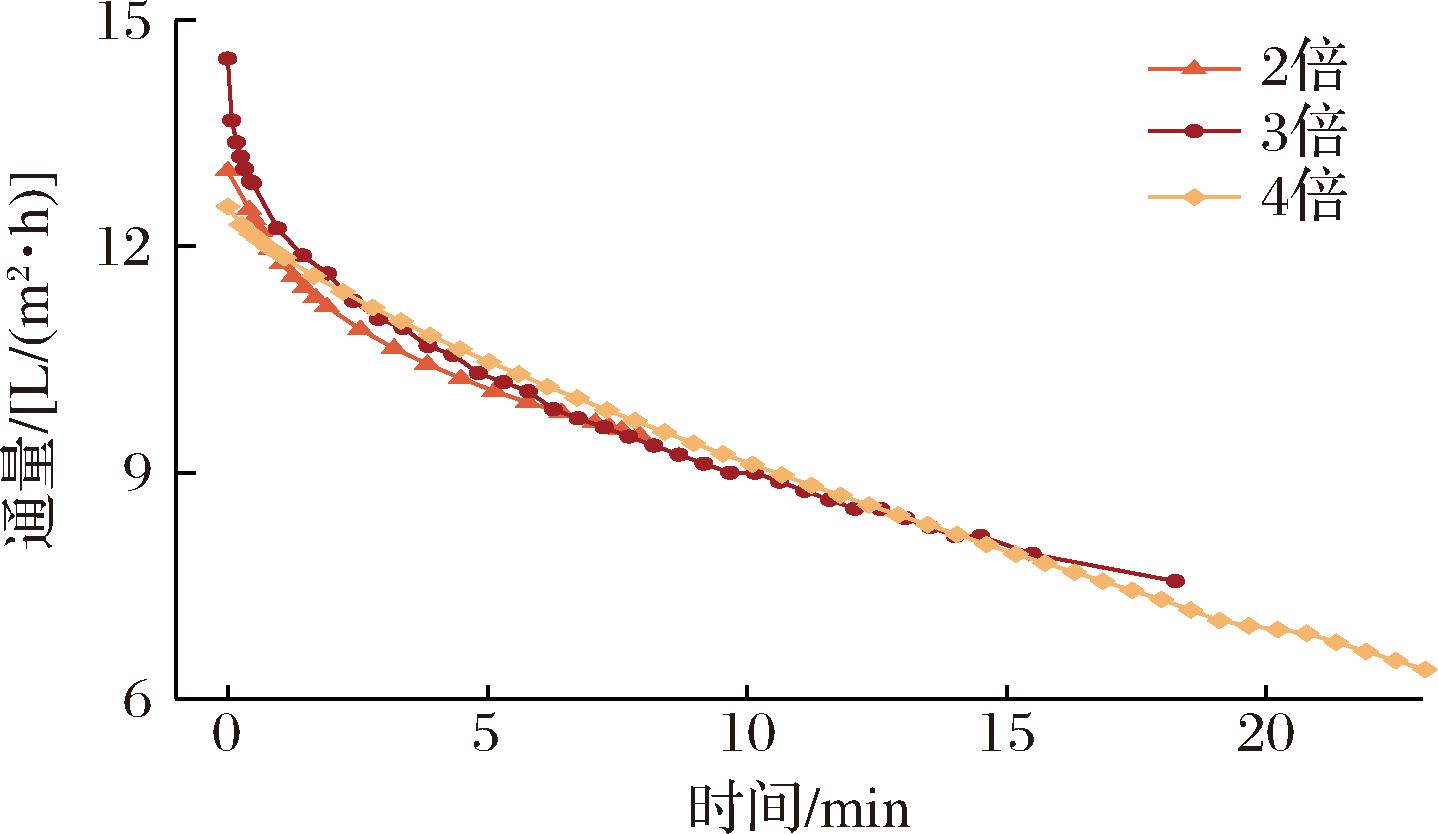
图5 浓缩倍数对超滤膜性能的影响
Fig.5 Effect of concentration times on the Performance of ultrafiltration membranes
不同浓缩倍数的无乳糖MPC蛋白浓度如图6所示,其中M为脱脂乳,N1、N2和N3分别为过滤浓缩液、第一次洗滤浓缩液和第二次洗滤浓缩液。透过液蛋白浓度均低于0.5 g/L。浓缩倍数越高的产品蛋白含量越高,2倍浓缩的无乳糖MPC蛋白浓度为40.01 g/L。
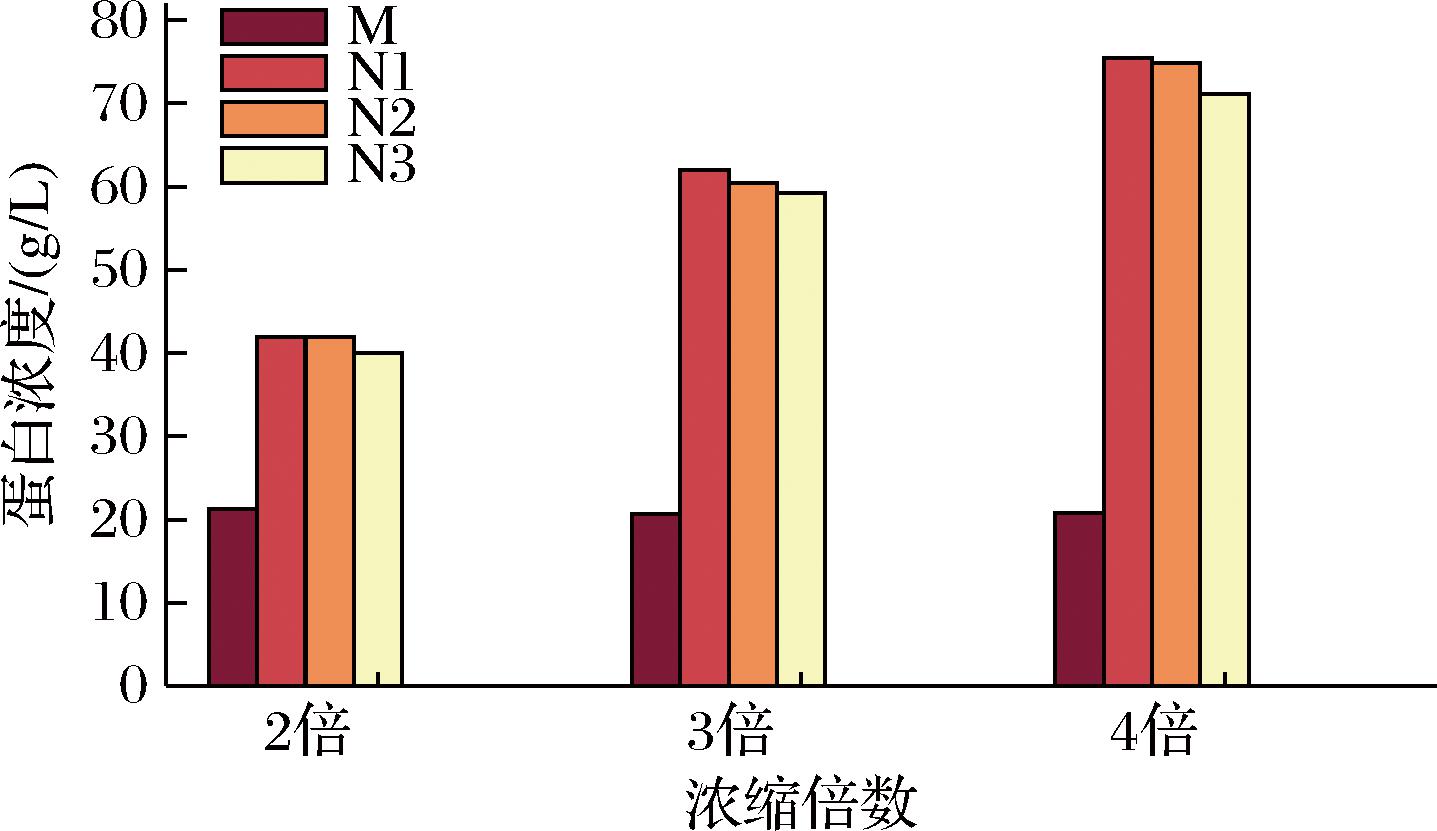
图6 浓缩倍数对无乳糖MPC蛋白浓度的影响
Fig.6 Effect of concentration times on the concentration of lactose free MPC protein
PES中空纤维超滤膜制备无乳糖MPC的蛋白组分与浓缩倍数关系如图7所示。图中标注出了牛乳中典型蛋白的分子质量条带分布。C1、C2为2倍浓缩的浓缩物与透过液;C3、C4为3倍浓缩的浓缩物与透过液;C5、C6为4倍浓缩的浓缩物与透过液。浓缩物样品均为牛乳蛋白条带,C1、C3、C5的蛋白组分并没有发生变化;C3条带较C1条带的15 k~25 kDa范围内的3条酪蛋白条带黑色加深且边缘更清晰,且15 kDa部分的β乳球蛋白条带颜色加深;C5条带较C3与C1的颜色更深。结果表明,蛋白浓度随浓缩倍数升高而增加。透过液中没有明显的蛋白质条带,表明分离精度为10 kDa的PES中空纤维超滤膜可在各个浓缩倍数下将牛乳蛋白质保留在浓缩物中。
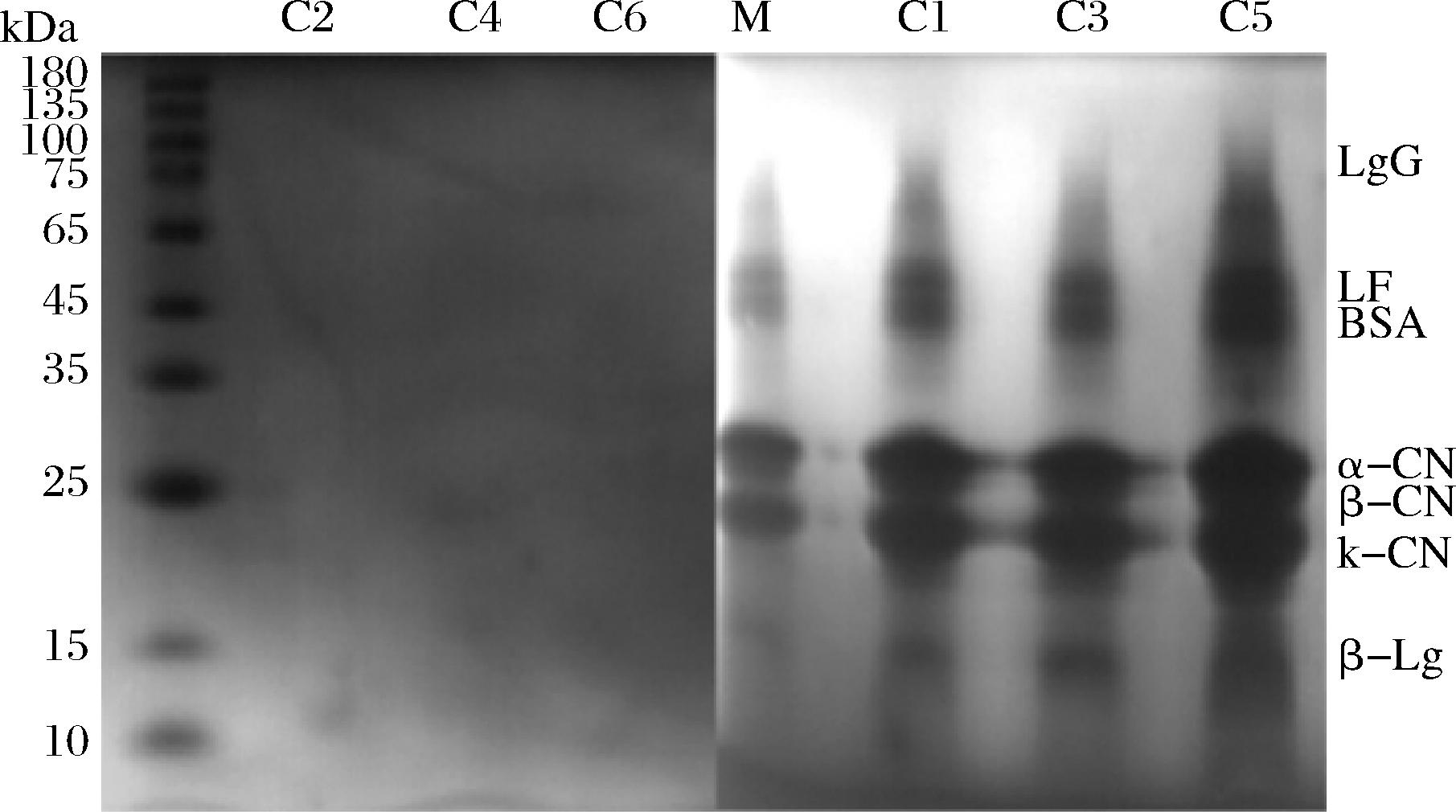
图7 不同浓缩倍数样品的SDS-PAGE凝胶电泳图
Fig.7 SDS-PAGE gel electrophoresis patterns of samples with different concentration ratios
浓缩倍数对超滤无乳糖MPC产品的乳糖浓度影响如图8所示。脱脂乳中乳糖质量浓度为33.75 g/L,2倍浓缩的浓缩物与透过液乳糖质量浓度分别为29.75、32.63 g/L,3倍浓缩的浓缩物与透过液乳糖质量浓度分别为30.63、32.63 g/L,4倍浓缩的浓缩物与透过液乳糖质量浓度分别为30.63、31.63 g/L。浓缩倍数对膜两侧料液乳糖浓度影响不显著,表明乳糖在不同浓缩倍数下都可进入透过液,使浓缩液中的乳糖浓度降低。
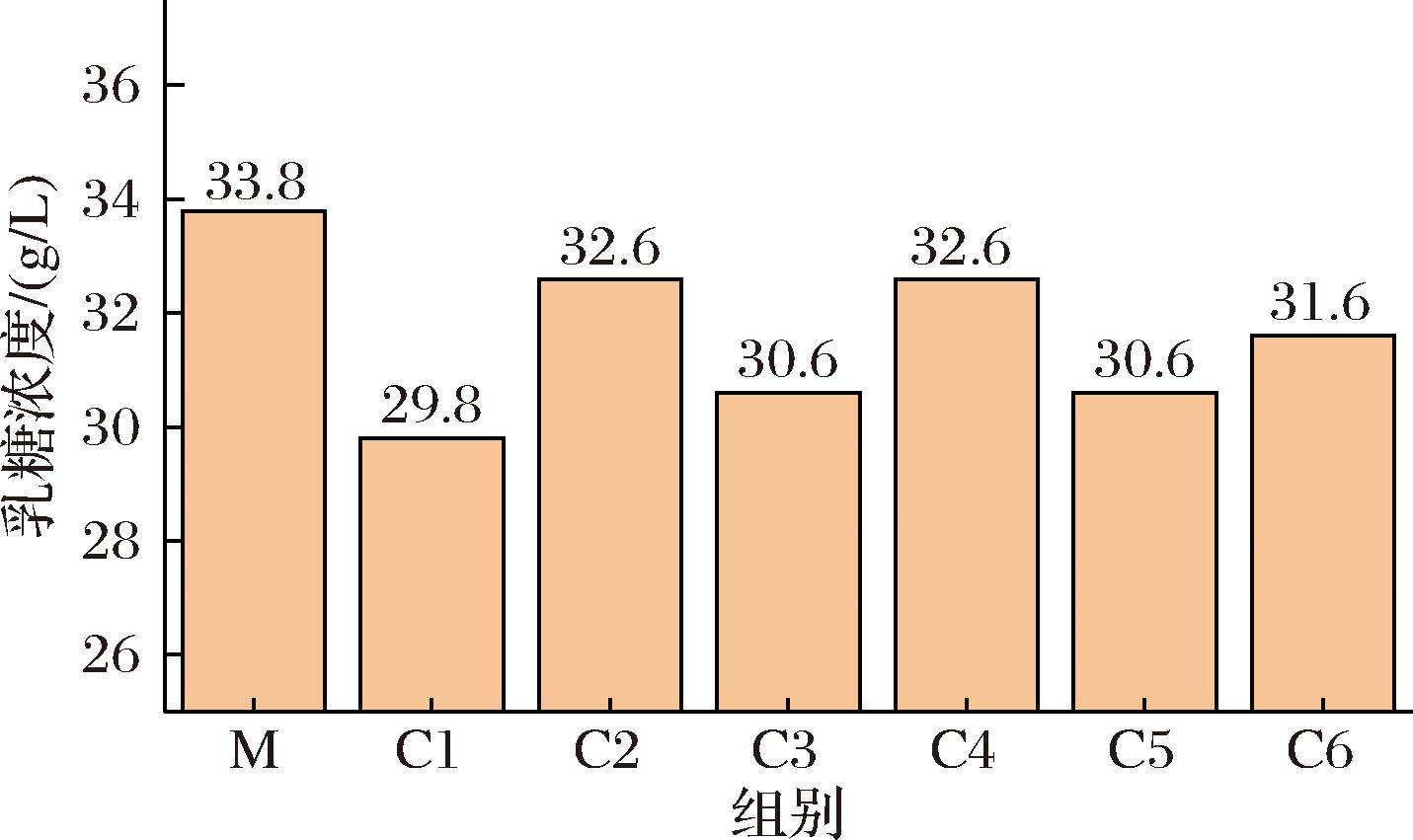
图8 不同浓缩倍数的超滤样品乳糖浓度
Fig.8 Lactose concentration of ultrafiltration samples with different concentration ratios
洗滤次数与无乳糖MPC产品的脱盐与脱乳糖效果的关系如图9所示。脱盐率从过滤的58.6%升至第3次洗滤的90.2%,高脱盐率使无乳糖MPC产品作为食品添加剂不会对奶粉等食品原有的配比产生影响。乳糖脱除率是无乳糖MPC的关键指标,过滤阶段的乳糖脱除率为55.9%,进行3次洗滤后的乳糖质量浓度为1.17 g/L,乳糖脱除率为96.5%,符合GB 28050—2011《预包装食品营养标签通则》中无乳糖产品乳糖质量浓度低于5 g/L的要求。
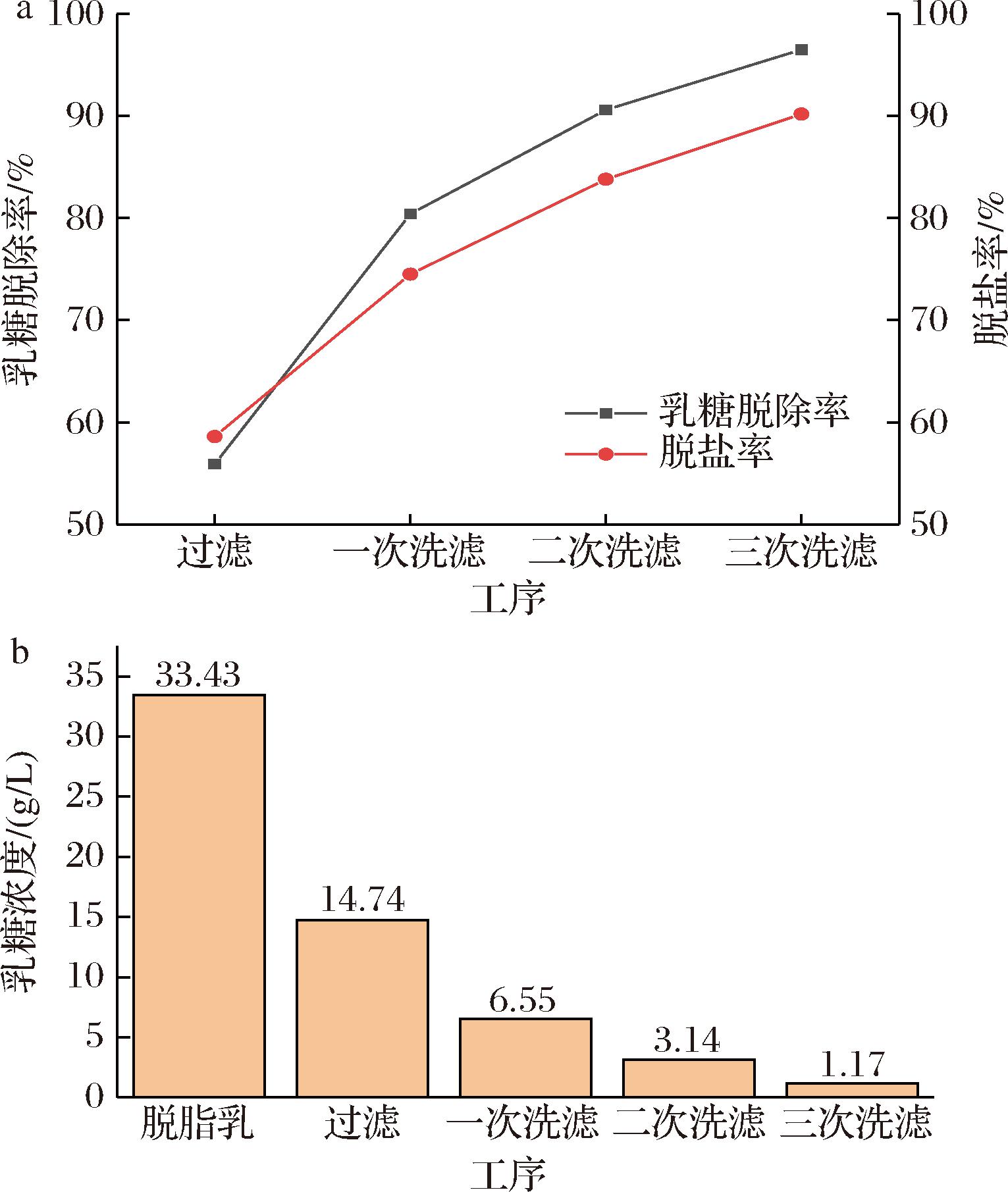
a-洗滤次数与脱盐率及乳糖脱除率的关系;b-洗滤次数与乳糖浓度的关系
图9 洗滤次数对无乳糖MPC脱盐与乳糖脱除效果的影响
Fig.9 Effect of washing times on desalination rate and lactose removal rate of lactose free MPC
综上所述,本研究采用2倍浓缩、3次洗滤的洗滤条件用于PES中空纤维超滤膜制备无乳糖MPC。
2.3 操作温度
温度对牛乳理化性质和膜分离效率的影响显著。牛乳为典型的温敏原料,升温可加剧料液分子运动并降低黏度以加快渗透速率。传统牛乳浓缩工艺中对牛乳的热处理强度远高于膜分离,而长时间热处理会对构成蛋白质二级和三级结构的非共价键产生影响,造成蛋白质变性并体现为pH值突变或蛋白沉淀等现象,所以超滤过程中应选择适当的操作温度在保障产品质量的同时提高分离效率[25]。图10表明通量随着操作温度升高由3.11 L/(m2·h)升至10.52 L/(m2·h)。
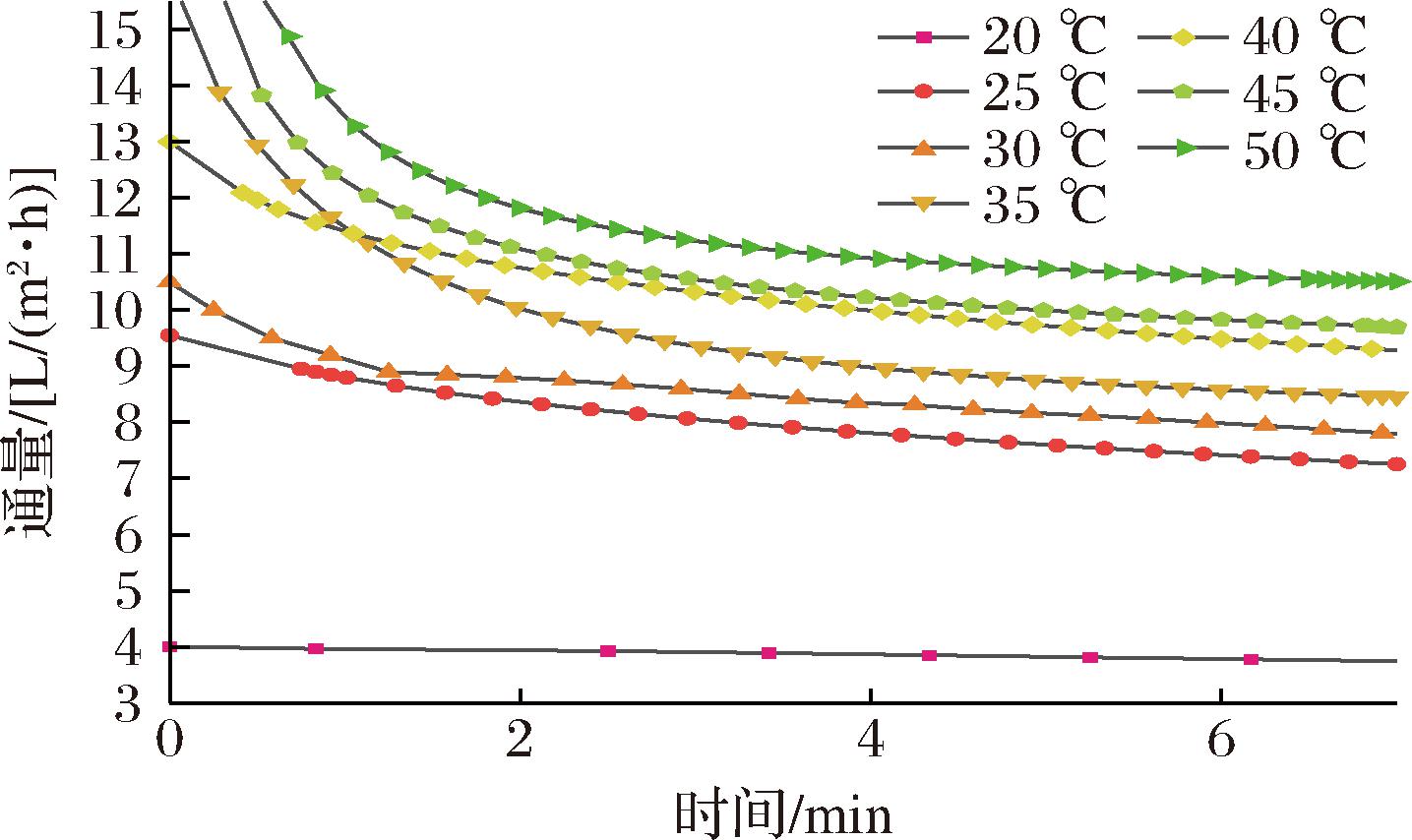
图10 操作温度对超滤膜性能的影响
Fig.10 Effect of operating temperature on the Performance of ultrafiltration membranes
操作温度与各阶段样品pH值关系如图11-a所示,浓缩物pH值在长时间热处理后都遵循出逐步升高的规律而透过液pH基本稳定,但在50 ℃时浓缩物pH值变化规律出现反常,这表明料液中的蛋白质随着温度的升高产生了一定程度的变性。操作温度与各阶段样品电导率关系如图11-b所示,N1和T1的电导率与M的电导率近似,N1、N2、N3阶段的电导率依次降低。结果表明矿物盐等低分子质量物质在超滤过程未被截留,有效降低了浓缩物的盐浓度。图11-c为操作温度与各阶段样品蛋白浓度关系,透过液中的蛋白浓度可忽略不计,浓缩物蛋白质量浓度近似于脱脂乳蛋白的2倍。

a-样品pH;b-样品电导率;c-样品蛋白浓度
图11 操作温度对无乳糖MPC理化指标的影响
Fig.11 Effect of operating temperatures on physical and chemical indexes of lactose free MPC
高温长时间处理对于牛乳组分的理化性质有不良影响,易结块沉淀或变质,所以工业上一般不采用45 ℃以上的牛乳超滤浓缩工艺。40 ℃升温到45 ℃的通量提升幅度有限且产物蛋白浓度近似,所以本研究采用40 ℃的操作温度用于PES中空纤维超滤膜制备无乳糖MPC。
2.4 操作压力
操作压力对膜通量的影响具有两面性,一方面驱动力增加使膜分离的传质系数增大导致膜通量增加,另一方面操作压力增加造成膜表面凝胶污染层加厚导致通量下降,所以应采用适当的操作压力。
操作压力与通量随时间变化关系如图12所示。通量随压力增大由5.64 L/(m2·h)升至10.19 L/(m2·h)。值得注意的是,0.1~0.15 MPa的通量增幅低于0.05~0.1 MPa的通量增幅,这表明操作压力对分离效率的促进作用随着压力增大而逐渐弱化,此结果归因于操作压力过大引发的凝胶污染层增厚现象。
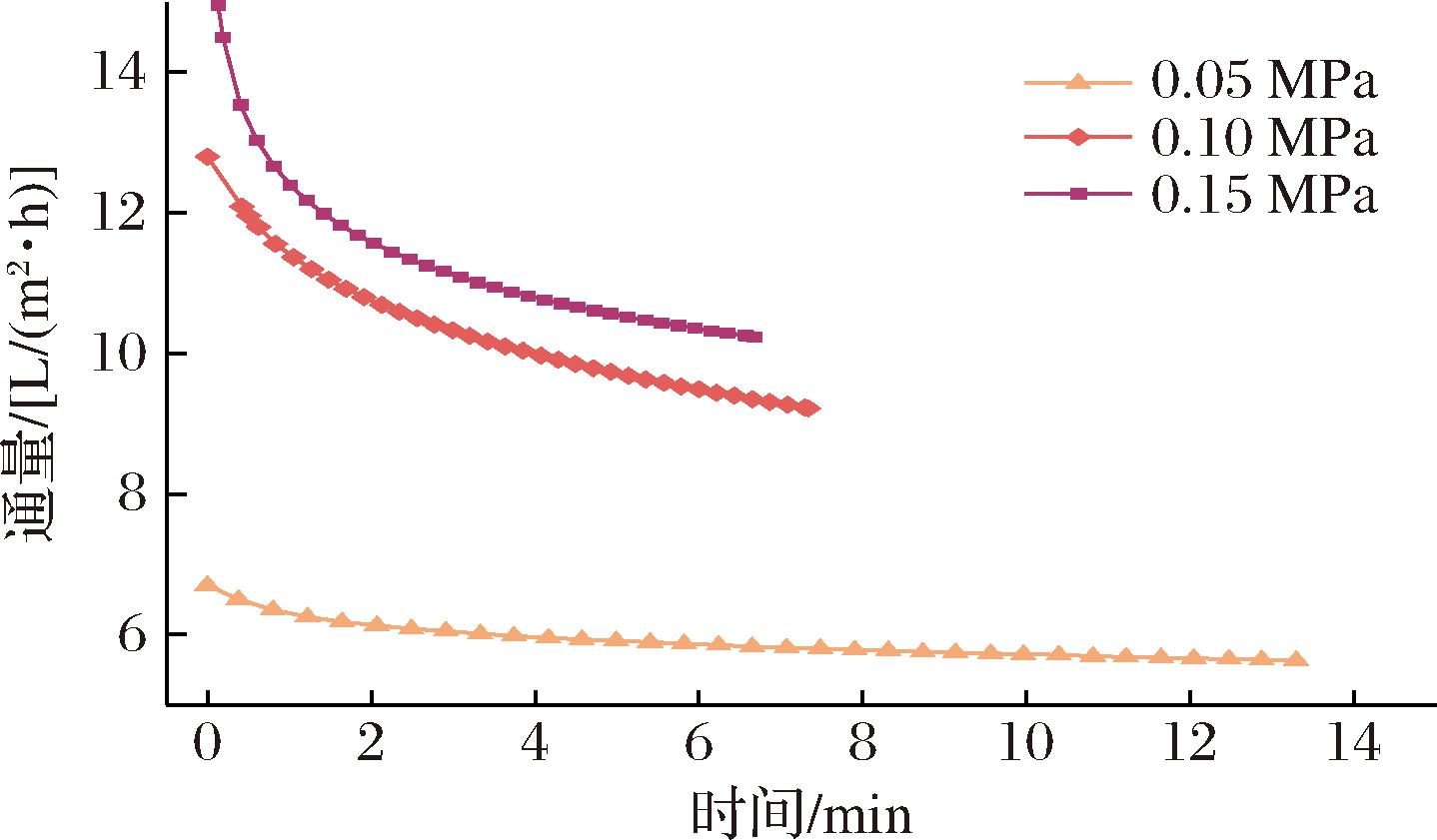
图12 操作压力对超滤膜性能的影响
Fig.12 Effect of operating pressures on the Performance of ultrafiltration membranes
随着操作压力升高各阶段样品的电导率和pH值基本稳定。操作压力与无乳糖MPC蛋白浓度的关系如图13所示。
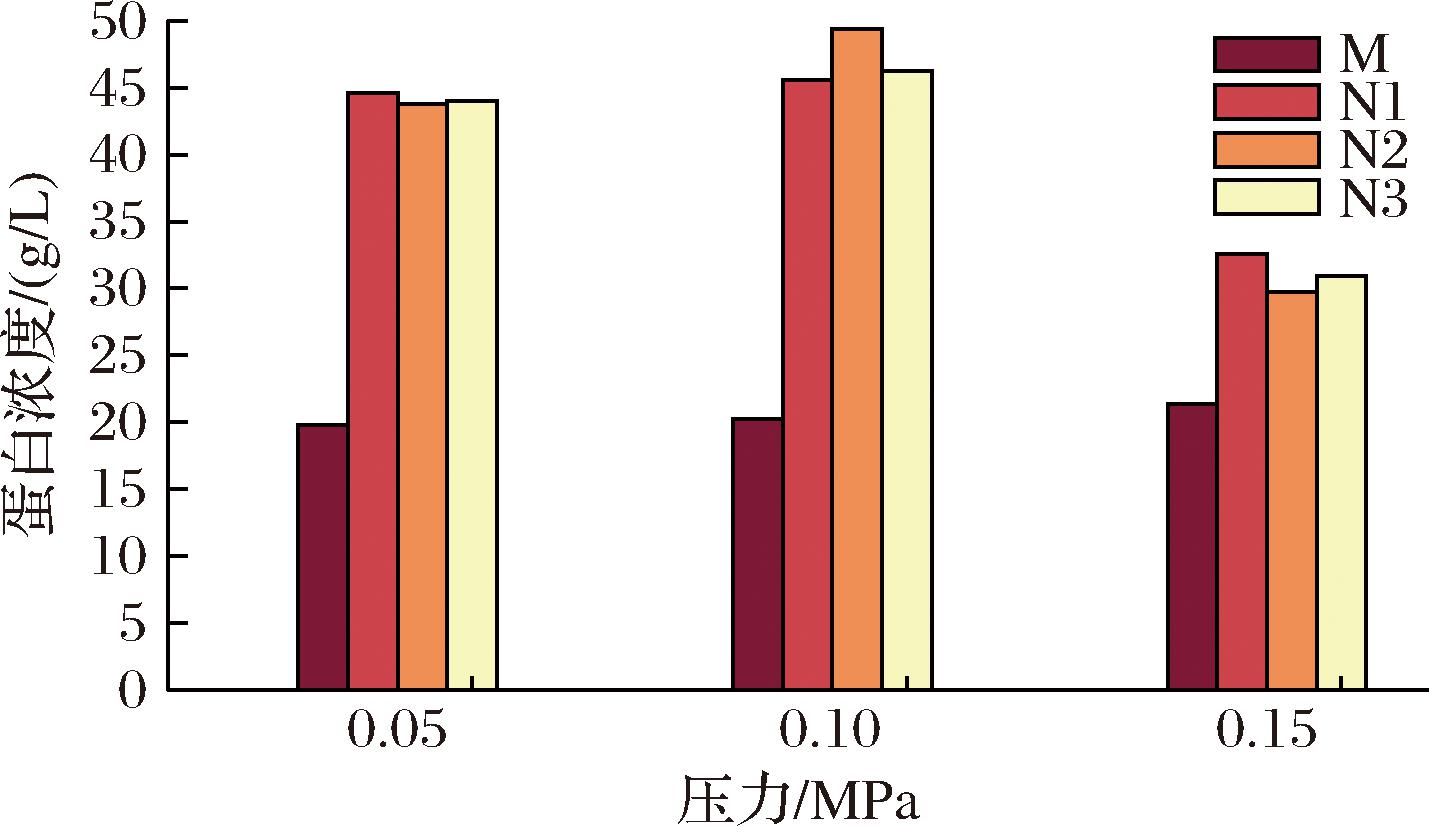
图13 操作压力对无乳糖MPC蛋白浓度的影响
Fig.13 Effect of operating pressures on the protein concentration of lactose free MPC
0.1 MPa操作压力制备的无乳糖MPC蛋白质量浓度为46.26 g/L;0.15 MPa操作压力制备的无乳糖MPC蛋白质量浓度为30.90 g/L。0.15 MPa操作压力制备的无乳糖MPC蛋白浓度较其他条件低的原因是操作压力过大导致膜污染加剧以及膜表面凝胶层加厚令料液蛋白含量减少。另外操作压力过大导致凝胶层的密度增大,洗滤效果变差,后续过程的料液蛋白浓度下降。为得到最优的产品理化指标和分离效率,本研究采用0.1 MPa的操作压力用于PES中空纤维超滤膜制备无乳糖MPC。
2.5 产品指标
使用本研究选定的40 ℃操作温度、0.1 MPa操作压力下通过2倍浓缩、3次反洗补水洗滤工艺路线制备的无乳糖MPC样品的蛋白组分如图14所示。
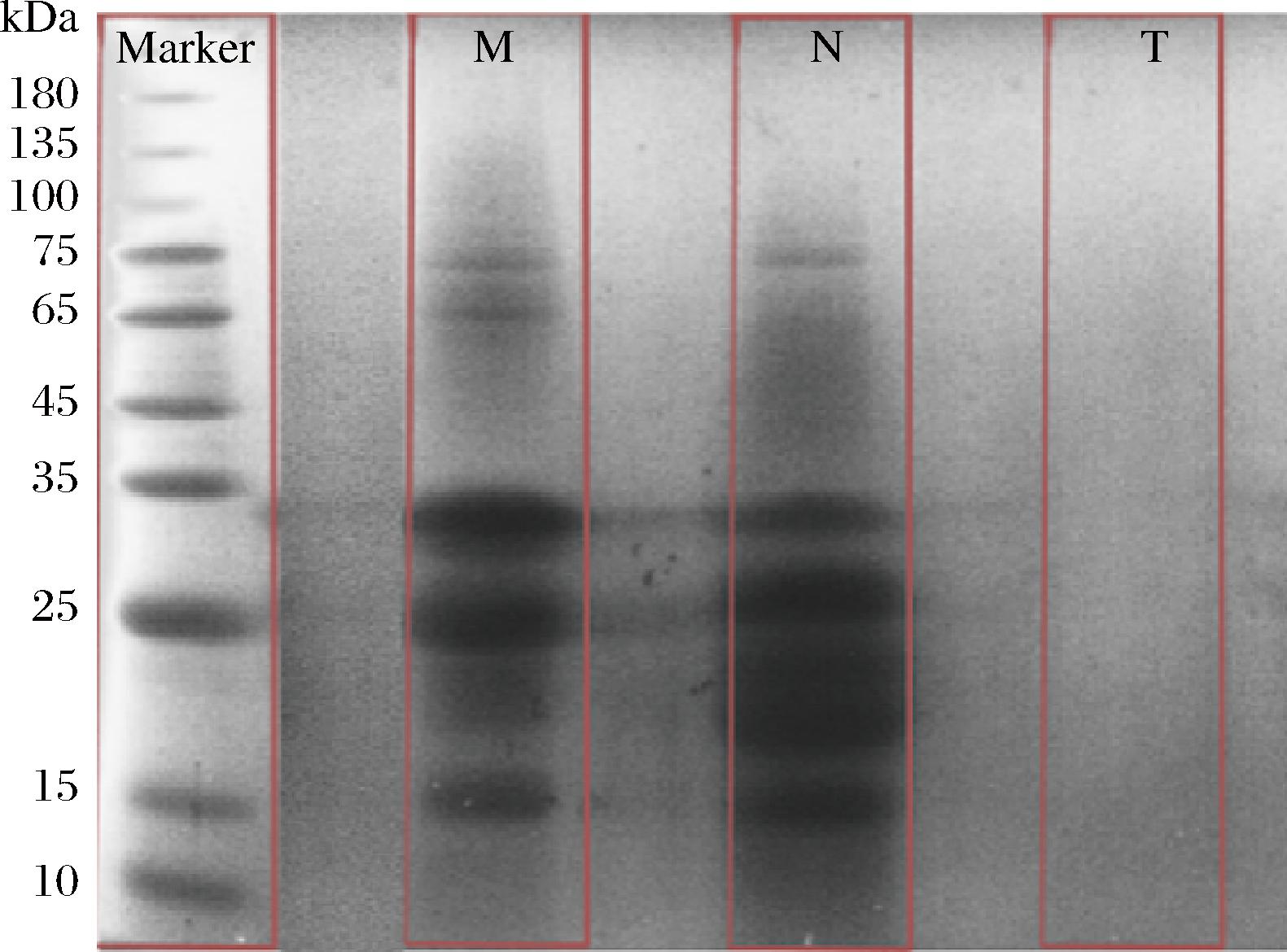
图14 无乳糖MPC产品SDS-PAGE凝胶电泳图
Fig.14 SDS-PAGE gel electrophoresis of lactose free MPC products
M为脱脂乳样品,N为浓缩物样品,T为透过液样品。原料乳中呈现牛乳典型的蛋白条带,浓缩物中的蛋白浓度较脱脂乳高且蛋白组分保留完整,透过液中不存在蛋白质条带表明蛋白质被完全截留在浓缩液中。超滤过程的膜通量随时间逐渐下降但保持在10 L/(m2·h)以上,无乳糖MPC产品理化指标为:乳糖质量浓度为1.17 g/L,蛋白质量浓度为40.01 g/L,pH值为6.98,乳糖脱除率为96.5%。通过与以往研究结果对比,表明本文对中空纤维超滤膜系统的工艺优化有效提升了无乳糖MPC的生产效率和产品质量。
3 结论
本文采用超滤技术制备无乳糖MPC以避免乳糖不耐及过敏症状,通过对超滤过程的分离系统、洗滤方案、操作条件等工艺条件进行优化以提高分离效率与产品质量。最终确定了使用自制10 kDa截留分子质量中空纤维超滤膜组件与过滤/洗滤膜分离系统,在40 ℃操作温度、0.1 MPa操作压力下2倍浓缩、3次反洗补水洗滤的最优工艺路线。无乳糖MPC产品质量较以往研究提升显著:乳糖质量浓度1.17 g/L、蛋白质量浓度40.01 g/L、脱盐率90.2%、乳糖脱除率为96.5%。满足QNXSS 0006 S—2022《浓缩牛奶蛋白(液)》中MPC产品蛋白质量浓度40 g/L以上的要求;满足GB 28050—2011《预包装食品营养标签通则》无乳糖产品的乳糖质量浓度小于5 g/L的要求。此工艺路线可用于PES中空纤维超滤膜制备高质量无乳糖MPC产品,对超滤制备无乳糖MPC的工业生产具有一定指导意义,体现了超滤技术在乳品工业中的应用潜力。
[1] EIGEL W N, BUTLER J E, ERNSTROM C A, et al.Nomenclature of proteins of cow’s milk:Fifth revision 1[J].Journal of Dairy Science, 1984, 67(8):1599-1631.
[2] ZHANG S Y, CHENG J J, XIE Q G, et al.Foaming and physicochemical properties of commercial protein ingredients used for infant formula formulation[J].Foods, 2022, 11(22):3710.
[3] JUAN B, TRUJILLO A J, FERRAGUT V.The effect of salt reduction and partial substitution of NaCl by KCl on physicochemical, microbiological, and sensorial characteristics and consumers’ acceptability of semi-hard and hard lactose-free cow’s milk cheeses[J].Frontiers in Nutrition, 2022, 9:861383.
[4] DI COSTANZO M, BIASUCCI G, MADDALENA Y, et al.Lactose intolerance in pediatric patients and common misunderstandings about cow’s milk allergy[J].Pediatric Annals, 2021, 50(4):e178-e185.
[5] DUPONT C, HOL J, NIEUWENHUIS E E S, et al.An extensively hydrolysed casein-based formula for infants with cows’ milk protein allergy:Tolerance/hypo-allergenicity and growth catch-up[J].The British Journal of Nutrition, 2015, 113(7):1102-1112.
[6] PAL S, WOODFORD K, KUKULJAN S, et al.Milk intolerance, beta-casein and lactose[J].Nutrients, 2015, 7(9):7285-7297.
[7] LI Y H, WANG W J.Short communication:Formation of oxidized flavor compounds in concentrated milk and distillate during milk concentration[J].Journal of Dairy Science, 2016, 99(12):9647-9651.
[8] DEAN GOLDRING J P.Concentrating proteins by salt, polyethylene glycol, solvent, SDS precipitation, three-phase partitioning, dialysis, centrifugation, ultrafiltration, lyophilization, affinity chromatography, immunoprecipitation or increased temperature for protein isolation, drug interaction, and proteomic and peptidomic evaluation[J].Methods in Molecular Biology, 2019, 1855:41-59.
[9] YE A Q, SINGH H, TAYLOR M W, et al.Interactions of fat globule surface proteins during concentration of whole milk in a pilot-scale multiple-effect evaporator[J].The Journal of Dairy Research, 2004, 71(4):471-479.
[10] 李延华. 牛乳加热及乳粉加工中热相关工艺对氧化风味的影响研究[D].哈尔滨:哈尔滨工业大学, 2013.LI Y H.Study on the influence of heat-related technology on oxidation flavor in milk heating and milk powder processing[D].Harbin:Harbin Institute of Technology, 2013.
[11] PARK Y W.The impact of plant-based non-dairy alternative milk on the dairy industry[J].Food Science of Animal Resources, 2021, 41(1):8-15.
[12] BIEWENDT H G.Sterilization values for ultrahigh heating of milk[J].Die Nahrung, 1994, 38(3):233-252.
[13] MARELLA C, MUTHUKUMARAPPAN K, METZGER L E.Evaluation of commercially available, wide-pore ultrafiltration membranes for production of α-lactalbumin-enriched whey protein concentrate[J].Journal of Dairy Science, 2011, 94(3):1165-1175.
[14] FELICIANO R J, BOUÉ G, MEMBRÉ J M.Overview of the potential impacts of climate change on the microbial safety of the dairy industry[J].Foods, 2020, 9(12):1794.
[15] IB
 EZ R A, GOVINDASAMY-LUCEY S, JAEGGI J J, et al.Effect of lactose standardization of milk using low-concentration factor ultrafiltration:Effect of reducing the lactose-to-casein ratio on the properties of milled-curd Cheddar cheese[J].Journal of Dairy Science, 2021, 104(8):8467-8478.
EZ R A, GOVINDASAMY-LUCEY S, JAEGGI J J, et al.Effect of lactose standardization of milk using low-concentration factor ultrafiltration:Effect of reducing the lactose-to-casein ratio on the properties of milled-curd Cheddar cheese[J].Journal of Dairy Science, 2021, 104(8):8467-8478.
[16] PURI R, SINGH U, O’MAHONY J A.Influence of processing temperature on membrane performance and characteristics of process streams generated during ultrafiltration of skim milk[J].Foods, 2020, 9(11):1721.
[17] GAVAZZI-APRIL C, BENOIT S, DOYEN A, et al.Preparation of milk protein concentrates by ultrafiltration and continuous diafiltration:Effect of process design on overall efficiency[J].Journal of Dairy Science, 2018, 101(11):9670-9679.
[18] 施正学, 张建忠, 高锡永.利用膜分离技术和酶技术生产低乳糖牛奶的研究[J].农业工程学报, 1997, 13(3):221-224.SHI Z X, ZHANG J Z, GAO X Y.Studies on the manufacture of low lactose milk using membrane and enzymatic technology[J].Transactions of the Chinese Society of Agricultural Engineering, 1997, 13(3):221-224.
[19] 叶俊华. 设计纳滤和超滤组合膜系统优化牛奶组分[J].现代食品, 2023, 29(4):44-47.YE J H.Design of nanofiltration and ultrafiltration combined membrane system to optimize milk composition[J].Modern Food, 2023, 29(4):44-47.
[20] 吴士业, 罗惠波, 刘达玉.超滤技术开发低乳糖乳粉的研究[J].四川轻化工学院学报, 2004(1):22-24.WU S Y, LUO H B, LIU D Y.Development of low lactose milkpowder by ultrafiltration[J].Journal of Sichuan Institute of Light Industry and Chemical Technology, 2004(1):22-24.
[21] BAEK Y, YANG D Y, ZYDNEY A L.Development of a hydrodynamic cleaning cycle for ultrafiltration/diafiltration processes used for monoclonal antibody formulation[J].Industrial &Engineering Chemistry Research, 2018, 57(47):16110-16115.
[22] 孙士青, 王少杰, 李秋顺, 等.考马斯亮蓝法快速测定乳品中蛋白质含量[J].山东科学, 2011, 24(6):53-55.SUN S Q, WANG S J, LI Q S, et al.Coomassie brilliant blue method based protein content determination in milk[J].Shandong Science, 2011, 24(6):53-55.
[23] 蒋珍菊, 林芳栋.莱因-埃农氏法测定原料乳中乳糖含量的研究[J].食品工业科技, 2012, 33(14):80-82.JIANG Z J, LIN F D.Research of content determination of lactose in the raw milkby Lane-Eynon’s method[J].Science and Technology of Food Industry, 2012, 33(14):80-82.
[24] 薛建龙. 牛羊乳中蛋白质和脂肪的差异比较研究[D].西安:陕西科技大学, 2015.XUE J L.Comparative Study on the Difference of protein and Fat in Cattle and Sheep Milk[D].Xi’an:Shaanxi University of Science &Technology, 2015.
[25] 孙琦. 牛乳热加工特性及其盐类平衡的研究[D].北京:中国农业科学院, 2012.SUN Q.Study on thermal processing characteristics of milk and its salt balance[D].Beijing:Chinese Academy of Agricultural Sciences, 2012.