氧化作用是蛋白质发生变性的一个重要因素,它不仅能使蛋白质的结构遭到破坏,甚至还会影响和改变其功能特性,从而致使产品的风味、色泽以及质地等品质发生改变,威胁人体健康[1]。肉糜是常见的肉类加工制品,因其营养丰富和食用方便深受消费者的喜爱,并且在食品工业中有着广泛应用[2]。然而,肉糜在加工储藏过程中易发生氧化,氧化后可能出现一些问题,如产生酸败味以及哈喇味、使其保水性下降等,不仅影响其食用品质,还会缩短货架期[3]。
多酚能够有效清除自由基,降低蛋白质氧化程度,且因其为天然物质,具有安全、高效的特点而受到大量食品研究相关人员的关注[4]。儿茶素是茶多酚中最重要的一种黄烷醇组分[5],其结构中存在多个酚羟基,易被氧化生成对应的O-醌类,两者都是氢气的受体或供体,因而具有较高的抗氧化活性[6]。SOENDJAJA等[7]通过对豌豆和大豆蛋白溶液中脂质氧化的研究发现,儿茶素主要通过与蛋白质的相互作用来减少脂质氧化。PI等[8]评估了大豆蛋白与多酚结合后的蛋白质修饰能力和功能特性,发现得到的偶联物抗氧化能力和乳化性能均得到大幅提高。
猪血红蛋白(porcine hemoglobin,PHb)是猪血中重要的营养成分,但由于其性质不稳定,很难进一步开发,因此通常需要将其进行改性。苏克楠等[9]采用酶解-磷酸化协同改性的方法对PHb进行处理,处理后的PHb的功能特性和稳定性得到提升。糖基化反应作为一种绿色高效的化学改性方法,可以改善蛋白质功能性质[10]。经糖基化后的蛋白质不仅溶解性得到了提高,而且其乳化性、起泡性和抗氧化性都得到了不同程度的改善[11]。NOOSHKAM等[12]通过对蛋白质进行糖基化改性,增强蛋白质在长期储存、加热和冻融处理、酸性条件各种不稳定条件下的抗氧化能力。BAK等[13]将PHb进行糖基化改性,发现得到的PHb水解产物风味最为中性,有望在食品中得到最广泛的应用。
目前关于PHb改性的研究有很多,但将改性后的PHb与儿茶素进行互作的相关研究很少。本文通过研究PHb、糖基化猪血红蛋白(glycosylated porcine hemoglobin,G-PHb)和儿茶素-糖基化猪血红蛋白(catechin complex glycosylated porcine hemoglobin,CG-PHb)对贮藏期内猪肉肉糜的动态流变性、水分分布、pH、挥发性盐基氮(total volatile basic nitrogen,TVB-N)、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)和羰基值的影响以及其抑菌作用来评估CG-PHb在肉糜制品中应用可行性。
1 材料与方法
1.1 材料与试剂
硼酸,茂名市雄大化工有限公司;硫代巴比妥酸,广东翁江化学试剂有限公司;MgO、三氯乙酸,广州市江顺化工科技有限公司;上述试剂均为分析纯。LB培养基,青岛海博生物技术有限公司;平板计数琼脂,广州市莱润实验仪器有限公司。
1.2 仪器与设备
PHSJ-4F型pH计,青岛明博环保科技有限公司;TA DHR-2流变仪,美国沃特斯公司;NMI20-015V-I低场核磁共振成像分析仪,上海纽迈电子科技有限公司;BBS-V800洁净工作台,济南鑫贝西生物技术有限公司;THZ-103B恒温培养摇床,上海一恒科学仪器有限公司。
1.3 试验方法
1.3.1 肉糜的制备
挑选符合国家卫生标准的猪肉,将解冻好的猪肉称重后洗净,除去可见脂肪与结缔组织,切成小块,然后用绞肉机绞碎,放入斩拌机中,2 000 r/min斩拌60 s,将肉糜分成4个处理组:第1组为空白对照组;第2、3、4组分别添加质量分数0.01%的PHb、G-PHb和CG-PHb;以2%(以肉饼质量为基准)NaCl为基础物质添加到各处理组中。充分混匀后,将肉糜制成15 g的均匀一致的肉饼,放入保鲜盒,用保鲜膜密封后,置于4 ℃冰箱冷藏。
1.3.2 动态流变学测定
参照许帅强等[14]的方法,并稍作改动。采用40 mm的铝平板探头,取适量肉糜样品置于测试平台上,涂布均匀,尽量地赶掉气泡。测定参数为:狭缝距离为1 mm,频率1 Hz,应变0.05%,样品以5 ℃/min从25 ℃升温至85 ℃,记录肉糜的储存模量(G′)随温度升高的变化情况。试验中为防止升温过程中水分的蒸发影响结果,用硅油封住平行板与空气接触的外沿。
1.3.3 低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)测定
将样品分成高1.5 cm的小块,取样器取样后放于核磁管底部。测试参数为:τ值(90°~180°脉冲)250 μs,重复间隔3 000 ms,接收信号光子数4 500,重复采样32,回波数10 000,质子共振频率为22.6 MHz,温度32 ℃,弛豫时间用CPMG序列测定,每个样品测定3个平行。
1.3.4 pH值测定
参照何向丽等[15]的方法进行测定。在第1、3、6、9天时,取出1 g样品并加入到9 mL蒸馏水中,匀浆处理1 min后使用pH计测定样品的pH值。
1.3.5 TVB-N值测定
根据阮一凡等[16]的方法,测定添加PHb、G-PHb和CG-PHb的肉糜样品在4 ℃分别贮藏1、3、6、9 d的TVB-N值,结果以mg/100 g表示。
1.3.6 TBARS值测定
参照张瑛等[17]的方法,测定添加PHb、G-PHb和CG-PHb的肉糜样品在4 ℃分别贮藏1、3、6、9 d的TBARS值,以每千克肉糜样品中丙二醛的含量表示TBARS值。
1.3.7 羰基值测定
参照李佳珊等[18]的方法并略加修改。10 g猪肉试样在10 g 0.1 mol/L磷酸盐缓冲液(pH 7)中均匀混合,取2支试管,每支试管中加入2 mL混合溶液和2 mL体积分数20%三氯乙酸混合,离心(10 000 r/min,5 min)。一份沉淀物用来测定蛋白质量浓度,另一份沉淀物加入2 mL 10 mmol/L的二硝基苯肼,在4 ℃下静置1 h,按12 000 r/min离心15 min,弃去上清液,沉淀干燥后,加入3 mL 6 mol/L盐酸胍(缓冲液pH 8.7),在50 ℃下保温45 min,在370 nm波长下测吸光度。羰基含量由公式(1)计算得到:
羰基含量![]()
(1)
式中:2.2×104,摩尔吸光系数,L/(mol·cm);106,单位转换系数;ρ,用盐酸胍作空白在280 nm波长处测得的蛋白质量浓度,mg/mL。
1.3.8 菌悬液制备及抑菌活性的测定
将活化后的的金黄色葡萄球菌和大肠杆菌接种在LB培养基中,在36 ℃培养24 h。取各供试菌的菌悬液,用无菌蒸馏水稀释合适倍数,通过平板计数法确定菌悬液浓度,使菌悬液浓度在106~108 CFU/mL,将菌悬液与灭菌后的固体培养基按照1∶100的体积比例混匀后倒平板。采用牛津杯法测定抑菌活性。
1.3.9 混合物、复合物的抑菌率测定
取若干支试管分别加入4 mL LB培养基灭菌后备用,向灭菌后的1~5号试管中加入100 μL的大肠杆菌菌液及1 mL一定浓度的样品溶液,使其最终质量浓度为分别为0.025、0.05、0.1、0.15、0.2 mg/mL,6号试管加入1 mL灭菌后的蒸馏水及100 μL大肠杆菌菌液作为阳性对照,7号试管只加入培养基加入1 mL灭菌后的蒸馏水作为阴性对照。将试管置于恒温摇床中37 ℃培养12 h后600 nm下测定OD值。计算如公式(2)所示:
抑菌率![]()
(2)
1.3.10 数据处理
对每组试验均做3次平行试验,利用Origin 9.0软件对紫外光谱、荧光光谱、傅里叶红外光谱的数据进行平滑处理及作图,利用DPS 7.05软件进行显著性分析。
2 结果与分析
2.1 动态流变学性质
对添加PHb、G-PHb和CG-PHb的肉糜进行温度扫描动态流变测试,可得到其储能模量(G′),动态流变学特性中的G′可以直观地表征蛋白质变性聚集和化学作用力变化引起的弹性变化,反映出肉糜凝胶的三维网状结构结合状态[19]。肌肉纤维蛋白受热凝聚是肉糜升温加热过程的实质,在此过程中蛋白质经历了解链、变性、凝聚等变化,故其动态流变过程极不稳定。凝胶结构受肌肉中肌原纤维蛋白变性的影响体现在热动态流变的变化上,肌原纤维蛋白形成凝胶的能力越好G′值就越高。由图1可知,随着温度的升高,肉糜的G′值均呈现先上升后趋于平缓的趋势,G′值的上升,是由于蛋白质分子充分展开,分子之间互相交联构成稳定的结构;后趋于平缓,且有下降趋势,这可能是温度超过了蛋白三维网状结构的热稳定值,从而造成了稳定结构的破坏,与刁小琴等[20]的研究结果一致。相同温度下,添加PHb、G-PHb和CG-PHb的肉糜样品,其弹性模量G′均高于空白对照组,这表明三者均可以增强肌原纤维蛋白的凝胶能力,有效帮助肉糜形成稳定致密的凝胶网络结构。且同样的添加量下,添加CG-PHb的肉糜G′最大,G-PHb次之,而添加PHb的肉糜G′最小,这表明添加CG-PHb的肉糜具有优良的弹性,糖基化处理及与儿茶素复合可以提高肉糜的凝胶品质。从不同贮藏期的流变结果也可以看出,添加CG-PHb的肉糜G′始终高于其他组,且G′在前6 d的下降不明显。

a-0 d;b-3 d;c-6 d;d-9 d
图1 添加PHb、G-PHb和CG-PHb对肉糜动态流变性的影响
Fig.1 Effects of adding PHb, G-PHb, and CG-PHb on dynamic rheological properties of minced meat
2.2 LF-NMR分析
LF-NMR技术是由磁场对样品中的自旋原子核进行干扰,促使原子核吸收外界施加的射频场能量,并且发射电磁信号的物理技术[21]。水分作为肉制品中含量最高且非常重要的化学组分,直接关系到肉制品的品质,并影响其加工特性。采用LF-NMR可以检测肉糜中蛋白质水分迁移和分布变化,提供更多的信息。T2横向弛豫过程表征质子自旋系统内部的能量交换,能够有效地表征水分的分布特性变化。通过弛豫时间T2反映肉糜中水分的3种状态:结合水、不易流动水和自由水。随着弛豫时间T2的增加,水分从结合水逐渐过渡到自由水,水分子变得更容易流动。由图2可知,空白组及各处理组肉糜均呈现3个T2弛豫时间峰,弛豫时间在0~10 ms出现的峰表示肉糜中蛋白质等大分子结合的水和部分脂肪中的水分,称结合水;弛豫时间在10~100 ms的特征峰称为不易流动水,用T21表示;弛豫时间在100~1 000 ms的特征峰称为自由水,用T22表示。各处理组肉糜中结合水的弛豫时间无明显变化。与空白组相比,CG-PHb增加了肉糜中不易流动水的峰比例,自由水和结合水的变化很小,说明添加CG-PHb能够有效地改善肉糜的凝胶性能,提高其品质。从不同贮藏期的水分分布图可以看出,自由水逐渐增加,而添加了CG-PHb的肉糜自由水的增加量最少,同样说明了CG-PHb改善了猪肉的凝胶性能。栗俊广等[22]通过将鹰嘴豆分离蛋白添加至猪肉糜中来研究猪肉糜中水分的分布状态,发现添加鹰嘴豆分离蛋白,增加了猪肉糜的T21的峰比例,减少了T22的峰比例,从而提升猪肉糜凝胶的品质,这与我们的研究结果相似。

a-1 d;b-3 d;c-6 d;d-9 d
图2 添加PHb、G-PHb和CG-PHb对肉糜不同组分水分弛豫时间的影响
Fig.2 Effects of adding PHb, G-PHb, and CG-PHb on water relaxation time of different components of minced meat
2.3 pH值的变化
pH是反映肉品新鲜程度的重要指标,由图3可以看出,不同组肉糜的pH均随着贮藏日期的延长呈现出先降低后升高的趋势,肌糖原发生无氧酵解产生乳酸是导致肉糜的pH在贮藏初期逐渐降低的原因;而随着时间的延长,肉糜中的蛋白质被微生物和酶分解产生一系列次级代谢产物(例如氨及胺类和碱性化合物)在肉糜中逐渐积累,使得pH升高。经PHb、G-PHb和CG-PHb处理后的肉糜pH均显著低于对照组(P<0.05)。其中CG-PHb处理9 d后pH值最低为5.83,且变化幅度最小(0.04)。说明添加PHb、G-PHb和CG-PHb均可以降低肉糜在贮藏过程中蛋白质分解成氨类和碱性物质的速度,抑制pH值的增加。魏瑾雯等[23]制备西兰花叶多酚-木薯淀粉/果胶复合基膜,有效的抑制了羊肉pH的增长,说明多酚对羊肉具有良好的保鲜效果,与本文研究结果一致。
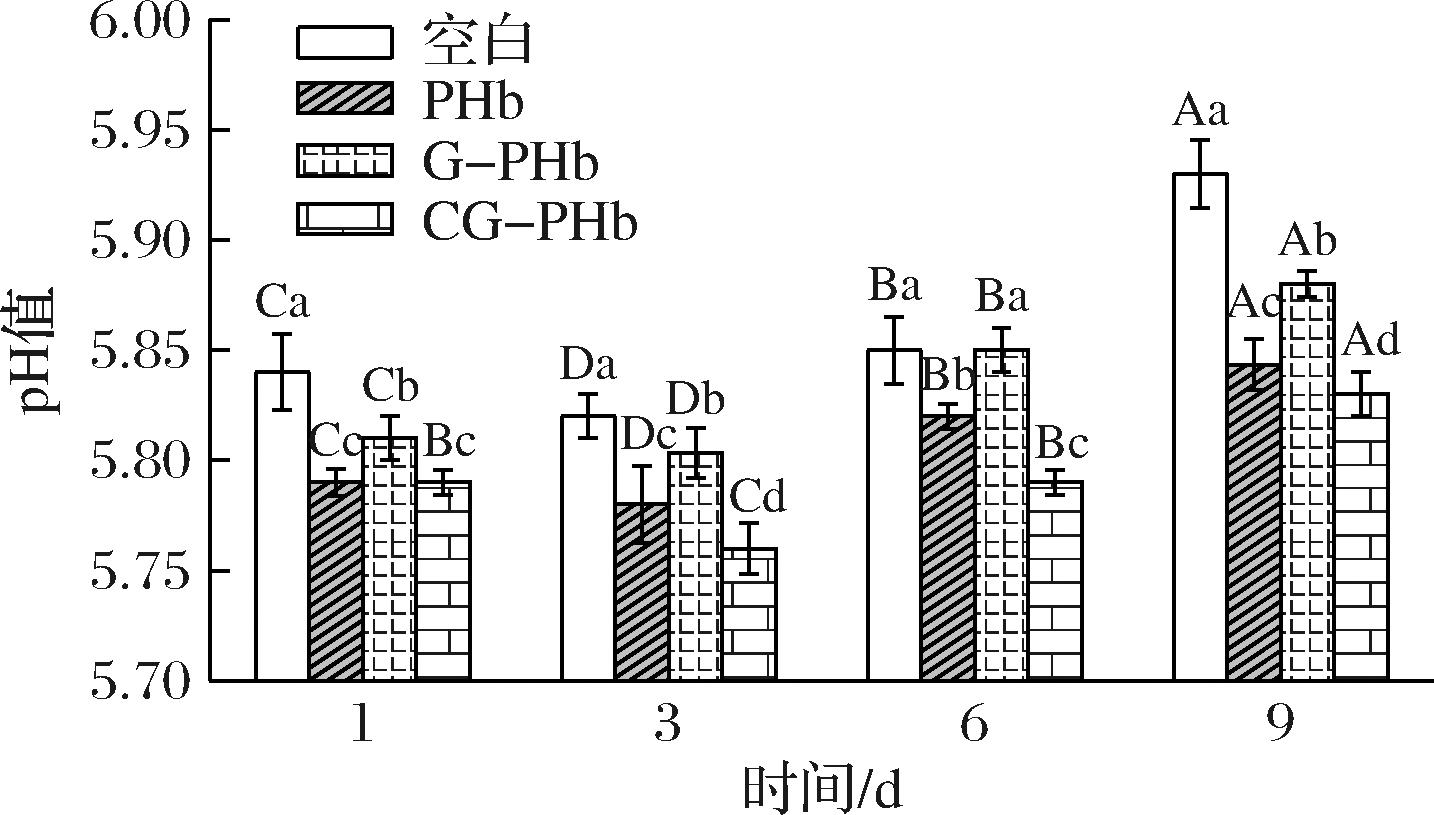
图3 添加PHb、G-PHb和CG-PHb对肉糜贮藏期pH的影响
Fig.3 Effects of adding PHb, G-PHb, and CG-PHb on the pH of minced meat during storage
注:不同大写字母代表同一组别不同贮藏时间的显著差异;不同小写字母代表不同组别在同一贮藏时间的显著差异(P<0.05)(下同)。
2.4 TVB-N分析
TVB-N是表征肉及肉制品新鲜度的常用参数,TVB-N值的增加是由微生物和内源性酶的协同作用引起的[24]。由图4可知,对照组与试验组的肉糜的TVB-N值随着贮藏期的延长不断增加。贮藏1 d时,各处理组之间并无显著差异(P<0.05),贮藏时间为9 d时,空白组及添加PHb、G-PHb和CG-PHb的肉糜TVB-N值分别增大了21.18、17.35、19.51、11.88 mg/100 g,且各处理组之间差异显著(P<0.05)。CG-PHb处理后的肉糜TVB-N值显著降低(P<0.05),说明CG-PHb的添加有效抑制了因蛋白质腐败分解而造成的TVB-N的形成,这可能与CG-PHb的抗氧化活性有关。TANG等[25]研究表明儿茶素对鸡肉具有良好的抗氧化效果,其原因是儿茶素结构中酚羟基与自由基相互结合,并络合金属离子,截断脂肪氧化反应链,抑制鸡肉脂肪氧化的进程。
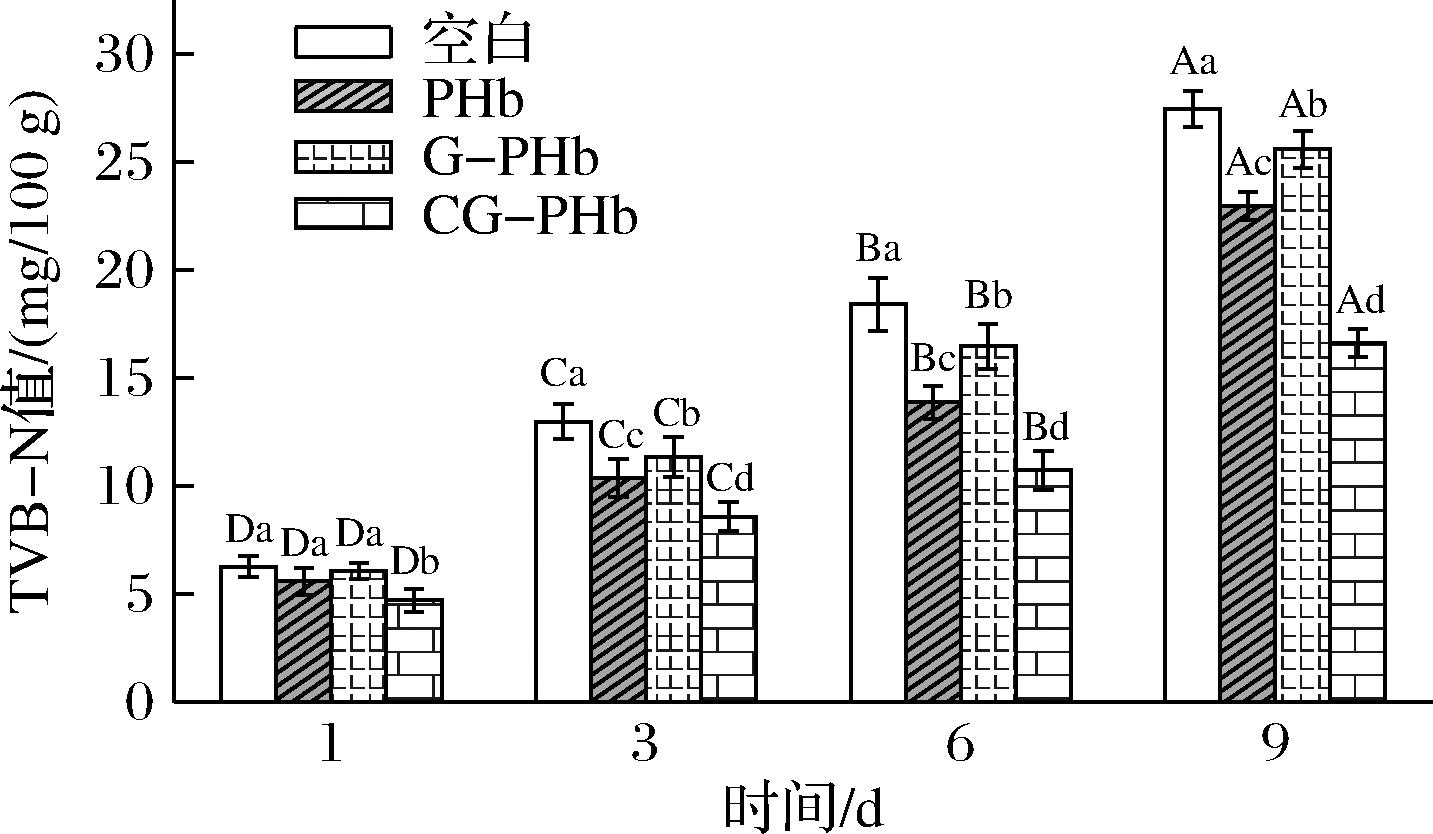
图4 添加PHb、G-PHb和CG-PHb对肉糜贮藏期TVB-N值的影响
Fig.4 Effect of adding PHb, G-PHb, and CG-PHb on TVB-N of minced meat during storage
2.5 TBARS分析
TBARS值能够反映肉类脂肪的氧化程度,通常被认为是肉制品重要的品质参数,随着氧化程度的加深,氧化产物不断增多,TBARS值不断增大。由图5可知,试验组与空白对照组的肉糜的TBARS值均随着贮藏时间的延长整体呈上升趋势,其中空白组第9天的TBARS值约为第1天时的4倍,上升幅度最大。而相较于空白组,添加CG-PHb使肉糜样品TBARS值增加的幅度由1.39 mg/kg降至0.65 mg/kg,变化显著(P<0.05)。这表明CG-PHb可以减缓肉糜在贮藏期间的TBARS值的变化,能有效抑制猪肉糜中脂肪的氧化。赵钜阳等[26]在研究儿茶素对虾滑贮藏和食用品质的影响中发现,添加儿茶素可有效延缓虾滑的TBARS值,这与本文结果一致。
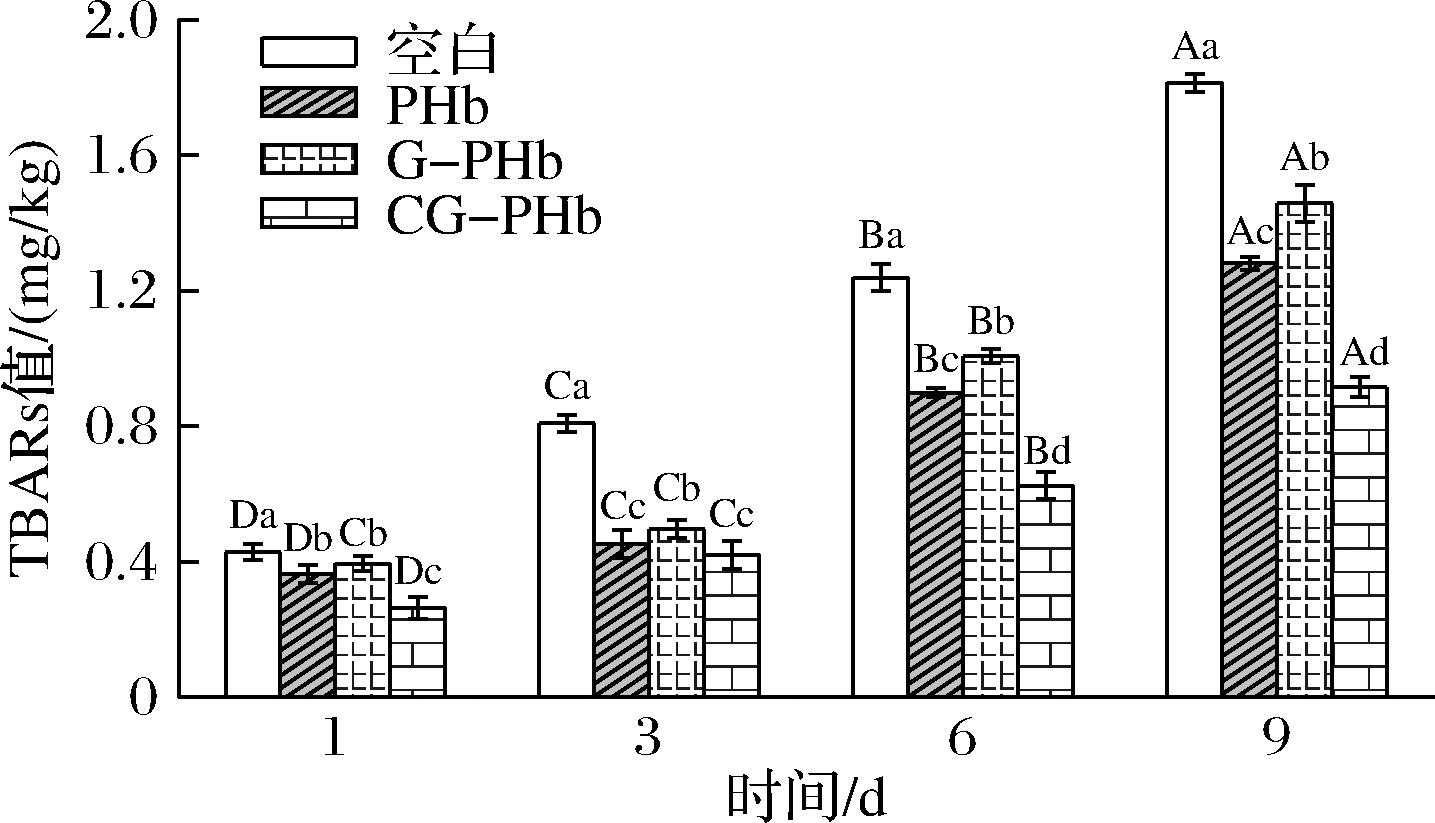
图5 添加PHb、G-PHb和CG-PHb对肉糜贮藏期TBARS值的影响
Fig.5 Effects of adding PHb, G-PHb, and CG-PHb on TBARS of minced meat during storage
2.6 羰基值分析
羰基主要由赖氨酸、精氨酸、脯氨酸等氨基酸的侧链直接氧化形成,因此产生羰基类化合物是蛋白质氧化的重要标志。如图6所示,随着贮藏时间延长,各处理组中羰基含量均呈上升趋势,说明贮藏时间越长,猪肉糜中蛋白氧化程度越严重。相同贮藏时间时,添加有CG-PHb的猪肉糜羰基值显著低于其他组(P<0.05),说明CG-PHb具有良好的抑制蛋白质氧化的性能。
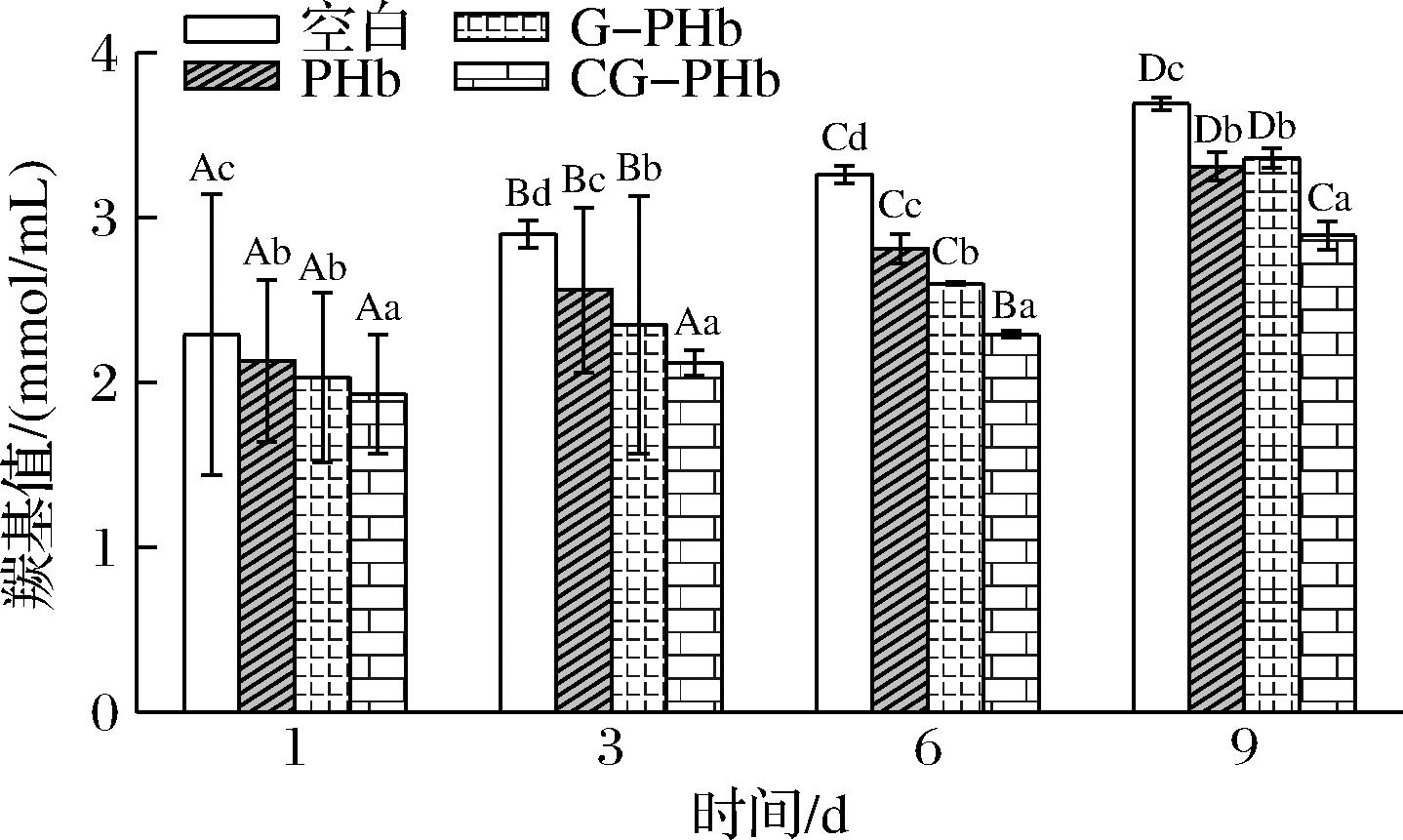
图6 添加PHb、G-PHb和CG-PHb对肉糜贮藏期羰基值的影响
Fig.6 Effect of the addition of PHb, G-PHb and CG-PHb on the carbonyl value of minced meat during storage
2.7 抑菌性能对比分析
抑菌圈和抑菌率是最为常用的抑菌性能指标[27],本文将G-PHb与儿茶素进行相互作用制备其复合物CG-PHb并以PHb为对照组,对其抑菌性能进行了研究。由表1结果可知,CG-PHb浓度与其对大肠杆菌以及金黄色葡萄球菌的抑菌率呈现正相关,且表现出最好的抑制作用,对大肠杆菌的抑菌率较PHb和G-PHb分别平均提高了14.93%和7.05%(P<0.05);对金黄色葡萄球菌的抑菌率较PHb和G-PHb分别平均提高了47.54%和33.40%(P<0.05)。图7为3种样品质量浓度为5 mg/mL时的抑菌圈结果,在培养24 h的情况下,通过比较抑菌圈直径可以发现,在同一质量浓度下,PHb基本上没有抑菌作用,G-PHb的抑菌效果很微弱,金黄色葡萄球菌和大肠杆菌对CG-PHb最为敏感,且CG-PHb对金黄色葡萄球菌的抑制效果优于大肠杆菌。
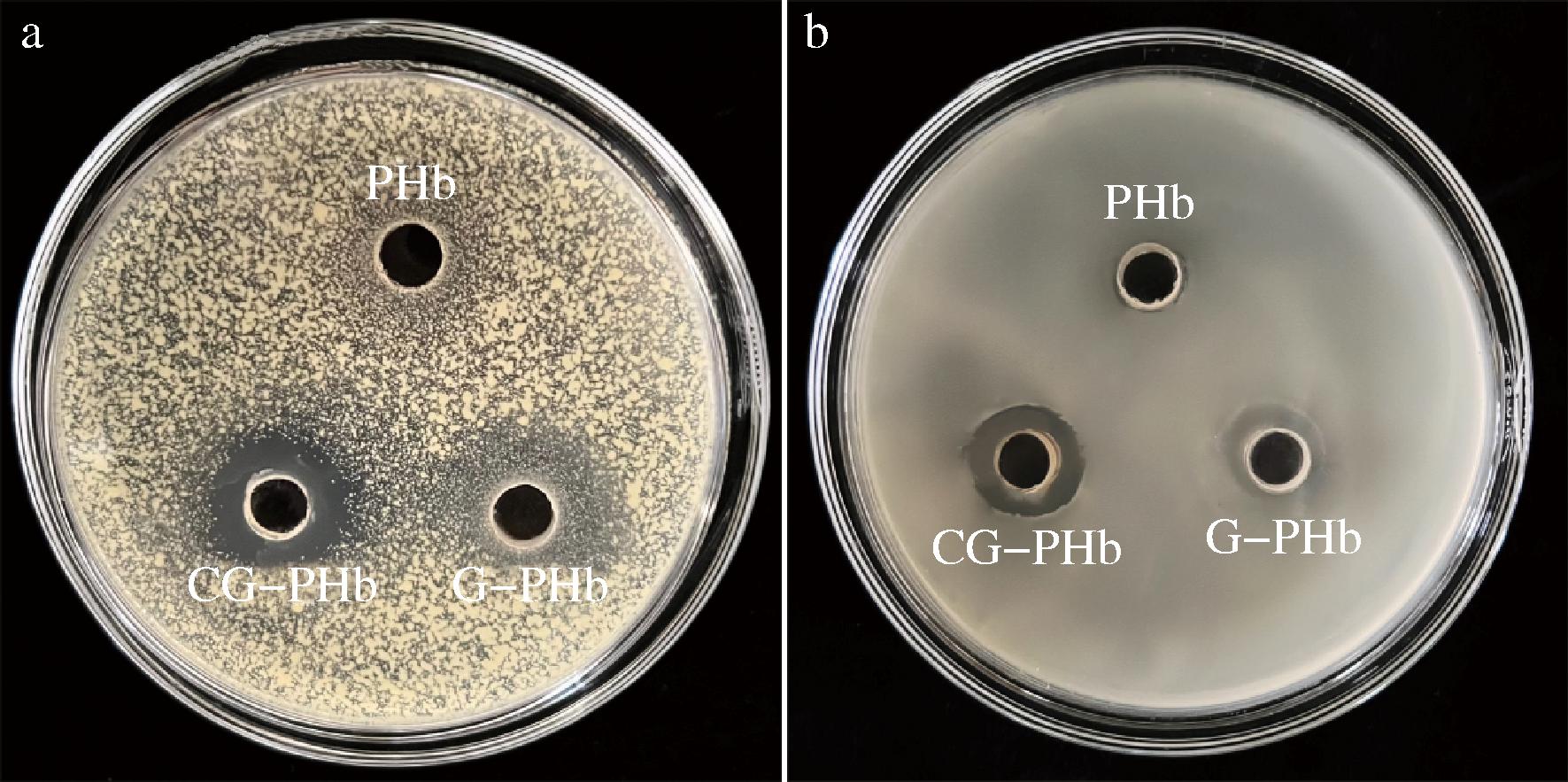
a-金黄色葡萄球菌;b-大肠杆菌
图7 PHb、G-PHb和CG-PHb的抑菌效果图
Fig.7 Antibacterial effects of PHb, G-PHb, and CG-PHb
表1 PHb、G-PHb和CG-PHb的抑菌率 单位:%
Table 1 Bacteriostatic rate of PHb, G-PHb and CG-PHb
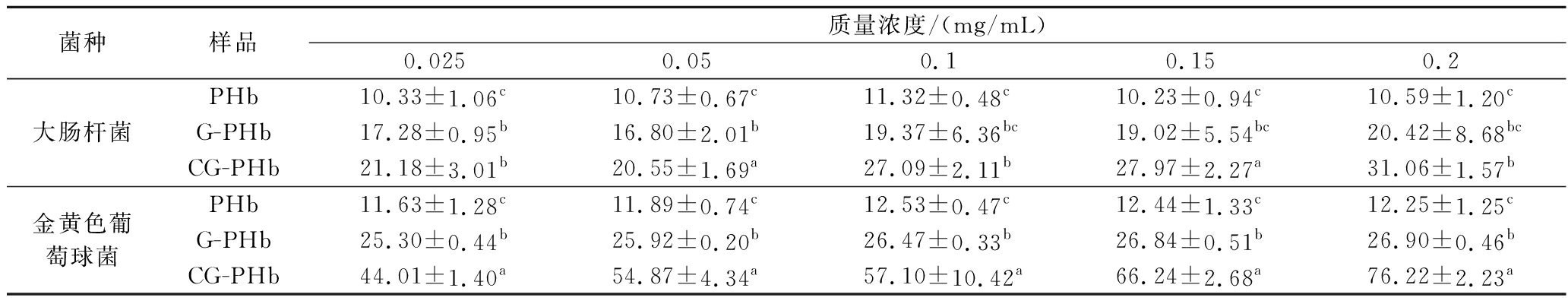
菌种样品质量浓度/(mg/mL)0.0250.050.10.150.2大肠杆菌PHb10.33±1.06c10.73±0.67c11.32±0.48c10.23±0.94c10.59±1.20cG-PHb17.28±0.95b16.80±2.01b19.37±6.36bc19.02±5.54bc20.42±8.68bcCG-PHb21.18±3.01b20.55±1.69a27.09±2.11b27.97±2.27a31.06±1.57b金黄色葡萄球菌PHb11.63±1.28c11.89±0.74c12.53±0.47c12.44±1.33c12.25±1.25cG-PHb25.30±0.44b25.92±0.20b26.47±0.33b26.84±0.51b26.90±0.46bCG-PHb44.01±1.40a54.87±4.34a57.10±10.42a66.24±2.68a76.22±2.23a
注:同列肩标字母不同表示差异显著(P<0.05)。
3 结论
本文研究了添加PHb、G-PHb和CG-PHb对肉糜动态流变性、水分分布、pH值、TVB-N及抑菌性能的影响,主要结论如下:添加CG-PHb的肉糜具有优良的弹性,CG-PHb增加了肉糜中不易流动水的峰比例,自由水和结合水的变化很小,说明PHb经糖基化处理及与儿茶素复合可以有效地改善肉糜的凝胶性能,提高其品质;添加PHb、G-PHb和CG-PHb均可以降低肉糜在贮藏过程中蛋白质分解成氨类和碱性物质的速度,抑制pH值的增加;CG-PHb可以抑制因蛋白质腐败分解而造成的TVB-N的形成,降低肉糜的TVB-N值;同时,CG-PHb可以抑制肉糜中脂肪和蛋白质的氧化,降低TBARS值和羰基值。对比分析PHb、G-PHb和CG-PHb的抑菌效果,得到相较于PHb和G-PHb,CG-PHb对金黄色葡萄球菌的抑菌率平均提高了47.54%和33.40%(P<0.05),对大肠杆菌的抑菌率平均提高了14.93%和7.05%(P<0.05),CG-PHb表现出了最好的抑菌效果。综上,添加CG-PHb后的肉糜弹性变好,凝胶性能得到改善,降低蛋白质分解速度,抑制脂肪氧化以及具有良好的抑菌效果,可为CG-PHb应用于肉糜储藏提供理论支持。
[1] WU H Z, BAK K H, GORAN G V, et al.Inhibitory mechanisms of polyphenols on heme protein-mediated lipid oxidation in muscle food:New insights and advances[J].Critical Reviews in Food Science and Nutrition, 2024, 64(15):4921-4939.
[2] 张根生, 赵金娜, 刘燕静, 等.复配决明胶配比优化及对肉糜肠品质影响[J].中国食品添加剂, 2023, 34(4):14-22.ZHANG G S, ZHAO J N, LIU Y J, et al.Optimization of the ratio of compounded cassia gum and its effect on the quality of minced meat sausage[J].China Food Additives, 2023, 34(4):14-22.
[3] 余康, 邹俊, 袁梦, 等.纳米茶籽油微囊对低脂猪肉糜制品品质影响[J].食品工业科技, 2024,45(4):61-69.YU K, ZOU J, YUAN M, et al.Effect of nano tea seed oil microcapsules on the quality of low fat minced pork products[J].Science and Technology of Food Industry, 2024,45(4):61-69.
[4] ABD EL-HACK M E, DE OLIVEIRA M C, ATTIA Y A, et al.The efficacy of polyphenols as an antioxidant agent:An updated review[J].International Journal of Biological Macromolecules, 2023, 250:126525.
[5] WANG W W, LE T, WANG W, et al.Effects of key components on the antioxidant activity of black tea[J].Foods, 2023, 12(16):3134.
[6] SEBASTIANI F, D’ALTERIO C, VOCCA C, et al.Effectiveness of silymarin, sulforaphane, lycopene, green tea, tryptophan, glutathione, and escin on human health:A narrative review[J].Uro, 2023, 3(3):208-228.
[7] SOENDJAJA V, GIRARD A L.Effects of plant polyphenols on lipid oxidation in pea and soy protein solutions[J].Food Chemistry, 2024, 433:137340.
[8] PI X W, LIU J F, SUN Y X, et al.Protein modification, IgE binding capacity, and functional properties of soybean protein upon conjugation with polyphenols[J].Food Chemistry, 2023, 405(Pt A):134820.
[9] 苏克楠, 刘丽莉, 杨乐, 等.酶解-磷酸化协同改性对猪血红蛋白功能特性和结构的影响[J].核农学报, 2023, 37(10):2028-2033.SU K N, LIU L L, YANG L, et al.Effects of synergistic enzymatic-phosphorylation modification on the functional properties and structure of porcine haemoglobin[J].Journal of Nuclear Agricultural Sciences, 2023, 37(10):2028-2033.
[10] 冷雪冬, 孙华军, 朱磊, 等.米糠蛋白复合戊聚糖糖基化反应条件的优化及性质研究[J].中国粮油学报, 2023,38(11):69-74.LENG D X, SUN H J, ZHU L, et al.Optimization of the reaction conditions and properties of rice bran protein complex pentoglycation[J].Journal of the Chinese Cereals and Oils Association, 2023,38(11):69-74.
[11] ZHOU Y, PETROVA S P, EDGAR K J.Chemical synthesis of polysaccharide-protein and polysaccharide-peptide conjugates:A review[J].Carbohydrate Polymers, 2021, 274:118662.
[12] NOOSHKAM M, VARIDI M, ZAREIE Z, et al.Behavior of protein-polysaccharide conjugate-stabilized food emulsions under various destabilization conditions[J].Food Chemistry:X, 2023, 18:100725.
[13] BAK K H, WAEHRENS S S, FU Y, et al.Flavor characterization of animal hydrolysates and potential of glucosamine in flavor modulation[J].Foods, 2021, 10(12):3008.
[14] 许帅强, 孙迪, 邵俊花, 等.不同盐处理对肉糜乳化凝胶水合特性及蛋白质构象变化的影响[J].食品与发酵工业, 2018, 44(11):105-110.XU S Q, SUN D, SHAO J H, et al.Effect of salt treatments on protein hydration properties and molecular conformation of emulsified gel[J].Food and Fermentation Industries, 2018, 44(11):105-110.
[15] 何向丽, 曹利娜, 朱宸言.食盐质量分数对冷冻猪里脊肉糜解冻后加工特性的影响[J].食品科技, 2022, 47(11):99-105.HE X L, CAO L N, ZHU C Y.Effects of salt concentration on processing characteristics in thawed pork tenderloin meat batters[J].Food Science and Technology, 2022, 47(11):99-105.
[16] 阮一凡, 潘道东, 孙杨赢, 等.混菌发酵鸭腿工艺优化及其贮藏品质特性[J].食品科学, 2020, 41(10):101-109.RUAN Y F, PAN D D, SUN Y Y, et al.Optimization of production of fermented duck thigh with a mixed starter culture of Lactobacillus plantarum and Saccharomyces cerevisiae and changes in its quality characteristics during storage[J].Food Science, 2020, 41(10):101-109.
[17] 张瑛, 张宇晴, 杨铭铎, 等.罗汉果甜苷对炖煮五花肉品质及贮藏稳定性的影响[J].食品工业科技, 2023, 44(10):336-342.ZHANG Y, ZHANG Y Q, YANG M D, et al.Effect of mogroside on the quality and storage stability of stewed pork belly[J].Science and Technology of Food Industry, 2023, 44(10):336-342.
[18] 罗章, 陈琴, 刘振东, 等.红曲色素改善藏香猪肉糜贮藏品质的机理研究[J].高原农业, 2023, 7(4):345-358.LUO Z, CHEN Q, XU J, et al.Study on the mechanism of monascus pigment improving the storage quality of Tibetan pork[J].Journal of Plateau Agriculture, 2023, 7(4):345-358.
[19] 曹涓泉, 李心悦, 徐静, 等.圆苞车前子壳粉对鸡肉肌原纤维蛋白凝胶特性和蛋白结构的影响[J].食品工业科技, 2023, 44(17):100-107.CAO J Q, LI X Y, XU J, et al.Effects of Psyllium husk powder on gel properties and protein structure of chicken myofibrillar protein[J].Science and Technology of Food Industry, 2023, 44(17):100-107.
[20] 刁小琴, 孙薇婷, 徐筱君, 等.高压处理大豆分离蛋白水解物对羊肉糜凝胶特性及贮藏期氧化稳定性的影响[J].食品科学技术学报, 2022, 40(5):160-170.DIAO X Q, SUN W T, XU X J, et al.Effects of soy protein isolate hydrolysate obtained by high pressure processing on gelation properties and oxidation stability of mutton batters during storage[J].Journal of Food Science and Technology, 2022, 40(5):160-170.
[21] ZHU M M, WANG H, ZONG J X, et al.Evaluating the effects of low-frequency alternating magnetic field thawing on oxidation, denaturation, and gelling properties of porcine myofibrillar proteins[J].Food Chemistry, 2024, 433:137337.
[22] 栗俊广, 张旭玥, 陈宇豪, 等.鹰嘴豆分离蛋白对猪肉肌原纤维蛋白乳化特性的影响[J].轻工学报, 2021, 36(6):30-37.LI J G, ZHANG X Y, CHEN Y H, et al.Effects of chickpea protein isolate on the emulsification properties of pork myofibrillar protein[J].Journal of Light Industry, 2021, 36(6):30-37.
[23] 魏瑾雯, 孔祥颖, 张伟, 等.西兰花叶多酚-木薯淀粉/果胶复合膜对羊肉冷藏保鲜效果的影响[J].食品与发酵工业, 2022, 48(21):232-238.WEI J W, KONG X Y, ZHANG W, et al.Effect of broccoli leaf polyphenols-tapioca starch/pectin composite film on the refrigerated mutton[J].Food and Fermentation Industries, 2022, 48(21):232-238.
[24] PEREIRA A D, GOMIDE L A M, CECON P R, et al.Evaluation of mortadella formulated with carbon monoxide-treated porcine blood[J].Meat Science, 2014, 97(2):164-173.
[25] TANG S Z, KERRY J P, SHEEHAN D, et al.Antioxidative mechanisms of tea catechins in chicken meat systems[J].Food Chemistry, 2002, 76(1):45-51.
[26] 赵钜阳, 孙昕萌, 李越, 等.儿茶素对虾滑贮藏和食用品质的影响[J].食品与生物技术学报, 2023, 42(5):35-42.ZHAO J Y, SUN X M, LI Y, et al.Effects of catechins on storage and edible quality of shrimp paste[J].Journal of Food Science and Biotechnology, 2023, 42(5):35-42.
[27] 张孟军, 刘丽莉, 杨协力, 等.儿茶素与卵黄免疫球蛋白互作的多重光谱分析及抑菌性变化[J].光谱学与光谱分析, 2022, 42(7):2297-2303.ZHANG M J, LIU L L, YANG X L, et al.Multispectral analysis of interaction between catechins and egg yolk immunoglobulin and the change of bacteriostasis[J].Spectroscopy and Spectral Analysis, 2022, 42(7):2297-2303.