科学合理的膳食能改善人体健康,增强机体免疫力,预防病毒入侵。中华医学会肠外肠内营养分会建议:每天摄入高蛋白类食物,丰富食品种类和来源。然而,高动物蛋白膳食模式会增加肾脏负担,伴随摄入的高胆固醇会引起心血管疾病[1];适量摄入植物蛋白有利于减少心血管患病风险,且植物蛋白更经济。不过植物蛋白难以全面补充人体必需氨基酸,可以通过混合搭配动物蛋白和植物蛋白实现“蛋白质互补”,有效提升人体健康水平[2-3]。
鸡胸肉具高蛋白、低脂肪的优点,但加工特性差,难形成完好的热导凝胶网络结构[4]。大豆组织蛋白具有良好的吸水性、保油性和纤维状结构,是理想的肉制品替代物[5]。大豆蛋白和鸡肉重组经加热可形成新颖的双蛋白网络结构,但直接重组的双蛋白网络结构持水性较差,稳定性较低[6]。研究发现,肉制品中加入食用胶,可有效保持产品的多汁性,提高产品可接受度和膳食纤维含量,卡拉胶与魔芋胶属于多糖类食用胶,复配后的胶束能相互紧密缠绕,使凝胶网络结构充实[7]。谷氨酰胺转氨酶(glutamine transaminase,TG)是用于催化蛋白质分子交联的蛋白酶,可与变性淀粉和食用胶复合,增强素肉肠弹性,提高其产品品质[8]。目前,有关TG改善蛋白类制品品质的研究已相当广泛,如利用TG促进蛋白内或蛋白间、蛋白与多糖之间的交联[9-11],但综合考虑在TG的作用下,动-植物双蛋白与食用胶混合对肉制品品质及热导凝胶体系影响的研究极少。
本文基于前期实验以鸡胸肉、大豆蛋白为主料,添加羟丙基二淀粉磷酸酯(hydroxypropyl distarch phosphate,HDP)、食用胶、TG等辅料研制的动-植物双蛋白复合肉饼,深入探究各类添加物对双蛋白肉糜凝胶特性的影响,可为双蛋白产品的开发提供理论和技术支撑。
1 材料与方法
1.1 材料与试剂
冷冻鸡胸肉,重庆市北碚区天生丽街永辉超市;大豆分离蛋白、大豆组织蛋白、卡拉胶、TG,河南万邦化工科技有限公司;魔芋胶,四川森态园生物科技有限公司;HDP,上海鑫泰食品配料商城;二甲基硅油、三氯乙酸、KBr,成都市科龙化工试剂厂;尿素,广东光华科技股份有限公司;NaCl,成都金山化学试剂有限公司;福林酚试剂,上海瑞永生物科技有限公司。
1.2 仪器设备
MX-SS1绞肉机,厦门建松电器有限公司;TA-XT Plus质构仪,英国Stable Micro System公司;DHR-1流变仪,美国TA公司;ALPH2-1/LD冷冻干燥机,珀金埃尔默公司;SU8010高分辨冷场扫描电镜,日本日立公司;5840R冷冻离心机,德国Eppendorf公司;PB-10型pH计,赛多利斯科学仪器(北京)有限公司;UQL-861涡旋混合器,海门市齐林贝尔仪器制造有限公司;MC 759紫外分光光度计,上海菁华科技仪器有限公司;CHA-B水浴恒温振荡器,常州亚特实验仪器有限公司;IRTracer-100红外光谱仪,日本岛津公司,DXR2拉曼光谱仪,赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 复合双蛋白肉糜制作
1.3.1.1 原料预处理
将鸡胸肉化冻洗净,切成长宽高均为1.5 cm左右的肉粒。大豆组织蛋白复水:称取适量大豆组织蛋白,加入5倍质量50~60 ℃的温水,浸泡20 min,用水清洗2次,挤压多余水分,使吸水大豆组织蛋白质量数为原质量数的2.5倍。
1.3.1.2 复合双蛋白交联
参考高雪琴[12]方法并略作修改。根据前期实验,确定双蛋白复合肉糜基础配料(质量分数):鸡胸肉64.84%,大豆组织蛋白30%,大豆分离蛋白5.16%。按肉与大豆蛋白的总质量计,添加冰水10%,HDP 12%、复配胶1.52%、TG 0.25%。
设置5个样品组,分别为:A1双蛋白组(肉、大豆蛋白、水)、A2双蛋白+HDP组(肉、大豆蛋白、水、HDP)、A3双蛋白+食用胶组(肉、大豆蛋白、水、魔芋胶、卡拉胶)、A4双蛋白+TG组(肉、大豆蛋白、水、TG)、A5双蛋白+复合组(肉、大豆蛋白、水、HDP、魔芋胶、卡拉胶、TG)。肉粒中加入食盐、冰水总量1/2于绞肉机高速斩拌2 min,按组所需加入HDP、食用胶、TG、大豆分离蛋白及剩余冰水,高速斩拌1 min,最后加入大豆组织蛋白并中速斩拌1 min成双蛋白肉糜。
1.3.1.3 酶联反应
将1.3.1.2节制备的双蛋白肉糜放入容器密封,置于冰箱(4 ℃),静置6 h,备用。
1.3.1.4 肉糜凝胶制备
称取50 g制备好的肉糜于100 mL离心管密封,500 r/min、4 ℃离心3 min以驱除气泡。每个样品组肉糜均分为2组,其中1组肉糜置于4 ℃保存用于结合特性测定,另1组肉糜于90 ℃水浴锅加热20 min,取出冷却,擦去表面多余水分,为肉糜凝胶待测。
1.3.2 结合特性测定
将低速离心的肉糜(m1)放入离心管中(m0),70 ℃恒温水浴30 min。取出离心管,开盖倒置于已称重的干燥瓶(m2)中,室温静置2 h收集渗出液,称量余下离心管和肉糜总质量数(m3),将收集液体于105 ℃烘16 h,测定烘干后总质量(m4),每组6个重复。脂肪流失率计算时,忽略少量的蛋白和盐分损失[12]。计算方法如公式(1)~公式(3)所示:
总汁液流失率![]()
(1)
水分流失率![]()
(2)
脂肪流失率![]()
(3)
1.3.3 质构特性测定
将肉糜凝胶样品切成长宽高为1 cm的正方体。用物性测试仪对双蛋白肉糜凝胶进行质地多面剖析。质地剖面分析模式(texture profile analysis,TPA);36R平底柱形探头;测前速率l mm/s、测试速度l mm/s、测后速度l mm/s,压缩比50%[13]。每组试验重复5次,取平均值。
1.3.4 动态流变测定
样品置于载物台,涂抹均匀并赶走气泡,加硅油液密封边缘。选择40 mm直径的平板,夹具间隙1 mm,应变1%,20 ℃保温5 min,温度梯度20~80 ℃,升温时间5 ℃/min[12]。
1.3.5 红外光谱和拉曼光谱测定
将1.3.1节所得样品置于冰箱(-40 ℃)预冻12 h,于真空冷冻干燥机脱水24 h,样品粉末与KBr按1∶50的质量比混合,用玛瑙研钵研成粉后压片,置于红外光谱仪中进行全波长扫描,分辨率4 cm-1,扫描次数32次,测量范围400~4 000 cm-1。
将肉糜凝胶粉末平铺在玻璃片表面,置于载物台上进行拉曼光谱扫描测量。参数选择:激发波长785 nm;物镜20×焦距;光阑50 μm狭缝;曝光时间10 s;样品曝光15次。
1.3.6 分子间作用力的测定
不同溶剂能够破坏凝胶中的特定分子作用力,NaCl溶液(0.6 mol/L)会破坏离子键,低浓度(1.5 mol/L)尿素会破坏氢键,高浓度(8 mol/L)尿素会破坏疏水相互作用,而β-巯基乙醇(0.5 mol/L)会破坏二硫键[13]。参照文献[13-14]的方法,略作修改,每个样品组分别称取4份1 g肉糜凝胶样品,采用逐级溶解法,分别加入S1(0.6 mol/L NaCl)、S2(1.5 mol/L尿素和0.6 mol/L NaCl的混合液)、S3(8 mol/L尿素和0.6 mol/L NaCl的混合液)、S4(0.5 mol/L β-疏基乙醇、8 mol/L尿素和0.6 mol/L NaCl的混合液,pH 7)各20 mL,充分搅拌溶解,于10 000 r/min离心10 min,取出上清液,向所得上清液中分别加入等体积的三氯乙酸(20 g/100 mL),10 000 r/min离心10 min,弃上清液,向所得沉淀中分别加入1 mL NaOH溶液(1 mol/L),利用Lowry法测定其蛋白质含量。以溶解于S1的蛋白含量表示离子键含量,以溶解于S2溶液与S1溶液蛋白质含量的差值表示氢键含量,以溶解于S3溶液与S2溶液蛋白质含量的差值表示疏水相互作用的强弱,以溶解于S4溶液与S3溶液蛋白质含量的差值表示二硫键含量。
1.3.7 微观结构测定
将1.3.1节所制凝胶样品切成1 mm厚的块状,置于冰箱(-40 ℃)预冻12 h,于真空冷冻干燥机脱水24 h喷金,抽真空,电压5 kV,用扫描电镜放大2 000倍观察微观结构。
1.4 数据处理
所有结果均表示为平均值±标准差,使用SPSS 26通过软件对实验数据进行统计分析,不同小写字母表示样品间存在显著性差异(P<0.05)。PeakFit 4.12软件对光谱图进行平滑、去卷积等处理。采用Origin Pro 9.0软件绘制图表。
2 结果与分析
2.1 不同添加物对双蛋白肉糜凝胶结合特性的影响
结合特性是反映肉糜加热形成凝胶过程中,体系内脂肪融化、水分挥发导致产品得率和品质变化的重要指标。如图1所示,相较于A1组,A2、A3、A4、A5组汁液流失分别减少5.32%、5.45%、2.15%、9.88%,水分流失分别减少5.09%、5.23%、2.07%、9.54%,脂肪流失分别减少0.99%、0.85%、0.25%、1.32%。结果显示,与A1相比,其余组的汁液流失、水分流失都有明显减少,A5组显著低于其他各组(P<0.05),这可能是由于HDP能够填充于蛋白质空间网络结构中,吸收与蛋白质网络结构结合不紧密的水分,并将这些水分固定于体系内,使整个体系保水能力提高[15];魔芋胶和卡拉胶通过复配可产生交互作用与肌肉蛋白形成致密有序的网状结构,限制了凝胶中的水分子渗出,从而提高肉糜的持水性[16],这与代佳佳[4]报道的魔芋胶、卡拉胶交互作用能显著提高鸡胸肉匀浆物凝胶保水性的结果一致;双蛋白中含大豆分离蛋白,其长链结构中的极性基团能吸收保留水分,能与TG联合,形成交联网状结构,增强蛋白网络结构体系,使体系持水持油性提高。各添加物的加入均有效的改善了双蛋白肉糜凝胶的汁液流失问题,说明HDP、食用胶、TG的单独及复合添加可以有效参与肉糜凝胶的水、油截留过程,且复合添加的效果最好。
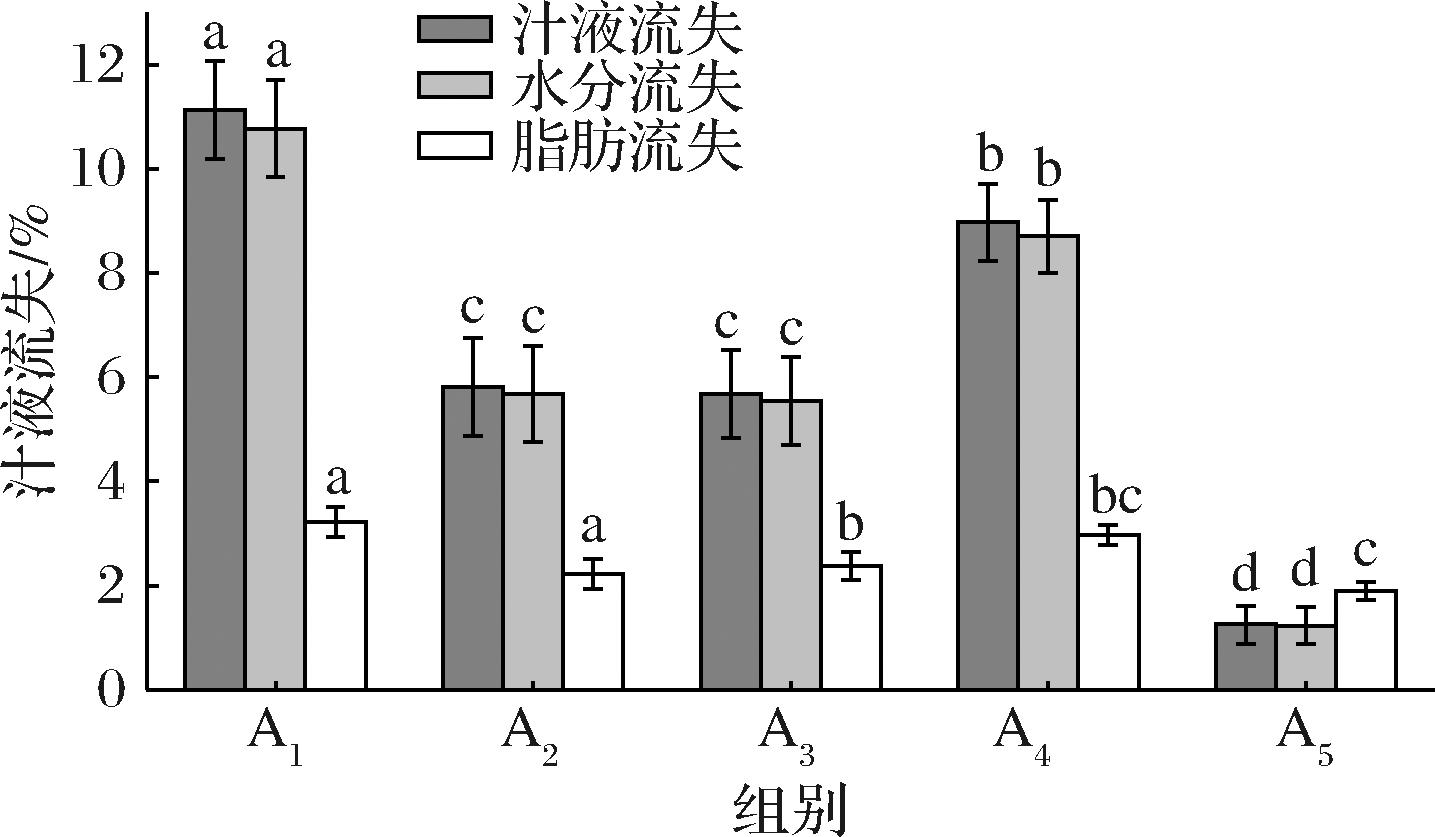
图1 不同添加物对双蛋白肉糜凝胶结合特性的影响
Fig.1 Effect of different additives on the binding properties of dual-protein mincemeat gel
注:不同小写字母代表差异显著(P<0.05)(下同)。
2.2 不同添加物对双蛋白肉糜凝胶质构特性的影响
如表1所示,与A1组相比,添加TG的A4组硬度稍有下降,主要原因可能是TG能增强双蛋白凝胶网络的交联,使体系的弹性、咀嚼性有所增加,能够降低肉糜凝胶的失水率,但其自身不具可填充网络体系的作用,从而降低了肉糜凝胶的硬度。A2组和A5组的硬度、弹性等均得到显著提高,可能是因为HDP吸水性好,自身具有填充作用,在加热后能糊化成黏稠且具有一定透明性的胶体,使双蛋白肉糜凝胶的稳定性得到提高;复合添加的双蛋白肉糜凝胶质地得到显著提升(P<0.05),这或是因为HDP能够填充在双蛋白凝胶网络中,束缚不能与双蛋白凝胶体系稳定结合的水,蛋白质分子在加热过程中内部功能性基团暴露,聚合物通过蛋白质分子间、蛋白质与多糖分子间的相互作用形成聚集体,随后聚集体交联形成有序的凝胶网络结构[17],魔芋胶、卡拉胶类多糖能与肌原纤维蛋白经交互作用后形成三维网状结构[4],TG能促进蛋白质分子间或分子内生成ε-(γ-谷氨酰)赖氨酸共价键,诱导蛋白质发生交联、聚合形成大分子网络结构[17-18],在TG与蛋白相互作用的基础上添加亲水多糖可改善食品的品质[19],提高了双蛋白凝胶硬度、咀嚼性等。
表1 不同添加物对双蛋白肉糜凝胶质构特性的影响
Table 1 Effects of different additives on texture characteristics of dual-protein mincemeat gel
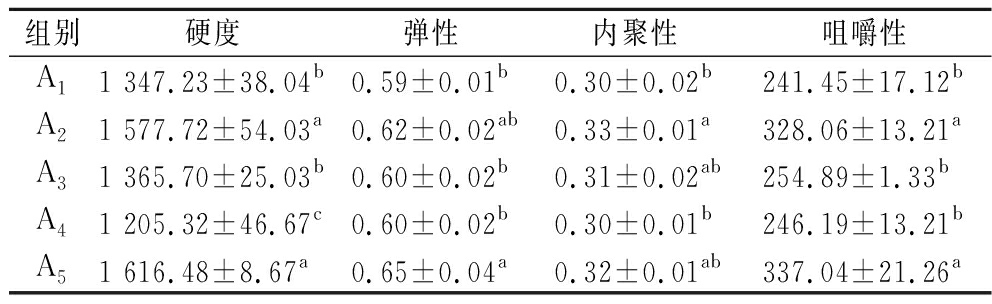
组别硬度弹性内聚性咀嚼性A11 347.23±38.04b0.59±0.01b0.30±0.02b241.45±17.12bA21 577.72±54.03a0.62±0.02ab0.33±0.01a328.06±13.21aA31 365.70±25.03b0.60±0.02b0.31±0.02ab254.89±1.33bA41 205.32±46.67c0.60±0.02b0.30±0.01b246.19±13.21bA51 616.48±8.67a0.65±0.04a0.32±0.01ab337.04±21.26a
2.3 不同添加物对双蛋白肉糜流变特性的影响
如图2-a所示,G′为储能模量,反映凝胶的弹性,其值越大,凝胶受力的复原力越强,凝胶内分子链的缠结点越多。肉糜凝胶的形成主要经历两个过程,首先蛋白受热变性展开,随后展开的蛋白因为凝集作用而形成较大分子的凝胶体[20]。各实验组均在35~50 ℃,各组肉糜凝胶的G′逐步上升,在50~55 ℃ G′开始下降,在55 ℃后G′再次上升。双蛋白肉糜凝胶的温度扫描曲线大体形态未发生大的变化,因此当凝胶形成时,肉糜凝胶网络结构仍然在各个混合体系中占主导地位。A1的G′值最低,随着HDP、食用胶、TG和复合物的依次加入,G′值得到不同程度的升高,且A5组升高的最为明显,其G′曲线的趋势呈迅速上升后趋于平缓,即形成更牢固的凝胶网络结构。说明不同的添加物增加了凝胶体系中分子链的缠结点,增大凝胶化程度[21]。在升温过程中,HDP逐渐糊化、吸水膨胀并占据更多空间,从而使双蛋白肉糜凝胶结构更紧凑,另外,随着温度的升高令蛋白质结构发生变化,蛋白质分子开始凝胶化[20,22],HDP吸水膨胀后黏弹性明显高于A1,从而导致HDP混合双蛋白肉糜凝胶发生变性时的G′更高[23]。魔芋胶、卡拉胶紧密链接缠绕可与肌球蛋白尾部结合,提高蛋白凝胶的三维网络结构[4],肉糜凝胶的热稳定性增强。TG的加入提升了蛋白间的交联程度,也可能促进了双蛋白与多糖间的相互作用[19]。因此各添加物的加入使双蛋白凝胶体系的G′上升,复合添加的G′值最高,形成凝胶性与热稳定性较好的复合双蛋白凝胶体系。阻尼因子tanδ为G″/G′的比值,是材料黏弹性评价另一指标。当tanδ<1时,样品表现为弹性特性,当tanδ>1时,样品表现为黏性特性,从图2-b可知,不同添加物的添加引起tanδ值减小,说明双蛋白肉糜凝胶体系弹性的增强[13],这与质构特性测定结果一致。

a-储能模量(G′);b-tanδ
图2 不同添加物对双蛋白肉糜温度扫描中G′和tanδ的影响
Fig.2 Effects of different additives on G′ and tanδ in temperature scanning of dual-protein mincemeat
2.4 不同添加物对双蛋白肉糜凝胶蛋白结构的影响
2.4.1 红外光谱分析结果
红外光谱能由引起偶极矩变化的分子振动来确定物质分子结构。主要特征峰有酰胺Ⅲ带(1 200~1 335 cm-1)、酰胺Ⅱ带(1 500~1 600 cm-1)、酰胺Ⅰ带(1 600~1 700 cm-1)、C—H的特征吸收峰(2 926 cm-1)和位于3 000~3 600 cm-1的单强峰(3 310 cm-1)。如图3可知,酰胺I带为酰胺带中吸收最强,也常被用作蛋白二级结构含量分析。2 926 cm-1附近出现的弱峰为酰胺B带的C—H伸缩,在3 000~3 600 cm-1的宽带归属为O—H和N—H基团,暗示着氢键相互作用的潜力,蛋白凝胶表面的强氢键势有助于蛋白质之间的稳定和有序,加速蛋白质的重排和聚集过[24]。
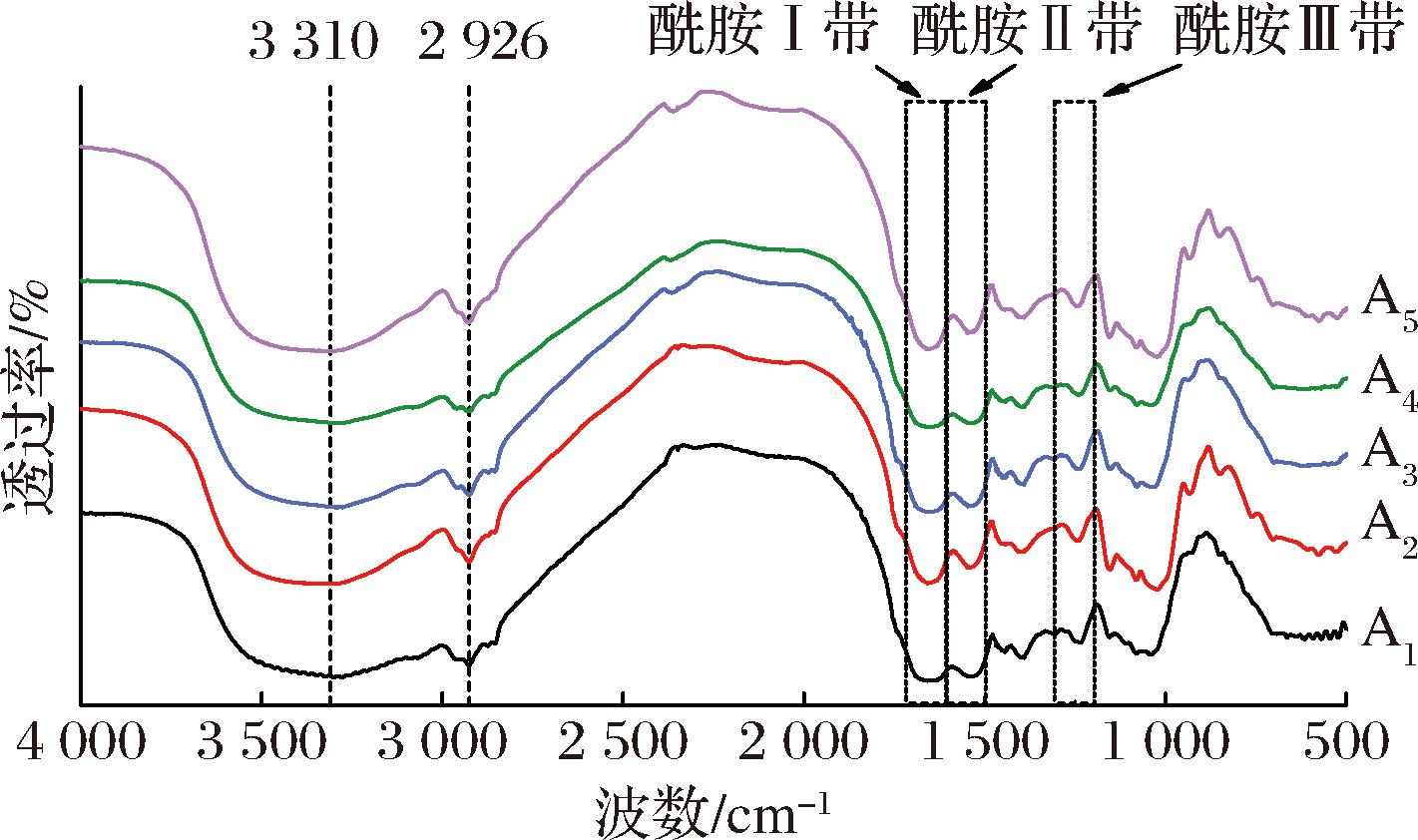
图3 双蛋白肉糜凝胶的红外光谱图
Fig.3 Infrared spectrum of dual-protein mincemeat gel
通过对红外光谱酰胺I带去卷积和拟合得到二级结构含量变化见图4。α-螺旋和β-折叠代表有序结构,β-转角和无规则卷曲代表无序结构[25]。添加HDP后,α-螺旋、β-转角、无规则卷曲占比均有减少,β-折叠含量增加6.17%,主要存在α-螺旋向β-折叠的转变,这可促进肌原纤维蛋白分子的伸展[26-27],使凝胶化作用增强。食用胶、TG及复合添加均能β-折叠相对含量增多,所形成的双蛋白体系稳定性得以提高,且复合添加组的双蛋白体系中2种无序结构向β-折叠有序结构转变最多,α-螺旋有序结构的相对含量仅减少1.96%,β-折叠相对含量增加4.7%,TG的添加能增强蛋白质分子内、分子间及蛋白质与多糖间的相互作用,推测TG可促进双蛋白质分子和多糖间的相互作用[19],多糖有利于α-螺旋结构的稳定,另一方面使β-转角与无规则卷曲向β-折叠有序结构转变,蛋白结构稳定性得到提高,有效改善了双蛋白肉糜凝胶特性。

图4 添加物对双蛋白肉糜凝胶蛋白质二级结构的影响
Fig.4 Effect of additives on secondary structure of dual-protein mincemeat gel
2.4.2 不同添加物对双蛋白肉糜凝胶的拉曼光谱分析结果
拉曼光谱可以分析蛋白质二级结构及某些氨基酸基团所处微环境的变化。为研究不同添加物对双蛋白肉糜凝胶体系蛋白结构的影响,对样品进行拉曼光谱扫描,结果如图5所示。
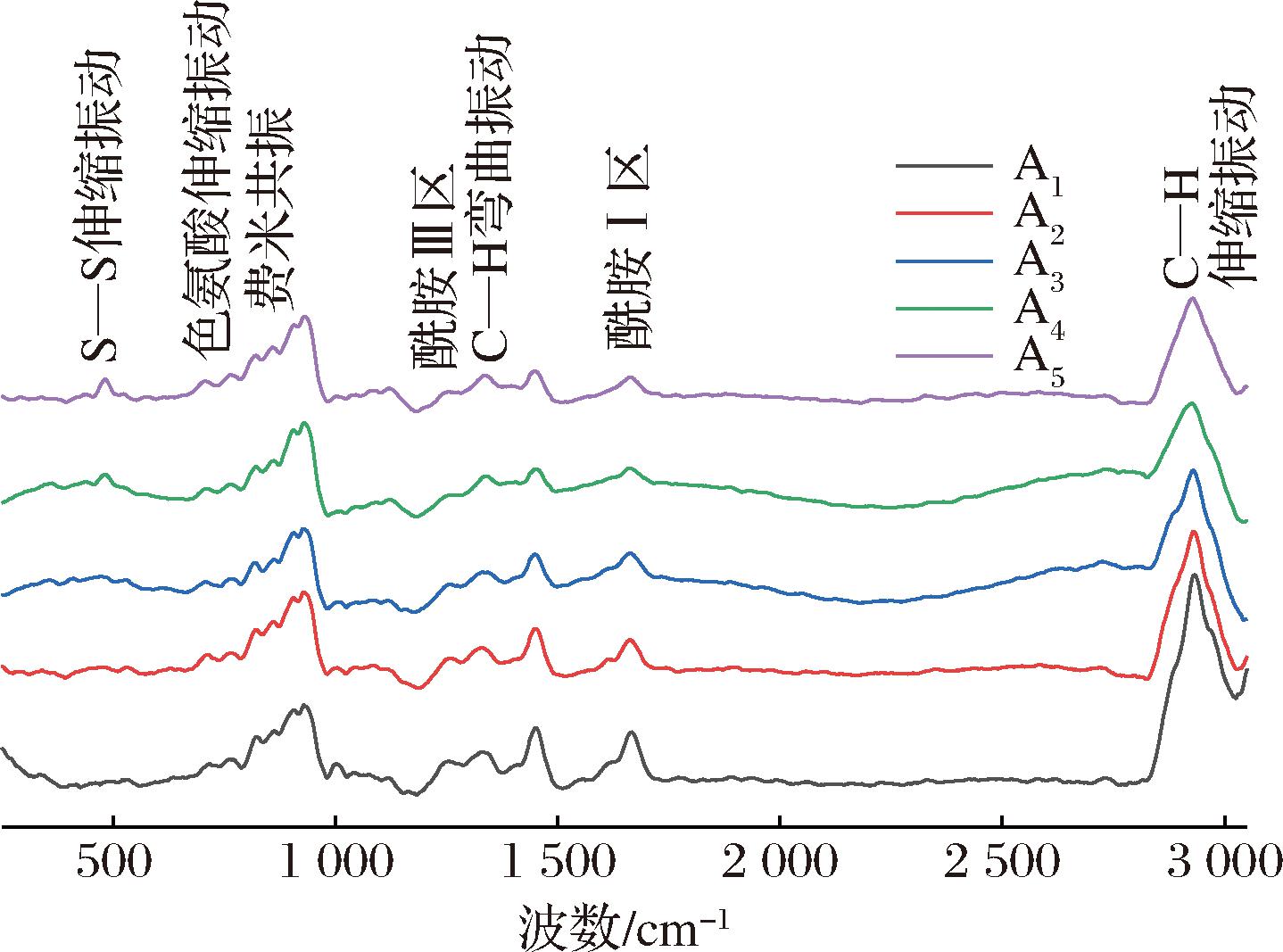
图5 双蛋白肉糜凝胶的拉曼光谱图
Fig.5 Raman spectrum of dual-protein mincemeat gel
2.4.2.1 S—S伸缩振动变化
二硫键是稳定蛋白质三级结构的作用力,在拉曼光谱中的吸收谱带为510~550 cm-1(图6),其中515 cm-1附近特征峰为扭式-扭式-扭式构象,525 cm-1附近特征峰为扭式-扭式-反式构象,540 cm-1附近特征峰为反式-扭式-反式构象[28]。A2和A3在515 cm-1附近的特征峰减弱甚至消失,而在519 cm-1出现一个条带更宽的特征峰,说明原本扭式-扭式-扭式构象的二硫键发生损失或扭式-扭式-反式构象的二硫键可能向反式-扭式-反式构象转变,而A3在525 cm-1附近的特征峰消失,在534 cm-1出现特征峰,说明原本为扭式-扭式-反式构象的二硫键发生损失或扭式-扭式-反式构象的二硫键可能向反式-扭式-反式构象转变[29]。随着不同物质的添加,各构象吸收峰均发波动变化,说明不同添加物在一定程度影响了蛋白质二硫键。
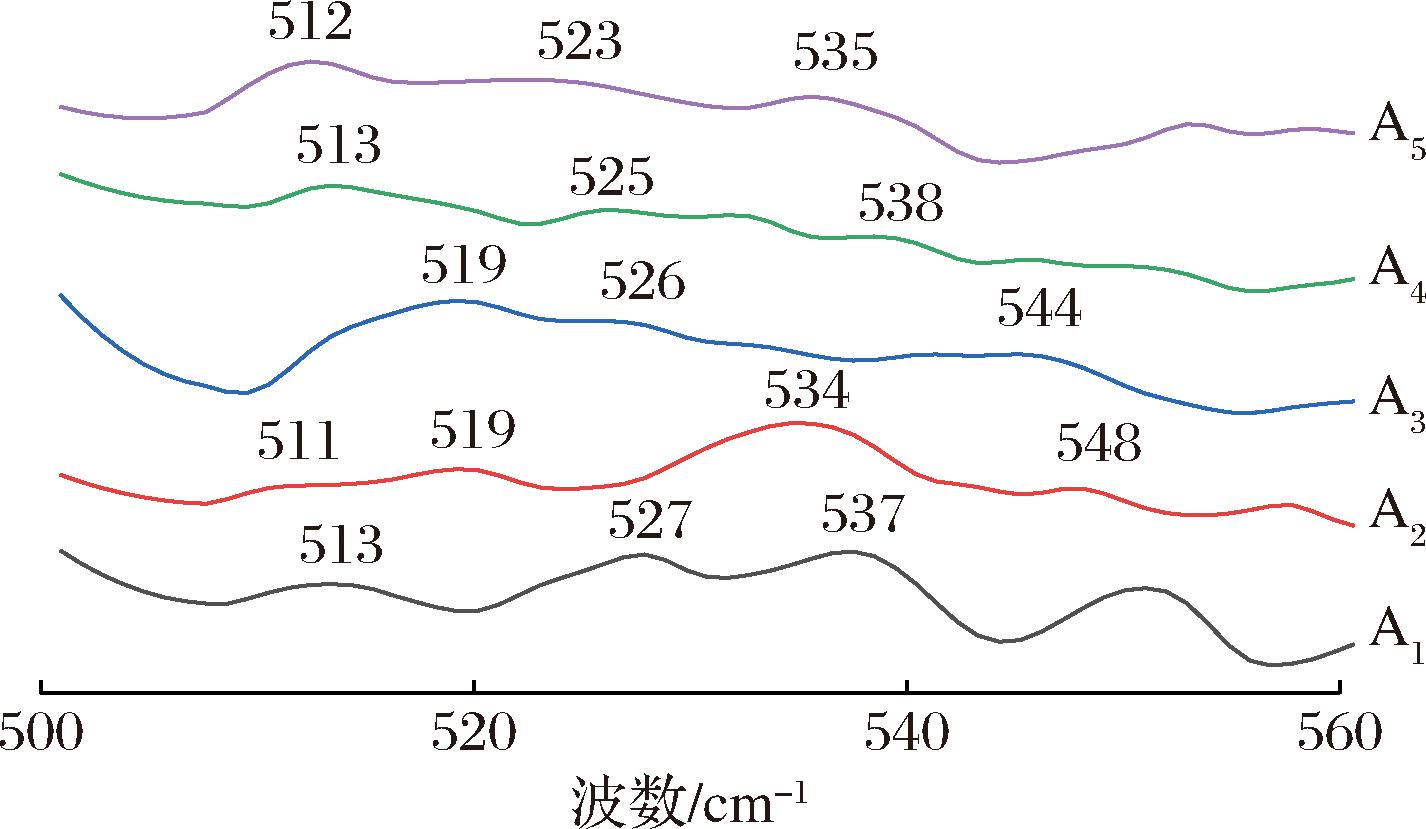
图6 双蛋白肉糜凝胶二硫键伸缩振动拉曼光谱图
Fig.6 Vibrational Raman spectrum of disulfide bond expansion of dual-protein mincemeat gel
2.4.2.2 酪氨酸和色氨酸残基微环境
拉曼光谱中757 cm-1和l 340 cm-1附近区域能表征色氨酸残基的微环境,I757(图7)以及I1340(图8)的下降都反映了色氨酸残基的暴露。天然蛋白质的结构呈高度折叠状态,当加热变性时,蛋白质发生去折叠,导致原来在疏水环境中的活性基团暴露在极性环境中,当暴露的基团逐渐增多时,相邻基团会通过疏水相互作用、二硫键或非二硫共价键形成三维凝胶网络[13]。酪氨酸残基上对位取代苯环的振动引起拉曼光谱为830 cm-1和850 cm-1出现双峰。双峰的比值与酚羟基上氢键和微环境的情况有关,由图7可知,A1的I850/I830值为1.15,添加不同物质后,A2~A5的I850/I830值增加到1.28、1.29、1.29、1.28,表明其他物质的加入能引起酪氨酸残基暴露到极性环境中或者参与中度或弱的氢键的形成[13]。

图7 双蛋白肉糜凝胶氨基酸残基微环境拉曼图谱
Fig.7 Raman spectrum of amino acid residue microenvironment of dual-protein mincemeat gel
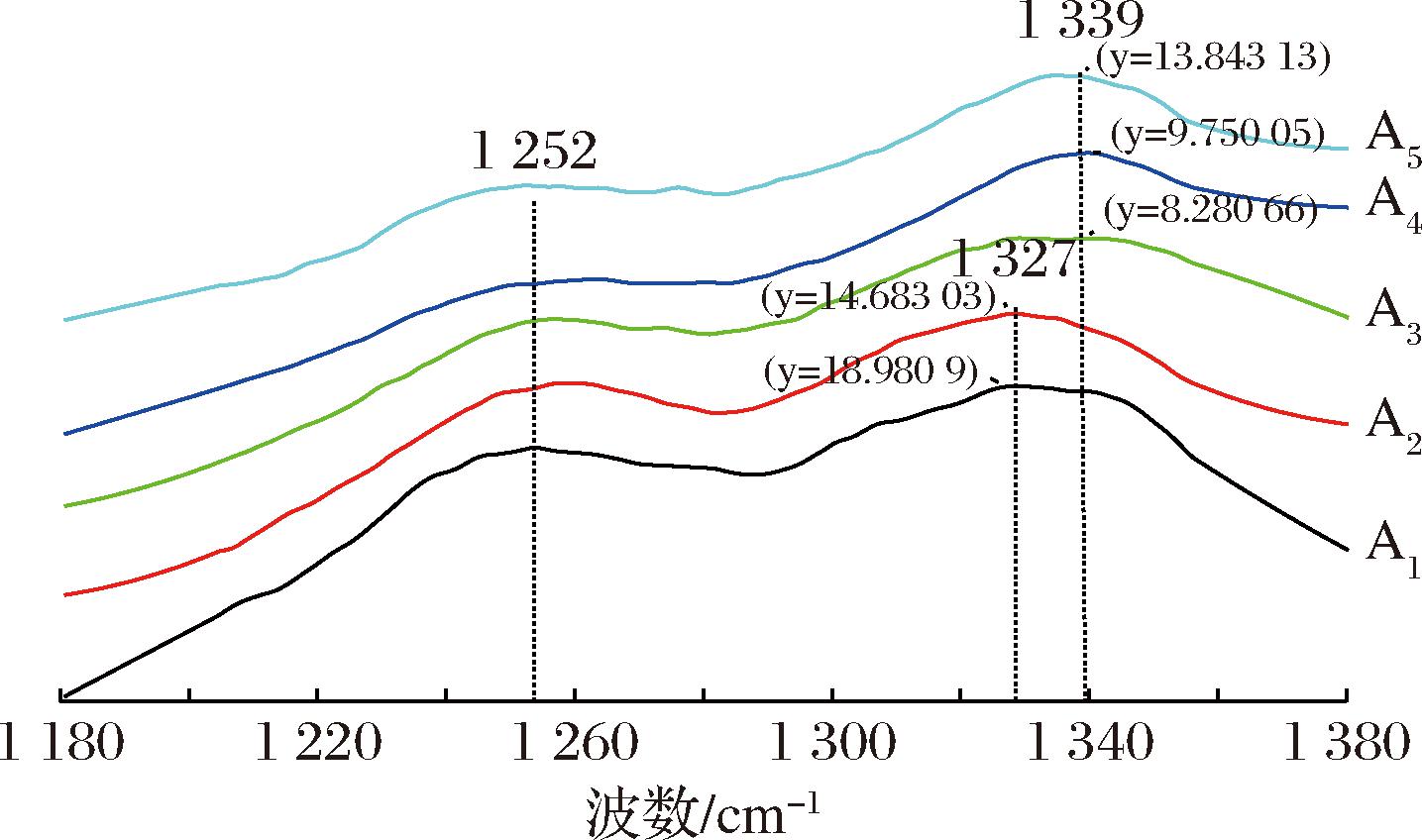
图8 双蛋白肉糜凝胶酰胺Ⅲ区拉曼光谱图
Fig.8 Raman spectrum of amide Ⅲ region of dual-protein mincemeat gel
2.4.2.3 蛋白质主链变化
如图5所示,含不同添加物的复合肉糜凝胶在酰胺I带(1 650 cm-1左右)比对照组的拟合峰面积都有减少,这意味着α-螺旋总量的减少,这种减少可能是由于凝胶主要部分中相当数量的α-螺旋的解旋化造成的,需要指出的是,α-螺旋中的肽键可能形成氢键[30]。本研究中,加入不同添加物,α-螺旋有一定程度的解旋化,分子内疏水基团的暴露似乎有利于解旋化作用后凝胶网络的形成和新蛋白折叠的出现(β-折叠),从而促进了疏水作用和凝胶化的稳定。
拉曼光谱中酰胺Ⅲ带(1 230~1 350 cm-1)是构象灵敏的谱带区,该区能提供多肽链主链构象的振动信息,包括C—N伸缩振动、N—H面内弯曲振动、Cα—C伸缩振动以及C![]() O面内弯曲振动。如图8所示,A1、A2、A3、A4及A5的肉糜凝胶蛋白拉曼峰分别出现在1 327、1 327、1 339、1 339、1 339 cm-1处,相对峰强为18.980 9、14.683 03、8.280 66、9.750 05、13.843 13。添加HDP,该处拉曼峰峰位置未出现变化,而随着食用胶、TG及复合物的添加,肉糜凝胶蛋白在酰胺Ⅲ区的拉曼峰逐渐向大波数方向偏移了12 cm-1,整体的峰强都减小,说明肉糜凝胶蛋白中α-螺旋结构减少[31]。肉糜凝胶蛋白二级结构中β-折叠谱带(1 230~1 245 cm-1)和无规则卷曲谱带(1 240~1 255 cm-1)部分重叠,使得酰胺Ⅲ区的解析相对困难。各组在1 250 cm-1附近有拐角,对比A1峰形坡度有所减缓。在1 250 cm-1和1 315 cm-1附近形成的谱带分别是由肌球蛋白的球形结构和纤维状结构的头部和尾部区域的α-螺旋结构引起[31]。说明双蛋白肉糜体系中的相互作用造成了蛋白质原有的二级结构和空间构象的改变。
O面内弯曲振动。如图8所示,A1、A2、A3、A4及A5的肉糜凝胶蛋白拉曼峰分别出现在1 327、1 327、1 339、1 339、1 339 cm-1处,相对峰强为18.980 9、14.683 03、8.280 66、9.750 05、13.843 13。添加HDP,该处拉曼峰峰位置未出现变化,而随着食用胶、TG及复合物的添加,肉糜凝胶蛋白在酰胺Ⅲ区的拉曼峰逐渐向大波数方向偏移了12 cm-1,整体的峰强都减小,说明肉糜凝胶蛋白中α-螺旋结构减少[31]。肉糜凝胶蛋白二级结构中β-折叠谱带(1 230~1 245 cm-1)和无规则卷曲谱带(1 240~1 255 cm-1)部分重叠,使得酰胺Ⅲ区的解析相对困难。各组在1 250 cm-1附近有拐角,对比A1峰形坡度有所减缓。在1 250 cm-1和1 315 cm-1附近形成的谱带分别是由肌球蛋白的球形结构和纤维状结构的头部和尾部区域的α-螺旋结构引起[31]。说明双蛋白肉糜体系中的相互作用造成了蛋白质原有的二级结构和空间构象的改变。
2.5 不同添加物对双蛋白肉糜凝胶分子间作用力的影响
热诱导凝胶是指蛋白质分子经分子间的作用力包括氢键、离子键、二硫键、疏水相互作用等聚集而成的有序三维网状结构。经70 ℃温度加热处理,肉糜凝胶中离子键、氢键含量大量减少,蛋白质发生聚集和凝胶化,而冷却使氢键发生重组,含量略有回升,故氢键增加对冷却后凝胶强度增加有突出贡献[32],由图9可知,双蛋白肉糜凝胶中离子键、氢键含量总体上比二硫键、疏水相互作用少,这与史梅莓等[27]研究结果一致。相比A1,其余组氢键含量显著增加(P<0.05),说明HDP、食用胶、TG的单独及复合添加都有利于蛋白质的凝胶化和提高冷却后双蛋白肉糜凝胶强度。氢键、离子键加热被破坏,说明所形成的双蛋白凝胶体系中,疏水相互作用和二硫键是维持蛋白凝胶网络的主要作用力[33],几种添加物的加入,使双蛋白凝胶体系中疏水相互作用和二硫键含量都有显著提升,疏水相互作用是蛋白质折叠的主要驱动力,加热过程会促进体系蛋白质间疏水相互作用的发生,蛋白疏水性基团的暴露使得疏水相互作用增强,暴露出的大量巯基发生氧化,使得蛋白质之间产生交联作用,从而促进二硫键的形成,稳定蛋白质肽链空间结构[34]。由于疏水相互作用和二硫键使蛋白质分子形成了聚集物,导致原本的疏水位点被掩盖,表面疏水性降低,蛋白质表面发生氧化变性的可能性减少,所以双蛋白肉糜凝胶更加的稳定,从而提高了产品品质[35]。此结果与计红芳等结果一致[36]。
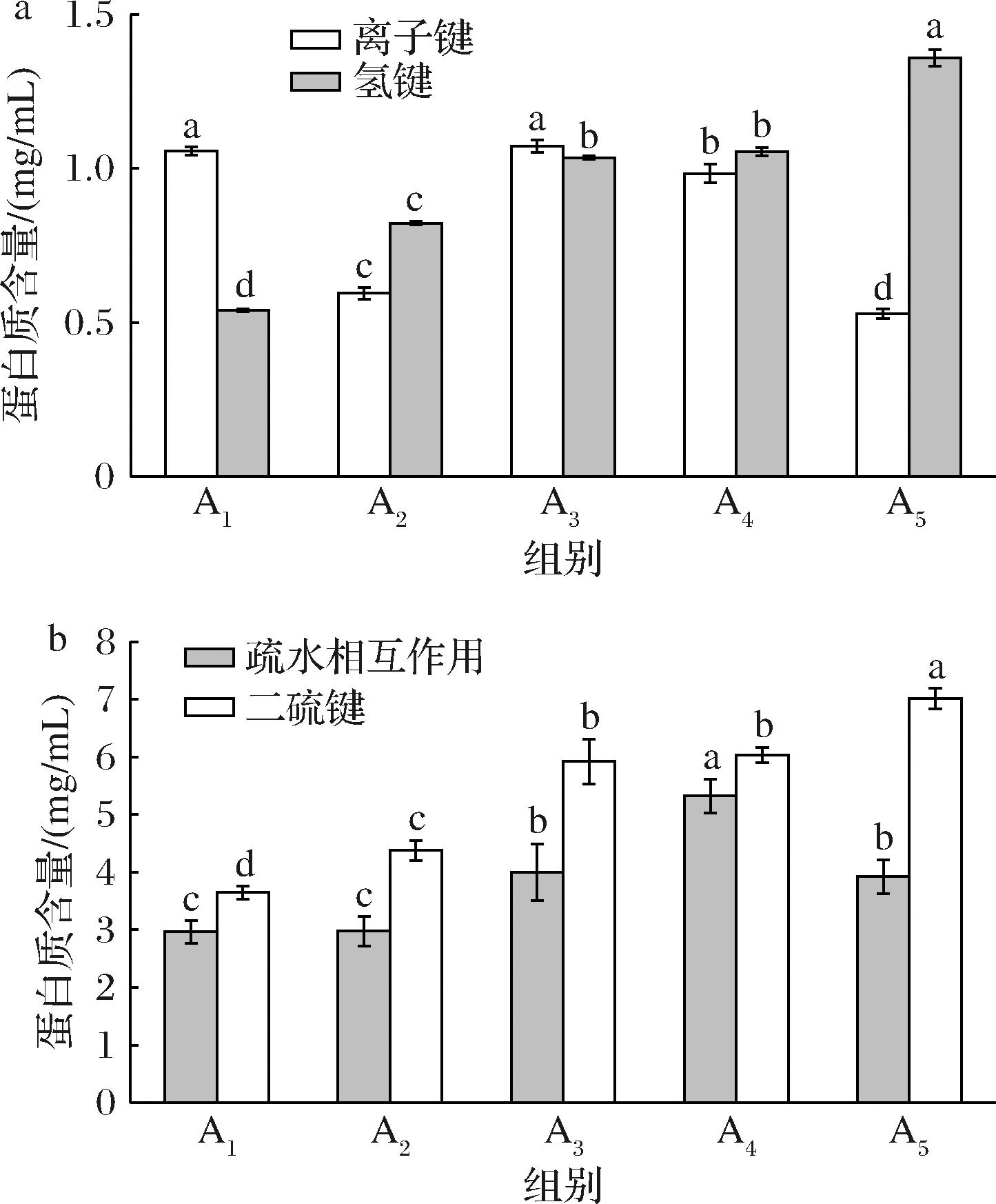
a-离子键和氢键;b-疏水相互作用和二硫键
图9 不同添加物对双蛋白肉糜凝胶分子间相互作用力的影响
Fig.9 Effects of different additives on intermolecular force of dual-protein mincemeat gel
2.6 不同添加物对双蛋白肉糜凝胶微观结构的影响
利用扫描电镜表征微观形貌结构,可以观察蛋白质与蛋白质、蛋白质与其他物质间的交联情况。大豆蛋白经加热,蛋白质分子受热变性,蛋白链展开[37],同时高温加快鸡肉肌原纤维蛋白质分子热运动,折叠的蛋白分侧链结合键断裂使蛋白结构伸展,活性基团暴露,蛋白分子构象发生改变,通过活性基团的非共价键作用有助于蛋白间活性基团的相互交联[20],冷却后,热动能的降低有助于重新聚集、缔合,能够形成蛋白凝胶[21]。如图10-a所示,直接重组的双蛋白组微观结构不规则、粗糙、疏松多孔,表面不平整,空洞周围缺少交联,很难将水、油保留于体系中,表现为保水性差、质构特性不好。HDP的添加,填补了双蛋白凝胶体系中的孔洞,且表面平整光滑(图10-b),形成致密而均匀的凝胶网状结构,阻断水分子的迁移和渗出。食用胶的加入使得孔洞周围的连接加强,孔洞内部结合紧密,表面较光滑(图10-c),可能是食用胶、大豆蛋白和肌原纤维蛋白之间相互作用加固了凝胶网络结构,增强了对水分的束缚能力。单独添加TG,双蛋白肉糜凝胶结构更加致密、规则且均匀,孔隙微小(图10-d),表现为双蛋白凝胶体系的保水性和弹性提高,这可能是由于TG促进了大豆蛋白与肌原纤维蛋白的交联。几种添加物的结合使骨架网络结构紧密,并局部形成连续膜结构,提高蛋白交联网络的强度和保水能力,进一步增加凝胶强度(图10-e)。SALVADOR等[38]研究凝胶结构和保水性的相关性,发现结构致密的凝胶更容易截留水分,因此具有较高的保水性,与本研究微观结构和保水效果的趋势基本一致。
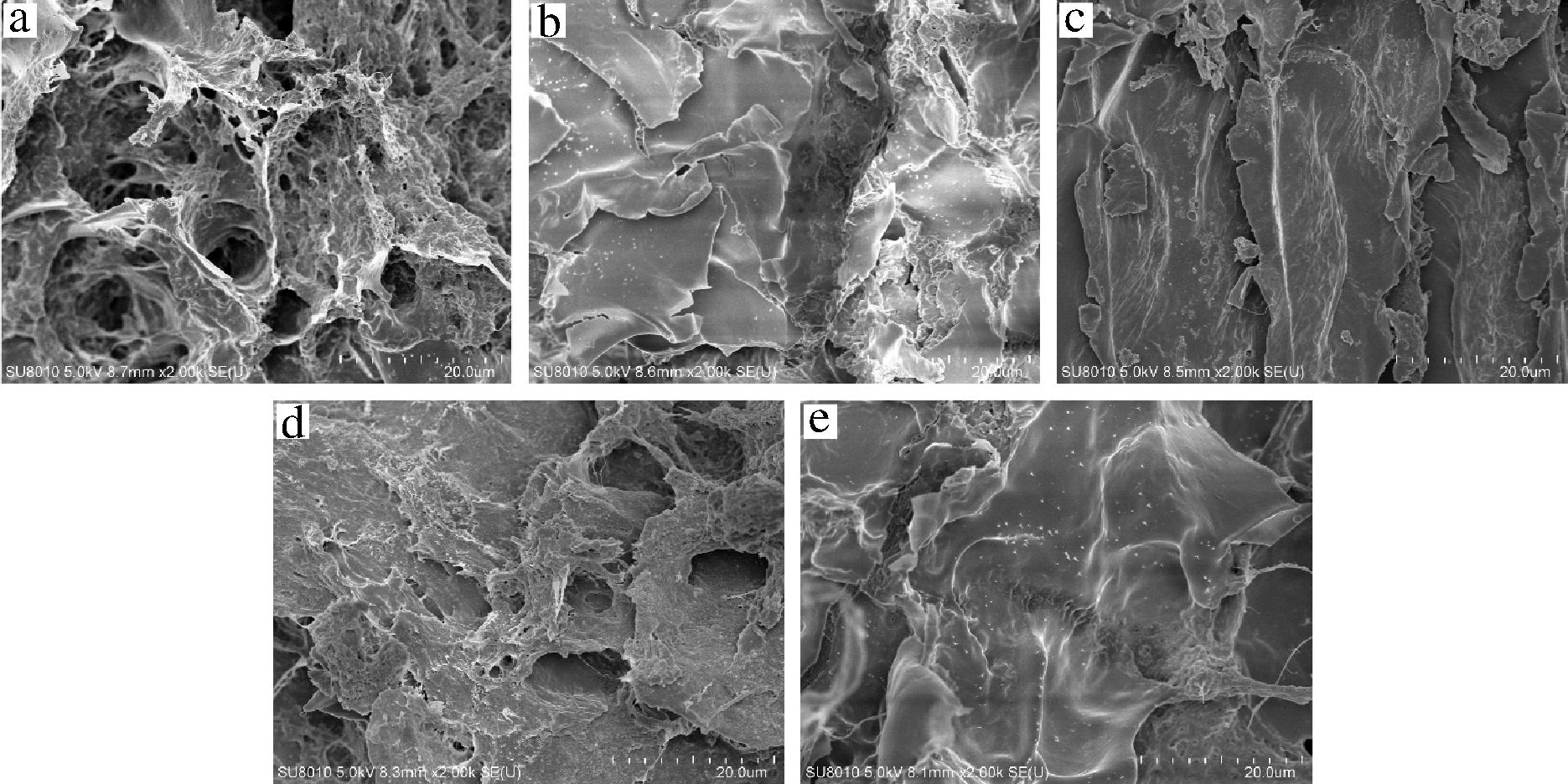
a~e分别代表A1~A5组
图10 不同添加物对双蛋白肉糜凝胶微观结构的影响
Fig.10 Effects of different additives on microstructure of dual-protein mincemeat gel
3 结论
本研究发现,HDP、多糖、TG单独及复合添加均可增强双蛋白肉糜凝胶的凝胶特性及改善凝胶网络结构。HDP与食用胶可以在凝胶网络中间形成填充物,且自身具有锁水性,吸收与凝胶网络结合不紧密的水分,从而增强双蛋白肉糜凝胶的持水性能、质构特性;TG更能促进大豆蛋白与鸡肌原纤维蛋白之间的交联,促进蛋白二级结构中有序结构的相对含量提高及蛋白微环境发生改变,提高氢键、二硫键含量及疏水相互作用,增强双蛋白凝胶的网络之间的连接。作为蛋白黏结剂的TG,与HDP、食用胶复合添加改善双蛋白肉糜凝胶效果最为显著(P<0.05)。结果表明,与对照组相比,复合添加的双蛋白肉糜凝胶的G′提升最为明显,蛋白质二级结构中有序结构的相对含量达到53.26%,形成的三维网状凝胶结构更稳定,体现为体系保油保水性提高,质构特性改善,具体表现在复合双蛋白凝胶体系的汁液、水分、脂肪流失量分别减少9.88%、9.54%、1.32%,硬度、弹性、咀嚼性分别显著提升19.98%、10.17%、39.59%(P<0.05)。本研究有效改善了大豆-鸡肉复合双蛋白肉糜凝胶网络结构,增强了动-植物双蛋白结构的保水性和稳定性,可为开发动-植物双蛋白产品提供理论支持。
[1] RUBIO N R, XIANG N, KAPLAN D L.Plant-based and cell-based approaches to meat production[J].Nature Communications, 2020, 11(1):6276.
[2] ZEPEDA BASTIDA A, AYALA MARTINEZ M, ALFARO RODR GUEZ R H, et al.Sensory analysis and texture profile of chorizo using blends of rabbit meat and textured soybean protein[J].Nova Scientia, 2018, 10(21):391-402.
GUEZ R H, et al.Sensory analysis and texture profile of chorizo using blends of rabbit meat and textured soybean protein[J].Nova Scientia, 2018, 10(21):391-402.
[3] WU C, YAN X Y, WANG T, et al.A self-sorted gel network formed by heating a mixture of soy and cod proteins[J].Food &Function, 2019, 10(8):5140-5151.
[4] 代佳佳. 卡拉胶、魔芋胶和变性淀粉对鸡肉匀浆物凝胶特性的影响及应用[D].南京:南京农业大学, 2009.DAI J J.Effects of carrageenan, konjac glucomannan and modified starch on the gelation properties of chicken muscle homogenate and application[D].Nanjing:Nanjing Agricultural University, 2009.
[5] 郑鹏飞, 高云, 吴金龙, 等.传统方便面中大豆组织蛋白素食牛肉粒的研制[J].粮食与油脂, 2018, 31(7):56-58.ZHENG P F, GAO Y, WU J L, et al.Preparation of vegetarian beef granules from soybean tissue protein in traditional instant noodle[J].Cereals &Oils, 2018, 31(7):56-58.
[6] NICOLAI T.Gelation of food protein-protein mixtures[J].Advances in Colloid and Interface Science, 2019, 270:147-164.
[7] CUI Q, LIU J N, WANG G R, et al.Effect of freeze-thaw treatment on the structure and texture of soy protein-dextran conjugate gels crosslinked by transglutaminase[J].LWT, 2022, 153:112443.
[8] 秦建鹏. 高弹性素食肠加工工艺及凝胶形成机理研究[D].天津:天津农学院, 2022.QIN J P.Study on processing technology and gel formation mechanism of highly elastic vegetarian sausage[D].Tianjin:Tianjin Agricultural University, 2022.
[9] 刘辉, 高瑞萍, 刘嘉.转谷氨酰胺酶及其在肉制品生产中的应用[J].肉类研究, 2010, 24(12):80-82.LIU H, GAO R P, LIU J.Transglutaminase and its application in meat products[J].Meat Research, 2010, 24(12):80-82.
[10] 潘红梅, 尹蓉学, 游敬刚, 等.牛肉与豆腐TG重组肉的响应面优化条件研究[J].食品与发酵科技, 2011, 47(5):10-14.PAN H M, YIN R X, YOU J G, et al.Beef and bean curd TG recombination meat response surface sptimization condition research[J].Food and Fermentation Technology, 2011, 47(5):10-14.
[11] SUN X D, ARNTFIELD S D.Gelation properties of chicken myofibrillar protein induced by transglutaminase crosslinking[J].Journal of Food Engineering, 2011, 107(2):226-233.
[12] 高雪琴. 大豆分离蛋白和卡拉胶复配对调理猪肉制品品质的影响及机理研究[D].南京:南京农业大学, 2015.GAO X Q.Studies of effects and mechanism of soybean protein isolate and carrageenan on qualities of prepared pork products[D].Nanjing:Nanjing Agricultural University, 2015.
[13] 任仙娥, 李春枝, 杨锋, 等.涡流空化改善大豆分离蛋白溶解性的分子间作用机制[J].食品科学, 2020, 41(3):93-98.REN X E, LI C Z, YANG F, et al.Intermolecular interaction mechanism for improvement in solubility of soy protein isolate by swirling cavitation[J].Food Science, 2020, 41(3):93-98.
[14] 于楠楠. 盐和多糖对鱼糜凝胶形成的影响与机制[D].无锡:江南大学, 2017.YU N N.Effect of salts and polysaccharides on the formation of surimi gel and the mechanism[D].Wuxi:Jiangnan University, 2017.
[15] 倪伟, 米杰, 孙仲麒, 等.羟丙基二淀粉磷酸酯对虾糜凝胶特性及其蛋白结构的影响[J].水产学报, 2021, 45(7):1181-1190.NI W, MI J, SUN Z Q, et al.Effects of hydroxypropyl distarch phosphate on the gel properties and protein structure of shrimp surimi[J].Journal of Fisheries of China, 2021, 45(7):1181-1190.
[16] 黄明发, 鲁兴容, 刁兵, 等.魔芋胶的功能特性及其在肉制品中的应用[J].中国食品添加剂, 2012(1):186-190.HUANG M F, LU X R, DIAO B, et al.The functional characteristics of konjac gum and its application in meat industry[J].China Food Additives, 2012(1):186-190.
[17] 杨琴. 花生球蛋白-罗勒籽胶复合凝胶的形成机理、结构性质及应用研究[D].合肥:合肥工业大学, 2022.YANG Q.Formation mechanism, structure, properties and application of arachin - basil seed gum composite gels[D].Hefei:Hefei University of Technology, 2022.
[18] 程孝中, 赵鑫锐, 洪皓飞, 等.微生物谷胺酰胺转氨酶在蛋白质修饰中的应用[J].食品与生物技术学报, 2019, 38(6):1-10.CHENG X Z, ZHAO X R, HONG H F, et al.Recent applications of microbial transglutaminase in protein modificaiton[J].Journal of Food Science and Biotechnology, 2019, 38(6):1-10.
[19] 马骏骅, 颜金鑫, 樊炯, 等.亲水多糖对谷氨酰胺转氨酶交联大豆分离蛋白凝胶特性的影响[J].食品安全质量检测学报, 2023, 14(15):20-32.MA J H, YAN J X, FAN J, et al.Effects of hydrophilic polysaccharides on the properties of transglutaminase enzyme cross linked soy protein isolate gel[J].Journal of Food Safety &Quality, 2023, 14(15):20-32.
[20] 计红芳, 李莎莎, 张令文, 等.豌豆蛋白对鸡肉糜热诱导凝胶品质特性与微观结构的影响[J].食品科学, 2020, 41(4):74-79.JI H F, LI S S, ZHANG L W, et al.Effect of pea protein on quality properties and microstructure of heat-induced gel of chicken batter[J].Food Science, 2020, 41(4):74-79.
[21] 曲敏, 王宇, 朱秀清, 等.谷朊粉基共混黏合体系的构建及在素肉饼中的应用[J].农业工程学报, 2022, 38(19):285-294.QU M, WANG Y, ZHU X Q, et al.Construction of gluten based blend adhesive system and its application in vegetable meat pie[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(19):285-294.
[22] 杨玉玲, 游远, 彭晓蓓, 等.加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J].中国农业科学, 2014, 47(10):2013-2020.YANG Y L, YOU Y, PENG X B, et al.Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle[J].Scientia Agricultura Sinica, 2014, 47(10):2013-2020.
[23] 吴香, 李新福, 李聪, 等.变性淀粉对肌原纤维蛋白凝胶特性的影响[J].食品科学, 2020, 41(2):22-28.WU X, Ll X F, Ll C, et al.Effect of different modified starches on gel properties of myofibrillar protein[J].Food Science, 2020, 41(2):22-28.
[24] HARWANSH R K, MUKHERJEE P K, KAR A, et al.Enhancement of photoprotection potential of catechin loaded nanoemulsion gel against UVA induced oxidative stress[J].Journal of Photochemistry &Photobiology, B:Biology, 2016, 160:318-329.
[25] STAWOSKA I, WESE UCHA-BIRCZY
UCHA-BIRCZY SKA A, SKOCZOWSKI A, et al.FT-Raman spectroscopy as a tool to study the secondary structures of wheat gliadin proteins[J].Molecules, 2021, 26(17):5388.
SKA A, SKOCZOWSKI A, et al.FT-Raman spectroscopy as a tool to study the secondary structures of wheat gliadin proteins[J].Molecules, 2021, 26(17):5388.
[26] SUN F Y, HUANG Q L, HU T, et al.Effects and mechanism of modified starches on the gel properties of myofibrillar protein from grass carp[J].International Journal of Biological Macromolecules, 2014, 64:17-24.
[27] 史梅莓. 亲水胶体-蛋白质类对猪肉糜凝胶特性的影响及机理研究[D].自贡:四川轻化工大学, 2021.SHI M M.Study on the effect and mechanism of hydrocolloid-protein on the gelation properties of pork mince[D].Zigong:Sichuan University of Science &Engineering, 2021.
[28] LIU R, ZHAO S M, XIE B J, et al.Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J].Food Hydrocolloids, 2011, 25(5):898-906.
[29] 常荣, 韦诚, 段珍珍, 等.发酵对酸肉蛋白质结构的影响[J].食品科学, 2019, 40(12):182-189.CHANG R, WEI C, DUAN Z Z, et al.Structural changes of proteins during the fermentation of sour pork[J].Food Science, 2019, 40(12):182-189.
[30] 郑卓琦, 李岩, 李松艳, 等.原花色素对鸡胸肉肌原纤维蛋白凝胶特性影响[J].中国农业大学学报, 2023, 28(5):140-153.ZHENG Z Q, LI Y, LI S Y, et al.Effect of proanthocyanidins on gel properties of chicken breast myofibrillar protein[J].Journal of China Agricultural University, 2023, 28(5):140-153.
[31] 高文宏, 叶瑞森, 潘廷跳, 等.基于拉曼光谱解析冻藏过程中鱼糜蛋白的结构变化[J].食品科学, 2018, 39(24):71-77.GAO W H, YE R S, PAN T T, et al.Analysis of structural changes of surimi proteins during frozen storage by Raman spectroscopy[J].Food Science, 2018, 39(24):71-77.
[32] 严文莉. 改性魔芋葡甘聚糖对鲢鱼糜凝胶特性的影响及增强机制[D].武汉:华中农业大学, 2022.YAN W L.The effect of modified KGM on the gel properties of silver carp surimi and mechanism for surimi gelation enhancement[D].Wuhan:Huazhong Agricultural University, 2022.
[33] 刘阳. 基于共混改性理论解析淀粉改善鱼糜3D可打印性的机制[D].湛江:广东海洋大学, 2022.LIU Y.The insight into the mechanism of starch improving 3D printability of surimi based on the blending modification theory[D].Zhanjiang:Guangdong Ocean University, 2022.
[34] 康怀彬, 邹良亮, 张慧芸, 等.高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J].食品科学, 2018, 39(23):80-86.KANG H B, ZOU L L, ZHANG H Y, et al.Effect of high temperature treatment on chemical forces of beef proteins and structure of myofibrillar protein[J].Food Science, 2018, 39(23):80-86.
[35] 李琼帅, 唐善虎, 李思宁, 等.石榴皮提取物对贮藏期间牦牛肉糜蛋白质氧化及挥发性风味物质的影响[J].食品与发酵工业, 2022, 48(10):93-100.LI Q S, TANG S H, LI S N, et al.Effects of pomegranate peel extract on the protein oxidation and volatile flavor substances of yak minced meat during storage[J].Food and Fermentation Industries, 2022, 48(10):93-100.
[36] 计红芳, 李莎莎, 张令文, 等.添加面筋蛋白对猪肉热诱导凝胶品质及水分迁移特性的影响[J].食品科学, 2020, 41(18):58-63.JI H F, LI S S, ZHANG L W, et al.Effect of gluten on quality properties and water migration of heat-induced gel from pork[J].Food Science, 2020, 41(18):58-63.
[37] 秦传军, 刘宝才, 杨再山, 等.大豆分离蛋白凝胶性影响因素研究[J].粮食与油脂, 2007, 20(11):18-20.QIN C J, LIU B C, YANG Z S, et al.Affect factors of gelation properties of soybean protein isolate[J].Cereals &Oils, 2007, 20(11):18-20.
[38] SALVADOR P, TOLDR M, SAGUER E, et al.Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J].Food Hydrocolloids, 2009, 23(7):1654-1659.
M, SAGUER E, et al.Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J].Food Hydrocolloids, 2009, 23(7):1654-1659.