陈皮(Citri Reticulatae Pericarpium)由芸香科植物橘及其栽培变种的成熟果皮经过开皮、翻皮、晒干、陈化等多种工艺制作而成,主要产于广东省江门市新会区,故又名广陈皮、新会皮。陈皮是一种药食同源的传统药材,具有止咳化痰、调节气脾的功效。植物化学和药理学研究表明,陈皮的活性物质主要包括黄酮类、酚酸类、挥发油类和多糖类等,其中黄酮类是最主要的活性成分,包括芸香柚皮苷、柚皮苷、橙皮苷、川陈皮素和橘皮素等[1],具有保肝、利胆、抗炎、抗菌、降血脂、抗氧化、抗肿瘤、改善肠道疾病和治疗心血管疾病等多种药理作用。陈皮陈化年份越长,品质越好,究其主要原因是陈皮内活性物质发生了变化,而导致这种变化的主要因素包括环境中的温度、湿度以及陈皮表面的微生物等。据报道陈皮中的优势真菌属曲霉属与总黄酮、橙皮苷具有显著正相关性,而假丝酵母属、酵母属与总黄酮、橙皮苷显著负相关[2];此外,曲霉属亦与D-柠檬烯、月桂烯有显著的正相关性,与2-甲氨基苯甲酸甲酯、松油烯-4-醇、α-松油醇、百里酚有显著的负相关性[3]。黑曲霉返接无菌陈皮经过12 d的高温高湿储藏之后,橙皮苷含量下降,而橙皮素、牡荆素、柚皮素、槲皮素含量升高,抗氧化活性增强[4]。红曲霉和酿酒酵母共发酵陈皮之后,柑橘、甜、草木、木本、松树油等气味增强,而酸味等刺激性气味减弱,表明发酵陈皮的口感和风味得到很好的改善[5]。
微生物转化是一种绿色、友好的现代生物加工技术,因其具有反应温和、安全性高的特点而广泛应用于药物代谢物、碳水化合物和氨基酸的生产中[6]。微生物代谢过程中产生的一系列酶,例如氧化还原酶和水解酶等,催化底物进行甲氧基化、糖基化、羟基化、脱糖基化等结构修饰,从而生成新的活性物质[7]。利用微生物转化可以将一些溶解性低、生物利用度不高的化合物转化成溶解性高的化合物,提高其生物利用度。此外,微生物转化也可以促进有毒物质的降解,减少其副作用。HAN等[8]报道了Clavispora lusitaniae YC2降解二甲戊灵生成1,2-二甲基-3,5-二硝基-4-n(丁基-1,3-二烯基)-二硝基-一氧化氮和1,2-二甲基-3,5-二硝基-4-n(丙基-1-烯-2-基)-二硝基一氧化氮,最终通过一系列酶促反应分解生成CO2和H2O。葡萄牙棒孢酵母(Clavispora lusitaniae 146)亦可降解霉菌毒素,从而保护柠檬免于指状青霉的侵染[9]。
目前已有研究表明经黑曲霉发酵后,陈皮活性黄酮含量增加,抗氧化活性增强,对氧化性肝损伤小鼠的保护作用增强[4,10]。课题组前期研究发现,从陈皮中分离纯化得到的葡萄牙棒孢酵母(Clavispora lusitaniae CP-1,CP-1)可以将橙皮苷转化为橙皮素和甲基橙皮苷[11],因此推测CP-1亦可能与陈皮中的活性物质变化有关,但尚未研究CP-1对陈皮提取物及其体外抗氧化活性的影响。因此,本研究以CP-1为转化菌株,建立其对陈皮乙醇提取物以及特定底物芸香柚皮苷和橙皮苷的转化工艺。采用高效液相色谱法测定主要黄酮类化合物含量,DPPH法、ABTS法、铁离子还原能力(Ferric reducing ability of plasma, FRAP)法和氧自由基吸收能力(Oxygen radical absorbance capacity,ORAC)法评估抗氧化活性,使用皮尔逊相关性分析抗氧化活性与主要黄酮类化合物之间的相关性,最后采用正交试验设计优化CP-1对橙皮苷的转化条件。研究结果将有助于为进一步研究微生物转化柑橘黄酮类化合物的作用机制提供理论基础,对于柑橘皮渣高值化利用具有重要意义。
1 材料与方法
1.1 材料与试剂
葡萄牙棒孢酵母(Clavispora lusitaniae CP-1,GDMCC No:61036):由前期课题组成员从陈皮中分离纯化得到并保藏于广东省微生物菌种保藏中心。
新鲜陈皮:新鲜茶枝柑果实于2022年12月从广东省新会区采集,剥皮之后置于热泵干燥器中,设置温度40~45 ℃烘干至恒重。
主要试剂:麦芽汁培养基、技术琼脂粉,广东环凯微生物科技有限公司;NaOH,天津市大茂化学试剂厂;Na2HPO4、NaH2PO4、DPPH、荧光素钠、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis-2-methyl-propanimidamide, dihydrochloride,AAPH),上海源叶生物科技有限公司;芸香柚皮苷、柚皮苷、橙皮苷、柚皮素、川陈皮素、橘皮素,成都曼思特生物科技有限公司;柚皮素-7-O-葡萄糖苷、橙皮素-7-O-葡萄糖苷、橙皮素,成都普瑞法科技开发有限公司;无水乙醇、无水甲醇(色谱纯),天津市富宇精细化工有限公司;ABTS、Trolox(维生素E衍生物),天津市科密欧化试剂有限公司。
1.2 仪器与设备
GHRH-20热泵干燥器,广东农业机械研究所;SW-CJ-2FD无菌操作台,苏州安康空气技术有限公司;SPX-250B-Z生化培养箱、YXQ-LS-50SⅡ型立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;ZQZY-88BV型振荡培养箱,上海知楚仪器有限公司;D3024R台式高速冷冻离心机,美国赛洛捷克SCILOGEX公司;LC-20AT高效液相色谱仪,日本岛津公司;双光束紫外可见分光光度计,上海美谱达仪器有限公司。
1.3 试验方法
1.3.1 菌液制备和菌液浓度测定
菌液制备:从保藏有CP-1的甘油管中取1 mL菌液,接种到50 mL麦芽汁液体培养基中,置于37 ℃、200 r/min的摇床中培养12 h,得到活化的种子液;取100 μL种子液至麦芽汁固体培养基平板中,用玻璃涂布棒涂至均匀干燥,倒放置于37 ℃恒温培养箱中培养24 h,制得酵母菌落;用接种环刮取菌落至50 mL麦芽汁液体培养基中,置于摇床中培养12 h,得到酵母菌液。
菌液浓度:参考GB 4789.35—2023《食品安全国家标准 食品微生物学检验乳酸菌检验》通过平板计数法测定。
1.3.2 陈皮乙醇物质的提取
采用热回流法[12]。称取100 g陈皮粉,以料液比1∶5(g∶mL)加入体积分数60%乙醇,75~90 ℃下回流提取1.5 h,使用纱布、脱脂棉过滤;滤渣继续以料液比1∶2.5加入体积分数60%乙醇回流提取2次,提取时间分别为1.0、0.5 h;合并3次得到的滤液,旋蒸至浸膏状态。
1.3.3 葡萄牙棒孢酵母转化陈皮乙醇提取物、特异性底物
陈皮乙醇提取物转化:取6个100 mL 锥形瓶,分别称取1.25 g陈皮乙醇提取物浸膏,加入50 mL蒸馏水,超声至浸膏完全溶解,115 ℃高压灭菌20 min备用;3瓶接1 mL无菌水,记为对照组;3瓶按照10%接种量接种CP-1(菌液离心之后使用1 mL无菌水重悬),记为酵母组。对照组和酵母组均置于摇床中培养,分别于培养0、8、16、24 h取适量样品用于HPLC测定和酚类物质提取。
特异性底物转化:用0.01 mol/L NaOH溶液配制1 000 μg/mL芸香柚皮苷、橙皮苷溶液(现配现用)。准备6个 20 mL PA瓶,分别加入8 mL 0.02 mol/L PBS(pH 7.0)和1 mL底物溶液,115 ℃高压灭菌20 min备用。3瓶接1 mL无菌0.02 mol/L PBS(pH 7.0),记为对照组;3瓶按照10%接种量接种CP-1(菌液离心之后使用1 mL pH值为7.0的PBS溶液重悬),记为处理组。对照组和处理组均置于摇床中培养,分别于培养0、8、16、24、32、40、48 h取适量样品用于HPLC检测。
1.3.4 α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的部位确定
参考刘丽娜[11]的方法制备细胞外酶、细胞内酶、细胞碎片物质。分别将细胞外酶、细胞内酶、细胞碎片物质以及未经细胞破碎的CP-1菌液与橙皮苷进行微生物转化,方法同1.3.3节,分别于培养0、8、16、24、32、40、48 h取适量样品用于HPLC检测。
1.3.5 总黄酮(total flavonoids,TFs)和总酚(total polyphenols,TPs)含量测定
酚类物质提取:将1.3.3节制取的样品,加入5 mL无水甲醇,摇匀,置于超声清洗机中超声60 min,随后以5 000 r/min离心10 min,上清液即为酚类物质提取液,可用于测定TFs、TPs和抗氧化活性。
TFs的测定[13]:取2 mL 提取液,加入0.3 mL 5%(质量分数)NaNO2溶液,静置5 min,加入0.3 mL 10%(质量分数)Al(NO3)3溶液,静置6 min,加入1.5 mL 1 mol/L NaOH溶液,静置15 min,以无水甲醇为空白对照,测量510 nm处的吸光值。以芦丁为标准品,测量其在不同浓度下510 nm处的吸光值,得到的标准曲线方程为:y=0.002x+0.054,R2=0.999 6。结果以芦丁当量mg RE/mL表示。
TPs的测定:采用Folin-Ciocalten法[14]。取1 mL提取液,加入2 mL福林酚试剂,混合均匀之后加入2 mL 5%(质量分数)Na2CO3溶液,混合均匀,避光反应1 h,以无水甲醇为空白对照,测量760 nm处的吸光值。以没食子酸为标准品,测量其在不同浓度下760 nm处的吸光值,得到的标准曲线方程为:y=0.008x+0.051 3,R2=0.993 4。结果以没食子酸当量mg GAE/mL表示。
1.3.6 抗氧化活性的测定
使用DPPH法、ABTS法、FRAP法和ORAC法4种方法评估抗氧化活性,以Trolox为标准品制作标准曲线,如表1所示,结果以Trolox当量mg TE/mL或者mg TE/g表示。
表1 抗氧化活性的标准曲线
Table 1 Standard curves of antioxidant activity
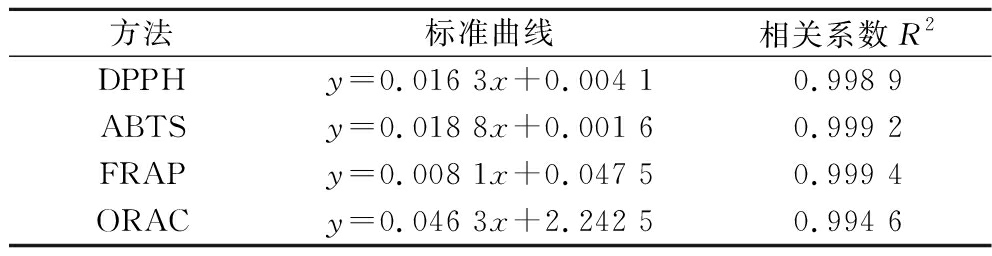
方法标准曲线相关系数R2DPPHy=0.016 3x+0.004 10.998 9ABTSy=0.018 8x+0.001 60.999 2FRAPy=0.008 1x+0.047 50.999 4ORACy=0.046 3x+2.242 50.994 6
DPPH、ABTS和FRAP的测定方法参考李晓华等[15]的方法。
ORAC[16]:黑色96孔板加入20 μL样品[如需稀释,用75 mmol/L PBS(pH 7.4)稀释后备用],孵育至37 ℃,加入80 μL 1.25 μmol/L荧光素钠溶液[75 mmol/L PBS(pH 7.4)配制],37 ℃孵育5 min,加入100 μL 140 mmol/L AAPH,振荡混匀,用酶标仪测定荧光强度。以120 μL蒸馏水与80 μL荧光素钠溶液作为阴性对照,以20 μL蒸馏水、80 μL荧光素钠溶液以及100 μL AAPH作为空白对照。荧光测定条件:激发波长485 nm,发射波长520 nm,循环35次,每个循环2.5 min。样品ORAC值(mmol TE /L)按公式(1)、公式(2)、公式(3)计算。
![]()
(1)
NetAUC=AUCsample-AUCblank
(2)
ORAC值![]()
(3)
式中:AUC(area under the curve, AUC),荧光衰退曲线下面积; f1,第1次读取的荧光信号值; fi,第i次读取的荧光信号值;CT,每次循环间隔时间;Net AUC,荧光衰退曲线的延缓部分面积;CTrolox,Trolox的摩尔浓度,mmol/L;k,样品的稀释因子。
1.3.7 正交试验设计优化CP-1转化橙皮苷的条件
1.3.7.1 单因素对橙皮素产率的影响
以时间、pH、菌液浓度、橙皮苷浓度为主要因素,研究各因素对橙皮素浓度和产率的影响,橙皮素产率按公式(4)计算。
橙皮素产率![]()
(4)
式中:n,物质的量,mol。
1.3.7.2 正交试验设计表
在单因素试验的基础上,采用L9(34)正交试验,具体因素与水平设计如表2所示,以橙皮素产率为综合指标,确定最佳转化条件。
表2 L9(34)正交试验的因素与水平
Table 2 The factors and levels of L9(34) orthogonal experiment
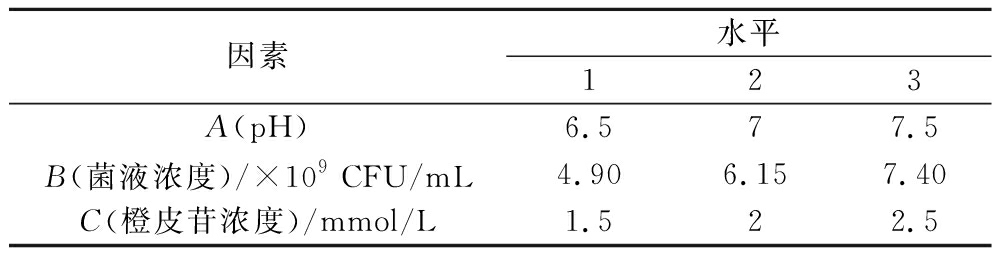
因素水平123A(pH)6.577.5B(菌液浓度)/×109 CFU/mL4.906.157.40C(橙皮苷浓度)/mmol/L1.522.5
1.3.8 HPLC检测方法
采用HPLC分析主要单体黄酮类化合物的含量,使用相对应的标准品绘制标准曲线,如表3所示。
表3 主要黄酮类化合物的标准曲线
Table 3 Standard curves of the main flavonoids

化合物CAS分子式标准曲线相关系数R2芸香柚皮苷14259-46-2C27H32O14y=19 124.12x-26 012.60.999 9柚皮苷10236-47-2C27H32O14y=19 950.15x-24 827.40.999 9橙皮苷520-26-3C28H34O15y=12 145.71x-89.200.999 9柚皮素-7-O-葡萄糖苷529-55-5C21H22O10y=29 344.89x-42 561.90.999 9橙皮素-7-O-葡萄糖苷31712-49-9C22H24O11y=17 483.19x+21 765.320.999 0柚皮素480-41-1C15H12O5y=40 007.62x-59 133.80.999 9橙皮素520-33-2C16H14O6y=35 104.13x+7 8180.999 4川陈皮素478-01-3C21H22O8y=56 648.62x-97 572.60.999 9橘皮素481-53-8C20H20O7y=55 999.83x-90 507.80.999 9
色谱条件:色谱柱为X-Bridge RPC18(4.6 mm×250 mm,5 μm,Waters);流动相:D相为乙腈,B相为-0.04%乙酸溶液,梯度洗脱(0~40 min,25% D;40~45 min,35% D;45~50 min,50% D;50~60 min,5% D;60~70 min,5% D);流速0.8 mL/min;检测波长190~800 nm全扫描;柱温30 ℃;最大泵压20 MPa;进样量10 μL。
1.3.9 数据处理
全部实验进行3次重复,结果以平均值±标准误差表示。数据处理使用Excel 2010,方差分析用IBM SPSS Statistics 22单因素ANOVA检验,图形绘制用Origin 2021、GraphPad Prism 9.3,正交试验的极差分析用latin。
2 结果与分析
2.1 转化过程中TPs、TFs和主要黄酮类化合物含量的变化
由图1可知,酵母组中陈皮乙醇提取物的TPs和TFs含量均显著升高(P<0.05),分别增长了42.22%和9.46%,而对照组中的TPs和TFs含量没有显著变化(P>0.05)。采用HPLC检测主要黄酮类化合物含量,结果如图2和图3所示。酵母组中的芸香柚皮苷、橙皮苷、川陈皮素和橘皮素含量均显著降低,而橙皮素含量显著升高;柚皮素含量先升高后降低,在8 h达到最大值;柚皮苷含量在前16 h没有显著变化。此外,在酵母组中检测到橙皮素-7-O-葡萄糖苷,在8 h达到最大值,之后便逐渐降低;然而在对照组中没有检测到橙皮素-7-O-葡萄糖苷,说明CP-1的加入产生了橙皮素-7-O-葡萄糖苷。总的来说,此结果与LIU等[17]、WANG等[18]的研究报告相一致。
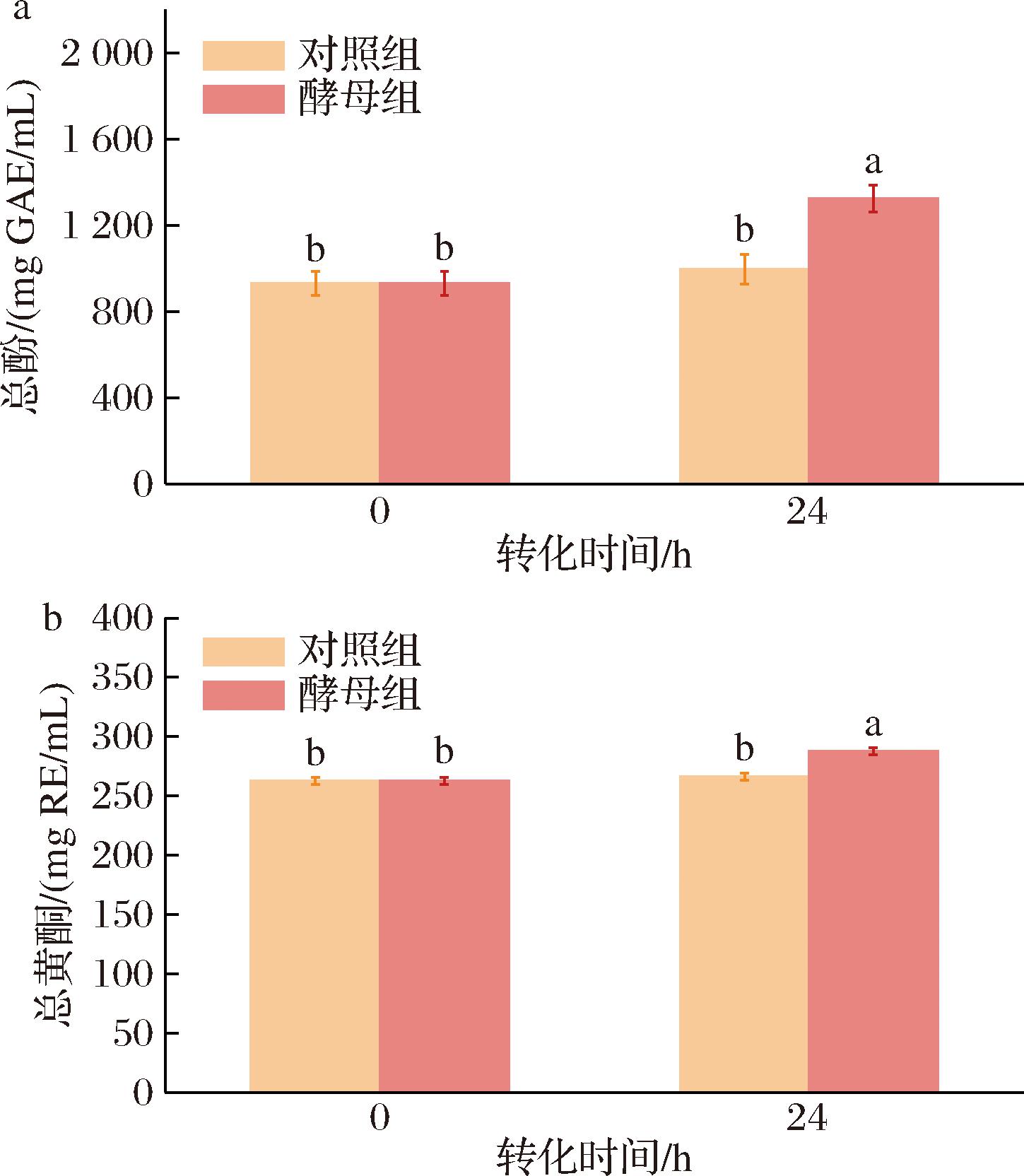
a-总酚;b-总黄酮
图1 不同转化时间总酚和总黄酮的含量变化
Fig.1 Content changes of TPs and TFs at different transformation time
注:不同小写字母表示显著性差异(P<0.05)(下同)。
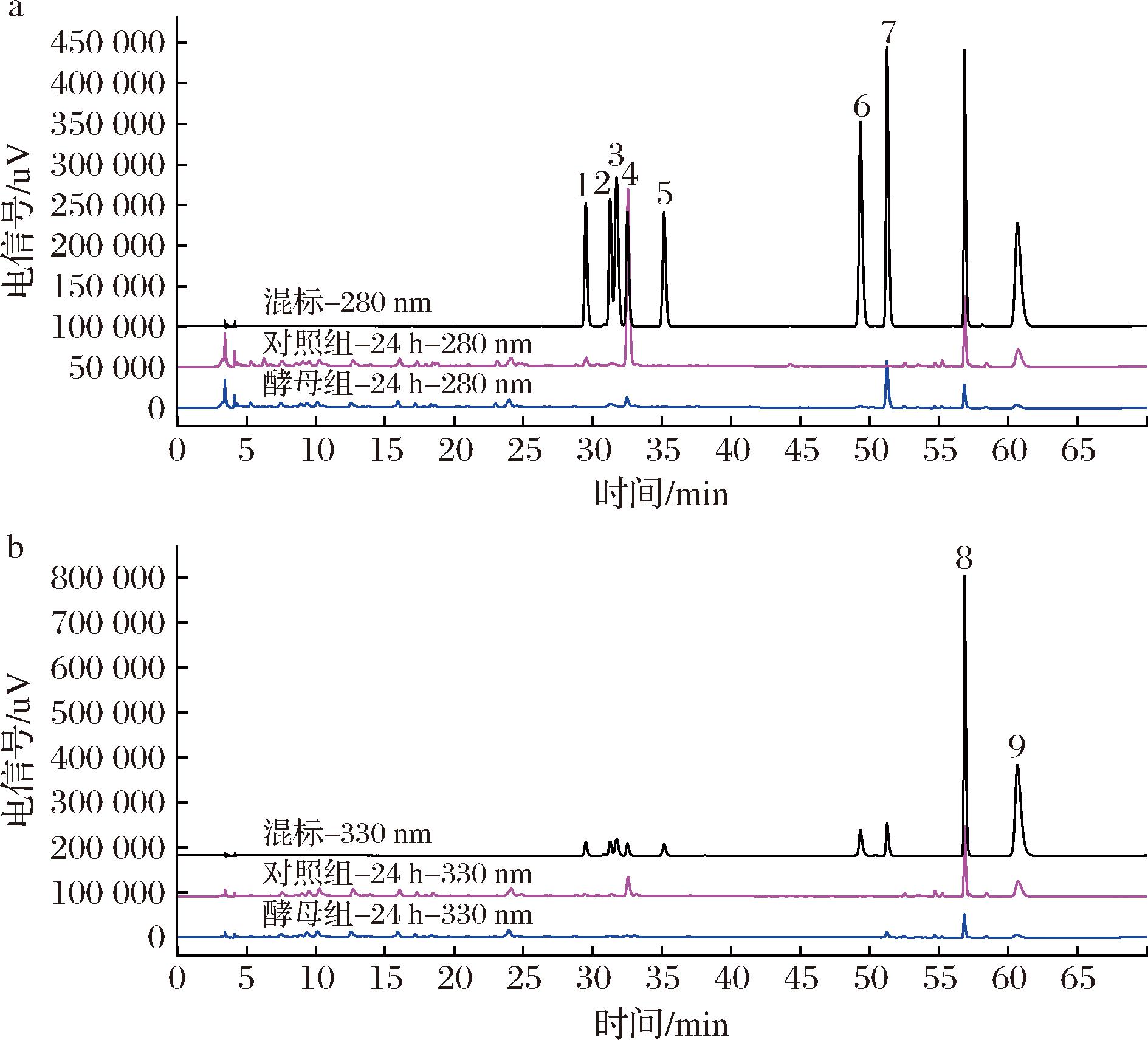
a-280 nm;b-330 nm
图2 混合标准品、对照组和酵母组的HPLC图谱
Fig.2 HPLC chromatogram of mixed standard, control and yeast group
注:数字1-9分别表示芸香柚皮苷、柚皮苷、柚皮素-7-O-葡萄糖苷、橙皮苷、橙皮苷-7-O-葡萄糖苷、柚皮素、橙皮素、川陈皮素、橘皮素(下同)。

a-对照组;b-酵母组
图3 不同转化时间主要黄酮类化合物的含量变化
Fig.3 Content changes of the main flavonoids at different transformation time
为了明确酵母组中产物橙皮素和柚皮素的来源,使用CP-1分别对两个黄酮O型苷类(橙皮苷和芸香柚皮苷)进行特异性转化,结果如图4所示。
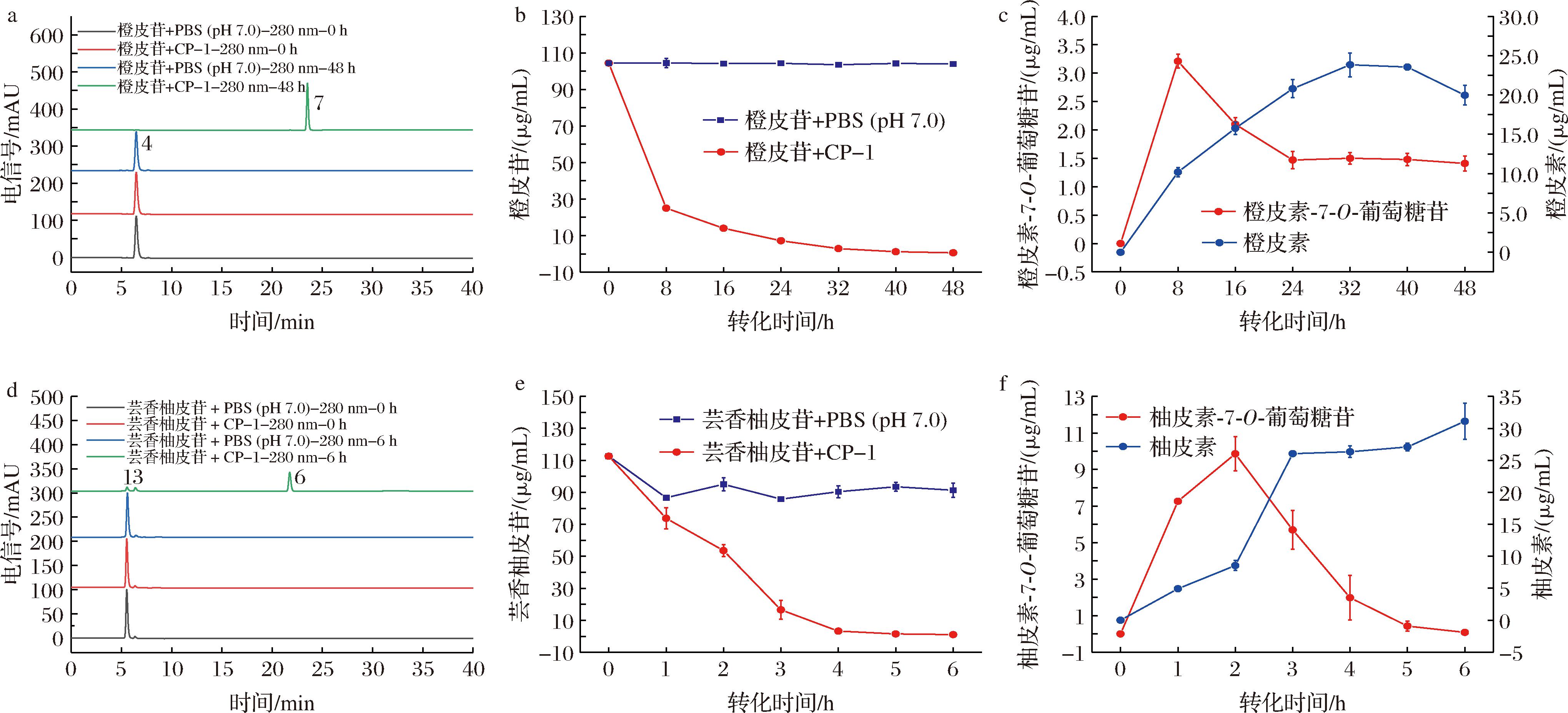
a-橙皮苷HPLC图谱;b-橙皮苷含量变化;c-橙皮素-7-O-葡萄糖苷和橙皮素含量变化;d-芸香柚皮苷HPLC图谱;e-芸香柚皮苷含量变化;f-柚皮素-7-O-葡萄糖苷和柚皮素含量变化
图4 橙皮苷和芸香柚皮苷及其产物在不同转化时间的HPLC图谱和含量变化
Fig.4 HLPC chromatogram and content of hesperidin, narirutin and their products at different transformation time
橙皮苷含量逐渐减少,产生两个代谢产物,分别被鉴定为橙皮素-7-O-葡萄糖苷和橙皮素;橙皮素-7-O-葡萄糖苷浓度在8 h达到最大值,之后逐渐降低;橙皮素含量逐渐升高到32 h后逐渐降低。类似地,芸香柚皮苷被逐渐转化为柚皮素-7-O-葡萄糖苷和柚皮素;柚皮素-7-O-葡萄糖苷在2 h达到最大值,之后被进一步降解为柚皮素。总的来说,CP-1转化橙皮苷、芸香柚皮苷的结果与转化陈皮乙醇提取物的结果相一致,表明橙皮素和柚皮素的来源分别是橙皮苷和芸香柚皮苷。
陈皮中的黄酮类化合物主要为黄酮碳苷类、黄酮O型苷类、黄酮苷类和多甲氧基黄酮[19]。芸香柚皮苷、柚皮苷和橙皮苷均属于黄酮O型苷类,其中橙皮苷是陈皮中含量最丰富的活性成分。芸香糖是橙皮苷和芸香柚皮苷两者共有的二糖组分,分别与橙皮素和柚皮素结合生成橙皮苷和芸香柚皮苷。芸香糖(α-L-鼠李糖基(1→6)-β-D-葡萄糖基)由一个鼠李糖和一个葡萄糖通过糖苷键结合而成[20]。诸多研究表明,α-L-鼠李糖苷酶催化橙皮苷、芸香柚皮苷脱去α-L-鼠李糖基而分别形成橙皮素-7-O-葡萄糖苷、柚皮素-7-O-葡萄糖苷;β-D-葡萄糖苷酶催化橙皮素-7-O-葡萄糖苷、柚皮素-7-O-葡萄糖苷脱去β-D-葡萄糖基而分别形成橙皮素、柚皮素[21-23]。因此,推测本研究中CP-1代谢产生的α-L-鼠李糖苷酶和β-D-葡萄糖苷酶催化橙皮苷和芸香柚皮苷进行脱糖基化,从而生成橙皮素和柚皮素,说明CP-1代谢产生的α-L-鼠李糖苷酶具有α-(1→6)糖苷酶活性。川陈皮素和橘皮素均属于多甲氧基黄酮类化合物,两者的含量在CP-1的作用下均随转化时间的延长而降低,但是在本研究中两者的具体代谢产物尚未明确,有待进一步研究。有相关研究表明,川陈皮素的代谢产物为7-去甲基-川陈皮素和6-去甲基-川陈皮素[24];橘皮素的代谢产物为3′,4′-二羟基-5,6,7,8-四甲氧基黄酮、4′,6,7-三羟基-5,8-二甲氧基黄酮[25]。川陈皮素和橘皮素代谢模式均为黄酮骨架中的甲基被降解或者被替换成其他基团,具体的去甲基化机制和生物学效仍需深入研究。
2.2 α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的部位确定
对CP-1进行超声破碎,获得细胞外酶、细胞内酶和细胞碎片。以橙皮苷作为底物,以PBS(pH 7.0)为空白组、未经破碎的CP-1细胞为对照组,测定细胞外酶、细胞内酶、细胞碎片对橙皮苷的转化效果,确认α-L-鼠李糖苷酶和β-D-葡萄糖苷酶在细胞中的定位。采用HPLC法测定橙皮苷和产物的含量,结果如图5所示。

a-橙皮苷溶液HPLC图谱;b-橙皮苷+细胞外酶HPLC图谱;c-橙皮苷+细胞内酶HPLC图谱;d-橙皮苷+细胞碎片HPLC图谱;e-橙皮苷+未经细胞破碎的CP-1细胞HPLC图谱;f-橙皮苷的含量变化;g-橙皮素-7-O-葡萄糖苷的含量变化;h-柚皮素的含量变化
图5 细胞不同部位酶转化橙皮苷及其产物在不同转化时间的HLPC图谱和含量变化
Fig.5 HLPC chromatogram and content of hesperidin and its products transformed by enzymes in different parts of cells at different transformation time
空白组和细胞外酶的转化体系中橙皮苷产量没有显著变化,且未检测到产物特征峰,说明细胞外酶中不存在α-L-鼠李糖苷酶和β-D-葡萄糖苷酶。对照组、细胞内酶和细胞碎片中的橙皮苷含量均随着转化时间的延长逐渐减少,检测到两个产物峰,分别被鉴定为橙皮素-7-O-葡萄糖苷、橙皮素,说明α-L-鼠李糖苷酶和β-D-葡萄糖苷酶主要存在于细胞内酶和细胞碎片中[11]。对照组和细胞碎片中橙皮素-7-O-葡萄糖苷的含量均升高至8 h达到最大值后逐渐降低,然而细胞内酶中橙皮素-7-O-葡萄糖苷的含量在48 h内持续升高,说明细胞内酶适用于制备橙皮素-7-O-葡萄糖苷;对照组和细胞内酶中橙皮素的含量均随着转化时间逐渐升高,而细胞碎片中的橙皮素的含量在32 h达到最高之后逐渐降低,说明细胞碎片适用于快速制备橙皮素。
2.3 转化过程中陈皮乙醇提取物的抗氧化活性变化
采用DPPH、ABTS、FRAP和ORAC四种方法分别测定陈皮乙醇提取物的抗氧化活性,结果如图6-a~图6-d所示。酵母组的DPPH值、ABTS值、FRAP值较对照组分别升高了20.66%、9.73%、9.84%,而ORAC值较对照组降低了3.30%。和对照组相比,酵母组表现出更好的自由基清除能力和铁离子还原能力,较弱的氧自由基吸收能力,这可能与酵母组中的酚类和黄酮类化合物的成分或者含量发生了变化有关。采用同样的方法比较标准品橙皮苷、橙皮素-7-O-葡萄糖苷和橙皮素三者之间的抗氧化活性,结果如图6-e和图6-f所示。橙皮素(转化产物)具有比橙皮苷(转化底物)、橙皮素-7-O-葡萄糖苷(中间产物)更强的自由基清除能力和铁离子还原能力,较弱的氧自由基吸收能力,此结果与酵母组的抗氧化活性变化趋势具有相似性且与WANG等[25]、CHOI等[26]的研究结果一致。
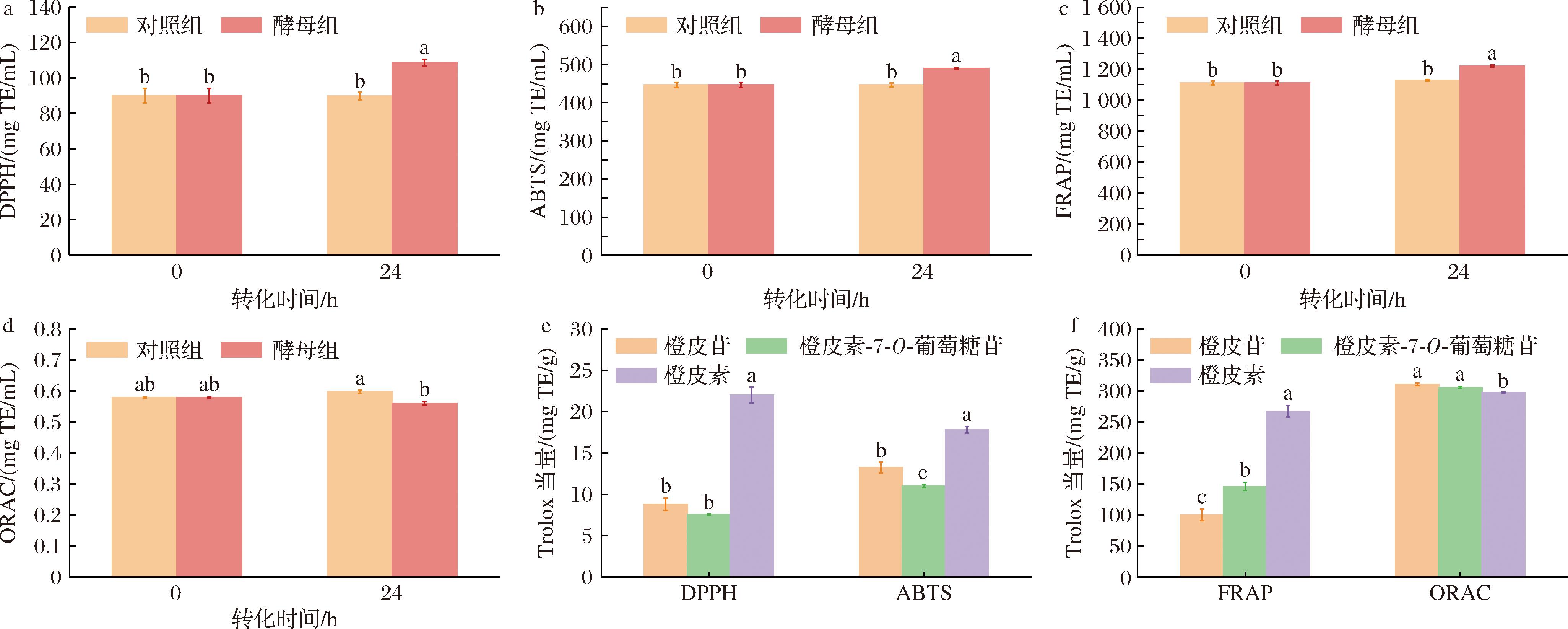
a-对照组和酵母组的DPPH自由基的Trolox当量;b-对照组和酵母组的ABTS阳离子自由基的Trolox当量;c-对照组和酵母组的FRAP还原力的Trolox当量;d-ORAC的Trolox当量;e-橙皮苷、橙皮素-7-O-葡萄糖苷和橙皮素的DPPH自由基和ABTS阳离子自由基的Trolox当量;f-橙皮苷、橙皮素-7-O-葡萄糖苷和橙皮素的FRAP还原力和ORAC的Trolox当量
图6 不同转化时间的抗氧化活性变化及橙皮苷、橙皮素-7-O-葡萄糖苷和橙皮素的抗氧化活性比较
Fig.6 Changes of antioxidant activity at different transformation time and comparison of antioxidant activity among standards hesperidin, hesperetin-7-O-glucoside and hesperetin
将酵母组的抗氧化活性与TPs、TFs及其主要黄酮类化合物进行皮尔逊相关性分析,结果如图7所示。DPPH、ABTS和FRAP均与TPs、橙皮素-7-O-葡萄糖苷、柚皮素和橙皮素呈现显著正相关,与芸香柚皮苷、柚皮苷、橙皮苷、川陈皮素和橘皮素呈现显著负相关;其中ABTS和TFs两者之间有显著正相关性,而DPPH、FRAP均与TFs没有显著相关性。与之相反的是,ORAC与TPs、橙皮素-7-O-葡萄糖、柚皮素和橙皮素显著负相关,与芸香柚皮苷、柚皮苷、橙皮苷、川陈皮素和橘皮素显著正相关,与TFs没有相关性。因此,推断酵母组的抗氧化活性主要受酚类和黄酮类物质的影响,其中酚类物质的影响作用更大。有研究表明,陈皮的ABTS值受到酚酸的影响,与肉桂酸呈显著负相关,与对香豆酸、苯甲酸、水杨酸呈极显著正相关[1];利用商用酵母和本地酵母发酵均可以提高葡萄酒的多酚含量和总抗氧化活性[27]。
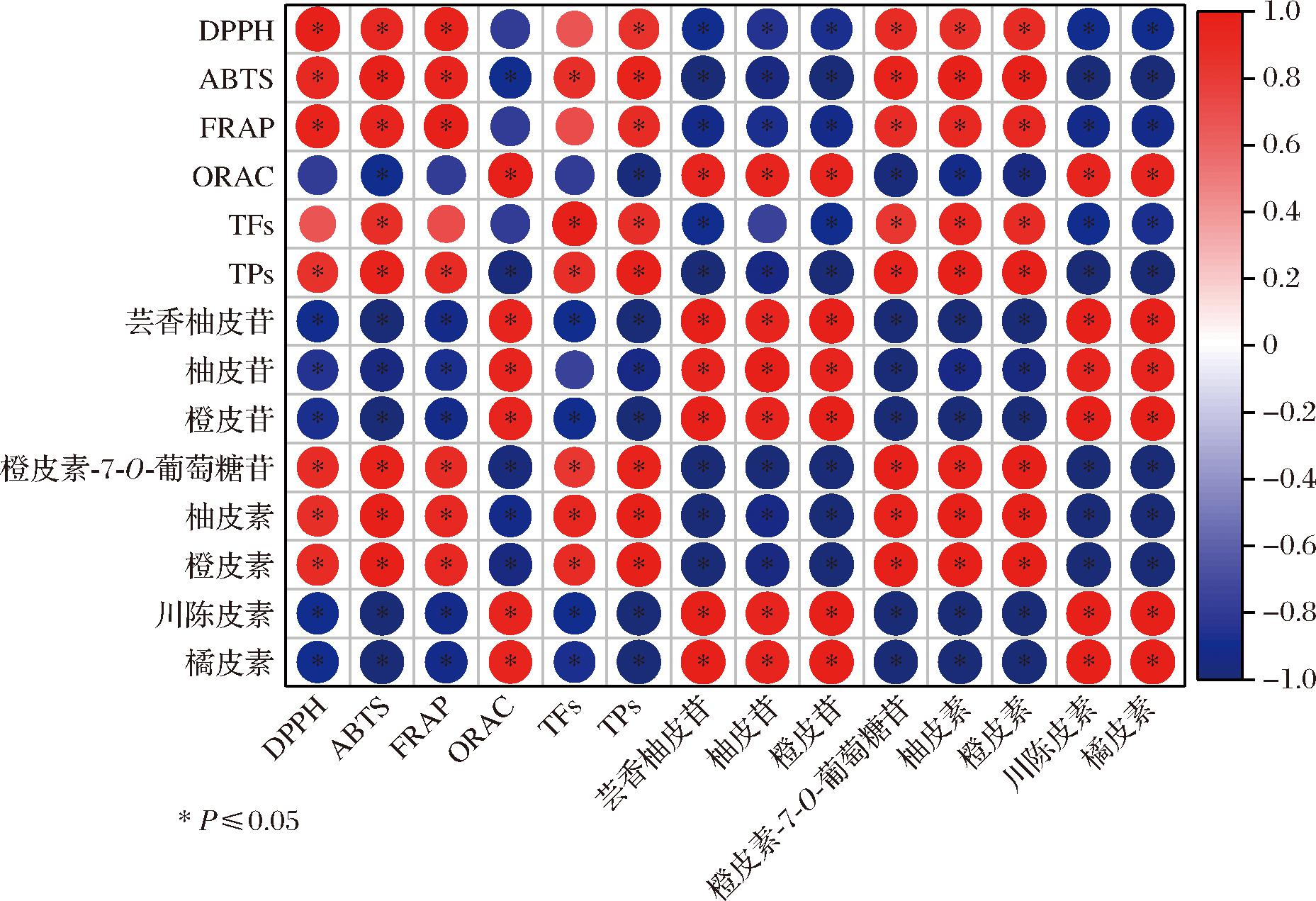
图7 抗氧化活性与TPs、TFs及主要黄酮类化合物的皮尔逊相关性热图
Fig.7 Pearson correlation heatmap among antioxidant activity, TPs, TFs and the main flavonoids
CP-1利用陈皮乙醇提取物中的碳水化合物、氨基酸等营养物质进行代谢活动,代谢活动过程中分泌产生的各种酶将结构复杂的大分子物质催化降解为结构简单的小分子物质,从而导致陈皮乙醇提取物的抗氧化活性发生了变化。结构复杂的大分子物质进入人体后难以被吸收,被微生物降解为结构简单的小分子物质之后,更容易被人体消化、吸收和利用[28]。如2.1节所述,α-L-鼠李糖苷酶和β-D-葡萄糖苷酶催化芸香柚皮苷和橙皮苷脱去一个鼠李糖和一个葡萄糖而分别形成柚皮素和橙皮素。被降解下来的鼠李糖和葡萄糖可以继续作为碳源为CP-1的代谢活动提供能量。研究表明,橙皮素拥有比橙皮苷更强的抗菌活性、抗炎活性和抗氧化活性[26]。柚皮素拥有比柚皮苷更低的苦味,更显著的神经保护作用[29]。糖苷是阻止黄酮类化合物吸收的主要因素;糖苷水解酶催化黄酮类化合物进行脱糖基化,生物利用度得到提高的同时其生物活性亦得到了增强[30]。脱糖基化可将更多的酚羟基暴露出来。据研究报道,黄酮骨架中的酚羟基对于抗氧化活性是至关重要的,如果缺失或者被另一个基团替代,抗氧化活性将显著降低[31]。本研究中,酵母组的两个重要产物柚皮素和橙皮素的黄酮骨架中均具有酚羟基。因此,酵母组的抗氧化活性随着柚皮素和橙皮素含量的升高而逐渐增强;其中,柚皮素含量在8 h达到最高之后便逐渐降低,可能原因是柚皮素作为合成其他黄酮类化合物的重要前体物质,在CP-1代谢产生的各种酶催化下逐渐转化为其他酚类或者黄酮类化合物,例如圣草酚和山奈酚等黄酮骨架中同样具有酚羟基的化合物[32]。总之,CP-1作用下柚皮素的代谢产物仍需进一步深入研究。
2.4 正交试验优化CP-1对橙皮苷的转化条件
2.4.1 单因素试验
2.4.1.1 转化时间对橙皮素产率的影响
如图8-a所示。随着转化时间的延长,橙皮素产率和浓度均先上升后下降,于32 h最高,产率为56.74%,质量浓度达到42.87 μg/mL,可能原因是此时CP-1产生的酶量最大,酶结合位点充足,橙皮苷能够充分地与酶结合位点结合,进而提高酶反应速率。继续延长转化时间,橙皮素产率和浓度均有所下降,这可能是因为转化时间过长,转化体系中的营养消耗过多,代谢副产物积累,菌体出现死亡[33];亦可能是因为橙皮素被CP-1进一步降解代谢[34],具体代谢产物有待进一步研究。综上,选择32 h为最佳转化时间。

a-转化时间;b-pH;c-菌液浓度;d-橙皮苷浓度
图8 转化时间、pH、菌液浓度和橙皮苷浓度对橙皮素产量的影响
Fig.8 Effect of transformation time, pH, concentration of fungi solution and concentration of hesperidin on hesperitin yield
2.4.1.2 pH对橙皮素产率的影响
如图8-b所示,随着PBS的pH升高,橙皮素产率和浓度均呈现先快速增长后缓慢下降的趋势。当pH值为6.0~7.0时,橙皮素产率和浓度增长迅速,于pH 7.0时达到最高,分别为48.07%、29.06 μg/mL;当pH值为7.0~8.0时,橙皮素产率和浓度开始逐渐下降,可能原因是碱性的环境下,α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的酶活性逐渐降低[35-36],酶反应速率减慢,橙皮素产率和浓度因此逐渐降低。综上所述,调整PBS的pH值为7.0最佳。
2.4.1.3 菌液浓度对橙皮素产率的影响
转化体系中CP-1的初始浓度会直接影响CP-1转化橙皮苷的效果,如图8-c所示,随着菌液浓度的增加,橙皮素产率和浓度均先升高后降低,于菌液浓度为6.15×109 CFU/mL时达到最高,分别为49.64%、30.03 μg/mL。菌液浓度过低时,酵母分泌产生的酶量过少,酶反应速率过低;菌液浓度过高时,橙皮素产率和浓度降低,其原因可能是生存空间不足以提供所有CP-1细胞生长,转化体系中的营养消耗过大,代谢副产物过多,加速了菌体死亡,从而使转化效果降低[33]。因此,以6.15×109 CFU/mL为最佳菌液浓度。
2.4.1.4 橙皮苷浓度对橙皮素产率的影响
由图8-d可知,随着橙皮苷浓度的逐渐升高,橙皮素产率、浓度均呈现先升高后降低的变化趋势。当橙皮苷浓度为2 mmol/L时,橙皮素产率达到最高,为46.18%;而当橙皮苷浓度为2.5 mmol/L时,橙皮素质量浓度达到最高,为33.57 μg/mL。橙皮苷浓度从0.5 mmol/L增加至2.0 mmol/L时,橙皮素产率显著升高,可能原因是高浓度橙皮苷可以增加橙皮苷与酶结合位点的结合概率,从而提高酶促反应速率;当橙皮苷浓度继续升高至2.5 mmol/L时,橙皮素产率开始降低,可能是因为CP-1生长代谢过程中产生的酶量有限,底物浓度过高,酶的结合位点已经饱和,从而酶反应速率开始下降。因此,选择2 mmol/L为最佳浓度。
2.4.2 正交试验优化及结果分析
以橙皮素产率为评价指标,根据单因素试验结果,选取pH、菌液浓度、橙皮苷浓度3个因素进行正交试验优化,设计L9(34)正交试验,试验结果如表4所示。由极差R可知,影响橙皮素产率的最显著因素是pH,其次是橙皮苷浓度,菌液浓度的影响较小,即3个因素的影响程度为:A(pH)>C(橙皮苷浓度)>B(菌液浓度)。比较正交设计表中的9个组合,得到橙皮素产率最高的最优组合是A1B3C3,产率达到83.34%;比较各因素k值大小,pH的最优水平是1(6.5),菌液浓度的最优水平是1(4.9×109 CFU/mL),橙皮苷浓度的最优水平是3(2.5 mmol/L),因此得到制备橙皮素的最佳方案组合为A1B1C3。
表4 CP-1转化橙皮苷的正交试验方案及极差分析
Table 4 Orthogonal experiment scheme and result analysis of transformation of hesperidin by CP-1

序号A(pH)B(菌液浓度)/(×109 CFU/mL)C(橙皮苷浓度)/(mmol/L)橙皮素产率/%11(6.5)1(4.90)1(1.5)62.37212(6.15)2(2.0)71.76313(7.40)3(2.5)83.3442(7.0)1370.66522174.23623259.6573(7.5)1260.41832347.42933146.79K1217.47193.45183.39K2204.54193.41191.82K3154.62189.78201.42k172.4964.4861.13k268.1864.4763.94k351.5463.2667.14极差R20.951.226.01最优水平A1B1C3主次因素A>C>B
由于正交试验组中的最优组合与极差分析得到的最佳组合不一致,为验证试验结果的可靠性,对两组最佳组合进行验证,试验重复3次。结果表明,A1B3C3和A1B1C3的橙皮素产率分别为83.57%和84.28%,前者略低于后者,因此最终确定A1B1C3为最佳组合,即pH值为6.5,菌液浓度为4.9×109 CFU/mL,橙皮苷浓度为2.5 mmol/L。
3 结论与讨论
本研究探讨了CP-1转化对陈皮乙醇提取物的活性成分及抗氧化活性的影响。研究发现,CP-1转化24 h之后,陈皮乙醇提取物中TPs和TFs的含量分别升高了42.22%和9.46%;随着转化时间的延长,橙皮素含量升高7.52倍,柚皮素和橙皮素-7-O-葡萄糖苷在8 h升高至最大值,之后便逐渐降低,芸香柚皮苷、橙皮苷、川陈皮素和橘皮素含量逐渐降低,分别降低85.10%、88.86%、72.13%和81.82%。经过特异性底物验证,CP-1可以将芸香柚皮苷转化为柚皮素-7-O-葡萄糖苷和柚皮素,将橙皮苷转化为橙皮素-7-O-葡萄糖苷和橙皮素。参与转化的α-L-鼠李糖苷酶和β-D-葡萄糖苷酶主要存在于细胞内酶和细胞碎片。CP-1亦能够显著增强陈皮乙醇提取物的抗氧化活性,DPPH值、ABTS值和FRAP值分别升高20.66%、9.73%和9.84%,而ORAC值降低3.30%。以橙皮苷为底物经过正交试验优化得到的最佳转化工艺条件为:pH 6.5,菌液浓度4.9×109 CFU/mL,橙皮苷浓度2.5 mmol/L。综上所述,CP-1可以促进酚类和黄酮类化合物等活性物质的转化和积累,对于柑橘皮渣高值化利用具有重要意义。
[1] BIAN X Q, XIE X Y, CAI J L, et al.Dynamic changes of phenolic acids and antioxidant activity of Citri Reticulatae Pericarpium during aging processes[J].Food Chemistry, 2022, 373:131399.
[2] 刘素娟. 陈皮陈化过程“环境因子—真菌—药效物质基础”相关性研究[D].成都:成都中医药大学, 2018.LIU S J.Correlation research of environmental factors, fungi and effective substance in the aging process of Citri Reticulatae Pericarpium[D].Chengdu:Chengdu University of Traditional Chinese Medicine, 2018.
[3] FU M Q, XIAO G S, WU J J, et al.Chemical Constituents from Pericarpium Citri Reticulatae[J].Chinese Herbal Medicines, 2017, 9(1):86-91.
[4] YANG F Q, HE L Y, SHEN M Y, et al.A correlation between Pericarpium Citri Reticulatae volatile components and the change of the coexisting microbial population structure caused by environmental factors during aging[J].Frontiers in Microbiology, 2022, 13:930845.
[5] WANG F, CHEN L, CHEN S W, et al.Microbial biotransformation of Pericarpium Citri Reticulatae (PCR) by Aspergillus niger and effects on antioxidant activity[J].Food Science &Nutrition, 2021, 9(2):855-865.
[6] SHEN F, WANG T Y, ZHANG R J, et al.Metabolism and release of characteristic components and their enzymatic mechanisms in Pericarpium Citri Reticulatae co-fermentation[J].Food Chemistry, 2024, 432:137227.
[7] 傅曼琴, 陈玉婷, 吴继军, 等.陈皮表面微生物及其转化黄酮类物质的研究进展[J].现代食品科技, 2022, 38(4):282-291.FU M Q, CHEN Y T, WU J J, et al.Research progress on the surface microorganisms of Citri Reticulatae Pericarpium and derived microbial transformation of flavonoids[J].Modern Food Science and Technology, 2022, 38(4):282-291.
[8] HAN Y J, TANG Z G, BAO H F, et al.Degradation of pendimethalin by the yeast YC2 and determination of its two main metabolites[J].RSC Advances, 2019, 9(1):491-497.
[9] D AZ M A, PEREYRA M M, SANTANDER F F S, et al.Protection of citrus fruits from postharvest infection with Penicillium digitatum and degradation of patulin by biocontrol yeast Clavispora lusitaniae 146[J].Microorganisms, 2020, 8(10):1477.
AZ M A, PEREYRA M M, SANTANDER F F S, et al.Protection of citrus fruits from postharvest infection with Penicillium digitatum and degradation of patulin by biocontrol yeast Clavispora lusitaniae 146[J].Microorganisms, 2020, 8(10):1477.
[10] 杨丹, 杨放晴, 燕娜娜, 等.黑曲霉发酵对陈皮黄酮类成分及抗氧化活性的影响[J].食品科技, 2019, 44(12):23-27.YANG D, YANG F Q, YAN N N, et al.Effects of Aspergillus niger fermentation on flavonoids and antioxidant activity of pericarpium citri reticulatae(PCR)[J].Food Science and Technology, 2019, 44(12):23-27.
[11] 刘丽娜. 基于微生物代谢对陈皮陈化活性物质转化机制的研究[D].湛江:广东海洋大学, 2019.LIU L N.Study on the mechanism of the active substance transformation of Citri Reticulatae Pericarpium aging based on microbial metabolism[D].Zhanjiang:Guangdong Ocean University, 2019.
[12] 荆常亮. 紫花苜蓿总黄酮的提取、纯化及其抗氧化活性研究[D].北京:中国农业科学院, 2016.JING C L.Extraction, purification and antioxidant activities of flavonoids from alfalfa[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[13] FU M Q, AN K J, XU Y J, et al.Effects of different temperature and humidity on bioactive flavonoids and antioxidant activity in Pericarpium Citri Reticulata (Citrus reticulata ‘Chachi’)[J].LWT, 2018, 93:167-173.
[14] KWAW E, MA Y K, TCHABO W, et al.Effect of Lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chemistry, 2018, 250:148-154.
[15] 李晓华, 徐玉娟, 刘雯雯, 等.不同配比陈皮-蜜橘皮茶汤品质分析[J].食品与发酵工业, 2024, 50(12):159-169.LI X H, XU Y J, LIU W W, et al.Quality analysis of Pericarpium Citri Reticulatae-Citrus Unshiu peel tea soups with different proportions[J].Food and Fermentation Industries, 2024, 50(12):159-169.
[16] ZULUETA A, ESTEVE M J, FR GOLA A.ORAC and TEAC assays comparison to measure the antioxidant capacity of food products[J].Food Chemistry, 2009, 114(1):310-316.
GOLA A.ORAC and TEAC assays comparison to measure the antioxidant capacity of food products[J].Food Chemistry, 2009, 114(1):310-316.
[17] LIU R T, TAO Y X, XU T T, et al.Antioxidant activity increased due to dynamic changes of flavonoids in orange peel during Aspergillus niger fermentation[J].International Journal of Food Science &Technology, 2023, 58(6):3329-3336.
[18] WANG F, CHEN L, LI F Q, et al.The Increase of flavonoids in pericarpium citri reticulatae (PCR) induced by fungi promotes the increase of antioxidant activity[J].Evidence-Based Complementary and Alternative Medicine, 2018, 2018(1):2506037.
[19] YU X, SUN S, GUO Y Y, et al.Citri Reticulatae Pericarpium (Chenpi):Botany, ethnopharmacology, phytochemistry, and pharmacology of a frequently used traditional Chinese medicine[J].Journal of Ethnopharmacology, 2018, 220:265-282.
[20] SHILPA V S, SHAMS R, DASH K K, et al.Phytochemical properties, extraction, and pharmacological benefits of naringin:A review[J].Molecules, 2023, 28(15):5623.
[21] PENG C, LI R, NI H, et al.The effects of α-L-rhamnosidase, β-D-glucosidase, and their combination on the quality of orange juice[J].Journal of Food Processing and Preservation, 2021, 45(7):e15604.
[22] ZHU Y P, JIA H Y, XI M L, et al.Purification and characterization of a naringinase from a newly isolated strain of Bacillus amyloliquefaciens 11568 suitable for the transformation of flavonoids[J].Food Chemistry, 2017, 214:39-46.
[23] ZOU Y C, XIN X, XU H X, et al.Highly efficient bioconversion of flavonoid glycosides from citrus-processing wastes in solvent-buffer systems[J].Green Chemistry, 2020, 22(10):3196-3207.
[24] SU S W, ZHAO D G, YUAN B, et al.Biosynthesis of 6- and 7-mono-demethylated nobiletins by a newly isolated strain of yeast[J].Journal of Agricultural and Food Chemistry, 2022, 70(49):15439-15448.
[25] NIELSEN S E, BREINHOLT V, CORNETT C, et al.Biotransformation of the citrus flavone tangeretin in rats.Identification of metabolites with intact flavane nucleus[J].Food and Chemical Toxicology, 2000, 38(9):739-746.
[26] CHOI S S, LEE S H, LEE K A.A comparative study of hesperetin, hesperidin and hesperidin glucoside:antioxidant, anti-inflammatory, and antibacterial activities in vitro[J].Antioxidants, 2022, 11(8):1618.
[27] GRIECO F, CARLUCCIO M A, GIOVINAZZO G.Autochthonous Saccharomyces cerevisiae starter cultures enhance polyphenols content, antioxidant activity, and anti-inflammatory response of apulian red wines[J].Foods, 2019, 8(10):453.
[28] GARCIA-ALONSO A, S NCHEZ-PANIAGUA L
NCHEZ-PANIAGUA L PEZ M, MANZANARES-PALENZUELA C L, et al.Edible plant by-products as source of polyphenols:Prebiotic effect and analytical methods[J].Critical Reviews in Food Science and Nutrition, 2023, 63(31):10814-10835.
PEZ M, MANZANARES-PALENZUELA C L, et al.Edible plant by-products as source of polyphenols:Prebiotic effect and analytical methods[J].Critical Reviews in Food Science and Nutrition, 2023, 63(31):10814-10835.
[29] SEONG H J, IM A E, KIM H, et al.Production of prunin and naringenin by using naringinase from Aspergillus oryzae NYO-2 and their neuroprotective properties and debitterization[J].Journal of Agricultural and Food Chemistry, 2023, 71(3):1655-1666.
[30] KARIM N, JIA Z Q, ZHENG X D, et al.A recent review of Citrus flavanone naringenin on metabolic diseases and its potential sources for high yield-production[J].Trends in Food Science &Technology, 2018, 79:35-54.
[31] XIE P J, HUANG L X, ZHANG C H, et al.Phenolic compositions, and antioxidant performance of olive leaf and fruit (Olea europaea L.) extracts and their structure-activity relationships[J].Journal of Functional Foods, 2015, 16:460-471.
[32] DELMULLE T, MAESENEIRE S L, DE MEY M.Challenges in the microbial production of flavonoids[J].Phytochemistry Reviews, 2018, 17(2):229-247.
[33] SUN X X, LI X L, SHEN X L, et al.Recent advances in microbial production of phenolic compounds[J].Chinese Journal of Chemical Engineering, 2021, 30:54-61.
[34] WANG J H, CAO F L, SU E Z, et al.Improving flavonoid extraction from Ginkgo biloba leaves by prefermentation processing[J].Journal of Agricultural and Food Chemistry, 2013, 61(24):5783-5791.
[35] YE H Y, LI X J, LI L Y, et al.Homologous expression and characterization of α-L-rhamnosidase from Aspergillus niger for the transformation of flavonoids[J].Applied Biochemistry and Biotechnology, 2022, 194(8):3453-3467.
[36] WEI Y, ZHAO W Q, ZHANG Q, et al.Purification and characterization of a novel and unique ginsenoside Rg1-hydrolyzing β-D-glucosidase from Penicillium sclerotiorum[J].Acta Biochimica et Biophysica Sinica, 2011, 43(3):226-231.