小麦是目前世界上种植最广泛的谷物之一,年产量超过6.5亿吨[1],是人类重要的热量来源[2]。麦麸是小麦碾磨后的外层部分[3],约占原小麦粒重的25%[4],是小麦制粉过程中重要的副产物。如果所有供人类食用的小麦都经过碾磨,每年可生产约1.5亿吨麦麸[1]。但目前,麦麸主要用于饲料、发酵等领域。麦麸的利用还不充分,其应用价值有待进一步挖掘。因此,开发麦麸的利用可以有效地减少浪费,产生经济价值,提高小麦产业的附加值。麦麸富含膳食纤维、蛋白质、淀粉、灰分、酚酸、类黄酮等成分[5],其中膳食纤维含量超过40%[6],所以麦麸膳食纤维的提取和利用是开发麦麸资源的重要方向之一。
膳食纤维是指不能在小肠内消化吸收,而常在大肠中完全或部分发酵的植物可食用部分及其提取物、合成类似物,包括多糖、低聚糖、木质素和抗性淀粉等[7]。膳食纤维按水溶性的不同可分为不溶性膳食纤维(insoluble dietary fiber,IDF)和可溶性膳食纤维(soluble dietary fiber,SDF)。IDF主要包括纤维素、木质素和抗性淀粉等,它们可以有效地增加粪便的体积,促进排便[8-9]。SDF包括半纤维素、果胶、琼脂、瓜尔胶等,具有促进益生菌增殖的作用[8-9]。膳食纤维在蔬菜、水果和谷物中广泛存在,但不同来源的膳食纤维含量和性质均存在区别[10],同一植物中不同品种之间膳食纤维含量和性质也存在差异[11]。膳食纤维的结构特征是其理化性质的基础,进而显著影响膳食纤维的功能特性。膳食纤维常呈片状或絮状,表面存在褶皱和孔洞的结构,有的表面伴有小颗粒,结构疏松、褶皱多、孔洞大、表面粗糙度低的膳食纤维的理化性质更为优异[12]。膳食纤维的理化性质主要包括水合特性、持油力、吸附能力等,是膳食纤维开发应用的重要依据。因此,对膳食纤维进行结构表征和理化性质测定可为其开发利用提供参考。
本课题选取河南省种植的、具有代表性的4个小麦品种,从麸皮膳食纤维的含量测定出发,研究不同小麦品种麸皮可溶性膳食纤维的微观结构和理化性质,积累基础数据,为小麦麸皮膳食纤维的深度开发利用提供有效参考。
1 材料与方法
1.1 材料与试剂
新麦26麸皮、新麦45麸皮、开麦1701麸皮,河南大学农学院;飞天小麦麸皮,河南飞天生物科技股份有限公司提供的某品种小麦麸皮,简称飞天,4种麸皮均在2022年获取,其基本组成如表1所示;2-(N-吗啉代)乙烷磺酸[2-(n-morpholine) ethane sulfonic acid,MES,>99.0%],上海源聚生物科技有限公司;三羟甲基氨基甲烷(tris base,TRIS,≥99.0%),国药集团化学试剂有限公司;三氟乙酸(色谱纯),上海安谱实验科技股份有限公司;膳食纤维含量测定试剂盒,爱尔兰Megazyme公司;NaOH(分析纯),福晨(天津)化学试剂有限公司;KBr(光谱纯),天津市科密欧化学试剂有限公司;丙酮、盐酸,均为分析纯,广东广试试剂科技有限公司;淀粉酶(480 U/g)、糖化酶(300 U/g)、蛋白酶(500 U/g),诺维信Novozymes公司。
表1 小麦麸皮的基本组成
Table 1 The basic composition of wheat brans
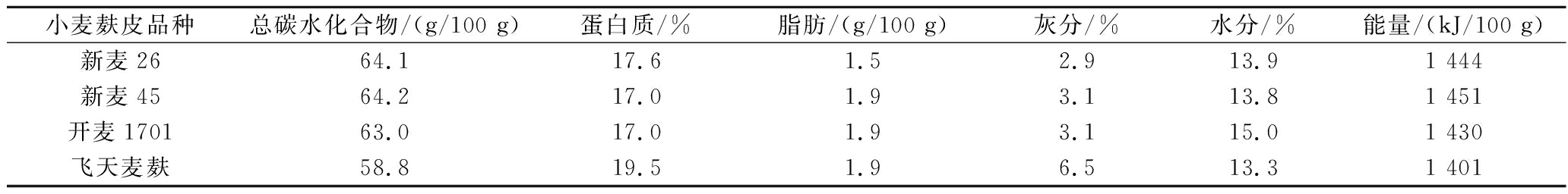
小麦麸皮品种总碳水化合物/(g/100 g)蛋白质/%脂肪/(g/100 g)灰分/%水分/%能量/(kJ/100 g)新麦2664.117.61.52.913.91 444新麦4564.217.01.93.113.81 451开麦170163.017.01.93.115.01 430飞天麦麸58.819.51.96.513.31 401
1.2 仪器与设备
BSA124S-CW型分析天平,德国Sartotius公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限公司;SHA-B型恒温振荡水浴箱,常州澳华仪器有限公司;SH420F型石墨消解仪、K9840型凯氏定氮仪,山东海能科学仪器有限公司;FO410C型高温干燥箱,日本Yamato Scientific公司;XSP-2CA型生物光学显微镜,上海佑科仪器仪表有限公司;EVO18型扫描电子显微镜,德国Zeiss公司;Xpert3 X型射线衍射仪,荷兰Panalytical公司;TENSOR27型傅里叶红外光谱仪,德国Bruker公司;LGJ-10型冷冻干燥机,北京松源华兴科技发展有限公司;TDL-5-A型自动脱盖离心机,上海安亭科学仪器厂;Reacti-thermo型氮气吹扫仪、Thermo ICS 5000+离子色谱系统,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 膳食纤维含量测定
采用AOAC Official Method 991.43《Total, Soluble, and Insoluble Dietary Fiber in Foods: Enzymatic-Gravimetric Method, MES-TRIS Buffer》 的方法测定小麦麸皮IDF和SDF含量。
1.3.2 小麦麸皮SDF制备
参考文献[13]的方法稍作改动,主要步骤如下:
小麦麸皮→粉碎→45 ℃温水洗涤→3 000 r/min离心分离10 min→弃去上清液,加入与沉淀等质量的蒸馏水→加入淀粉酶酶液,酶液用量为上一步所得混合液质量的0.2%,调节pH值为4.0,50 ℃水浴振荡反应2 h→加入糖化酶酶液,糖化酶用量为上一步所得混合液质量的0.2%,调节pH值为4.0,50 ℃水浴振荡反应2 h→3 000 r/min离心分离10 min→弃去上清液,向沉淀加入与沉淀等质量的蒸馏水→加入蛋白酶酶液,酶液用量为上一步所得混合液质量的0.2%,调节pH值为7.0,50 ℃水浴振荡反应2 h→3 000 r/min离心分离10 min→保留上清液→0.1 MPa真空度、40 ℃下真空浓缩至溶液质量为原来的![]() 加入4倍体积60 ℃的体积分数为95%的乙醇,室温下沉淀1 h→3 000 r/min离心分离10 min→收集沉淀,真空冻干40 h→粉碎,过80目筛→SDF样品。
加入4倍体积60 ℃的体积分数为95%的乙醇,室温下沉淀1 h→3 000 r/min离心分离10 min→收集沉淀,真空冻干40 h→粉碎,过80目筛→SDF样品。
1.3.3 持油力(oil-holding capacity, OHC)测定
称取2 g SDF样品于离心管中,加入过量玉米胚芽油(20 mL)浸泡30 min,每10 min摇匀1 min,浸泡后3 000 r/min离心15 min,倒出上清液,OHC的计算如公式(1)所示[14]:
(1)
式中:mw,样品湿质量,g;md,样品干质量,g。
1.3.4 密度测定
称取10 g样品于25 mL的量筒中,在量筒5~8 cm处敲击10次,读取样品体积[15]。密度的计算如公式(2)所示:
(2)
式中:m,样品质量,g;V,样品体积,mL。
1.3.5 溶解性(water solubility, WS)测定
准确称取样品1 g于离心管中,加入蒸馏水10 mL,室温下放置1 h,3 000 r/min离心10 min,将上清液倒入烧杯中,干燥至恒重[16],WS的计算如公式(3)所示:
(3)
式中:mt,恒重后烧杯和残留物总质量,g;mb,烧杯质量,g;ms,样品质量,g。
1.3.6 光学显微镜观察
取少量小麦麸皮粉和SDF样品,使其分散在乙醇中,取2~3滴混合液于载玻片上,覆上盖玻片后观察小麦麸皮粉和SDF的形貌[13]。
1.3.7 扫描电镜观察
根据TANG等[17]的方法稍作改动,取少量样品粉末均匀分布在已贴在载物台的导电胶上,镀金,将载物台放入扫描电镜中,抽真空,在10 kV电子枪加速电压和800倍的放大倍数下观察并拍摄照片。
1.3.8 X-射线衍射分析
参考TANG等[17]的方法,采用X-射线衍射仪进行测定,衍射条件为:Cu靶,40 kV,40 mA,步长0.013°,扫描速度12 s/步。2θ扫描范围:4°~60°。
1.3.9 红外吸收光谱分析
取1 mg小麦麸皮SDF样品,加入100 mg KBr,在玛瑙研钵研磨后,压片,经红外光谱进行扫描,扫描波数范围为4 000~400 cm-1[18]。
1.3.10 单糖组成分析
分别称取适量标准品岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖和木糖,配成质量浓度为10 mg/mL的单标标准溶液母液后,取适量单标母液混合配成质量浓度为0.4、0.8、4、8、16、24、32和40 μg/mL的混标标准品,上样制定标准曲线。
称取3 mg SDF样品,加入1 mL 2 mol/L三氟乙酸溶液,121 ℃加热2 h后,通N2,吹干。加入99.99%甲醇清洗,再吹干,重复用甲醇清洗2~3次。之后加入1 mL无菌水溶解,转入色谱瓶中供离子色谱测定[19]。
色谱条件:Thermo ICS 5000+离子色谱系统;电化学检测器;DionexTM CarboPacTM PA20(长度150 mm,直径3.0 mm,粒径10 μm)液相色谱柱;进样量为5 μL。流动相A(ddH2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温30 ℃;洗脱梯度:0 min V(A相)∶V(B相)∶V(C相)=95∶5∶0,26 min V(A相)∶V(B相)∶V(C相)=85∶5∶10,42 min V(A相)∶V(B相)/V(C相)=85∶5∶10,42.1 min V(A相)∶V(B相)∶V(C相)=为60∶0∶40,52 min V(A相)∶V(B相)∶V(C相)=60∶40∶0,52.1 min V(A相)∶V(B相)∶V(C相)=95∶5∶0,60 min V(A相)∶V(B相)∶V(C相)=95∶5∶0。
1.3.11 数据处理与统计分析
所有实验至少重复3次,数据以平均值±标准差表示。采用SPSS统计软件统计分析。使用origin软件作图。
2 结果与分析
2.1 小麦麸皮膳食纤维含量
通常大部分谷物的外皮部分膳食纤维含量较高,而胚乳部分含量较低[10],因此小麦麸皮可以成为获取膳食纤维的来源之一。如表2所示,新麦45麸皮的IDF(22.75 g/100 g)较低,而飞天麦麸的IDF(50.48 g/100 g)和SDF(8.01 g/100 g)含量均显著高于其他3个品种。SDF含量最低的麦麸是开麦1701,但除飞天麦麸外,其他品种小麦麸皮的SDF含量差异不显著,约为4~5 g/100 g,均高于大麦谷粒、水稻谷粒等其他谷物来源[10]。4种麦麸IDF含量则差异显著(P<0.05)。由此可见,不同来源小麦麸皮的膳食纤维含量有所区别,但均具有作为稳定膳食纤维来源的潜力。
表2 小麦麸皮膳食纤维含量(干基)
Table 2 Dietary fiber content of wheat brans (dry basis)

小麦麸皮品种IDF/(g/100 g)SDF/(g/100 g)新麦2624.69±0.64c4.98±0.10b新麦4522.75±0.66d5.02±0.09b开麦170125.81±0.69b4.77±0.13b飞天麸皮50.48±0.19a8.01±0.24a
注:同一列数据上标不同字母表示差异显著(P<0.05)(表3同)。
2.2 小麦麸皮SDF理化性质
持油力是膳食纤维重要的理化性质,有助于减少食品加工中的脂肪损失和降低血清胆固醇水平[20]。纤维的表面性质、电荷密度和疏水性可影响持油力[21]。如表3所示,飞天麸皮的SDF持油力(2.33 g/g)最高,新麦26(2.14 g/g)次之,新麦45(1.83 g/g)和开麦1701(1.98 g/g)SDF的持油力稍弱。这与燕麦谷粒和甘薯渣SDF的持油力接近[22-23]。密度在一定程度上反映了膳食纤维颗粒的疏松程度和表面积,体积密度最大的SDF来自新麦45(0.582 1 g/mL),而开麦1701(0.503 5 g/mL)和新麦26 SDF(0.484 4 g/mL)的体积密度较低。由此可见,疏松的结构可能有助于持油力的提高,同时YOSHIDA等[24]的研究也呈现出类似的结果。膳食纤维溶解性是重要的加工性能之一[25],与肠道菌群组成有关[26]。4种麦麸SDF的常温溶解度无显著差异(P>0.05),均超过85%,展现出良好的溶解能力,具有较佳的加工应用性质。
表3 小麦麸皮SDF理化性质
Table 3 Physicochemical properties of wheat bran SDFs
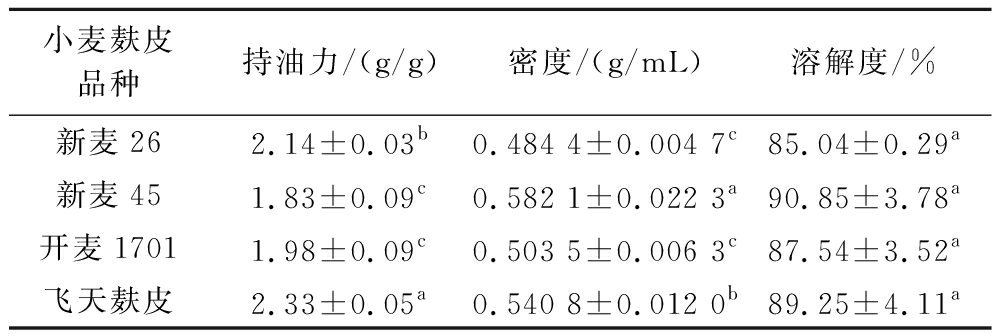
小麦麸皮品种持油力/(g/g)密度/(g/mL)溶解度/%新麦26 2.14±0.03b0.484 4±0.004 7c85.04±0.29a新麦45 1.83±0.09c0.582 1±0.022 3a90.85±3.78a开麦1701 1.98±0.09c0.503 5±0.006 3c87.54±3.52a飞天麸皮 2.33±0.05a0.540 8±0.012 0b89.25±4.11a
2.3 小麦麸皮SDF形貌观察
图1为4种小麦麸皮粉和SDF的光学显微镜和扫描电镜观察图。左图为光学显微镜观察,放大倍数为400倍;右图为扫描电镜观察,放大倍数是800倍。观察发现,麦麸粉主要为层叠的片状或块状,且表面相对光滑。大部分品种外部均伴随有卵形淀粉。小麦麸皮SDF则主要呈无规则块状,有密集的絮状层叠,表面比麸皮粉更为光滑。其中开麦1701、新麦26和飞天麦麸麸皮SDF表面及断面有一定孔洞和空腔结构,这样的结构增大了比表面积。结合2.2节的理化性质,这可能导致了它们更小的体积密度和更好的持油力。由此可见,不同来源的小麦麸皮SDF呈现的微观结构稍有不同,将其结构区别与理化性质差异进行对比,总体上呈现出一定的一致性。

图1 4种小麦麸皮麦麸粉和SDF的显微结构
Fig.1 Microstructure of four wheat brans and SDFs
2.4 小麦麸皮SDF结晶结构分析
X-射线衍射是分析样品结晶情况的重要手段[27]。由图2可知,4种小麦麸皮SDF的X-射线衍射图谱相似,均在15°~25°有广而宽的衍射峰,可能来自无定形部分[20, 28],如半纤维素等[29]。其未出现明显I型纤维素的特征结晶峰,且衍射峰较宽较规则,这与贡水白柚皮SDF[30]和多种方法预处理的柠檬皮SDF[31]的XRD检测情况类似。推测SDF结晶度较低,主要由非结晶结构组成,且这一研究结果与不同来源和多种处理方法SDF情况相似,说明结论有一定可靠性,不仅限于特定条件或来源的样品。
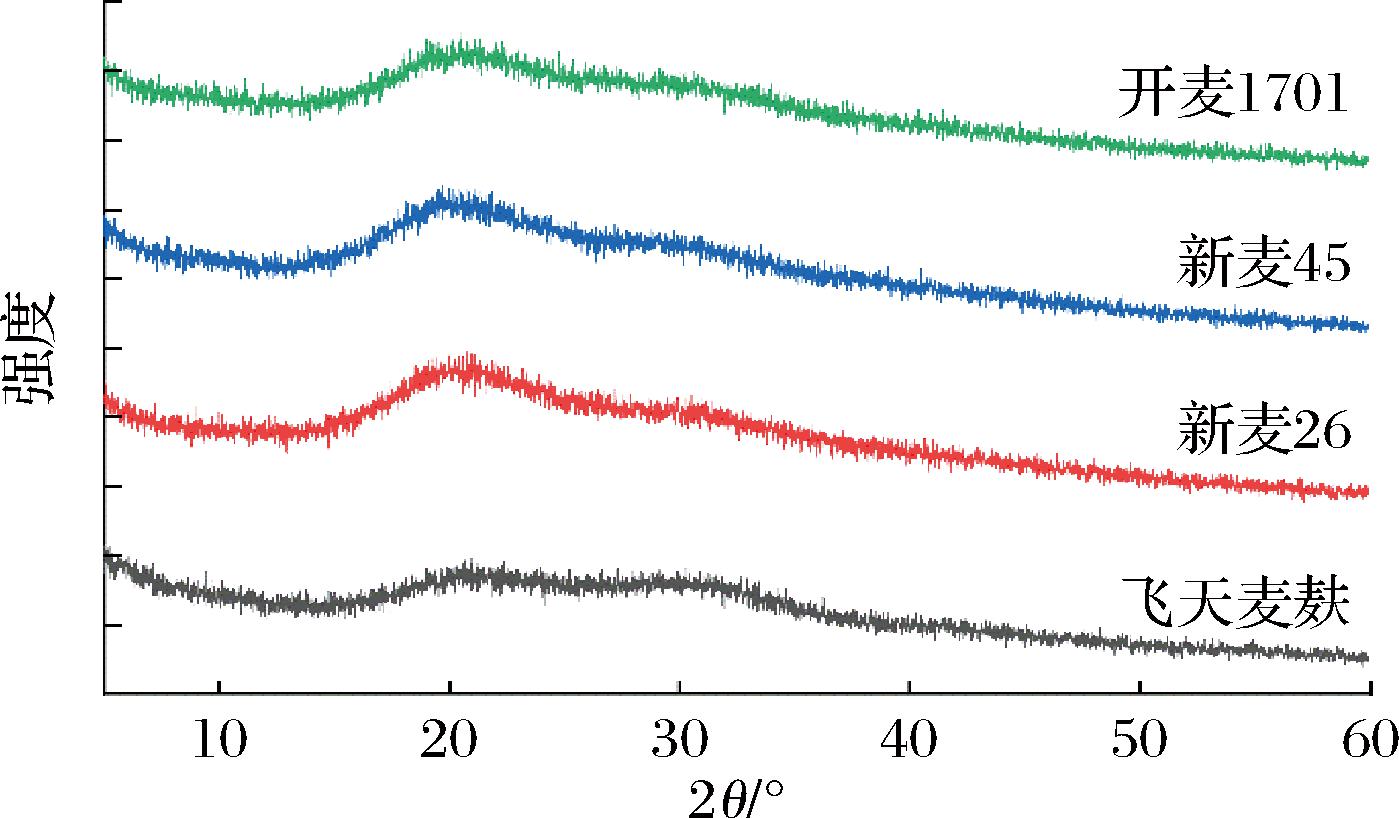
图2 小麦麸皮SDF的X-射线衍射图
Fig.2 X-ray diffraction patterns of wheat bran SDFs
2.5 小麦麸皮SDF红外吸收性质
傅里叶变换红外光谱是鉴定有机化合物结构的经典方法,可根据光谱情况识别化合物官能团和化学键[32]。如图3所示,4种麦麸SDF的红外光谱分布比较相似。JIA等[28]研究表明,SDF红外光谱图中3 423 cm-1附近的强峰是O—H伸缩振动形成的吸收峰。HUA等[33]研究表明,1 404 cm-1附近的吸收峰与C—H的变形振动有关。根据文献[18, 20],1 645 cm-1附近的峰可能由不对称的C![]() O伸缩振动引起,说明其可能存在糖醛酸相关结构。CHEN等[34]研究表明,1 080 cm-1和1 045 cm-1附近的吸收峰源自C—O伸缩振动,可能由伯醇结构或糖环中的C—O—H和C—O—C结构产生。上述官能团的存在表明,SDF具有多糖化合物的典型结构[35],与不同方法提取的竹笋SDF[36]等的官能团相似。
O伸缩振动引起,说明其可能存在糖醛酸相关结构。CHEN等[34]研究表明,1 080 cm-1和1 045 cm-1附近的吸收峰源自C—O伸缩振动,可能由伯醇结构或糖环中的C—O—H和C—O—C结构产生。上述官能团的存在表明,SDF具有多糖化合物的典型结构[35],与不同方法提取的竹笋SDF[36]等的官能团相似。
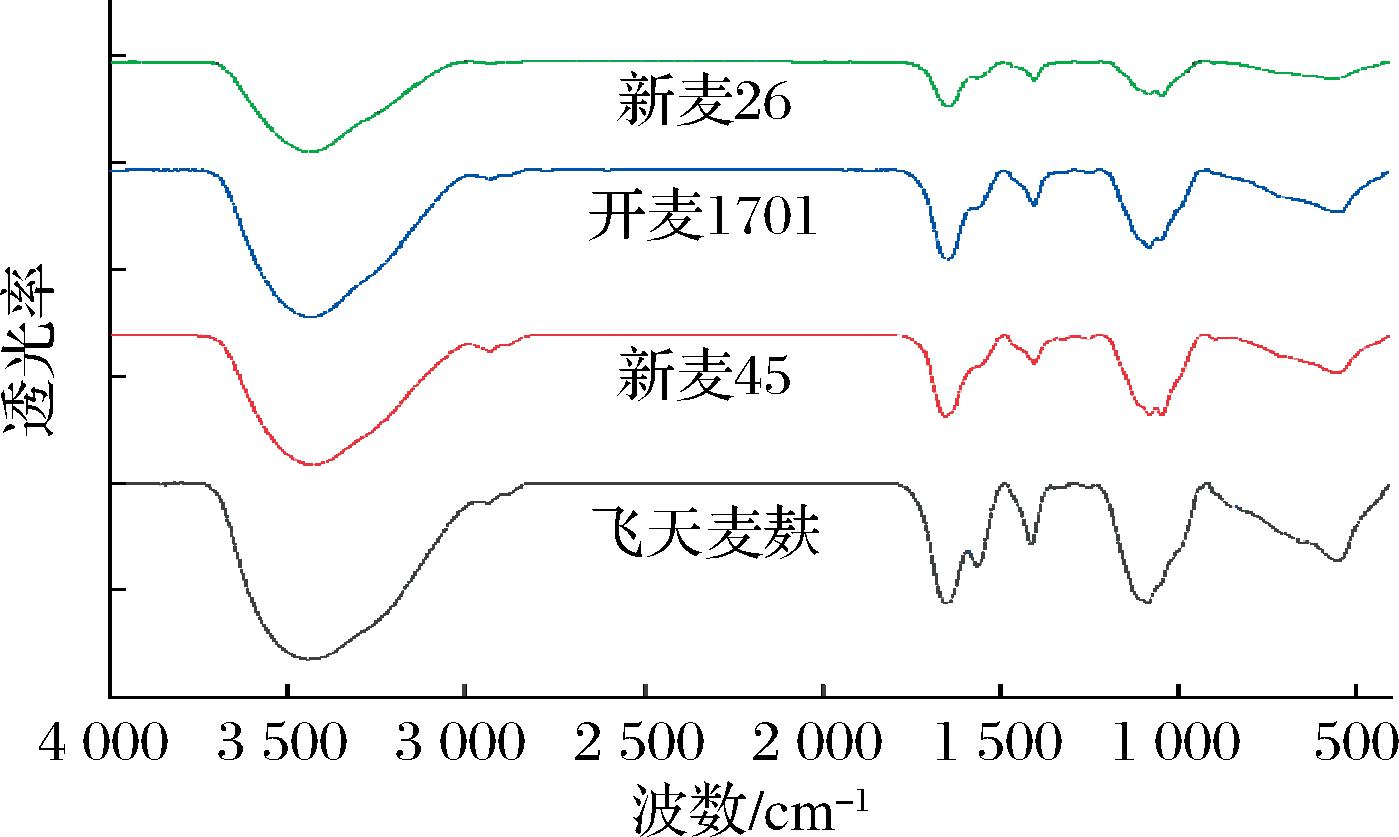
图3 小麦麸皮SDF的红外光谱图
Fig.3 Infrared spectra of wheat bran SDFs
2.6 小麦麸皮SDF单糖组成
由2.5节的研究可知,麦麸SDF具备多糖类化合物的结构,而多糖类化合物主要由单糖组成,因此麦麸SDF的结构和活性功能可能也会受单糖组成的影响。从图4的离子色谱图可知,单糖的出峰顺序依次为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖和木糖。表4为4种麦麸SDF的单糖组成摩尔比,可以看出不同品种的小麦麸皮SDF单糖组成的种类和含量存在少许差异。其中在4种小麦麸皮SDF中均检出阿拉伯糖、半乳糖、葡萄糖和木糖,且除飞天麦麸的阿拉伯糖含量(22.01%)稍高于葡萄糖(20.86%)外,其他3种小麦麸皮SDF单糖组成排序均为木糖>葡萄糖>阿拉伯糖>半乳糖。考虑到半纤维素的主要组成包括木糖、阿拉伯糖、葡萄糖、半乳糖等,因此可推测4种小麦麸皮SDF中均含有半纤维素类成分。注意到新麦45(0.29%)和开麦1701(0.35%)麸皮的SDF中均检测出鼠李糖,其中开麦1701还含有极少量岩藻糖,这可能与果胶类成分相关。与其他品种小麦麸皮SDF相比,本研究选取的4个品种SDF的木糖含量较高,葡萄糖含量较低,不同品种麦麸SDF的单糖组成有所区别,表明其中半纤维素、果胶等成分含量不同,进而可能影响其活性功能。
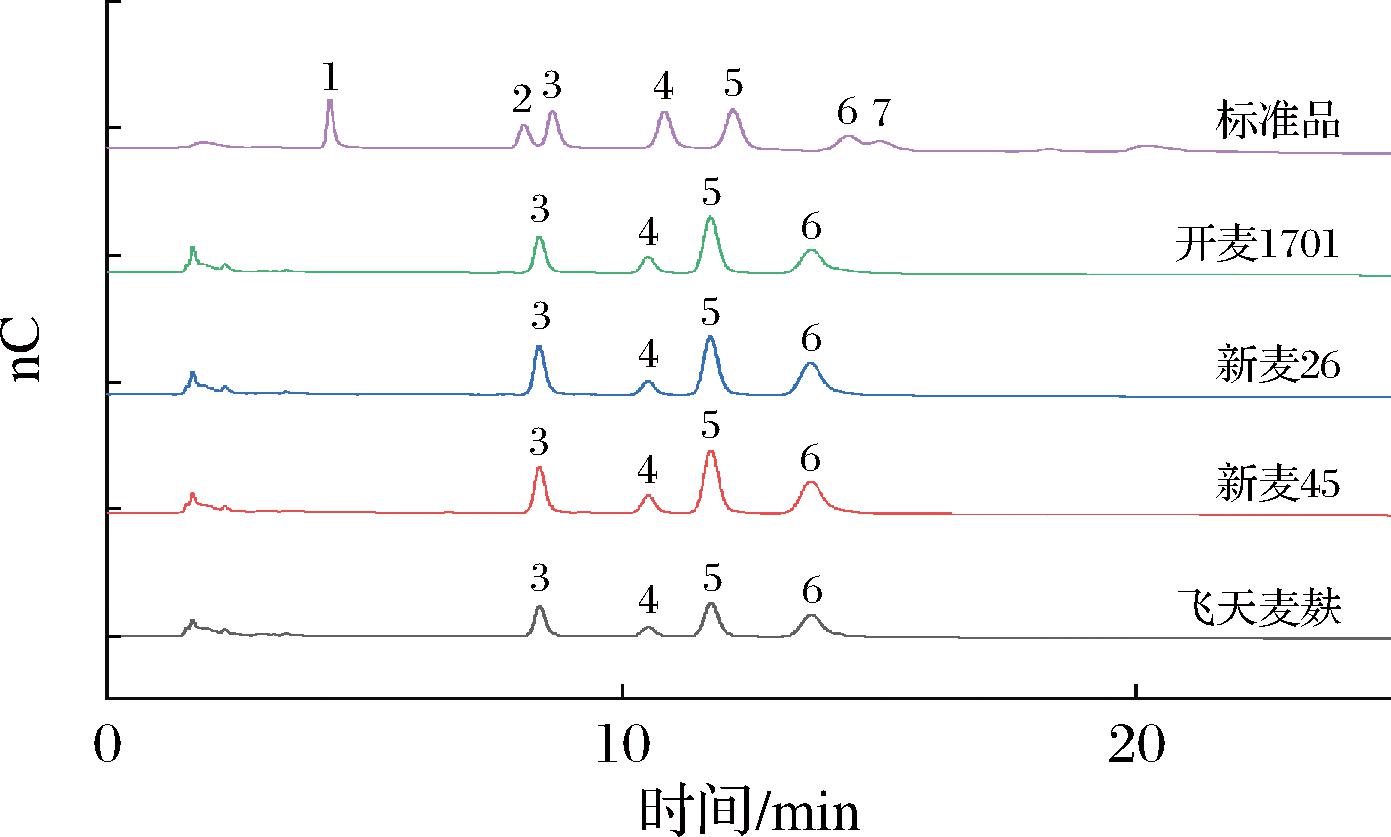
1-岩藻糖;2-鼠李糖;3-阿拉伯糖;4-半乳糖;5-葡萄糖;6-木糖;7-甘露糖
图4 小麦麸皮SDF单糖组成离子色谱图
Fig.4 Ion chromatogram of SDF monosaccharide composition
表4 小麦麸皮SDF单糖组成摩尔比 单位:%
Table 4 The molar ratio of wheat bran SDF monosaccharides
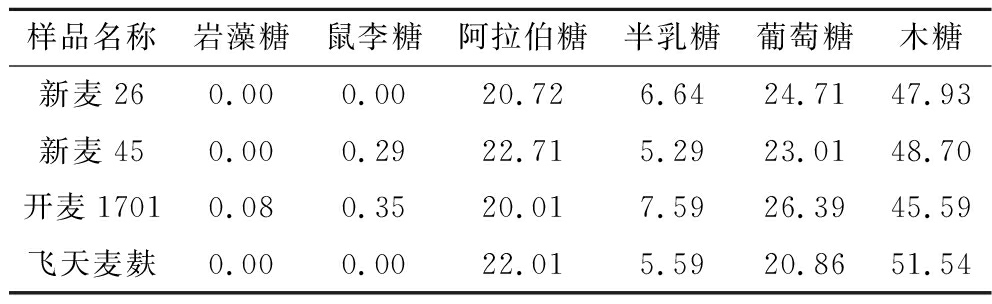
样品名称岩藻糖鼠李糖阿拉伯糖半乳糖葡萄糖木糖新麦260.000.0020.726.6424.7147.93新麦450.000.2922.715.2923.0148.70开麦17010.080.3520.017.5926.3945.59飞天麦麸0.000.0022.015.5920.8651.54
3 讨论
4种小麦麸皮SDF的异同点如表5所示。新麦26持油力较强,结构疏松,溶解度良好,可进一步发掘其在吸附方面的作用,如在降血脂等生理活性方面。新麦45具有较高的阿拉伯糖含量,开麦1701含有较多的半乳糖,且两者均有极少量鼠李糖,说明其含有一定的果胶及半纤维素成分,可作为益生元来源,调节肠道微生物[37]。飞天麦麸SDF含量和持油力相对较好,考虑到肉制品脂肪含量较高,且常需结合高温烹调后食用,因此飞天麦麸SDF可以应用于肉制品,减少脂肪和脂溶性维生素流失[38]。考虑到4种小麦麸皮SDF的溶解性良好,亦可将它们应用于饮料中,以提高饮料的生理功能。
表5 四种麦麸SDF异同点
Table 5 Similarities and differences of SDFs of wheat bran

指标新麦26新麦45开麦1701飞天麦麸SDF含量中中中高持油力较高中中高密度低高低中溶解度溶解度良好,4个品种无显著性差异微观结构表面及断面存在孔洞和空腔结构无规则层叠块状,相对致密表面及断面存在孔洞和空腔结构表面及断面存在孔洞和空腔结构结晶情况主要由非晶体结构组成官能团包括O—H、C—H、CO和C—O等单糖组成木糖、阿拉伯糖含量偏低含有极少量鼠李糖,半乳糖含量最低,阿拉伯糖含量最高含有极少量鼠李糖,半乳糖含量最高,木糖、阿拉伯糖含量低木糖含量最高,葡萄糖含量最低
4 结论
4种麦麸SDF溶解性均大于85%,且相互无显著差异。飞天麦麸具有较高的SDF含量(8.01 g/100 g)和持油力(2.33 g/g)。光学显微镜和扫描电镜观察发现,开麦1701、新麦26和飞天麦麸麸皮SDF表面及横截面有明显孔洞和空腔结构。4种麦麸SDF都主要由非结晶结构组成,其中呈现多糖类化合物的典型红外吸收峰。它们的单糖组成主要由木糖、葡萄糖、阿拉伯糖和半乳糖组成,其中新麦45和开麦1701含有极少量鼠李糖。
[1] PRÜCKLER M, SIEBENHANDL-EHN S, APPRICH S, et al.Wheat bran-based biorefinery 1:Composition of wheat bran and strategies of functionalization[J].LWT, 2014, 56(2):211-221.
[2] ZHANG Y F, LOU H Y, GUO D D, et al.Identifying changes in the wheat kernel proteome under heat stress using iTRAQ[J].The Crop Journal, 2018, 6(6):600-610.
[3] PIETI INEN S, MOLDIN A, STRÖM A, et al.Effect of physicochemical properties, pre-processing, and extraction on the functionality of wheat bran Arabinoxylans in breadmaking:A review[J].Food Chemistry, 2022, 383:132584.
INEN S, MOLDIN A, STRÖM A, et al.Effect of physicochemical properties, pre-processing, and extraction on the functionality of wheat bran Arabinoxylans in breadmaking:A review[J].Food Chemistry, 2022, 383:132584.
[4] DAS NEVES M A, KIMURA T, SHIMIZU N, et al.Production of alcohol by simultaneous saccharification and fermentation of low-grade wheat flour[J].Brazilian Archives of Biology and Technology, 2006, 49(3):481-490.
[5] APPRICH S, TIRPANALAN Ö, HELL J, et al.Wheat bran-based biorefinery 2:Valorization of products[J].LWT - Food Science and Technology, 2014, 56(2):222-231.
[6] 蔺艳君, 刘丽娅, 钟葵, 等.不同来源小麦麸皮营养成分及酚类物质含量的比较[J].现代食品科技, 2014, 30(12):194-200.LIN Y J, LIU L Y, ZHONG K, et al.Comparison of nutritional and phenolic content of wheat bran obtained from different sources[J].Modern Food Science and Technology, 2014, 30(12):194-200.
[7] JONES J M.CODEX-aligned dietary fiber definitions help to bridge the ‘fiber gap’[J].Nutrition Journal, 2014, 13:34.
[8] WILLIAMS B A, MIKKELSEN D, FLANAGAN B M, et al.“Dietary fibre”:Moving beyond the “soluble/insoluble” classification for monogastric nutrition, with an emphasis on humans and pigs[J].Journal of Animal Science and Biotechnology, 2019, 10:45.
[9] BACH KNUDSEN K E.The nutritional significance of “dietary fibre” analysis[J].Animal Feed Science and Technology, 2001, 90(1-2):3-20.
[10] KAUR H, SINGH B, SINGH A.Comparison of dietary fibers obtained from seven Indian cereal grains[J].Journal of Cereal Science, 2021, 102:103331.
[11] DA MOTA R V, LAJOLO F M, CORDENUNSI B R, et al.Composition and functional properties of banana flour from different varieties[J].Starch - Stärke, 2000, 52(2-3):63-68.
[12] YU G Y, BEI J, ZHAO J, et al.Modification of carrot (Daucus carota Linn.var.Sativa Hoffm.) pomace insoluble dietary fiber with complex enzyme method, ultrafine comminution, and high hydrostatic pressure[J].Food Chemistry, 2018, 257:333-340.
[13] 王娟, 汪雨亭, 杨公明.香蕉不溶性膳食纤维的理化特性与通便功能研究[J].食品工业科技, 2017, 38(2):337-341.WANG J, WANG Y T, YANG G M.Research on the physicochemical characteristics and laxative effects of insoluble dietary fiber from bananas[J].Science and Technology of Food Industry, 2017, 38(2):337-341.
[14] SINGH A, SHARMA S, SINGH B.Effect of germination time and temperature on the functionality and protein solubility of Sorghum flour[J].Journal of Cereal Science, 2017, 76:131-139.
[15] L PEZ-MARCOS M C, BAILINA C, VIUDA-MARTOS M, et al.Properties of dietary fibers from agroindustrial coproducts as source for fiber-enriched foods[J].Food and Bioprocess Technology, 2015, 8(12):2400-2408.
PEZ-MARCOS M C, BAILINA C, VIUDA-MARTOS M, et al.Properties of dietary fibers from agroindustrial coproducts as source for fiber-enriched foods[J].Food and Bioprocess Technology, 2015, 8(12):2400-2408.
[16] WANG W, XING X, LIU L, et al.Effects of different drying methods on the functional and structural properties of dietary fiber from peanut shell[J].Agricultural Biotechnology, 2020, 9(3):128-132.
[17] TANG C D, YANG J L, ZHANG F S, et al.Insight into the physicochemical, structural, and in vitro hypoglycemic properties of bamboo shoot dietary fibre:Comparison of physical modification methods[J].International Journal of Food Science &Technology, 2022, 57(8):4998-5010.
[18] HUANG H R, CHEN J J, CHEN Y, et al.Modification of tea residue dietary fiber by high-temperature cooking assisted enzymatic method:Structural, physicochemical and functional properties[J].LWT, 2021, 145:111314.
[19] ZHU M Q, HUANG R M, WEN P, et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano (Cucumis metuliferus) peels[J].Carbohydrate Polymers, 2021, 254:117371.
[20] JIANG Y L, YIN H, ZHENG Y R, et al.Structure, physicochemical and bioactive properties of dietary fibers from Akebia trifoliata (Thunb.) Koidz.seeds using ultrasonication/shear emulsifying/microwave-assisted enzymatic extraction[J].Food Research International, 2020, 136:109348.
[21] FEMENIA A, LEFEBVRE A C, THEBAUDIN J Y, et al.Physical and sensory properties of model foods supplemented with cauliflower fiber[J].Journal of Food Science, 1997, 62(4):635-639.
[22] LIU M, ZHOU S H, LI Y X, et al.Structure, physicochemical properties and effects on nutrients digestion of modified soluble dietary fiber extracted from sweet potato residue[J].Food Research International, 2021, 150:110761.
[23] DONG J L, YANG M, SHEN R L, et al.Effects of thermal processing on the structural and functional properties of soluble dietary fiber from whole grain oats[J].Food Science and Technology International, 2019, 25(4):282-294.
[24] YOSHIDA B Y, PRUDENCIO S H.Alkaline hydrogen peroxide improves physical, chemical, and techno-functional properties of okara[J].Food Chemistry, 2020, 323:126776.
[25] 麦馨允, 苏仕林, 曾维标.膳食纤维的加工性能以及在脂肪替代物方面的应用[J].粮食与饲料工业, 2019(5):17-21.MAI X Y, SU S L, ZENG W B.Processing properties of dietary fiber and its application in fat replacer[J].Cereal &Feed Industry, 2019(5):17-21.
[26] YANG F, CHIA N, SCHOOK L B, et al.Shifts in the fecal microbial community composition are associated with dietary fiber solubility[J].The FASEB Journal, 2013, 27(S1):1056.2.
[27] BHAT N V, DESHMUKH R R.X-ray crystallographic studies of polymeric materials[J].Indian Journal of Pure and Applied Physics, 2002, 40(5):361-366.
[28] JIA M Y, CHEN J J, LIU X Z, et al.Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J].Food Hydrocolloids, 2019, 94:468-474.
[29] ZHANG S S, XU X L, CAO X, et al.The structural characteristics of dietary fibers from Tremella fuciformis and their hypolipidemic effects in mice[J].Food Science and Human Wellness, 2023, 12(2):503-511.
[30] 张乔会, 胡百顺, 康宇, 等.贡水白柚皮可溶性与不可溶膳食纤维对比分析[J].粮食与油脂, 2022, 35(1):149-152;157.ZHANG Q H, HU B S, KANG Y, et al.Comparative analysis of soluble and insoluble dietary fiber in Gongshui white pomelo peel[J].Cereals &Oils, 2022, 35(1):149-152;157.
[31] ZHANG D L, JIANG B, LUO Y H, et al.Effects of ultrasonic and ozone pretreatment on the structural and functional properties of soluble dietary fiber from lemon peel[J].Journal of Food Process Engineering, 2022, 45(1):e13916.
[32] BUNACIU A A, ABOUL-ENEIN H Y, FLESCHIN S.Recent applications of Fourier transform infrared spectrophotometry in herbal medicine analysis[J].Applied Spectroscopy Reviews, 2011, 46(4):251-260.
[33] HUA M, SUN Y S, SHAO Z J, et al.Functional soluble dietary fiber from ginseng residue:Polysaccharide characterization, structure, antioxidant, and enzyme inhibitory activity[J].Journal of Food Biochemistry, 2020, 44(12):e13524.
[34] CHEN H H, ZHAO C M, LI J, et al.Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of Lotus root[J].LWT, 2018, 93:204-211.
[35] YAN X G, YE R, CHEN Y.Blasting extrusion processing:The increase of soluble dietary fiber content and extraction of soluble-fiber polysaccharides from wheat bran[J].Food Chemistry, 2015, 180:106-115.
[36] DONG Y F, LI Q, ZHAO Y H, et al.Effects of ultrasonic assisted high-temperature cooking method on the physicochemical structure characteristics and in vitro antioxidant capacities of dietary fiber from Dendrocalamus brandisii Munro shoots[J].Ultrasonics Sonochemistry, 2023, 97:106462.
[37] 董吉林, 王雷.膳食纤维对肠道微生物及机体健康影响的研究进展[J].粮食与饲料工业, 2019(1):36-40.DONG J L, WANG L.Research progress of the effect of dietary fiber on intestinal microorganism and host health[J].Cereal &Feed Industry, 2019(1):36-40.
[38] GAN J P, HUANG Z Y, YU Q, et al.Microwave assisted extraction with three modifications on structural and functional properties of soluble dietary fibers from grapefruit peel[J].Food Hydrocolloids, 2020, 101:105549.