陈皮(pericarpium citri reticulatae, PCR)是芸香科柑桔属植物橘(Citrus reticulata Blanco)及其栽培变种的干燥成熟果皮,药用价值高,具有理气健脾,燥湿化痰之功效,属于六陈中药之一,自古以来就有着“陈久者良”之说[1],在《神农本草经》、《本草经集注》和《食疗本草》中均有记载。陈皮中的化学成分主要包括黄酮类、生物碱类及挥发油类等,其中黄酮类物质被认为是陈皮中最重要的活性物质[2]。大量研究结果表明,陈化过程中贮藏条件及环境因子等因素与其活性成分、表面菌落组成及香气等密切相关[1,3-4]。因此,对于不同贮藏方式陈皮品质及香气的差异研究具有一定的研究意义与价值。
色泽属于陈皮一个重要的感官品质,它的变化能够直接影响其潜在应用价值及消费价值;类胡萝卜素是柑橘皮中主要的呈色物质,对于陈皮品质及色泽有一定影响,且具有强抗氧化性和抗炎能力,能降低癌症和心血管等疾病的风险[5];黄酮类成分是陈皮中最重要的特征性化学成分,在陈化过程中逐渐积累,直接影响着陈皮品质及药用功效[6];挥发性成分能够客观反映出不同陈皮的风味特点,是陈皮风味品质的重要指标之一,目前研究结果表明,陈皮风味物质主要以烯烃类、醇类、醛类为主[7]。
陈皮陈化过程中的影响因素主要为微生物、温湿度及水分含量,目前陈皮贮藏方式主要分为2种:自然陈化(natural aging, NA)和标准干仓陈化(standard dry storage, SD)。自然陈化方式多以麻布袋将陈皮包装后置于室内阴凉处,属于传统陈皮制作方式,具有温湿度不稳定,且每年需要在梅雨季节对其进行人工翻晒等缺点,极容易受到污染[8];标准干仓方式具有干燥洁净,温湿度稳定且通风透气的特点,但是其陈化速度相对较慢[9]。目前对于不同贮藏方式陈皮品质间差异的研究未见报道,因此,对于不同贮藏方式下陈皮品质的变化规律是否具有差异性的探究属于目前亟待解决的问题。
本实验以陈化0~9年的标准干仓陈皮和自然陈化陈皮为研究对象,对其色差、类胡萝卜素、总酚、总黄酮、抗氧化活性、黄酮类化合物及挥发性成分进行分析比较,旨在为2种陈皮的品质差异和贮藏条件鉴别提供参考依据。
1 材料与方法
1.1 材料与仪器
本研究所用陈皮均由江门市新会陈皮村市场股份有限公司提供,标准干仓陈皮的贮藏条件为全年温度控制在30 ℃,湿度≤70%,定期(1个月1次)通风换气,自然陈化陈皮的贮藏条件为传统的阴凉通风处自然存放。
无水乙醇(分析纯)、无水甲醇(分析纯)、色谱级甲醇、正己烷(分析纯),天津大茂化学试剂公司;NaOH、DPPH、ABTS,上海麦克林生化科技有限公司;Trolox(维生素E衍生物),天津科密欧化学试剂有限公司;Na2CO3、K2S2O8、NaNO2、Al(NO3)3,天津福晨化学试剂厂;没食子酸、芦丁、橙皮苷、香蜂草苷、川陈皮素、橘皮素、抗坏血酸等标准品、Folin-Ciocalteu试剂,上海源叶生物科技有限公司;28种烷烃混标(C5~C32),上海安谱璀氏标准技术服务有限公司。
Ultra Scan VIS全自动色差仪,美国Hunter Lab公司;RHP-100高速多功能粉碎机,浙江永康市荣浩工贸有限公司;ME204电子分析天平、DL-800B超声波清洗器,上海之信仪器有限公司;JW-1042型离心机,安徽嘉文仪器装备有限公司;LC-20AT高效液相色谱、UV-1800紫外可见分光光度计,日本岛津公司;DF-101S集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;GC-MS 7890-5977B-ODP气相色谱-质谱联用仪,美国Agilent公司。
1.2 实验方法
1.2.1 色差测定
采用全自动色差仪对陈皮进行色差测量分析,分别用L*、a*、b*、ΔE值表示,其中L*值为亮度值,a*值为红绿值,b*值为黄蓝值,ΔE值为总色差值。每个样品重复测量10次,结果取平均值。
1.2.2 类胡萝卜素含量的测定
参考徐明月[10]的方法进行测定:将适量陈皮剪碎,用打粉机轻微打成粉末状,过100目筛,备用。准确称取1.00 g陈皮粉末,用15.00 mL正己烷超声提取10 min,过滤,重复提取至粉末无色,合并滤液,定容至50.00 mL,以正己烷为空白对照,于450 nm处测定吸光值。类胡萝卜素的含量通过β-胡萝卜素的消光系数E1%计算,计算公式(1)如下:
(1)
式中:M类胡萝卜素,总类胡萝卜素含量,μg/g;V,提取液总体积;E1%,β-胡萝卜素在正己烷中的消光系数,为2 505;m,样品质量,g。
1.2.3 总酚含量测定
酚类物质提取:参考FU等[11]的方法并做适当修改:准确称量1.00 g陈皮粉末,加入5.00 mL无水甲醇,以功率400 W、35 ℃超声波提取20 min,后于5 000 r/min条件下离心5 min,取上清液,重复提取3次,合并上清液并用无水甲醇定容至15.00 mL,得到酚类物质样液。
取适当稀释过后的样液1.00 mL,加入2.00 mL体积分数50%的Folin-Ciocalteu溶液混合均匀,再加入2.00 mL体积分数10%的Na2CO3溶液,混匀静置避光反应1 h,以无水甲醇为空白对照,于765 nm处测定吸光度;以没食子酸为标准品绘制标准曲线:y=17.193x+0.049,R2=0.999 4。结果以没食子酸毫克当量mg GAE/g表示。
1.2.4 总黄酮含量测定
参考LIU等[12]的测定方法并作适当修改。分别取6.00 mL适当稀释后的样液,加入1.00 mL的体积分数5%亚硝酸钠溶液,混合均匀后反应6 min,然后添加1.00 mL体积分数10%硝酸铝溶液,继续静置反应6 min,最后加入4.00 mL体积分数4%的氢氧化钠溶液,反应15 min之后,以无水甲醇为空白对照于510 nm处测定吸光值,平行重复3次实验取平均值。以芦丁为标准品绘制标准曲线:y=3.526 6x+0.043 7,R2=0.999 7。结果以芦丁毫克当量mg RE/g表示。
1.2.5 抗氧化活性测定
DPPH法:将DPPH溶于体积分数80%甲醇中,至其最终浓度为100 μmol/L,避光保存备用。取0.40 mL的待测液与0.60 mL的DPPH溶液于试管中避光反应30 min,于517 nm下测定其吸光度;以Trolox为标准品,测定不同浓度Trolox对DPPH自由基的清除能力并绘制标准曲线(y=0.014 4x+0.014 8,R2=0.996 7),结果以Trolox当量(mg TE/g)表示[13]。
ABTS法:取2.45 mmol/L K2S2O8溶液与7 mmol/L ABTS溶液按体积比1∶1混合,记为ABTS储备液。将其置于避光条件下反应12 h后,用体积分数80%甲醇稀释至其在734 nm波长下的吸光度为0.70±0.02,得到ABTS工作液。取0.40 mL待测液,加入3.60 mL ABTS工作液,摇匀后在避光条件下反应30 min,于波长734 nm下测定其吸光度;以Trolox为标准品,通过测定其不同浓度与吸光值绘制标准曲线(y=0.018 8x+0.001 6,R2=0.998 6),结果以Trolox当量(mg TE/g)表示[14]。
1.2.6 主要黄酮类化合物含量测定
通过HPLC对陈皮中主要黄酮类化合物含量进行分析,包括橙皮苷、香蜂草苷、川陈皮素、橘皮素4种黄酮类化合物。总黄酮提取液用无水甲醇适当稀释后通过0.22 μm的有机相滤膜。色谱条件如下:C18色谱柱(4.6 mm×250 mm,5 μm),柱温为30 ℃;二极管阵列检测器(PDA),流动相:超纯水(A),甲醇(B);0~10 min,10% A,90% B;10~14 min,30% A,70% B;14~15 min,50% A,50% B;15~20 min,90% A,10% B;检测波长280 nm;流速1.0 mL/min;进样量10 μL[11]。
表1 4种黄酮类化合物的标准曲线
Table 1 The standard curves for four flavonoids

化合物标准曲线相关系数R2橙皮苷y=24 969x-164 7900.999 9香蜂草苷y=15 322x-140 7030.999 9川陈皮素y=36 276x-1 751 512.90.992 1橘皮素y=34 795x-1 179 367.850.996 5
1.2.7 挥发性成分测定
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合GC-MS检测陈皮的挥发性成分含量。参考WANG等[15]的方法并做适当修改。准确称取0.50 g陈皮粉末于顶空瓶中,加入5.00 mL的蒸馏水浸泡20 min,于65 ℃恒温水浴磁力搅拌转速150 r/min,在恒温加热磁力搅拌器中平衡10 min后,将活化好的萃取针插入顶空瓶中萃取吸附30 min,最后将吸附完成的萃取头拔出并插入到GC-MS进样器中,同时启动仪器采集数据,解吸5 min。
色谱条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 μm);载气:He,流速为1.0 mL/min。进样口温度250 ℃,手动进样且不分流;程序升温:柱初温40 ℃,以10 ℃/min的速率升温到70 ℃,然后以3 ℃/min的速率升温到190 ℃,最后以10 ℃/min的速率升温到220 ℃。
质谱条件:电离方式为电子轰击离子源;电离电压70 eV;传输线温度280 ℃;离子源温度230 ℃;电子倍增器电压1 353 V;四极杆温度150 ℃;质量扫描范围33~50 u。
定性:以C5~C32饱和烷烃作为标准,用相同的升温程序对正构烷烃进行定性分离与测定,并计算测试样品中各组分的保留指数(retention indices, RI),结合计算机NIST 14.0库进行相似度检索及参考文献和数据库中相关物质的保留指数进行共同定性,按照公式(2)进行计算。
RI=100N+100n(tRa-tRN)/(tR(N+n)-tRN)
(2)
式中:N,色谱图中位于目标物质左侧正构烷烃的碳原子数;n,位于目标物质两侧的正构烷烃碳原子数之差;tRa、tRN和tR(N+n),分别是色谱图中待测物质、待测物质左侧、待测物质右侧正构烷烃的保留时间。
定量:相对含量按照峰面积归一化法计算,求出各个挥发性成分的相对含量。
1.3 数据处理
所有实验处理均重复3次,结果以平均值±标准偏差表示;采用Origin 2022与SIMCA 13.0绘图;数据处理运用SPSS 26.0软件进行显著性分析。
2 结果与分析
2.1 不同贮藏方式陈皮色差比较
不同贮藏方式的10个陈化年份陈皮的色差值如图1所示,在2种贮藏条件下不同年份样品的L*、a*、b*和ΔE的数值在一定范围内存在变化,均表现为新皮(陈化0年)L*、a*、b*值最高而ΔE值最低,伴随着陈化年份的增长,整体上表现为L*、a*、b*值下降,ΔE值上升。在陈化0年到陈化9年期间,自然陈化贮藏条件下陈皮的L*、a*、b*值的下降趋势均显著高于标准干仓陈皮,L*值下降率分别为41.39%与37.59%,a*值下降率分别为81.25%和65.65%,b*值下降率分别为89.54%和65.67%,自然陈化陈皮的ΔE值增长率显著高于标准干仓陈皮,分别为12.09%和6.47%,表明在陈化过程中陈皮外观的明亮度逐年下降,逐渐变暗,色泽加深,橙黄色逐渐褪去,颜色由黄红逐渐向蓝绿进行转变,且自然陈化陈皮变化趋势显著高于标准干仓陈皮。吴翠[4]对陈化1~23年广陈皮色差进行测定,结果与本研究结果相同。除陈化5年的2种不同贮藏条件陈皮在L*、a*与ΔE值和陈化0年与2年陈皮在ΔE值上没有显著性差异(P>0.05)以外,其余陈化年份陈皮在色差上均表现出明显的差异性(P<0.05),这与陈皮采集当年气候及柑果成熟度有直接关系。
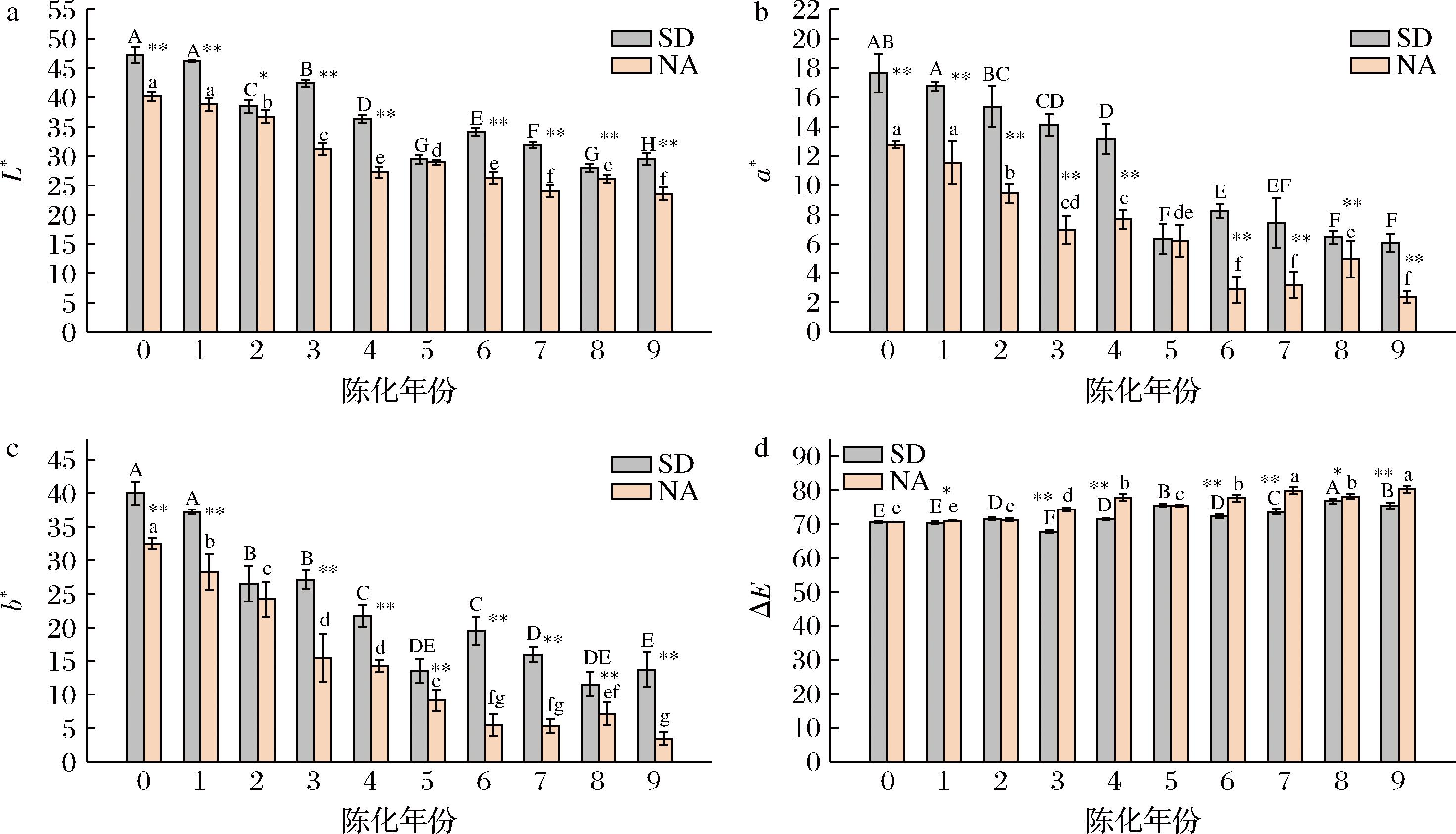
a-L*值;b-a*值;c-b*值;d-ΔE值
图1 不同贮藏方式陈皮色差值
Fig.1 Color difference of PCR in different storage methods
注:同一贮藏方式样品同一系列字母不同代表组间差异显著(P<0.05);“*”表示相同陈化年份不同贮藏方式间差异显著(P<0.05);“**”表示差异极显著(P <0.01)(下同)。
2.2 不同贮藏方式陈皮类胡萝卜素含量比较
类胡萝卜素是具有多个不饱和双键的萜类化合物,对热、光、氧敏感[16],是柑橘皮内主要的呈色物质,与陈化时间的延长呈现显著负相关关系。由图2可知,从新皮到陈化3年期间内,标准干仓与自然陈化2种贮藏方式下陈皮内类胡萝卜素含量显著下降,陈化3年后变化趋势趋于平缓,这说明在陈皮陈化前期,类胡萝卜素会被大量降解,而后含量相对稳定。王光宁[17]测定0~10年广陈皮中类胡萝卜素含量,发现陈化1年时时间内类胡萝卜素含量下降明显,第3年下降趋势缓慢,陈化10年类胡萝卜素含量最低,与本研究结果一致。标准干仓陈皮类胡萝卜素含量下降率显著低于自然陈化陈皮(降幅分别为51.89%和53.73%,P<0.05),实验结果表明,标准干仓贮藏条件对陈皮内类胡萝卜素的保留效果相对更好,这与色差值中b*值的变化相对应。
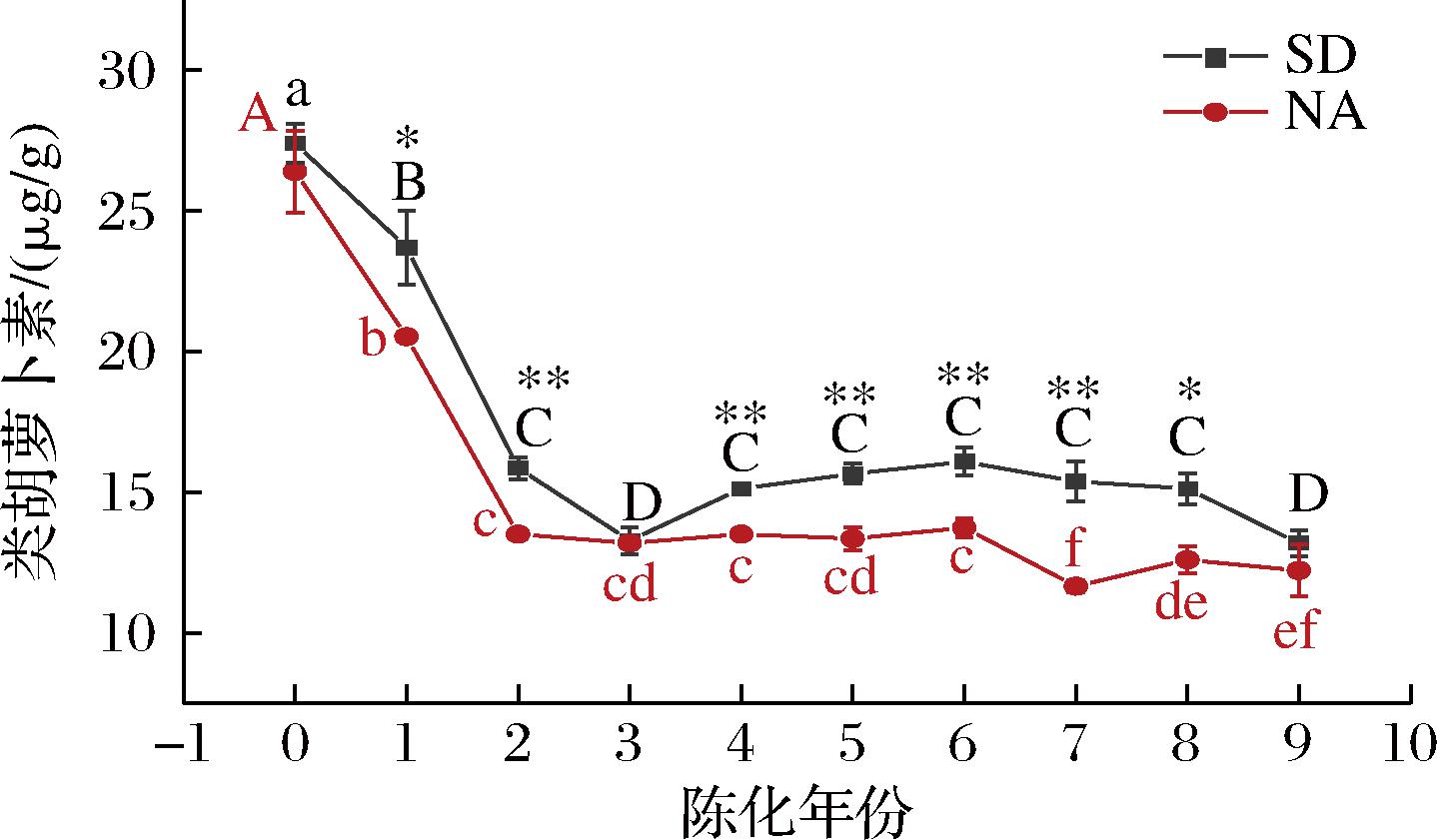
图2 不同贮藏方式陈皮类胡萝卜素含量
Fig.2 Carotenoid content of PCR in different storage methods
2.3 不同贮藏方式陈皮总酚和总黄酮含量比较
如图3所示,不同陈皮样品的总酚含量在陈化贮藏过程中整体上呈现上升趋势,其范围为12.80~16.15 mg GAE/g。陈化2年内标准干仓陈皮总酚含量高于自然陈化陈皮,此后自然陈化陈皮总酚含量高于标准干仓陈皮,陈化3年到6年期间内,总酚含量平缓上升,趋于稳定,该实验结果与王光宁[17]实验结果相似。由于陈化过程中水分含量及水分活度下降,导致多酚氧化酶活性降低,多酚成分减少了参与氧化反应[18],更有利于多酚物质的积累。总黄酮含量在贮藏0~9年期间内呈增加趋势,其范围在5.39~8.38 mg RE/g,2种贮藏条件下,陈化0~6年陈皮总黄酮含量无显著性差异(P>0.05),而在陈化7年后差异性显著(P<0.05),贮藏7、8年时,自然陈化陈皮总黄酮含量显著高于标准干仓陈皮,而在贮藏9年时,标准干仓陈皮黄酮含量显著高于自然陈化陈皮。LUO等[19]与WANG等[20]的实验同时证实了陈皮总酚、总黄酮含量伴随着陈化年份(分别为2~30年和0~13年)延长而积累,与本实验研究结果一致,而与FU等[11]研究发现贮藏36个月陈皮总黄酮含量发生下降的结果相反,认为造成这种差异可能是由于加工条件及陈化时间不一致。
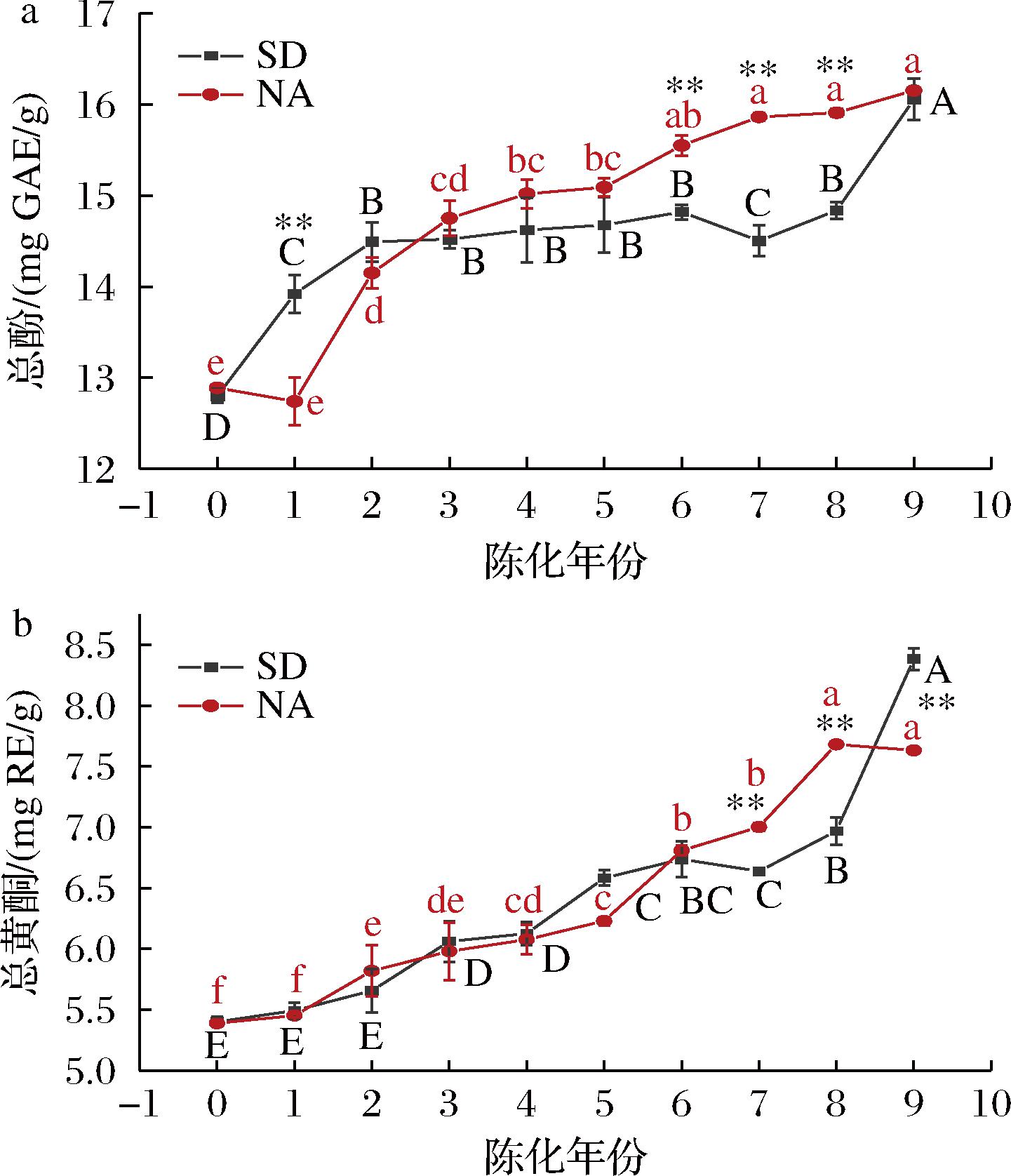
a-总酚;b-总黄酮
图3 不同贮藏方式陈皮总酚和总黄酮含量
Fig.3 Total polyphenols and total flavonoids contents of PCR in different storage methods
2.4 不同贮藏方式陈皮抗氧化活性比较
自由基和活性氧对生物体有害,并且与癌症、炎症、糖尿病和神经系统疾病等多种疾病相关[21]。陈皮作为天然抗氧化剂的丰富来源物质,其黄酮类化合物作为促进健康有益的天然活性物质已经得到广泛认可,这些化合物表现出强有效的抗氧化能力,对于预防和减轻各种疾病有着重要作用[1]。采用ABTS与DPPH 2种方法来评估不同样品的抗氧化活性,结果如图4所示,2种贮藏方式陈皮均表现为新皮抗氧化活性最低而陈化9年陈皮抗氧化活性最高,ABTS结果表明,2种陈皮在陈化初期(0~3年)抗氧化能力显著性增加(P<0.05),而在陈化3~7年期间内变化趋势不大,这与总酚含量结果相似。WANG等[20]报道在陈皮陈化贮藏期间其抗氧化活性伴随着总酚和总黄酮含量上升而增加,与本实验结果相同。同时LIU等[12]通过转接黑曲霉发酵陈皮发现,伴随着发酵时间延长,其抗氧化活性不断增强,且与总酚、总黄酮含量变化趋势相一致,说明在陈皮陈化过程中,微生物参与次级代谢物的形成,进而增强其抗氧化活性[3]。DPPH与ABTS法抗氧化能力结果相一致,均表现为标准干仓陈皮抗氧化能力高于自然陈化陈皮,但是由于其中所含多酚含量不同,造成它们的趋势不完全相同。说明标准干仓存储陈皮方式对于陈皮内抗氧化活性物质的积累作用优于自然陈化陈皮,推测是由于标准干仓温湿度稳定,有效降低陈皮出现霉变、回潮等情况,使其陈化过程中表面微生物的生长和生理生化特性稳定,更有利于活性物质的积累。
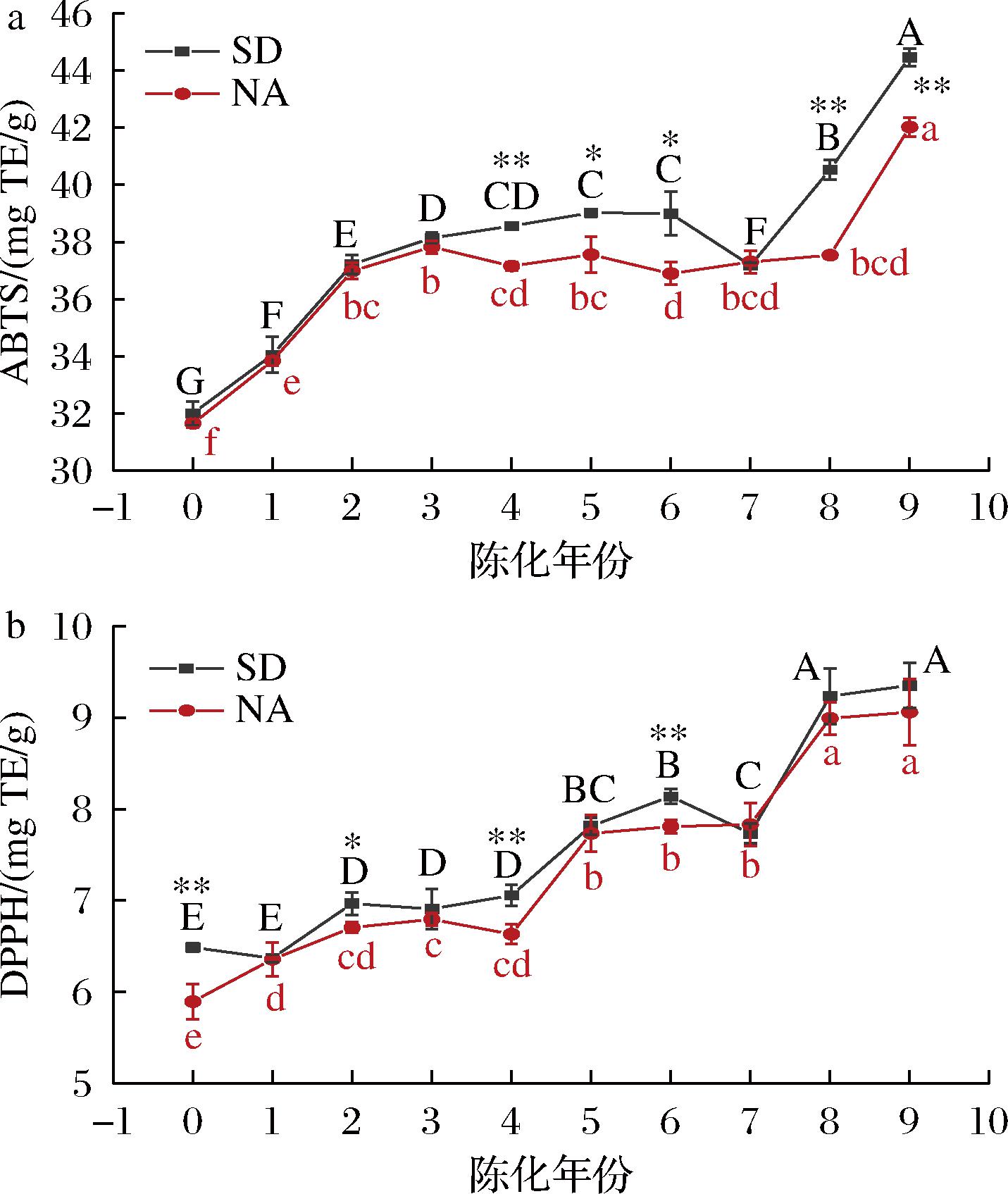
a-ABTS阳离子自由基清除能力;b-DPPH自由基清除能力
图4 不同贮藏方式陈皮的抗氧化能力
Fig.4 The antioxidant capacity of PCR in different storage methods
2.5 不同贮藏方式陈皮主要黄酮类化合物含量比较
通过HPLC法检测不同贮藏方式下10个年份陈皮中黄酮类化合物,得到的HPLC图谱如图5-a所示。
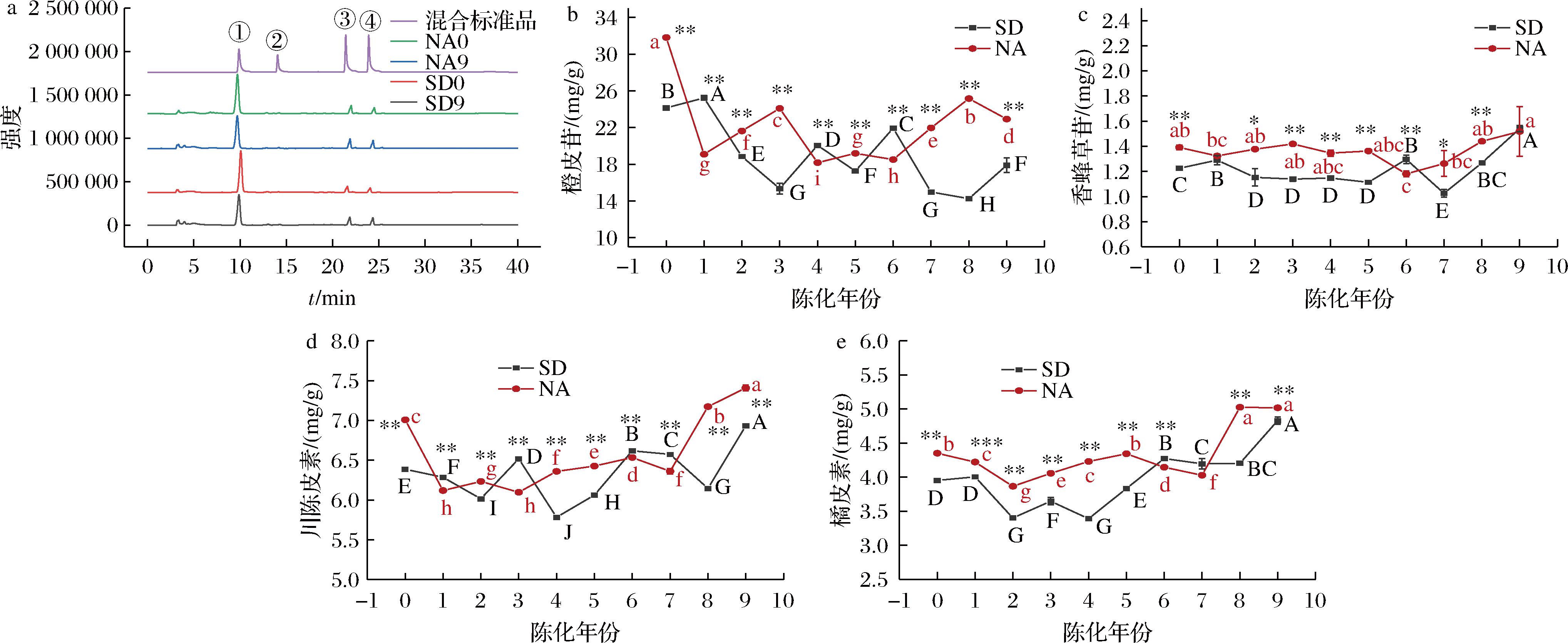
a-混合标准品和不同贮藏方式陈皮HPLC图谱;b-橙皮苷;c-香蜂草苷;d-川陈皮素;e-橘皮素
图5 不同贮藏方式陈皮中4种黄酮类化合物HPLC图谱及含量
Fig.5 HPLC chromatogram and contents of four flavonoids in PCR with different storage methods
注:①-橙皮苷;②-香蜂草苷;③-川陈皮素;④-橘皮素。
通过对比标准品及参考文献,鉴定出陈皮中黄酮类化合物主要为橙皮苷、香蜂草苷、川陈皮素和橘皮素。4种黄酮类化合物含量在陈化过程当中均在一定范围内变化,橙皮苷在整体上呈现出下降趋势,自然陈化陈皮中橙皮苷含量下降率高于标准干仓陈皮,分别为27.95%和25.93%,且2种贮藏方式下,不同年份陈皮中橙皮苷含量均具有显著性差异(P<0.05)。香蜂草苷、川陈皮素和橘皮素在陈化过程中均呈现出增加的趋势,且标准干仓贮条件下陈皮的增加率均显著高于自然陈化陈皮(P<0.05),分别为20.13%和8.55%、7.94%和5.40%、18.22%和13.35%。说明标准干仓贮藏方式下更有利于陈皮中黄酮类化合物的积累,陈皮在陈化过程中大分子黄酮苷含量下降,多甲氧基黄酮类化合物含量上升,可能是在陈化过程中存在类黄酮的转化作用。这与课题组前期对陈化3年陈皮研究发现橙皮苷伴随着多甲氧基黄酮含量增加而降低结果相一致[11]。广陈皮中含丰富的多甲氧基黄酮类化合物,具有抗癌、抗炎、降胆固醇和抗氧化等作用[13],其中川陈皮素和橘皮素是广陈皮中抗氧化能力的主要贡献物质[22],也是陈皮“陈久者良”的物质基础。
2.6 不同贮藏方式陈皮挥发性成分分析
挥发性有机化合物对于人体健康有着积极的益处,陈皮中挥发性成分是形成其独特风味的重要组成,也是影响其品质及消费者喜好程度的关键因素之一。为了研究不同贮藏方式陈皮的香气特征,利用HS-SPME与GC-MS联用方法对标准干仓陈皮与自然陈化陈皮10个不同年份陈皮样品的香气化合物成分及相对含量进行分析鉴定,采用NIST 14.0谱库及正构烷烃混合物计算保留指数分别对各色谱峰进行相似度检索比较,并选择匹配度高的检索结果作为有效香气物质,筛选出2种贮藏方式下陈皮的共有香气成分,使用面积归一化法取平均值计算各个挥发性成分相对百分含量。
由电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.037831)可知,共检测到了55个共有香气成分,分别占总挥发性成分的94.10%和93.72%。其中烯烃类25种、醇类12种、醛类6种、酮类5种、酯类4种、酚类2种和酸类1种。以55个共有香气成分作为因变量,不同贮藏方式为自变量,通过偏最小二乘回归分析(partial least squares discriminant analysis,PLS-DA)(图6-a),除自然陈化条件下的陈皮新皮以外,其余自然陈化陈皮均匀分布在横轴的正半轴,标准干仓陈皮全部均匀分布在横轴的负半轴,说明不同贮藏方式下的陈皮香气存在一定区别,实现2种贮藏方式陈皮样品的有效区分。本次分析中自变量的拟合指数![]() 为0.541,因变量拟合指数
为0.541,因变量拟合指数![]() 为0.989,模型预测指数(Q2)为0.81,R2和Q2均超过0.5,表示该模型拟合结果可接受。在经过200次置换检验后,结果如图6-b所示,Q2回归线斜率为正值,表明该模型不存在过拟合,即模型验证有效,认为该结果可以用于陈皮不同贮藏方式的鉴别分析。
为0.989,模型预测指数(Q2)为0.81,R2和Q2均超过0.5,表示该模型拟合结果可接受。在经过200次置换检验后,结果如图6-b所示,Q2回归线斜率为正值,表明该模型不存在过拟合,即模型验证有效,认为该结果可以用于陈皮不同贮藏方式的鉴别分析。
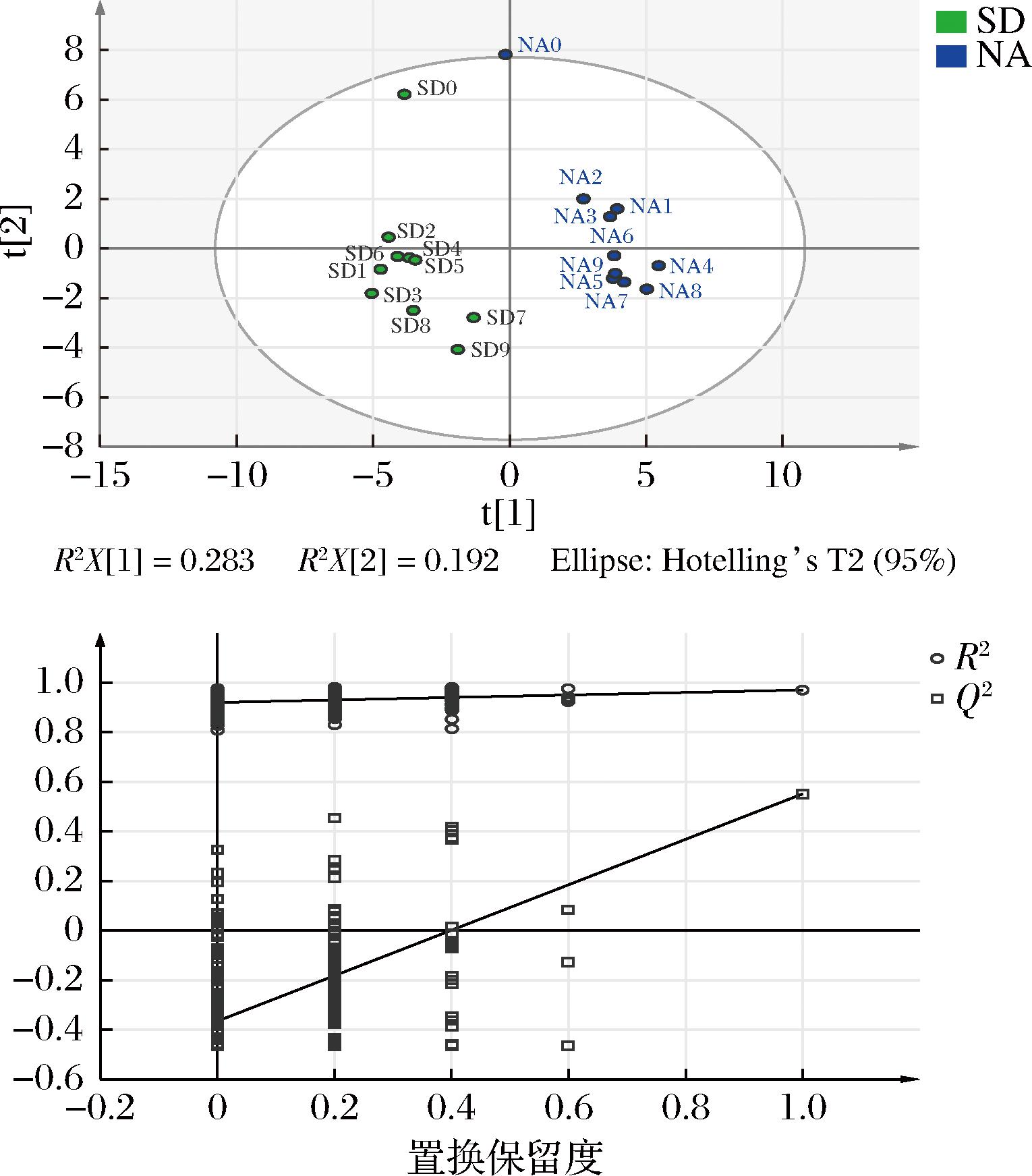
a-PLS-DA;b-模型交叉验证
图6 不同贮藏方式陈皮的PLS-DA及模型交叉验证结果
Fig.6 PLS-DA and model cross-validation results of PCR in different storage methods
根据香气成分的峰保留时间及峰面积值等相关参数,建立起不同贮藏方式陈皮香气指纹图谱(图7),不同贮藏方式陈皮香气指纹图谱之间具有明显差异。种类相似但物质相对含量有差异,含量最高的香气成分是烯烃类,其次是酯类、酚类、醛类、醇类、酮类和酸类。陈彤[23]对14个不同贮藏年份陈皮挥发性香气成分测定结果与本研究结果相一致。其中自然陈化陈皮中的醇类、醛类和酮类化合物相对含量显著高于标准干仓陈皮(P<0.05)。
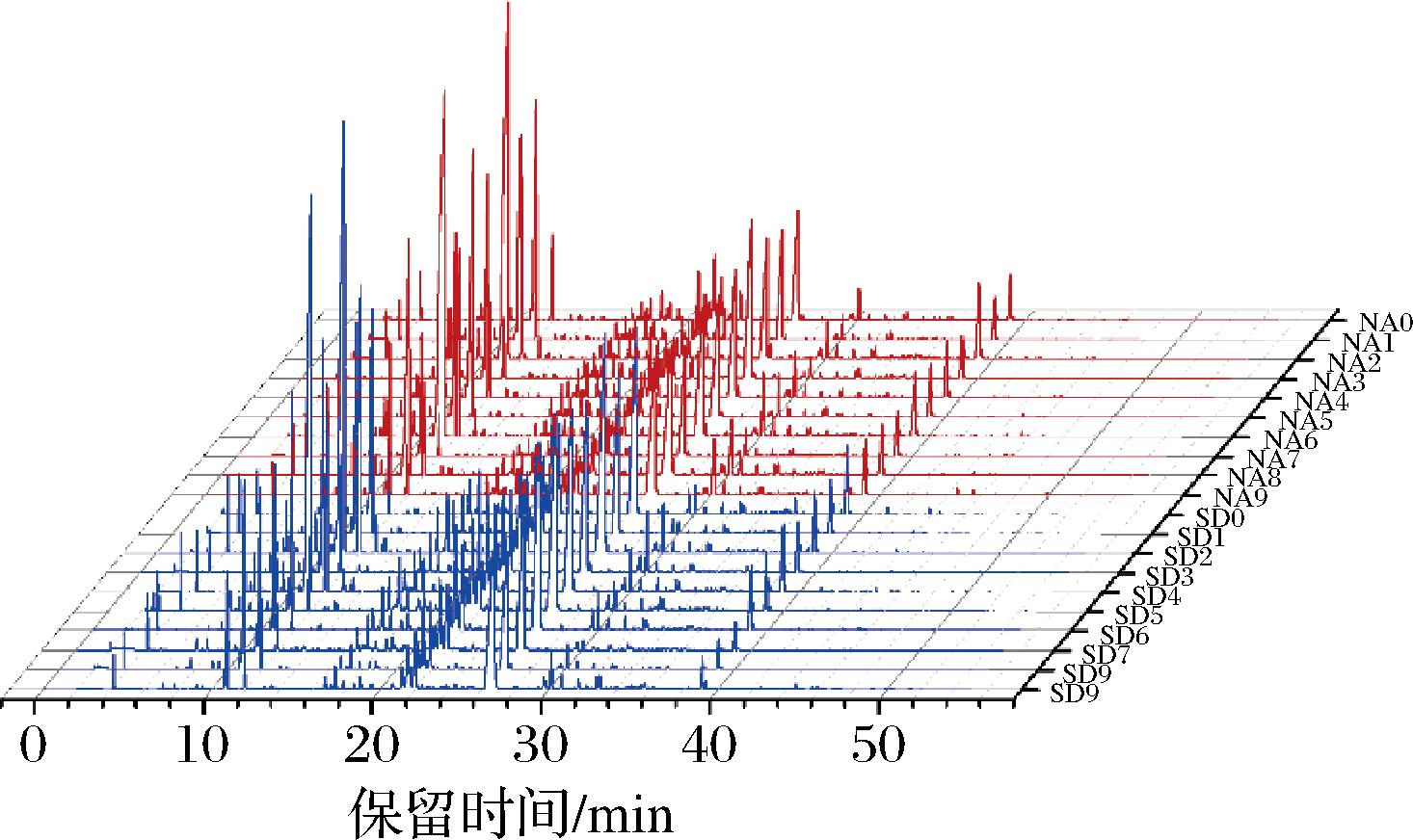
图7 不同贮藏方式陈皮香气指纹图谱
Fig.7 Aroma fingerprints of PCR in different storage methods
用以表征新会陈皮的挥发性成分主要是烯烃类物质和醇类化合物,共同组成了新会陈皮独特的香气特征和药理作用[24]。2种贮藏方式陈皮中检测出含量最高的烯烃类物质为D-柠檬烯、γ-松油烯和α-法呢烯,赋予陈皮柑橘及花果香气,D-柠檬烯作为陈皮的特征香气物质,分别占标准干仓陈皮与自然陈化陈皮烯烃类物质的64.89%和67.64%,但在2种贮藏方式中不存在显著性差异(P>0.05)。醇类物质通常阈值较小,对于陈皮整体风味起到积极作用,可以显著提高自然陈化陈皮中花果香气成分,在标准干仓陈皮和自然陈化陈皮样品中共鉴定出12种醇类物质,分别占其总含量的3.95%和5.36%,以(-)-4-萜品醇和香茅醇为主。醛类物质通常表现为青草香和果香,但是当其含量高于一定限值时,会产生腐败味进而对整体风味产生不良影响[25],因此可以认为标准干仓陈皮中醛类物质所表现出的整体风味会更加柔和。酮类物质通常具有花果香、青香等令人愉悦的香气并且阈值较高,对于陈皮的整体风味起到修饰作用。酯类物质以2-(甲氨基)苯甲酸甲酯为主,赋予陈皮柑橘皮持久柔和的香气及松木香气特征,作为新会陈皮的标志性风味物质之一[26],分别占标准干仓陈皮和自然陈化陈皮酯类物质的98.85%和98.16%,但在2种贮藏方式中不存在显著性差异(P>0.05)。酚类物质以麝香草酚和3-甲基-4-异丙基苯酚为主,显示出辛辣风味修饰陈皮整体风味,在2种贮藏方式中不存在显著性差异(P>0.05)。
2.7 不同贮藏方式陈皮香气成分差异分析
为了进一步分析不同香气成分对于区分不同贮藏方式陈皮的贡献作用,选择出差异化学标记物,从55种共有香气成分中进一步筛选出P<0.05且VIP>1的香气成分,得到13种2种贮藏方式陈皮的差异香气物质(图8),其中醇类5种、烯烃类3种、醛类2种、酮类2种和酯类1种。区域A为自然陈化陈皮中含量较为突出的11种香气成分,包括α-二去氢菖蒲烯、石竹素、10,10-二甲基-2,6-二亚甲基二环[7.2.0]十一烷-5-β-醇、对薄荷-1,3,8-三烯、α-甜橙醛、1-壬醇、反式-1-甲基-4-(1-甲基乙烯基)-2-环己烯醇、2-甲基-5-(1-甲基乙烯基)环己酮、右旋香芹酮、顺-2-甲基-5(-1-甲基乙烯基)-2-环己烯-1-醇、香芹醇。区域B是标准干仓陈皮中较高含量的2种香气成分,包括4-(1-甲基乙烯基)-1-环己烯-1-甲醛和二氢猕猴桃内酯。其中,2种贮藏方式新皮的差异香气物质成分含量相接近,这是由于新皮陈化时间较短,2种贮藏方式对其体现出来的香气差异不显著所导致的。
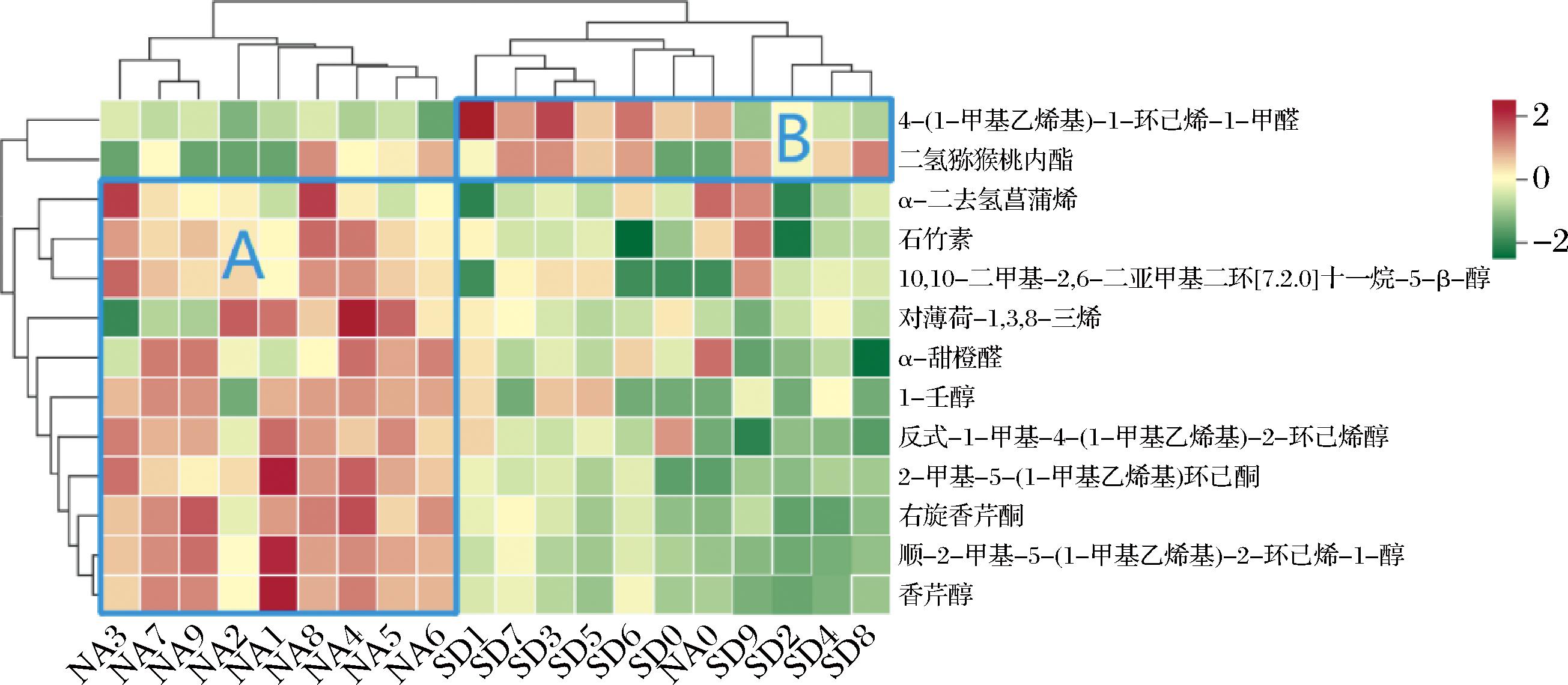
图8 不同贮藏方式陈皮的差异香气成分聚类热图
Fig.8 Heatmap of differential aroma components of PCR with different storage methods
2.8 基于差异香气成分的不同贮藏方式陈皮判别分析
为了对不同贮藏方式陈皮分析得到更加准确、直观的结果,根据筛选出来的13种具有组间差异的香气成分,对2种不同贮藏方式的20个陈皮样品香气数据进行分析。
使用PLS-DA对差异香气数据进行降维分析,得到前两个PC的2种贮藏方式陈皮得分散点图(图9)。PC1和PC2的方差贡献率分别为49.7%和14.9%,累计方差贡献率达到64.6%,认为选取的PC1、PC2分析样本具有较好的可靠性,可以基本反应不同样本中的主要特征信息[27]。除自然陈化新皮以外,其余自然陈化陈皮均匀分布在横轴的正半轴,标准干仓陈皮全部均匀分布在横轴的负半轴,2种贮藏方式陈皮得到较好区分,因此可以认为,13种差异香气成分对于陈皮的贮藏方式判别区分具有较好的效果。
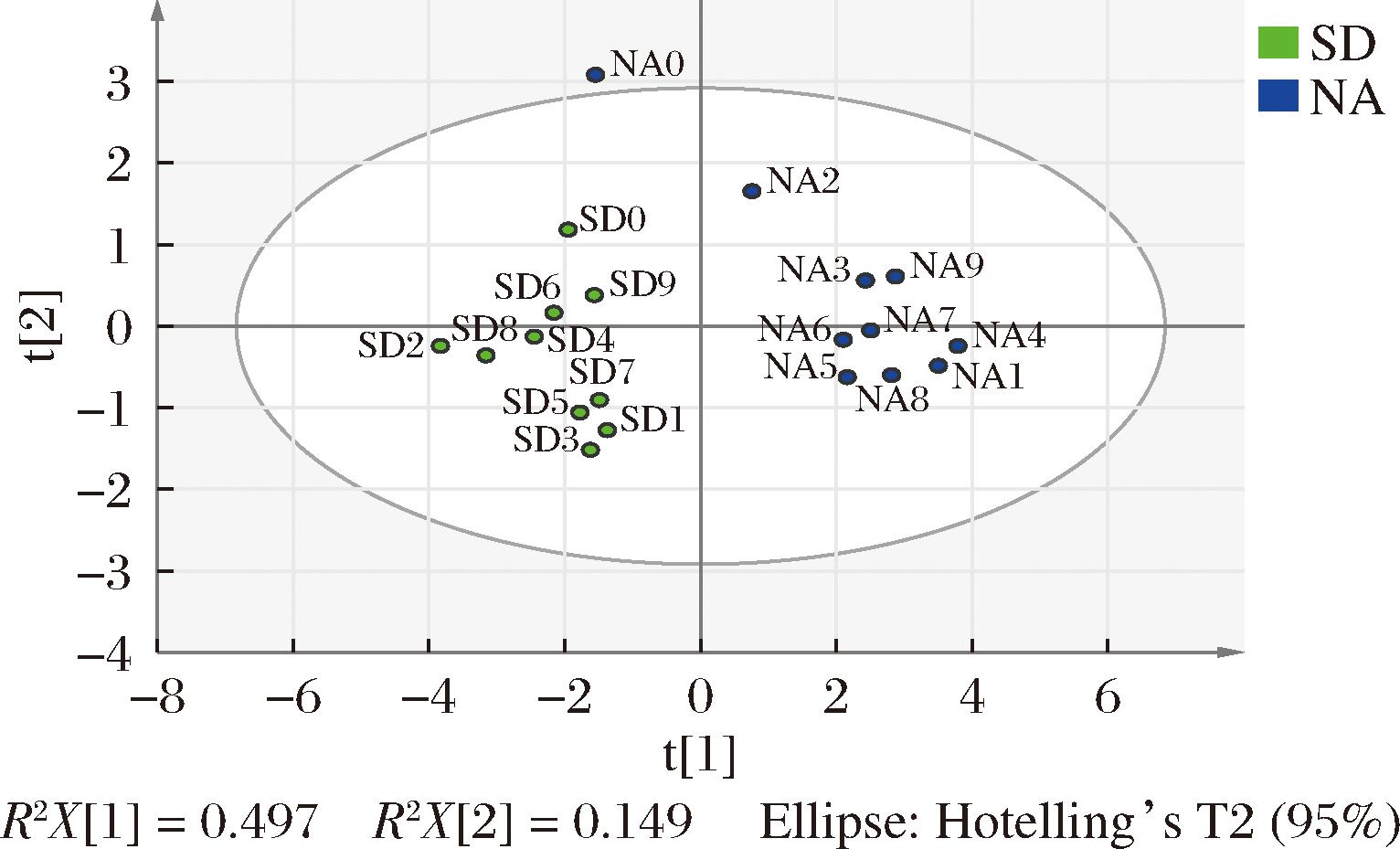
图9 不同贮藏方式陈皮差异香气成分的PLS-DA
Fig.9 PLS-DA plot of PCR with different storage methods
3 结论
本实验以2种不同贮藏方式的10个陈化年份陈皮为研究对象,对其色差、类胡萝卜素、总酚、总黄酮、抗氧化活性和黄酮类化合物等陈皮特质性成分及挥发性成分进行分析比较。实验结果表明,陈化0~9年间,2种贮藏方式陈皮中总酚、总黄酮、抗氧化活性、香蜂草苷、川陈皮素和橘皮素变化趋势一致,伴随着陈化时间的延长呈现增长趋势,且标准干仓陈皮增加率高于自然陈化陈皮。色差、类胡萝卜素与橙皮苷含量则随陈化时间延长而下降,标准干仓陈皮下降率低于自然陈化陈皮。标准干仓贮藏方式对于陈皮内活性物质的积累效果更优。
2种贮藏方式陈皮的香气成分种类一致,共检测出55个共有香气成分,以烯烃类、酯类为主,但其相对含量具有一定差异,具有明显的贮藏条件特征。自然陈化条件下醇类、醛类和酮类物质相对含量显著高于标准干仓陈皮(P<0.05)。筛选到与陈皮品质相关的13个香气物质[4-(1-甲基乙烯基)-1-环己烯-1-甲醛、二氢猕猴桃内酯和α-二去氢菖蒲烯等]在2种贮藏方式中含量具有显著性差异,对于判别区分不同贮藏方式陈皮具有一定意义,为辨别贮藏方式不一致的陈皮提供科学依据。
[1] FU M Q, AN K J, XU Y J, et al.Effects of different temperature and humidity on bioactive flavonoids and antioxidant activity in Pericarpium Citri Reticulata (Citrus reticulata ‘Chachi’)[J].LWT, 2018, 93:167-173.
[2] 肖建才, 闫滨滨, 万修福, 等.基于指纹图谱和UPLC-MS/MS定量测定对不同产地陈皮的质量评价研究[J].中草药, 2023, 54(10):3302-3311.XIAO J C, YAN B B, WAN X F, et al.Study on quality evaluation of Citrus reticulata from different origins by fingerprint and UPLC-MS/MS flavonoid content determination[J].Chinese Traditional and Herbal Drugs, 2023, 54(10):3302-3311.
[3] YANG F Q, HE L Y, SHEN M Y, et al.A correlation between Pericarpium citri reticulatae volatile components and the change of the coexisting microbial population structure caused by environmental factors during aging[J].Frontiers in Microbiology, 2022, 13:930845.
[4] 吴翠. 中药材“陈久者良”的本草考证和品质评价研究[D].北京:中国中医科学院, 2022.WU C.Herbal textual research and study on quality evaluation of chinesemateria medica of ‘the long, the better’[D].Beijing:China Academy of Chinese Medical Sciences, 2022.
[5] ZASOWSKA-NOWAK A, NOWAK P J, CIALKOWSKA-RYSZ A.Carotenoids in palliative care-is there any benefit from Carotenoid supplementation in the adjuvant treatment of cancer-related symptoms?[J].Nutrients, 2022, 14(15):3183.
[6] WANG Q, QIU Z Y, CHEN Y L, et al.Review of recent advances on health benefits, microbial transformations, and authenticity identification of Citri reticulatae pericarpium bioactive compounds[J].Critical Reviews in Food Science and Nutrition, 2023,16:1-29.
[7] YANG W L, LIU M S, CHEN B Z, et al.Comparative analysis of chemical constituents in Citri Exocarpium Rubrum, Citri Reticulatae Endocarpium Alba, and Citri Fructus Retinervus[J].Food Science &Nutrition, 2022, 10(9):3009-3023.
[8] 闫国琦, 屈佳蕾, 欧国良, 等.广陈皮干燥和仓储技术及装备的现状与对策[J].南方农业学报, 2021, 52(9):2543-2553.YAN G Q, QU J L, OU G L, et al.Current situation and countermeasures of drying and storage technology and equipment of Citrus reticulata ‘Chachi’[J].Journal of Southern Agriculture, 2021, 52(9):2543-2553.
[9] 陈林, 吴蓓, 陈鸿平, 等.不同年份标准仓储广陈皮表面微生物的分布[J].中国食品学报, 2022, 22(3):281-287.CHEN L, WU B, CHEN H P, et al.Microbe distribution on the surface of pericarpium citri reticulatae in different years[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(3):281-287.
[10] 徐明月. 干燥条件对柑橘皮化学成分影响的研究[D].上海:上海海洋大学, 2016.XU M Y.Research on the Effects of drying conditions on chemical components of citrus peel[D].Shanghai:Shanghai Ocean University, 2016.
[11] FU M Q, XU Y J, CHEN Y L, et al.Evaluation of bioactive flavonoids and antioxidant activity in Pericarpium Citri Reticulatae (Citrus reticulata ‘Chachi’) during storage[J].Food Chemistry, 2017, 230:649-656.
[12] LIU R T, TAO Y X, XU T T, et al.Antioxidant activity increased due to dynamic changes of flavonoids in orange peel during Aspergillus niger fermentation[J].International Journal of Food Science &Technology, 2023, 58(6):3329-3336.
[13] MAMY D, HUANG Y Y, AKPABLI-TSIGBE N D K, et al.Valorization of Citrus reticulata peels for flavonoids and antioxidant enhancement by solid-state fermentation using Aspergillus niger CGMCC 3.6189[J].Molecules, 2022, 27(24):8949.
[14] CHEN X M, KITTS D D, JI D Y, et al.Free radical scavenging activities of phytochemical mixtures and aqueous methanolic extracts recovered from processed coffee leaves[J].International Journal of Food Science &Technology, 2019, 54(10):2872-2879.
[15] WANG M, LI X, DING H Y, et al.Comparison of the volatile organic compounds in Citrus reticulata ‘Chachi’ peel with different drying methods using E-nose, GC-IMS and HS-SPME-GC-MS[J].Frontiers in Plant Science, 2023, 14:1169321.
[16] 廖娜, 张雁, 唐小俊, 等.基于提高类胡萝卜素稳定性的甜玉米营养糊配方优化[J].中国粮油学报, 2024, 39(1):54-64.LIAO N, ZHANG Y, TANG X J, et al.Optimization of formulation for sweet corn paste based on improvement to stability of carotenoids[J].Journal of the Chinese Cereals and Oils Association, 2024, 39(1):54-64.
[17] 王光宁. 基于化学组分分析广陈皮陈化变化及褐变反应研究[D].广州:广州中医药大学, 2021.WANG G N.Study on aging change and Browning reaction of broad orange peel based on chemical composition analysis[D].Guangzhou:Guangzhou University of Chinese Medicine, 2021.
[18] SUN Y J, SHEN Y, LIU D H, et al.Effects of drying methods on phytochemical compounds and antioxidant activity of physiologically dropped un-matured Citrus fruits[J].LWT, 2015, 60(2):1269-1275.
[19] LUO Y, ZENG W, HUANG K E, et al.Discrimination of Citrus reticulata Blanco and Citrus reticulata ‘Chachi’ as well as the Citrus reticulata ‘Chachi’ within different storage years using ultra high performance liquid chromatography quadrupole/time-of-flight mass spectrometry based metabolomics approach[J].Journal of Pharmaceutical and Biomedical Analysis, 2019, 171:218-231.
[20] WANG H, CHEN G, FU X, et al.Effects of aging on the phytochemical profile and antioxidative activity of Pericarpium Citri Reticulatae ‘Chachiensis’[J].RSC Advances, 2016, 6(107):105 272-105281.
[21] FEUMBA DIBANDA R, PANYOO AKDOWA E, RANI P A, et al.Effect of microwave blanching on antioxidant activity, phenolic compounds and browning behaviour of some fruit peelings[J].Food Chemistry, 2020, 302:125308.
[22] LIU N, SUN J C, YANG W N, et al.Evaluation of bioactive flavonoids in Citri Reticulatae Pericarpium from different regions and its association with antioxidant and α-glucosidase inhibitory activities[J].Traditional Medicine Research, 2022, 7(1):2.
[23] 陈彤. 陈皮的黄酮和风味物质变化及其机理研究[D].广州:华南农业大学, 2016.CHEN T.Changes of Flavonoids and flavor substances of Chen Pi and their mechanism studies[D].Guangzhou:South China Agricultural University, 2016.
[24] 曹烙文, 李华, 黄豆, 等.HS/SPME-GC×GC-TOFMS结合化学计量学方法鉴别分析新会陈皮[J].沈阳农业大学学报, 2021, 52(1):49-61.CAO L W, LI H, HUANG D, et al.HS/SPME-GC × GC-TOFMS combined with chemometric methods for differentiation of Xinhui Citri reticulatae pericarpium[J].Journal of Shenyang Agricultural University, 2021, 52(1):49-61.
[25] 刘潇. 高温胁迫下电子束辐照对储藏籼稻脂质变化规律的影响机制研究[D].南京:南京财经大学, 2023.LIU X.Effect mechanism of electron beam irradiation on lipid changes in indica rice under high temperature stress[D].Nanjing:Nanjing University of Finance &Economics, 2023.
[26] 梁奕尧, 陈柏忠, 杨玉华, 等.《中国药典》2020版陈皮质量标准修订的研究[J].中国医院药学杂志, 2022, 42(2):142-146.LIANG Y Y, CHEN B Z, YANG Y H, et al.Study on the quality standards of Citri reticulatae pericarpium in Chinese pharmacopoeia(2020 edition)[J].Chinese Journal of Hospital Pharmacy, 2022, 42(2):142-146.
[27] 张馨文. 超高压处理对沃柑汁品质的影响[D].南宁:广西大学, 2022.ZHANG X W.Effect of ultrahigh-pressure treatment on the quality of Citrus sinensis juice[D].Nanning:Guangxi University, 2022.