植物乳杆菌(Lactobacillus plantarum)是一种常用于食品加工和发酵的食品级微生物[1-2]。利用植物乳杆菌进行直投式发酵不仅能显著缩短产品发酵周期,而且能产生大量的风味物质、有机酸、氨基酸等,提高产品风味的同时还具有抑制食源性致病菌[3]、增强人体免疫功能[4]、抗癌[5]等生理功效。何扬波等[6]利用实验室自选植物乳杆菌发酵红酸汤,将发酵时间缩短为9 d,相同发酵时间内的乳酸含量是自然发酵的16.37倍,为贵州红酸汤的工业生产提供了技术支持。LI等[7]研究发现,胡萝卜汁经过植物乳杆菌NCU116发酵后对高脂饮食和STZ诱导的2型糖尿病大鼠的血糖水平、氧化应激和脂质代谢有积极的影响。直投式发酵剂在产业中的应用越来越广泛,因此获得高浓度的菌剂在发酵产业中显得尤为重要。
高密度培养技术,一般指采用一定的培养技术或装置对菌体的培养工艺进行优化,使其与普通培养基相比显著提高菌体密度,最终以较低成本获得较多菌体直投式发酵剂[8]。熊涛等[9]通过利用单因素及响应面实验对植物乳杆菌NCU116进行高密度培养,最终获得菌体为9.30×109 CFU/mL。孙雨佳等[10]通过优化培养基中的营养成分,使NCU137的活菌数达到9.20×109 CFU/mL。董安利[11]以乳酸乳球亚种BL19为研究对象,对其高密度培养研究,使活菌数达到了1.82×1010 CFU/mL,是培养基优化前的6.07倍,每升培养基节约成本68%。综上,优化培养基成分和培养条件对提高菌体密度、节约生产成本具有重要意义。
L.plantarum NCU001929是从传统自然发酵的红酸汤中分离得到的一株红酸汤发酵专用菌株,将其制备成直投式发酵剂应用于红酸汤强化发酵,有望提升红酸汤的发酵品质、缩短其发酵周期。本研究通过单因素试验、响应面试验、静态培养、发酵罐工艺优化L.plantarum NCU001929的培养基成分及最适培养条件,为L.plantarum NCU001929菌剂的制备提供依据。
1 材料与方法
1.1 材料与试剂
L.plantarum NCU001929,保藏于南昌大学食品科学与资源挖掘全国重点实验室植物基发酵益生菌资源库。
葡萄糖,上海豪申化学试剂有限公司;麦芽糖、麦芽糊精、果糖、乳糖、蔗糖、菊粉、鱼蛋白胨、大豆蛋白胨、酪蛋白胨、亚硝酸钠、微维生素B2、维生素B3、维生素B7、维生素C、酪氨酸、尿嘧啶、鸟嘌呤、琼脂粉,北京索莱宝科技有限公司;酵母提取粉、牛肉浸粉、细菌学蛋白胨、胰蛋白胨,广东环凯微生物科技有限公司;甘露醇,上海源叶生物科技有限公司;柠檬酸铵,上海麦克林生化科技有限公司;吐温-80,上海市青析化工科技有限公司;K2HPO4,天津市大茂化学试剂厂;海藻糖、可溶性淀粉、NH4NO3、尿素、CuSO4·5H2O、ZnSO4·5H2O、FeSO4·7H2O、MgSO4、MnSO4·H2O、无水乙酸钠、氨水、Na2CO3、NaOH,西陇化工股份有限公司;胸腺嘧啶、半胱氨酸、谷氨酸、缬氨酸,上海阿拉丁生化科技有限公司;甘氨酸,国药集团化学试剂有限公司。
1.2 仪器与设备
JA2003N电子天平,上海精密科学仪器有限公司;CJ-1680超净工作台,苏州市净化设备有限公司;DNP-9272生化培养箱,上海精宏实验设备有限公司;MLS-3751L-PC高压蒸汽灭菌锅,松下健康医疗器械株式会社;PHS-25C pH计,上海精密仪器仪表有限公司;MX-S混匀仪,大龙兴创实验仪器有限公司;KLF 3.0 L小型发酵罐,瑞士比欧生物工程公司。
1.3 实验方法
1.3.1 菌株活化
L.plantarum NCU001929用甘油保藏法保藏在甘油管(-20 ℃)中,每次实验前在MRS培养基中活化并连续传代,接种量为2%(体积分数),于37 ℃培养24 h。取连续传代2次后的菌株进行后续试验。
1.3.2 活菌数的测定
将L.plantarum NCU001929培养液充分摇匀后准确吸取100 μL于900 μL生理盐水中,振荡摇匀,即为稀释10倍,按照此操作重复6~7次,选择3个合适的稀释梯度,准确吸取100 μL涂布于MRS固体培养基上,并置于37 ℃恒温培养48 h后计数。
1.3.3 单因素试验
以MRS为基础培养基,分别以20 g/L(质量浓度)的麦芽糖、麦芽糊精、蔗糖、甘露糖、乳糖、菊糖、可溶性淀粉、海藻糖和果糖代替MRS培养基中的原有碳源(葡萄糖),L.plantarum NCU001929按2%(体积分数)的接种量接种到替换碳源后的MRS培养基中,37 ℃恒温培养24 h后测定发酵液中活菌数,选取最佳碳源;在获得最佳碳源种类基础上,进一步探究碳源添加量(10、15、20、25、30、35、40、45 g/L)对菌体生长的影响。依次考察氮源种类(牛肉浸粉、细菌学蛋白胨、酵母粉提取粉)分别替换为20 g/L(质量浓度)牛肉浸粉、细菌学蛋白胨、酵母粉、胰蛋白胨、鱼蛋白胨、大豆蛋白胨、酪蛋白胨尿素、NaNO3)及氮源正交比例(表1)、微量元素(FeSO4·7H2O、ZnSO4·5H2O、CuSO4·5H2O、MnSO4·H2O、MgSO4)、生长因子(酪氨酸、半胱氨酸、缬氨酸、甘氨酸、谷氨酸、腺嘌呤、鸟嘌呤、胸腺嘧啶、尿嘧啶、维生素C、维生素B2、维生素B3、维生素B7)对菌体生长的影响。
1.3.4 Plackett-Burman试验设计
通过Plackett-Burman试验对麦芽糖、牛肉浸粉、酵母提取粉、细菌学蛋白胨、无水乙酸钠、柠檬酸三铵、吐温-80、K2HPO4等8个因素进行考察,每个因素取高(+)、低(-)两水平,如表3所示,根据方差分析的结果筛选出对活菌数影响最显著的因素进行下一步试验。
1.3.5 最陡爬坡试验设计
根据Plackett-Burman实验结果,确定显著因子,设计最陡爬坡实验的方向和步长,从而获得响应面实验因素的中心点。
1.3.6 BBD试验设计
根据Plackett-Burman和最陡爬坡试验确定的中心点,以交联麦芽糖、牛肉浸粉、酵母提取粉、柠檬酸三铵的添加量为自变量,采用Design-Expert 10软件设计对L.plantarum NCU001929的培养条件进行响应面优化试验。
1.3.7 静态培养条件优化
在响应面优化试验的基础上,以不同的初始pH值(5.5、6.0、6.5、7.0、7.5)、接种量(1%、2%、3%、4%、5%)(体积分数)、培养温度(25、30、35、40 ℃)进行单因素试验,确定最佳静态培养条件。
1.3.8 发酵罐工艺优化
在上一步实验的基础上,以不同的转速(50、100、150、200 r/min)、气体种类(无菌空气、N2、CO2)、pH(6.0、6.5、7.0、7.5)和中和剂种类(25% NH3·H2O、25% NaCO3、25% NaOH)(质量分数)进行单因素优化,30 ℃恒温培养24 h后,以活菌数为指标,筛选出最适合L.plantarum NCU001929生长发酵罐培养最佳工艺参数。
1.4 数据处理
所有数据采用SPSS 26软件进行方差分析,采用Origin 2023作图,采用Design-Expert 10软件对Plackett-Burman和Box-Behnken进行实验设计与数据分析。
2 结果与分析
2.1 单因素试验
2.1.1 碳源的优化
碳源是微生物所需的主要营养物质之一,对微生物碳骨架的合成及生长代谢有着重要作用[12]。由图1可知,初始MRS培养基的活菌数为1.33×109 CFU/mL,且不同碳源对乳酸菌的生长有显著不同的影响,麦芽糖对L.plantarum NCU001929的促生长作用最明显,其次是蔗糖和麦芽糊精。对麦芽糖质量浓度进一步进行优化,结果如图2所示,当麦芽糖添加量为30 g/L时,活菌数最高,达到了3.27×109 CFU/mL,是初始MRS培养基的2.46倍,活菌数显著提高(P<0.05),因此选择30 g/L的麦芽糖碳源进行后续实验。金玉洁等[13]研究发现,麦芽糖作为碳源时,植物乳杆菌ZU018活菌数最高;LAI等[14]也发现,麦芽糖对植物乳杆菌的生长促进作用较葡萄糖更显著,这可能是因为植物乳杆菌对麦芽糖具有更好的偏好性。
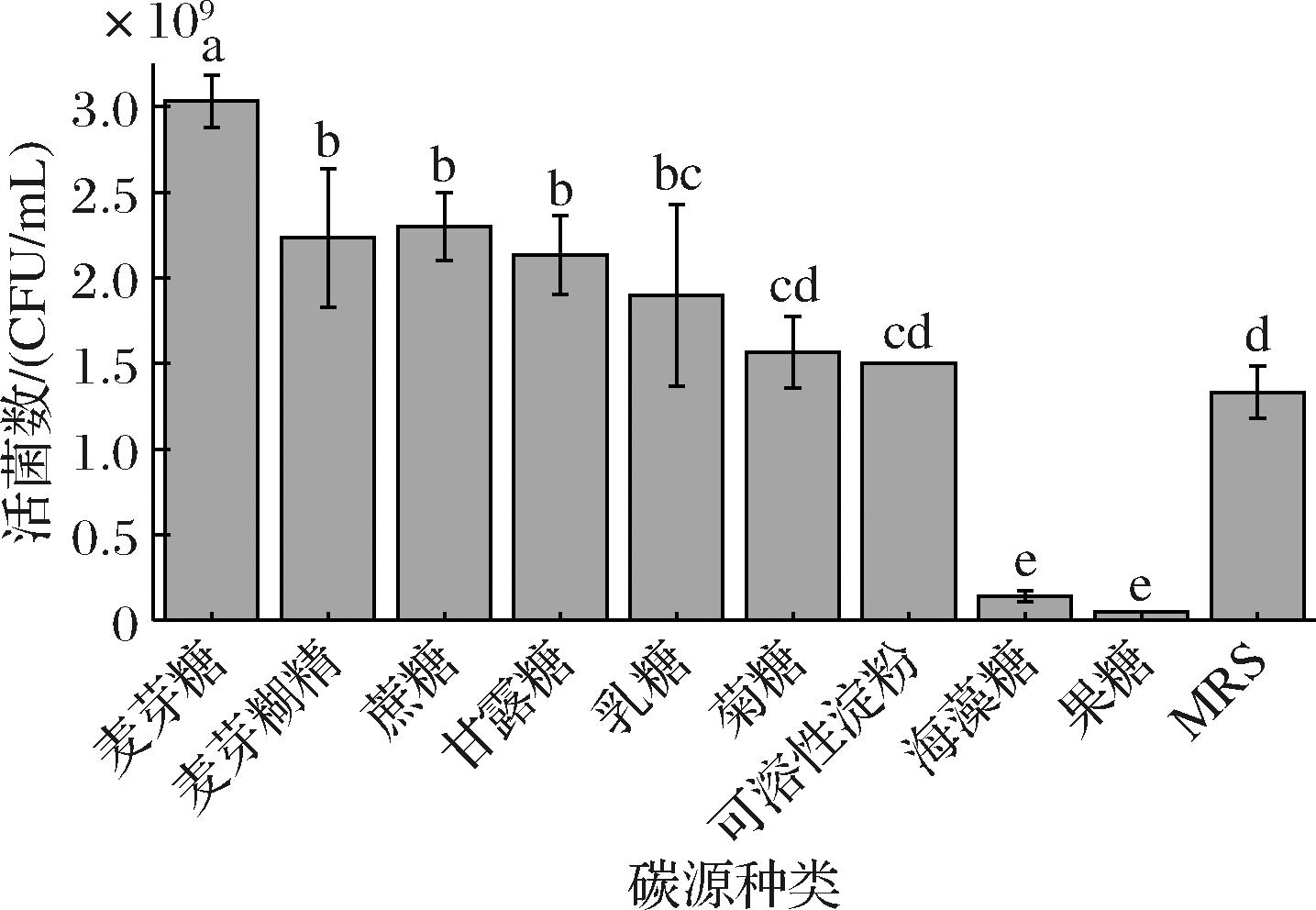
图1 不同碳源种类对L.plantarum NCU001929的影响
Fig.1 Effects of different carbon sources on the viable count of L.plantarum NCU001929
注:不同小写字母表示差异显著(P<0.05)(下同)。
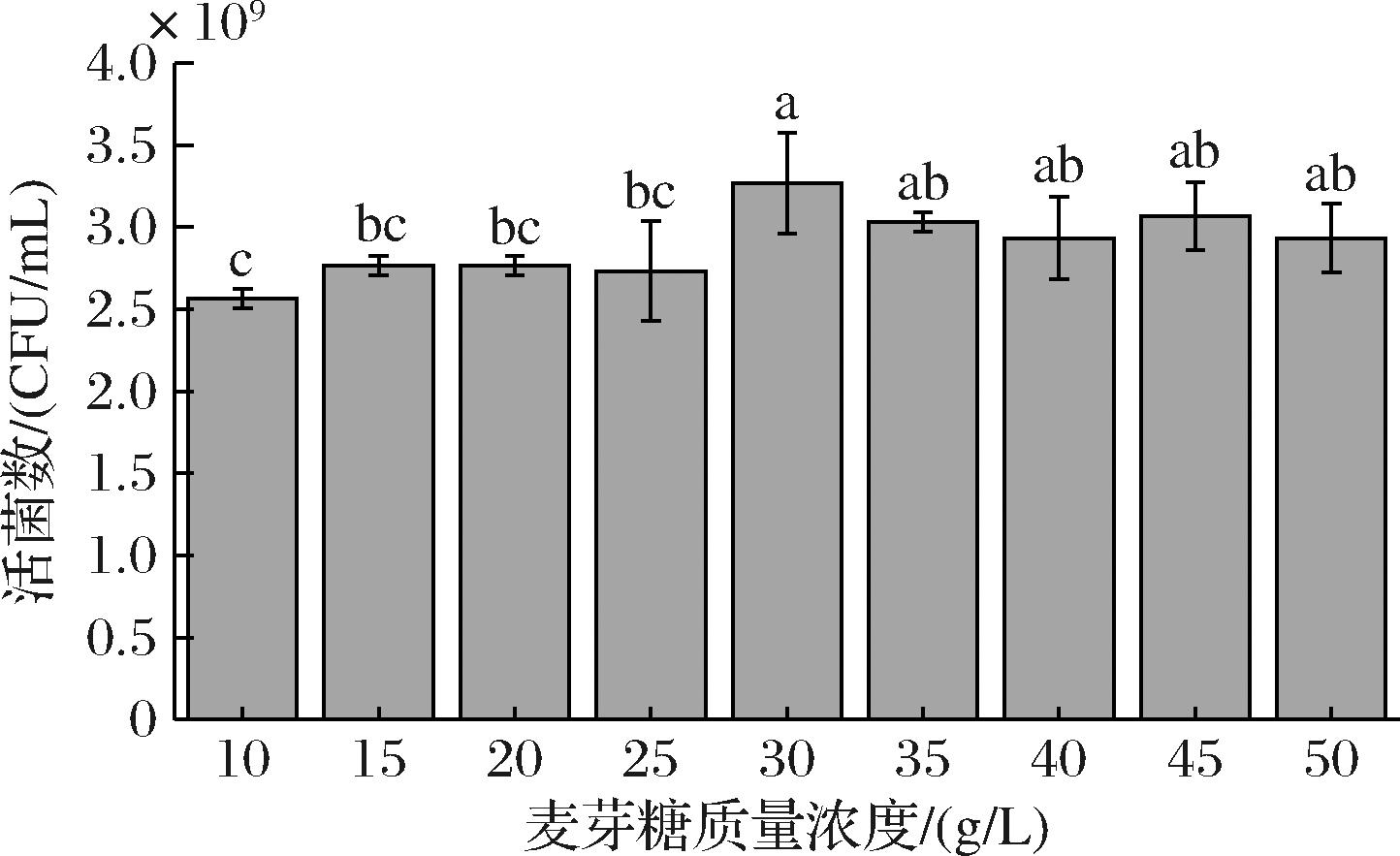
图2 麦芽糖浓度对L.plantarum NCU001929的影响
Fig.2 The effects of maltose mass concentrations on the viable count of L.plantarum NCU001929
2.1.2 氮源的优化
氮源能为细菌提供丰富的氨基酸、矿物质、维生素等,对菌体的生长具有促进作用[15-16]。基于上一步碳源优化结果,进行氮源优化。由图3可知,牛肉浸粉、细菌学蛋白胨、酵母提取粉和胰蛋白胨4种氮源对菌体的促生长有明显作用,但无显著差异。考虑胰蛋白胨的成本较高,最终选择牛肉浸粉、细菌学蛋白胨、酵母提取粉进行复配正交试验,复合氮源因子水平表如表1所示。氮源正交试验结果如表2所示,3种氮源对L.plantarum NCU001929生长影响的大小关系为:酵母提取粉>细菌学蛋白胨>牛肉浸粉;理论上最佳氮源组合为A3B2C3,即添加量为15 g/L酵母提取粉,10 g/L细菌学蛋白胨和15 g/L牛肉浸粉。选取最佳氮源组合进行验证实验,其活菌数为4.63×109 CFU/mL,大于正交试验组,是碳源优化结果的1.42倍,较上一步实验活菌数显著提高(P<0.05),所以该组为最优氮源复配组合,即15 g/L酵母提取粉、10 g/L细菌学蛋白胨和15 g/L牛肉浸粉。
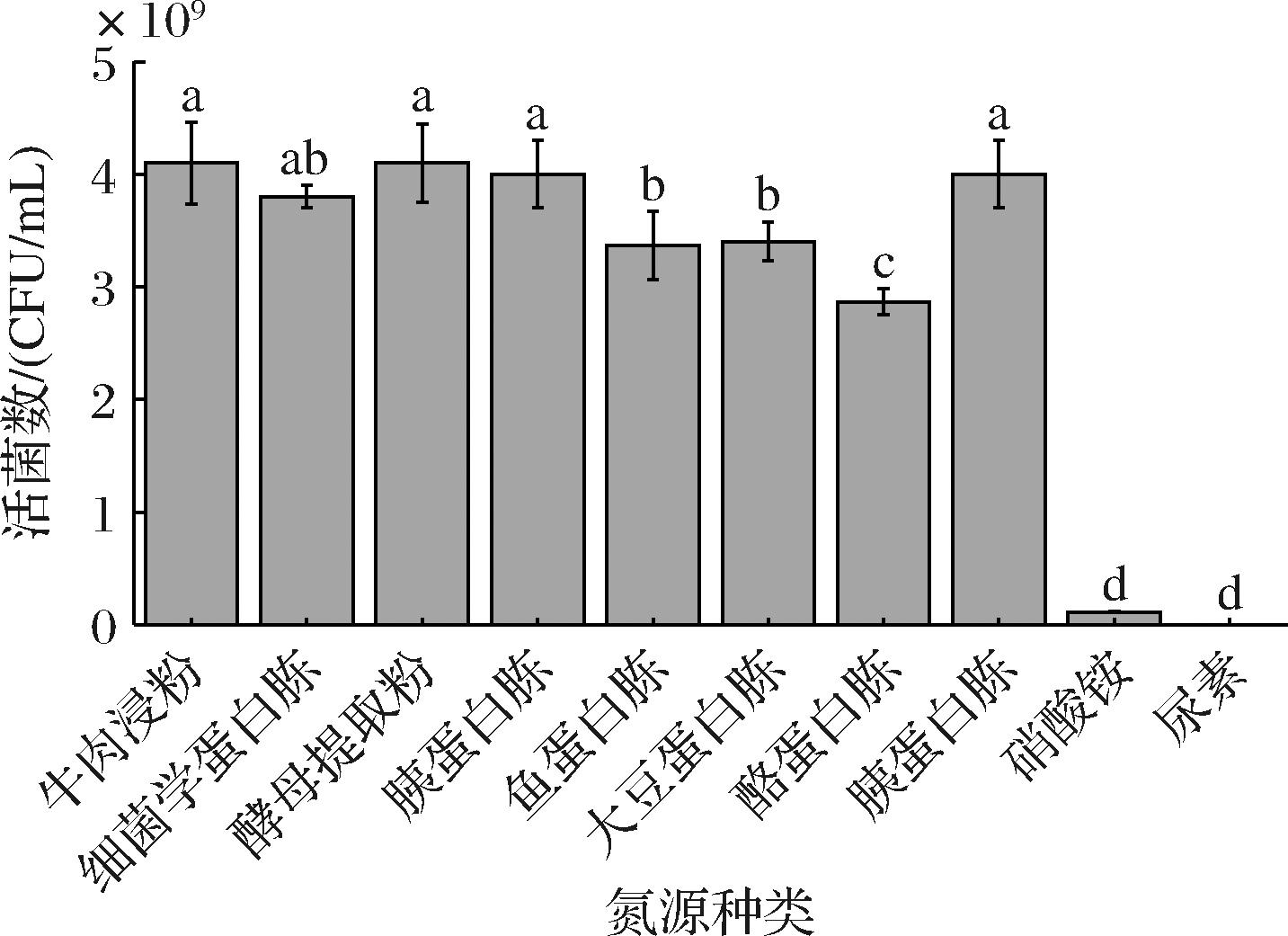
图3 不同氮源对L.plantarum NCU001929活菌数的影响
Fig.3 Effects of different nitrogen sources on the viable count of L.plantarum NCU001929
表1 复合氮源因子水平表 单位:g/L
Table 1 Factors and levels of complex nitrogen sourse
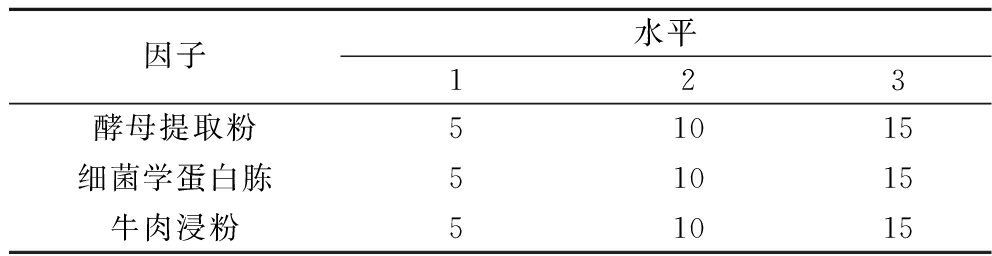
因子水平123酵母提取粉51015细菌学蛋白胨51015牛肉浸粉51015
表2 复合氮源正交试验结果
Table 2 Orthogonal experiment results of complex nitrogen sources
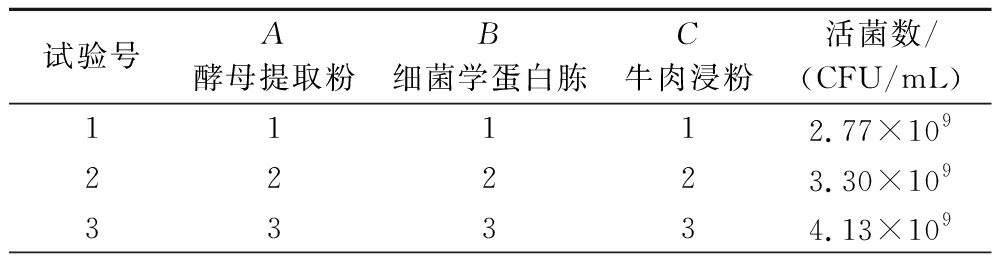
试验号A酵母提取粉B细菌学蛋白胨C牛肉浸粉活菌数/(CFU/mL)11112.77×10922223.30×10933334.13×109
续表2
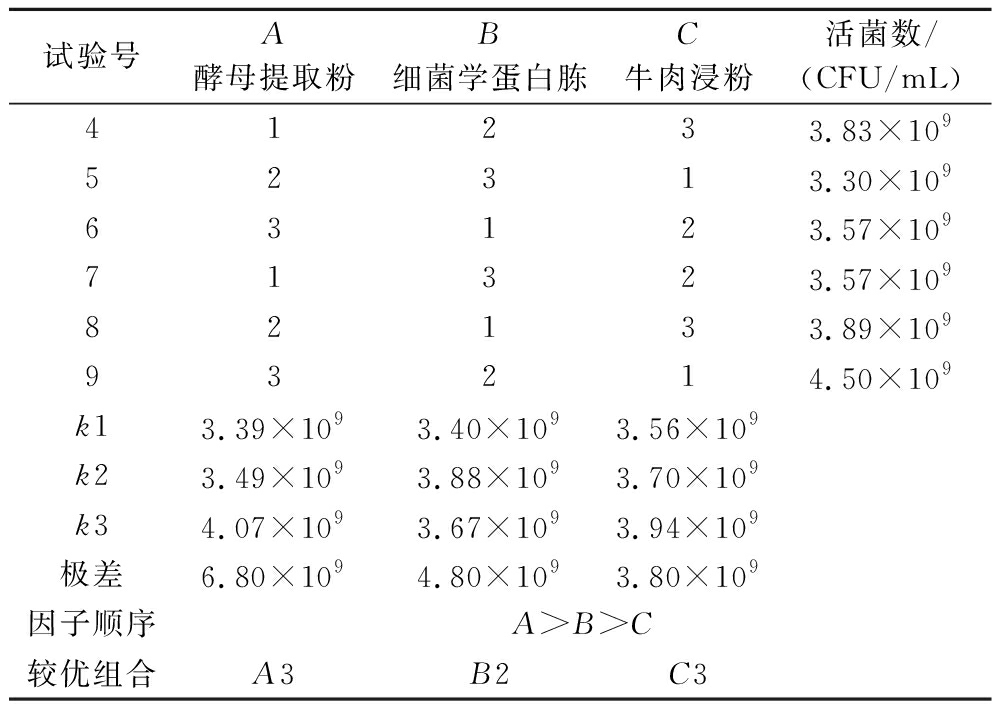
试验号A酵母提取粉B细菌学蛋白胨C牛肉浸粉活菌数/(CFU/mL)41233.83×10952313.30×10963123.57×10971323.57×10982133.89×10993214.50×109k13.39×1093.40×1093.56×109k23.49×1093.88×1093.70×109k34.07×1093.67×1093.94×109极差6.80×1094.80×1093.80×109因子顺序A>B>C较优组合A3B2C3
2.1.3 微量元素的优化
微量元素对于微生物的发育和繁衍至关重要,它们既能够作为酶的辅因子促进酶的催化,也能够为菌体提供有效的生物活性物质[17]。基于上述氮源优化结果,研究不同微量元素对L.plantarum NCU001929生长的影响,结果如图4所示,相较于对照组,添加FeSO4·7H2O、ZnSO4·5H2O、CuSO4·5H2O、MgSO4对菌体生长产生了抑制作用,而MnSO4·H2O能够显著提高L.plantarum NCU001929的活菌数。图4-e表明MnSO4·H2O质量浓度为0.06 g/L时,活菌数最高,为4.85×109 CFU/mL,是氮源优化结果的1.05倍,较上一步实验活菌数提高效果不显著(P>0.05),选择该浓度为微量元素的最佳浓度。研究表明,Mn2+通过调节一些关键酶进一步调控丙酮酸到乳酸的代谢途径,从而在细胞的生长、产酸、代谢方面发挥着重要作用[18]。
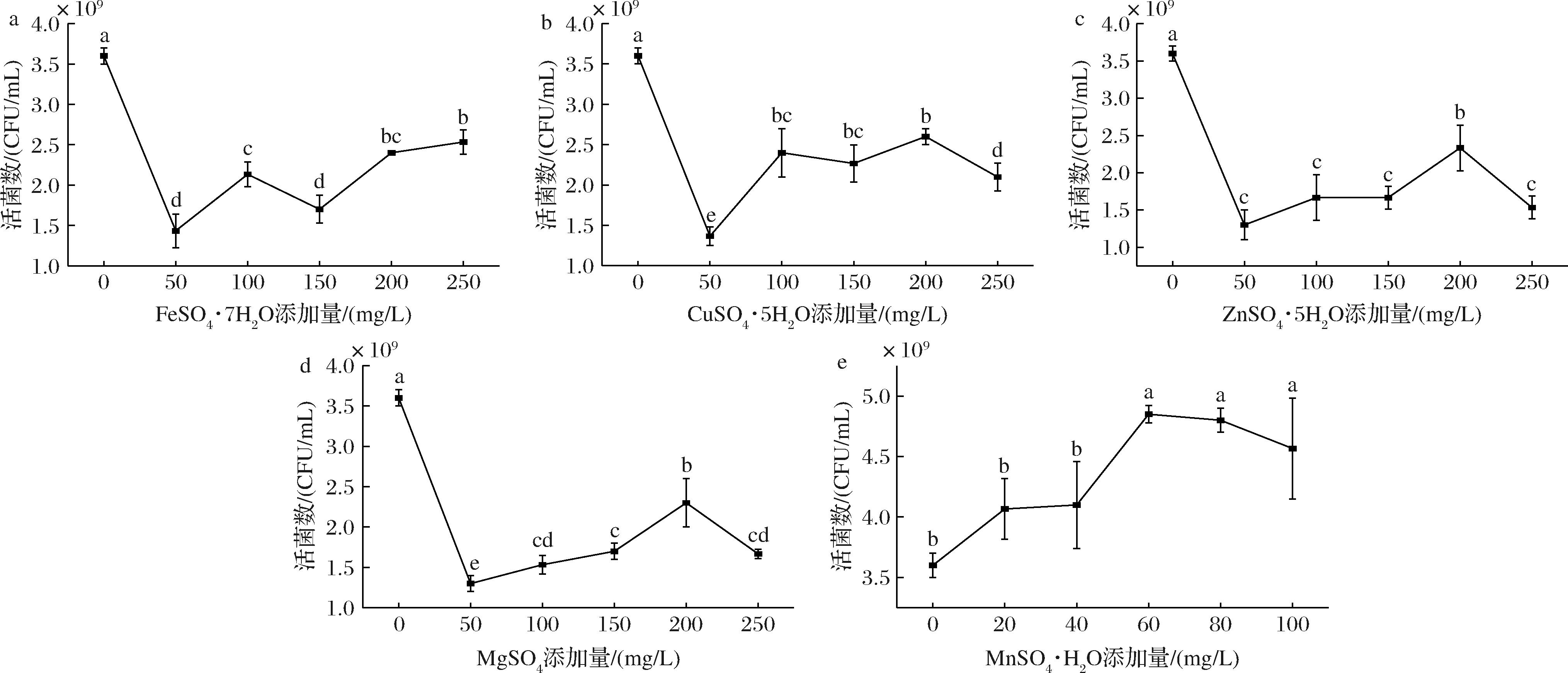
a-FeSO4·7H2O添加量;b-CuSO4·5H2O添加量;c-ZnSO4·5H2O添加量;d-MgSO4添加量;e-MnSO4·H2O添加量
图4 不同微量元素对L.plantarum NCU001929活菌数的影响
Fig.4 Effect of different trace elements on the viable count of L.plantarum NCU001929
2.1.4 生长因子的优化
微生物自身难以合成一些生长所必须的核苷酸、氨基酸和维生素类等前体物质,这些物质对微生物的生长具有促进作用[17],因此在上一步实验优化的基础上进行生长因子优化。由图5可知,胸腺嘧啶、尿嘧啶、酪氨酸、半胱氨酸、缬氨酸、维生素B2和维生素C对L.plantarum NCU001929的生长有促进作用,其中维生素C的促生长效果最佳,所以选取维生素C进行浓度优化。如图6所示,维生素C质量浓度过高对L.plantarum NCU001929有抑制作用,因此选择20 mg/L的维生素C作为生长因子的最优添加量,此时活菌数达到5.20×109 CFU/mL,是微量元素优化结果的1.07倍,较上一步实验活菌数提高效果不显著(P>0.05)。

图5 不同生长因子对L.plantarum NCU001929活菌数的影响
Fig.5 Effects of different growth factor on the viable count of L.plantarum NCU001929
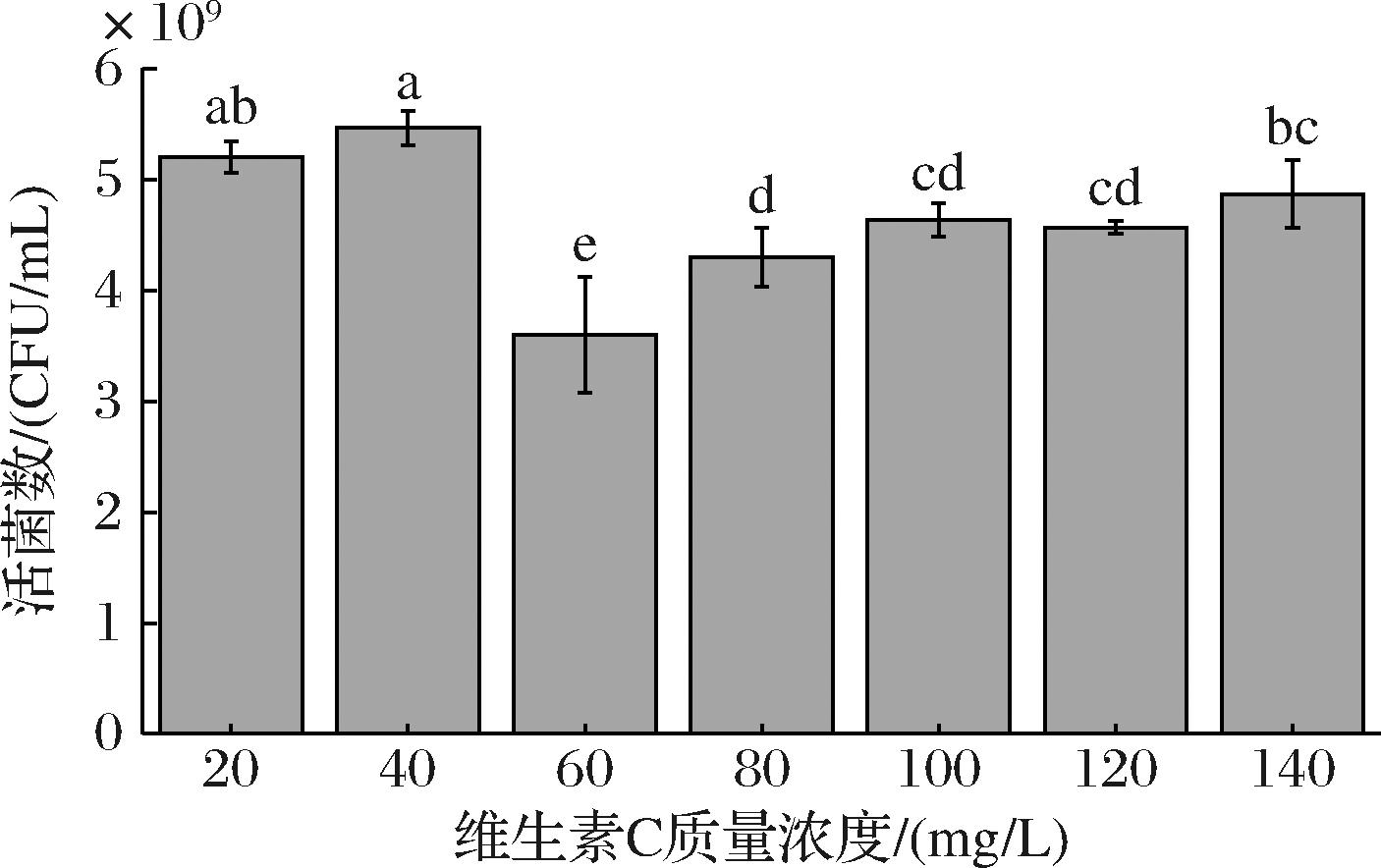
图6 维生素C质量浓度对L.plantarum NCU001929的影响
Fig.6 The effects of Vitamin C mass concentrations on viable count of L.plantarum NCU001929
2.2 Plackett-Burman实验
由单因素试验结果可知,碳源和氮源能显著提高L.plantarum NCU001929的活菌数,而微量元素和生长因子对L.plantarum NCU001929活菌数提高效果不显著(P>0.05),因此在接下来的实验中不考虑微量元素和生长因子的优化。实验因素及水平如表3所示,选择麦芽糖、牛肉浸粉、酵母提取粉、细菌学蛋白胨及MRS培养基中其他的营养成分(无水乙酸钠、柠檬酸三铵、吐温-80、K2HPO4)等8个因素进行考察。Plackett-Burman实验结果如表4,方差分析结果表明(表5),该模型P<0.05,R2=0.968 5,表明模型显著,相关性较好。其中麦芽糖、牛肉浸粉、酵母提取粉和柠檬酸三铵对L.plantarum NCU001929的生长影响最显著(P<0.05),因此选择麦芽糖、牛肉浸粉、酵母提取粉和柠檬酸三铵这4个因素进行最陡爬坡实验。其余因素为非显著因素,不作为后续实验的研究对象。
表3 Plackett-Burman实验因素与水平表
Table 3 Plackett-Burman experimental factors and levels
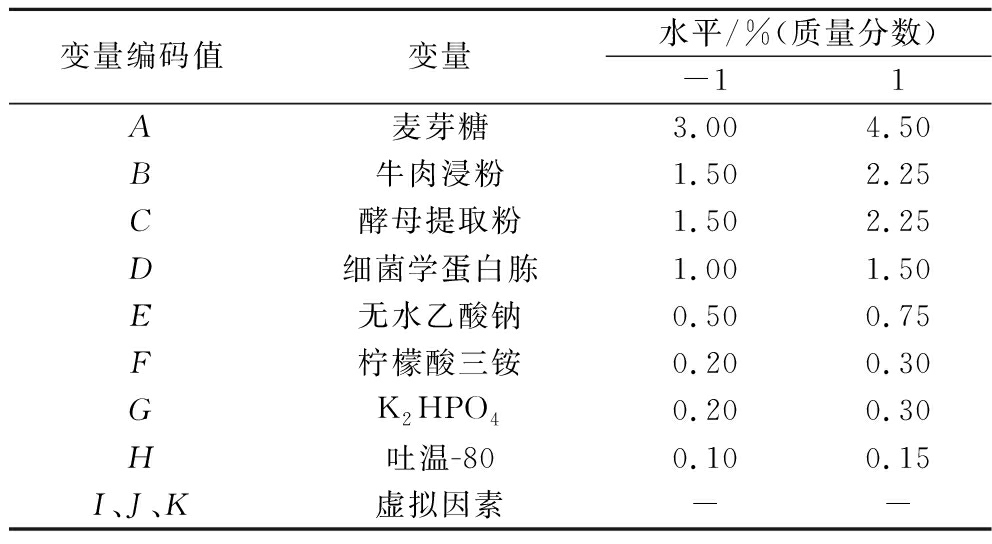
变量编码值变量水平/%(质量分数)-11A麦芽糖3.004.50B牛肉浸粉1.502.25C酵母提取粉1.502.25D细菌学蛋白胨1.001.50E无水乙酸钠0.500.75F柠檬酸三铵0.200.30GK2HPO40.200.30H吐温-800.100.15I、J、K虚拟因素--
表4 Plackett-Burman实验结果
Table 4 Plackett-Burman experimental results

试验号ABCDEFGHIJK活菌数/(CFU/mL)1 1 1-1 1 1 1-1-1-1 1-14.03×1092-111-1111-1-1-114.37×10931-111-1111-1-1-14.27×1094-11-111-1111-1-14.17×1095-1-11-111-1111-14.67×1096-1-1-11-111-11115.00×10971-1-1-11-111-1114.43×109811-1-1-11-111-114.40×1099111-1-1-11-111-13.97×10910-1111-1-1-11-1114.10×109111-1111-1-1-11-113.73×10912-1-1-1-1-1-1-1-1-1-1-14.63×109
表5 Plackett-Burman实验方差分析
Table 5 Variance analysis of Plackett-Burman experiment

变异来源响应值平方和自由度均方F值P值显著性模型4.31×1091.29×101881.61×101711.550.034 6*A-1.75×1083.68×101713.68×101726.400.014 3*B-1.42×1082.41×101712.41×101717.300.025 3*C-1.31×1082.05×101712.05×101714.690.031 3*D-9.72×1071.13×101711.13×10178.150.064 9E-8.06×1077.79×101617.79×10165.590.098 9F1.42×1082.41×101712.41×101717.300.025 3*G5.28×1073.34×101613.34×10162.400.219 0H2.50×1077.50×101517.50×10150.540.516 1
2.3 最陡爬坡实验
最陡爬坡实验是一种能够快速寻找各变量变化最优区域的方法。由PB实验可知,麦芽糖、牛肉浸粉、酵母提取粉对L.plantarum NCU001929的活菌数有显著的正效应,应该增加因素的水平;柠檬酸三铵对L.plantarum NCU001929的活菌数有显著的负效应,应该减少因素的水平。最陡爬坡实验设计及结果如表6所示,实验第4组的活菌数最高,即最陡爬坡实验拐点,因此选择第4组实验作为中心点进行接下来的响应面试验。
表6 最陡爬坡实验设计及结果
Table 6 Design and results of the steepest climbing experiment
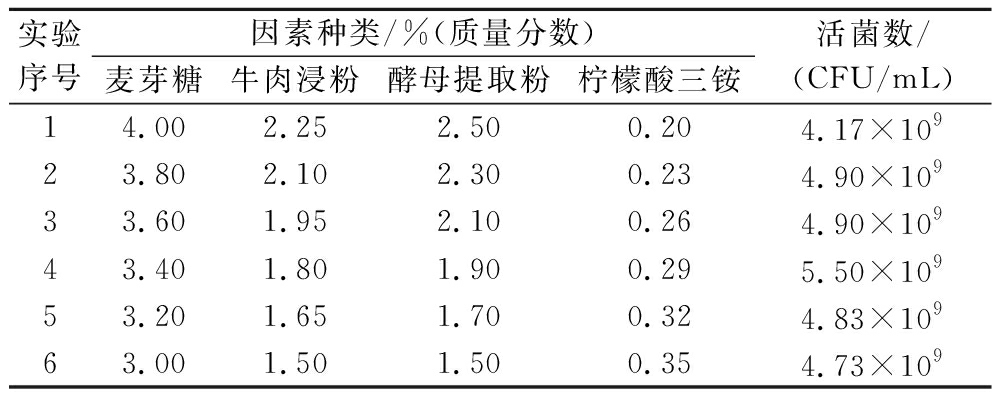
实验序号因素种类/%(质量分数)麦芽糖牛肉浸粉酵母提取粉柠檬酸三铵活菌数/(CFU/mL)14.002.252.500.204.17×10923.802.102.300.234.90×10933.601.952.100.264.90×10943.401.801.900.295.50×10953.201.651.700.324.83×10963.001.501.500.354.73×109
2.4 响应面实验
根据最陡爬坡实验结果,选取麦芽糖、牛肉浸粉、酵母提取粉和柠檬酸三铵4个因素,通过Box-Behnken实验获得这4个因素的最佳水平以及这些因素之间的相互作用[19],并进一步绘制等高线图及响应面图,从而探究这些因素对L.plantarum NCU001929生长的影响。实验设计见表7,结果如表8、表9所示。模型F值为11.69,表明模型显著;模型相关系数R2=0.921 2,表明模型可信度较好;而失拟度的F值为0.85,不显著,说明试验点均能用模型模拟。其中AD、BD、A2、B2、C2、D2是重要的显著项(P<0.05),说明麦芽糖与柠檬酸三铵、牛肉浸粉与柠檬酸三铵之间有显著的交互作用。根据Design Expert 10.0.7得到的回归分析结果,可以得到各因素添加量的交互作用图。图7是A(麦芽糖)与D(柠檬酸三铵)、B(牛肉浸粉)与D(柠檬酸三铵)之间的响应面图及等高线图,从图中可以看出,A与D、B与D的等高线图呈椭圆,且存在极点,说明A与D、B与D相互之间交互作用显著。根据Design Expert得到的回归分析结果,软件预测的显著因素的最优解组合为:麦芽糖34.36 g/L、牛肉浸粉17.40 g/L,酵母提取粉1.862 g/L,柠檬酸三铵2.80 g/L,对应的最大响应值为5.81×109 CFU/mL。对最优解组合进行验证实验,活菌数达到5.80×109 CFU/mL,与模型预测值的拟合率为99.83%,说明该模型能较好预测L.plantarum NCU001929活菌数的影响,此时,活菌数是单因素试验结果的1.12倍。
表7 响应面实验设计因子水平表
Table 7 Response surface experimental design factor level table

因子编码值因子水平/%(质量分数)-101麦芽糖A3.03.43.8牛肉浸粉B1.51.82.1酵母提取粉C1.51.92.3柠檬酸三铵D0.200.290.38
表8 响应面设计及结果
Table 8 Response surface design and results

实验序号麦芽糖牛肉浸粉酵母提取粉柠檬酸三铵活菌数/(CFU/mL)1 0 1 1 04.57×1092-10104.40×1093-11004.97×1094010-15.03×10950-1-105.40×109600005.80×10970-1015.00×109800114.77×1099-1-1005.00×1091000005.80×10911-100-14.60×1091201015.50×109131-1005.30×1091401-104.83×1091511005.07×10916100-15.17×1091700005.60×10918-10015.10×109190-10-15.36×1092010-104.57×1092100006.10×10922001-14.70×10923-10-104.77×1092400-114.57×1092510014.73×1092610104.80×109270-1104.53×1092800-1-14.90×1092900005.70×109
表9 BBD方差分析
Table 9 BBD variance analysis
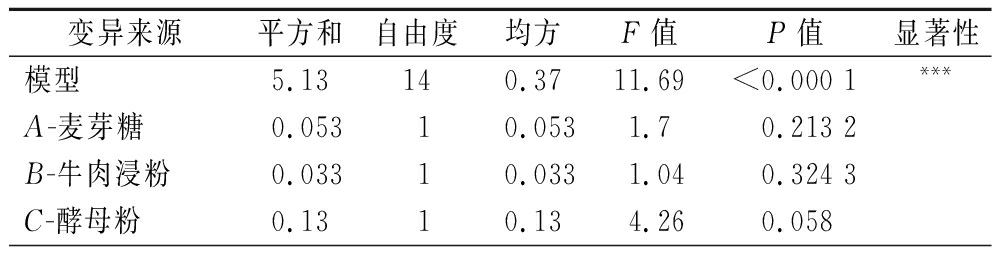
变异来源平方和自由度均方F值P值显著性模型5.13140.3711.69<0.000 1***A-麦芽糖0.05310.0531.70.213 2B-牛肉浸粉0.03310.0331.040.324 3C-酵母粉0.1310.134.260.058
续表9
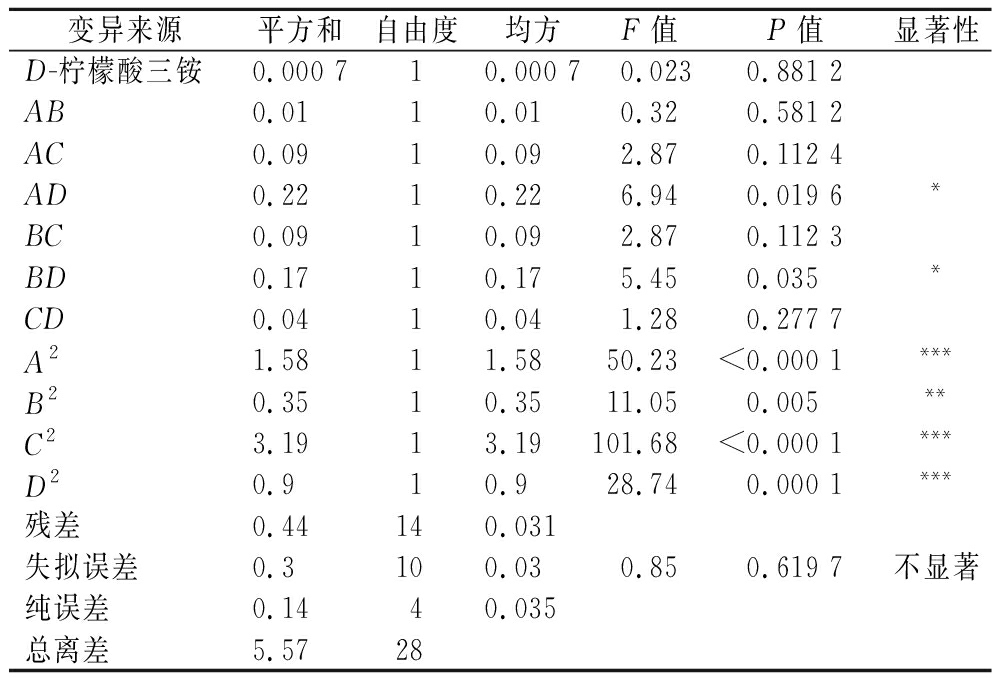
变异来源平方和自由度均方F值P值显著性D-柠檬酸三铵0.000 710.000 70.0230.881 2AB0.0110.010.320.581 2AC0.0910.092.870.112 4AD0.2210.226.940.019 6*BC0.0910.092.870.112 3BD0.1710.175.450.035*CD0.0410.041.280.277 7 A21.5811.5850.23<0.000 1***B20.3510.3511.050.005**C23.1913.19101.68<0.000 1***D20.910.928.740.000 1***残差0.44140.031失拟误差 0.3100.030.850.619 7不显著纯误差 0.1440.035总离差 5.5728

图7 因素交互作用响应面图及相应的等高线图
Fig.7 Factor Interaction response surface and corresponding contour map
2.5 静态培养条件优化
初始pH、温度和接菌量对活菌数都有一定的影响。合适的pH有利于保持微生物细胞膜的完整性,过酸或过碱对乳酸菌生长产生不利影响。当温度过低时,乳酸菌代谢缓慢,菌体生长受到抑制;而温度过高可能会导致乳酸菌的蛋白质活力、酶活力和细胞膜流动性受损,不利于菌体的生长[20]。当初始接种量过高时,菌体生长速度较快,营养物质消耗过快,产生过多的代谢产物,在一定程度抑制菌体生长[21]。在响应面实验优化的基础上进行静态培养条件优化,静态培养单因素试验结果如图8-a所示,当接种量为2%(体积分数)时,活菌数最高。pH单因素试验结果如图8-b所示,活菌数呈现先上升后下降的趋势,培养基的初始pH值为7时活菌数最高。温度单因素试验结果如图8-c所示,最终活菌数呈现先上升后下降的趋势,培养基的初始温度为30 ℃时活菌数最高。综上,当接种量2%,pH值为7,温度30 ℃,静态培养条件最佳,此时活菌数为6.40×109 CFU/mL,是响应面实验结果的1.10倍。
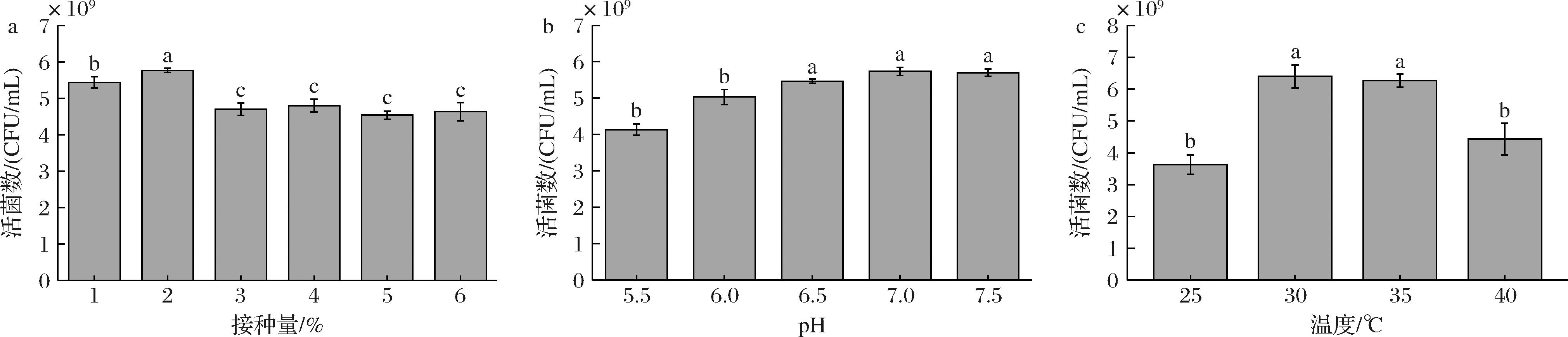
a-接种量;b-pH;c-温度
图8 不同静态培养条件对L.plantarum NCU001929活菌数的影响
Fig.8 Effects of different static culture on the viable count of L.plantarum NCU001929
2.6 发酵罐工艺优化
在静态培养优化的基础上,对L.plantarum NCU001929进行发酵罐放大培养,通过改变转速,气体环境和挑选合适的中和剂控制pH等对L.plantarum NCU001929的培养进行进一步优化。搅拌可以使菌体与培养液中的营养物质与气体充分接触,影响菌体的生长[21]。发酵罐工艺优化结果见图9。由图9-a可知,L.plantarum NCU001929活菌数随着转速的增加先升高后降低,当转速为150 r/min时活菌数最高,为8.6×109 CFU/mL。乳酸菌为厌氧或兼性厌氧微生物,厌氧环境利于大部分乳酸菌的生长,但是部分菌株具有一定的氧耐受能力,所以改变气体环境可能会影响乳酸菌的生长[22]。由图9-b可知,通入无菌空气时对L.plantarum NCU001929的增殖效果最好,此时活菌数为8.6×109 CFU/mL,N2次之,CO2对L.plantarum NCU001929的增殖效果最差。乳酸菌产生的有机酸和H+能抑制乳酸菌的生长,但可通过流加中和剂维持培养液恒定的pH,可较好的解除酸根抑制[23]。由图9-c可知,当pH值为7时活菌数最高,为1.17×1010 CFU/mL。改变中和剂的种类,由图9-d可知25%质量分数NaOH对L.plantarum NCU001929的增殖效果最好,活菌数达到了1.32×1010 CFU/mL,25%质量分数氨水次之,25%质量分数Na2CO3对L.plantarum NCU001929的增殖效果最差。综上,选择发酵罐转速为150 r/min,最佳气体为无菌空气,发酵罐恒pH值为7.0,以25%质量分数的NaOH作为中和剂,在此条件下工艺参数最佳,活菌数可达到1.32×1010 CFU/mL,是静态培养实验结果的2.06倍。
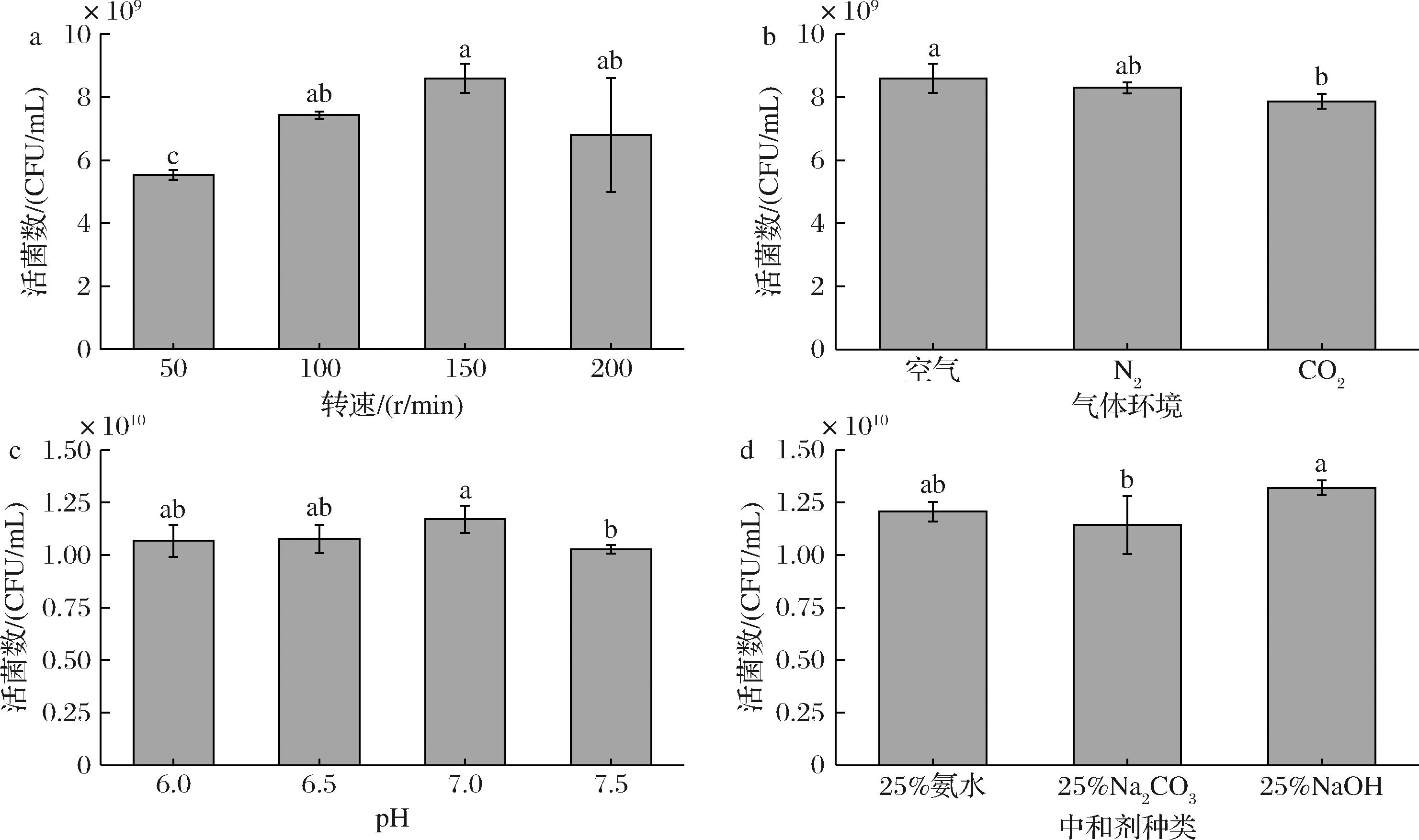
a-转速;b-气体环境;c-pH;d-中和剂种类
图9 不同发酵罐工艺条件对L.plantarum NCU001929活菌数的影响
Fig.9 Effects of the optimal process parameters for fermentation tanks on the viable count of L.plantarum NCU001929
3 结论
本研究通过对L.plantarum NCU001929的高密度发酵配方及发酵工艺条件进行优化。根据实验结果,最佳的培养基成分为麦芽糖34.35 g/L、牛肉浸粉17.40 g/L,酵母提取粉18.62 g/L,柠檬酸三铵2.80 g/L,细菌学蛋白胨10.00 g/L,MnSO4·H2O 0.06 g/L,无水乙酸钠3.00 g/L,维生素C 0.02 g/L,吐温-80 1 mL/L,K2HPO4 2.00 g/L;静态培养最佳条件为接种量2%(体积分数),pH值为7,温度30 ℃,此时活菌数为6.40×109 CFU/mL,是MRS培养基的4.81倍;发酵罐最佳工艺条件为转速150 r/min,通入无菌空气,维持发酵罐pH值为7.0,以25%质量分数的NaOH作为中和剂,活菌数可达到1.32×1010 CFU/mL;是MRS培养基的9.92倍。
[1] SEKHAVATIZADEH S S, POURAKBAR N, GANJE M, et al.Physicochemical and sensory properties of probiotic yogurt containing Lactobacillus plantarum ATCC 10241 microencapsulated with okra (Abelmoschus esculentus) mucilage and sodium alginate[J].Bioactive Carbohydrates and Dietary Fibre, 2023, 30:100364.
[2] SHI F F, WANG L, LI S R.Enhancement in the physicochemical properties, antioxidant activity, volatile compounds, and non-volatile compounds of watermelon juices through Lactobacillus plantarum JHT78 fermentation[J].Food Chemistry, 2023, 420:136146.
[3] DA SILVA SABO S, VITOLO M, GONZ LEZ J M D, et al.Overview of Lactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J].Food Research International, 2014, 64:527-536.
LEZ J M D, et al.Overview of Lactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J].Food Research International, 2014, 64:527-536.
[4] 胡昌辉. Lactobacillus plantarum P1对食源性致病菌抑菌效果及邻苯二甲酸酯吸附功能的研究[D].广州:华东理工大学, 2019.HU C H.Study on the antibacterial effect of Lactobacillus plantarum P1 on foodborne pathogenic bacteria and the adsorption function of phthalates[D].Guangzhou:East China University of Science and Technology, 2019.
[5] NAMI Y, ABDULLAH N, HAGHSHENAS B, et al.A newly isolated probiotic Enterococcus faecalis strain from vagina microbiota enhances apoptosis of human cancer cells[J].Journal of Applied Microbiology, 2014, 117(2):498-508.
[6] 何扬波, 李咏富, 钟定江, 等.红酸汤直投式发酵剂制备及其发酵效能分析[J].食品科技, 2023, 48(1):22-28.HE Y B, LI Y F, ZHONG D J, et al.Preparation and fermentation efficiency analysis of directed vat set for red sour soup[J].Food Science and Technology, 2023, 48(1):22-28.
[7] LI C, NIE S P, ZHU K X, et al. Lactobacillus plantarum NCU116 fermented carrot juice evokes changes of metabolites in serum from type 2 diabetic rats[J]. Food Research International, 2016, 80: 36-40.
[8] 柴利平. 动物双歧杆菌高密度培养及高活性冻干菌粉制备的研究[D]. 哈尔滨:哈尔滨商业大学,2023.CHAI L P. Study on high-density culture of bifidobacterium animalis and preparation of highly survival rate lyophilized bacteria powder[D]. Harbin: Harbin University of Commerce, 2023.
[9] 熊涛, 黄锦卿, 宋苏华, 等. 植物乳杆菌发酵培养基的优化及其高密度培养技术[J]. 食品科学, 2011, 32(7):262-268.XIONG T, HUANG J Q, SONG S H, et al. Lactobacillus plantarum: Optimization of fermentation medium and investigation of high-density culture methods[J]. Food Science, 2011, 32(7):262-268.
[10] 孙雨佳, 黄辉, 刘长根, 等.植物乳杆菌NCU137培养基成分与培养条件的优化[J].中国食品学报, 2022, 22(8):223-233.SUN Y J, HUANG H, LIU C G, et al.Optimization of medium composition and culture conditions of Lactobacillus plantarum NCU137[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(8):223-233.
[11] 董安利. 乳酸乳球菌乳酸亚种BL19的高密度培养研究[D].呼和浩特:内蒙古农业大学, 2019.DONG A L.Study on high density culture of Lactococcus lactis subsp.lactis BL19[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[12] 吴军林, 柏建玲, 莫树平, 等.高浓度培养乳酸菌发酵培养基的优化[J].食品工业科技, 2018, 39(9):96-101.WU J L, BAI J L, MO S P, et al.Optimization of fermentation medium of lactic acid bacteria cultured in high concentration[J].Science and Technology of Food Industry, 2018, 39(9):96-101.
[13] 金玉洁, 何国庆.植物乳杆菌ZU018增殖培养基的优化[J].食品工业科技, 2020, 41(14):94-100.JIN Y J, HE G Q.Optimization of Lactobacillus plantarum ZU018 proliferation medium[J].Science and Technology of Food Industry, 2020, 41(14):94-100.
[14] LAI C, CAO Y, YANG Y, et al.Fermentation kinetics and high density culture studies of Lactobacillus plantarum[J].Food and Fermentation Industries, 2022, 48(20):137-144.
[15] ASPMO S I, HORN S J, EIJSINK V G H.Use of hydrolysates from Atlantic cod (Gadus morhua L.) viscera as a complex nitrogen source for lactic acid bacteria[J].FEMS Microbiology Letters, 2005, 248(1):65-68.
[16] 张国柱, 宫俊峰, 赵玉明, 等.植物乳杆菌高密度发酵[J].食品工业, 2022, 43(10):144-147.ZHANG G Z, GONG J F, ZHAO Y M, et al.High-density fermentation of lactobacillus plantarum[J].The food Industry, 2022, 43(10):144-147.
[17] DONG Z X, GU L, ZHANG J, et al.Optimisation for high cell density cultivation of Lactobacillus salivarius BBE 09-18 with response surface methodology[J].International Dairy Journal, 2014, 34(2):230-236.
[18] CHENG X, DONG Y, SU P, et al.Improvement of the fermentative activity of lactic acid bacteria starter culture by the addition of Mn2+[J].Applied Biochemistry and Biotechnology, 2014, 174(5):1752-1760.
[19] WANG T, LU Y Y, YAN H, et al.Fermentation optimization and kinetic model for high cell density culture of a probiotic microorganism:Lactobacillus rhamnosus LS-8[J].Bioprocess and Biosystems Engineering, 2020, 43(3):515-528.
[20] 左梦楠, 刘伟, 张菊华, 等.发酵乳杆菌BLHN3的高密度培养优化[J].食品与机械, 2022, 38(12):181-189.ZUO M N, LIU W, ZHANG J H, et al.Optimization of high density culture of Lactobacillus fermentum BLHN3[J].Food &Machinery, 2022, 38(12):181-189.
[21] 李娜. 植物乳杆菌ZJ316的高密度发酵及高活性菌制剂的初步研究[D].南宁:广西大学, 2020.LI N.High-density fermentation of Lactobacillus plantarum ZJ316 and preliminary study on its preparation with high activity[D].Nanning:Guangxi University, 2020.
[22] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律[D].无锡:江南大学, 2017.CUI S M.Influencing factors and laws of growth inhibition and freeze-drying survival of lactic acid bacteria[D].Wuxi:Jiangnan University, 2017.
[23] 孙媛媛, 崔树茂, 唐鑫, 等.发酵乳杆菌的生长限制性因素分析及高密度培养工艺优化[J].食品与发酵工业, 2021, 47(6):1-10.SUN Y Y, CUI S M, TANG X, et al.Growth limiting factors of Lactobacillus fermentum and optimization of its high-density cultivation[J].Food and Fermentation Industries, 2021, 47(6):1-10.