果蔬因其种类繁多、色泽鲜艳、风味独特、营养丰富而广受消费者喜爱。然而,果蔬具有较强的季节性和区域性,在采后贮运过程中进行着以呼吸代谢为主的生理代谢活动,导致自身营养物质的消耗和品质的劣变,严重影响食用和商业价值,造成严重的经济损失。低温贮藏技术因其可以有效降低果蔬的呼吸强度,减缓采后果蔬的生理代谢活动,延缓自身营养物质的消耗,抑制病原菌的生长,使其成为采后果蔬保鲜最有效的措施[1]。然而,许多热带和亚热带果蔬属于冷敏性果实,在不适宜的低温环境中长期贮藏会导致果蔬的细胞结构受损、营养成分流失、新陈代谢失调及抗逆能力下降,最终引发果实的风味劣变、后熟能力丧失,果实表面组织出现水渍状斑点、凹陷变色、果肉组织发生褐变等冷害(chilling injury,CI)症状,严重影响果实的质地、风味及营养价值[2]。随着冷链物流的高速发展,冷害所造成的损失高达亿元[3],因此低温贮运中冷害问题已成为制约我国果蔬产业发展的关键因素,如何有效控制采后果蔬低温贮藏期间冷害的发生和品质的维持已成为果蔬采后研究重点和热点。
甘氨酸甜菜碱(glycine betaine,GB)即N-N-N-三甲基甘氨酸,于19世纪在甜菜汁中被首次发现[4],是一类天然存在于植物中的两性季铵型水溶性生物碱,其分子式为C5H11NO2,分子质量为117.15 Da,沸点为218.95 ℃,熔点为310 ℃,稳定性高,易吸潮,极易溶于水,难溶于乙醚[4]。目前GB的主要制备方法包括植物提取和化学合成。植物提取法通常是从甜菜及其加工的副产品中分离提取生产;化学合成法是以三甲胺和氯乙酸为原料,经过重结晶等方法分离提纯制得,属于植物天然等同物[5]。由于化学合成法的低成本、不受季节限制、产量产率高等优点使其应用更为广泛。GB具有一个非极性碳氢基团、一个可结合阴离子的氨基和结合阳离子的羧基,在较大生理pH范围内可始终保持电中性,其独特的分子结构赋予了其高溶解、低黏度以及兼具极性和非极性的特点,可以作为分子伴侣稳定酶、蛋白质和膜脂的结构和功能,同时还可以起到渗透剂的作用稳定细胞质的pH和渗透压,以及作为胁迫及之后的恢复阶段的潜在的碳源和氮源,从而参与到植物的生长发育、次生代谢和非生物胁迫的防御反应中[6-7]。近年来研究表明,GB作为天然植物的成分,具有安全绿色、无毒无污染的优势,外源施用GB可以有效延缓采后果蔬冷害症状的发生,并在李子[8]、香蕉[9]、梨[10]、桃[1]、木瓜[11]、青椒[12]等多种果蔬中得到广泛研究。目前,对于GB在采后果蔬冷害控制中的功能及作用机制缺乏系统全面的阐述。因此,本文围绕GB的生物合成,在采后果蔬冷害控制中的应用形式及研究进展,冷害的调控机制等方面进行综述,以期为采后果蔬冷害控制提供理论依据和实践参考。
1 植物GB的生物合成
GB存在于多种生物中,包括原核生物、真核微生物、高等植物和动物中。已知的生物系统中GB合成途径有3种,其中存在于植物中的生物合成只有胆碱氧化一种途径。在高等植物中GB的合成主要发生在叶绿体基质中,其以胆碱为底物,经胆碱单加氧酶(choline monooxygenase,CMO)催化生成甜菜碱醛,继而被甜菜碱醛脱氢酶(betaine aldehyde dehydrogenase,BADH)催化生成GB(图1)。CMO和BADH是植物甜菜碱合成的关键酶,其活性对GB的合成积累意义重大,其中CMO是仅存在于植物中的一种加氧酶。GB在植物体内是稳定的,其合成而非降解是影响其积累的关键因素[13-14]。此外,GB的积累受逆境胁迫条件的调控,且积累浓度与抗逆水平相关。当植物受到逆境胁迫时,GB在植物体内快速积累,进而维持植物细胞渗透压,稳定生物大分子的结构和功能,在保护蛋白质和酶的功能、调控胁迫反应等方面发挥着重要作用[15-16]。
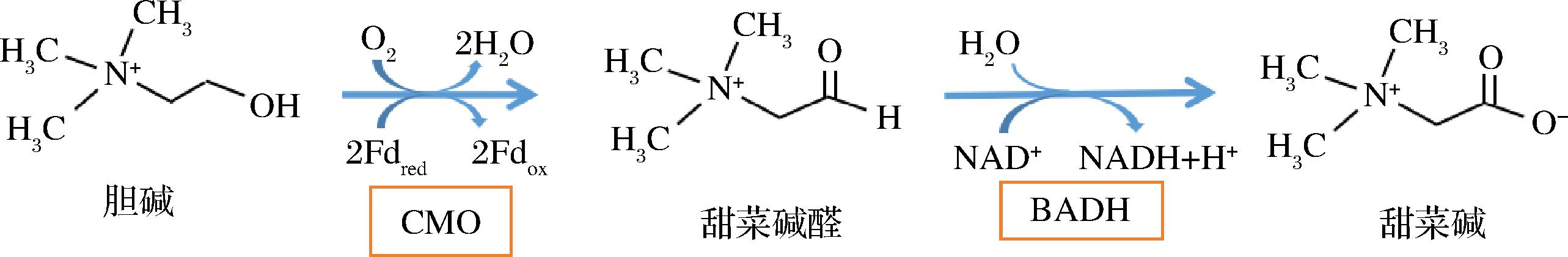
图1 植物中GB的主要合成途径[16]
Fig.1 The main synthetic pathways of GB in plants
2 外源GB在果蔬冷害控制中的研究进展
低温贮藏可以有效降低采后果蔬的呼吸速率和新陈代谢,抑制病原菌的生长,延缓果蔬病害的发生,对于延长果蔬采后货架期、保持品质具有重要意义。然而,长期的低温贮藏容易导致冷敏性果蔬CI症状的发生,对果蔬的品质造成不利影响。果蔬的CI症状与程度因其品种而异,越来越多的研究表明施用外源GB可以有效缓解果蔬在长期低温贮藏中的CI症状,维持果蔬采后的贮藏品质。同时,研究表明GB的浓度是影响采后果蔬冷害控制效应的重要因素,在不同果蔬之间所使用GB浓度不尽相同。目前,多数果蔬的GB最佳使用浓度范围在5~20 mmol/L间[1,8,10-11,17-18],少数果实如香蕉采用较高的GB浓度(150 mmol/L)进行处理[19],但鲜有报道表明GB对采后果蔬冷害的控制具有副作用。
2.1 外源GB在冷藏水果中的应用
香蕉、番木瓜、石榴等浆果类水果主要产于热带地区,长期低温贮藏会导致果实出现果皮凹陷、褐变、失去香气并产生异味等冷害症状[9,11,20]。研究发现利用100 mmol/L GB浸泡香蕉果实后,有效地提高了果实的抗氧化能力,减轻了冷藏香蕉的果皮褐变和点蚀现象[9]。类似的,在采前香蕉叶片上采用GB喷雾处理延缓了低温诱导的果实表皮褐变现象,有效降低采后香蕉果实贮藏中的CI症状[19]。SANAZ等[20]报道,采后用10和20 mmol/L GB处理石榴果实均能有效缓解果实表面的凹陷及褐变,维持石榴果实中较高的总酚、类黄酮和花青素含量,且20 mmol/L处理效果更佳。PAN等[11]利用15 mmol/L GB处理番木瓜发现其可以有效延缓果皮凹陷症状的发生,抑制果实相对电导率和丙二醛含量的上升。
常见的核果类水果主要有李、樱桃、桃等果实,其在低于10 ℃的条件下贮藏2~3周后会发生冷害症状,主要表现为果肉褐变、木质化或者絮败、丧失后熟能力[8,21-22]。单体敏等[22]研究发现外源不同浓度(5、10和20 mmol/L)的GB处理均能够有效抑制(0±1) ℃贮藏期间‘雨花2号’桃果实果肉的褐变,减轻冷害症状,且以10 mmol/L GB处理效果最为显著,相似的结果在‘湖景蜜露’桃果实上得到验证[23]。此外,果实风味和丰富的汁液是消费者评价桃果实品质的重要标准,经过GB处理后‘湖景蜜露’果实维持了较高的可溶性固形物、有机酸和游离氨基酸的含量,其风味品质更佳[24];同样GB处理延缓了‘雨花二号’果实出汁率的下降,维持了果实柔软多汁的特性[25]。多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)可以将酚类化合物氧化为棕色的醌或奎宁类化合物,并最终导致果实褐变的发生。外源GB处理‘雨花二号’桃果实后发现其有效抑制了PPO和POD活性,减轻了桃果实内部褐变[1]。MAHMOUDI等[8]利用GB制作可食用涂料,对李果实进行包衣处理,发现GB延缓了李在低温贮藏中果实失重和组织软化现象的发生。同样,采前施用外源GB也可以减轻采后贮藏期间核果的冷害症状。LI等[21]研究表明,采前4 g/L GB喷洒有效减轻‘Lapins’和‘Regina’两种樱桃采后贮藏期间果皮凹陷和花梗的褐变,维持果实的品质。
仁果类水果如梨、山楂、枇杷等果实在长期的低温贮藏期间会出现果皮点蚀、香味衰减、果实软化腐烂等现象[26-28]。SUN等[26]用10 mmol/L GB溶液浸泡‘Nanguo’梨果实明显减轻了其果实香气损失,减缓了‘Nanguo’梨的冷害症状。RAZAYI等[27]用外源GB(10 mmol/L)处理可以提高山楂果实抗氧化酶活性,促进抗氧化物质的积累,抑制贮藏期间活性氧自由基的积累,从而减轻果实的冷害,维持山楂的营养品质。ZHANG等[28]采用热水、GB(10 mmol/L)及复合(热水结合GB)处理枇杷果实,结果发现不同处理均能有效减轻低温对果实的伤害,抑制果实褐变的发生,且以复合处理效果最佳。
2.2 外源GB在冷藏蔬菜中的应用
辣椒、黄瓜、西葫芦等蔬菜具有较高的经济价值,但这类蔬菜多属喜温性,在采后的长期低温贮藏过程中易出现组织褐变、茎木质化、尖端软化、水浸、凹陷和麻点等冷害症状[12,29-32]。WANG等[12]研究表明外源1 mmol/L GB通过诱导提高抗氧化相关基因的表达及酶的活性,进而增强辣椒果实的耐冷性,维持果实贮藏期间的品质。张海英等[29]探索了不同浓度(5、10、15 mmol/L)GB对‘中农8号’黄瓜低温贮藏过程中冷害发生的影响,结果表明10 mmol/L GB处理效果最佳,且GB处理可以通过增加渗透调节物质含量,维持细胞膜通透性,抑制果实冷害的发展,类似的结果出现在‘乾德1217’黄瓜中[30],且GB与褪黑素的复合使用效果优于单一处理。西葫芦是典型的冷敏性蔬菜,低温贮藏期间冷害发展迅速。姚文思等[31]研究表明10 mmol/L GB处理能有效抑制西葫芦果皮凹陷及叶绿素的降解,维持果实的抗氧化能力,从而抑制果实冷害的发展。张苗等[32]进一步研究发现采用冷激复合GB处理的西葫芦,可以维持果实贮藏期间较高的能荷水平,增强了西葫芦果实的抗冷性和贮藏保鲜的效果。
表1 外源GB在控制果蔬冷害中的应用
Table 1 Application of GB in controlling chilling injury of fruits and vegetables

种类物种处理时期GB浓度处理方法处理时间贮藏温度与时间参考文献水果浆果类核果类仁果类香蕉血橙石榴番木瓜桃李樱桃梨山楂枇杷采后0,50,100,150 mmol/L单一浸泡10 min7 ℃/7 dCHEN等[9]采前150 mmol/L单一喷雾/10 ℃/6 h转23 ℃/8 dRODRÍGUEZ-ZAPATA等[19]采后15,30 mmol/L30 kPa真空渗透8 min3 ℃/90 dHABIBI等[33]采后0,10,20 mmol/L单一浸泡20 min4 ℃/90 dSANAZ等[20]采后15 mmol/L单一浸泡10 min6 ℃/40 d袁梦麒等[17]采后15 mmol/L单一浸泡10 min6 ℃/40 dPAN等[11]采后5,10,20 mmol/L单一浸泡5 min0 ℃/35 d单体敏等[22]采后10 mmol/L单一浸泡10 min0 ℃/35 dSHAN等[34]采后10 mmol/L单一浸泡10 min0 ℃/35 dWANG等[1,25,35];王莉[36]采后10 mmol/L单一浸泡10 min0 ℃/35 d王懿等[23][37]采后10 mmol/L单一浸泡10 min0 ℃/35 dJIA等[24]采后5 mmol/L与壳聚糖复合涂膜/1 ℃/40 dMAHMOUDI等[8]采前4 g/L单一喷雾/0 ℃/28 dLI等[21]采后10 mmol/L单一浸泡10 min0 ℃/120 dWANG等[38]采后10 mmol/L单一浸泡10 min0 ℃/120 d转常温12 dLUO等[10,39]采后10 mmol/L单一浸泡15 min0 ℃/120 dSUN等[26]采后0,10,20 mmol/L单一浸泡10 min1 ℃/20 dRAZAVI等[27]采后5~15 mmol/L单一/与40~50 ℃热水复合浸泡处理5~10 min1 ℃/35 d张瑜[18]采后10 mmol/L单一/与45 ℃热水复合浸泡处理20 min1 ℃/35 dZHANG等[28]蔬菜黄瓜辣椒西葫芦采后5,10,15 mmol/L单一浸泡15 min4 ℃/14 d张海英等[29]采后9 mmol/L单一/与106 μmol/LMT复合13 min4 ℃/15 d骆思铭[30]采后1 mmol/L单一浸泡20 min3 ℃/16 dWANG等[12]采后10 mmol/L单一浸泡15 min1 ℃/15 dYAO等[40]采后5,10,15,20 mmol/L单一浸泡15 min1 ℃/15 d姚文思等[31]采后10 mmol/L单一/与0 ℃冰水复合浸泡处理30 min4 ℃/12 d张苗等[32]
3 GB诱导果蔬采后抗冷性的机制
近年来,对外源GB在果蔬抵抗低温胁迫中的作用及机制、信号传导途径等方面的研究已取得重大进展,归纳如下:
3.1 参与渗透调节
果蔬组织在遭受低温胁迫时会发生细胞渗透压失调及氧化损伤等生理伤害,而渗透保护物质的合成和积累则是果蔬响应低温胁迫的重要机制之一[1]。研究表明,外源GB可以诱导渗透调节物质的合成和积累,进而提高果蔬组织的抗冷性。目前,果蔬组织常见的渗透保护物质包括GB、脯氨酸、多胺(腐胺、精胺和亚精胺)、γ-氨基丁酸(γ-aminobutyric acid,GABA)及蔗糖等。GB本身作为一种非毒性渗透调节物质,在果蔬组织中以较稳定的形式存在,其在抗低温胁迫中发挥着渗透调节、维持蛋白质结构和功能的重要作用。SHAN等[34]研究表明当果实组织面临低温胁迫时,BADH酶活性被诱导,促进GB合成和积累来维持细胞的渗透势,而外源GB处理则进一步诱导提高了细胞内源GB的含量,减轻了低温对细胞的伤害。MAHMOUDI等[8]研究发现不论是单一的GB处理或者是GB复合壳聚糖涂膜处理均诱导提高冷藏期间李果的内源GB含量,且内源GB的积累受外源GB处理浓度的调控,外源GB处理浓度越高,内源GB的积累越多,有效保护了低温贮藏期间细胞的结构和功能,从而提高其抗冷性,延长贮藏期,类似的结果在石榴[20]中得到验证。此外,研究发现将GB合成相关基因(胆碱氧化酶,cod A)转入马铃薯质体基因组中,该基因编码COD催化胆碱转化为GB,进而提高了转基因马铃薯对低温胁迫的耐性[41]。
脯氨酸作为细胞内重要的生物活性成分,其积累可维持植物细胞蛋白完整性,稳定细胞膜和线粒体之间的电子转移,维持细胞膜的流动性和稳定性[34];GABA作为植物组织的次级代谢产物,具有稳定亚细胞结构、保护细胞的功能,同时可以参与逆境胁迫应答以及机体的信号传递等;而多胺是组织中具有生物活性的一类低分子质量脂肪族含氮碱,与果实采后细胞膜完整性、细胞壁紧密性及抗逆性密切相关。这些渗透保护剂在低温逆境中不仅起到渗透调节作用,还具有抗氧化性,稳定胞质pH,以及维持蛋白质结构和功能完整的作用[42]。SHAN等[34]研究发现,外源GB处理通过提高脯氨酸合成相关酶[吡咯啉-5-羧酸合成酶(pyrroline-5-carboxylate synthase,P5CS)和鸟氨酸D-转氨酶(ornithine aminotransferase, OAT)]的活性及降低降解相关的脯氨酸脱氢酶(pyruvate dehydrogenase complex,PDH)的活性来调节脯氨酸代谢,促进枇杷果实脯氨酸含量的积累,进而提高果实的耐冷性。ZHANG等[28]研究发现,外源GB处理还可以通过提高谷氨酸脱羧酶(glutamate decarboxylase,GAD)的活性来促进枇杷果实GABA含量的积累,延缓果实冷害的发生。JIA等[24]进一步研究发现外源GB处理诱导提高了多胺合成相关精氨酸脱羧酶(arginine decarboxylase,ADC)和鸟氨酸脱羧酶(ornithine decarboxylase,ODC)活性,抑制降解相关二胺氧化酶(diamine oxidase,DAO)和多胺氧化酶(polyamine oxidase,PAO)活性,激活了多胺生物合成途径而抑制了分解代谢途径,促进了腐胺、精胺和亚精胺的积累,从而减轻低温逆境下桃果实的生理损伤。类似的结果在外源GB处理的西葫芦[40]、黄瓜[29]等果实中发现。此外,蔗糖在低温胁迫条件下的积累不仅作为能量代谢的底物,同时还作为渗透缓冲剂和低温防护剂发挥重要作用。采用外源GB处理桃和梨果实[36,38],可以提高蔗糖的含量,进而减轻果实的冷害症状。
3.2 维持细胞膜完整性
细胞膜是维持细胞生命活动及分隔细胞与环境的第一道屏障[43]。采后果蔬的冷害与细胞膜脂质过氧化、脂肪酸饱和指数增加、磷脂降解等密切相关,导致细胞膜由液晶相逐步转变为凝胶相,阻碍了细胞膜的正常功能,因此膜系统的结构和功能的完整性对于果蔬组织抵抗低温胁迫至关重要[1]。研究表明,在低温胁迫下,GB作为季铵类阳离子,可与膜外蛋白上的羧基阴离子相互作用,保护膜的完整性和有序性,同时还可以降低原生质膜相变的温度,减轻低温对细胞膜的伤害[44]。在梨果实的研究中发现,外源GB处理通过抑制参与不饱和脂肪酸和磷脂降解的脂氧合酶(lipoxygenase,LOX)与磷脂酶D(phospholipase D,PLD)活性,维持了较高的不饱和/饱和脂肪酸比率,从而诱导了采后梨果实的抗冷性[10]。WANG等[1]研究结果表明,桃果实中冷害的发生与棕榈酸和硬脂酸含量的增加及亚油酸和亚麻酸脂肪酸含量降低有关,而GB处理的果实抑制了LOX、PLD和脂肪酶基因的表达和酶的活性,维持了较低的饱和脂肪酸含量和较高的不饱和脂肪酸水平,进而维持了细胞膜的结构和功能,减缓了果实的冷害。同样GB处理显著抑制LOX活性并提高不饱和/饱和脂肪酸比例,从而减少了西葫芦果实的膜损伤[40]。这些研究表明,GB处理在维持采后果蔬细胞膜完整性和减少低温胁迫对膜的损伤方面发挥着重要作用。丙二醛(malondialdehyde,MDA)是不饱和脂肪酸氧化的终产物,电解质泄漏则反映细胞膜的损伤程度。研究表明,外源GB处理采后果蔬(如桃[37]、梨[10]、番木瓜[11]、山楂[27]、西葫芦[40]等)可提高果实的抗氧化系统,延缓细胞膜脂的氧化,有效抑制果蔬组织电解质渗漏水平和MDA含量的上升,减轻果实的冷害。
3.3 稳定抗氧化系统
当果蔬处于低温胁迫条件下时,果实组织内活性氧(reactive oxygen species,ROS)的产生和清除失衡,导致过量的ROS积累,致使生物大分子和膜脂遭受氧化损伤,进而导致植物组织出现代谢障碍和膜脂透性的改变,最终使组织遭受伤害。果蔬对低温导致的氧化应激具有一套复杂而精细的抗氧化系统来抵御和清除过量的ROS,此系统由酶促防御和非酶防御系统构成,与细胞的抗氧化能力紧密相关。酶促系统主要由抗氧化酶构成,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、POD及抗坏血酸-谷胱甘肽循环(ascorbate-glutathione,AsA-GSH)系统酶;非酶促系统则由具有抗氧化能力的生物活性物质组成,如AsA、GSH、维生素E、多酚和类胡萝卜素等[45]。大量的研究表明,外源GB处理可以通过调节酶促和非酶防御系统,消除过量积累的ROS,从而提高采后果蔬的抗冷性。RAZAVI等[27]研究表明GB可以提高山楂果实的CAT、APX和SOD活性,促进AsA、酚类物质、黄酮类物质和花青素等抗氧化物质的积累,进而维持较低的H2O2含量,减轻了ROS的积累,延缓果实冷害的发生。SUN等[26]对梨果实进行研究,结果同样发现GB处理可通过提高抗氧化酶活性及其基因表达水平,降低果实中ROS的含量及冷害程度。其他在枇杷[28]、血橙[33]、甜椒[12]和西葫芦[40]等果蔬中的研究也发现了类似的结果。此外,AsA-GSH循环作为抗氧化系统重要组成部分,在果蔬抗冷进程中起到关键作用。王懿等[23]研究发现GB处理可通过增加APX、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase, MDHAR)、脱氢抗坏血酸酶(dehydroascorbate reductase,DHAR)和谷胱甘肽还原酶(glutathione reductase,GR)的活性及关键基因的表达,促进桃果实中AsA和GSH两种非酶抗氧化剂的再生,有效清除积累的H2O2,提高果实的抗氧化能力,增强桃果实的抗冷性。CHEN等[9]研究同样表明外源GB处理提高了总酚、GSH和AsA等抗氧化物质的积累,进而保护了香蕉果实在低温贮藏过程中免受氧化损伤。
3.4 调控物质代谢
酚类物质、黄酮类物质和花青素等果蔬次生代谢产物的积累能够增强果实的抗氧化和抗菌能力,提高果实的抗逆性[46]。研究发现石榴和山楂经GB处理之后,增加了果实中酚类化合物、类黄酮和花青素的积累,提高了果实对于ROS的清除能力,减轻了低温对石榴和山楂的胁迫[20,27]。WANG等[25]研究发现,外源GB处理提高了桃果实中苯丙烷代谢途径中关键酶苯丙氨酸解氨酶、肉桂酸羟化酶、4-香豆酸辅酶A连接酶和查尔酮异构酶的活性,促进了总酚和总黄酮的含量。此外,外源GB处理还提高了原儿茶素、儿茶素、绿原酸、新绿原酸、槲皮素-3-芸香糖苷、槲皮素-3-葡萄糖苷和山奈酚-3-芸香糖苷等酚类单体的积累水平,这些酚类化合物在组织面对低温响应中发挥着重要作用。槲皮素能够通过阻断环氧合酶和脂氧合酶途径来保护细胞免受氧化应激损伤;而儿茶素则具有强抗氧化性和抗菌性,可通过清除活性氧簇和ROS反应生成稳定化合物的方式使得活性氧自由基达到稳态平衡,从而提高了果实抵抗低温的能力[47]。
糖是植物生长发育的物质基础,果蔬中的糖不仅与风味和营养价值有关,也与能量代谢和细胞结构有关[38]。研究表明,较高水平的蔗糖有助于细胞膜稳定,增强桃果实的低温耐受性[25]。HABIBI等[33]研究发现GB处理血橙,保持了其较高的蔗糖、葡萄糖和果糖的浓度,对于延缓冷藏过程中糖含量的减少具有积极作用。WANG等[25]采用GB处理桃果实发现,其有效提高了蔗糖磷酸合酶和蔗糖合酶的活性,降低了蔗糖降解相关中性转化酶和酸性转化酶的活性,进而维持了较高的蔗糖含量,从而保护了低温胁迫下细胞结构的完整性。此外,研究还表明,较高的蔗糖含量在贮藏后期转化为果糖和葡萄糖,还可为酚类或黄酮类的生物合成提供底物,进而维持果实低温贮藏期间代谢底物的转化平衡,提高抗冷性[36]。
3.5 改善能量代谢
果蔬的生命代谢活动离不开能量的供应,而三磷酸腺苷(adenosine triphosphate,ATP)是驱动生命活动最有效、最直接的能量载体。在低温胁迫下,ATP合成能力减弱和能量供给匮乏引发线粒体的活性增强,导致过量的ROS积累而损伤生物膜的结构和功能,影响细胞正常的代谢活动。在番木瓜中,外源GB处理改善了能量状态,提高了能量代谢相关的H+-三磷酸腺苷酶、Ca2+-三磷酸腺苷酶、琥珀酸脱氢酶和细胞色素C氧化酶的酶活性,维持了较高的ATP、二磷酸腺苷和能量电荷水平,诱导了果实在低温贮藏过程中的耐冷性[11]。同样地,外源GB处理可以有效维持桃果实[34]和西葫芦[32]等果实中较高的ATP含量及能荷水平,而充足的ATP的供应为细胞的各类生理代谢提供能量,有助于维持低温胁迫下果实膜结构和功能的完整性,增强果实对低温的抗性。
3.6 增强转录因子表达和代谢调控
热激转录因子(Hsfs)作为植物中一类重要的转录调控因子,是植物防御反应的中心元件,在调控植物信号的转导以及应对非生物胁迫中起到至关重要的作用[48]。WANG等[35]研究发现,桃果实中含有17个Hsfs,根据N端的结合域、寡聚域之间氨基酸残基长度的大小被划分为A、B、C三类。低温诱导了PpHsfA1a,PpHsfA1b,PpHsfA2a,PpHsfB1a,PpHsfA4a,PpHsfA4b,PpHsfB2b和PpHsfC1a,表明这些转录因子可能在桃果实响应低温胁迫中起重要作用;而GB处理则诱导了PpHsfA1a、PpHsfA2a、PpHsfB2a/b、PpHsfC1a等的表达水平,且其中与PpHsfA1a/2a与PpAPX呈协同表达,这表明GB可能通过诱导提高PpHsfs转录水平来调控抗氧化基因的表达,进而抑制果实中过量活性氧的积累,提高果实的抗氧化能力,保护细胞结构的完整性,从而缓解冷藏期间果实CI的发展。此外,热激蛋白(Hsp)作为一类胁迫响应蛋白,在植物应对非生物胁迫中起到分子伴侣、维持蛋白质和细胞膜稳定性的重要作用[36]。进一步研究发现,外源GB处理促进了桃果实中Hsps的转录和表达,调控了PpsHsp17/18/22,PpHsp70s以及PpHsp90s家族基因的表达,同时通过蛋白组数据发现GB处理促进Hsp18/22/70含量的积累,从而起到保护细胞的作用[36]。
研究表明,GB可有效缓解低温贮藏期间果实香气的减弱。LUO等[10]发现GB处理调控了LOX途径中LOX(PuLOX1、PuLOX2、PuADH3)、乙醇脱氢酶(ADH,PuADH4、PuADH9)和醇酰基转移酶(AAT,PuAAT)基因的表达,诱导提高了LOX、ADH和AAT的活性,进而增强了梨果实低温贮藏期间的酯类物质合成水平,从而有效地改善了冷藏果实的品质。进一步的研究发现,GB通过提高CMO和BADH的活性和表达来增加GB的含量,上调与乙烯生物合成直接相关的基因(PuACO1、PuACO2和PuACS)和乙烯反应因子(PuERF2、PuERF109-like、PuERF071-like、PuERF015、PuERF114、PuRAV1-like和PuERF113-like),进而通过调控乙烯生物合成和信号转导来加速酯类的积累,从而维持冷藏后的货架期间梨果实的香气物质含量[39]。此外,GB在调控果蔬低温贮藏期间抗氧化系统和抗逆胁迫物质代谢失衡中发挥重要作用。JIA等[24]在桃果实的研究中发现,GB通过提高精氨酸代谢(PpARG)和GABA分流相关基因(PpADC、PpODC、PpOAT、PpGAD、PpGABA-T和PpSSADH)的表达,下调降低多胺降解途径中PpPAO基因表达,进而提高桃果低温贮藏的风味品质和耐寒性。王懿[37]研究表明,GB处理不仅调控桃果实氨基酸代谢(PpARG、PpADC、PpOAT、PpODC、PpGAD、PpGABA-T)基因的转录,同时还诱导了ASA-GSH循环相关基因(PpAPX、PpGR和PpMDHAR)的表达,从而缓解了冷害的发生,维持了果实的品质。类似地,在梨[26]、西葫芦[40]、香蕉[9]和甜椒[12]等果蔬中均发现GB处理对抗氧化代谢相关基因的调控作用。
4 展望
目前的研究表明外源GB处理采后果蔬能够有效缓解低温贮藏引起的冷害症状,并且通过参与渗透调节,维持细胞膜完整性,稳定抗氧化系统,调控物质代谢,改善能量代谢及增强转录因子表达调控等途径缓解果蔬冷害(图2),提高果实低温贮藏期间的品质和寿命。虽然目前GB在改善果蔬贮藏期间冷害的相关研究已取得了较为显著的成果,但其在诱导果蔬抗寒性的分子机制研究方面还不深入和全面,仍具有较大的探索空间。今后的研究需要更多地关注GB介导的分子转录调控机制,通过转录组筛选关键转录因子,利用分子生物学和生物信息学以及结合组学相关技术(如转录组、代谢组、蛋白组等)进行深入探究;同时可以利用基因沉默或基因编辑技术对GB合成、代谢或信号转导过程的关键因子进行进一步的研究,这将有助于深入揭示GB调控果蔬抗冷性的机制。此外,后期仍需探索开发GB与其他物理及生物方法的复合使用技术,将其融入前期预处理和保鲜设备中,拓宽其商业化应用途径,从而有效控制采后果蔬低温贮藏期间冷害的发生及减轻我国果蔬产业发展因冷害造成的经济损失。

图2 GB参与缓解果蔬采后冷害的代谢途径
Fig.2 Metabolic pathways of GB involved in alleviating postharvest chilling injury in fruits and vegetables
[1] WANG L, BOKHARY S U F, XIE B, et al.Biochemical and molecular effects of Glycine betaine treatment on membrane fatty acid metabolism in cold stored peaches[J].Postharvest Biology and Technology, 2019, 154:58-69.
[2] 金鹏, 王静, 朱虹, 等.果蔬采后冷害控制技术及机制研究进展[J].南京农业大学学报, 2012, 35(5):167-174.JIN P, WANG J, ZHU H, et al.Progress on techniques and mechanisms in alleviating chilling injury of postharvest fruits and vegetables[J].Journal of Nanjing Agricultural University, 2012, 35(5):167-174.
[3] 烟小霞, 康宁波, 鲁玲, 等.果蔬采后冷害及调控技术的研究进展[J].食品与发酵工业, 2023, 49(8):325-334.YAN X X, KANG N B, LU L, et al.Research progress on chilling injury and regulation technology of postharvest fruits and vegetables[J].Food and Fermentation Industries, 2023, 49(8):325-334.
[4] ANNUNZIATA M G, CIARMIELLO L F, WOODROW P, et al.Spatial and temporal profile of Glycine betaine accumulation in plants under abiotic stresses[J].Frontiers in Plant Science, 2019, 10:230.
[5] DOBRIJEVI D, PASTOR K, NASTI
D, PASTOR K, NASTI N, et al.Betaine as a functional ingredient:Metabolism, health-promoting attributes, food sources, applications and analysis methods[J].Molecules, 2023, 28(12):4824.
N, et al.Betaine as a functional ingredient:Metabolism, health-promoting attributes, food sources, applications and analysis methods[J].Molecules, 2023, 28(12):4824.
[6] AHMAD R, LIM C J, KWON S Y.Glycine betaine:A versatile compound with great potential for gene pyramiding to improve crop plant performance against environmental stresses[J].Plant Biotechnology Reports, 2013, 7(1):49-57.
[7] SAKAMOTO A, MURATA N.The role of glycine betaine in the protection of plants from stress:clues from transgenic plants[J].Plant, Cell &Environment, 2002, 25(2):163-171.
[8] MAHMOUDI R, RAZAVI F, RABIEI V, et al.Application of glycine betaine coated chitosan nanoparticles alleviate chilling injury and maintain quality of plum (Prunus domestica L.) fruit[J].International Journal of Biological Macromolecules, 2022, 207:965-977.
[9] CHEN L L, SHAN W, CAI D L, et al.Postharvest application of Glycine betaine ameliorates chilling injury in cold-stored banana fruit by enhancing antioxidant system[J].Scientia Horticulturae, 2021, 287:110264.
[10] LUO M L, ZHOU X, SUN H J, et al.Glycine betaine treatment alleviates loss of aroma-related esters in cold-stored ‘Nanguo’ pears by regulating the lipoxygenase pathway[J].Food Chemistry, 2020, 316:126335.
[11] PAN Y G, ZHANG S Y, YUAN M Q, et al.Effect of Glycine betaine on chilling injury in relation to energy metabolism in Papaya fruit during cold storage[J].Food Science &Nutrition, 2019, 7(3):1123-1130.
[12] WANG Q, DING T, ZUO J H, et al.Amelioration of postharvest chilling injury in sweet pepper by Glycine betaine[J].Postharvest Biology and Technology, 2016, 112:114-120.
[13] CHEN T H H, MURATA N.Glycinebetaine protects plants against abiotic stress:Mechanisms and biotechnological applications[J].Plant, Cell &Environment, 2011, 34(1):1-20.
[14] KORKE R, RINK A, SEOW T K, et al.Genomic and proteomic perspectives in cell culture engineering[J].Journal of Biotechnology, 2002, 94(1):73-92.
[15] GIRI J.Glycinebetaine and abiotic stress tolerance in plants[J].Plant Signaling &Behavior, 2011, 6(11):1746-1751.
[16] ASHRAF M, FOOLAD M R.Roles of Glycine betaine and proline in improving plant abiotic stress resistance[J].Environmental and Experimental Botany, 2007, 59(2):206-216.
[17] 袁梦麒, 潘永贵, 张伟敏, 等.甜菜碱处理对番木瓜果实采后冷害及抗氧化系统的影响[J].热带作物学报, 2016, 37(8):1582-1587.YUAN M Q, PAN Y G, ZHANG W M, et al.Effect of exogenous betaine treatment on chilling injury and antioxidant system of Papaya fruit[J].Chinese Journal of Tropical Crops, 2016, 37(8):1582-1587.
[18] 张瑜. 热水和甜菜碱复合处理对枇杷果实冷害的影响及机理研究[D].南京:南京农业大学, 2017.ZHANG Y.Studies on effects and mechanisms of hot water combined glycine betaine treatment on chilling injury of loquat fruit[D].Nanjing:Nanjing Agricultural University, 2017.
[19] RODR GUEZ-ZAPATA L C, ESPADAS Y GIL F L, CRUZ-MART
GUEZ-ZAPATA L C, ESPADAS Y GIL F L, CRUZ-MART NEZ S, et al.Preharvest foliar applications of Glycine-betaine protects banana fruits from chilling injury during the postharvest stage[J].Chemical and Biological Technologies in Agriculture, 2015, 2:8.
NEZ S, et al.Preharvest foliar applications of Glycine-betaine protects banana fruits from chilling injury during the postharvest stage[J].Chemical and Biological Technologies in Agriculture, 2015, 2:8.
[20] SANAZ M, VALI R, ALI S, et al.Exogenous application of Glycine betaine increases the chilling tolerance of pomegranate fruits cv.Malase Saveh during cold storage[J].Journal of Food Processing and Preservation, 2021, 45(3):15315.
[21] LI M, ZHI H H, DONG Y.Influence of preharvest and postharvest applications of Glycine betaine on fruit quality attributes and storage disorders of ‘lapins’ and ‘Regina’ cherries[J].HortScience, 2019, 54(9):1540-1545.
[22] 单体敏, 金鹏, 许佳, 等.外源甜菜碱处理对冷藏桃果实冷害和品质的影响[J].园艺学报, 2015, 42(11):2244-2252.SHAN T M, JIN P, XU J, et al.Effects of exogenous Glycine betaine treatment on chilling injury and quality of cold-stored peach fruits[J].Acta Horticulturae Sinica, 2015, 42(11):2244-2252.
[23] 王懿, 侯媛媛, 马钰晴, 等.甘氨酸甜菜碱处理对桃果实冷害及抗坏血酸-谷胱甘肽循环代谢的影响[J].食品科学, 2021, 42(13):158-165.WANG Y, HOU Y Y, MA Y Q, et al.Effect of Glycine betaine treatment on chilling injury and ascorbic acid-glutathione cycle metabolism in peach fruit[J].Food Science, 2021, 42(13):158-165.
[24] JIA Z Y, WANG Y, WANG L, et al.Amino acid metabolomic analysis involved in flavor quality and cold tolerance in peach fruit treated with exogenous Glycine betaine[J].Food Research International, 2022, 157:111204.
[25] WANG L, SHAN T M, XIE B, et al.Glycine betaine reduces chilling injury in peach fruit by enhancing phenolic and sugar metabolisms[J].Food Chemistry, 2019, 272:530-538.
[26] SUN H J, LUO M L, ZHOU X, et al.Exogenous Glycine betaine treatment alleviates low temperature-induced pericarp browning of ‘Nanguo’ pears by regulating antioxidant enzymes and proline metabolism[J].Food Chemistry, 2020, 306:125626.
[27] RAZAVI F, MAHMOUDI R, RABIEI V, et al.Glycine betaine treatment attenuates chilling injury and maintains nutritional quality of hawthorn fruit during storage at low temperature[J].Scientia Horticulturae, 2018, 233:188-194.
[28] ZHANG Y, JIN P, HUANG Y P, et al.Effect of hot water combined with Glycine betaine alleviates chilling injury in cold-stored loquat fruit[J].Postharvest Biology and Technology, 2016, 118:141-147.
[29] 张海英, 王有年, 韩涛, 等.外源甜菜碱对黄瓜果实冷藏期间延缓冷害的影响[J].中国农业科学, 2008, 41(8):2407-2412.ZHANG H Y, WANG Y N, HAN T, et al.Effect of exogenous Glycine betaine on chilling injury and chilling-resistance parameters in cucumber fruits stored at low temperature[J].Scientia Agricultura Sinica, 2008, 41(8):2407-2412.
[30] 骆思铭. 甜菜碱复合褪黑素处理对黄瓜保鲜效果的研究[D].南京:南京农业大学, 2021.LUO S M.Effects of glycine betaine combined with melatonin treatment on the perservation of cucumber fruits[D].Nanjing:Nanjing Agricultural University, 2021.
[31] 姚文思, 金鹏, 许婷婷, 等.外源甘氨酸甜菜碱处理对西葫芦果实冷害和品质的影响[J].核农学报, 2018, 32(9):1781-1788.YAO W S, JIN P, XU T T, et al.Effects of exogenous Glycine betainetreatment on chilling injury and quality of Cucurbita pepo L.under low temperature storage[J].Journal of Nuclear Agricultural Sciences, 2018, 32(9):1781-1788.
[32] 张苗, 姜玉, 汤静, 等.冷激结合甜菜碱处理对西葫芦冷害及能量代谢的影响[J].食品科学, 2020, 41(7):184-190.ZHANG M, JIANG Y, TANG J, et al.Effects of cold shock combined with Glycine betaine treatment on chilling injury and energy metabolism of zucchini[J].Food Science, 2020, 41(7):184-190.
[33] HABIBI F, VALERO D, SERRANO M, et al.Exogenous application of Glycine betaine maintains bioactive compounds, antioxidant activity, and physicochemical attributes of blood orange fruit during prolonged cold storage[J].Frontiers in Nutrition, 2022, 9:873915.
[34] SHAN T M, JIN P, ZHANG Y, et al.Exogenous Glycine betaine treatment enhances chilling tolerance of peach fruit during cold storage[J].Postharvest Biology and Technology, 2016, 114:104-110.
[35] WANG L, HOU Y Y, WANG Y, et al.Genome-wide identification of heat shock transcription factors and potential role in regulation of antioxidant response under hot water and Glycine betaine treatments in cold-stored peaches[J].Journal of the Science of Food and Agriculture, 2022, 102(2):628-643.
[36] 王莉. 甜菜碱和热水处理调控桃果实冷害机制研究[D].南京:南京农业大学, 2020.WANG L.Mechanism of glycine betaine and hot water treatments on regulation of chilling injury in peach fruit[D].Nanjing:Nanjing Agricultural University, 2020.
[37] 王懿. 甜菜碱处理对桃果实采后氨基酸代谢和AsA-GSH循环代谢的影响[D].南京:南京农业大学, 2021.WANG Y.Effects of glycine betaine treatment on amino acids metabolism and AsA-GSH cycle metabolism of postharvest peach fruit[D].Nanjing:Nanjing Agricultural University, 2021.
[38] WANG J W, LV M, HE H S, et al.Glycine betaine alleviated peel browning in cold-stored ‘Nanguo’ pears during shelf life by regulating phenylpropanoid and soluble sugar metabolisms[J].Scientia Horticulturae, 2020, 262:109100.
[39] LUO M L, SUN H J, GE W Y, et al.Effect of Glycine betaine treatment on aroma production of ‘Nanguo’ pears after long-term cold storage-possible involvement of ethylene synthesis and signal transduction pathways[J].Food and Bioprocess Technology, 2022, 15(6):1327-1342.
[40] YAO W S, XU T T, FAROOQ S U, et al.Glycine betaine treatment alleviates chilling injury in zucchini fruit (Cucurbita pepo L.) by modulating antioxidant enzymes and membrane fatty acid metabolism[J].Postharvest Biology and Technology, 2018, 144:20-28.
[41] SONG Q P, YOU L L, LIU Y, et al.Endogenous accumulation of Glycine betaine confers improved low temperature resistance on transplastomic potato plants[J].Functional Plant Biology, 2020, 47(12):1105-1116.
[42] WANG L, WANG Y, HOU Y Y, et al.Physiological and metabolomic analyses of hot water treatment on amino acids and phenolic metabolisms in peach cold tolerance[J].Postharvest Biology and Technology, 2021, 179:111593.
[43] AGHDAM M S, BODBODAK S.Physiological and biochemical mechanisms regulating chilling tolerance in fruits and vegetables under postharvest salicylates and jasmonates treatments[J].Scientia Horticulturae, 2013, 156:73-85.
[44] KHAN M S, YU X, KIKUCHI A, et al.Genetic engineering of Glycine betaine biosynthesis to enhance abiotic stress tolerance in plants[J].Plant Biotechnology, 2009, 26(1):125-134.
[45] WANG L, CHEN S C, SHAO J W, et al.Hydrogen sulfide alleviates chilling injury in peach fruit by maintaining cell structure integrity via regulating endogenous H2S, antioxidant and cell wall metabolisms[J].Food Chemistry, 2022, 391:133283.
[46] 方筱琴, 徐利伟, 朱婷婷, 等.γ-氨基丁酸对低温胁迫下桃果实蔗糖代谢的影响[J].核农学报, 2020, 34(7):1470-1479.FANG X Q, XU L W, ZHU T T, et al.Effects of γ-aminobutyric acid on sucrose metabolism of peach fruit under stress of low temperature[J].Journal of Nuclear Agricultural Sciences, 2020, 34(7):1470-1479.
[47] JOHNSON J B, HOYOS B E, MANI J S, et al.Identification of phenolics responsible for the high antioxidant activity in Burdekin plum (Pleiogynium timoriense) fruit[J].Food Chemistry Advances, 2022, 1:100081.
[48] HU Y, HAN Y T, ZHANG K, et al.Identification and expression analysis of heat shock transcription factors in the wild Chinese grapevine (Vitis pseudoreticulata)[J].Plant Physiology and Biochemistry, 2016, 99:1-10.