民以食为天,食品安全与每一个人息息相关。微生物污染[1]、食品掺假、转基因食品、食品过敏原[2]等食品安全问题日渐成为人们关注的焦点。目前食品安全检测中常用的方法主要有聚合酶链式反应、酶联免疫吸附分析、高效液相色谱法等[3]。虽然这些方法准确性高,但是前处理相对复杂,仪器设备昂贵,难以满足食品安全检测快速、高效的需求。因此,面对日趋严重的食品安全问题,快速、高效、简单的检测方法是食品安全领域关注的热点。
基于分子生物学的核酸检测技术是食品安全检测的重要方法,因其高灵敏度和特异性而广泛应用于食品安全检测。虽然PCR技术是目前应用最为广泛的方法,但它只能应用于基因扩增,后续的结果分析需要借助琼脂糖凝胶电泳技术[4]、荧光检测技术[5]或测序技术[6]。而且PCR对设备的要求很高,在扩增过程中必须反复升温和降温,进行不同温度的循环[7]。环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)从样品处理到后续检测展现出优势,所需样品检测数量较少,只需在小管中进行,可实现快速检测[8]。与常规PCR相比,LAMP可以在恒定温度下进行,无需热循环仪器设备,更易于操作。且LAMP具有较高的特异性和扩增效率,被广泛用于食品安全领域。
LAMP技术近年来得到了长足的发展,本文主要讨论LAMP技术的原理、特点以及LAMP与其他技术相结合在食品安全检测中的应用和研究进展。
1 LAMP
1.1 LAMP原理
LAMP是NOTOMI等[9]在2000年建立的一种在等温条件下以高灵敏度和特异性扩增目标DNA序列的分子生物学技术,在60~65 ℃的恒温条件下进行核酸快速扩增。针对目标DNA链上的6个区段,设计4个不同的引物,包括内引物(FIP/BIP)和外引物(F3/B3)(图1-a)。利用链置换型DNA聚合酶,在一定温度(60~65 ℃)下反应30~60 min,即可完成扩增。扩增反应分为两阶段,第一阶段为起始物合成阶段,最终会形成一条哑铃结构的DNA,作为第二阶段循环扩增的模板。循环阶段从这个哑铃结构开始,内引物(FIP/BIP)不断与新形成的单链结合位点杂交,同时形成更长的哑铃结构的DNA(图1-b)。NAGAMINE等[10]设计引入2个环引物后能够在更短的时间完成核酸扩增反应。而且此反应只需把样品DNA、引物、链置换型DNA聚合酶、dNTPs、Mg2+等共同置于60~65 ℃,经过1个步骤即可完成核酸快速扩增(图2)。
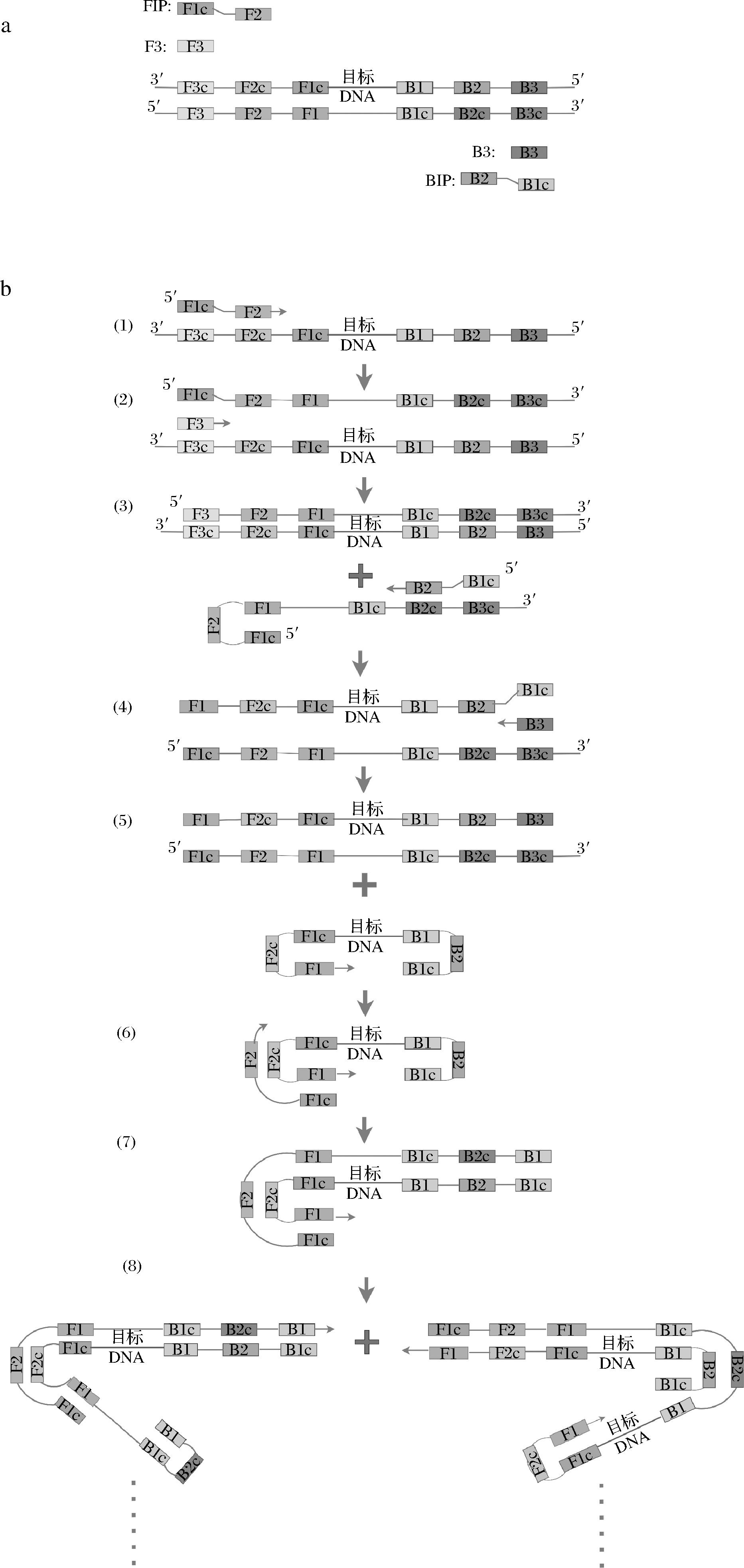
a-LAMP引物设计;b-扩增原理
图1 LAMP原理图
Fig.1 Principle of amplification by LAMP
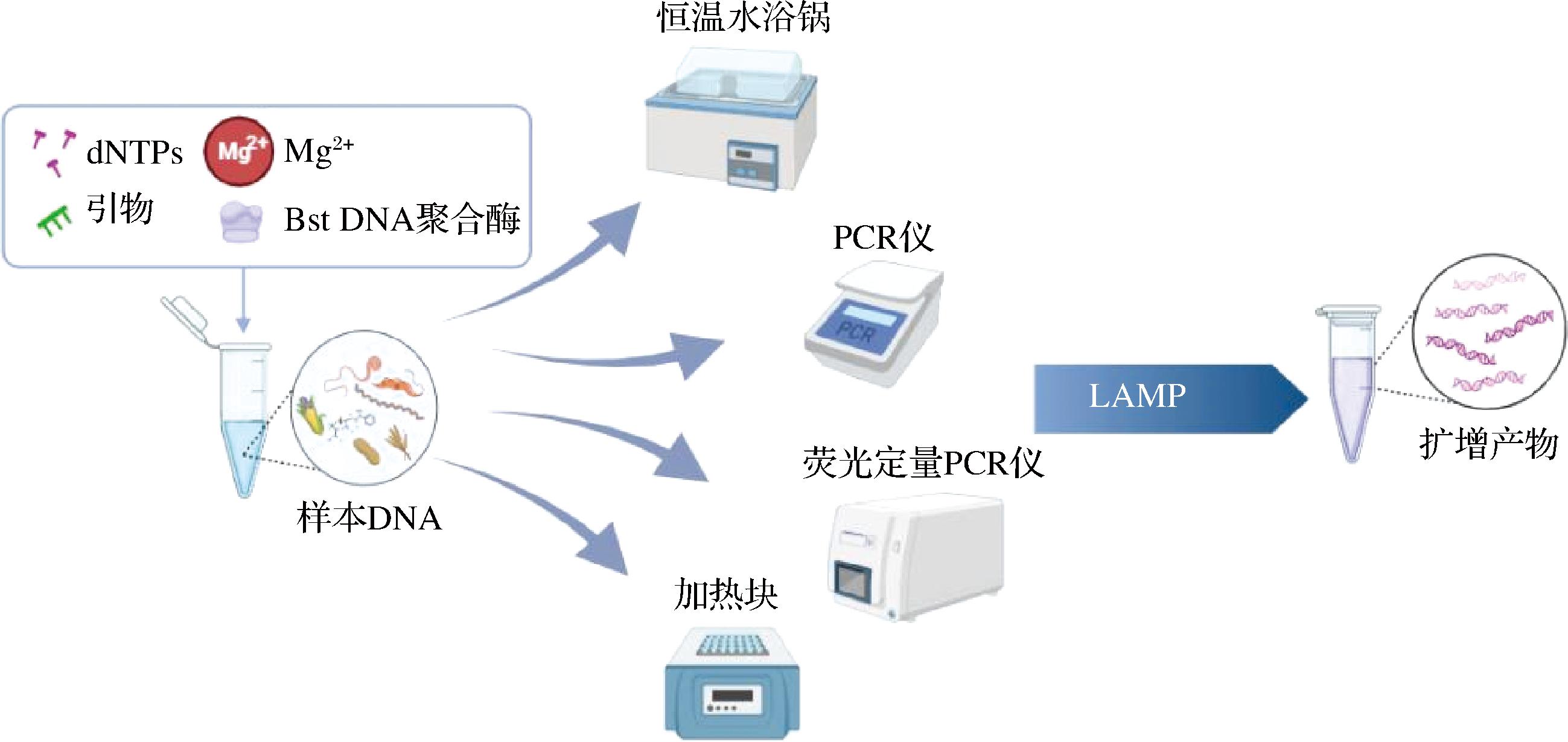
图2 LAMP反应流程图
Fig.2 Flowchart of LAMP
1.2 LAMP和常规PCR技术的主要特点比较
LAMP反应和常规PCR反应相比较更具优势(表1),常规PCR反应需要设计2个引物,通过热循环仪反复升温进行核酸扩增,反应时间在2 h内,灵敏度在103拷贝,结果判定多是通过琼脂糖凝胶电泳和荧光检测,广泛应用的PCR反应变型有实时定量PCR、反转录PCR、荧光定量反转录PCR等。与PCR相比,LAMP可在60~65 ℃ 恒温条件下进行,在水浴或者加热块的条件下就可以完成反应,没有温度循环变化带来的时间损失[11]。LAMP设计的4条引物可以识别目的基因中的6条特定序列[12],将它们进行结合就能使扩增反应发生,反应混合物中的非目的基因DNA不受其影响,因此LAMP具有较高的特异性。整个扩增反应过程只需要30~60 min[13-14],即可将几个拷贝的靶基因扩增到109水平,其灵敏度是常规PCR的10~100 倍。不需要使用昂贵设备,通过肉眼观察、比浊分析、荧光检测、电泳等即可以使结果得到可视化。实时定量LAMP、多重LAMP、微流控-数字LAMP等新型LAMP也逐渐被开发与应用。
表1 LAMP技术与PCR的特点比较
Table 1 Comparison of the main features of LAMP and PCR techniques
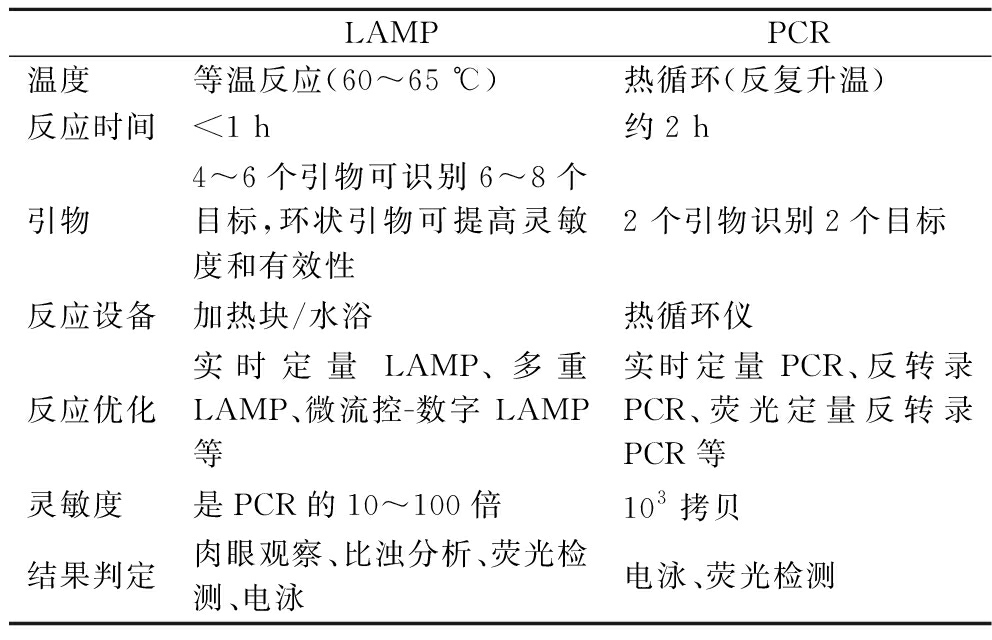
LAMPPCR温度等温反应(60~65 ℃)热循环(反复升温)反应时间<1 h约2 h引物4~6个引物可识别6~8个目标,环状引物可提高灵敏度和有效性2 个引物识别2个目标反应设备加热块/水浴热循环仪反应优化实时定量LAMP、多重LAMP、微流控-数字 LAMP等实时定量PCR、反转录PCR、荧光定量反转录PCR等灵敏度是PCR的10~100倍103拷贝结果判定肉眼观察、比浊分析、荧光检测、电泳电泳、荧光检测
1.3 LAMP技术的优势
与其他扩增技术相比,首先,LAMP技术操作简单,反应温度恒定,不依赖任何专门的仪器设备就可实现现场高通量快速检测,检测成本远低于荧光定量PCR。其次,LAMP技术可以有效地检测少量的目标物质,并快速完成大量DNA扩增。此外,LAMP技术具有多对引物,因此具有很高的特异性,可以有效地检测出目标物质。该技术与其他新兴技术的优缺点比较见表2。
表2 各检测技术的优缺点
Table 2 Advantages and disadvantages of each testing technique

技术优点缺点应用方面文献LAMP对实验设备要求低、扩增时间短、特异性和灵敏度高、结果判定可视化、能应用于现场检测引物设计难度较大,易出现气溶胶污染,使结果假阳性,易形成引物二聚体应用于微生物污染、食品掺假、转基因食品、食品过敏原检测等[11-13]免疫胶体金技术方便快捷、特异敏感、稳定性强、无需特殊设备和试剂、结果直观胶体金价格较昂贵,结果易受环境、样品等多种因素影响,检测信号只能显示是和否的结果应用于对微生物、农药残留、激素、重金属等类别的食品、药品、化工、生物、临床医学诸多领域的检测[15-16]免疫印迹技术灵敏度高、蛋白质特异性鉴别效果明显,可微量级蛋白质的检测,可定性和半定量分析准确度不高,缺乏可重复性,所需时间长,需要相对较大的样品量常用于鉴定某种蛋白,并能对蛋白进行定性和半定量分析[17]基因编辑技术快速、廉价、高灵敏度和特异性依赖参考基因组,依赖专业技术人员,需结合扩增、转录等技术应用于病原微生物、遗传病、肿瘤基因突变、小分子等核酸检测[18-19]DNA条形码操作简单、分类覆盖率高、检测高通量需借已建立的DNA条形码数据库,确定研究目标的保守基因片段具有难度常用于动植物的分类鉴定,在肉制品、海产品等食品掺假中也有应用[20-22]
1.4 LAMP 技术现存问题
1.4.1 引物设计
LAMP至少使用4个引物,为内引物(FIP/BIP)和外引物(F3/B3)。内引物在2个不同的区域杂交,一些研究报道,在这些引物中间使用通常由4个胸腺嘧啶组成的接头可以提高检测性能。引物利用日本荣研在线免LAMP引物设计软件Primer Explorer v5(http://primerexplorer.jp/lampv5e/index.html)来设计,上传的DNA特异性序列<2 000 bp,靶标序列长度≤280 bp,引物设计需考虑引物Tm值范围区间、引物间距、引物GC含量、引物末端稳定性和二级结构等问题[9]。LAMP技术的发展与应用需要克服设计引物的难题,未来可以考虑开发相对更成熟的引物设计软件来服务LAMP技术。
1.4.2 结果判定
目前LAMP技术结果判定常用的方法包括琼脂糖凝胶电泳法、浊度比色法、DNA结合染料法、金属离子指示剂法等。因LAMP是多引物扩增技术, 其扩增产物长度呈阶梯状,琼脂糖凝胶电泳检测时易出现拖尾现象;LAMP可加入SYBR Green、钙黄绿色等荧光染料使结果可视化,也可以加入羟基萘酚蓝(hydroxynaphthol blue, HNB)进行肉眼比色。在应用过程中, 判定方法各有利弊(表3), 需根据实际需求进行选择优化。
表3 LAMP结果判定方法对比
Table 3 Comparison of LAMP result determination methods

方法原理应用对象反应前后变化缺点文献琼脂糖凝胶电泳琼脂糖凝胶电泳是一种根据大分子(DNA、RNA和蛋白质)及其片段大小和电荷进行分离和分析的方法dsDNA梯状条带该方法操作繁琐且容易产生气溶胶污染,多用于验证LAMP[23-24]浊度比色法利用扩增过程中 DNA 聚合反应的副产物焦磷酸根离子(PPi)不断析出,与反应体系中的 Mg2+结合,形成白色焦磷酸镁沉淀,产生肉眼可见的浑浊PPi反应液从澄清透明到白色浑浊避免了气溶胶污染;肉眼可分辨的程度较低,样品浊度不稳定,需反应后立即观察[25-26]DNA结合染料法(SYBR Green I)一种能够结合双链DNA (double-strained DNA, dsDNA)嵌入染料的小分子,本身具有微弱荧光信号,在嵌入dsDNA时发出强烈的荧光dsDNA自然光:橙色变黄绿色紫外光:有荧光高浓度的SYBR GreenⅠ会一定程度地抑制扩增,降低扩增效率,需开盖加入,增加了气溶胶污染而造成假阳性的风险[27-30]
续表3

方法原理应用对象反应前后变化缺点文献金属离子指示剂法钙黄绿素LAMP反应前,钙黄绿素与Mn2+结合淬灭荧光显橙色;当LAMP反应时,Mn2+被释放并与焦磷酸根结合产生焦磷酸锰沉淀,钙黄绿素与残留的Mg2+结合恢复至绿色荧光HNBMg2+与HNB结合反应体系为紫罗兰色;随反应进行,Mg2+与焦磷酸根反应生成焦磷酸镁沉淀,HNB失去Mg2+,体系变为天蓝色酸性蓝K酸性蓝K能够指示Mg2+的金属浓度变化,随着反应液Mg2+浓度的减小,颜色从红色变化到蓝色Mg2+自然光:橙黄色变草绿色紫外线光:有荧光钙黄绿素和MnCl2似乎会降低LAMP的灵敏度,容易受到基质中金属杂质残留的影响,造成误判[31-36]自然光下:紫罗兰变天蓝色容易受到基质中金属杂质残留的影响,造成误判[37-39]从红色到蓝色的颜色容易受到基质中金属杂质残留的影响,造成误判[40]横向流动试纸条(lat-eral flow dipstick, LFD)利用被标记的引物和特异性探针进行特异性扩增。当存在特异性扩增时, LFD检测线上形成肉眼可见的有色线条dsDNA肉眼可见的有色线条需要将检测试纸封装在防污染封闭式核酸快速检测盒内[41]
1.4.3 通量检测
为提高等温核酸扩增的检测通量,通常是将多组引物添加到单个等温核酸扩增反应中进行多目标检测, 即多重等温核酸扩增[42-43],LAMP的引物较多,增加了非特异性扩增的可能,也会导致灵敏度降低。目前微流控芯片能有效调高检测通量,以平行方式在数百万个单个液滴中进行快速DNA扩增,微流控装置体积小,减少了样品和试剂的使用量,从而降低运行成本,除上述特点外,便携性、自动化、高通量等优势也为解决低通量提供了广阔的机会。
2 LAMP技术在食品安全检测领域的创新
LAMP技术自建立以来,在食品安全检测中已被广泛应用于细菌检测、病毒检测、转基因检测以及食物过敏源等方面。随着LAMP技术的不断改进与发展,许多研究者将LAMP技术与其他技术进行联合,开发了多种有效的检测方法。
2.1 多重LAMP(multiple LAMP,m-LAMP) 技术
m-LAMP利用多个基因同时检测多个靶序列,在一个反应体系中加入多组引物,一次 LAMP反应可以检测出多个目标。它还被用于区分同一病原体的不同菌株,扩展了检测范围,提高了该技术的特异性和准确性。LAMP可以与色谱侧向流动试纸联用(LAMP-LFD),用AuNP荧光标记的生物素扩增,产生的LAMP产物结合视觉来判定结果。该方法称为LAMP-LFD,已用于检测牛奶、猪肉、牛肉和鸡肉中沙门氏菌属的hilA基因,基因组DNA的检测限为13.5 fg/μL,细胞的检测限为6.7 CFU/mL[44]。LAMP-LFD可以升级为多重检测系统,因为它已被证明可以同时检测婴儿配方奶粉中的沙门氏菌属、克罗诺杆菌属和金黄色葡萄球菌,检测限在3~4 CFU/g[45]。刘宁伟[46]构建了一种能够应用于副溶血性弧菌、沙门氏菌和李斯特菌感染的多重LAMP方法,检出率与常规LAMP一致。m-LAMP由于同一反应体系存在多种特异性引物,不可避免地产生了引物间互相干扰,形成引物二聚体等问题。同时,由于极高的灵敏度,假阳性问题也极其容易出现。
2.2 微流控-数字LAMP技术
数字液滴LAMP(digital droplet, ddLAMP)技术即在微流控芯片上进行环介导等温扩增反应,通过微流控系统将反应体系分隔在大量大小均一的液滴中,每1滴即为1个反应单元,根据泊松分布在60~65 ℃进行独立的单分子等温扩增,从而达到绝对定量的目的[47]。ddLAMP可以在等温条件下高效快速的完成扩增反应[48],特异性、灵敏度和扩增效率都得到了提高,试剂消耗少,便于携带等优点也较为突出。FU等[49]设计了一种基于聚甲基丙烯酸甲酯的微芯片结合LAMP技术检测水中的粪便指示菌,使用聚甲基丙烯酸甲酯微芯片在35 min内完成PCR扩增,检出限可达到102拷贝/μL。鞠鹤鹏等[50]建立了1种能够快速检测3种食源性致病菌的ddLAMP方法,包括沙门氏菌、大肠杆菌O157、金黄色葡萄球菌,3种致病菌的检测限均可达到1×102 CFU/mL。ddLAMP能够进行大量独立的LAMP反应,并提供靶DNA序列的定量,该技术已成为核酸检测的重要手段。
2.3 淬灭基团释放LAMP技术(detection of amplification by release of quenching LAMP, DARQ-LAMP)
DARQ-LAMP是在一条内引物的5′端修饰荧光基团(或淬灭基团),并加入一条与上游内引物(FIP)中的F1c部分互补且3′端修饰淬灭基团(或荧光基团)的探针,该探针在反应前需预先与内引物进行孵育,使探针与内引物杂交形成淬灭探针双链(quenching probe double chain,QPD),使得荧光处于淬灭状态,当聚合酶遇到双链,探针就会移位并产生荧光信号[51]。CREGO-VICENTE等[52]关于曼氏血吸虫和类圆线虫属DNA的检测,开发了2种基于 DARQ 探针的LAMP,可以在便携式等温荧光仪中进行,其中1种可在室温下稳定双链 DARQ-LAMP混合物,用作即用型形式,便于在现场环境中进行对曼氏血吸虫病和类圆线虫病即时分析诊断。这种方法在检测海鲜中寄生虫方面具有良好的借鉴意义。韦锦源等[53]建立了1种DARQ-LAMP方法检测单增李斯特菌,其检测限为7.3×101 拷贝/mL,灵敏度是PCR的100倍。该方法效率高、特异性好、灵敏度高,为LAMP检测食源性致病菌的研究提供参考。
2.4 分子信标LAMP技术
分子信标 (molecular beacons,MB) 是一种长约15~30 bp的DNA茎环结构,分别在5′和3′末端标记有荧光团和淬灭剂[54]。在没有目标DNA的情况下,由于靠近淬灭剂,荧光团可以通过荧光共振能量转移来淬灭。当特定目标存在时,茎环结构打开以产生用于检测目的基因的荧光信号。先前的研究已经证明,MB在“单重”检测中实现了在LAMP反应时产物的特异性检测的巨大潜力[55]。LIU等[56]研究了一种基于分子信标的环介导等温扩增方法(MB-LAMP),明确了使用分子信标指示的LAMP有效降低了检测结果假阳性率。此外,加入特异性MB探针不仅可以大幅度提高特异性和灵敏度,还可以同时检测多个物种[57]。XUE等[58]开发1种视觉MB-LAMP检测方法,用于特异性检测加工鱼制品中的玉梭鱼成分。该新型测定法的特点是具有很高的特异性。此外,包含具有优化茎环结构的特定MB探针可实现低背景信号和高扩增效率。最后,MB-LAMP可以用肉眼以闭管形式可视化,降低交叉污染的风险,并展现出现场测试的巨大潜力。
3 LAMP技术在食品安全检测中的应用
目前, LAMP技术在食品检测领域的应用主要包括食源性病原微生物检测、食品转基因成分检测、食品掺杂掺假检测等。
3.1 LAMP 技术在食源性病原微生物检测的应用
近年来,大量研究致力于探索 LAMP技术检测各类食品(包括牛奶、海鲜和肉类)中病原体的能力。这些研究中LAMP技术大多使用荧光来指示扩增产物中是否存在病原体,也通过直接用肉眼识别信号,证明该技术可能适合现场检测。例如,通过观察扩增过程中的浑浊度异常或颜色变化来检测鸡肉中是否存在沙门氏菌或弯曲杆菌[59]。使用LAMP方法可以得到与PCR相当甚至更好的结果。例如,XIONG等[60]报告称,在检测鱼类样本中是否存在金黄色葡萄球菌时,LAMP方法的灵敏度是传统 PCR方法的10 倍。在另一项研究中,LAMP和PCR方法都能检测出鸡肉中的沙门氏菌和弯曲杆菌,检测结果分别低至10 CFU/g和103 CFU/g,而无需对样本进行富集[61]。LAMP技术在检测食品样本中的食源性致病菌方面具有很高的灵敏度和特异性。因其成本低、速度快,能与生物传感器等先进技术联用,该技术是现场或实地检测的可行工具。
3.2 LAMP技术在转基因食品成分检测中的应用
随着生物技术的快速发展,越来越多的转基因作物被开发出来。转基因食品对人类消费和环境是否安全仍然存在很多争论。为了监测法规的遵守情况,必须开发简单、灵敏和快速的方法来检测作物及其产品中是否存在转基因生物。
YU等[62]开发了1种新型环介导等温扩增与TaqMan联用的方法(LAMP-TaqMan),用于筛选具有 NOS终止子的转基因生物的快速定性检测。该方法荧光信号在等温扩增反应中出现的时间比TaqMan PCR 中更早,所以反应时间比TaqMan方法更短,且具有与TaqMan PCR相同的特异性和检测限。张吉红等[63]针对转基因油菜MS8品系的特征序列建立了LAMP反应体系,该检测方法通过肉眼观察染色情况即可分辨转基因油菜MS8品系,具有良好的特异性,适用于现场检测。TAKABATAKE等[64]设计了1套 LAMP 引物用于检测番木瓜内源参考序列木瓜凝乳蛋白酶,并确认了其种属特异性。这种简单、快速的转基因番木瓜筛选方法将有助于预防转基因非授权作物对环境的污染。LAMP检测技术通常针对1种成分进行检测,因此在未来运用LAMP技术检测转基因食品过程中需加大对质粒标准品的重视。总之,当前转基因食品检测中运用LAMP技术大多只是对检测成分的定性,以达到成分检测的目的。未来应针对转基因食品的检测技术进行升级优化,并与其他技术联用,提升对转基因成分检测的精准度,进而为转基因食品产业提供安全保障。
3.3 LAMP技术在食品掺杂掺假检测中的应用
食品掺假难被发现,LAMP技术可以准确鉴别不同食品类型中掺杂物的种类。肖剑等[65]根据大豆Lectin基因保守序列,建立了一种可为植物蛋白饮料大豆成分掺杂掺假的快速LAMP检测方法。由于鸡肉成本较低,通常被用作几种肉制品的掺杂物。THANGSUNAN等[66]开发一种基于比色LAMP检测方法,用于鉴定生肉和加工肉制品中的鸡肉含量。通过pH敏感指示剂中性红直接比色,准确检测生肉基质和商业加工食品中的鸡肉含量,使其成为现场食品鉴定以及实验室中有价值的分析工具。ZHANG等[67]使用靶向线粒体细胞色素b基因和细胞色素c氧化酶亚基基因开发了一种实时荧光LAMP -微流控,可以同时检测食品中的猪肉、牛肉、羊肉和鸭肉, 30 min内即可完成整个扩增,以验证肉类的标签认证,防止食品掺假。
4 展望
食品安全是一项重大而持久的挑战,对人类生活质量有着深远的影响。环介导等温扩增是一种在等温条件下的基因扩增方法,便捷、快速、灵敏、特异性高的特点使其成为临床研究、兽医和植物检疫诊断和食品、饲料质量控制检测方面的有效方法。但是LAMP技术也还存在着局限性,如交叉污染的高风险和随后的假阳性结果,因其DNA扩增效率很高,开管可视化需要格外小心,以避免交叉污染。使用多个引物也会增加二聚体形成和引物与引物杂交的机会,这可能会产生不可靠的结果。并且设计LAMP的引物可能是一个复杂且不直观的过程,也给该技术增加了困难。令人欣慰的是,LAMP引物在线设计软件(Primer Explorer V5)包括引物设计的教程和分步指南。假阳性结果也可能归因于凋亡细胞DNA的扩增。因此,研究人员尝试开发能够区分存活和非存活微生物细胞的扩增方法,如结合单氮化丙啶处理的扩增、RNA扩增或使用噬菌体等[68]。需要注意的是,大多数涉及单氮化丙啶处理的研究都是基于PCR技术,与等温扩增技术结合的研究很少,未来可以加深该方向的研究。
关于食品安全检测领域中食源性致病菌污染、食品掺假、转基因食品、食品过敏原的检测研究较多,然而,大多数研究更关注特定的病原体,如沙门氏菌、李斯特菌、大肠杆菌和副溶血性弧菌等。建议今后的研究可以多加侧重诺如病毒或其他病原体检测。此外,在农产品中产霉菌毒素的霉菌的检测样本较少。霉菌毒素是全世界关注的问题,包括曲霉菌属和镰刀菌属的产毒真菌,会产生粮食、饲料中一系列有害的霉菌毒素污染,威胁人类和动物的健康。全面的实施产毒真菌LAMP检测非常有必要,可以降低动物饲料供应链中的风险,减轻它们对食品和谷物饲料造成的经济损失。虽然LAMP检测本身无法检测到毒素的存在,但它可以快速检测农产品中是否存在潜在的产毒霉菌。应用LAMP技术不一定直接检测某些菌种,而是利用与合成霉菌毒素相关的某些基因来检测产毒的潜在可能性。如可以检测出产黄曲霉毒素的不同曲霉属或产生的单端孢霉烯族化合物的不同镰刀菌属的真菌,未来可以借鉴LAMP技术在植物病原体检疫中的应用,弥补在食品相关检测中的空白。LAMP技术作为一种新型的核酸扩增技术,未来在食品安全检测中将得到更广泛的推广和应用,也会更好地服务于食品安全领域。
[1] 孙献周, 于琪, 张巧.食品中食源性致病菌污染现状及危害[J].河南医学高等专科学校学报, 2021, 33(3):335-339.SUN X Z, YU Q, ZHANG Q.Pollution status and harm of foodborne pathogens in food[J].Journal of Henan Medical College, 2021, 33(3):335-339.
[2] SENA-TORRALBA A, PALL S-TAMARIT Y, MORAIS S, et al.Recent advances and challenges in food-borne allergen detection[J].TrAC Trends in Analytical Chemistry, 2020, 132:116050.
S-TAMARIT Y, MORAIS S, et al.Recent advances and challenges in food-borne allergen detection[J].TrAC Trends in Analytical Chemistry, 2020, 132:116050.
[3] 管昭巍, 齐丽娟, 张玉, 等.等温核酸扩增技术在食品安全中的应用研究进展[J].分析化学, 2023, 51(7):1077-1085.GUAN Z W, QI L J, ZHANG Y, et al.Research progress in application of isothermal nucleic acid amplification technology in food safety[J].Chinese Journal of Analytical Chemistry, 2023, 51(7):1077-1085.
[4] HANADA K.Introduction and perspectives of DNA electrophoresis[J].Methods in Molecular Biology, 2020,2119:1-13.
[5] MACKAY I M.Real-time PCR in the microbiology laboratory[J].Clinical Microbiology and Infection, 2004, 10(3):190-212.
[6] SHEN Y M, NIE J Y, KUANG L X, et al.DNA sequencing, genomes and genetic markers of microbes on fruits and vegetables[J].Microbial Biotechnology, 2021, 14(2):323-362.
[7] CRAW P, BALACHANDRAN W.Isothermal nucleic acid amplification technologies for point-of-care diagnostics:A critical review[J].Lab on a Chip, 2012, 12(14):2469-2486.
[8] CHANG L J, HSIAO C J, CHEN B, et al.Accuracy and comparison of two rapid multiplex PCR tests for gastroenteritis pathogens:A systematic review and meta-analysis[J].BMJ Open Gastroenterology, 2021, 8(1):e000553.
[9] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research, 2000, 28(12):E63.
[10] NAGAMINE K, HASE T, NOTOMI T.Accelerated reaction by loop-mediated isothermal amplification using loop primers[J].Molecular and Cellular Probes, 2002, 16(3):223-229.
[11] 杨柳, 张一, 边忠博, 等.LAMP技术在食源性致病菌检测中的应用现状[J].食品安全导刊, 2016(12):103.YANG L, ZHANG Y, BIAN Z B, et al.Current status of the application of LAMP technology in the detection of foodborne pathogens[J].China Food Safety Magazine, 2016(12):103.
[12] 黄海龙, 朱鹏, 杨浩.LAMP-LFD技术及其在生物快检方面应用[J].中国生物工程杂志, 2015, 35(12):89-95.HUANG H L, ZHU P, YANG H.LAMP-LFD technology and its application in rapid detection of biological[J].China Biotechnology, 2015, 35(12):89-95.
[13] 张海艳. 环介导等温扩增技术及其在食品检测中的应用[J].安徽农学通报, 2018, 24(21):41-43.ZHANG H Y.Application of loop-mediated isothermal amplification and its use in food testing[J].Anhui Agricultural Science Bulletin, 2018, 24(21):41-43.
[14] 王静, 许鑫, 王雪雨, 等.环介导等温扩增技术检测食品安全的研究进展[J].中国生物工程杂志, 2018, 38(11):84-91.WANG J, XU X, WANG X Y, et al.Research progress of loop-mediated isothermal amplification in food safety testing[J].China Biotechnology, 2018, 38(11):84-91.
[15] 李向梅, 刘志威, 陈晓敏, 等.食品安全免疫层析检测技术研究进展[J].食品安全质量检测学报, 2020, 11(15):4939-4955.LI X M, LIU Z W, CHEN X M, et al.Advances of immunochromatography assay for food safety[J].Journal of Food Safety &Quality, 2020, 11(15):4939-4955.
[16] 朱明智, 李惠文.快速检测技术在食品安全监管中应用的研究进展[J].食品安全导刊, 2023(21):189-192.ZHU M Z, LI H W.Progress on the application of rapid detection technology in food safety supervision[J].China Food Safety Magazine, 2023(21):189-192.
[17] MISHRA M, TIWARI S, GOMES A V.Protein purification and analysis:Next generation Western blotting techniques[J].Expert Review of Proteomics, 2017, 14(11):1037-1053.
[18] 孙雯君, 黄行许, 王鑫杰.基于CRISPR的快速灵敏便捷分子检测[J].生物工程学报, 2023, 39(1):60-73.SUN W J, HUANG X X, WANG X J.CRISPR-based molecular diagnostics:A review[J].Chinese Journal of Biotechnology, 2023, 39(1):60-73.
[19] 刘静. 基于CRISPR-Cas12基因编辑技术的新冠病毒快速检测系统的研究[D].南昌:南昌大学, 2023.LIU J.A CRISPR-Cas12-based system for the rapid detection of SARS-CoV-2[D].Nanchang:Nanchang University, 2023.
[20] 牛家乐, 费鑫杨, 傅寅旭, 等.DNA条形码技术在加工食品鉴定中的应用[J].山东化工, 2019, 48(10):61-64.NIU J L, FEI X Y, FU Y X, et al.Application of DNA barcoding in identification of processed food[J].Shandong Chemical Industry, 2019, 48(10):61-64.
[21] 钟文涛, 徐越, 王淑好, 等.食品中常见病原微生物的DNA条形码识别技术[J].食品与机械, 2021, 37(2):47-51.ZHONG W T, XU Y, WANG S H, et al.Study on DNA barcoding identification technology of common pathogenic microorganisms in food[J].Food &Machinery, 2021, 37(2):47-51.
[22] 陈佳, 王爽, 周巍, 等.DNA条形码技术在淀粉掺假鉴别中的应用[J].食品科学, 2019, 40 (16):281-285.CHEN J, WANG S, ZHOU W, et al.Application of DNA barcoding in detection of starch adulteration[J].Food Science, 2019, 40(16):281-285.
[23] MA C C, SONG D F, GU Q, et al.Reverse transcription loop-mediated isothermal amplification assays allow the rapid detection of Listeria monocytogenes in fresh-cut fruits and vegetables[J].Journal of Food Safety, 2019, 39(4):e12658.
[24] WANG Y F, YU Z Z, LIU Y F.A high sensitivity method of closed-tube loop-mediated isothermal amplification developed for visual and rapid detection of cow milk adulteration[J].International Dairy Journal, 2022, 127:105214.
[25] TAMURA S, MAEDA T, MISAWA K, et al.Development of a highly resolved loop-mediated isothermal amplification method to detect the N526K ftsI mutation of β-lactamase-negative ampicillin-resistant Haemophilus influenzae[J].Journal of Microbiological Methods, 2017, 141:108-114.
[26] ALMASI A, SHARAFI K, HAZRATI S, et al.A survey on the ratio of effluent algal BOD concentration in primary and secondary facultative ponds to influent raw BOD concentration[J].Desalination and Water Treatment, 2015, 53(13):3475-3481.
[27] KUMARI S, KUMAR R R, MENDIRATTA S K, et al.Development of loop-mediated isothermal method and comparison with conventional PCR assay for rapid on spot identification of tissue of cattle origin[J].Journal of Food Science and Technology, 2021, 58(12):4608-4615.
[28] KUMARI S, KUMAR R R, MENDIRATTA S K, et al.Development of rapid and sensitive loop-mediated isothermal method for on-site visual identification of tissue origin of pig by using mitochondrial COI gene sequences[J].Animal Production Science, 2023, 63(7):704-711.
[29] GIRISH P S, KUMARI A, GIREESH-BABU P, et al.Alkaline lysis-loop mediated isothermal amplification assay for rapid and on-site authentication of buffalo (Bubalus bubalis) meat[J].Journal of Food Safety, 2022, 42(1):e12955.
[30] MANZANAS C, ALAM M M, LOEB J C, et al.A valve-enabled sample preparation device with isothermal amplification for multiplexed virus detection at the point-of-care[J].ACS Sensors, 2021, 6(11):4176-4184.
[31] FOO P C, NURUL NAJIAN A B, MUHAMAD N A, et al.Loop-mediated isothermal amplification (LAMP) reaction as viable PCR substitute for diagnostic applications:A comparative analysis study of LAMP, conventional PCR, nested PCR (nPCR) and real-time PCR (qPCR) based on Entamoeba histolytica DNA derived from faecal sample[J].BMC Biotechnology, 2020, 20(1):34.
[32] ZHANG M M, LIU J F, SHEN Z Q, et al.A newly developed paper embedded microchip based on LAMP for rapid multiple detections of foodborne pathogens[J].BMC Microbiology, 2021, 21(1):197.
[33] SAYAD A, IBRAHIM F, MUKIM UDDIN S, et al.A microdevice for rapid, monoplex and colorimetric detection of foodborne pathogens using a centrifugal microfluidic platform[J].Biosensors and Bioelectronics, 2018, 100:96-104.
[34] SHAO N, CHEN J W, HU J Y, et al.Visual detection of multiple genetically modified organisms in a capillary array[J].Lab on a Chip, 2017, 17(3):521-529.
[35] VASHISHTHA A K, KONIGSBERG W H.Effect of different divalent cations on the kinetics and fidelity of RB69 DNA polymerase[J].Biochemistry, 2016, 55(18):2661-2670.
[36] SIDDIQUE M P, JANG W J, LEE J M, et al.Detection of Vibrio anguillarum and Vibrio alginolyticus by singleplex and duplex loop-mediated isothermal amplification (LAMP) assays targeted to groEL and fklB genes[J].International Microbiology, 2019, 22(4):501-509.
[37] 黄旭春, 关丽梅, 况文东, 等.可视化LAMP技术快速检测新冠病毒的方法[J].江西科学, 2021, 39(4):593-596; 621.HUANG X C, GUAN L M, KUANG W D, et al.Rapid detection of SARS-CoV-2 by visual LAMP technology[J].Jiangxi Science, 2021, 39(4):593-596; 621.
[38] ALI S A, KAUR G, BOBY N, et al.Rapid and visual detection of Leptospira in urine by LigB-LAMP assay with pre-addition of dye[J].Molecular and Cellular Probes, 2017, 36:29-35.
[39] JI C, XUE S X, YU M, et al.Rapid detection of SARS-CoV-2 virus using dual reverse transcriptional colorimetric loop-mediated isothermal amplification[J].ACS Omega, 2021, 6(13):8837-8849.
[40] WANG X F, FU Z F, CHEN X Y, et al.Use of a novel metal indicator to judge loop-mediated isothermal amplification for detecting the 35S promoter[J].Analytical and Bioanalytical Chemistry, 2017, 409(4):881-889.
[41] 曾军辉. 可视化环介导等温扩增技术研究进展[J].广东畜牧兽医科技, 2016, 41(1):8-10;19.ZENG J H.Review on visualizable loop-mediated isothermal amplification[J].Guangdong Journal of Animal and Veterinary Science, 2016, 41(1):8-10;19.
[42] JIN B, MA B, LI J L, et al.Simultaneous detection of five foodborne pathogens using a mini automatic nucleic acid extractor combined with recombinase polymerase amplification and lateral flow immunoassay[J].Microorganisms, 2022, 10(7):1352.
[43] MA B, LI J L, CHEN K, et al.Multiplex recombinase polymerase amplification assay for the simultaneous detection of three foodborne pathogens in seafood[J].Foods, 2020, 9(3):278.
[44] MEI X R, ZHAI X W, LEI C W, et al.Development and application of a visual loop-mediated isothermal amplification combined with lateral flow dipstick (LAMP-LFD) method for rapid detection of Salmonella strains in food samples[J].Food Control, 2019, 104:9-19.
[45] JIANG Y J, CHEN S H, ZHAO Y M, et al.Multiplex loop-mediated isothermal amplification-based lateral flow dipstick for simultaneous detection of 3 food-borne pathogens in powdered infant formula[J].Journal of Dairy Science, 2020, 103(5):4002-4012.
[46] 刘宁伟. 三种食源性致病菌多重环介导恒温扩增检测技术研究[D].北京:中国人民解放军军事医学科学院, 2017.LIU N W.Study on multiplex loop-mediated isothermal amplification assay for the detection of three food-borne pathogens[D].Beijing:Academy of Military Medical Sciences, 2017.
[47] 张孟雨, 彭嘉屹, 韦锦源, 等.液滴微流控结合核酸扩增技术在食源性致病菌检测中的应用[J].食品工业科技, 2023, 44(18):484-491.ZHANG M Y, PENG J Y, WEI J Y, et al.Application of droplet microfluidic technology combined with nucleic acid amplification in the detection of foodborne pathogens[J].Science and Technology of Food Industry, 2023, 44(18):484-491.
[48] YUAN H, CHAO Y C, SHUM H C.Droplet and microchamber-based digital loop-mediated isothermal amplification (dLAMP)[J].Small, 2020, 16(9):1904469.
[49] FU J, CHIANG E L C, MEDRIANO C A D, et al.Rapid quantification of fecal indicator bacteria in water using the most probable number - loop-mediated isothermal amplification (MPN-LAMP) approach on a polymethyl methacrylate (PMMA) microchip[J].Water Research, 2021, 199:117172.
[50] 鞠鹤鹏, 戴菁, 谢逸欣, 等.LAMP微流控芯片快速检测三种食源性致病菌[J].解放军预防医学杂志, 2018, 36(3):309-313.JU H P, DAI J, XIE Y X, et al.Quick detection of three food-borne pathogens by LAMP micro fluidic chip[J].Journal of Preventive Medicine of Chinese PLA, 2018, 36(3):309-313.
[51] NANAYAKKARA I A, WHITE I M.Demonstration of a quantitative triplex LAMP assay with an improved probe-based readout for the detection of MRSA[J].The Analyst, 2019, 144(12):3878-3885.
[52] CREGO-VICENTE B, FERN NDEZ-SOTO P, GARC
NDEZ-SOTO P, GARC A -BERNALT DIEGO J, et al.Development of a duplex LAMP assay with probe-based readout for simultaneous real-time detection of Schistosoma mansoni and Strongyloides spp.:A laboratory approach to point-of-care[J].International Journal of Molecular Sciences, 2023, 24(1):893.
A -BERNALT DIEGO J, et al.Development of a duplex LAMP assay with probe-based readout for simultaneous real-time detection of Schistosoma mansoni and Strongyloides spp.:A laboratory approach to point-of-care[J].International Journal of Molecular Sciences, 2023, 24(1):893.
[53] 韦锦源, 刘丹, 杨静贤, 等.建立DARQ-LAMP方法快速检测单增李斯特菌[J].食品研究与开发, 2023, 44(3):162-168.WEI J Y, LIU D, YANG J X, et al.Development of DARQ-LAMP for rapid detection of Listeria monocytogenes[J].Food Research and Development, 2023, 44(3):162-168.
[54] TYAGI S, KRAMER F R.Molecular beacons:Probes that fluoresce upon hybridization[J].Nature Biotechnology, 1996, 14(3):303-308.
[55] SHERRILL-MIX S, HWANG Y, ROCHE A M, et al.Detection of SARS-CoV-2 RNA using RT-LAMP and molecular beacons[J].Genome Biology, 2021, 22(1):169.
[56] LIU W, HUANG S M, LIU N W, et al.Establishment of an accurate and fast detection method using molecular beacons in loop-mediated isothermal amplification assay[J].Scientific Reports, 2017, 7:40125.
[57] LI Q P, XUE H Y, FEI Y J, et al.Visual detection of rainbow trout (Oncorhynchus mykiss) and Atlantic salmon (Salmo salar) simultaneously by duplex loop-mediated isothermal amplification[J].Food Chemistry:Molecular Sciences, 2022, 4:100107.
[58] XUE H Y, CAO M, WANG S H, et al.Visual and rapid detection of escolar (Lepidocybium flavobrunneum) using loop mediated isothermal amplification in conjunction with a specific molecular beacon probe[J].Food Chemistry, 2024, 432:137262.
[59] WANG S Y, LIU N, ZHENG L Y, et al.A lab-on-chip device for the sample-in-result-out detection of viable Salmonella using loop-mediated isothermal amplification and real-time turbidity monitoring[J].Lab on a Chip, 2020, 20(13):2296-2305.
[60] XIONG J, HUANG B, XU J S, et al.A closed-tube loop-mediated isothermal amplification assay for the visual detection of Staphylococcus aureus[J].Applied Biochemistry and Biotechnology, 2020, 191(1):201-211.
[61] ZENDRINI A, CARTA V, FILIPELLO V, et al.One-day molecular detection of Salmonella and Campylobacter in chicken meat:A pilot study[J].Foods, 2021, 10(5):1132.
[62] YU Y B, LI R, MA Z H, et al.Development and evaluation of a novel loop mediated isothermal amplification coupled with TaqMan probe assay for detection of genetically modified organism with NOS Terminator[J].Food Chemistry, 2021, 356:129684.
[63] 张吉红, 王佳莹, 崔俊霞, 等.转基因油菜Ms8品系的LAMP检测[J].食品安全质量检测学报, 2018, 9(21):5592-5595.ZHANG J H, WANG J Y, CUI J X, et al.Detection of transgenic rapeseed line Ms8 by loop-mediated isothermal amplification[J].Journal of Food Safety &Quality, 2018, 9(21):5592-5595.
[64] TAKABATAKE R, KAGIYA Y, FUTO S, et al.Rapid screening detection of genetically modified papaya by loop-mediated isothermal amplification[J].Biological &Pharmaceutical Bulletin, 2023, 46(5):713-717.
[65] 肖剑, 梁美丹, 孙雪奇, 等.环介导等温扩增技术快速检测植物蛋白饮料中大豆成分[J].食品安全质量检测学报, 2021, 12(21):8433-8438.XIAO J, LIANG M D, SUN X Q, et al.Rapid detection of soybean components in vegetable protein beverages by loop-mediated isothermal amplification[J].Journal of Food Safety &Quality, 2021, 12(21):8433-8438.
[66] THANGSUNAN P, TEMISAK S, JAIMALAI T, et al.Sensitive detection of chicken meat in commercial processed food products based on one-step colourimetric loop-mediated isothermal amplification[J].Food Analytical Methods, 2022, 15(5):1341-1355.
[67] ZHANG H, CAO W W, ZHANG Y L, et al.Identification for meat adulteration (pork, beef, sheep and duck) in foodstuff by microfluidic chip-based real-time fluorescent LAMP[J].Journal of Food Composition and Analysis, 2023, 119:105223.
[68] FODDAI A C G, GRANT I R.Methods for detection of viable foodborne pathogens:Current state-of-art and future prospects[J].Applied Microbiology and Biotechnology, 2020, 104(10):4281-4288.