在饲料中通常会添加谷物成分,但是谷物中的植酸作为抗营养因子的一种,常与磷结合形成植酸磷[1],这一结合形态的磷不易被饲养动物吸收,从而造成磷元素的浪费,并随动物粪便排出进而可能造成环境污染。酶处理成为解决这一问题的有效方法之一[2]。植酸酶可以使植酸降解为肌醇和无机磷酸[3],在饲料中适当添加植酸酶可以分解饲料中的植酸,提高动物对磷的利用效率,减少磷元素的排放,减轻环境污染风险,降低企业生产成本,具有极高的经济、生态价值。
毕赤酵母属于甲醇营养型酵母,具有生长快、蛋白表达效率高,在简单培养条件下可实现高密度生长,且易于进行分子遗传学改造等优良特点,特别适合真核生物体来源的重组蛋白大规模工业化生产,是最有发展前景和商业价值的高效异源蛋白表达系统之一,目前被广泛地用于酶制剂的生产。例如史政豪等[4]利用毕赤酵母作为外源蛋白表达载体融合来自水蛭的透明质酸酶(hyaluronidase,HAase)基因发酵生产HAase,并对诱导阶段影响较大的因素(如诱导温度、甲醇浓度)进行工艺优化,提高了HAase的发酵产量,酶活力最高可达826 000 U/mL。陈洲等[5]将芽孢杆菌来源的碱性果胶酶在毕赤酵母中表达,在5 L发酵罐水平进行高密度发酵,其酶活力达到2 301.05 U/mL,为进一步工业化放大生产提供参考。
通过重组毕赤酵母基因工程菌发酵生产植酸酶并提高植酸酶的表达水平成为研究的热点。例如赵凯等[6]探究不同比生长速率控制甲醇流加策略对发酵产植酸酶的影响,通过工艺优化,提高了植酸酶表达水平。但上述研究中补料策略的选择多依赖于OD600值、湿重等指标,但这些离线生物量包含了死细胞和其他物质质量,而活菌生物量更能反映发酵体系中菌体的真实生长情况。因此,迫切需要引入在线检测仪器对植酸酶发酵过程活菌生物量进行检测并指导过程调控。
活细胞传感仪的应用可以有效解决上述问题,利用两对电极形成交变电场使具有完整细胞膜的活细胞被极化,极化程度通过电容值大小表现出来,在特征频率下,电容值与活细胞数量呈正相关,对于活菌生物量具有很好的监测效果[7]。本文在毕赤酵母发酵生产植酸酶过程中引入在线活细胞传感仪,首先在5 L发酵罐验证甲醇诱导阶段活菌浓度与OD600值、湿重、电容值的对应关系,在50 L罐植酸酶发酵过程优化实验中,将在线电容值数据、氧消耗速率(oxygen uptake rate,OUR)相结合,以此指导甲醇补料过程,并探究营养盐添加量、甲醇流加速率等因素对植酸酶表达的影响,对发酵过程进行优化,以期提高植酸酶表达水平,降低生产成本。
1 材料与方法
1.1 实验材料
1.1.1 菌株与试剂
菌株:重组毕赤酵母基因工程菌FZ-1(Mut+),由青岛蔚蓝生物集团有限公司构建并保存,分泌表达植酸酶。
主要试剂:酵母提取物、蛋白胨,OXOID公司;琼脂粉,北京奥博星生物技术有限公司;其余试剂均为国产分析纯或生化试剂。
1.1.2 培养基
种子培养基:酵母浸出粉胨葡萄糖 (yeast extract peptone dextrose, YPD)培养基。
发酵培养基:基础盐培养基(base salt medium, BSM),用葡萄糖替换甘油。
营养盐溶液(g/L):(NH4)2SO4 100,KH2PO4 100,MgSO4·7H2O 70。
PTM1溶液(g/L):MnSO4·H2O 3.0,CuSO4·5H2O 6.0,NaI 0.08,H3BO30.02,CoCl2·6H2O 0.5,Na2MoO4·2H2O 0.2,FeSO4·7H2O 65.0,ZnCl2 20.0,生物素0.2,98%(体积分数)H2SO4 5.0 mL/L。
其中葡萄糖、MgSO4·7H2O单独进行灭菌,生物素过滤除菌后添加,PTM1添加消泡剂后加入。
1.1.3 仪器与设备
FUTURA系列在线活细胞浓度测量仪,英国ABER公司;UV-5120型紫外可见分光光度计,尤尼柯上海仪器有限公司;5920 R型高速低温离心机,德国Eppendorf公司;多功能酶标仪,美国Thermo公司;FUG-5L单层玻璃上机械搅拌发酵罐、FUS-15L-50L-50L并行反应器,上海国强生化工程装备有限公司。
1.2 实验方法
1.2.1 种子培养
将保藏菌种划线培养在YPD培养基平板上,恒温箱中30 ℃培养,待长出单菌落,将单菌落接种于YPD种子培养液中,在30 ℃、200 r/min摇床中培养48 h。
1.2.2 甲醇诱导阶段电容值与生物量线性关系验证实验方法
在5 L发酵罐中当菌体生长开始后,溶氧会逐渐降低,待初始葡萄糖消耗殆尽后(标志为溶氧开始急速上升),开始流加质量分数为60%的葡萄糖溶液(含12 mL/L PTM1溶液),通过调整补料速率、搅拌转速和通气量保持溶氧在30%以上,补料速率设定为溶氧联动补料模式。待湿重增长至180 g/L左右时停止补料,饥饿30 min左右,准备流加甲醇诱导产酶。诱导产酶阶段调整甲醇的流加速率、通气和转速,控制溶氧在20%以上。发酵过程通过流加氨水控制pH值在4.5~5.0。数据采集过程是在甲醇诱导阶段(约为发酵时间24 h后)每隔8 h或16 h取样进行平板活菌计数并测定OD600值、湿重。
1.2.3 50 L罐植酸酶发酵过程优化实验方法
发酵液底料中含有30 g/L初始葡萄糖溶液,葡萄糖耗尽后溶氧回升,此时开始流加质量分数为60%的葡萄糖溶液(含PTM1溶液)直至诱导所需湿重180 g/L左右(此过程发酵时间大约24 h),之后停止流加葡萄糖,饥饿30 min左右,开始流加甲醇诱导产酶。流加氨水控制pH值在4.5左右。整个发酵过程每隔8 h或16 h取样检测各相关指标并留存样品。
实验在50 L-50 L两联发酵罐中进行,实验共4个批次,每个发酵批次均设置对照组和实验组,批次1为采用原始发酵工艺的对照批次,具体工艺为营养盐添加量100%,发酵21 h时开始顺控补料,发酵49 h时调控甲醇流加速率至1∶19(每20 s泵入1 s),发酵73 h时调控甲醇流加速率至1∶17,发酵97 h时调控甲醇流加速率至1∶14。批次2较批次1仅减少25%营养盐添加量考察其对发酵产酶的影响。批次3、批次4设置与批次2相同的75%营养盐添加量,在批次2甲醇流加策略的基础上,批次3在发酵125~161 h时逐步调控甲醇流加速率从1∶13至1∶11,批次4在发酵33 h时提前调控甲醇流加速率至1∶19,并在发酵33~165 h逐步提高甲醇流加速率至1∶10。实验设计如表1所示。
表1 植酸酶发酵过程优化实验设计
Table 1 Experimental design for the optimization of phytase fermentation
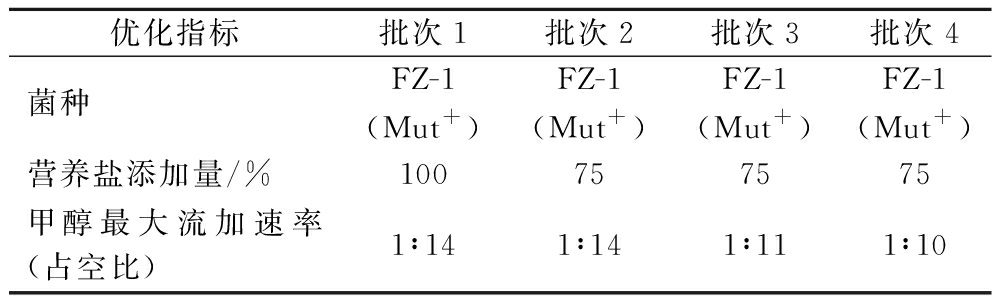
优化指标批次1批次2批次3批次4菌种FZ-1(Mut+)FZ-1(Mut+)FZ-1(Mut+)FZ-1(Mut+)营养盐添加量/%100757575甲醇最大流加速率(占空比)1∶141∶141∶111∶10
1.2.4 生化参数检测方法
5 L罐湿重测定方法:取10 mL发酵液,15 000 r/min离心15 min后倒去上清液,称菌体质量。
50 L罐湿重测定方法:取适当发酵液,先称发酵液质量,15 000 r/min离心15 min后倒去上清液,再称菌体质量。
OD600值:取发酵液稀释至适当倍数,使用紫外可见分光光度计于600 nm处测定吸光度值,OD600=稀释倍数×吸光度值。
平板活菌计数:在不同发酵阶段选择适宜的稀释倍数以及涂布量,涂布于YPD琼脂平板,30 ℃下培养48 h计数。
植酸酶酶活力:采用GB/T 18634—2009《饲用植酸酶活性的测定 分光光度法》。
植酸酶蛋白量:采用考马斯亮蓝法[8]测定蛋白量。
1.2.5 活细胞传感仪电容值、电导率值检测方法
首先将活细胞传感仪的电极插入发酵罐中,连同发酵培养基一起灭菌消毒,在接种之前,调整探头或传感器的位置,确保活细胞传感仪已经校准。通过全频扫描确定了适宜的检测频率为580 kHz,检测模式选择适宜毕赤酵母的单频检测模式。电导率与发酵培养基中带电离子的强度有关系,离子强度越高,电导率就越高[9]。对于电导率的测量,在测量之前记录基线值,然后在实验过程中进行比较。
2 结果与分析
2.1 甲醇诱导阶段电容值与生物量的线性关系分析
在5 L发酵罐进行电容值与生物量参数的相关性测试。由图1结果可知,甲醇诱导阶段OD600值、湿重、电容值与活细胞浓度之间存在线性关系,相关系数R2分别为0.915 9、0.939 1、0.956 7,但相较于OD600值、湿重与活菌浓度的相关性而言,电容值与活菌浓度之间的线性相关程度更高,表明两者拟合程度较好,所以在甲醇补料阶段电容值更能反映活菌生物量的变化趋势。
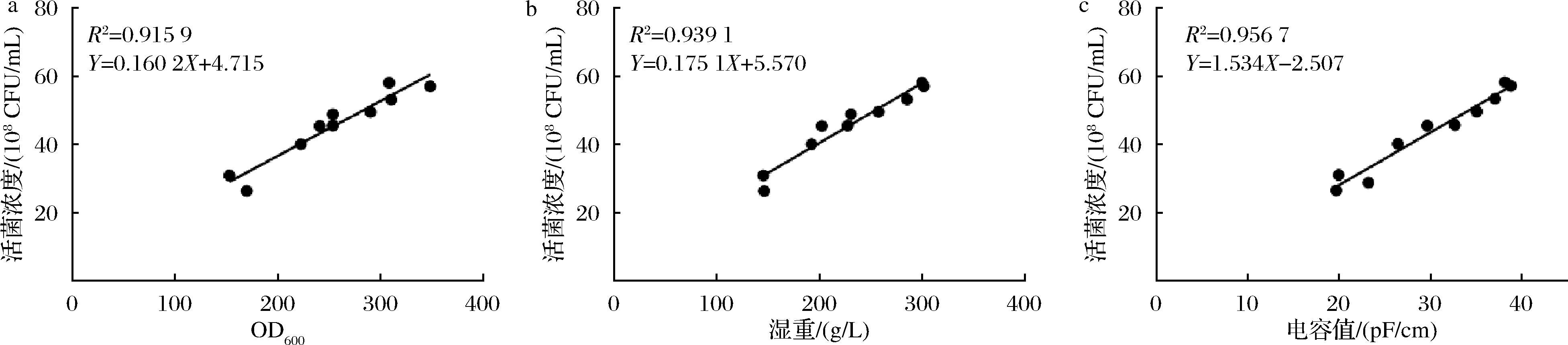
a-OD600;b-湿重;c-电容值
图1 不同参数表征的生物量与活细胞浓度之间关系
Fig.1 The relationship between viable cell concentration and biomass shown by different parameters
因此,在验证电容值与活菌生物量呈明显线性相关的基础上,进一步在50 L罐发酵优化实验中应用在线活细胞传感仪电容值、电导率值来及时、高效、理性地指导甲醇诱导阶段补料过程调控,探究不同培养条件下对发酵产酶的影响。
2.2 活细胞传感仪应用于50 L罐植酸酶发酵过程优化
2.2.1 营养盐的不同添加量对毕赤酵母产植酸酶的影响
营养盐和微量元素对于毕赤酵母的生长和产物的合成有着不可或缺的作用,其含有的金属离子可以作为酶的辅基对酶起到激活或抑制的作用,从而影响酶的发酵产量。其中选取合适的营养盐添加量尤为重要,营养盐浓度较高时会改变发酵体系内的pH值、渗透压、细胞膜的通透性等关键指标使发酵结果受影响[10]。其次,在大规模工业化生产时,高浓度的营养盐将会给后期污水处理增加压力,增添企业生产成本。因此,本实验在以往批次1原始对照工艺的基础上,通过批次2减少营养盐添加量来探究其对发酵产酶的影响。实验结果如图2所示。

a-电容值;b-电导率;c-OUR;d-湿重;e-酶活力浓度;f-蛋白量
图2 不同营养盐添加量发酵过程参数比较
Fig.2 Profiles of the fermentation with different nutrient salt contents
注:批次1:100%营养盐添加量;批次2:75%营养盐添加量。
由图2可知,批次2的电导率值在整个发酵周期都明显低于批次1,表明批次2发酵体系中离子浓度低于批次1,这与工艺控制条件是一致的。但批次2发酵中后期的湿重和酶活性指标略高于批次1,反应活细胞量的电容值整体高于批次1,这说明批次1原始发酵工艺的营养盐添加量可能过高,发酵初始阶段高浓度的营养盐使得体系内形成高渗透压,从而对发酵过程菌体的生长产生抑制。两批次发酵前期蛋白浓度差异不明显,但120 h后批次2蛋白量略低,其原因还需要进一步研究。后续诱导阶段甲醇补料速率工艺优化实验采用75%的营养盐添加量。
2.2.2 诱导阶段不同甲醇补料速率对毕赤酵母产植酸酶的影响
在毕赤酵母发酵产植酸酶过程中,甲醇诱导阶段菌体的生长和植酸酶的生成与甲醇的补料速率有着密切的关系,诱导阶段前期甲醇流加速率较快的话,容易造成菌体中毒,进而抑制生长和蛋白表达,诱导阶段后期甲醇流加量不够的话,产物的生产会受到影响,甚至菌种可能会因为营养缺乏而死亡[11]。因此,本实验通过批次3、批次4保持相同营养盐添加量改变诱导阶段甲醇流加速率,探究其对产酶的影响,以此提高植酸酶发酵产量,提升生产效率。实验结果如图3所示。

a-OUR;b-电容值;c-酶活力浓度;d-蛋白量;e-湿重;f-总酶活力
图3 诱导阶段不同甲醇补料速率对发酵过程的影响
Fig.3 The influence of methanol feeding rates on the fermentation during the induction stage
注:批次2:甲醇最大补料速率1∶14;批次3:甲醇最大补料速率1∶11;批次4:甲醇最大补料速率1∶10。
从图3可知,首先批次3在批次2的基础上在发酵中后期阶段逐步提高甲醇流加速率,其OUR数据相比于批次2在发酵126 h后有明显提高,电容值相较于批次2也略微增长,这是因为此时甲醇补料速率加快,碳源的供应量充足,菌体生长速率也明显加快。批次4在批次2基础上,在诱导初始阶段提前进行补料,并在发酵中后期阶段采取比批次3更高的补料速率,其OUR、电容值数据在诱导初始阶段和发酵中后期阶段相比于批次2、3都有着更明显的增长,这些对应的变化关系可以说明OUR、电容值等数据的变化趋势可以真实地反映甲醇补料速率调控下菌体的生长情况。其次随着甲醇流加速率的逐步提高,在诱导阶段开始后,批次4、批次3相比于批次2的湿重、产量、蛋白量、酶活力等参数均有提高,其中批次4相较于批次1对照组的提高尤为显著。从这些指标对比说明可能原始补料工艺发酵中后期甲醇作为碳源的供应量存在不足,影响到了菌体的生长。同时,比较蛋白量的变化说明原始工艺发酵中后期的甲醇补料速率在一定程度上也限制了甲醇作为外源蛋白诱导剂的作用,使得批次2植酸酶的表达量较批次3、4的表达量略低。
随着发酵过程调控研究的不断深入开展,基于多参数相关性分析的方法理念被用于指导发酵工艺优化和放大过程。李兰[12]在假气单胞菌发酵生产PHAs的过程中将电容值与过程质谱仪测得的生理代谢参数相结合,可以实时地感知细胞呼吸强度和比生长速率的变化情况,并发现与目标产物产量具有良好的相关性,可以作为工艺控制的关键参数。因此,基于OUR和电容值参数分阶段逐步提高诱导阶段甲醇补加速率,将使得甲醇补料过程更具有针对性,实现了植酸酶的高效表达。
2.2.3 基于活细胞传感仪在50 L罐规模优化毕赤酵母生产植酸酶
如表2所示,批次4在甲醇、氨水补料量合理地增长的情况下,对比于批次1的湿重、酶活力、发酵指数等发酵指标均有所提高,其中批次4的最大酶活力、总酶活力、发酵指数等发酵指标增长显著,相比于批次1分别提高了29.8%、42.6%、42.6%。另外,批次4的酶活力-甲醇得率、湿重-甲醇得率相比于批次1也分别提高了10.4%、8.1%。这些发酵指标的对比说明基于活细胞传感仪优化50 L罐植酸酶发酵过程,不仅提高了植酸酶的表达活性以及甲醇的利用率,实现了植酸酶产量的提升,同时也为后续进一步实现诱导阶段甲醇自动反馈补料提供了数据参考。
表2 植酸酶发酵优化过程主要指标对比
Table 2 Comparison of the main indexes of phytase fermentation during process optimization
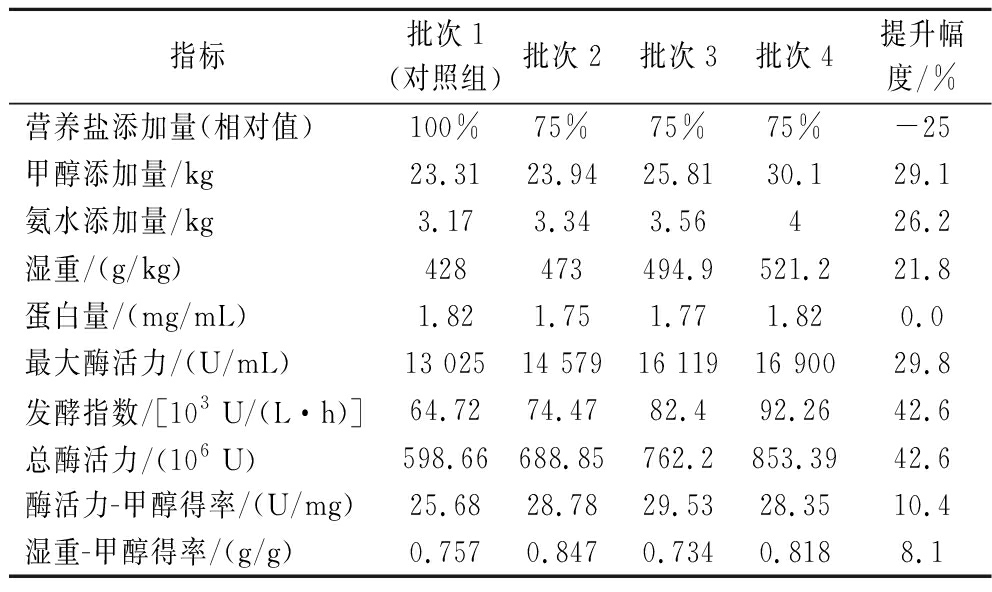
指标批次1(对照组)批次2批次3批次4提升幅度/%营养盐添加量(相对值)100%75%75%75%-25甲醇添加量/kg23.3123.9425.8130.129.1氨水添加量/kg3.173.343.56426.2湿重/(g/kg)428473494.9521.221.8蛋白量/(mg/mL)1.821.751.771.820.0最大酶活力/(U/mL)13 02514 57916 11916 90029.8发酵指数/[103 U/(L·h)]64.7274.4782.492.2642.6总酶活力/(106 U)598.66688.85762.2853.3942.6酶活力-甲醇得率/(U/mg)25.6828.7829.5328.3510.4湿重-甲醇得率/(g/g)0.7570.8470.7340.8188.1
3 结论
本研究首先在毕赤酵母发酵产植酸酶过程的甲醇诱导阶段将OD600值、湿重以及在线活细胞传感仪测得的电容值与活菌浓度之间的线性关系分别进行验证,结果表明,活菌浓度与电容值之间具有更好的对应关系,相关性系数R2=0.956 7。其次本研究利用活细胞传感仪测得的电容值、电导率参数和生理代谢参数OUR指导50 L罐植酸酶发酵过程优化,重点探究了营养盐添加量和诱导阶段不同甲醇流加速率对植酸酶生产的影响,发现适当地减少营养盐添加量并分阶段逐步提高诱导阶段甲醇流加速率既可以保证菌体的生长,又使得植酸酶得到充分诱导表达,提高了原材料利用效率。在营养盐添加量为75%、最大甲醇流加速率为1∶10(占空比)的条件下,50 L罐发酵终点植酸酶的最大酶活力和总酶活力分别达到16 900 U/mL和853.39×106U,比优化前提高了29.8%和42.6%。由上可见,在线活细胞传感仪为毕赤酵母发酵产植酸酶过程的活菌浓度在线监测与甲醇补料控制提供了一种实时高效的工具。
[1] GOUFO P, FERREIRA L M M, TRINDADE H, et al.Distribution of antioxidant compounds in the grain of the Mediterranean rice variety ‘Ariete’[J].CyTA - Journal of Food, 2015, 13(1):140-150.
[2] 李娟娟, 刘艺欢, 陈东方, 等.谷物制品的生物加工研究进展[J].食品工业科技, 2020, 41(13):358-363.LI J J, LIU Y H, CHEN D F, et al.Research progress of bio-processing of cereal products[J].Science and Technology of Food Industry, 2020, 41(13):358-363.
[3] SINGH B, BOUKHRIS I, PRAGYA, et al.Contribution of microbial phytases to the improvement of plant growth and nutrition:A review[J].Pedosphere, 2020, 30(3):295-313.
[4] 史政豪, 陈高明, 肖媛, 等.毕赤酵母发酵产透明质酸酶的研究[J].现代工业经济和信息化, 2021, 11(10):235-236;241.SHI Z H, CHEN G M, XIAO Y, et al.Study of hyaluronidase production by fermentation of Pichia abies[J].Modern Industrial Economy and Informationization, 2021, 11(10):235-236;241.
[5] 陈洲, 王亚森, 汪步青, 等.枯草芽孢杆菌来源的碱性果胶酶在毕赤酵母中的高效表达[J].食品科技, 2022, 47(2):1-9.CHEN Z, WANG Y S, WANG B Q, et al.High-efficiency expression of alkaline pectinase from Bacillus subtilis in Pichia pastoris[J].Food Science and Technology, 2022, 47(2):1-9.
[6] 赵凯, 葛菁华, 王海.不同比生长速率对毕赤酵母发酵生产植酸酶的影响[J].山东科学, 2018, 31(5):43-47.ZHAO K, GE J H, WANG H.Effects of different specific growth rates on phytase production by Pichia pastoris fermentation[J].Shandong Science, 2018, 31(5):43-47.
[7] YING Y L, HU Y X, GAO R, et al.Wireless nanopore electrode for electron transfer imaging in live cells[J].Biophysical Journal, 2019, 116(3):315a.
[8] GRINTZALIS K, GEORGIOU C D, SCHNEIDER Y J.An accurate and sensitive Coomassie Brilliant Blue G-250-based assay for protein determination[J].Analytical Biochemistry, 2015, 480:28-30.
[9] LI C W, WANG Y, SHA S, et al.Analysis of the tendency for the electronic conductivity to change during alcoholic fermentation[J].Scientific Reports, 2019, 9(1):5512.
[10] 王蕊, 王林风, 闫德冉, 等.基因工程菌毕赤酵母发酵产纤维二糖酶条件研究[J].山东化工, 2015, 44(17):17-21.WANG R, WANG L F, YAN D R, et al.Fermentation conditions of cellulose enzyme by genetic engineered Pichia pastoris strain[J].Shandong Chemical Industry, 2015, 44(17):17-21.
[11] 孙玮遥, 王向东, 林剑.外源蛋白在毕赤酵母中的高效表达策略[J].中国酿造, 2016, 35(9):11-15.SUN W Y, WANG X D, LIN J.High efficiency expression strategy for heterologous protein in Pichia pastoris[J].China Brewing, 2016, 35(9):11-15.
[12] 李兰. 活细胞传感仪在生物过程优化中的应用研究与开发[D].上海:华东理工大学, 2014.LI L.Studies on the Application and Development of Biomass Monitor in Bioprocess Optimization[D].Shanghai:East China University of Science and Technology, 2014.