副溶血性弧菌(Vibrio parahaemolyticus)属于革兰氏阴性菌,是世界范围内食用海鲜引起食源性疾病爆发的主要原因之一[1]。它主要存在于水生环境及海产品中,当食用生或未熟的海鲜易染此类病菌,严重时会引发急性胃肠炎及败血症,甚至休克和死亡[2]。近年来,全世界范围内的V.parahemolyticus感染事故频发。在2006~2017年,美国V.parahemolyticus感染的数量平均每年增加54%[3],而我国平均每年有523.5例感染病例[4]。因此,解决副溶血性弧菌对人类健康造成的威胁是刻不容缓的。
植物源天然防腐剂的来源非常广泛,这些植物为抵御外界的威胁自身会分泌一些次级代谢物,故具有抑制细菌、酵母和霉菌的生长繁殖的作用[5]。近年来,许多国内外研究学者证实了植物中单一成分复配物和提取复合物抑制副溶血性弧菌的能力。刘文伟等[6]研究发现0.5 g/L的茶多酚可以有效抑制副溶血性弧菌的生长。PALAMAE等[7]发现,茶多酚与壳聚糖结合物对副溶血性弧菌的最低抑菌浓度能达到1.024 mg/mL。谢庆超等[8]发现,蓝莓提取物在100 mg/mL的质量浓度下对副溶血性弧菌的抑制率达到100%。
栀子花是茜草科药食两用栀子(Gardenia jasminoides Ellis)的芳香花,是栀子中未被重视和应用的部分[9]。它不仅是道路绿化、庭院美化的优势树种之一,还可食用药用,具有清热解毒、润肺止咳的功效。现代药理研究证实了栀子花提取物的几种生物活性,例如抗氧化活性、抗炎活性和抑菌活性[10]等。栀子花中含有酚酸、黄酮和其他植物衍生的化合物,其中一些在体外已显示出强大的抑菌能力[11]。迄今为止,关于系统研究栀子花对海产品的抑菌作用及机理的还未报道。因此,栀子花在抑制V.parahemolyticus对食用海产品的危害是值得研究的,以寻找到其潜在的抑菌活性机理和在食品工业中的应用。
经过前期实验比较了不同提取和富集工艺,筛选出栀子花乙醇提取物(GFE-EA)为栀子花的最佳抑菌有效组分。本文研究了GFE-EA对V.parahemolyticus的抑菌活性及机理,包括细胞壁膜通透性、完整性,细胞形态、胞内参与能量代谢和维持细胞稳态的酶和产物以及DNA的构象等方面,为栀子花在天然食品防腐剂中的应用提供理论依据和参考。
1 材料与方法
1.1 样品制备
栀子花于2022年6月采自浙江农林大学坪山基地的山栀子。将新鲜的栀子花清洗擦干,经烘箱45 ℃低温干燥后,磨粉过40目筛。经过前期的工艺探索和活性评价,得出最佳提取工艺:乙醇浓度36%,液固比16∶1,提取温度70 ℃,提取时间3.8 h。再使用乙酸乙酯萃取得到栀子花乙醇提取物GFE-EA。
1.2 菌种、培养基与试剂
V.parahemolyticus:RIMD 2210633,来自浙江农林大学动物科技学院馈赠。
LB(Luria-Bertani)培养基:1%胰蛋白胨、0.5%酵母提取物、2% NaCl,英国OXOID公司,高压灭菌备用。
试剂:N-苯基-1-萘胺(N-phenyl-1-naphthylamine,NPN)、1,6-二苯基-1,3,5-已三烯(1, 6-diphenyl-1,3, 5-hexatriene,DPH),上海阿拉丁生化科技股份有限公司;过氧化氢酶(catalase,CAT)测定试剂盒、总超氧化物歧化酶(total-superoxide dismutase,T-SOD)测试盒、超微量总ATP酶(ATPase)试剂盒、ATP含量测定试剂盒、丙二醛测定试剂盒、活性氧测定试剂盒,南京建成生物工程研究所;其他试剂均为国产分析纯。
1.3 仪器与设备
VELOCITY 14R冷冻离心机,英国Dynamica公司;Synergy H1酶标仪,美国BIOTEK公司;JY92-II超声波细胞粉碎机,宁波新艺超声设备有限公司;UV-5500紫外分光光度计,上海元析仪器有限公司;-80 ℃超低温冰箱,美国Thermo Scientific公司。
1.4 菌种活化
将-80 ℃保藏的菌种接种到液体培养基中活化,37 ℃ 150 r/min培养24 h。培养出的菌悬液在相应固体培养基上三区划线。接种单个菌落到相应液体培养基中培养24 h,稀释到合适浓度备用。
1.5 抑菌圈直径的测定
根据WANG等[12]描述的方法进行了抑菌性测定,采用琼脂孔扩散法测定受试物的抑菌圈直径。每个无菌培养皿(90 mm)中倾倒25 mL的培养基,凝固后加入1×108 CFU/mL浓度的菌液,用玻璃珠均匀涂板,放置0.5 h以上后用打孔器在培养基上打孔(6 mm),每孔分别加入不同浓度的GFE-EA和阴性对照DMSO(100 μL)。在37 ℃下培养24 h后,采用游标卡尺十字交叉法测定抑菌圈直径(mm)。
1.6 最低抑菌浓度和最低杀菌浓度的测定
参照美国临床实验室标准化委员会(Clinical and Laboratory Standards Institutes,CLSI)微量稀释法[13],在无菌96孔板中加入180 μL液体培养基和梯度稀释的样品,与20 μL菌体浓度为1×108 CFU/mL菌悬液混合,37 ℃培养24 h,使用多功能酶标仪在600 nm处测定光密度值。得到的光密度值与不加菌液的阴性对照组之差小于0.05的最低给样浓度被定义为最低抑菌浓度(minimal inhibit concentration,MIC)。选取大于等于MIC的样品浓度的孔内液体进行涂板,平板上菌落数少于5个的最低给样浓度被定义为最低杀菌浓度(minimum bactericidal concentration,MBC)。
1.7 抑菌机理的研究
1.7.1 生长曲线的测定
参考高瑞芳等[14]的方法将培养到对数期的V.parahemolyticus接种到含不同GFE-EA浓度的液体培养基中,使其终浓度为1×107~1×108 CFU/mL。放置在37 ℃ 150 r/min摇床中培养24 h,每2 h测定其OD600值监测细菌生长情况。
1.7.2 V.parahemolyticus细胞内容物泄露的测定
参考SUN等[15]的方法并略有修改。将培养到对数期的V.parahemolyticus用PBS清洗3次后,调节菌悬液浓度后加入不同浓度的GFE-EA。摇床培养8 h后,离心测其上清液的OD260、OD280值和蛋白质含量。
1.7.3 V.parahemolyticus细胞膜通透性的测定
参考周志娥等[16]的方法但略有改动。将培养到对数期的V.parahemolyticus清洗后调节菌悬液浓度,分别加入不同浓度的GFE-EA,在摇床中反应1 h。离心收集菌体细胞并清洗,调节菌悬液浓度,加入终浓度为1×10-4 mol/L 的NPN,分别通过荧光激发光波长350 nm,发射光波长420 nm来测定其荧光强度。
1.7.4 V.parahemolyticus细胞膜流动性的测定
参照王铭遥等[17]的方法稍作修改。将培养到对数期的V.parahemolyticus清洗后调节菌悬液浓度,加入不同浓度的GFE-EA在恒温摇床下反应不同时间。离心收集菌体细胞并用PBS清洗2次。调节菌悬液浓度后加入DPH,使其终浓度为 1×10-6 mol/L。室温避光孵育 30 min后通过荧光激发光波长360 nm,发射光波长460 nm测定其荧光强度。
1.7.5 V.parahemolyticus细胞膜完整性的测定
使用碘化丙啶(propidium iodide,PI)荧光探针来检测细菌细胞膜的完整性,参考孙畅等[18]的方法,并稍作修改。将培养到对数期的V.parahemolyticus清洗后,调节菌悬液浓度,分别加入不同浓度的GFE-EA后在恒温摇床中反应不同时间。离心收集菌体细胞并用PBS清洗后调节菌悬液浓度,加入终浓度为3×10-5 mol/L的PI,在黑暗冰浴中反应15 min后通过荧光激发光波长530 nm,发射光波长620 nm测定其荧光强度。
1.7.6 扫描电子显微镜(scanning electron microscope,SEM)观察细胞形态
参考ZHOU等[19]的方法,观察V.parahemolyticus的外观形态变化。将不同浓度的GFE-EA和稀释好的菌悬液加入到液体培养基中,在摇床中培养12 h。离心收集菌体细胞并用PBS清洗2次。然后将菌体细胞在体积分数为2.5%戊二醛中4 ℃固定12 h。采用乙醇梯度脱水和临界点干燥后,镀膜观察。
1.7.7 V.parahemolyticus细胞内CAT、T-SOD、ATP活力的测定
将培养到对数期的V.parahemolyticus清洗并调节浓度,加入不同浓度的GFE-EA,放入恒温摇床中培养不同时间,离心清洗菌体3次。将菌液进行超声波破碎细胞,得到不同浓度和时间处理的菌液。
按照试剂盒的要求和步骤对CAT、T-SOD、ATP活力进行测定,并用公式计算。
1.7.8 V.parahemolyticus细胞内ATP、MDA含量的测定
将培养到对数期的V.parahemolyticus处理后调节浓度,加入不同浓度的GFE-EA放入温摇床中培养不同时间后取出,离心清洗菌体3次。将菌液进行超声破碎细胞,得到不同浓度和时间处理的菌液。
按照试剂盒的要求和步骤对ATP、MDA含量进行测定,并用公式计算。
1.7.9 对V.parahemolyticus细胞内活性氧(reactive oxygen species,ROS)的测定
参考王虎玄等[20]的方法,使用试剂盒检测细胞内活性氧含量。菌悬液与1×10-5 mol/L的2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorofluorescein diacetate,DCFH-DA)在37 ℃下孵育1 h。离心收集细胞,用PBS清洗细胞外多余的探针。将细菌细胞与不同浓度GFE-EA在37 ℃孵育6 h,在激发波长488 nm和发射光波长525 nm处检测其荧光强度。
1.7.10 对V.parahemolyticus基因组DNA的结合作用
根据ZHOU等[19]的方法研究V.parahemolyticus对DNA的作用。
(a)根据荧光强度判断GFE-EA对细菌基因组DNA的影响。将活化后的V.parahemolyticus过夜培养,使用细菌基因组DNA试剂盒提取DNA,分别加入不同浓度的GFE-EA。避光室温反应15 min后在激发光波长280 nm、发射光波长300~500 nm的范围内测定其荧光强度。
(b)琼脂糖凝胶电泳检测GFE-EA对细菌基因组DNA的作用。提取好的细菌基因组DNA与不同浓度的GFE-EA混合,将混合物在室温下避光反应30 min,使用琼脂糖凝胶电泳检测。
1.8 数据分析
数据采用 SPSS 22 软件进行单因素方差分析(analysis of variance,ANOVA),Tukey检验进行组间比较,Origin Pro 2021进行作图。所有数据结果均以平均值±标准偏差的形式来表示,显著水平为P<0.05。
2 结果与分析
2.1 抑菌活性的测定
由表1,GFE-EA对V.parahemolyticus的MIC为2.5 mg/mL,说明其有较好的抑菌活性。MBC为20 mg/mL,说明在此质量浓度下GFE-EA对V.parahemolyticus有明显的杀灭效果。
表1 GFE-EA对副溶血性弧菌MIC和MBC测定结果
Table 1 Results of MIC and MBC determination of V.parahemolyticus by GFE-EA

质量浓度/(mg/mL)MICMBC20--10-+5-+2.5-+1.25++0.63++0.31+++0.16++++
注:“-”代表无细菌长出,“+”代表有少量细菌长出,“++”代表有大量细菌长出。
2.2 不同浓度GFE-EA对V.parahemolyticus生长繁殖的影响
生长曲线可以直接反映细菌生长繁殖的状态和速度。如图1,对照组及低浓度GFE-EA处理的V.parahemolyticus生长正常,显示出典型的迟缓期、对数期、稳定期和衰亡期。经1/2MIC样品处理过的V.parahemolyticus对数期延缓,生长繁殖受到了明显的抑制。当给样浓度为MIC时,细菌的生长繁殖基本被抑制。
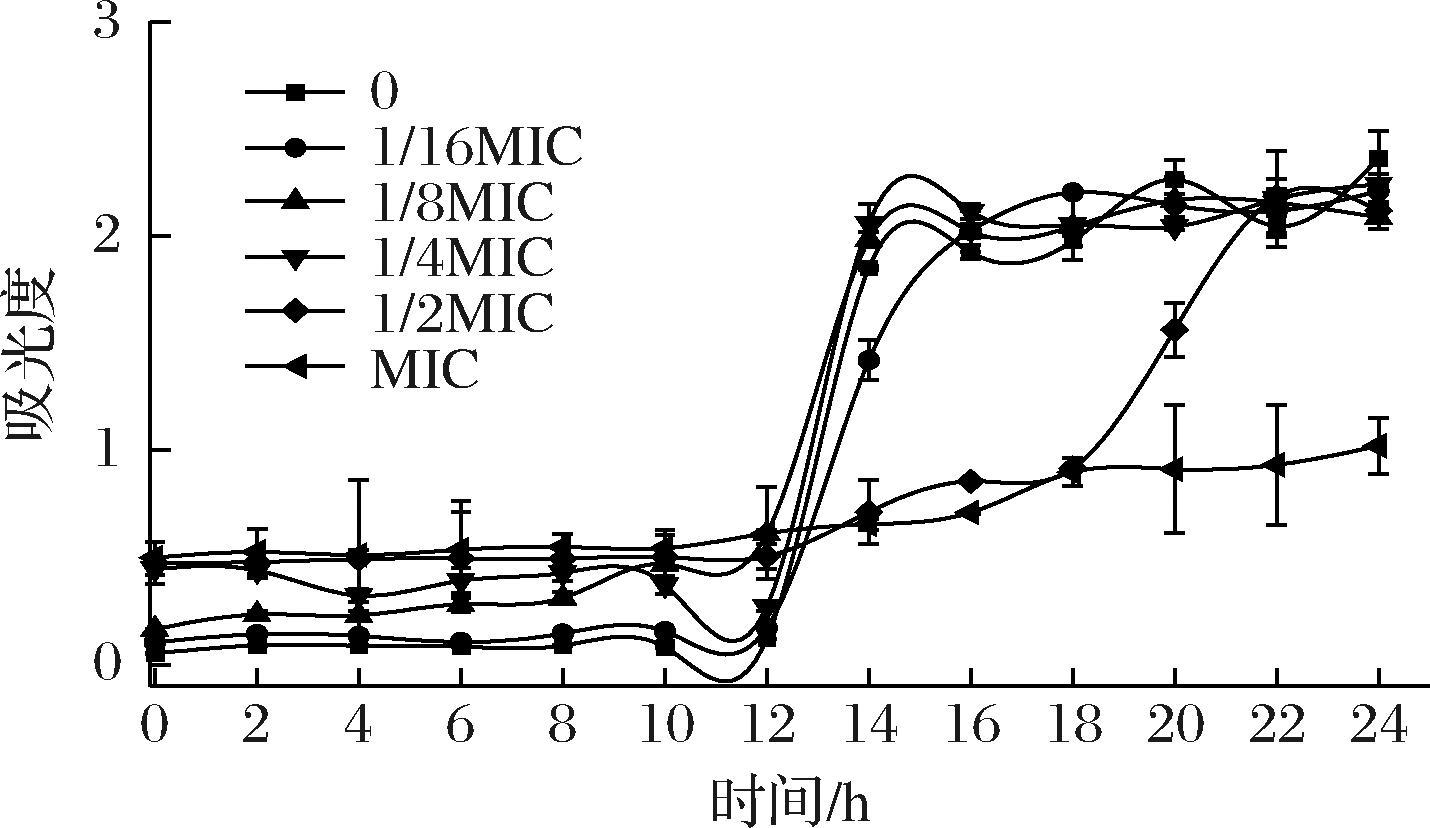
图1 GFE-EA作用下V.parahemolyticus的生长曲线
Fig.1 Growth curves of V.parahemolyticus under GFE-EA
2.3 GFE-EA对V.parahemolyticus细胞内容物泄露的影响
细菌细胞内容物含有的生物大分子(核酸等)在260、280 nm下有强吸收光。如图2,经MBC处理的V.parahemolyticus比对照组的OD260和OD280升高了26.4倍和20.3倍,蛋白质含量对比对照组增加了47.7倍。结果表明,经过高浓度GFE-EA的处理,菌体细胞内大分子物质大量泄露。
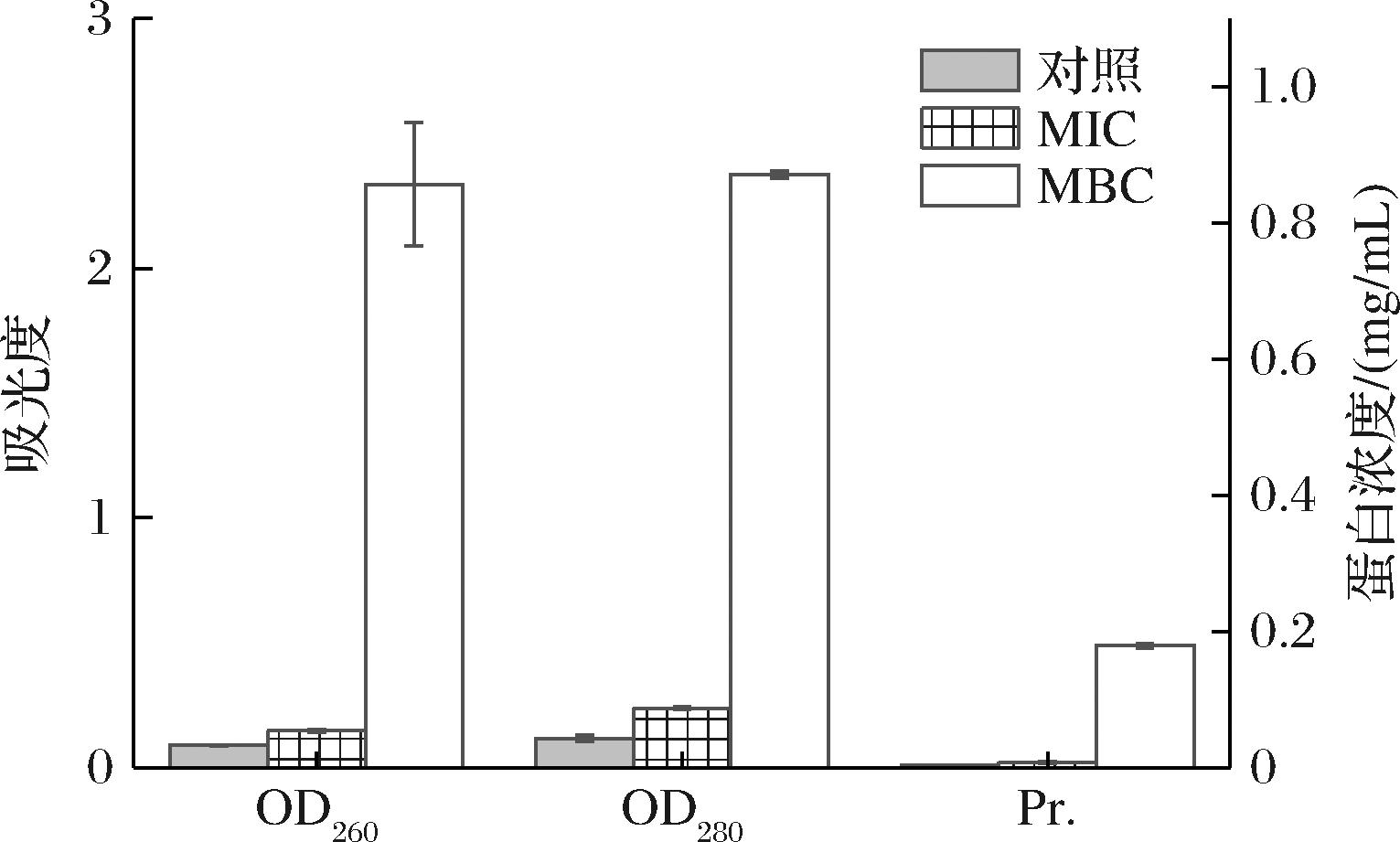
图2 GFE-EA作用下V.parahemolyticus细胞内容物泄露情况
Fig.2 Leakage of V.parahemolyticus contents under GFE-EA
注:OD260和OD280数据参考左侧纵坐标吸光度,Pr.(蛋白质)参考右坐标蛋白浓度。
2.4 GFE-EA对V.parahemolyticus细胞膜通透性、流动性和完整性的影响
NPN处理过的V.parahemolyticus的荧光强度可以反应GFE-EA作用下细胞膜通透性的变化。如图3-a,当浓度达到MIC时,NPN的荧光强度达到最大。在经过2MIC处理后,荧光强度呈下降的趋势。这可能是因为在高浓度处理下,膜的结构遭到破坏,细胞裂解,细胞液流出,使得NPN无法进入到疏水环境中产生荧光。
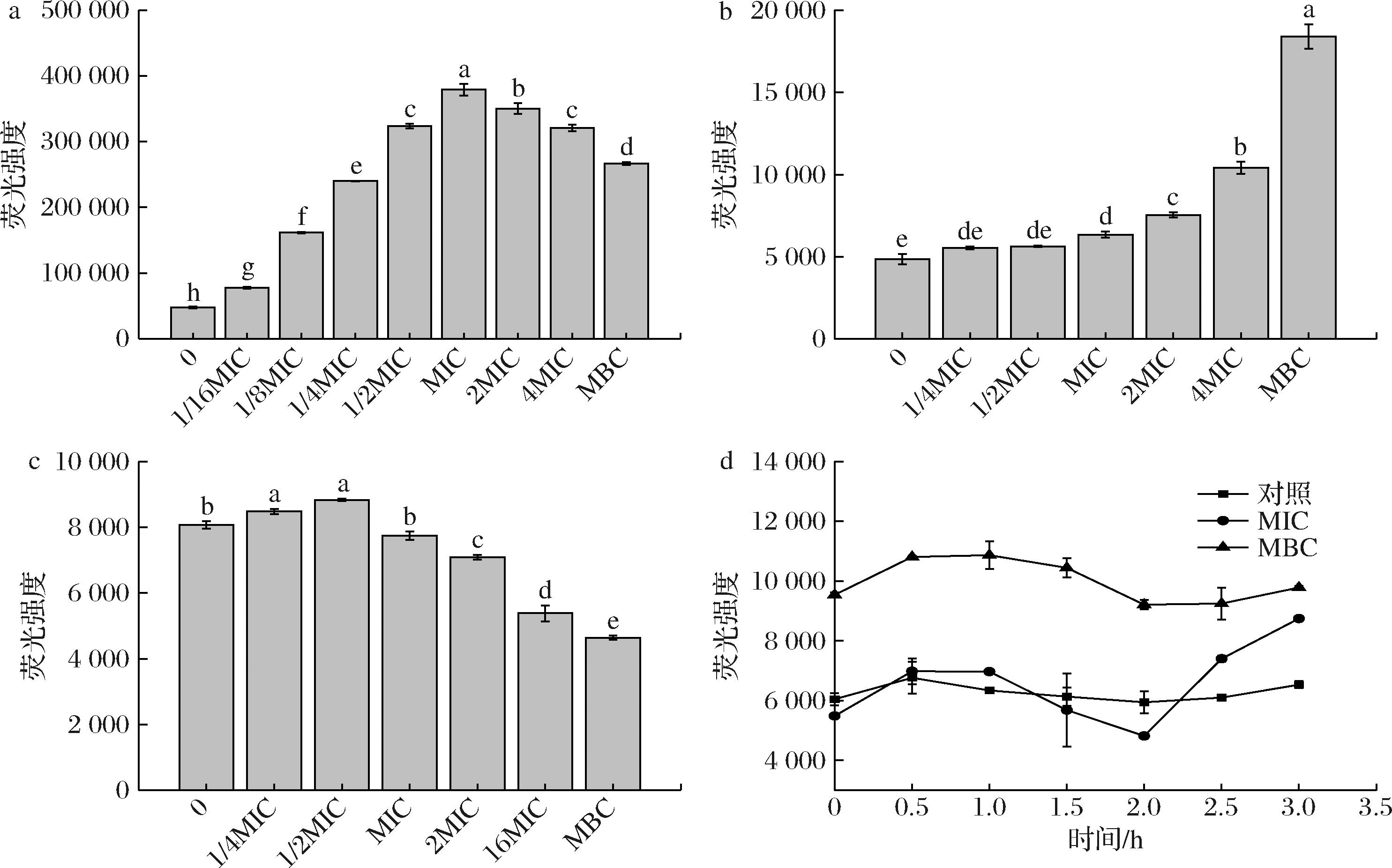
a-细胞膜通透性;b-细胞膜流动性;c-不同GFE-EA浓度对细胞膜完整性的影响;d-不同时间内GFE-EA细胞膜完整性的影响
图3 不同浓度GFE-EA对V.parahemolyticus膜通透性、流动性和完整性的影响
Fig.3 Effects of different concentrations of GFE-EA on permeability, fluidity and integrity of V.parahemolyticus membrane
注:不同小写字母表示差异显著(P<0.05)(下同)。
测定DPH的荧光强度可以有效反应细胞膜流动性状况,荧光强度越高,膜流动性越差。由图3-b可知,随着浓度的增加,荧光强度呈现逐渐上升的趋势,说明细胞膜流动性逐渐变差。
PI 荧光探针不能穿透完整的细胞膜,只能在细胞膜受损后进入细胞内部与细胞核结合使 DNA 染成红色,导致荧光强度增强。因此,通过检测荧光强度的变化可以直观了解PI荧光探针穿透细胞膜进入细胞情况,从而反映V.parahemolyticus细胞膜完整性变化情况。如图3-c所示,V.parahemolyticus 经低浓度 GFE-EA处理时,荧光强度呈缓慢上升的状态。当处理浓度高于MIC时,V.parahemolyticus的荧光强度逐渐下降,且浓度增大有持续下降趋势。而由图3-d可知,经对照组和MIC处理过的V.parahemolyticus荧光强度基本保持不变,说明细胞膜一直保持较好的完整性。经MIC处理的V.parahemolyticus在1~2 h的荧光强度降低,这可能是因为受到攻击的菌体触发了细胞的自我保护机制。而2 h后荧光强度升高,说明此时其细胞无法抵御GFE-EA的攻击,膜完整性遭到破坏。而经MBC处理后从0~2 h起就保持了较高的荧光强度,说明高浓度的GFE-EA对菌细胞壁膜系统的破坏作用十分迅速和高效。
2.5 GFE-EA对V.parahemolyticus细胞外观形态的影响
为明确GFE-EA对V.parahemolyticus细胞壁膜和结构形态的影响,通过扫描电子显微镜观察经GFE-EA作用12 h的细菌细胞形态变化。如图4,未经处理的V.parahemolyticus呈弧状和棒状,是两端圆钝的短杆状,菌体细胞形态完整,边缘清晰整齐,外观饱满,折光性好。经MIC处理的V.parahemolyticus呈现出较明显的损伤,包括表面有轻度不规则的破损,部分菌体有凹陷、起皱及囊泡状,且有断裂倾向。而经MBC处理的V.parahemolyticus,其细胞形态完全被破坏,大部分细胞被裂解,原生质外泄,细胞堆积且细胞表面黏附着大量的破损细胞碎片。

a-对照组;b-MIC处理组;c-MBC处理组
图4 不同浓度GFE-EA处理V.parahemolyticus的扫描电镜图
Fig.4 Scanning electron microscopy of V.parahemolyticus treated with different concentrations of GFE-EA
2.6 GFE-EA对V.parahemolyticus细胞内CAT、T-SOD、ATP活力的影响
CAT和T-SOD是细菌细胞内重要的抗氧化酶,可以直接参与清除细胞内氧化自由基等物质。如图5-a所示,对照组别中6 h内处理V.parahemolyticus的CAT含量无显著的变化。经高于MIC浓度处理过的菌体细胞中,CAT含量呈现先上升再下降的趋势,这可能是因为菌体为维护内环境稳态而加强细胞内抗氧化能力。而经MBC处理过的细菌细胞,对比对照组和MIC组在不同的处理时间有着更低的CAT含量。

a-CAT;b-T-SOD;c-ATP
图5 GFE-EA作用对V.parahemolyticus细胞内CAT、T-SOD、ATP活力的影响
Fig.5 Effect of GFE-EA on CAT、T-SOD、ATP activity in V.parahemolyticus
如图5-b所示,正常生长的V.parahemolyticus胞内T-SOD活力在1~6 h内无明显的变化。当添加GFE-EA浓度为MIC时,V.parahemolyticus内T-SOD活力在2~3 h内有明显上升,在3 h时酶活性分别达到最高点,这可能是因为细菌受到了外界威胁后,菌体内开始提高T-SOD活力以抵抗增多的自由基,进行自我保护。3 h后酶活对比未处理组别有显著降低,且低于正常的酶活力。而经过MBC浓度处理的菌体T-SOD活力与MIC处理过的升降趋势一致,但对比低浓度处理降幅较大。
ATP是参与细菌细胞内能量代谢和物质转运功能等以维持细胞正常生理功能的一种很重要的蛋白酶。如图5-c所示,V.parahemolyticus对照组的ATP活力在0~3 h呈上升趋势,在3~6 h内缓慢下降,说明在0~3 h细菌细胞进入新的环境,开始快速生长发育,需要的能量增加,故此时的酶活力迅速上升。当添加了浓度为MIC和MBC的GFE-EA,随着作用时间的增加,酶活力逐渐下降,直至ATP活力基本失活。
2.7 GFE-EA对V.parahemolyticus细胞内ATP、MDA含量的影响
ATP含量可反映细胞的存活状况,且与活细胞数密切相关。如图6-a所示,对照组在0~2 h内有下降趋势,在2 h后ATP含量趋于稳定,可能是因为细菌刚进入新的环境时,需要消耗能量来维持菌体稳定。经MIC和MBC浓度的GFE-EA处理的菌体ATP含量逐渐下降,在6 h时降为最低。
MDA的积累不仅能影响线粒体中的酶活性,还能加速膜的损伤。通过测定细菌细胞内MDA含量,可以反应出其脂质氧化程度和细胞受损水平。如图6-b可知,对照组V.parahemolyticus的MDA含量比较稳定,无大幅波动。经MIC和MBC处理6 h后,V.parahemolyticus的MDA含量分别有一定程度的上升,与对照组相比有显著的增加。
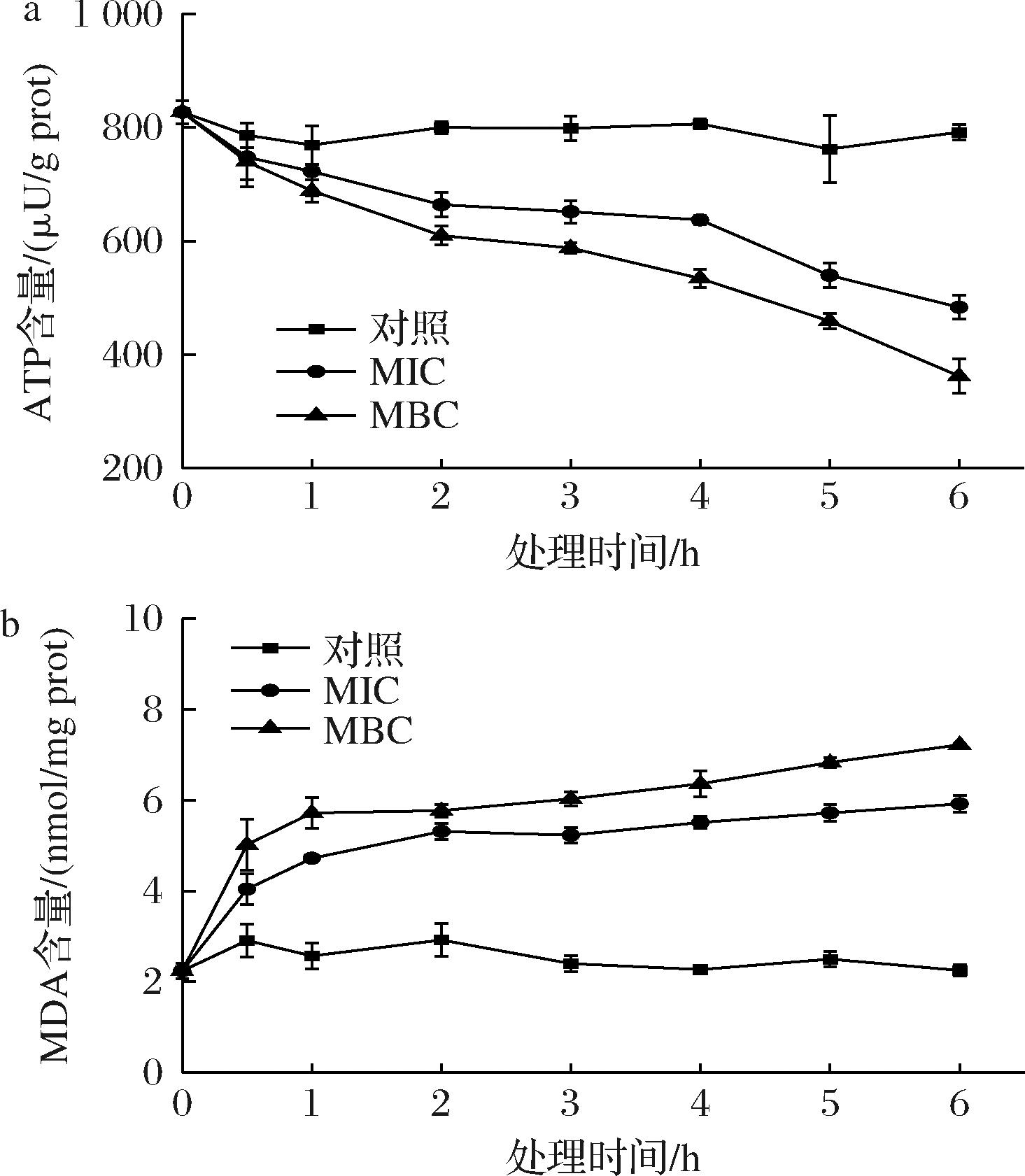
a-ATP含量;b-MDA含量
图6 GFE-EA作用对V.parahemolyticus细胞内ATP、MDA含量的影响
Fig.6 Effect of GFE-EA on ATP、MDA content in V.parahemolyticus
2.8 GFE-EA对V.parahemolyticus细胞氧化损伤的影响
ROS水平会引起细胞中的氧化还原平衡发生变化,会导致一系列细胞机能障碍。通过检测装载DCFH-DA探针的荧光强度,可以判断细胞内ROS的水平。如图7所示,1/2 MIC至MIC浓度处理下V.parahemolyticus的荧光强度显著上升,与对照组相比均有显著性差异。当MBC浓度的GFE-EA处理菌体时,V.parahemolyticus的荧光强度剧增,这表明在此浓度下GFE-EA能够促进菌体内ROS的急剧产生。

图7 不同浓度GFE-EA处理对V.parahemolyticus细胞氧化损伤的影响
Fig.7 Effects of different concentrations of GFE-EA on oxidative damage of V.parahemolyticus
2.9 GFE-EA与DNA的结合作用
采用荧光光谱法和凝胶阻滞法研究GFE-EA与细菌DNA的相互作用。如图8所示。
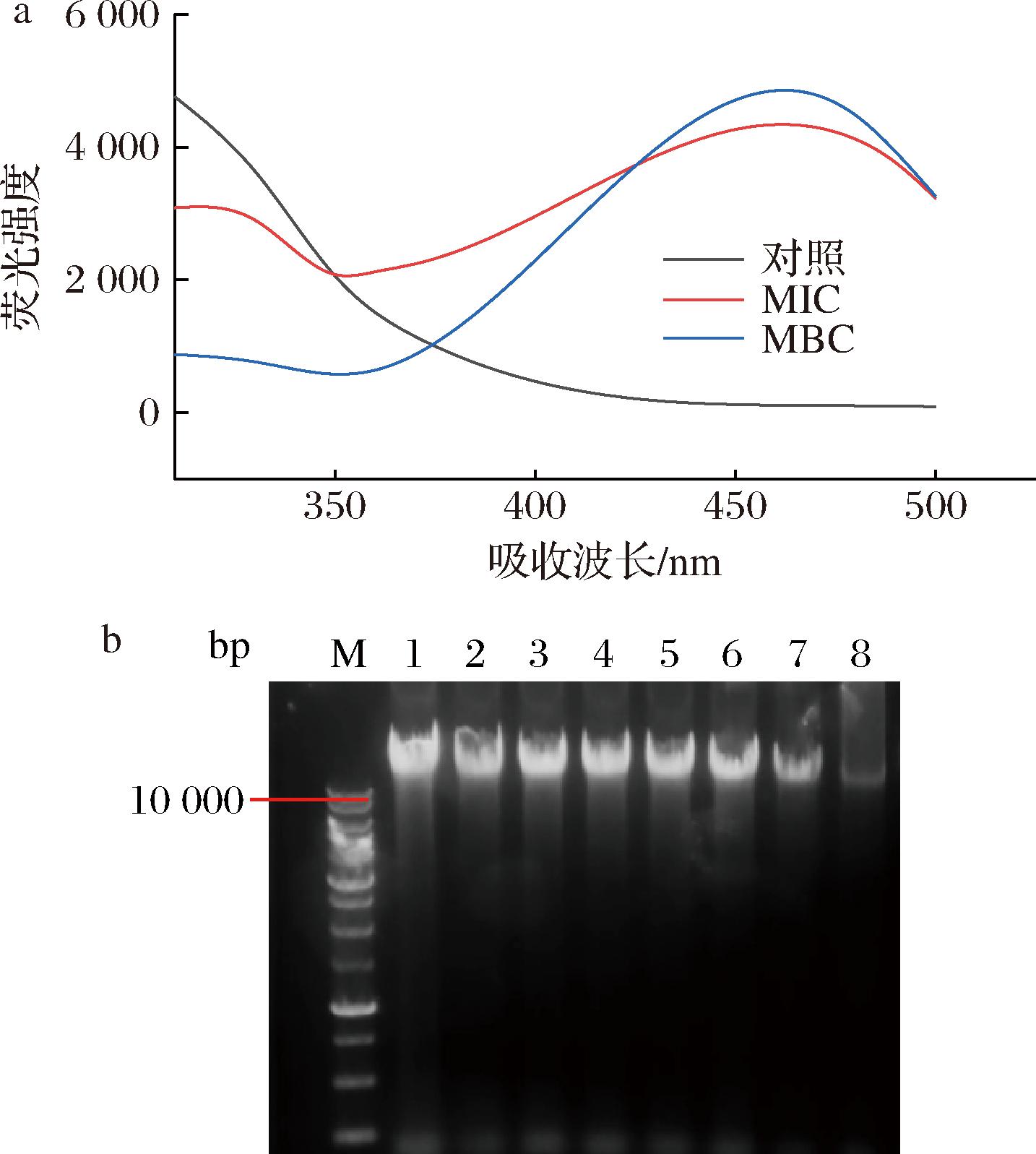
泳道1~8:基因组DNA+不同浓度的GFE-EA(0、1/4MIC、1/2MIC、MIC、2MIC、4MIC、8MIC和MBC)a-DNA荧光强度;b-DNA凝胶电泳
图8 GFE-EA对V.parahemolyticus 基因组DNA的影响
Fig.8 Effect of GFE-EA on genomic DNA of V.parahemolyticus
不同浓度的GFE-EA处理30 min后,V.parahemolyticus的基因组DNA显示出了明显的荧光淬灭,说明GFE-EA能与DNA结合并导致其构象和结构上的变化。而琼脂糖凝胶电泳结果显示,对照基因组DNA条带(泳道1)整齐明亮,经1/4 MIC~MBC(泳道2~8)处理后的基因组DNA条带亮度逐渐变浅,条带逐渐弥散。MBC时变化最为明显,条带几乎弥散消失,说明随着GFE-EA的浓度增大,其与细菌基因组DNA的相互作用增强。
3 结论与讨论
本研究结果表明,高于MIC浓度的GFE-EA对V.parahemolyticus有明显的抑杀作用。王奇升等[21]报道,石花菜醇提物乙酸乙酯萃取物对比其他溶剂萃取物有更强的抗氧化和抑菌活性,对金黄色葡萄球菌和V.parahemolyticus的抑菌活性更强,这与本文的研究结果类似。说明经乙醇萃取的植物提取物乙酸乙酯对V.parahemolyticus有着较好的抑菌活性。由扫描电镜和测定结果表明,GFE-EA能够引起菌体外观形态的显著变化,证明它可以通过破坏细胞壁膜,使GFE-EA进入细菌细胞发挥抑菌作用。有研究发现,革兰氏阴性菌细胞壁膜的缺失和被破坏,对其细胞内各项生理活性是致命的[22]。谢丽玲等[23]发现,黄芩醇提物对V.parahemolyticus有很强的抑制效果,其通过破坏细胞膜的完整性导致菌体裂解死亡。孙杨等[15]发现,V.parahemolyticus与高于MIC的柠檬草精油共培养,其细胞壁、膜的完整性被破坏,导致上清液中碱性磷酸酶活性、蛋白质含量和电导率上升,细胞边界模糊和内容物流失。这与本文研究结果类似,以上说明了GFE-EA等植物提取物可以通过破坏V.parahemolyticus的细胞壁膜,导致细胞内重要大分子和离子泄出细胞,其生理活动受到严重影响,最终造成菌体死亡。综合试验中CAT、T-SOD、ATP活力的变化来看,抑菌物质接触到细菌细胞初期,对其造成了胁迫,导致细菌为了维护自身内环境稳态,酶活呈现上升的趋势,加强了菌体细胞的抗氧化和能量代谢能力。随着作用时间加长,GFE-EA将逐渐破坏细菌细胞膜,使抑菌活性物质进入细胞内,导致细菌内质物流出细胞外,各类酶失去了发挥作用的场所,酶活性受到抑制。而ATP、MDA和ROS含量反映了细菌细胞内的能量代谢、脂质氧化和细胞受损情况。试验结果说明,经GFE-EA处理过的菌体受到攻击,一些抗氧化酶和能量代谢的酶酶活性受到抑制无法发挥其正常的生理功能,导致菌体细胞受到损伤从而堆积大量的自由基。产生的自由基开始攻击菌体内的蛋白质和脂肪等能量物质,受到损伤后细胞内的脂质氧化水平升高,积累的过氧化产物损伤细胞,导致菌体生理活动受到影响甚至死亡。王晓迪等[24]发现,姜黄素与柠檬酸经过蓝光激活后,通过作用于细胞内酶,导致细胞内ROS水平显著升高,对V.parahemolyticus造成较强的杀灭作用,其作用机理与本研究类似。最后,与DNA结合实验结果表明,低浓度的GFE-EA可以影响细菌遗传物质发挥作用,而高浓度的GFE-EA可以影响DNA的结构和构象。有研究表明,抗菌肽在破坏细胞膜后,能与DNA结合,虽然不能使其降解,但可以通过与DNA结合影响其生理功能,且存在剂量和浓效关系。PALAMAE等[25]发现,壳寡糖-儿茶素偶联物能与V.parahemolyticus细胞膜相互作用,进入细胞质,其分子与DNA结合,使其失去原有的遗传功能,从而破坏细菌的正常生理功能,最终导致细菌死亡,与本文中DNA改变现象相似。进一步说明GFE-EA可以通过破坏V.parahemolyticus的细胞壁膜系统进入细胞,与DNA结合,影响DNA的正常功能,从而干扰细胞的正常代谢,最终抑制细胞生长,甚至导致其死亡。
总的来说,GFE-EA对V.parahemolyticus有较好的抑菌活性,能够抑制V.parahemolyticus的生长繁殖,在高于MIC的浓度处理下,能够在短时间内几乎消灭V.parahemolyticus。GFE-EA通过作用于V.parahemolyticus的细胞壁膜,使其通透性和流动性增大,破坏细胞壁膜完整性,导致细胞壁膜正常的生理功能障碍,细胞内容物大量泄漏,V.parahemolyticus无法正常进行各项生理活动和抵御外界环境,最终导致细菌死亡。同时,GFE-EA还可以与V.parahemolyticus胞内遗传物质作用,使其含量和构象发生改变,影响其正常的遗传和表达功能,导致细菌无法生长繁殖甚至死亡。本研究仅对GFE-EA对V.parahemolyticus的抑菌活性及机理进行初步探究,表明栀子花具有开发成为植物源天然防腐剂的潜力,后续可以通过分离、纯化的手段鉴定GFE-EA中的单体成分,明确贡献抑菌活性具体成分,还可以进一步研究单体间是否存在协同抑菌的效果。本研究为GFE-EA作为植物源天然防腐剂的开发应用提供了理论依据,为栀子花资源的高值化利用提供了新方向。
[1] NELAPATI S, NELAPATI K, CHINNAM B.Vibrio parahaemolyticus- An emerging foodborne pathogen[J].Veterinary World, 2012:48.
[2] LOPATEK M, WIECZOREK K, OSEK J.Prevalence and antimicrobial resistance of Vibrio parahaemolyticus isolated from raw shellfish in Poland[J].Journal of Food Protection, 2015, 78(5):1029-1033.
[3] ABANTO M, GAVILAN R G, BAKER-AUSTIN C, et al.Global expansion of Pacific northwest Vibrio parahaemolyticus sequence type 36[J].Emerging Infectious Diseases, 2020, 26(2):323-326.
[4] 陈江, 陈莉莉, 王绩凯, 等.浙江省食源性病例副溶血性弧菌检出率时空聚集分析[J].中国公共卫生, 2022, 38(11):1379-1381.CHEN J, CHEN L L, WANG J K, et al.Spatio-temporal clustering of Vibrio parahaemolyticus detection rate among foodborne disease cases in Zhejiang Province, 2016—2017:A monitoring data analysis[J].Chinese Journal of Public Health, 2022, 38(11):1379-1381.
[5] YÜZBA
 O
O LU D, ÜNAL F, KOÇ F, et al.Genotoxicity assessment of vaccine adjuvant squalene[J].Food and Chemical Toxicology, 2013, 56:240-246.
LU D, ÜNAL F, KOÇ F, et al.Genotoxicity assessment of vaccine adjuvant squalene[J].Food and Chemical Toxicology, 2013, 56:240-246.
[6] 刘文伟, 沈晓盛, 刘承初.茶多酚对泥蚶中副溶血性弧菌的抑制效果[J].食品与发酵工业, 2010, 36(5):41-44.LIU W W, SHEN X S, LIU C C.Effect of Tea Polyphenol to Vibrio parahaemolyticus in Tegillarca granosas[J].Food and Fermentation Industries, 2010, 36(5):41-44.
[7] PALAMAE S, MITTAL A, YINGKAJORN M, et al.Vibrio parahaemolyticus isolates from Asian green mussel:Molecular characteristics, virulence and their inhibition by chitooligosaccharide-tea polyphenol conjugates[J].Foods, 2022, 11(24):4048.
[8] 谢庆超, 孙晓红, 沈潇, 等.蓝莓提取物对副溶血性弧菌的抑制作用[J].天然产物研究与开发, 2012, 24(8):1094-1097;1108.XIE Q C, SUN X H, SHEN X, et al.Bacteriostasis effects of blueberries extracts on Vibrio parahaemolyticus[J].Natural Product Research and Development, 2012, 24(8):1094-1097;1108.
[9] 卢路路, 樊怡灵, 邓珂, 等.不同品种和花期栀子花挥发性物质的主成分和聚类分析[J].核农学报, 2021, 35(7):1601-1608.LU L L, FAN Y L, DENG K, et al.Principal component and cluster analysis of volatile components in cape jasmine flower from different cultivars at different stages of bloom[J].Journal of Nuclear Agricultural Sciences, 2021, 35(7):1601-1608.
[10] 阙珊奇, 杨良缘, 胡钰, 等.花期及提取方法对重瓣栀子花成分及活性影响[J].核农学报, 2023, 37(6):1193-1200.QUE S Q, YANG L Y, HU Y, et al.Effects of flowering period and extraction methods on the ingredients and activity of Gardenia flower[J].Journal of Nuclear Agricultural Sciences, 2023, 37(6):1193-1200.
[11] 钟宜科, 吴迪, 花晓丹, 等.黄酮类化合物抑菌作用研究进展[J].中国食品添加剂, 2019, 30(8):166-171.ZHONG Y K, WU D, HUA X D, et al.Progress in the study of antibacterial effect of flavonoids compounds[J].China Food Additives, 2019, 30(8):166-171.
[12] WANG L Y, GUO H Y, WANG J, et al.Effects of Herba Lophatheri extract on the physicochemical properties and biological activities of the chitosan film[J].International Journal of Biological Macromolecules, 2019, 133:51-57.
[13] TRACZEWSKI M M, AMBLER J E, SCHUCH R.Determination of MIC quality control parameters for exebacase, a novel lysin with antistaphylococcal activity[J].Journal of Clinical Microbiology, 2021, 59(7):e0311720.
[14] 高瑞芳, 王占黎, 曹星月, 等.内蒙古香青兰提取物的抑菌作用及机制研究[J].中医药学报, 2023, 51(2):37-41.GAO R F, WANG Z L, CAO X Y, et al.Bacteriostatic effect and mechanism of Dracocephalum moldavica L.extracts in Inner Mongolia[J].Acta Chinese Medicine and Pharmacology, 2023, 51(2):37-41.
[15] SUN Y, WANG X D, ZHU J L, et al.Antibacterial activity and mechanism of lemon grass essential oil (LG-EO)on Vibrio parahaemolyticus[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(3):157-167.
[16] 周志娥, 罗秋水, 熊建华, 等.绿原酸、异绿原酸A对大肠杆菌的抑菌机制[J].食品科技, 2014, 39(3):228-232.ZHOU Z E, LUO Q S, XIONG J H, et al.Antimicrobial mechanisms of 3-O-caffeoyl quinic acid and 3, 5-di-O-caffeoyl quinic acid against Escherichia coli[J].Food Science and Technology, 2014, 39(3):228-232.
[17] 王铭遥, 郑明静, 任中阳, 等.凡纳滨对虾抗菌肽的筛选及其抑菌活性和DNA结合机制研究[J].中国食品学报, 2024,23(7):140-151.WANG M Y, ZHENG M J, REN Z Y, et al.Screening of antimicrobial peptides from Penaeus vannamei to investigate antimicrobial activity and DNA binding mechanism[J].Journal of Chinese Institute of Food Science and Technology, 2024,23(7):140-151.
[18] 孙畅, 李湘, 王银红, 等.山苍子精油对柑橘意大利青霉的抑菌活性及作用机制[J].食品科学, 2023, 44(11):17-25.SUN C, LI X, WANG Y H, et al.Antibacterial activity and mechanism of Litsea cubeba essential oil against Penicillium italicum in Citrus fruits[J].Food Science, 2023, 44(11):17-25.
[19] ZHOU Y D, ZHANG Y L, ZONG H, et al.Chemical constituents, antibacterial activity and mechanism of Paeonia suffruticosa Andr.buds extract against Staphylococcus aureus and Escherichia coli O157:H7[J].Natural Product Research, 2021, 35(6):1005-1009.
[20] 王虎玄, 彭中花, 王聪, 等.香芹酚对鲁氏接合酵母的抗菌活性及其机制[J].中国食品学报, 2023, 23(2):27-39.WANG H X, PENG Z H, WANG C, et al.The antifungal activity and mechanism of carvacrol against Zygosaccharomyces rouxii[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(2):27-39.
[21] 王奇升, 但阿康, 罗海涛, 等.石花菜醇提物提取工艺及抗氧化、抗菌活性研究[J].中国食品学报, 2023, 23(1):171-183.WANG Q S, DAN A K, LUO H T, et al.Studies on the extraction process, antioxidant and antibacterial activity of Gelidium amansii ethanol extract[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):171-183.
[22] 刘雪飞, 吴思楠, 李秀霞, 等.细胞壁缺失对副溶血性弧菌生物学特性的影响[J].中国食品学报, 2021, 21(5):23-30.LIU X F, WU S N, LI X X, et al.Effects of cell wall deletion on the biological characteristics of Vibrio parahaemolyticus[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):23-30.
[23] 谢丽玲, 彭齐, 蔡链纯, 等.黄芩醇提物对副溶血性弧菌抑制机制的研究[J].生物技术通报, 2015(8):159-165.XIE L L, PENG Q, CAI L C, et al.A study on antibacterial mechanisms of Ethanol-extracts from Scutellaria baicalensis AgainstVibrio parahaemolyticus[J].Biotechnology Bulletin, 2015(8):159-165.
[24] 王晓迪, 郑双芝, 庞一, 等.光动力技术对副溶血性弧菌的灭活作用[J].食品与发酵工业, 2024, 50(3):119-125.WANG X D, ZHENG S Z, PANG Y, et al.Inactivation effect of photodynamic technology on Vibrio parahaemolyticus[J].Food and Fermentation Industries, 2024, 50(3):119-125.
[25] PALAMAE S, MITTAL A, BUATONG J, et al.Chitooligosaccharide-catechin conjugate:Antimicrobial mechanisms toward Vibrio parahaemolyticus and its use in shucked Asian green mussel[J].Food Control, 2023, 151:109794.