Ⅱ型糖尿病(type 2 diabetes,T2DM)是一种常见的慢性代谢性疾病,表现为高血糖水平和胰岛素抵抗,主要发生于中年和老年人群。T2DM的病因复杂,涉及遗传、环境、生活方式和代谢异常等多种因素[1]。T2DM会引发多种并发症,如心血管疾病、肾脏问题和神经病变[2]。其发病机制与胰岛素抵抗和胰岛素分泌不足密切相关。胰岛素是一种重要的调节血糖的激素,促进细胞对葡萄糖的摄取和代谢[3]。在T2DM中,细胞对胰岛素的响应减弱,导致葡萄糖不能有效进入细胞,从而在血液中积累,引发高血糖[4]。目前,T2DM的治疗策略主要包括生活方式干预、药物治疗和血糖监测。通过健康饮食、适度运动和体重管理,可以有效降低T2DM的风险并控制血糖水平。药物治疗包括口服药物和胰岛素注射,主要改善胰岛素敏感性,促进葡萄糖利用[5]。但药物治疗可能会对肝肾功能损害,增加心血管疾病的风险。因此,寻求更自然、安全的预防和治疗策略十分重要。
青稞(Hordeum vulgare L.var.nudum Hook.f.)作为一种特色粮食作物,富含高蛋白、高纤维、高维生素以及低脂肪、低糖等有益成分[6]。此外,青稞中还富含功能性物质,如β-葡聚糖、γ-氨基丁酸、阿拉伯木糖醇、麦绿素、黄酮和酚类,这些物质不仅有助于预防糖尿病和心血管疾病,还在抗氧化、抗衰老、抗癌和增强免疫力方面发挥积极作用[7]。本研究以db/db小鼠为模型,探究青稞汁及其乳酸发酵饮品对小鼠血糖调节作用及其对肠道菌群的影响,旨在为糖尿病预防和治疗提供新的策略和思路。
1 材料与方法
1.1 材料与试剂
白青稞,西藏自治区农牧科学院;植物乳杆菌(Lactiplantibacillus plantarum)L321,国家酒类品质与安全国际联合研究中心菌库,筛选自西藏曲拉;α-耐高温淀粉酶、糖化酶,夏盛(上海)生物科技有限公司;青稞葡聚糖(含70% β-葡聚糖),西安新合生物科技有限公司;SPF级雄性5周龄db/db小鼠(共25只),斯贝福(北京)生物技术有限公司(许可证号SCXK(京)2019-0010);丙氨酸转氨酶(glutamic-pyruvic transaminase, ALT)、天冬氨酸转氨酶(glutamic oxalacetic transaminase, AST)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)试剂盒,南京建成生物工程研究所;肝糖原、葡萄糖激酶(glucokinase,GCK)活性、磷酸化糖酶激酶(pyruvate kinase, PK)试剂盒,上海酶联生物科技有限公司。
1.2 仪器与设备
YXQ-50G立式灭菌锅,上海博迅生物仪器股份有限公司;Spectra Max®iD3多功能酶标仪,美国美谷公司;LEGEND Micro 21R微量台式离心机,美国赛默飞公司;BG-subMIDI多用途水平电泳仪,上海珂淮仪器有限公司;BC-C57 PCR仪、Tanon1600凝胶成像系统,上海天能科技有限公司。
1.3 青稞发酵饮品的制备
将青稞原料粉碎、过筛,按料水比1∶6混合,95 ℃下加入耐高温α-淀粉酶糊化15 min,然后降温至60 ℃添加糖化酶糖化1 h,碘试不变色,过滤后加热煮沸10 min,降至室温,调节至适宜糖度,pH值为5.5,得到青稞汁。植物乳杆菌37 ℃活化、扩培,接种量2%(体积分数)接至青稞糖化醪中,30 ℃条件下发酵4~5 d,至pH值为3.8发酵结束,然后置于4~5 ℃低温后熟48 h,2 000 r/min低温低速离心得到青稞乳酸发酵液(含菌量>106 CFU/mL)。青稞发酵液50 ℃旋转蒸发浓缩,浓缩倍数为4倍,添加1 g/100 mL青稞葡聚糖,得到青稞乳酸发酵浓缩液。
1.4 实验动物
按照GB/T 35892—2018《实验动物——动物福利伦理审查指南》的要求进行,确保实验过程的合法性和动物福利。将25只小鼠,适应性喂养7 d后,随机分成5组,分组情况见表1。小鼠饲养在恒温(22±2) ℃的环境中,遵循12 h的明暗交替,相对湿度保持在(50±5)%。持续4周的灌胃后,所有小鼠12 h隔夜禁食,测量体重。眼球取血,脱颈处死小鼠,迅速解剖取出肝脏,在冰生理盐水中冲洗、称量。血清、肝脏组织和小鼠肠道内容物保存在-80 ℃的环境中,以备后续实验。
表1 小鼠分组情况及灌胃信息
Table 1 Mice grouping conditions and gavage information

分组名称处理动物数/只饲料灌胃剂量/μLA1空白对照组0.9%生理盐水5高糖高脂饲料250A2阳性对照组盐酸二甲双胍250 mg/(kg·d)5高糖高脂饲料250A3青稞汁组青稞汁5高糖高脂饲料250A4青稞乳酸发酵液组青稞乳酸发酵液5高糖高脂饲料250A5青稞乳酸发酵浓缩液组青稞乳酸发酵浓缩液5高糖高脂饲料250
注:高糖高脂饲料配方:猪油 10%,蔗糖 15%,蛋黄粉 15%,酪蛋白 5%,胆固醇 1.2%,胆酸钠 0.2%,CaHCO3 0.6%,石粉0.4%,鼠维持料 52.6%(质量分数)。
1.5 空腹血糖值的测定
每周固定1 d测量小鼠血糖。测量前1 d,小鼠隔夜禁食不禁水12 h后尾尖取血,利用血糖仪快速测定空腹血糖值。
1.6 糖耐量的测定
口服葡萄糖耐受实验(oral glucose tolerance test, OGTT)在最后1周进行。小鼠禁食不禁水12 h,测定空腹血糖即给葡萄糖前(0 min)的血糖值,30 min 后各剂量组给予不同浓度的青稞样品,A1组和A2组给予 0.1 mL/kg 剂量的蒸馏水,30 min后各组经口给予葡萄糖溶液(20 g/100 g)1.0 g/kg,尾尖取血测定30、60、90、120 min时的血糖值,并据此绘制糖耐量曲线,利用如下公式(1)计算曲线下面积[8]:
(1)
式中:BG1、BG2、BG5分别代表0、30、120 min时的血糖值。
1.7 各项生化指标的测定
ALT、AST、TC、TG、LDL-C、HDL-C、GCK、PK、肝糖原的测定按照试剂盒的操作进行。
1.8 肝脏病理形态的观察
用体积分数10%缓冲福尔马林固定肝脏组织24 h后,石蜡包埋。切取5 μm厚的切片,转移到玻片上,苏木精-伊红(hematoxylin-eosin,H&E)染色,进行组织病理学检查。
1.9 DNA提取及肠道菌群检测
按照试剂盒说明书提取粪便样品DNA,送至北京诺禾致源公司,采用IonS5TMXL高通量测序平台对实验大鼠粪便样本中细菌16S rDNA V4区基因序列进行测序分析。
1.10 数据处理
用SPSS 26.0进行差异显著性分析,多组均数间采用单因素方差分析(one-way ANOVA),样本均数的两两比较采用LSD检验,P<0.05为差异显著[9]。用GraphPad 8.4.2绘制图形。
2 结果与分析
2.1 不同处理对db/db小鼠体重的影响
体重检测可以直观反映动物状态、代谢水平,可作为实验过程中调整实验方案的有力证据,本研究5种不同处理对小鼠体重的影响结果如图1所示。
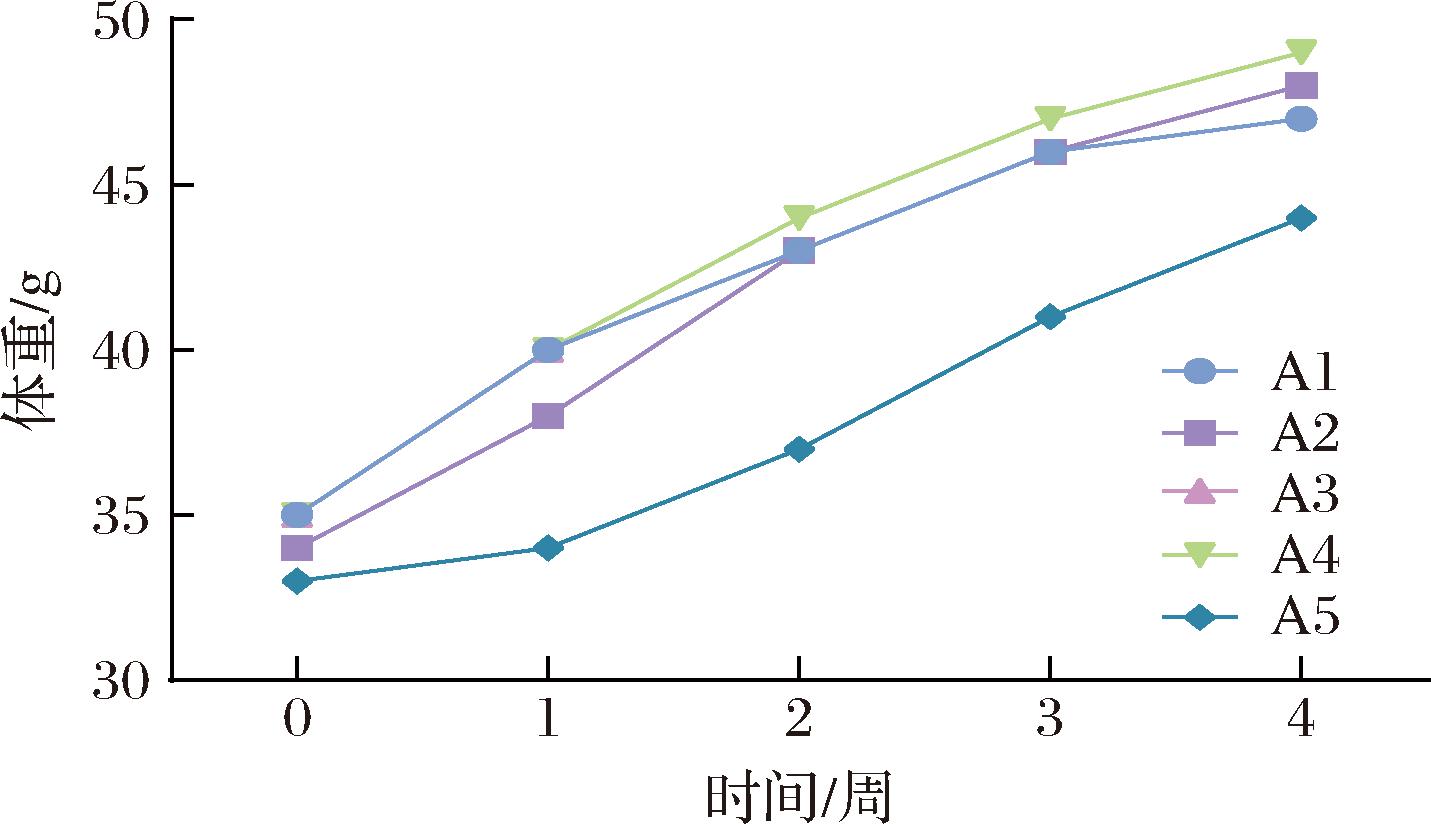
图1 各组小鼠体重变化
Fig.1 Changes in body weight of mice in each group
各组大鼠在整个灌胃期间皮毛覆盖均匀、尾部正常,各分泌器官无异常物出现,在饲养笼中行动便捷。在实验的持续过程中,各组小鼠的体重呈现逐渐上升的趋势,趋势基本一致,组间无显著性差异。说明青稞及青稞乳酸发酵液不影响小鼠体重。
2.2 不同处理对db/db小鼠空腹血糖的影响
空腹血糖水平常反映了动物在长时间未进食后血液中的葡萄糖浓度,是评估糖尿病治疗效果的一个常用指标[10],小鼠的血糖变化情况如图2所示。
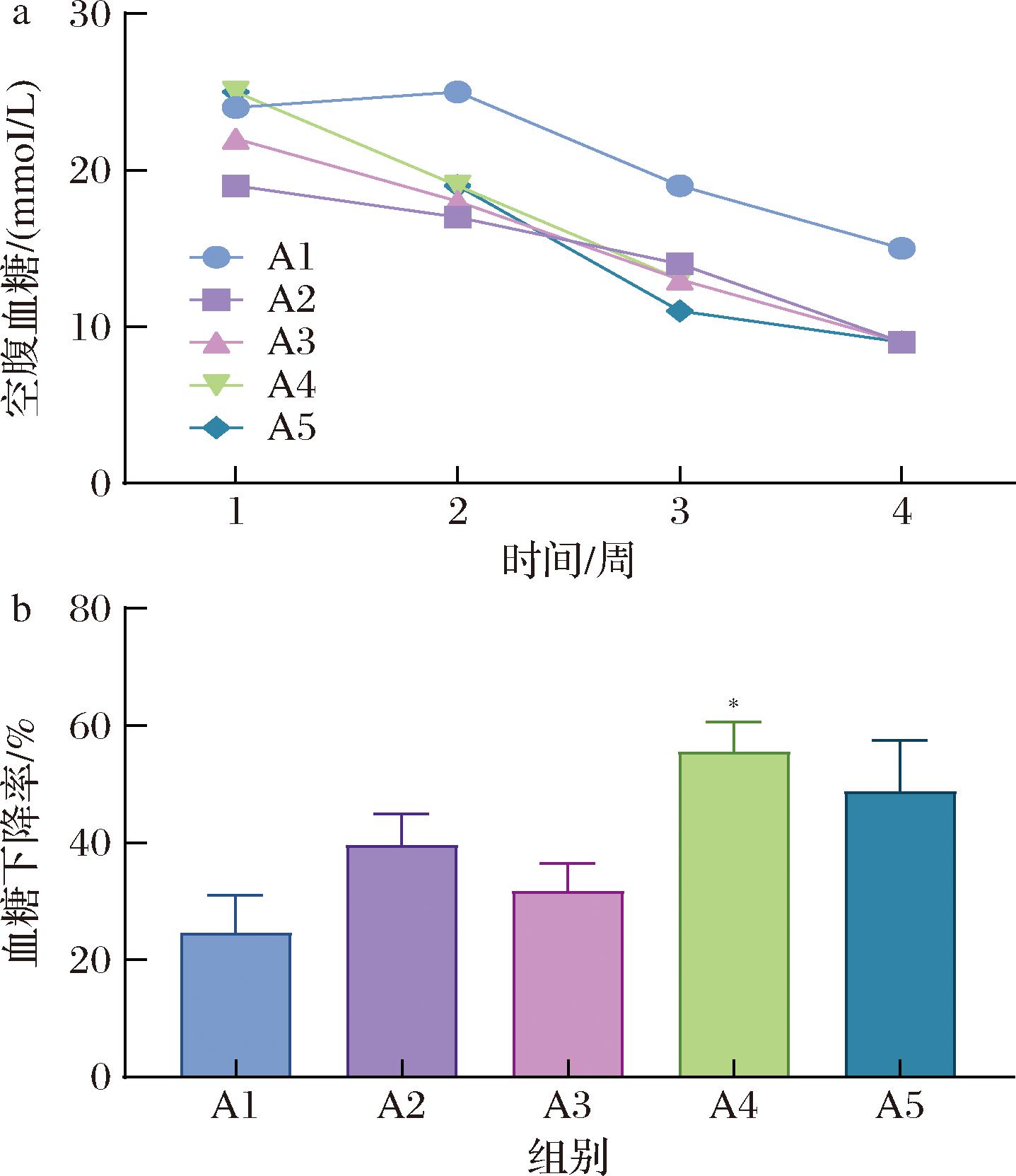
a-小鼠血糖变化;b-小鼠血糖下降率
图2 各组小鼠空腹血糖变化
Fig.2 Changes in fasting blood glucose of mice in each group
注:血糖下降率/%=(第4周空腹血糖值-第1周空腹血糖值)/第1周空腹血糖值×100。*表示2组之间的差异,*P<0.05,**P< 0.01(下同)。
在实验期的4周内,所有组别的小鼠血糖呈下降趋势,A4和A5组趋势表现得更为显著(图2-a)。计算血糖下降率,发现A4组小鼠的血糖下降速率较快,且与A1组相比,这种差异具有显著性(P<0.05)。可能是青稞乳酸发酵液中多种生物活性成分相互协同作用的结果,如提高胰岛素敏感性、促进胰岛素分泌以及调控肝脏葡萄糖代谢等复杂机制。
2.3 不同处理的db/db小鼠口服糖耐量结果
OGTT是通过测量服用一定量葡萄糖后血糖浓度的变化曲线,来评估机体对葡萄糖的耐受和处理能力,可以反映胰岛素分泌和胰岛素敏感性[11]。曲线下面积(area under curve,AUC)指血糖浓度在特定时间内的整体变化,常用于评估机体的葡萄糖耐受性,即机体对葡萄糖的处理能力,AUC数值增大,说明机体糖耐量能力下降,反之则能力升高[12]。结果如图3所示。
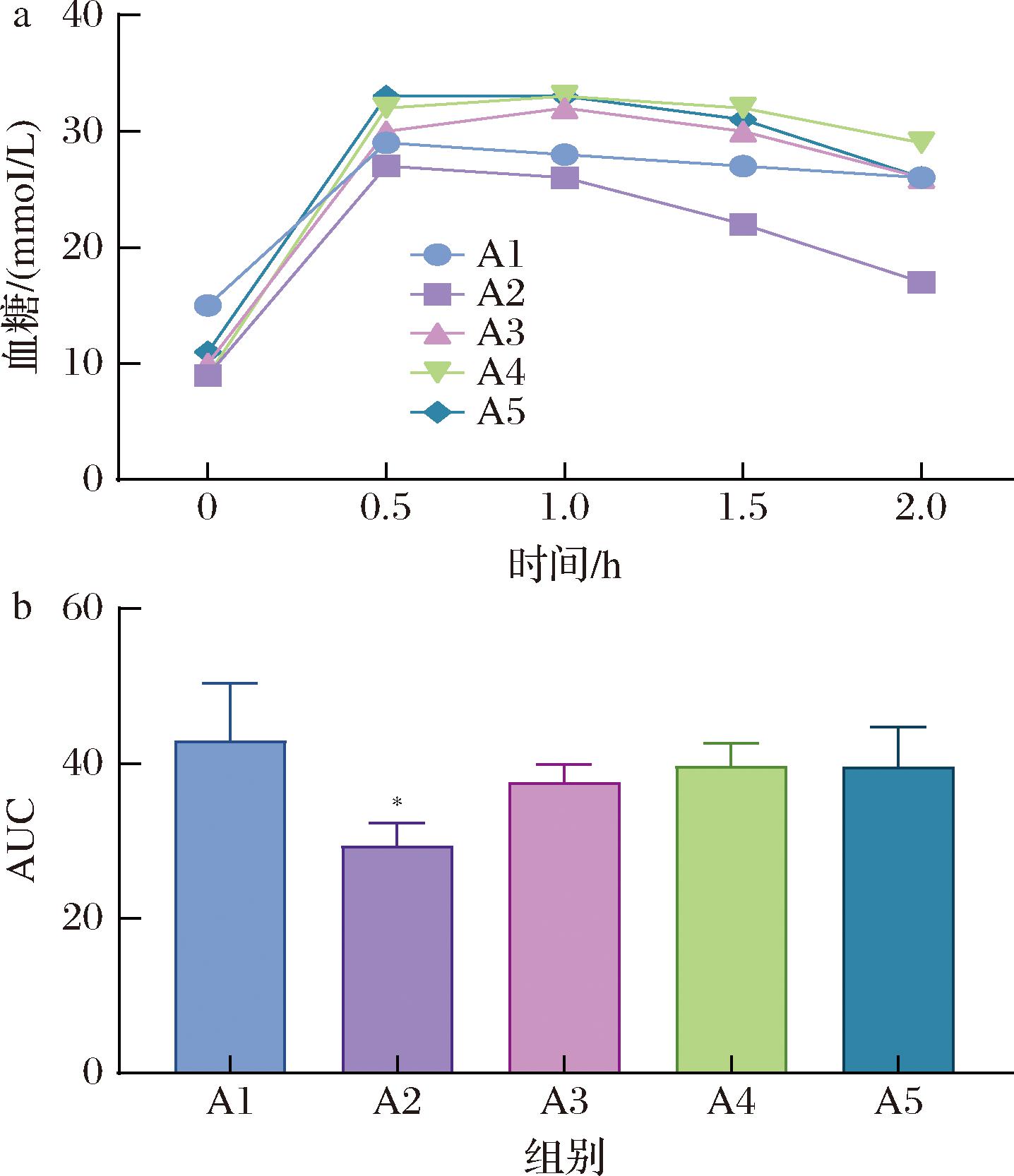
a-口服糖耐量OGTT;b-AUC
图3 各组小鼠口服糖耐量结果
Fig.3 Results of oral glucose tolerance of mice in each group
因葡萄糖摄入,各组小鼠血糖浓度均在0.5 h内迅速升高,达到峰值,随后逐渐下降,但均未恢复到初始血糖值。通过计算AUC数值发现,A2组小鼠的对葡萄糖的耐受性较好,青稞汁和青稞乳酸发酵液对小鼠的糖耐量能力改善不显著。
2.4 不同处理的db/db小鼠转氨酶含量
在T2DM的进程中,肝脏功能可能受影响。ALT和AST是评估肝脏功能的重要指标[13]。如图4所示,与A1组相比较,A2、A3和A5组小鼠的ALT和AST水平显著下降(P<0.05),而A4组则未显示出明显的变化。这一现象的原因可以从各组处理的不同角度来解释。青稞汁的制备过程,包括糊化和糖化青稞原料,有效地保留了青稞中的众多营养成分。这些成分,如抗氧化剂和维生素,对于肝脏健康可能具有积极的影响。在制备青稞乳酸发酵液的过程中,通过植物乳杆菌的发酵作用,青稞汁中产生新的生物活性物质,如有机酸和生物活性肽,改变了原有的营养成分,从而影响其对肝脏的保护作用。通过旋转蒸发浓缩和添加青稞葡聚糖,得到的青稞乳酸发酵浓缩液在增强肝脏保护方面表现得更为有效。
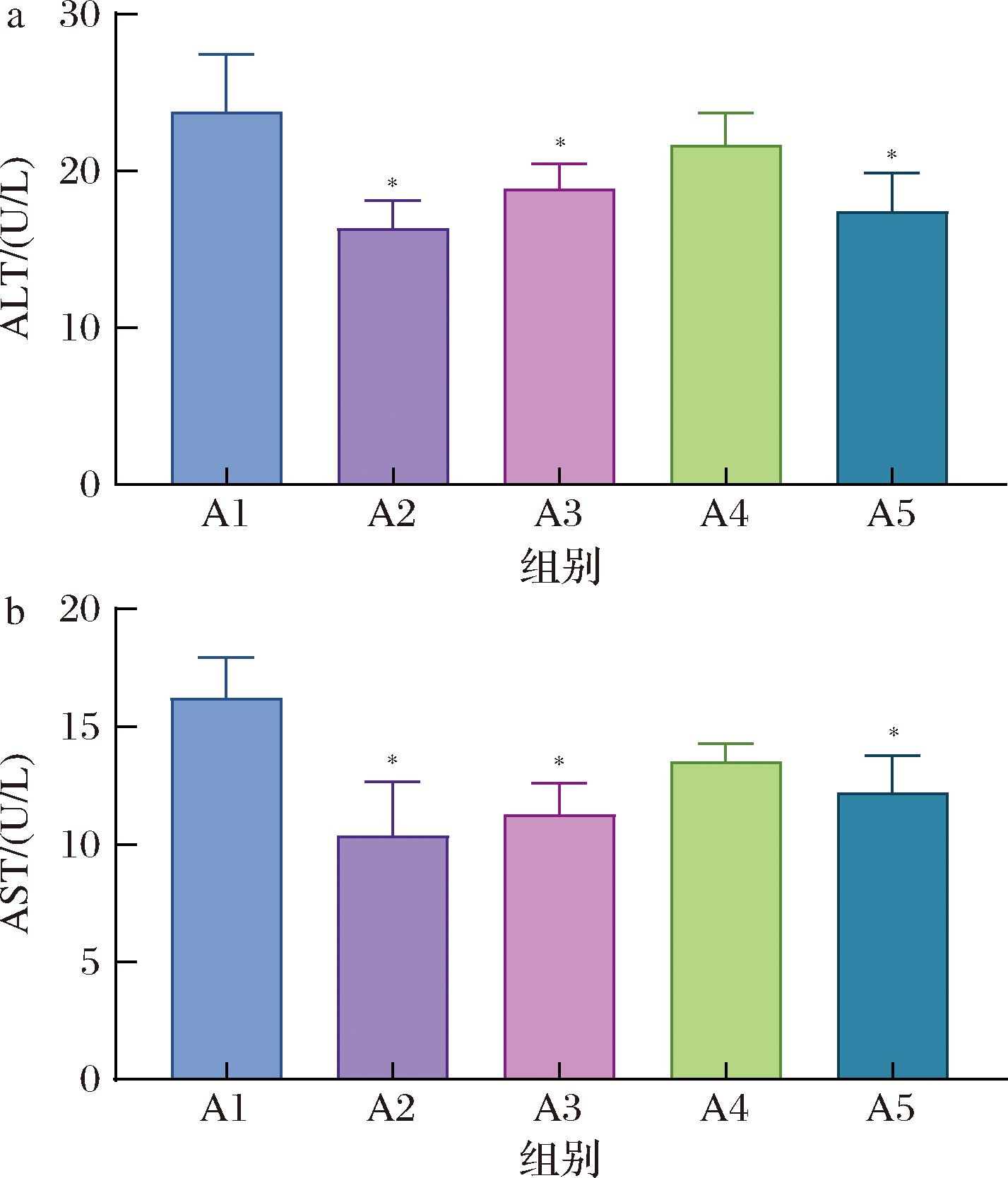
a-ALT含量;b-AST含量
图4 各组小鼠转氨酶含量
Fig.4 Transaminase levels of mice in each group
2.5 不同处理对db/db小鼠血脂的影响
TG、TC、LDL-C和HDL-C是T2DM最常见的脂质代谢评估指标。与A1组相比,各组小鼠的TG、TC和HDL-C含量显著降低(图5-a、图5-b、图5-d),A2、A3和A5组的LDL-C含量显著降低(图5-c)。以上结果表明,青稞汁及其乳酸发酵饮品可以降低TG和TC含量,影响HDL-C水平,对改善T2DM小鼠的血脂异常有积极作用。
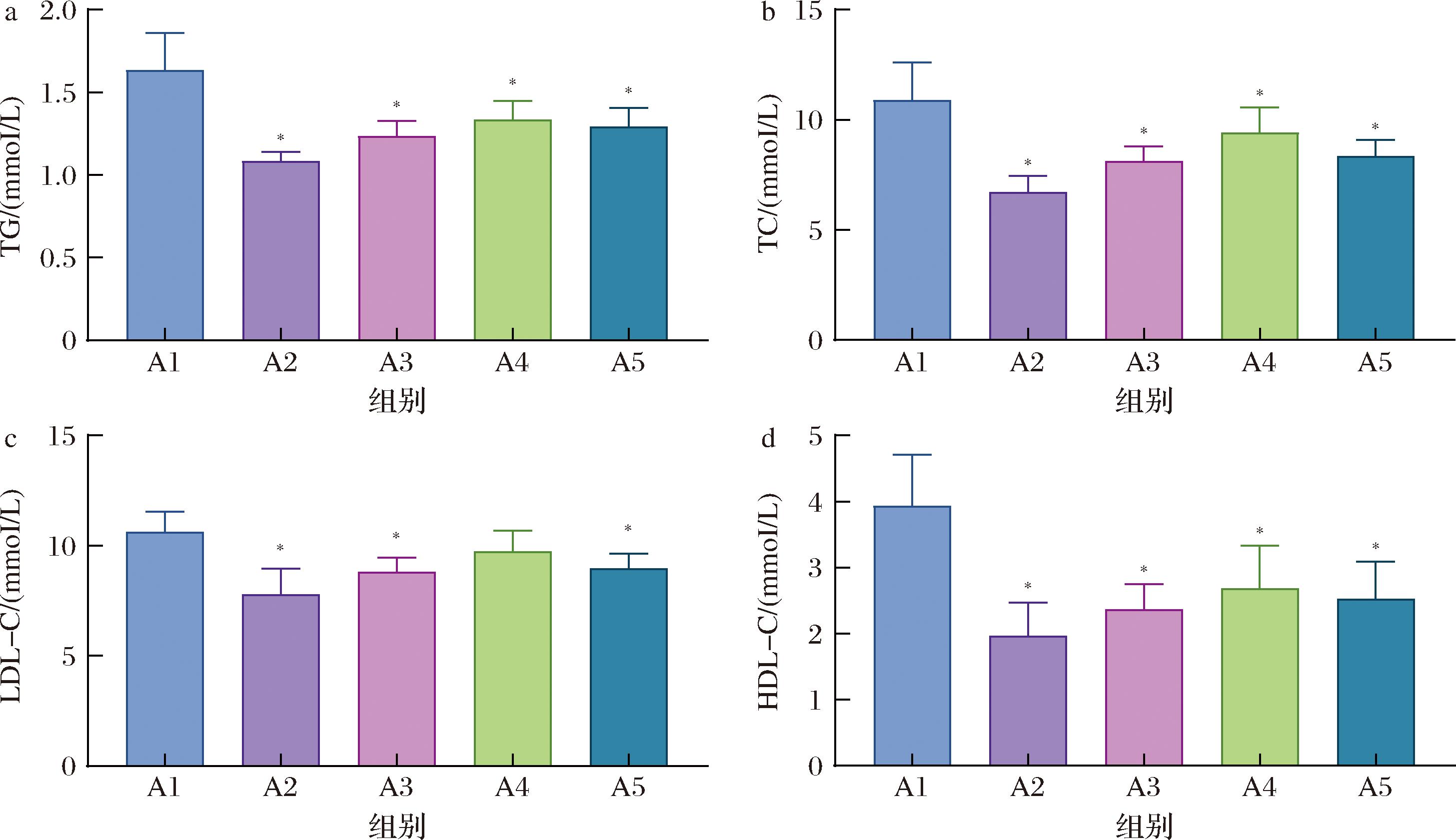
a-TG含量;b-TC含量;c-LDL-C含量;d-HDL-C含量
图5 各组小鼠血脂指标结果
Fig.5 Results of lipid indices of mice in each group
2.6 不同处理对db/db小鼠代谢的影响
PK和GCK是参与葡萄糖代谢的关键酶,而肝糖原则是机体调节血糖平衡的重要组成部分,是一种能够被肝脏存储和释放的多糖。PK在糖新生途径中会将葡萄糖转化为葡萄糖-6-磷酸,从而影响肝脏中葡萄糖的释放[14]。GCK在胰岛细胞中参与葡萄糖的感应和代谢调节。当PK和GCK发生异常时,会影响胰岛素的分泌和葡萄糖的代谢,从而导致血糖升高。
各组小鼠的PK含量在统计学上无显著性差异(图6-a)。与A1组相比,A3组的GCK含量显著升高(P<0.05)(图6-b),说明青稞汁中的成分对小鼠葡萄糖代谢产生了积极的影响;A2组小鼠的肝脏糖原含量显著降低(P<0.01),而A3和A5组也呈现显著下降(P<0.05),可能是青稞汁和青稞发酵浓缩液对肝脏糖原的合成和存储产生了影响,减缓葡萄糖的产生。
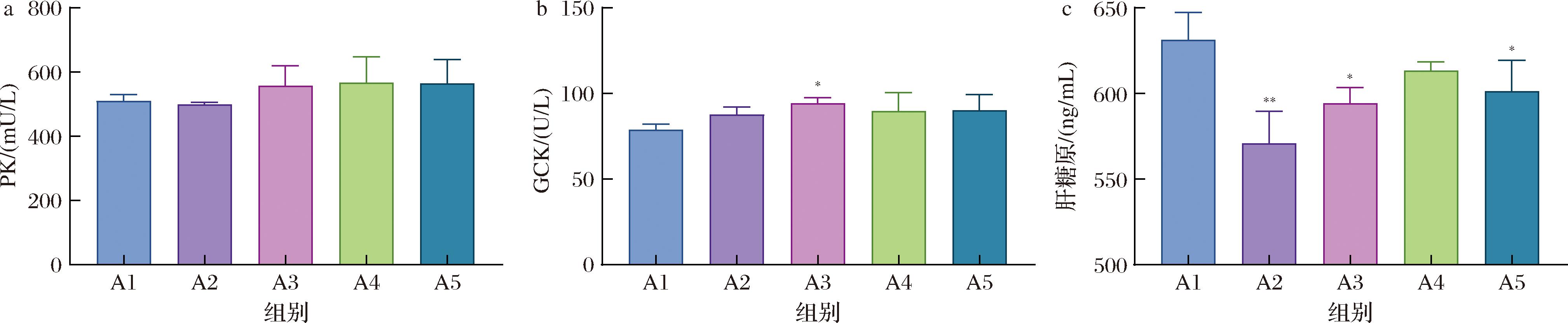
a-PK含量;b-GCK含量;c-肝糖原含量
图6 各组小鼠代谢指标结果
Fig.6 Results of metabolic indexes of mice in each group
2.7 不同处理对db/db小鼠肝脏病理形态的影响
肝脏在能量代谢和葡萄糖平衡中十分重要,T2DM常伴随着肝脏功能异常和脂肪变性。观察各组小鼠肝脏组织HE染色结果,如图7所示。
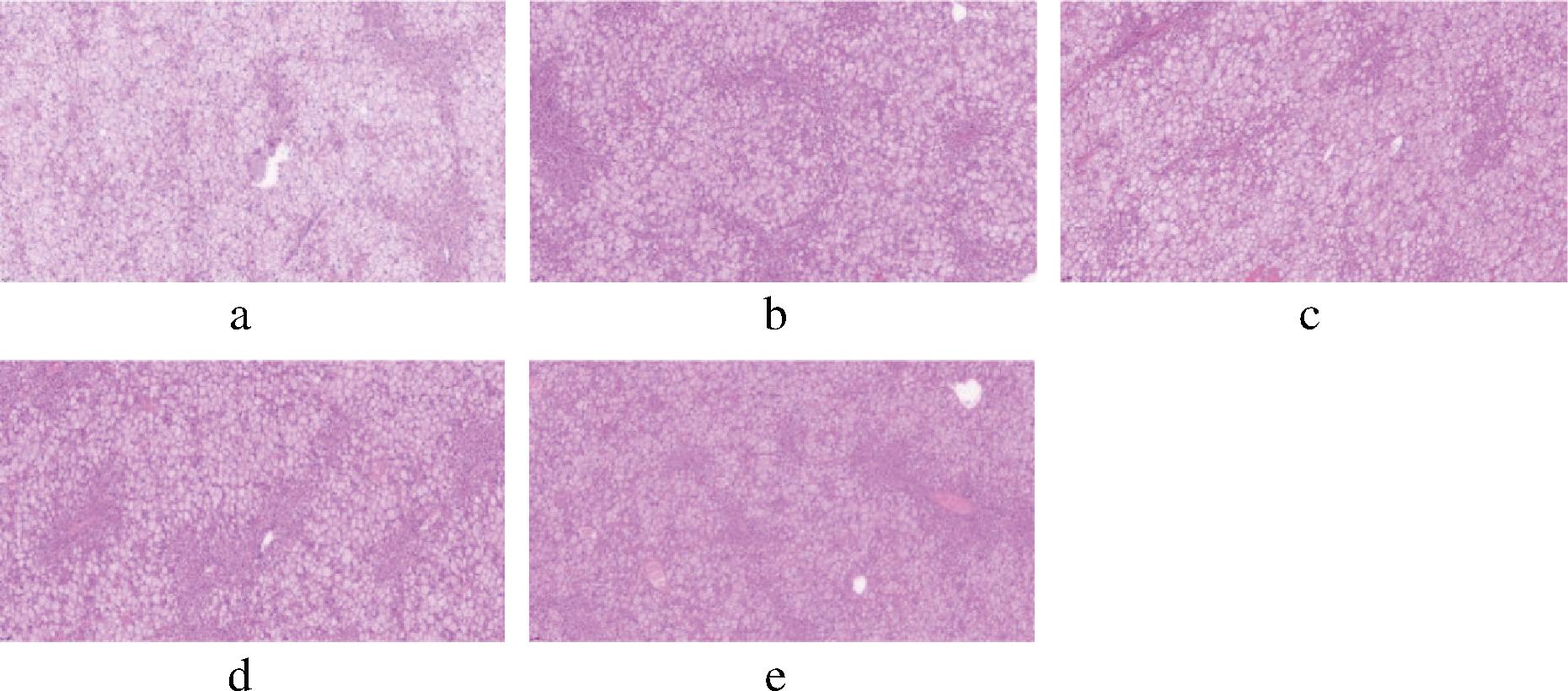
a-空白对照组;b-阳性对照组;c-青稞汁组;d-青稞乳酸发酵液组;e-青稞乳酸发酵浓缩液组
图7 小鼠肝脏组织HE染色结果
Fig.7 HE staining results of mice liver tissue
在A1组小鼠的肝脏中,脂肪组织呈现明显的变性,细胞排列呈紊乱状态。与A1组相比,A2组小鼠的肝脏脂肪变性程度显著减轻,组织结构基本恢复正常。A3、A4和A5组小鼠的肝脏组织结构与A2组类似,这表明青稞饮品具有减轻T2DM引起的肝脏损伤的作用。
2.8 不同处理对db/db小鼠肠道菌群的影响
肠道菌群与糖尿病的关联已成为研究的热点领域。众多研究表明,肠道微生物在糖尿病的发病和进展中发挥着重要作用。其复杂的组成和功能调节影响宿主的多个方面,包括能量代谢、炎症反应、胰岛素敏感性等。通过高通量测序技术,进一步探究青稞饮品对db/db小鼠肠道菌群的影响。
2.8.1 样本OTU数量
对样本的Effective Tags在97%的一致上进行OTUs聚类和物种注释,结果如图8所示。图8-a分析显示A1、A2、A3、A4、A5组分别鉴定出1 089、1 882、2 473、1 029、1 733个OTU,其中5组中有486个OTU存在重叠。图8-b分析显示A2、A3、A4、A5四组共有504个OTU重叠。其中A2组和A5组的OTU相似性更高,说明阳性药物和发酵青稞浓缩汁对小鼠的肠道菌群影响更相似。
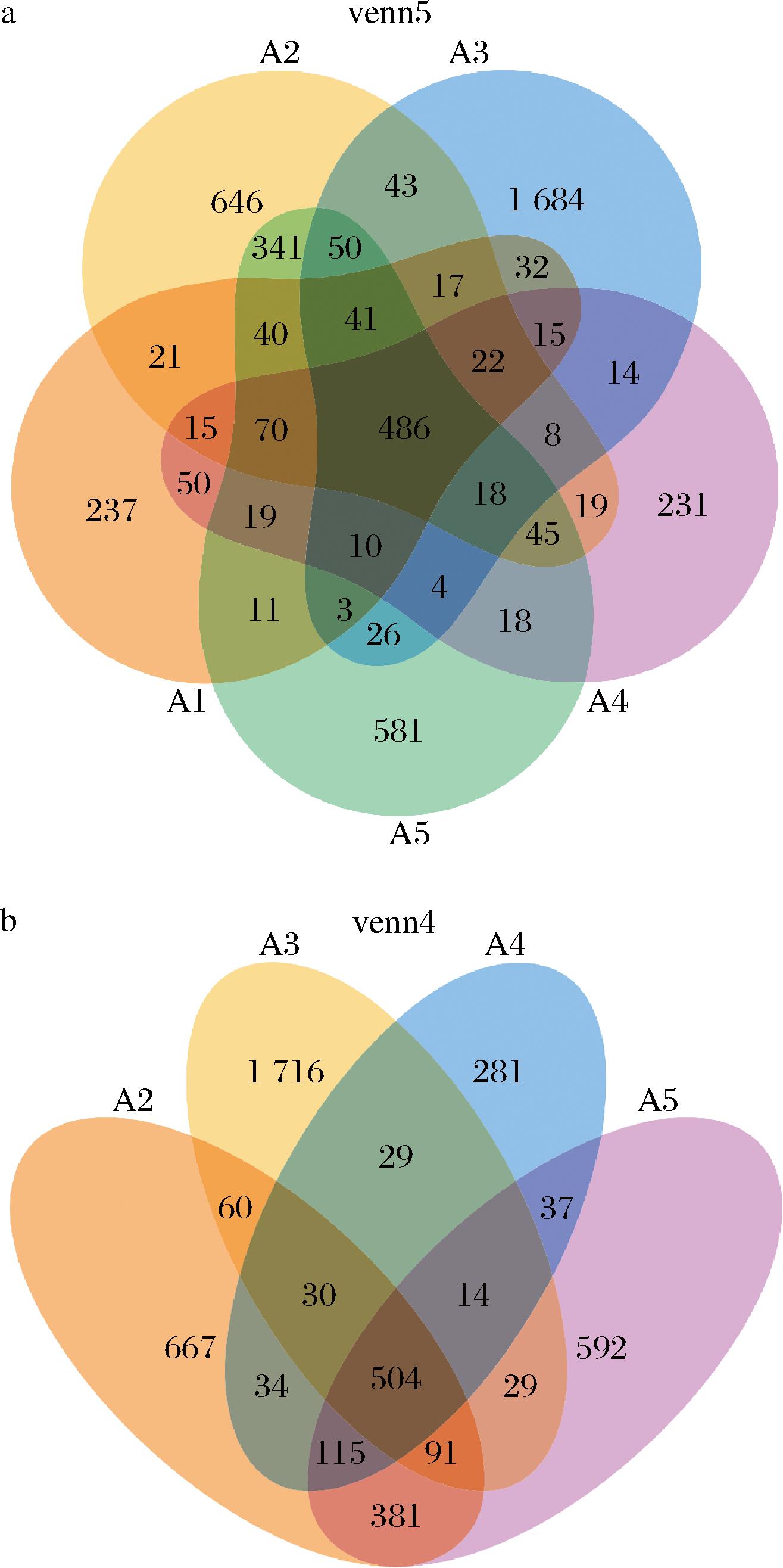
a-5组样本韦恩图;b-4组样本韦恩图
图8 样本OTU注释图
Fig.8 Annotation chart of sample OTU
2.8.2 LEfSe分析
如图9所示,使用LEfSe软件进行差异丰度分析,该分析基于线性判别分析,用于识别在不同组别之间具有显著差异的微生物特征。LEfSe分析的判别依据包括丰度和线性判别分析(linear discriminant analysis,LDA)分数,其中LDA分数用于确定特征的贡献度和影响大小。

a-LDA值分布柱状图;b-进化分支图
图9 LEfSe多级物种差异判别图
Fig.9 Multi-level species difference discrimination diagram LEfSe
LEfSe多级物种差异判别分析显示o_Verrucomicrobiales在A5组中显著富集,为A5的优势菌属。疣微菌属(Verrucomicrobiales)的细菌具有多样的代谢能力和生态功能,对生态系统的结构和功能具有影响。一些Verrucomicrobiales的成员,如嗜黏蛋白阿克曼菌(Akkermansia muciniphila),在人类肠道中丰度较高。研究发现,该菌属的丰度与肠道健康状态、肥胖、糖尿病等疾病相关[15]。
2.8.3 物种丰度
根据物种注释结果,选取样本在门和属水平上丰度排名前10的物种,生成物种相对丰度柱形累加图。
门水平细菌丰度柱形图(图10-a)分析显示,与A1组相比,各干预组小鼠厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)的比例发生明显变化。A2和A5组小鼠中疣微菌门(verrucomicrobiota)丰度增加,A5组变化更显著。进一步在属水平(图10-b)分析发现,A5组小鼠中阿克曼菌属(Akkermansia)丰富度显著增加。Akkermansia是肠道中潜在的益生菌,可以促进肠道屏障功能的增强,减少肠道黏膜的渗透性,抑制炎症反应,通过减少葡萄糖的吸收并调节能量代谢等机制,从而改善胰岛素敏感性和调节血糖[16]。
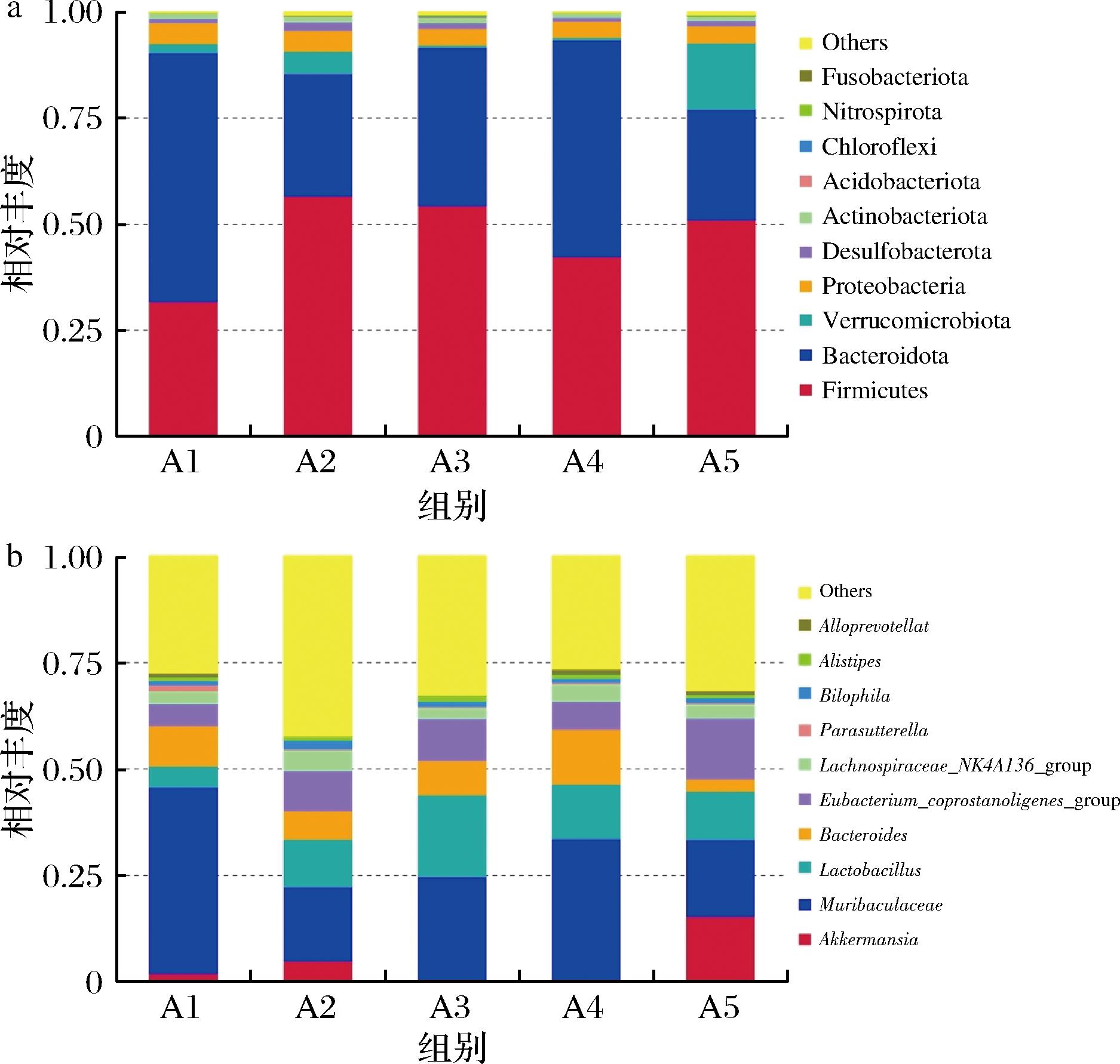
a-门水平丰度柱形图;b-属水平丰度柱形图
图10 物种相对丰度柱形图
Fig.10 Species relative abundance histogram
2.8.4 进化分析
如图11所示,属水平进化树分析显示,A3中乳杆菌属(Lactobacillus)显著增加。乳酸菌可以通过调节体内相关酶的活性,促进肝糖原合成,抑制糖异生作用,从而调节血糖代谢。还可以增强肠道有益菌酶活性,如β-半乳糖苷酶和葡萄糖苷水解酶,提高糖的消化吸收性能,促进机体对糖的摄取和利用,对血糖调节起到积极作用[17]。青稞乳酸发酵液可能是通过增加小鼠肠道中乳酸菌属的含量进行干预,实现血糖和代谢的调节。拟杆菌属(Bacteroides)在A4中富集。该菌属具有多样的代谢能力和生态功能,参与碳水化合物、蛋白质和脂肪的代谢过程。它们能够分解和利用复杂的多糖类物质,如纤维素和果胶,为小鼠提供能量和营养物质[18]。还会参与肠道免疫调节的过程,通过与肠道上皮细胞和免疫细胞的相互作用,维护肠道的免疫平衡[19]。青稞乳酸发酵液通过增加高糖高脂小鼠肠道中Bacteroides的数量,进而影响代谢和免疫调节。Eubacterlum_coprostanollgenes_group和Akkermansia在A5中显著富集。Eubacterlum_coprostanollgenes_group能够通过产生鞘氨醇来联合调节高脂饮食小鼠的血清血脂异常[20]。β-葡聚糖是燕麦和青稞谷物中的主要可溶性纤维,可能会影响微生物生态系统[21]。青稞浓缩汁增加了β-葡聚糖的含量,从而增加了Eubacterlum_coprostanollgenes_group和Akkermansia的数量,进而调节血糖和血脂水平。
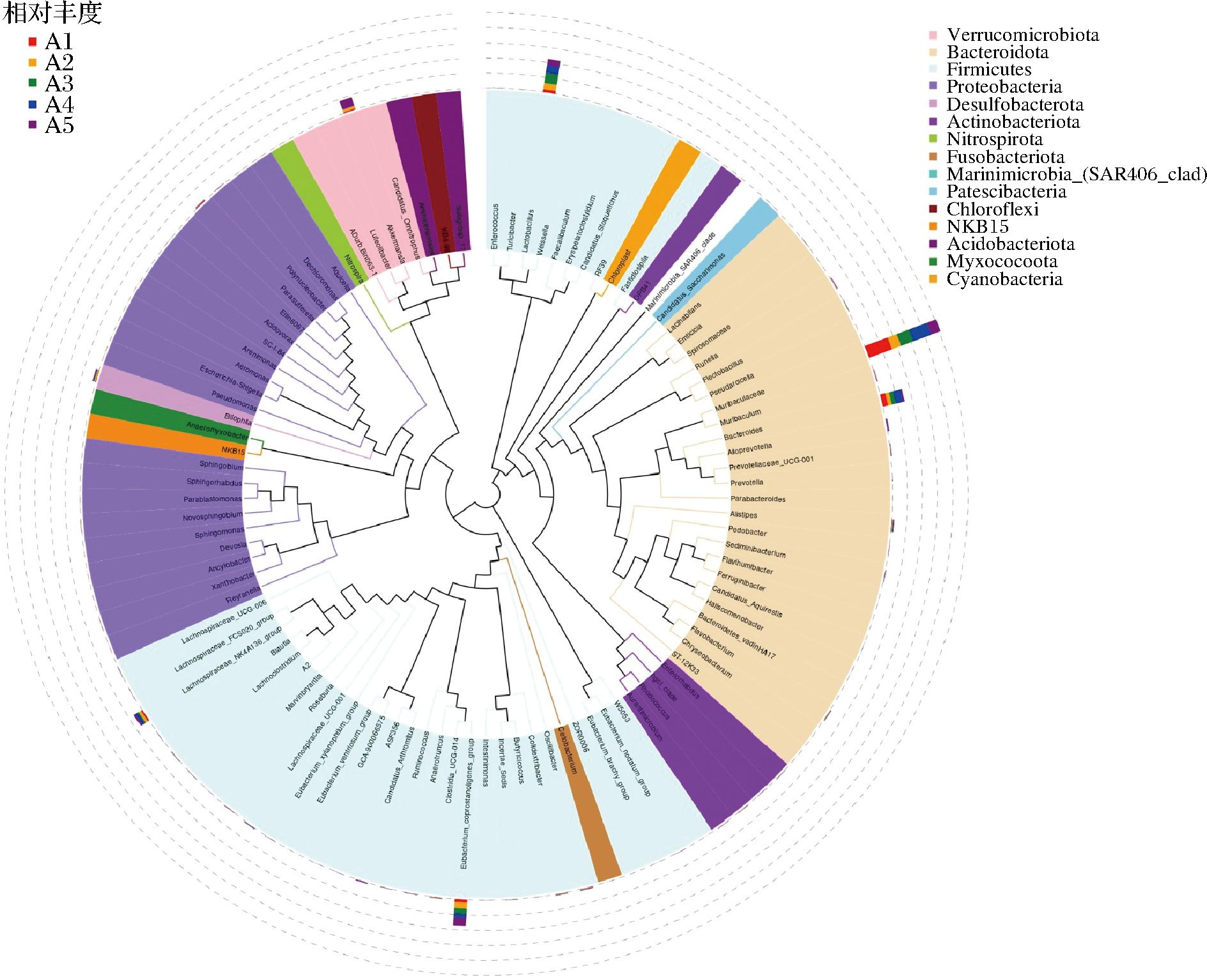
图11 物种进化树
Fig.11 Species evolutionary tree
3 讨论与结论
本研究通过对db/db小鼠的血糖、肝脏功能、脂质代谢以及肠道微生物组成进行了全面的分析,研究了3种青稞饮品和阳性药物的干预效果比较,深入探讨其对糖尿病的影响和机制。
在血糖代谢方面,A4表现出对空腹血糖的最佳调节效果,然而,对于OGTT的调节效果却微乎其微。相反,A2在空腹血糖的效果方面受限,但在OGTT的调节上表现出显著性。这可能是由于盐酸二甲双胍是一种已知的能够提高胰岛素敏感性的药物,因此它能够显著改善OGTT的结果。青稞乳酸发酵液可能含有可以调节血糖的成分,影响肝脏的葡萄糖产生或肌肉和脂肪组织的葡萄糖摄取,从而有助于降低空腹血糖水平,但这些成分对于应对OGTT中大量葡萄糖的短时间冲击效果有限。另一个可能性是两者在调节胰岛素分泌方面的机制不同。青稞乳酸发酵液可能主要通过改善胰岛素的作用而非增加分泌,而二甲双胍则可能同时促进胰岛素的分泌和作用。
A3和A5组小鼠的ALT、AST含量下降明显。说明青稞汁及其发酵浓缩液有助于改善肝脏健康状况,减轻炎症和氧化应激。肝脏代谢分析显示,A2组小鼠的肝糖原含量极显著下降,A3和A5组也显著下降。这可能与干预措施促进葡萄糖的利用和代谢有关,使得肝脏储存的糖原得以有效消耗,从而降低了肝糖原的含量。所有干预在降低TG、TC和HDL-C含量方面均表现出积极效果。
通过肠道微生物组成分析表明,青稞汁可以增加小鼠肠道中Lactobacillus的数量,调节血糖代谢。青稞乳酸发酵液通过富集Bacteroides,参与多种代谢过程和肠道免疫调节。青稞乳酸发酵浓缩液使小鼠肠道中富集Eubacterlum_coprostanollgenes_group和Akkermansia,调节血脂异常和改善代谢疾病。其中,青稞乳酸发酵浓缩液和阳性药物对高糖高脂饮食小鼠肠道菌群改变相似。
青稞及其乳酸发酵饮品通过不同机制对血糖和血脂水平产生积极影响。这些效果可能源于青稞中的生物活性成分,如抗氧化剂和维生素,以及发酵过程中产生的新生物活性物质。综合以上实验结果,青稞乳酸发酵液在血糖控制这一关键指标上,效果更显著。然而,这些发现需要通过更多研究来进一步验证,未来的研究可以关注青稞及其衍生产品对T2DM和其他代谢性疾病的潜在治疗作用及其具体机制。
[1] AHMAD E, LIM S, LAMPTEY R, et al.Type 2 diabetes[J].Lancet, 2022, 400(10365):1803-1820.
[2] KELSEY M D, NELSON A J, GREEN J B, et al.Guidelines for cardiovascular risk reduction in patients with type 2 diabetes JACC guideline comparison[J].Journal of the American College of Cardiology, 2022, 79(18):1849-1857.
[3] NORTON L, SHANNON C, GASTALDELLI A, et al.Insulin:The master regulator of glucose metabolism[J].Metabolism, 2022, 129:155142.
[4] DEMIR S, NAWROTH P P, HERZIG S, et al.Emerging targets in type 2 diabetes and diabetic complications[J].Advanced Science, 2021, 8(18):e2100275.
[5] YUN J S, KO S H.Current trends in epidemiology of cardiovascular disease and cardiovascular risk management in type 2 diabetes[J].Metabolism, 2021, 123:154838.
[6] 阎莹莹, 张文会.不同剥皮率对两个品种青稞粉营养品质及其产品的影响[J].食品研究与开发, 2023, 44(15):30-36.YAN Y Y, ZHANG W H.Effects of different peeling rates on nutritional quality and noodle products of two varieties of highland barley[J].Food Research and Development, 2023, 44(15):30-36.
[7] XIE J J, HONG Y, GU Z B, et al.Highland barley starch:Structures, properties, and applications[J].Foods, 2023, 12(2):387.
[8] 傅金凤, 涂师运, 王娟, 等.美食蕉的降血糖活性及其对糖脂代谢指标、激素的影响[J].食品科学, 2022, 43(19):165-173.FU J F, TU S Y, WANG J, et al.Anti-hyperglycemic activity and effects of plantain on glucolipid metabolism indices and hormones[J].Food Science, 2022, 43(19):165-173.
[9] 王妍凌, 薛洁, 赵昊, 等.高通量测序分析新疆不同产区葡萄酒对大鼠肠道菌群多样性的影响[J].中国酿造, 2023, 42(2):83-88.WANG Y L, XUE J, ZHAO H, et al.Effect of wine from different regions in Xinjiang on intestinal flora diversity in rats based on high-throughput sequencing technology[J].China Brewing, 2023, 42(2):83-88.
[10] GÜEMES M, RAHMAN S A, HUSSAIN K.What is a normal blood glucose?[J].Archives of Disease in Childhood, 2016, 101(6):569-574.
[11] FELBER J P, FERRANNINI E, GOLAY A, et al.Role of lipid oxidation in pathogenesis of insulin resistance of obesity and type Ⅱ diabetes[J].Diabetes, 1987, 36(11):1341-1350.
[12] 沈鑫婷, 姜秀杰, 许庆鹏, 等.发芽绿豆多酚提取物对T2DM小鼠糖脂代谢的改善作用[J].中国食品学报, 2023, 23(6):132-139.SHEN X T, JIANG X J, XU Q P, et al.The ameliorative effect of polyphenol extract from sprouting mung bean on glycolipid metabolism in type 2 diabetic mice[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(6):132-139.
[13] HUANG M, ZHAO P, XIONG M R, et al.Antidiabetic activity of perylenequinonoid-rich extract from Shiraia bambusicola in KK-Ay mice with spontaneous type 2 diabetes mellitus[J].Journal of Ethnopharmacology, 2016, 191:71-81.
[14] 钟浩, 王俭, 冯凤琴, 等.高脂膳食、肠道菌群和胆汁酸代谢与胰岛素抵抗之间关系的研究进展[J].中国食品学报, 2023, 9(3):347-364.ZHONG H, WANG J, FENG F Q, et al.Research progress on the relationship between high-fat diet, intestinal flora, bile acid metabolism and insulin resistance[J].Journal of Chinese Institute of Food Science and Technology, 2023, 9(3):347-364.
[15] DELEDDA A, PALMAS V, HEIDRICH V, et al.Dynamics of gut microbiota and clinical variables after ketogenic and Mediterranean diets in drug-Naïve patients with type 2 diabetes mellitus and obesity[J].Metabolites, 2022, 12(11):1092.
[16] RODRIGUES V F, ELIAS-OLIVEIRA J, PEREIRA  S, et al.Akkermansia muciniphila and gut immune system:A good friendship that attenuates inflammatory bowel disease, obesity, and diabetes[J].Frontiers in Immunology, 2022, 13:934695.
S, et al.Akkermansia muciniphila and gut immune system:A good friendship that attenuates inflammatory bowel disease, obesity, and diabetes[J].Frontiers in Immunology, 2022, 13:934695.
[17] 周彤, 潘道勇, 滕兆林.乳酸菌改善糖尿病代谢作用机制研究进展[J].食品安全质量检测学报, 2021, 12(9):3592-3597.ZHOU T, PAN D Y, TENG Z L.Research progress on the mechanism of lactic acid bacteria improving diabetes[J].Journal of Food Safety &Quality, 2021, 12(9):3592-3597.
[18] SMITH B J, MILLER R A, SCHMIDT T M.Muribaculaceae genomes assembled from metagenomes suggest genetic drivers of differential response to acarbose treatment in mice[J].mSphere, 2021, 6(6):e0085121.
[19] ZAFAR H, SAIER M H Jr.Gut Bacteroides species in health and disease[J].Gut Microbes, 2021,13(1):1-20.
[20] WEI W, JIANG W B, TIAN Z, et al.Streptococcus and g.Eubacterium_coprostanoligenes_group combined with sphingosine to modulate the serum dyslipidemia in high-fat diet mice[J].Clinical Nutrition, 2021, 40(6):4234-4245.
[21] SHI H L, YU Y H, LIN D H, et al.β-glucan attenuates cognitive impairment via the gut-brain axis in diet-induced obese mice[J].Microbiome, 2020, 8(1):143.