肠道菌群是寄居在人体肠道内的大量微生物构成的群落,在正常情况下可以和宿主及外部环境建立起动态的生态平衡。肠道菌群有助于消化食物成分、合成必需维生素、支持肠道功能,并通过小分子的代谢物(如短链脂肪酸、胆汁酸、氨基酸等)与宿主进行密切的相互作用,影响人体健康状态[1-2]。因此,维持肠道菌群的平衡对保持人体健康具有重要意义。肠道菌群紊乱会破坏肠道屏障功能,导致炎症、免疫功能下降,从而增加糖脂代谢异常、肠炎、便秘等疾病风险。食物中的营养功能成分与肠道菌群相互作用,可以改善其丰度及组成比例,从而干预肠道微生态[3]。因此,通过健康饮食干预调节肠道菌群,被认为是促进糖脂代谢健康及肠道健康的重要举措[4]。
茶是我国历史悠久的日常饮品,含有人体必需的矿物质和各种维生素,并具有提神醒脑、消食解腻的健康作用[5]。研究表明,茶的功能成分与肠道菌群的相互作用对人体健康有益[6-7]。通常大叶种茶的内含物质较小叶种茶更为丰富。以大叶茶为原料,经过不同加工工艺可以制备绿茶、白茶、普洱生茶、普洱熟茶、酸茶等茶叶。其中,白茶在自然萎凋过程中经内源性多酚氧化酶轻度发酵;普洱生茶利用晒青毛茶压饼,在存储过程中自然转化,以含有20%的儿茶素、0.1%茶黄素,2.5%的茶褐素为特征;普洱熟茶经人工渥堆发酵而成,在黑曲霉等环境微生物作用下较为充分地转化,以形成约10%茶褐素、1.5%茶多糖等大分子物质,儿茶素含量低于0.5%为特征[8]。酸茶主要由乳酸菌厌氧发酵制成,羧酸、芳香酸、有机酸、茶多酚含量在发酵过程中显著增加[9]。由于加工工艺的差别,导致不同茶所含的茶多酚、茶褐素、有机酸等物质存在含量差异,可能影响其功能特点。
体外微生物消化模型能够在模拟生理条件下培养来自人体粪便样品的肠道微生物群,进而模拟人体肠道菌群的生长和代谢,适用于研究人体肠道微生态和微生物消化[10]。体外发酵有助于深入了解肠道微生物群并进一步阐明肠道微生物群在健康和疾病中的作用。本实验通过体外发酵模拟系统,探究以大叶茶为原料分别制备的白茶、普洱生茶、普洱熟茶、酸茶对肠道菌群及其代谢物(主要是短链脂肪酸)的影响,并预测代谢通路及潜在健康作用。为大叶茶的保健作用提供科学参考。
1 材料与方法
1.1 材料与试剂
以云南大叶茶为原料,经不同加工工艺制备为白茶、普洱生茶、普洱熟茶、酸茶,均来自云南中茶茶业有限公司,分别编号为WT、RPT、RIPT、ST。
细菌基因组 DNA提取试剂盒(DP302-02-50),天根生化科技(北京)有限公司;盐酸、NaOH、NaCl、KCl、琼脂粉,国药集团化学试剂有限公司;PBS,吉诺生物医药技术有限公司;高纯N2(≥99.999%),杭州今工特种气体有限公司;乙醚、Na2HPO4、NaH2PO4、乙酸、丙酸、丁酸、异戊酸、正戊酸,上海麦克林生化科技有限公司; H3PO4溶液,上海阿拉丁生化科技股份有限公司;乙腈,美国TEDIA天地试剂公司。
1.2 仪器与设备
TGL-16台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;CP413电子精密天平,上海奥豪斯仪器有限公司;Waters 2695/2489液相色谱仪,美国沃特斯公司;CHA-S恒温振荡培养箱,常州国华电器有限公司;SW-CJ-1FD无菌操作台,苏州市金净净化设备科技有限公司。
1.3 实验方法
1.3.1 粪便收集与预处理
收集无炎症性肠炎、肠易激综合征等肠道疾病,且半年内没有使用过抗生素的3人(20~45岁)粪便作为正常肠道微生物来源;收集每周排便次数少于3次,大便干燥排出困难,或便质不硬但排便不畅,常伴有腹胀、腹痛,且半年内没有使用过抗生素的3人(20~45岁)粪便作为便秘肠道微生物来源。参与捐献人员志愿提供粪便,作为此项研究的肠道微生物样本,且已签署知情同意书。捐献者使用一次性无菌采样器收集好粪便后,立即转入厌氧操作箱。混匀3位捐献者粪便,以消除个体差异。称取10 g粪便于无菌容器中,加入80 mL无菌PBS(pH值为6.8)缓冲液,充分搅拌悬浮后,用3层无菌纱布过滤掉固体颗粒,立即置于厌氧环境中备用。
1.3.2 接种扩培
配制肠道体外批式模拟发酵培养基[11],灭菌后分别分装30 mL到30个总体积50 mL的批式发酵试管中,分别编号1~30。1~15接种10%的正常人群粪便预处理菌液,16~30接种10%的便秘人群粪便预处理菌液。通入N2 5 min,37 ℃,低速(75 r/min)振荡培养。其中正常人群组编号为N,便秘人群组编号为E。
1.3.3 加样前取样
24 h后,取试管编号1、10、30的发酵液3 mL。
1.3.4 添加茶汤
称量白茶、普洱生茶、普洱熟茶、酸茶8 g,浸泡于200 mL沸水中,静置冷却,在试管1、2、3、16、17、18中分别加入10 mL无菌水,即为对照组NC和EC。试管4、5、6中分别加入10 mL白茶茶汤,为N-WT组;试管7、8、9中分别加入10 mL普洱生茶茶汤,为N-RPT组;试管10、11、12 中分别加入10 mL普洱熟茶茶汤,为N-RIPT组;试管13、14、15中分别加入10 mL酸茶茶汤,为N-ST组;试管19、20、21中分别加入10 mL白茶茶汤,为E-WT组;试管22、23、24中分别加入10 mL普洱生茶茶汤,为E-RPT组;试管25、26、27中分别加入10 mL普洱熟茶茶汤,为E-RIPT组;试管28、29、30中分别加入10 mL酸茶茶汤,为E-ST组;分别通入N2后37 ℃,低速(75 r/min)振荡培养1 d、24 h后取样3 mL。
1.3.5 微生物组成测定
移取1.0 mL发酵液至离心管中,采用DNA提取试剂盒完成发酵液样品中的DNA提取,在-20 ℃冰箱保存待测。由杭州联川生物公司进行16S rDNA测序。
1.3.6 有机酸测定
移取1 mL发酵液至离心管中,离心(10 000 r/min,4 ℃)10 min,取上清液转移至新的离心管,加入100 μL浓盐酸和5 mL乙醚,充分振荡使其混合均匀。常温静置萃取20 min后离心(3 500 r/min,4 ℃)10 min,小心收集上清液移至新的离心管。向新离心管中加入500 μL 1 mol/L NaOH溶液,充分振荡使其混合均匀,常温静置萃取20 min,离心(3 500 r/min,4 ℃)10 min,小心收集下层液体转移至新的离心管。向新离心管中加入100 μL浓盐酸充分振荡并混合均匀,取上清液,用0.22 μm的滤膜过滤后,利用高效液相色谱进行分析。色谱条件:水相:0.025%的磷酸水溶液(A),有机相:乙腈(B);进样量20 μL;检测波长210 nm;柱温30 ℃;流速1 mL/min;色谱柱:ZORBAX SB-Aq(4.6 mm×250 mm,5 μm)[12]。
1.4 数据分析
应用Office和SPSS统计软件分析试验数据,采用单因素方差分析Tukey test方法对数据进行组间差异比较,P<0.05被认为具有统计学意义。应用Origin 8.5和Graphpad prism 9绘图软件作图。利用PICRUSt2开展肠道代谢通路预测后,用STAMP软件进行组间差异分析和作图。
2 结果与分析
2.1 肠道微生物多样性分析
2.1.1 α多样性分析
α多样性分析包含物种丰富度(指数越大,物种越丰富,多样性越大)和均匀度(指数越大,微生物分布越均匀,多样性越大)。丰富度反映物种数的多少,均匀度反映各个物种个体数量的分配情况。在物种丰富度一样的情况下,均匀度越高,肠道菌群结构越稳定。结果表明,在接种便秘人群粪便菌液的试管中,白茶、普洱生茶、普洱熟茶、酸茶的干预对物种的丰富度、均匀度均没有显著影响。如图1所示,在接种正常人群粪便菌液的试管中,白茶组显著增加了物种的丰富度,以Chao1指数判定的物种丰富度,与对照组的218.9±35.0相比,白茶升高至349.0±10.1。如图2所示,普洱熟茶显著地增加了物种的均匀度,以Shannon指数判定的均匀度,与对照组的3.8±0.1相比,普洱熟茶组升高至5.5±0.6。因此,普洱熟茶组的肠道微生态均匀度最高,表现出较好的肠道结构稳定性。
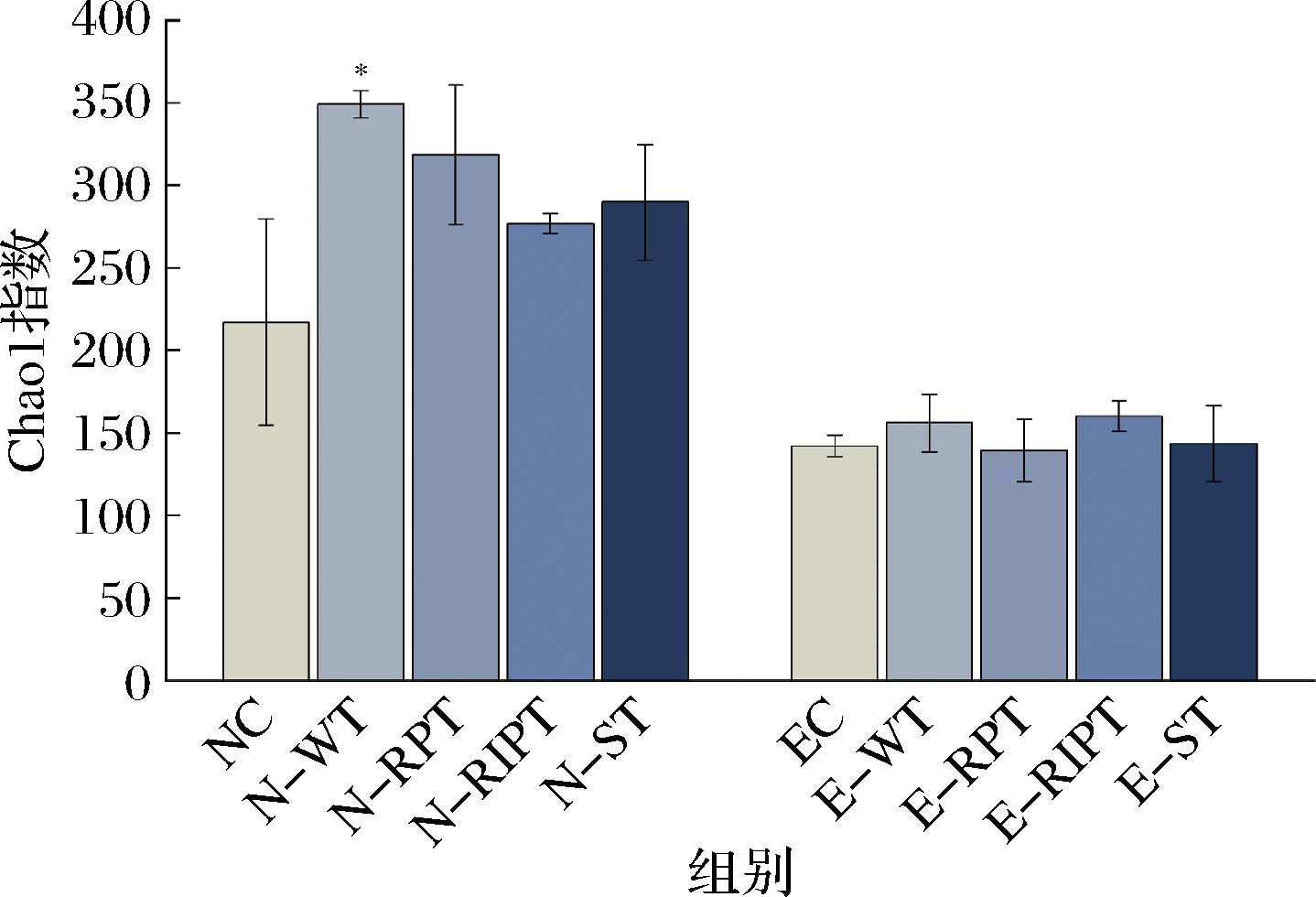
图1 不同加工工艺大叶茶的α多样性分析丰富度表征值
Fig.1 α diversity analysis of different processing techniques for Camellia sinensis var.assamica richness characterization values
注:*P<0.05,**P<0.01,***P<0.001(下同)。
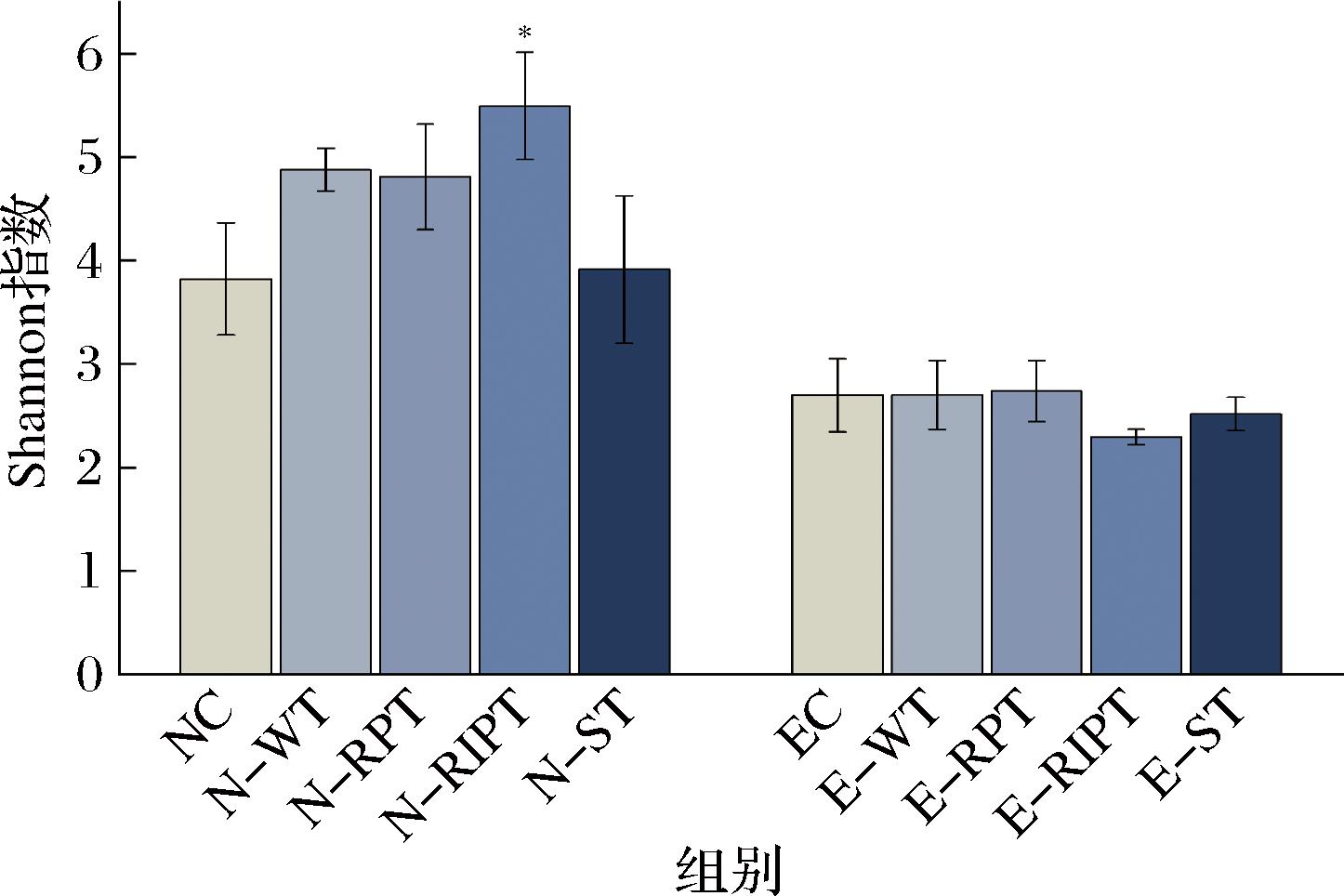
图2 不同加工工艺大叶茶的α多样性分析均匀度表征值
Fig.2 α diversity analysis of different processing techniques for Camellia sinensis var.assamica and characterization of uniformity
2.1.2 主成分分析(principal component analysis, PCA)
PCA样本距离越近,代表肠道菌群越相似,反之差异越大。如图3所示,在正常模型组和便秘模型组中,4种大叶茶均与对照组偏离,说明白茶、普洱生茶、普洱熟茶、酸茶干预后对正常人群和便秘人群肠道菌群组成均产生了影响。其中,普洱熟茶组偏离最远,说明普洱熟茶对肠道菌群组成影响最大。

图3 不同加工工艺大叶茶的肠道菌群PCA图
Fig.3 Principal component analysis of gut microbiota in Camellia sinensis var.assamica under different processing techniques
2.1.3 肠道菌群门层面变化分析
如图4所示,加样培养1 d后,正常模型组中,与对照组的各菌门相对丰度相比,白茶组、普洱生茶组、普洱熟茶组、酸茶组的厚壁菌门(Firmicutes)减少,普洱生茶、普洱熟茶组拟杆菌门(Bacteroidetes)显著增加(3.707±1.045)%、(6.840±1.045)%;便秘人群组中,与对照组的各菌门相对丰度相比,白茶组、普洱生茶组、普洱熟茶组、酸茶组的Firmicutes减少,普洱生茶组的放线菌门(Actinobacteria)增加,普洱熟茶组的拟杆菌门显著增加(0.710±0.146)%。

图4 不同加工工艺大叶茶的肠道菌群各菌门相对丰度柱状图
Fig.4 Bar chart of relative abundance of gut microbiota and phylum in Camellia sinensis var.assamica with different processing techniques
2.1.4 肠道菌群属层面变化分析
在正常模型组中,与对照组相比,白茶组中副拟杆菌(Parabacteroides)和颤螺球菌(Oscillibacter)显著增加(0.464±0.146)%、(0.055±0.019)%,其中颤螺菌丰度与溃疡性结肠炎患者的疾病严重程度呈负相关[13]。普洱生茶组中,双歧杆菌(Bifidobacterium)显著减少(-2.413±0.612)%,普雷沃氏菌(Prevotellaceae)和(Anaerostipes)显著增加(0.023±0.005)%、(0.0324±0.010)%。尽管Bifidobacterium被认为是益生菌,但其丰度过高会产生过量乙酸及乳酸,需进一步代谢为丙酸、丁酸以维持肠道稳态;Anaerostipes可能通过合成丙酸、丁酸等下游短链脂肪酸形成多种短链脂肪酸的稳态平衡[14]。因此,白茶和普洱生茶可能通过调节正常人群肠道发挥抗炎作用。
在正常模型组中,与对照组相比,普洱熟茶显著改变了14种菌属的相对丰度,在4种大叶茶中干预最为明显。其显著抑制了与人类多种化脓性炎症及超敏反应性疾病相关的致病性链球菌(Streptococcus)、产肠毒素的葡萄球菌(Staphylococcus)以及与肠道炎症相关的韦荣氏球菌(Veillonella)及梭杆菌(Fusobacterium),而与分泌抗炎因子、改善肠道炎症相关的拟杆菌(Bacteroides)、克雷伯氏菌(Klebsiella)、真杆菌(Blautia)、瘤胃球菌(Ruminococcus)、Oscillibacter、普雷沃氏菌(Prevotella),与肠癌、糖尿病等疾病负相关的毛螺菌(Lachnospiraceae),与肥胖负相关的Parabacteroides则显著增加(5.063±0.844)%、(0.377±0.119)%、(0.621±0.154)%、(0.963±0.259)%、(0.956±0.274)%、(1.219±0.146)%、(0.200±0.030)%、(0.340±0.074)%、(0.060±0.019)%。因此,普洱熟茶可能通过促进合成短链脂肪酸、抑制肠道炎症,改善代谢健康。
在正常模型组中,与对照组相比,酸茶组的乳杆菌(Lactobacillus)、Bifidobacterium和经黏液真杆菌(Blautia)的丰度显著减少(0.052±0.013)%、(2.416±0.612)%、(0.906±0.310)%。Blautia与标志心血管及代谢疾病风险的内脏脂肪面积负相关。Lactobacillus和Bifidobacterium丰度的降低可能与酸茶带入较高浓度的有机酸,从而反馈性抑制有关[15]。
在便秘模型组中,与对照组相比,白茶组及普洱生茶组中产肠毒素的Staphylococcus丰度显著降低(-0.169±0.053)%、(-0.189±0.053)%。普洱生茶组中,与抑制肥胖和炎症相关的优杆菌(Eubacterium)丰度显著增加(0.046 7±0.012 9)%。普洱熟茶组中,与改善肠道炎症相关的普拉梭菌(Faecalibacterium)、Bacteroides、Ruminococcus,与减肥相关的考拉杆菌(Phascolarctobacterium)、罕见小球菌(Subdoligranulum)、Parabacteroides、嗜黏蛋白阿克曼菌(Akkermansia)显著增加(0.124±0.026 2)%、(0.706±0.130)%、(0.042±0.013)%、(0.103±0.022)%、(0.299±0.090)%、(0.03±0.006)%、(0.089±0.019)%,可引起人类多种化脓性炎症及超敏反应性疾病的Streptococcus、产肠毒素的Staphylococcus、与炎症有关的Fusobacterium则显著减少(-0.142±0.033)%、(-0.215±0.053)%、(-0.046 6±0.014)%。不同加工工艺大叶茶的肠道菌群各菌属相对丰度变化见图5。
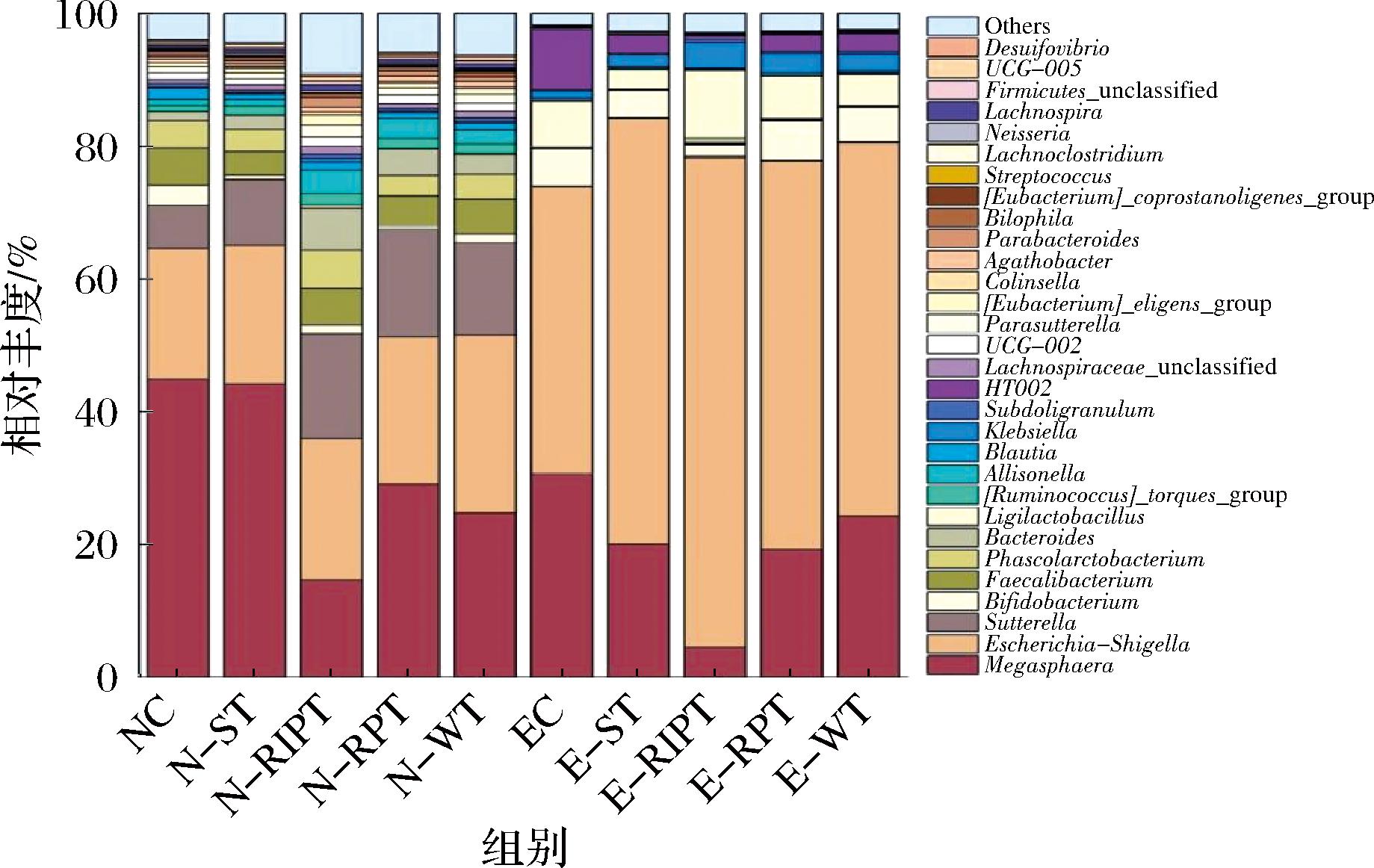
图5 不同加工工艺大叶茶的肠道菌群各菌属相对丰度柱状图
Fig.5 Histogram of the abundance of gut microbiota and genera in Camellia sinensis var.assamica with different processing techniques
2.1.5 PICRUSt2 功能预测分析
通过PICRUSt2功能预测,共测序出41条二级代谢途径。如图6所示,在正常模型组中,白茶的干预导致11条二级代谢途径存在显著性差异,其中促进了运输和分解代谢、内分泌系统、脂质代谢、酶家族、免疫系统疾病、细胞过程和信号转导等代谢途径,抑制了其他氨基酸代谢途径、消化系统、代谢疾病以及碳水化合物代谢。普洱生茶使5条二级代谢途径产生差异,促进了细胞过程和信号转导、生物降解和代谢、能量代谢等途径,抑制了循环系统途径。普洱熟茶使17条二级代谢途径产生显著性差异,其中促进了神经退行性疾病、排泄系统、细胞过程和信号转导、运输与分解代谢、内分泌系统、脂质代谢、心血管疾病、细胞运动性、免疫系统疾病、神经系统、能量代谢等途径,抑制了遗传信息处理、核苷酸代谢、辅助因子和维生素代谢以及代谢性疾病等途径。酸茶的干预则导致外源化合物生物降解代谢途径、三羧酸循环代谢途径存在显著性差异,促进了能量代谢。4种茶均与人体代谢健康相关,但作用的机理不同。特别是普洱生茶和酸茶,其作用机制应重点考虑抗氧化活性强以及对外源有害物质的降解能力强,从而产生抗炎保护作用。
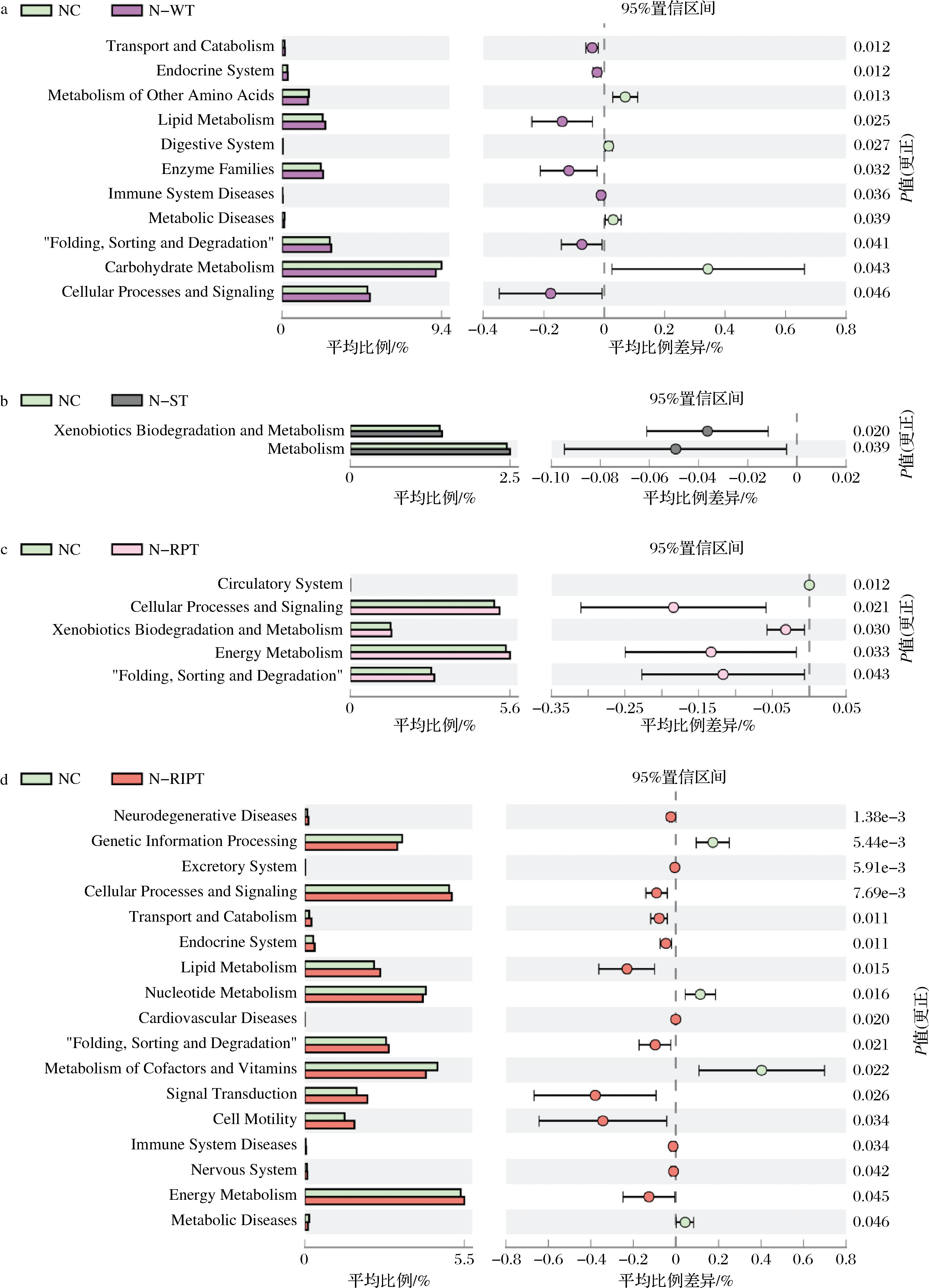
a-白茶干预; b-酸茶干预; c-普洱生茶干预; d-普洱熟茶干预
图6 不同加工工艺大叶茶干预下普通肠型菌群代谢PICRUSt预测差异性分析
Fig.6 Difference analysis of PICRUSt prediction of metabolism of common intestinal flora under the intervention of Camellia sinensis var.assamica with different processing techniques
进一步分析三级代谢途径显示(如图7),白茶、普洱生茶、普洱熟茶均不同程度促进了蛋白和脂质代谢,以普洱熟茶为最强,但只有普洱熟茶促进了淀粉和蔗糖的代谢。白茶、普洱生茶、普洱熟茶、酸茶均促进了脂肪酸的合成。白茶、普洱生茶、普洱熟茶、酸茶均激活了与肠道健康相关的PPARγ信号通路。研究表明,溃疡性结肠炎患者结肠上皮中PPARγ表达降低,可能是导致肠功能障碍和慢性炎症的重要因素[16],提示大叶茶对肠道炎症的抑制潜力。白茶、普洱熟茶、酸茶促进了能量代谢,白茶、普洱生茶、普洱熟茶抑制了Ⅱ型糖尿病途径。在降解外源化合物方面,普洱生茶抑制硫代谢,促进了苯甲酸降解,鞘糖脂的生物合成。普洱熟茶促进胆汁酸合成,促进能量代谢和脂肪酸的合成。酸茶促进了邻苯二酚等物质的降解。
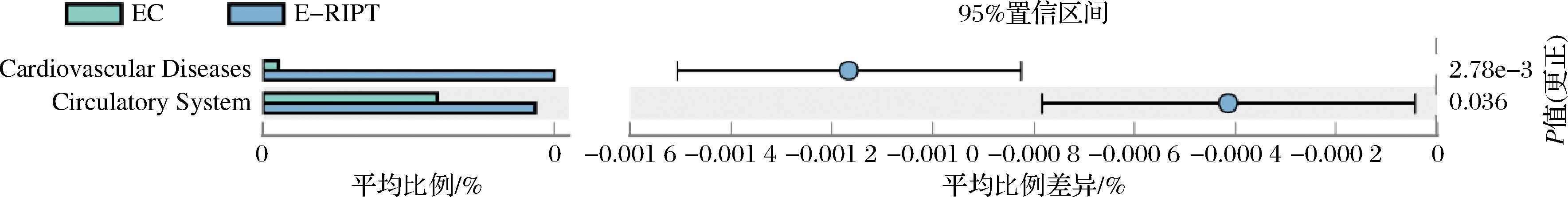
图7 不同加工工艺大叶茶干预下特殊肠型菌群代谢PICRUSt预测差异性分析
Fig.7 Difference analysis of PICRUSt prediction of metabolism of special intestinal flora under the intervention of Camellia sinensis var.assamica with different processing techniques
而在便秘人群中,白茶、普洱生茶和酸茶的摄入均未导致二级代谢途径产生显著性差异,只有普洱熟茶的干预使得与心血管健康和循环系统相关的2条二级代谢途径产生显著性差异。
2.2 有机酸分析
短链脂肪酸主要通过改善肠道pH值、抑制炎症反应、调节免疫力、改善肠道组织形态学、调节微生物谱促进肠道健康。其中,乙酸可以抑制病原菌、降低肠道感染性疾病的发生[17];丙酸能够激活宿主体内与肠道糖异生有关的通路;丁酸可以为肠道上皮提供能量、保护肠道上皮屏障,从而阻止毒素易位进入人体;此外也有激活下游代谢通路的作用[18-19]。
不同茶汤干预对不同肠型短链脂肪酸影响不同。如图8所示,在正常模型组,与对照组相比,白茶、普洱生茶、普洱熟茶、酸茶的总短链脂肪酸分别由(21.2±1.6) mmol/L上升至(49.1±20.4)、(54.1±4.7)、(50.8±14.6)、(57.3±15.5) mmol/L;乙酸分别由(10.3±1.7) mmol/L上升至(19.7±13.3)、(29.0±4.3)、(25.0±7.7)、(36.8±6.4) mmol/L,以酸茶和普洱生茶组的增加最为显著。与对照组相比,白茶、普洱生茶、普洱熟茶、酸茶的丙酸分别由(1.5±0.2) mmol/L上升至(3.3±0.9)、(12.6±1.0)、(14.5±3.7)、(7.5±4.5) mmol/L,以普洱熟茶和普洱生茶的增加最为显著;丁酸分别由(9.4±3.5) mmol/L上升至(26.1±23.7)、(12.5±2.4)、(11.3±3.5)、(12.9±5.2) mmol/L,以白茶的增加最为显著。

a-总短链脂肪酸;b-乙酸;c-丙酸;d-丁酸
图8 总短链脂肪酸、乙酸、丙酸、丁酸的含量的变化
Fig.8 Changes in the content of total short chain fatty acids, acetic acid, propionic acid, and butyric acid
便秘模型组的总短链脂肪酸、乙酸含量在酸茶干预下显著增加,乙酸含量从对照组的(8.0±4.7) mmol/L增加至(17.1±5.8) mmol/L;除此之外,其余茶汤的干预对便秘模型的短链脂肪酸含量影响均不显著。
2.3 典型“炎症-肥胖”通路相关指标分析
肠道菌群中Firmicutes和Bacteroidetes的相对丰度是指示肥胖易感性的生物标志物。比较肥胖和健康个体的肠道微生物群,肥胖人群中Firmicutes和Bacteroidetes的比值(F/B)较高,F/B值增加可能有利于能量吸收和脂肪储存,而导致体重增加和肥胖[20];反之,F/B值较低与不容易吸收热量、不容易胖相关。在正常人群肠道模型中,4种茶均有降低F/B的作用,从强到弱依次为普洱熟茶、普洱生茶、白茶、酸茶。便秘人群肠道模型的F/B相对于正常人群肠道模型显著升高,4种茶均降低便秘人群肠道模型的F/B,其中以普洱熟茶最为显著(表1)。
表1 不同加工工艺大叶茶对肠道菌群中厚壁菌/拟杆菌的影响 单位:%
Table 1 Effects of different processing techniques on Firmicutes/Bacteroides in the gut microbiota of Camellia sinensis var.assamica

组别对照组酸茶普洱熟茶普洱生茶白茶正常组37.46±18.63a27.72±22.42ab5.44±1.71b9.47±3.85b11.09±2.17b便秘组356.67±244.06a150.39±64.52ab23.00±11.04b186.71±75.18ab147.71±28.65ab
注:每行中的上标字母表示统计学显著性差异(P<0.05)。
肠道代谢形成的丁酸能够通过保护肠道上皮屏障的完整性,抑制毒素易位,从而降低系统性炎症及其带来的肥胖等代谢健康风险[19]。如图9所示,在正常模型组,观察到茶干预使得典型产丁酸菌Ruminococcus、真细菌、Lachnospiraceae和丁酸球菌增加,其中普洱熟茶组增加最强,表明普洱熟茶可能通过促进丁酸在肠道的合成抑制“炎症-肥胖”等通路,与代谢健康的积极作用相关[21]。饮茶对促进便秘模型组产乙酸、丁酸菌增殖的作用弱于正常模型组,其中Faecalibacterium的增殖以酸茶最强,其余产丁酸菌的增殖以普洱熟茶较强。酸茶促进产丁酸菌增殖的能力整体弱于普洱熟茶,提示酸茶干预引起的短链脂肪酸增加可能存在其他机制。
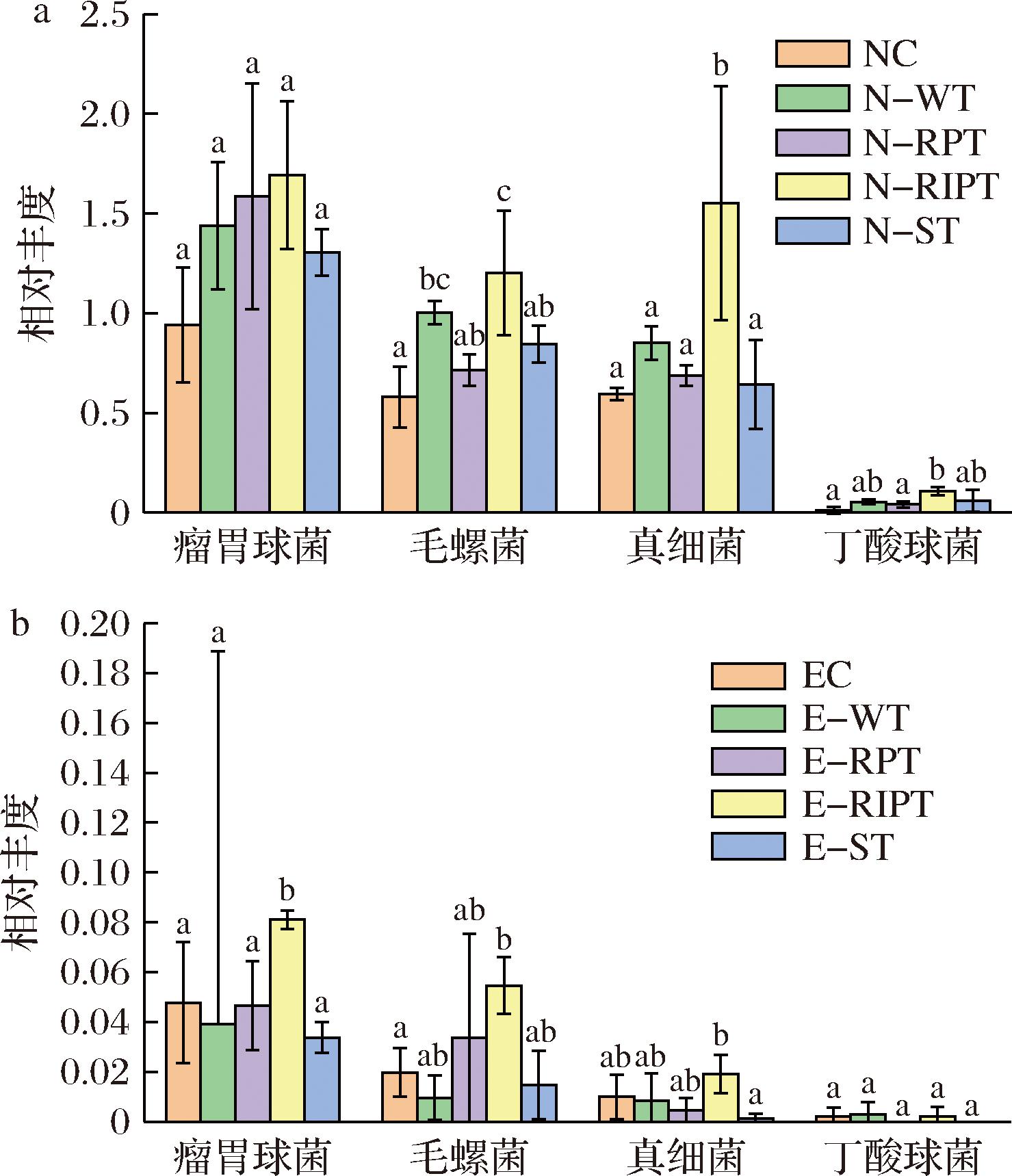
a-正常组;b-便秘组
图9 不同加工工艺大叶茶对肠道菌群主要产丁酸菌丰度的影响
Fig.9 Effect of different processing techniques on the abundance of main butyrate producing bacteria in the intestinal microflora of Camellia sinensis var.assamica
注:上标字母表示统计学显著性差异(P<0.05)。
产丁酸菌的增殖主要有以下原因:(a)饮茶抑制碳水化合物消化,为结肠微生物提供更多用于合成丁酸的底物[22]。(b)茶叶自身的茶多糖等物质为结肠微生物消化提供底物[23]。(c)大叶茶通过抗氧化作用,相对有利于厌氧菌的增殖,从而有利于产生乙酸、丁酸等短链脂肪酸的合成[24-25]。
普洱熟茶和白茶在正常模型组促进了Akkermansia的增殖;普洱熟茶和普洱生茶在便秘模型组促进了Akkermansia的增殖。Akkermansia在较低丰度时,其增加与促进代谢健康正相关。Akkermansia治疗高脂饮食喂养的肥胖小鼠后,可特异性地激活棕色脂肪的产热活性;同时激活肠道内胃肠激素胰高血糖素样肽1(GLP-1)的分泌,从而调节能量平衡、改善葡萄糖稳态[26]。
2.4 典型肠炎相关指标分析
炎症性肠病包括克罗恩病和溃疡性结肠炎,炎症性肠病患者的肠道微生物多样性是减少的。主要表现为Firmicutes的丰度减少,以及肠杆菌科丰度的增加。部分研究还观察到了Parabacteroides、Bifidobacterium以及Lactobacillus的变化。Blautia、Faecalibacterium、Ruminococcus是克罗恩病和溃疡性结肠炎中的关键菌群。Lachnospiraceae和Ruminococcus与复发性疾病、抗肿瘤坏死因子治疗的不良反应以及克罗恩病患者手术干预后的复发呈负相关。
在正常模型组中,与对照组相比,普洱熟茶组中与炎症性肠病负相关的Parabacteroides[27]、Ruminococcus显著增加。普洱生茶组和酸茶组中,具有致病性,有一定促炎作用的Bifidobacterium显著减少。酸茶组中,参与促炎途径的Blautia显著减少。在便秘模型中,与对照组相比,普洱熟茶组中Faecalibacterium显著增加,其在溃疡性结肠炎中丰度降低,显示其有益菌的功能。
3 结论
本研究基于体外试管发酵装置,比较了不同加工工艺的大叶种茶产品对普通肠道及肠杆菌型便秘肠道模型中微生态的影响,并预测其潜在生理功能。结果表明,4种茶对正常健康人及肠杆菌科高的人的肠道菌群结构均有影响;由于加工工艺导致的茶叶成分差异,其作用特点存在不同特征。
白茶、普洱生茶、普洱熟茶、酸茶是以大叶茶为原料制备的,由于加工工艺的不同,导致茶叶成分存在差异。其中,普洱生茶有较高含量的儿茶素,普洱熟茶含有较高的茶褐素和茶多糖。普洱熟茶对肠道菌群结构影响最为显著,这与其特征成分茶褐素、茶多糖有关。酸茶在发酵过程中形成了含量丰富的有机酸,饮用后进入人体肠道[28]。
普洱熟茶对肠道菌群结构的影响最为显著,且预测干预的代谢通路最多,提示其具有促进能量代谢、脂质代谢以及改善代谢疾病的作用。与其他茶相比,熟普洱茶经发酵形成含量较高的茶褐素、茶多糖等物质,分别作用于“胆汁酸-肝脏脂肪沉积”通路及“短链脂肪酸-肠道屏障-慢性炎症”通路,可能是普洱熟茶与改善代谢关联的主要物质因素。研究发现普洱熟茶中茶褐素可通过抑制乳酸杆菌属、芽孢杆菌属、肠球菌属、乳球菌属,Streptococcus生长,从而增加回肠结合胆汁酸水平来抑制肠道FXR-FGF15信号通路,增加肝脏胆汁酸生成和粪便排泄,减少肝脏胆固醇和脂肪生成。而对于另枝菌属、Akkermansia、布劳特氏菌属、罗斯氏菌属等与肥胖呈负相关的菌属,普洱熟茶则可显著提升其丰度。茶褐素增加7-去羟基化菌群如Akkermansia、梭状芽胞杆菌和Parabacteroides,使胆汁酸的生物合成从经典途径转移到替代途径,从而改善白色和棕色脂肪组织的能量代谢,起到改善肥胖作用。茶多糖也能通过调节肠道微生物色氨酸代谢,促进肠上皮细胞再生来改善结肠炎[29]。
酸茶经乳酸菌、芽孢杆菌的厌氧发酵后,含有天然乳酸、琥珀酸、柠檬酸等形成乙酸、丙酸、丁酸等短链脂肪酸的前体物质,同时保留含量较高的多酚类化合物,但茶多糖、茶褐素的含量未见显著增加。尽管熟普洱茶促进产乙酸、丁酸菌的增殖作用更为突出,但其促进肠道模型积累短链脂肪酸的能力却弱于酸茶,可能与酸茶带入有机酸有关。酸茶中自带的乳酸菌、芽孢杆菌等微生物并没有成为肠道菌群中的主导物种,提示酸茶对于肠道微生态的影响主要关注其代谢物而不是发酵微生物本身。被酸茶干预的代谢通路较少,提示针对酸茶的功能研究可以重点关注对肠道微环境的影响。
与正常人群肠道模型相比,尽管便秘人群模型的肠道菌群被茶干预,但未明显改变其肠型及代谢特征。提示饮茶干预人体健康的研究应关注适用人群及其肠道的初始状态。
研究表明,尽管采用相同的大叶茶原料,但内源性酶、厌氧细菌、真菌等不同因素的作用导致茶产品的功能物质含量存在差异。后续应关注不同加工工艺大叶茶的功能特性及物质基础,并判断其适用人群,做好健康导向的质量控制及应用推广。
[1] 李雪荣, 李晓丽.肠道菌群与非消化系统疾病关系的研究进展[J].胃肠病学和肝病学杂志, 2022, 31(1):14-17.LI X R, LI X L.Research progress on the relationship between gut microbiota and non-digestive diseases[J].Chinese Journal of Gastroenterology and Hepatology, 2022, 31(1):14-17.
[2] WOTING A N, BLAUT M.The intestinal microbiota in metabolic disease[J].Nutrients, 2016, 8(4):202.
[3] TAN R, DONG H W, CHEN Z S, et al.Intestinal microbiota mediates high-fructose and high-fat diets to induce chronic intestinal inflammation[J].Frontiers in Cellular and Infection Microbiology, 2021, 11:654074.
[4] TANNOCK G W.Modulating the gut microbiota of humans by dietary intervention with plant glycans[J].Applied and Environmental Microbiology, 2021, 87(6):e02757-e02720.
[5] 李丹. 黑茶对肠道菌群的调节作用研究[D].广州:华南农业大学, 2016.LI D.The study of the regulating effect of Dark tea on gut microbiota[D].Guangzhou:South China Agricultural University, 2016.
[6] BOND T, DERBYSHIRE E.Tea compounds and the gut microbiome:Findings from trials and mechanistic studies[J].Nutrients, 2019, 11(10):2364.
[7] 周方, 欧阳建, 黄建安, 等.茶多酚对肠道微生物的调节作用研究进展[J].茶叶科学, 2019, 39(6):619-630.ZHOU F, OUYANG J, HUANG J A, et al.Advances in research on the regulation of tea polyphenols and effects on intestinal flora[J].Journal of Tea Science, 2019, 39(6):619-630.
[8] 王梦倩, 盛玉泊, 范怡航, 等.不同仓储条件下普洱茶关键成分分析及品质评价[J].食品研究与开发, 2022, 43(16):35-43.WANG M Q, SHENG Y B, FAN Y H, et al.Key components and quality evaluation of Pu-erh tea with different storage conditions[J].Food Research and Development, 2022, 43(16):35-43
[9] 潘联云, 赵碧, 冉隆珣, 等.厌氧发酵促进酸茶中抗氧化物质生成的研究进展[J].食品与发酵工业, 2023, 49(16):350-355.PAN L Y, ZHAO B, RAN L X, et al.Research progress of anaerobic fermentation to promote antioxidant substances synthesis in pickled tea[J].Food and Fermentation Industries, 2023, 49(16):350-355.
[10] 冯潇, 包璇, 向沙沙, 等.探究钴卟啉模拟结肠发酵对肠道菌群的调控[J].食品与发酵工业, 2020, 46(12):87-94.FENG X, BAO X, XIANG S S, et al.Regulation of the gastrointestinal microbiota by cobalt porphyrins via simulated colonic fermentation[J].Food and Fermentation Industries, 2020, 46(12):87-94.
[11] MOON J S, JOO W, LING L, et al.In vitro digestion and fermentation of sialyllactoses by infant gut microflora[J].Journal of Functional Foods, 2016, 21:497-506.
[12] 王彩, 高培鑫, 许竞男, 等.小鼠粪便中短链脂肪酸提取与检测方法的建立及应用[J].现代生物医学进展, 2017, 17(6):1012-1015;1032.WANG C, GAO P X, XU J N, et al.Establishment and application of extraction and determination method for short-chain fatty acids in feces of mice[J].Progress in Modern Biomedicine, 2017, 17(6):1012-1015;1032.
[13] KONIKOFF T, GOPHNA U.Oscillospira:A central, enigmatic component of the human gut microbiota[J].Trends in Microbiology, 2016, 24(7):523-524.
[14] BUI T P N, MANNERÅS-HOLM L, PUSCHMANN R, et al.Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health[J].Nature Communications, 2021, 12(1):4798.
[15] HOU Y, MAO H L, LU F M, et al.Widely targeted metabolomics and HPLC analysis elaborated the quality formation of Yunnan pickled tea during the whole process at an industrial scale[J].Food Chemistry, 2023, 422:135716.
[16] LI D T, FENG Y, TIAN M L, et al.Gut microbiota-derived inosine from dietary barley leaf supplementation attenuates colitis through PPARγ signaling activation[J].Microbiome, 2021, 9(1):83.
[17] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al.From dietary fiber to host physiology:Short-chain fatty acids as key bacterial metabolites[J].Cell, 2016, 165(6):1332-1345.
[18] 林杨凡, 林炫财, 孔晶晶, 等.短链脂肪酸调控肠道健康研究进展[J].现代消化及介入诊疗, 2022, 27(4):520-524.LIN Y F, LIN X C, KONG J J, et al.Research progress of short-chain fatty acids regulating intestinal health[J].Modern Digestion &Intervention, 2022, 27(4):520-524.
[19] 戴博, 王广义.短链脂肪酸对肠道健康的调控机制研究[J].广东化工, 2020, 47(24):63;54.DAI B, WANG G Y.Regulation mechanism of short chain fatty acids on intestinal health[J].Guangdong Chemical Industry, 2020, 47(24):63;54.
[20] TURNBAUGH P J, LEY R E, MAHOWALD M A, et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature, 2006, 444(7122):1027-1031.
[21] KELLY C J, ZHENG L, CAMPBELL E L, et al.Crosstalk between microbiota-derived short-chain fatty acids and intestinal epithelial HIF augments tissue barrier function[J].Cell Host &Microbe, 2015, 17(5):662-671.
[22] GUTIERREZ A, FENG J N, TAN L B, et al.Inhibitory effect of four types of tea on the in vitro digestion of starch[J].Food Frontiers, 2020, 1(4):465-472.
[23] LI H S, FANG Q Y, NIE Q X, et al.Hypoglycemic and hypolipidemic mechanism of tea polysaccharides on type 2 diabetic rats via gut microbiota and metabolism alteration[J].Journal of Agricultural and Food Chemistry, 2020, 68(37):10015-10028.
[24] DE MOURA C, KABBAS T Jr, DE O PEDREIRA F R, et al.Purple tea (Camellia sinensis var.assamica) leaves as a potential functional ingredient:From extraction of phenolic compounds to cell-based antioxidant/biological activities[J].Food and Chemical Toxicology, 2022, 159:112668.
[25] AVIELLO G, KNAUS U G.ROS in gastrointestinal inflammation:Rescue Or Sabotage?[J].British Journal of Pharmacology, 2017, 174(12):1704-1718.
[26] YOON H S, CHO C H, YUN M S, et al.Akkermansia muciniphila secretes a glucagon-like peptide-1-inducing protein that improves glucose homeostasis and ameliorates metabolic disease in mice[J].Nature Microbiology, 2021, 6(5):563-573.
[27] ZAFAR H, JR SAIER M H.Gut Bacteroides species in health and disease[J].Gut Microbes, 2021, 13(1):1-20.
[28] 杨智, 蒋洁琳, 官兴丽, 等.普洱茶调节肠道菌群作用的研究进展[J].食品与发酵工业, 2023, 49(21):303-312.YANG Z, JIANG J L, GUAN X L, et al.Advances on the role of Pu-erh tea by regulating gut microbiota[J].Food and Fermentation Industries, 2023, 49(21):303-312.
[29] 李明珠, 李辉, 王丹.乳饮品中耐胃酸乳酸菌的分离鉴定与筛选[J].中国酿造, 2014, 33(9):42-44.LI M Z, LI H, WANG D.Isolation, identification and screening of gastric acid tolerant lactic acid bacteria from milk drinks[J].China Brewing, 2014, 33(9):42-44.