肥胖是一种慢性代谢疾病。通常,身体质量指数(body mass index,BMI)≥30 kg/m2被认定为肥胖[1]。据估计,到2025年,全球每5个成年人中就有1位肥胖症患者[2]。遗传、代谢和环境等因素均会诱发肥胖,其中肠道菌群的失调也是导致肥胖的重要因素[3]。肥胖会诱发代谢紊乱和心血管疾病[4]。目前,奥利司他和西布曲明被批准用于治疗肥胖症[5],然而长期服用会导致腹痛腹胀、心血管疾病等副作用。因此,寻找天然药食同源物质是更为安全有效的抗肥胖策略。
黄大茶是我国特有的轻度发酵茶类,主产于安徽霍山、湖南洞庭和四川蒙顶山地区,具有独特的浓郁焦香风味。近期研究发现,膳食补充黄大茶茶叶具有改善高脂饮食诱导的营养性肥胖的作用[6]。然而,黄大茶水提物降低体重的效果却不如黄大茶茶叶有效[7],这在很大程度上限制了黄大茶抗肥胖功能饮品的开发应用。
传统药食同源物质通过合理的配伍,可以起到协同增效的作用[8]。中医认为肥胖是由于脾胃运化失调导致的膏脂堆积[9]。薏苡仁为禾本科植物薏米的干燥种仁,具有利湿健脾的作用[10]。茯苓为多孔菌科茯苓的干燥菌核,具有宁心健脾、利水渗湿等功效[11]。薏苡仁和茯苓是传统的药食同源物质,在《神农本草经》中均被列为上品。本研究在中医理论指导下,选用薏苡仁、茯苓和黄大茶配伍,以期达到协同增效改善肥胖的作用。
肥胖的形成和发展往往伴随着肠道微生态的失衡[12]。肠道菌群在功能性食品活性成分的消化吸收过程中发挥重要作用[13]。本研究基于肠道菌群探讨黄大茶复配物改善高脂饮食诱导的营养性肥胖的作用,为进一步开发相关的功能食品提供依据。
1 材料与方法
1.1 动物、材料与试剂
3周龄SPF级C57/BL 6N雄性小鼠,南京维通利华,动物许可证号为SCXK2019-0001。恒定室温(22±2) ℃,相对湿度(50±5)%,12 h/12 h光暗周期环境下适应性饲养2周。实验期间小鼠自由饮水、摄食。动物实验经安徽中医药大学实验动物伦理委员会审批同意,动物伦理编号为AHUCM-mouse-2020088。
黄大茶(DB34/T3020—2017,霍山);薏苡仁(20210730,贵州);茯苓(20210730,安徽);奥利司他(96829-58-2),上海麦克林生化科技股份有限公司;甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒、谷草转氨酶(aspartate transaminase,AST)测试盒、谷丙转氨酶(alanine transaminase,ALT)测试盒,南京建成生物工程研究所;腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)抗体(380431)、p-AMPK抗体(310044)、激素敏感性脂肪酶(hormone-sensitive lipase,HSL)抗体(344379),成都正能生物技术有限公司;甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)抗体(ab207799)、p-HSL抗体(AF8029),美国艾菲公司;β-actin抗体(AF5003),上海碧云天生物技术有限公司。
1.2 仪器与设备
JA3003N电子精密天平,北京赛多利斯科学仪器有限公司;DFY-200A高速粉碎机,上海汗诺仪器有限公司;KRE-3000旋转蒸发仪,昆山市超声仪器有限公司;ALPHA1-2LD真空冷冻干燥机,德国 CHRIST 公司;Molecular Devices SpectraMaxiD3多功能酶标仪,美国 MD 公司;KH-TS生物组织智能自动脱水机,湖北省孝感市宏业医用仪器有限公司;DYY-7C电泳仪,北京六一生物科技有限公司;Gel View 6000 Plus曝光成像仪,广州博鹭腾生物科技有限公司;OLYMPUS BXS1显微镜,日本奥林巴斯株式会社;Agilent 1290高效液相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 黄大茶复配物、薏苡仁+茯苓复配物和黄大茶水提物的制备
称取538 g原料[m(黄大茶)∶m(薏苡仁)∶m(茯苓)=2∶2∶1],超纯水煮沸1 h(料液比1∶10),收集滤液,重复3次。合并滤液,经旋转蒸发浓缩、真空冷冻干燥,得黄大茶复配物,提取率为24%。称取薏苡仁215 g、茯苓108 g,过程与黄大茶复配物提取过程一致,提取率为26.3%。称取215 g黄大茶制备黄大茶水提物,过程与黄大茶复配物提取过程一致,提取率为28.9%。经HPLC检测,黄大茶复配物中含有表没食子酸儿茶素酸酯(epigallocatechin gallate,EGCG)7.5 mg/g,没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)17.4 mg/g,没食子儿茶素(gallocatechin,GC)13.3 mg/g,咖啡因23.4 mg/g,黄大茶水提物中含有EGCG 15.7 mg/g、GCG 13.3 mg/g、GC 8.3 mg/g、咖啡因18.9 mg/g。
1.3.2 动物饲料的制备
低脂饲料的制备参考美国Research Diets公布的D12450H配方,高脂饲料的制备参照D12451配方,见表1。
表1 动物饲料成分 单位:g
Table 1 Composition of animal diets

成分低脂饲料高脂饲料酪蛋白200200蔗糖176.8176.8麦芽糊精75100矿物质S10026B5050纤维素5050玉米淀粉452.272.8L-胱氨酸33酒石酸胆碱22维生素V10001C11猪油20177.5大豆油2525总计1 055858.1
1.3.3 动物造模与分组
适应性喂养小鼠2周后,随机分为6组,每组8只,低脂(low-fat diet,LFD)组给予低脂饲料,高脂(high-fat diet,HFD)组给予高脂饲料,奥利司他(Orlistat)组给予高脂饲料+0.01%奥利司他,黄大茶水提物(large-leaf yellow tea aqueous extracts,LAE)组给予高脂饲料+1.4%LAE,薏苡仁+茯苓水提物(Coix lachrymajobi L. combined with Poria cocos Wolf formula aqueous extracts, CPAE)组给予高脂饲料+2%CPAE,黄大茶复配物(large-leaf yellow tea formula aqueous extracts,LFAE)组给予高脂饲料+2.9%LFAE。LAE、CPAE及LFAE组提取物添加剂量由同等质量黄大茶茶叶按各自提取率换算得来。饮食干预12周,每周记录各组小鼠体重、能量摄入。
1.3.4 血清学指标检测
各组小鼠禁食12 h,心脏取血,4 ℃静置6 h,7 600 r/min离心5 min,取上层血清,分装于-80 ℃冰箱保存。TG、TC、HDL-C、LDL-C、AST及ALT指标按试剂盒说明书进行含量检测。
1.3.5 组织学HE染色
将固定在4%甲醛(质量分数,下同)中的肝脏及附睾脂肪组织冲水过夜,经乙醇、二甲苯、石蜡不同程序脱水、包蜡、切片。制成石蜡切片后,再经过脱蜡、复水、苏木精和伊红染色、二甲苯透明,最后用中性树胶封片。将切片置于烘箱烘干,显微镜下观察组织形态并拍照。
1.3.6 肠道菌群测序分析
各组小鼠麻醉处死,收集小鼠盲肠内容物,-80 ℃保存。提取样本的总DNA,采用Nanodrop对DNA进行定量,并用1.2%琼脂糖凝胶电泳检验提取的DNA浓度与纯度。无菌水将样品稀释至1 ng/μL,根据样本特定序列,设计相应引物,并添加Barcode序列,进行PCR扩增,在25 μL的PCR扩增产物中加入20 μL磁珠吸附,再加入20 μL磁珠洗涤液、200 μL体积分数为80%乙醇、25 μL洗脱液,静置吸附,收集上清液。采用荧光试剂定量后,将样本根据定量结果按比例混合,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备好测序文库后,使用MiSeq测序仪进行双端测序,测序试剂为MiSeq Reagent Kit V3 (600循环)。
1.3.7 Western blot 检测
称取100 mg附睾脂肪组织,加入500 μL的蛋白裂解液(RIPA裂解液∶蛋白酶抑制剂∶磷酸酶抑制剂=50∶1∶1,体积比),充分研磨,4 ℃,11 800 r/min离心取上清液。经BCA法测定蛋白浓度后,使用10%的SDS-PAGE电泳胶进行电泳分离,再转印至NC膜上,经AMPK、p-AMPK、ATGL、HSL、p-HSL或β-actin抗体稀释液4 ℃孵育过夜。二抗室温摇床孵育2 h,超敏发光液显色,曝光成像仪拍照。各目标条带的灰度值使用Image J 1.53图像软件分析处理。
1.3.8 统计学分析
实验数据采用GraphPad Prism 8.0.2进行分析,数据结果以![]() 表示,组间实验数据比较采用单因素方差分析。
表示,组间实验数据比较采用单因素方差分析。
2 结果与分析
2.1 LFAE对HFD食小鼠体重和能量摄入的影响
通过监测各组小鼠12周的体重及能量摄入变化,发现与LFD组相比,HFD组小鼠第12周体重为(42.3±3.3) g,体重显著增长(P<0.001);与HFD组相比,LAE组小鼠第12周体重为(39.6±4.2) g,无显著变化,CPAE组小鼠第12周体重为(38.2±3.4) g,LFAE组小鼠第12周体重为(31.7±3.2) g,显著降低(P<0.001);与LAE组相比,LFAE组小鼠第12周体重显著降低(P<0.01),见图1-a和表2。与LFD组相比,HFD组小鼠能量摄入显著升高(P<0.01),其他各组小鼠每日能量摄入与HFD组小鼠相比均无显著变化,见图1-b,表明LFAE能够在不影响小鼠能量摄入的条件下改善高脂饮食小鼠的体重。结果显示,薏苡仁+茯苓复配物降低小鼠体重作用没有黄大茶复配物显著。因此,后续选择黄大茶复配物进行研究。
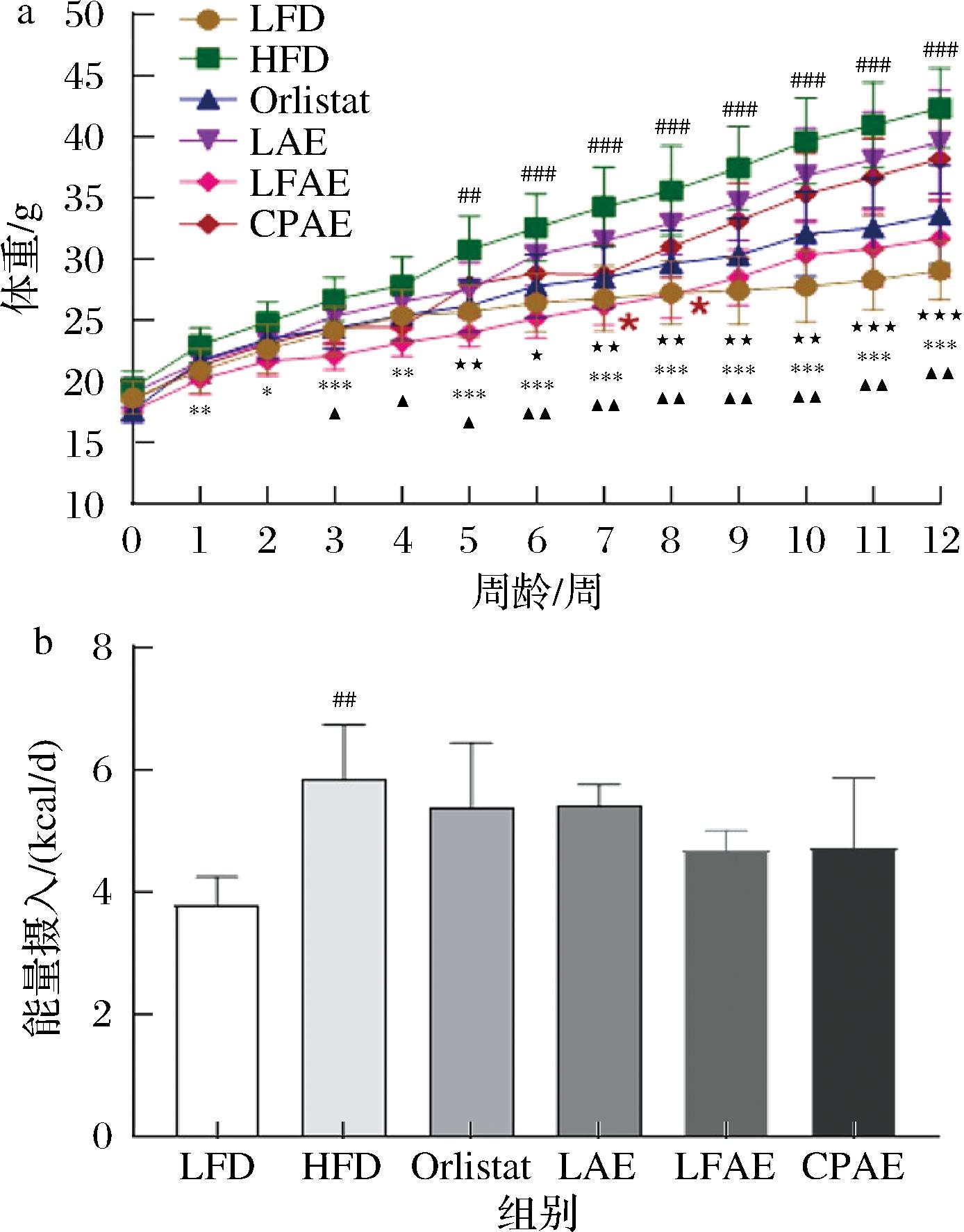
a-各组小鼠12周体重;b-各组小鼠每天的能量摄入
图1 LFAE对HFD小鼠体重和能量摄入的影响
Fig.1 Effects of LFAE on body weight and energy intake in high-fat diet-induced mice
注:与低脂组相比,#P<0.05,## P<0.01,###P<0.001;与高脂组相比,*P<0.05,**P<0.01,***P<0.001;与黄大茶水提物组比,▲P<0.05;▲▲P<0.01;▲▲▲P<0.001(下同)。
表2 各组小鼠第12周体重 单位:g
Table 2 Body weight of mice in each group at week 12
组别LFDHFDOrlistatLAELFAECPAE体重29.1±2.442.3±3.3###33.1±3.9***39.6±4.231.7±3.2***▲▲38.2±3.4
2.2 LFAE对HFD小鼠血脂水平的影响
肥胖往往伴随着血脂水平异常,检测小鼠TG、TC、HDL-C和LDL-C水平变化发现,与LFD组相比,HFD组小鼠TG、TC和LDL-C水平显著升高(P<0.01或P<0.001);与HFD组相比,LFAE组小鼠TC和LDL-C水平显著降低(P<0.05);与LAE组相比,LFAE组小鼠TG水平显著降低(P<0.01),见图2。以上结果表明,LFAE能够改善高脂饮食小鼠血脂异常。

a-血清TG水平;b-血清TC水平;c-血清HDL-C水平;d血清LDL-C水平
图2 LFAE对HFD小鼠血清中TG、TC、HDL-C和LDL-C水平的影响
Fig.2 Effects of LFAE on the levels of TG, TC, HDL-C, and LDL-C in high-fat diet-induced mice
2.3 LFAE对HFD小鼠脂质沉积的影响
脂代谢的不平衡往往会引起脂肪细胞脂质沉积,造成脂肪组织的增大,进而导致肥胖。肥胖会引起脂肪肝等代谢疾病的发生及发展[14]。因此,进一步考察各组小鼠EAT、肝脏系数及组织形态发现,与LFD组相比,HFD组小鼠EAT系数显著增加(P<0.001);与HFD组相比,LFAE组小鼠EAT系数显著降低(P<0.01),肝脏系数降低;与LAE组相比,LFAE组小鼠EAT系数显著降低(P<0.001),结果见图3-a、图3-b。HE染色结果显示,与LFD组相比,HFD组小鼠EAT细胞直径增大,肝脏出现大量脂滴;与HFD组相比,LAE组小鼠EAT细胞直径及肝脏中脂滴含量无显著变化,LFAE组小鼠的EAT细胞直径及肝脏中脂滴含量减少,见图3-d、图3-f。以上结果表明LFAE能够减轻高脂饮食小鼠EAT及肝脏的脂质沉积。

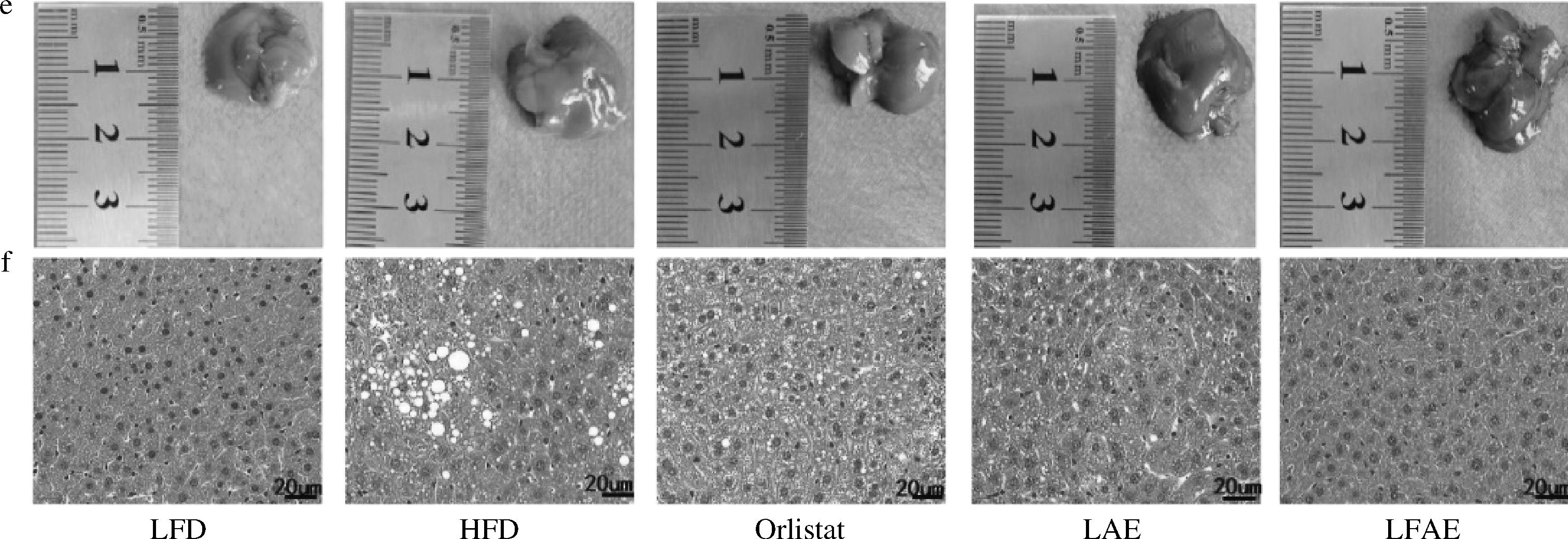
a-EAT系数;b-肝脏系数;c-EAT组织;d-EAT HE;e-肝脏组织;f-肝脏HE
图3 LFAE对HFD小鼠EAT、肝脏系数和脂质沉积的影响(×200, ×400)
Fig.3 Effects of LFAE on organ coefficient and lipid deposition of EAT and liver in high-fat diet-induced mice (×200, ×400)
此外,超重或肥胖的人往往伴随肝功能异常,AST、ALT的水平是反映肝脏损伤的有效指标[15]。如图4所示,与LFD组相比,HFD组小鼠AST、ALT水平均显著升高(P<0.001、P<0.01);与HFD组相比,LAE小鼠AST、ALT水平均降低(P<0.001、P<0.01),LFAE组小鼠AST、ALT水平均降低(P<0.01、P<0.05),见图4。表明LFAE能改善高脂饮食诱导的小鼠肝损伤。
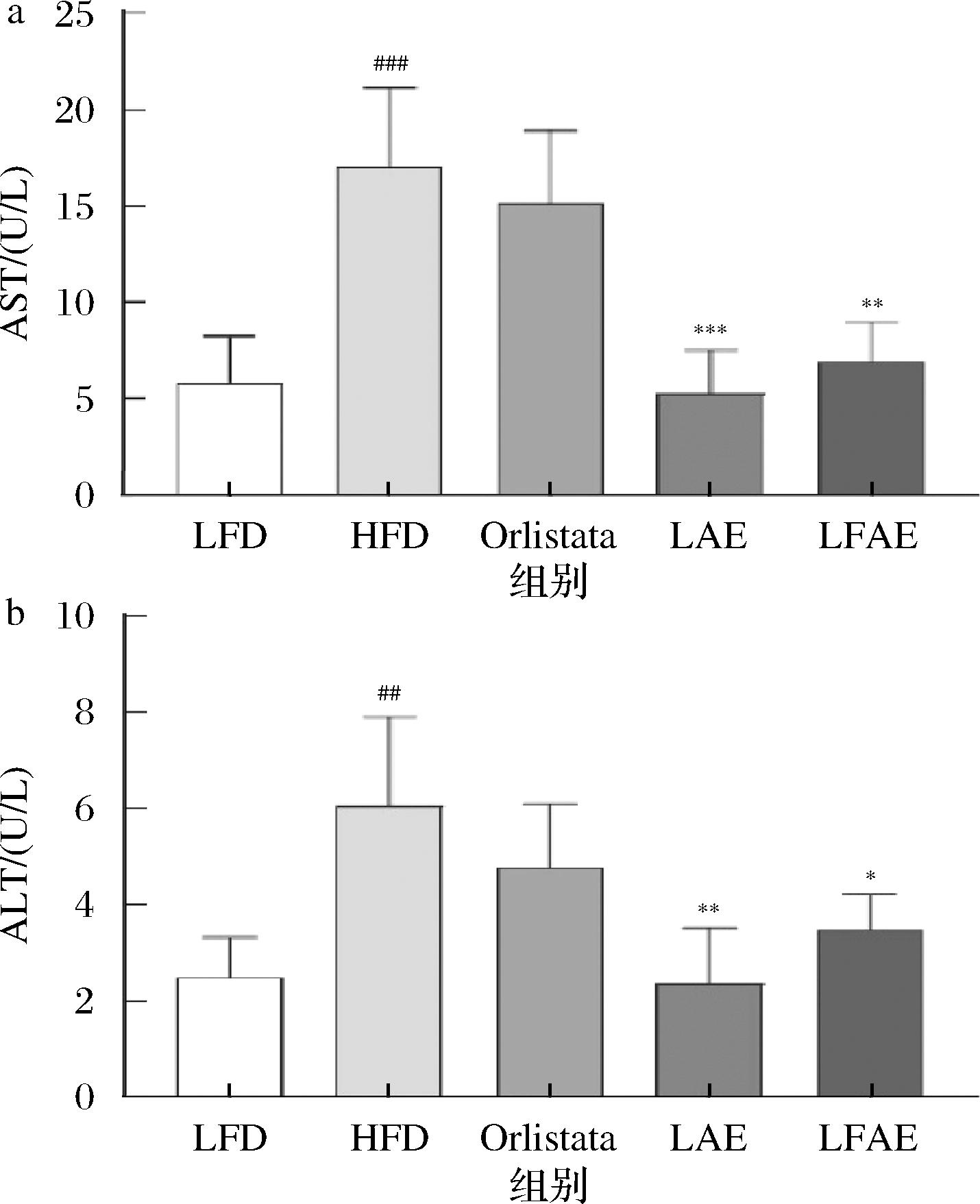
a-AST水平;b-ALT水平
图4 LFAE对HFD小鼠血清中AST和ALT水平的影响
Fig.4 Effects of LFAE on content of AST, and ALT in high-fat diet-induced mice
2.4 LFAE对HFD小鼠肠道菌群Alpha多样性的影响
研究报道,肥胖患者和代谢综合征患者体内正常的肠道微生物的平衡状态会发生失调[16]。本研究通过16S rRNA测序方法,考察LFAE对高脂饮食小鼠肠道菌群多样性变化的影响。与LFD组相比,HFD组小鼠的Chao 1指数、Shannon指数降低,Simpson指数和Faith指数升高;与HFD组相比,LFAE组小鼠Faith指数显著升高(P<0.01),与LAE组小鼠相比,LFAE组小鼠的Faith指数显著升高(P<0.05),Shannon指数升高,Simpson指数降低,见表3。以上结果表明LFAE可以提高小鼠肠道菌群的物种丰富度与多样性。
表3 各组小鼠肠道菌群α多样性
Table 3 α diversity of gut microbiota in mice

分组Chao1指数Shannon指数Simpson指数Faith指数LFD1 200.6±170.46.91±0.360.96±0.0181.66±6.01 HFD1 155.8±148.96.52±0.180.97±0.0187.78±11.75Orlistat918.9±154.94.88±0.850.77±0.06101.30±16.75LAE1 289.5±149.56.67±0.100.98±0.0191.79±9.78LFAE1 182.9±200.86.78±0.200.96±0.01123.90±28.69**▲
2.5 LFAE对HFD小鼠肠道菌群门水平的影响
为了探究各组小鼠肠道菌群的菌属差异,进行β多样性分析。PCoA主成分分析组间相似性,组间距离越近,表明相似度越大。结果显示,与LFD组相比,HFD组样本区间相距较远,说明HFD组小鼠菌群组成结构发生了显著差异;与HFD组及LAE相比,LFAE组样本区间相距较远或部分重合,说明LFAE组小鼠的菌群组成结构发生了显著变化,结果见图5-a。在门水平上,HFD组小鼠厚壁菌门(Firmicutes)丰度显著升高(P<0.001),拟杆菌门(Bacteroidetes)丰度降低;与HFD组相比,LFAE组小鼠的Firmicutes丰度显著降低(P<0.05),Bacteroidetes丰度升高;与LAE组相比,LFAE组小鼠Firmicutes丰度降低,Bacteroidetes丰度升高,结果见图5-b~图5-d。
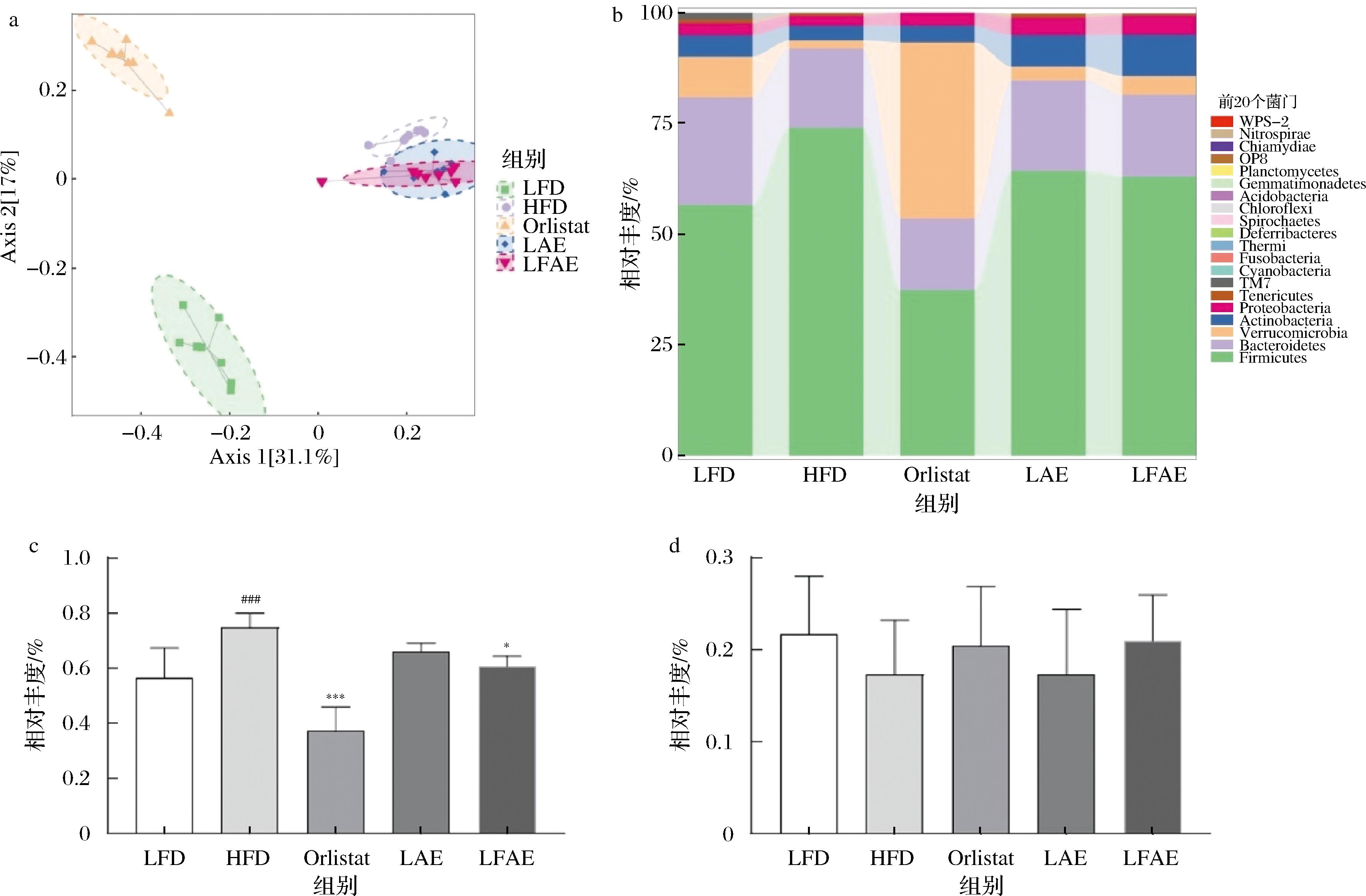
a-PCoA;b-门水平;c-Firmicutes定量;d-Bacteroidetes定量
图5 LFAE对HFD小鼠肠道菌群门水平组成的影响
Fig.5 Effects of LFAE on the phylum of gut microbiota in high-fat diet-induced mice
2.6 LFAE对HFD小鼠肠道菌群属水平的影响
在属水平上,与LFD组相比,HFD组小鼠的阿德勒克罗伊茨菌(Adlercreutzia)、异属杆菌(Allobaculum)丰度显著降低(P<0.05),狄氏副拟杆菌(Parabacteroides)及经黏液真杆菌属(Blautia)丰度无显著差异;与HFD组相比,LFAE组小鼠Adlercreutzia、Allobaculum、Parabacteroides和Blautia丰度均显著升高(P<0.05或P<0.001);与LAE组相比,LFAE小鼠的Adlercreutzia、Parabacteroides及Blautia丰度显著升高(P<0.01或P<0.001),见图6。结果显示,丰度升高的菌属均与脂质代谢相关,表明LFAE可能是通过脂质代谢途径改善小鼠肥胖。
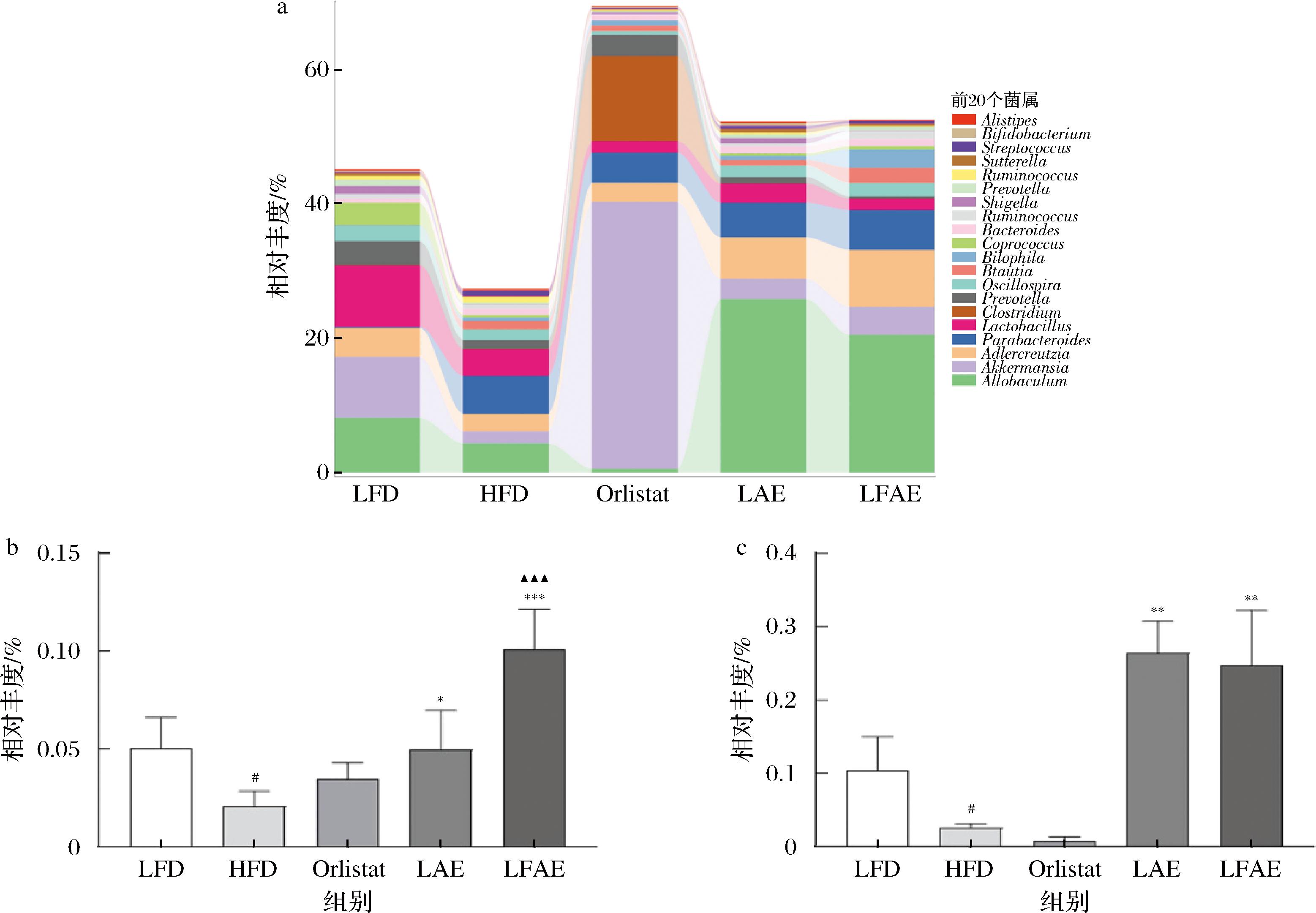
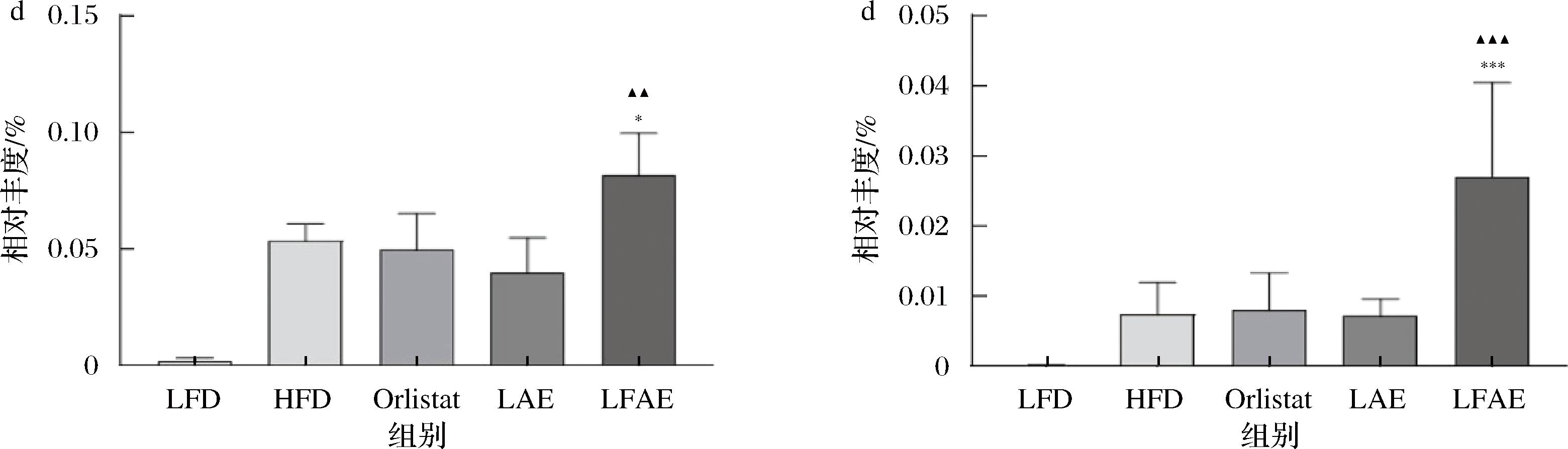
a-属水平;b-Adlercreutzia定量;c-Allobaculum定量;d-Parabacteroides定量;e-Blautia定量
图6 LFAE对HFD小鼠肠道菌群属水平组成的影响
Fig.6 Effects of LFAE on the genus of gut microbiota in high-fat diet-induced mice
2.7 LFAE对HFD小鼠附睾脂肪组织脂解相关蛋白表达的影响
本研究发现LFAE组小鼠肠道内Parabacteroides、Blautia等与脂质代谢相关的菌属丰度显著升高。机体脂肪分解代谢通过将TG分解成甘油和脂肪酸降低脂质沉积,ATGL和HSL是脂肪分解的关键限速酶[17]。如前文所述,LFAE能够减少小鼠EAT脂肪细胞的脂质沉积,因此进一步检测EAT中脂肪分解相关蛋白的表达水平。Western blotting结果显示,与LFD组相比,HFD组小鼠EAT中p-AMPK、ATGL、p-HSL蛋白表达均显著下降(P<0.05或P<0.01);与HFD组相比,LAE组小鼠EAT中AMPK、p-AMPK、ATGL、HSL及p-HSL蛋白的表达均无显著差异,LFAE组小鼠EAT中p-AMPK、ATGL及p-HSL蛋白表达均显著上升(P<0.05或P<0.01);与LAE组相比,LFAE组小鼠EAT中ATGL和p-HSL蛋白表达均显著上升(P<0.05),结果见图7。以上结果表明LFAE能够促进EAT的脂肪分解过程,改善小鼠高脂饮食诱导的肥胖。
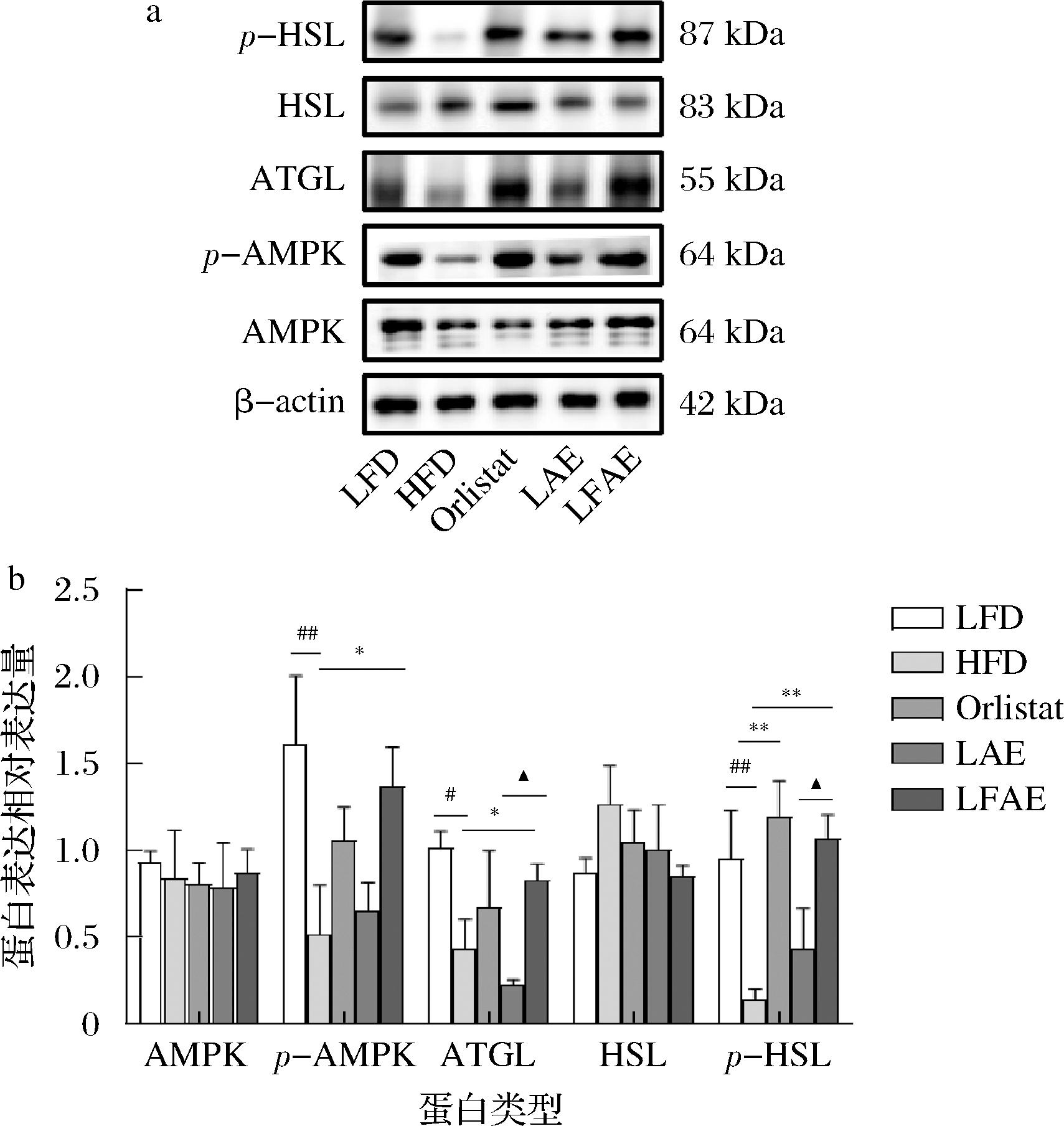
a-蛋白条带图;b-蛋白定量图
图7 LFAE对HFD小鼠EAT脂解相关蛋白表达的影响
Fig.7 Effects of LFAE on the expressions of lipolysis-related proteins of EAT in high-fat diet-induced mice
3 结论与讨论
中医认为肥胖者多属于痰湿体质[18-19]。有研究表明,痰湿体质是发生代谢性疾病的重要因素,痰湿体质的肥胖患者会表现出更严重的胰岛素抵抗等代谢紊乱[20]。薏苡仁和茯苓具有利水渗湿、健脾祛痰等功效,有着悠久的食用和药用历史。
已有研究报道,高脂饮食中添加0.5%的黄大茶水提物对小鼠体重并无显著影响[7]。与之一致,本研究也发现常规剂量黄大茶水提物对肥胖小鼠的体重及脂代谢紊乱并无显著改善作用。然而,通过与薏苡仁、茯苓合理配伍后,改善肥胖及代谢紊乱的效果更为显著。推测可能是通过配伍提高了黄大茶在水提过程中某些抗肥胖活性成分的溶出率。儿茶素是茶多酚的主要成分,具有降脂减肥的作用。GCG能够有效降低高脂血症大鼠的胆固醇及甘油三酯的水平[21]。咖啡因能够通过增加产热、脂肪酸氧化以及能量消耗来改善肥胖[22]。本研究结果显示,黄大茶复配物中GCG、GC、咖啡因含量均高于黄大茶水提物,表明薏苡仁茯苓配伍促进了黄大茶抗肥胖活性成分的溶出。
肠道微生物能够维持宿主的能量平衡状态,肠道菌群失调是肥胖等代谢性疾病发展的重要因素[23]。研究表明,人体的主要优势菌门是Firmicutes与Bacteroidetes,而肥胖患者往往Firmicutes水平较高,Bacteroidetes水平较低[24]。Adlercreutzia能够代谢异黄酮,在糖脂代谢中发挥调节作用。研究表明,糖脂代谢紊乱的小鼠中Adlercreutzia含量较低[25]。ZHENG等[26]研究发现,Allobaculum可以通过产生丁酸提高ANGPTL4的表达改善小鼠的肥胖。WANG等[27]研究发现,Parabacteroides可以通过产生琥珀酸和次级胆汁酸减轻高脂饮食小鼠的体重和高血脂等。Blautia与肥胖、Ⅱ型糖尿病等疾病密切相关[28]。与肥胖患者相比,在减肥成功的患者肠道菌群中,Blautia含量显著升高[29]。本研究结果表明,黄大茶复配物能够提高这些有益菌的丰度并且显著改善肥胖相关的脂代谢紊乱,与以往报道一致。
研究发现,促进AMPK磷酸化能够提高ATGL、HSL的表达,促进脂肪分解,从而改善肥胖小鼠的脂质沉积[30]。ATGL催化TG水解是脂肪分解的第一步。研究表明,ATGL基因缺失会导致小鼠脂肪组织重量增加,以及TG在非脂肪组织中的异位沉积[31]。降低ATGL蛋白的表达,能够抑制脂肪分解并增加脂肪沉积[32],而上调ATGL基因转录水平,能够促进脂肪分解改善肥胖。因此,ATGL在维持脂质储存和动员之间的平衡中具有重要作用[33]。本研究中黄大茶复配物能够上调EAT中ATGL蛋白的表达,减轻高脂饮食小鼠的脂质沉积。此外,临床研究发现,HSL基因表达缺乏的患者会患有血脂异常、胰岛素抵抗等代谢综合征,增强HSL蛋白的表达能够促进脂肪分解,从而减少脂肪细胞中的脂质沉积[34]。本实验发现黄大茶复配物能够提高EAT中HSL的活性,增加p-HSL蛋白的表达,促进脂肪分解过程。
综上所述,本研究发现黄大茶、薏苡仁和茯苓复配物相较于单一黄大茶水提物、茯苓和薏苡仁复配物,具有显著的协同增效抗肥胖作用,机制研究结果表明,黄大茶、薏苡仁和茯苓复配物能够重塑高脂饮食小鼠肠道菌群的组成结构,促进AMPK介导的脂肪组织脂解,为进一步开发相关抗肥胖功能产品提供了理论依据。
[1] CABALLERO B.Humans against obesity:Who will win?[J].Advances in Nutrition, 2019, 10:S4-S9.
[2] MOHAMMED M S, SENDRA S, LLORET J, et al.Systems and WBANs for controlling obesity[J].Journal of Healthcare Engineering, 2018, 2018:1564748.
[3] LEE C J, SEARS C L, MARUTHUR N.Gut microbiome and its role in obesity and insulin resistance[J].Annals of the New York Academy of Sciences, 2020, 1461(1):37-52.
[4] PICHÉ M E, TCHERNOF A, DESPRÉS J P.Obesity phenotypes, diabetes, and cardiovascular diseases[J].Circulation Research, 2020, 126(11):1477-1500.
[5] LEE S G, KANG H.Anti-obesity and lipid metabolism effects of Ulmus davidiana var.japonica in mice fed a high-fat diet[J].Journal of Microbiology and Biotechnology, 2021, 31(7):1011-1021.
[6] FENG X Y, YANG S Y, PAN Y N, et al.Yellow tea:More than turning green leaves to yellow[J].Critical Reviews in Food Science and Nutrition, 2024,64(22):7836-7853.
[7] 陆凤娟, 许娜, 沈钰珠, 等.黄大茶水提物改善高脂小鼠脂肪组织的脂肪酸代谢[J].食品科学, 2022, 43(17):156-163.LU F J, XU N, SHEN Y Z, et al.Large-leaf yellow tea aqueous extract ameliorates fatty acid metabolism in the adipose tissue of obese mice[J].Food Science, 2022, 43(17):156-163.
[8] 吴秀君, 李美芬, 辜学敏.中药配伍减毒增效的现代化研究进展[J].世界最新医学信息文摘, 2019, 19(99):77;79.WU X J, LI M F, GU X M.Progress of modern research on the compatibility of Chinese medicine to reduce toxicity and increase effectiveness[J].World Latest Medicine Information, 2019, 19(99):77;79.
[9] 范晓露, 唐红珍.肥胖与脾胃[J].河南中医, 2018, 38(3):339-342.FAN X L, TANG H Z.The correlation between obesity and spleen and stomach[J].Henan Traditional Chinese Medicine, 2018, 38(3):339-342.
[10] 马明慧, 刘秀峰, 余伯阳.薏苡仁的本草考证[J].中国民族民间医药, 2021, 30(19):32-37.MA M H, LIU X F, YU B Y.Herbal textual research of coicis semen[J].Chinese Journal of Ethnomedicine and Ethnopharmacy, 2021, 30(19):32-37.
[11] 崔鹤蓉, 王睿林, 郭文博, 等.茯苓的化学成分、药理作用及临床应用研究进展[J].西北药学杂志, 2019, 34(5):694-700.CUI H R, WANG R L, GUO W B, et al.Research advances in chemical components, pharmacological activities and clinical application of Poria cocos[J].Northwest Pharmaceutical Journal, 2019, 34(5):694-700.
[12] 于淼, 徐珒昭, 杨晓莹, 等.肠道菌群介导肥胖的机制及调控方法研究进展[J].食品科学, 2023, 44(15):339-350.YU M, XU J Z, YANG X Y, et al.Advances in the mechanism and regulation of obesity induced by gut microbiota[J].Food Science, 2023, 44(15):339-350.
[13] 张国壮, 陈士林, 董林林.中药微生物组学及其研究策略[J].中国中药杂志, 2023, 48(3):596-607.ZHANG G Z, CHEN S L, DONG L L.Traditional Chinese medicine microbiomics and its research strategies[J].China Journal of Chinese Materia Medica, 2023, 48(3):596-607.
[14] POLYZOS S A, KOUNTOURAS J, MANTZOROS C S.Obesity and nonalcoholic fatty liver disease:From pathophysiology to therapeutics[J].Metabolism:Clinical and Experimental, 2019, 92:82-97.
[15] PURCELL M, FLORES Y N, ZHANG Z F, et al.Prevalence and predictors of alanine aminotransferase elevation among normal weight, overweight and obese youth in Mexico[J].Journal of Digestive Diseases, 2013, 14(9):491-499.
[16] JOHN G K, MULLIN G E.The gut microbiome and obesity[J].Current Oncology Reports, 2016, 18(7):45.
[17] MORAK M, SCHMIDINGER H, RIESENHUBER G, et al.Adipose triglyceride lipase (ATGL) and hormone-sensitive lipase (HSL) deficiencies affect expression of lipolytic activities in mouse adipose tissues[J].Molecular &Cellular Proteomics:MCP, 2012, 11(12):1777-1789.
[18] 马欢, 孟凡艳, 张杰.痰湿与肥胖探析[J].辽宁中医药大学学报, 2020, 22(6):64-67.MA H, MENG F Y, ZHANG J.Analysis of phlegm-dampness and obesity[J].Journal of Liaoning University of Traditional Chinese Medicine, 2020, 22(6):64-67.
[19] 张潞潞, 苏晓鹏, 朱玲慧, 等.肥胖与中医体质相关研究进展[J].世界中医药, 2022, 17(17):2512-2516;2523.ZHANG L L, SU X P, ZHU L H, et al.Research progress on obesity and constitution of traditional Chinese medicine[J].World Chinese Medicine, 2022, 17(17):2512-2516;2523.
[20] SHIN J, LI T X, ZHU L H, et al.Obese individuals with and without phlegm-dampness constitution show different gut microbial composition associated with risk of metabolic disorders[J].Frontiers in Cellular and Infection Microbiology, 2022, 12:859708.
[21] LEE S M, KIM C W, KIM J K, et al.GCG-rich tea catechins are effective in lowering cholesterol and triglyceride concentrations in hyperlipidemic rats[J].Lipids, 2008, 43(5):419-429.
[22] HARPAZ E, TAMIR S, WEINSTEIN A, et al.The effect of caffeine on energy balance[J].Journal of Basic and Clinical Physiology and Pharmacology, 2017, 28(1):1-10.
[23] GOMES A C, HOFFMANN C, MOTA J F.The human gut microbiota:Metabolism and perspective in obesity[J].Gut Microbes, 2018, 9(4):308-325.
[24] MAGNE F, GOTTELAND M, GAUTHIER L, et al.The firmicutes/bacteroidetes ratio:A relevant marker of gut dysbiosis in obese patients?[J].Nutrients, 2020, 12(5):1474.
[25] LU H Q, YOU Y T, ZHOU X H, et al.Citrus reticulatae pericarpium extract decreases the susceptibility to HFD-induced glycolipid metabolism disorder in mice exposed to azithromycin in early life[J].Frontiers in Immunology, 2021, 12:774433.
[26] ZHENG Z B, LYU W T, REN Y, et al.Allobaculum involves in the modulation of intestinal ANGPTLT4 expression in mice treated by high-fat diet[J].Frontiers in Nutrition, 2021, 8:690138.
[27] WANG K, LIAO M F, ZHOU N, et al.Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J].Cell Reports, 2019, 26(1):222-235.
[28] LIU X M, MAO B Y, GU J Y, et al.Blautia-a new functional genus with potential probiotic properties?[J].Gut Microbes, 2021, 13(1):1-21.
[29] SONG M Y, KIM B S, KIM H.Influence of Panax ginseng on obesity and gut microbiota in obese middle-aged Korean women[J].Journal of Ginseng Research, 2014, 38(2):106-115.
[30] HAEMMERLE G, LASS A, ZIMMERMANN R, et al.Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase[J].Science, 2006, 312(5774):734-737.
[31] WEI C S, WANG X T, YAO X P, et al.Bifenthrin induces fat deposition by improving fatty acid uptake and inhibiting lipolysis in mice[J].Journal of Agricultural and Food Chemistry, 2019, 67(51):14048-14055.
[32] CERK I K, WECHSELBERGER L, OBERER M.Adipose triglyceride lipase regulation:An overview[J].Current Protein &Peptide Science, 2018, 19(2):221-233.
[33] RECAZENS E, MOUISEL E, LANGIN D.Hormone-sensitive lipase:Sixty years later[J].Progress in Lipid Research, 2021, 82:101084.
[34] SHIAU M Y, CHUANG P H, YANG C P, et al.Mechanism of interleukin-4 reducing lipid deposit by regulating hormone-sensitive lipase[J].Scientific Reports, 2019, 9(1):11974.