益生菌是指摄入一定数量后,能对宿主健康产生有益作用的活的微生物[1],在调节肠道菌群、抑制病原菌、调节免疫、降低血糖和血脂以及预防疾病等方面发挥重要作用[2]。益生菌产品的益生效果很大程度上取决于定植于结肠的活菌数量,但是,益生菌在食品加工、贮藏过程中容易受到环境压力(包括高温、湿度、氧胁迫、渗透压)[3]以及消化过程中低pH和胆盐[4]的影响导致细胞损伤甚至是活力丧失。为了减少益生菌在这些环境胁迫下丧失活力,可利用微胶囊技术制备益生菌口服递送体系。
益生菌微胶囊通过微囊技术将益生菌封装于保护性壁材中,可有效提高益生菌对环境中各种胁迫因素的抵抗力,延长保质期并实现在肠道内的靶向控释[5]。喷雾干燥是一种适用于工业化的微囊化技术,它通过雾化、加热、真空干燥的共同作用,一步快速生成干燥的粉末,具有高效经济的优点[6]。蛋白质和多糖是最常用的益生菌微囊化壁材,但是蛋白质对胃蛋白酶的敏感性以及多糖成膜性差、多孔性等缺点导致它们无法提供足够的保护效果。相比采用单一壁材包埋,蛋白质和多糖结合使益生菌微胶囊具有更高的包封率和消化后存活率。DEHKORDI等[7]采用乳化法制备海藻酸钠-乳清分离蛋白微胶囊并包埋嗜酸乳杆菌,其包封率高达97.5%,相比于游离益生菌,包封后的益生菌在消化后菌活提高了5.51 lg CFU/g。但是,以蛋白质和多糖为壁材的微胶囊存在多孔性和溶胀崩解的问题,导致益生菌在胃消化过程中因接触胃酸而活性降低。
Ca2+可以诱导蛋白质络合和多糖的交联,形成更为致密的网络结构,提高细胞的黏附以及对胃酸和消化酶的抗性[8]。Ca2+诱导交联往往是通过外部凝胶化[9]来实现,交联后的微胶囊在分离后进行喷雾干燥步骤。这种方法需要在干燥之前经历高强度的混合剪切,以产生可以通过喷嘴的小尺寸微胶囊,具有工艺复杂、包封率低等缺点。研究人员还利用挥发性碱来促进壁材和Ca2+在喷雾干燥过程的交联,实现一步制备交联的微胶囊[10],但是这可能不益于对pH敏感的益生菌。最近,我们创新性地采用一种三流体喷雾干燥技术,利用同喷涂CaCl2溶液诱导结冷胶原位交联,仅通过单步工艺实现微胶囊的成型、交联和干燥,简化了微胶囊的制备过程,最大限度地减少了污染风险和转移损失。
本研究分别制备明胶、明胶-氯化钙、明胶-结冷胶和明胶-结冷胶-氯化钙为壁材的益生菌微胶囊,通过考察微胶囊的溶解性、傅里叶红外光谱以及喷雾干燥益生菌、模拟消化液暴露和储存后益生菌的活性,评价凝聚和Ca2+交联微胶囊在益生菌保护方面的潜力。为生产具有胃肠保护特性的益生菌微胶囊提供了一个新思路,拓宽了益生菌在食品领域的应用。
1 实验材料和方法
1.1 实验材料
明胶,博洋生物科技有限公司;结冷胶,阜丰生物科技有限公司;蔗糖,西陇科学股份有限公司;植物乳杆菌,中科嘉益生物工程有限公司;MRS琼脂培养基,北京索莱宝科技有限公司;胃黏膜胃蛋白酶、猪胰腺脂肪酶、猪胰腺胰酶、牛胆盐,美国Sigma化学公司;CaCl2、柠檬酸钠、NaCl等试剂均为分析级,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
B290喷雾干燥塔,瑞士BUCHI有限公司;ZDX-35BI高压灭菌锅,上海申安医疗器械厂;NICOLET iS10傅里叶红外光谱仪,美国赛默飞世尔科学公司;Sigma 300冷冻扫描电子显微镜,德国ZEISS公司;Mastersizer 3000激光微米粒度仪,英国马尔文仪器有限公司;HH-4数显恒温磁力搅拌水浴锅,金坛市城西晓阳电子仪器厂。
1.3 实验方法
1.3.1 益生菌微胶囊的制备
首先,在100 mL去离子水中加入1 g结冷胶,在60 ℃水浴中搅拌至完全溶解,然后加入4 g明胶继续搅拌至形成均匀的蛋白质多糖溶液,将植物乳杆菌菌粉按1∶20(质量比)加入混合溶液中,最后加入5 g蔗糖,以提高益生菌在喷雾干燥过程中的热稳定性[11],制备浓度为20 mmol/L的CaCl2溶液作为交联剂。
通过配备三流体同轴喷嘴的喷雾干燥塔实现Ca2+原位交联、微胶囊的成型和干燥(如图1所示)。进风温度调节恒定为120 ℃,将益生菌混合溶液和CaCl2溶液分别通入三流体同轴喷嘴的内、外进料通道,收集70~80 ℃出风温度下的益生菌微胶囊,得到以明胶-钙离子、明胶-结冷胶-钙离子为壁材的益生菌微胶囊,即Gel-Ca2+、Gel-GG-Ca2+。作为对照,制备未交联的益生菌微胶囊,仅将益生菌混合溶液通入内进料通道中,收集以明胶、明胶-结冷胶为壁材的微胶囊,记录为Gel、Gel-GG。
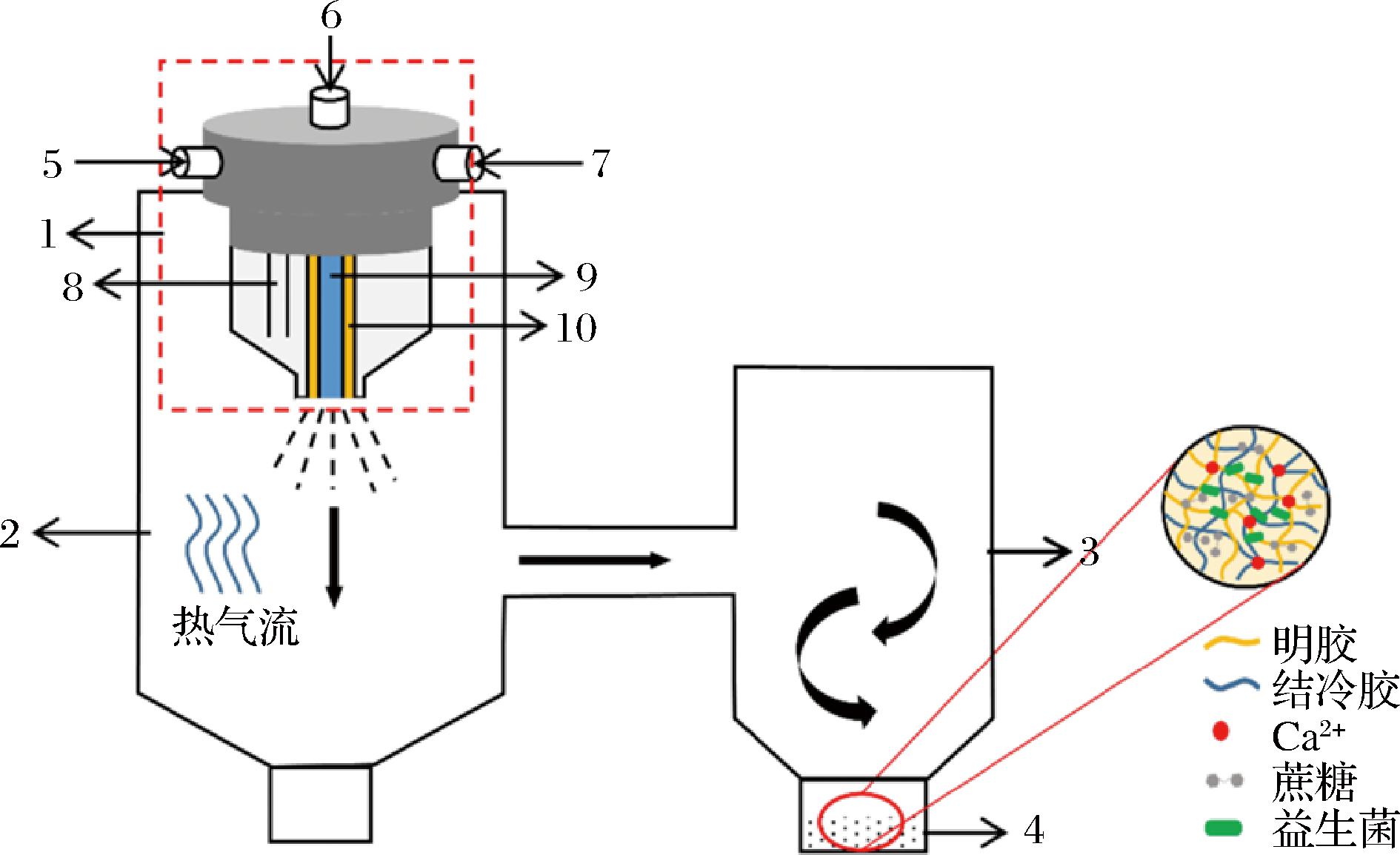
1-三流体同轴喷嘴;2-干燥塔;3-旋风分离;4-收集器;5-喷雾空气进口;6-内通道物料进口;7-外通道物料进口;8-气流通道;9-物料内通道;10-物料外通道
图1 三流体同轴喷雾干燥过程中微胶囊的形成过程
Fig.1 The formation process of microcapsules in the three-fluid co-axial spray drying process
1.3.2 微胶囊的微观结构
用Sigma 300扫描电镜观察喷雾干燥粉末的微观结构。将粉末用导电胶固定在样品台上后镀金,在3 kV电子束加速电压和×500和×2 000的放大倍数下观察微胶囊的形貌。
1.3.3 微胶囊的溶解性
微胶囊的溶解性测定参考ZHAO等[12]方法,通过激光粒度仪测量溶解过程中微胶囊的粒径变化来表示,具体细节如下:取0.5 g微胶囊分散于550 mL去离子水中,在2 500 r/min条件下搅拌,每2 min测一次微胶囊粒径,共测定90 min。样品折光率为1.52,吸收率为0.01,分散剂为去离子水,折射率为1.33,遮光度范围为2%~8%,温度为25 ℃。以时间为横坐标,分别以D(10)、D(50)、D(90)为纵坐标绘制粒径分布曲线图。
1.3.4 傅里叶红外光谱测定
分别称取1~3 mg样品,加入140 mg KBr研磨压片,使用傅里叶红外光谱仪进行扫描并分析,扫描范围4 000~400 cm-1,扫描次数64次。
1.3.5 喷雾干燥后微胶囊中益生菌计数
取0.1 g微胶囊于9.9 mL 质量分数为0.5%的柠檬酸钠溶液中,37 ℃孵育10 min,涡旋振荡至微胶囊完全溶解,使用生理盐水(质量分数为0.9%的NaCl溶液)将该溶液连续稀释后涂布于MRS琼脂培养基上,并在37 ℃下有氧培养48 h后进行菌落计数,测得微胶囊中益生菌的活菌数。采用同样的方法测定喷雾干燥前壁材溶液中的活菌数,即为益生菌在喷雾干燥前的活菌数。
1.3.6 微胶囊在模拟体外消化过程中的益生菌的存活率
参考HU等[13]的方法,考察益生菌在模拟胃肠液中暴露后的存活率,具体细节如下:
模拟胃消化液(simulated gastric fluid,SGF)的配制:将胃蛋白酶按3.2 mg/mL加入含有2 mg/mL NaCl和7 mL/L HCl的混合溶液中,并将其pH调节至2.0。模拟肠消化液(simulated intestinal fluid,SIF)配制:称取36.7 g CaCl2,218.7 g NaCl,用蒸馏水溶解并定容至1 L。
将0.1 g微胶囊加入到9.9 mL SGF中,并置于37 ℃、100 r/min条件下水浴振荡2 h,胃消化后用0.25 mol/L的NaOH溶液将混合液pH值调节至7.0。加入1.5 mL SIF、189 mg牛胆盐(溶于3.5 mL 5 mmol/L PBS缓冲液,pH值为7.0)、60 mg脂肪酶和60 mg胰蛋白酶(溶于2.5 mL 5 mmol/L PBS缓冲液,pH值为7.0),将混合液继续放置在37 ℃、100 r/min条件下水浴振荡2 h。分别取胃和肠消化后的消化液,加入质量分数为0.5%的柠檬酸钠溶液解囊后用生理盐水稀释并涂布于MRS培养基上,在37 ℃下有氧培养48 h后进行菌落计数。
1.3.7 微胶囊的贮藏稳定性
将微胶囊和干燥剂密封于铝箔袋中并置于4 ℃和25 ℃环境中保存,每隔7 d取样,通过平板计数法测定微胶囊中的活菌数[14]。
1.3.8 数据处理和分析
所有的数据重复测定3次,结果以平均值±标准偏差表示。采用SPSS 26对数据进行方差分析(ANOVA),使用最小显著性差异法(least significant difference,LSD)和Duncan检验,P<0.05表明样本之间具有显著性差异。
2 结果与分析
2.1 益生菌微胶囊的理化性质
2.1.1 微胶囊的微观结构
利用冷冻扫描电镜观察微胶囊的形态,结果如图2所示。所有微胶囊样品均未见裂缝和孔洞,且大多数微胶囊具有喷雾干燥典型的凹陷表面,这是水分在喷雾干燥过程中瞬间蒸发导致[15]。微胶囊表面上没有看到益生菌存在,这表明益生菌已成功地包埋在内部。

a-Gel;b-Gel-Ca2+;c-Gel-GG;d-Gel-GG-Ca2+
图2 益生菌微胶囊的冷冻扫描电镜图像
Fig.2 Scanning electron microscope (SEM) image of probiotic microcapsules
2.1.2 微胶囊的溶解性
微胶囊在水中的溶解情况与益生菌在模拟消化液中的存活率有关,微胶囊溶解速率越快,在消化液中的崩解速率就越快,能提供给益生菌的结构保护就越弱[16]。微胶囊的溶解性可以通过测量微胶囊在水中的粒径变化来表示。如图3所示,以D(10)、D(50)、D(90) 3种粒径大小表示各种微胶囊在水中溶胀过程的的粒径变化。Gel的粒径一直呈下降趋势,而且在40 min左右迅速崩解,最终D(10)和D(50)低至小于1 μm,表明其近乎完全溶解。GG的粒径呈现先减小后增大的趋势,最后达到一个稳定的值,表现出明显的溶胀行为。Gel-GG2+的粒径在溶解前30 min逐渐降低后基本维持不变。Gel-Ca2+的粒径先减小后增大然后继续降低,最终粒径保持一定大小。Gel-GG-Ca2+的粒径在整个溶胀过程中基本保持稳定。微胶囊在溶解前4 min内粒径的迅速降低可能是因为团聚微胶囊的解离。与单种壁材包埋相比,Gel-GG的溶解速率和溶胀性显著降低,并且能在后期维持稳定的微胶囊形态。Gel-Ca2+微胶囊在整个溶解过程先溶胀后仅部分崩解,这可能是因为Ca2+促进了明胶的络合并形成了稳定的凝胶网络结构[17]。Gel-GG-Ca2+微胶囊形态在整个溶解过程中基本保持稳定。CAI等[18]的研究中有相似的实验结果,明胶基水凝胶的溶胀比随着结冷胶和Ca2+的加入逐渐降低。以上结果表明,GG和Ca2+的添加可以降低明胶基微胶囊的溶解性和溶胀性。
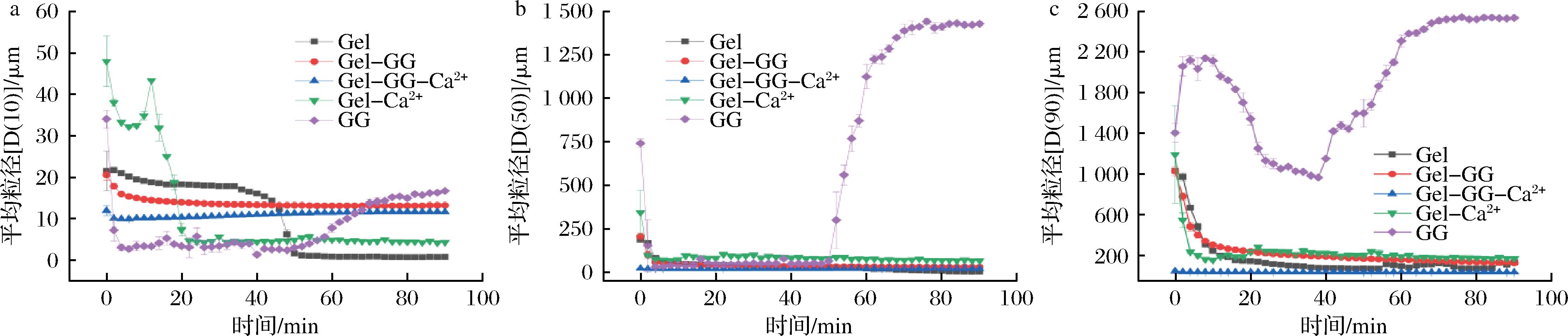
a-D(10);b-D(50);c-D(90)
图3 微胶囊的在水中分散的粒径随混合时间的变化曲线
Fig.3 Particle size of microcapsules dispersed in water as a function of mixing time
2.1.3 傅里叶红外光谱分析
为了确定微胶囊中明胶、结冷胶和Ca2+的相互作用,我们测定了结冷胶为壁材的微胶囊样品(GG)的傅里叶红外光谱图,结果如图4所示,在GG的红外光谱中,3 377 cm-1附近出现的峰值归因于O—H的伸缩振动,2 928 cm-1左右出现的峰值属于—CH2基团的C—H伸缩振动,1 613、1 414和1 045 cm-1处的峰值对应羧基,分别是—COO-的对称伸缩振动、—COO-的不对称伸缩振动和C—O的伸缩振动[19]。Gel样品红外图谱1 652、1 543和1 246 cm-1处的吸收峰分别属于酰胺Ⅰ峰的C![]() O伸缩振动、酰胺Ⅱ峰的N—H弯曲振动和酰胺Ⅲ峰的C—N伸缩振动,1 051 cm-1处的峰为C—O伸缩振动,3 356 cm-1处的宽吸收带归因于O—H和酰胺A峰的N—H伸缩振动和—OH伸缩振动耦合[20-21]。
O伸缩振动、酰胺Ⅱ峰的N—H弯曲振动和酰胺Ⅲ峰的C—N伸缩振动,1 051 cm-1处的峰为C—O伸缩振动,3 356 cm-1处的宽吸收带归因于O—H和酰胺A峰的N—H伸缩振动和—OH伸缩振动耦合[20-21]。

a-Gel;b-Gel-Ca2+;c-GG;d-GG-Ca2+;e-Gel-GG;f-Gel-GG-Ca2+
图4 益生菌微胶囊的傅里叶红外光谱
Fig.4 Fourier infrared spectroscopy of probiotic microcapsules
比较Gel和GG交联前后发现,酰胺A峰向低波数区移动,这可能是因为结冷胶中的—OH/—COO-与明胶的—NH基团形成氢键,伸缩振动频率降低[22]。此外,还观察到酰胺Ⅰ峰和酰胺Ⅱ峰向高波数区移动,这可能是明胶中的—NH3+与结冷胶中的—COO-间的静电相互作用导致的。
对于Gel-Ca2+和GG-Ca2+微胶囊,观察到酰胺A峰向高波数区移动,这可能是因为Ca2+的存在干扰了明胶或结冷胶分子间的氢键。然而Gel-Ca2+酰胺Ⅱ峰和酰胺Ⅲ峰均向高波数区移动并且吸收强度减弱,这表明Ca2+与明胶的酰胺基有键合作用。GG-Ca2+的—COO-对称伸缩振动和反对称伸缩对称振动吸收峰分别向低波数和高波数区移动,C—O伸缩振动吸收峰向低波数移动,这可能归因于Ca2+和GG侧链羧基上的离子键促进了三维网络状结构的形成。
与Gel-GG相比,Gel-GG-Ca2+样品的酰胺A峰、酰胺Ⅱ峰和酰胺Ⅲ峰向高波数区移动,酰胺Ⅰ峰和C—O伸缩振动吸收峰向低波数区移动,且所有吸收峰的吸收强度都有所减弱。Ca2+可能干扰了明胶和结冷胶分子间的氢键、离子键的形成,也可能导致—NH官能团键长增加[23],使酰胺A峰向蓝移。其他酰胺峰和C—O伸缩振动吸收峰的移动表明Ca2+可能和凝胶中酰胺基和羧基有键合作用。以上结果证明了明胶、结冷胶和Ca2+间氢键和离子相互作用,这可能有利于形成更稳定的凝胶网络结构。
2.2 益生菌微胶囊的喷雾干燥存活率
喷雾干燥后不同微胶囊中的益生菌存活率如图5所示,喷雾干燥前,各微胶囊样品的活菌数量无显著性差异,均在10.15 lg CFU/g左右。不同配方的微胶囊在喷雾干燥后益生菌活性有显著性差异。对于Gel样品,益生菌干燥后的存活率为55.33%,而与Ca2+交联后微胶囊中益生菌的存活率下降,这表明Ca2+对植物乳杆菌在喷雾干燥存活方面表现出拮抗特性,LI等[24]研究显示出相似的结果,Ca2+交联的海藻酸钠微胶囊在冷冻干燥后,其中的益生菌活性显著低于未交联的。黄雪[16]采用复合凝聚和喷雾干燥法制备了与Ca2+交联和未交联的益生菌微胶囊,微胶囊中菌活性分别降低2.23和0.7 lg CFU/g。
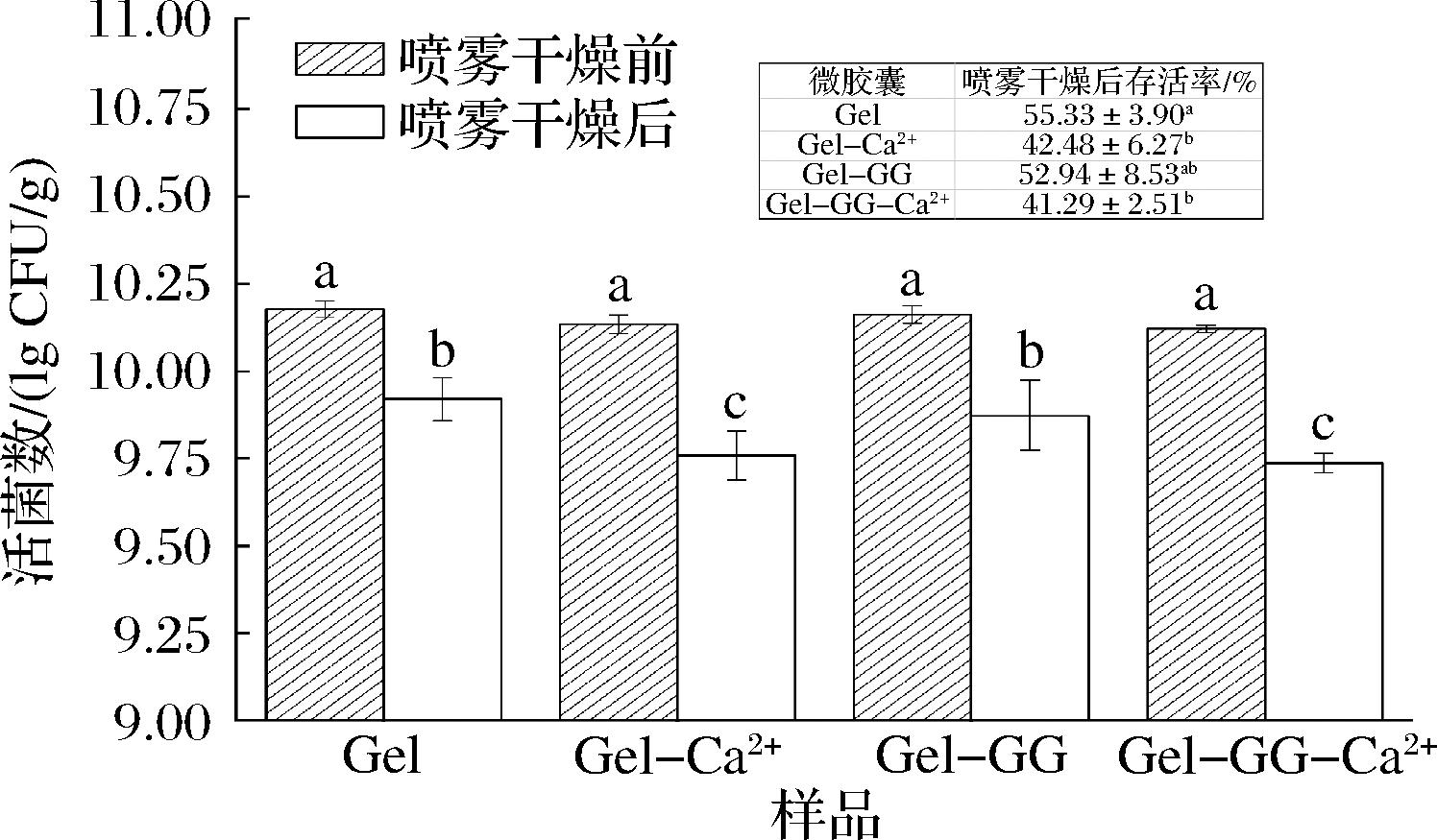
图5 不同微胶囊在喷雾干燥后的活菌数
Fig.5 The average number of viable bacteria in different probiotic microcapsules after spray drying
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 益生菌微胶囊的模拟胃肠液耐受能力
益生菌能否在宿主体内发挥益生作用,取决于益生菌在胃肠道中的存活率。未封装和不同壁材封装的益生菌微胶囊在模拟胃肠消化后的存活率如图6所示,未包封的益生菌在经过模拟胃肠消化后,菌活分别降低约5.0和5.65 lg CFU/g,而封装后的益生菌的菌活有不同程度的显著提高。各个微胶囊对益生菌的保护能力从大到小依次是Gel-GG-Ca2+>Gel-Ca2+>Gel-GG>Gel,在胃消化后菌活分别降低约0.97、1.82、2.90和3.51 lg CFU/g。明胶可以给益生菌提供一个缓冲微环境,提高其对胃酸和胆盐的耐受性。但是Gel微胶囊在消化液中快速崩解导致益生菌直接暴露于消化液中而大量死亡。Gel和GG交联后,微胶囊的消化存活率显著提高,这是因为结冷胶具有良好的凝胶性,降低微胶囊的溶解性、抵抗消化酶的水解,但是其结构较为松散,H+易进入微胶囊中导致菌活降低。Gel-Ca2+微胶囊在胃消化后菌活仅降1.74 lg CFU/g,可能归因于Ga2+促进明胶分子间交联聚集,使微胶囊结构致密,减缓了胃酸的渗透。Gel-GG-Ga2+微胶囊保护效果最好,菌活仅降低0.97 lg CFU/g,这说明Ca2+在与Gel和GG交联方面具有协同作用,进一步提高了微胶囊的致密性,降低了其溶胀性,抑制了胃酸的渗透[25]。

图6 不同益生菌微胶囊在模拟体外消化后的活菌数
Fig.6 The number of viable bacteria in different probiotic macrocapsules after simulated digestion in vitro
2.4 益生菌微胶囊的贮藏稳定性
微胶囊Gel-GG-Ca2+表现良好的模拟胃肠消化稳定性,基于此,本研究进一步考察了该微胶囊中植物乳杆菌在4和25 ℃条件下保存的稳定性,结果如图7所示。Gel-GG-Ca2+微胶囊在4 ℃冷藏保存8周后仍然保留有超过109 CFU/g活菌数。在常温下保存的微胶囊稳定性较差,益生菌活力有明显的下降,贮藏4周和8周后菌活分别减少1.25和1.95 lg CFU/g。益生菌在较低温度下可以维持较高的存活率,这是因为低温下对细胞有害的化学反应速率降低,如脂肪氧化和蛋白质降解等[26]。总的来说,喷雾干燥的Gel-GG-Ca2+在冷藏条件下可以维持至少8周的稳定性。
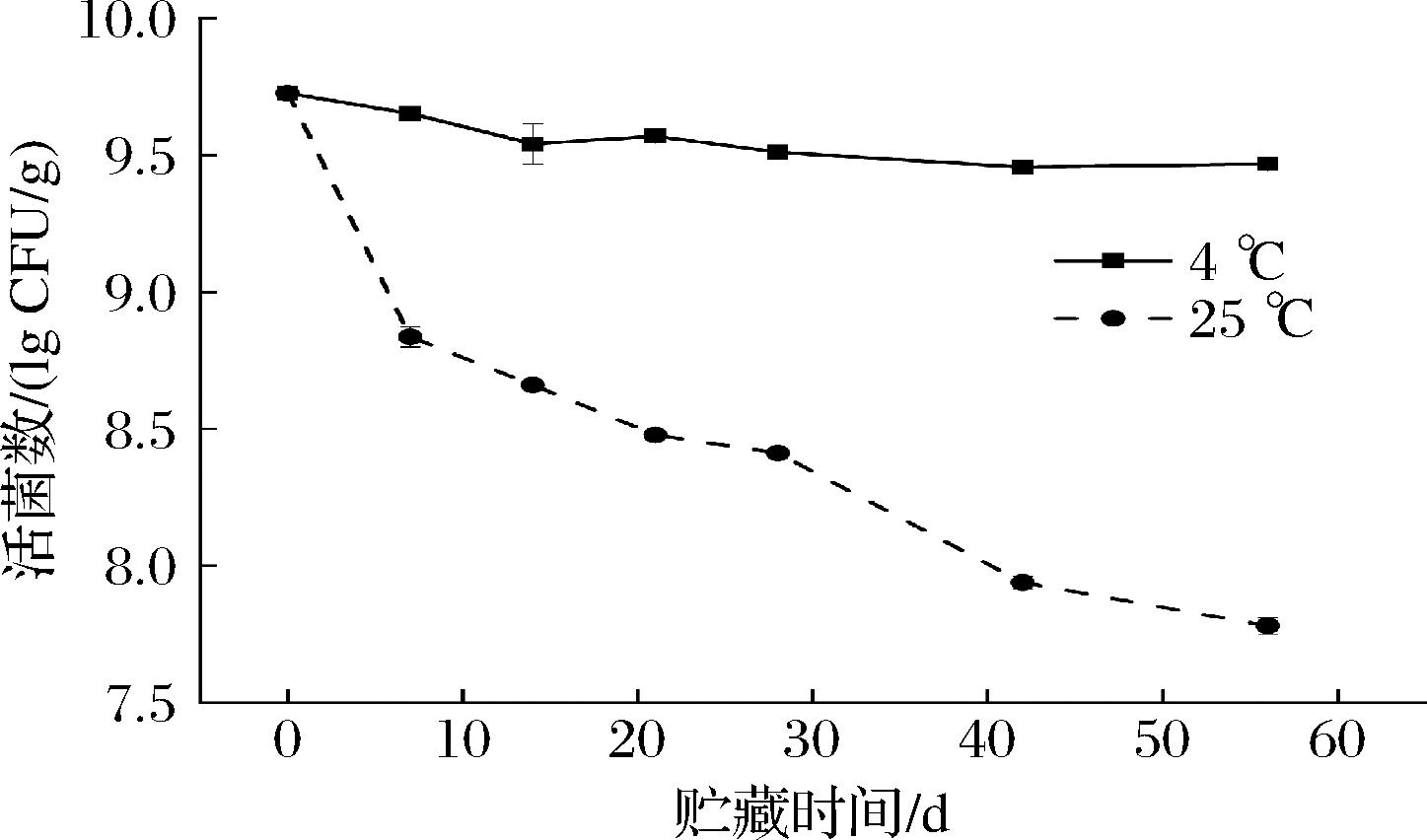
图7 益生菌微胶囊在4 ℃和25 ℃条件下贮藏过程中的活菌数量变化
Fig.7 Changes in the number of viable bacteria in probiotic microcapsules during storage at 4 ℃ and 25 ℃
3 结论
本研究采用了一种新型喷雾干燥技术,以明胶和结冷胶为复合壁材,通过同轴喷涂方式与Ca2+交联,将益生菌封装于微胶囊中。研究结果表明,明胶、结冷胶、Ca2+间通过交联形成更致密的凝胶网络,抑制微胶囊的在水中的溶胀和崩解,可有效维持益生菌在胃肠消化过程中的菌活。其中,Gel-GG-Ca2+微胶囊对益生具有突出的保护效果,在胃液和肠液中先后暴露2 h后,保留了8.74和7.59 lg CFU/g活菌。在4 ℃下贮藏8周后,菌活为9.45 lg CFU/g,体现出了良好的贮藏稳定性。因此,本研究制备的Gel-GG-Ca2+微胶囊在益生菌应用方面具有较大的潜力,而且,同轴三流体喷雾干燥技术还为益生菌的封装和微胶囊的制备提供了一种新的思路。
[1] HILL C, GUARNER F, REID G, et al.The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J].Nature Reviews Gastroenterology &Hepatology, 2014, 11:506-514.
[2] LUO Y, DE SOUZA C, RAMACHANDRAN M, et al.Precise oral delivery systems for probiotics:A review[J].Journal of Controlled Release, 2022, 352:371-384.
[3] TORP A M, BAHL M I, BOISEN A, et al.Optimizing oral delivery of next generation probiotics[J].Trends in Food Science &Technology, 2022, 119:101-109.
[4] HAN S Y, LU Y M, XIE J J, et al.Probiotic gastrointestinal transit and colonization after oral administration:A long journey[J].Frontiers in Cellular and Infection Microbiology, 2021, 11:609722.
[5] YAO M F, XIE J J, DU H J, et al.Progress in microencapsulation of probiotics:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):857-874.
[6] XU Y Y, DONG M S, XIAO H M, et al.Advances in spray-dried probiotic microcapsules for targeted delivery:A review[J].Critical Reviews in Food Science and Nutrition, 2023:1-17.DOI:10.1080/10408398.2023.2235424.
[7] DEHKORDI S S, ALEMZADEH I, VAZIRI A S, et al.Optimization of alginate-whey protein isolate microcapsules for survivability and release behavior of probiotic bacteria[J].Applied Biochemistry and Biotechnology, 2020, 190(1):182-196.
[8] BABOT J D, ARGA ARAZ-MART
ARAZ-MART NEZ E, APELLA M C, et al.Microencapsulation of probiotics with soy protein isolate and alginate for the poultry industry[J].Food and Bioprocess Technology, 2023, 16(7):1478-1487.
NEZ E, APELLA M C, et al.Microencapsulation of probiotics with soy protein isolate and alginate for the poultry industry[J].Food and Bioprocess Technology, 2023, 16(7):1478-1487.
[9] VIMON S, KERTSOMBOON T, CHIRACHANCHAI S, et al.Matrices-charges of agar-alginate crosslinked microcapsules via o/w microemulsion:A non-spore forming probiotic bacteria encapsulation system for extensive viability[J].Carbohydrate Polymers, 2023, 321:121302.
[10] STROBEL S A, SCHER H B, NITIN N, et al.In situ cross-linking of alginate during spray-drying to microencapsulate lipids in powder[J].Food Hydrocolloids, 2016, 58:141-149.
[11] SOMPACH G, RODKLONGTAN A, NITISINPRASERT S, et al.Microencapsulating role of whey protein isolate and sucrose in protecting the cell membrane and enhancing survival of probiotic lactobacilli strains during spray drying, storage, and simulated gastrointestinal passage[J].Food Research International, 2022, 159:111651.
[12] ZHAO M, HUANG X, ZHANG H, et al.Probiotic encapsulation in water-in-water emulsion via heteroprotein complex coacervation of type-a gelatin/sodium caseinate[J].Food Hydrocolloids, 2020, 105:105790.
[13] HU R H, DONG D J, HU J L, et al.Improved viability of probiotics encapsulated in soybean protein isolate matrix microcapsules by coacervation and cross-linking modification[J].Food Hydrocolloids, 2023, 138:108457.
[14] LI L T, MAHOTRA M, CHAN S Y, et al.In situ alginate crosslinking during spray-drying of lactobacilli probiotics promotes gastrointestinal-targeted delivery[J].Carbohydrate Polymers, 2022, 286:119279.
[15] LI H Y, PENG F, LIN J X, et al.Preparation of probiotic microcapsules using gelatin-xylooligosaccharides conjugates by spray drying:Physicochemical properties, survival, digestion resistance and colonization[J].Food Bioscience, 2023, 52:102462.
[16] 黄雪. 微囊化益生菌的胁迫耐受性改善研究[D].武汉:湖北工业大学, 2019.HUANG X.Study on improvement of stress tolerance of microencapsulated probiotics[D].Wuhan:Hubei University of Technology, 2019.
[17] 暴伊芮, 吴燕燕, 赵前程, 等.钙离子添加量对未漂洗海鲈鱼糜凝胶特性的影响[J].渔业现代化, 2021, 48(4):106-112.BAO Y R, WU Y Y, ZHAO Q C, et al.Effect of calcium ion adding on the gel properties of unrinsed minced meat of Lateolabrax japonicas[J].Fishery Modernization, 2021, 48(4):106-112.
[18] CAI W, LU L L, LI X S.An interpenetrating network biohydrogel of gelatin and gellan gum by using a combination of enzymatic and ionic crosslinking approaches[J].Polymer International, 2014, 63(9):1643-1649.
[19] YANG F, XIA S Q, TAN C, et al.Preparation and evaluation of chitosan-calcium-gellan gum beads for controlled release of protein[J].European Food Research and Technology, 2013, 237(4):467-479.
[20] WANG L Y, LI M Y, LI X M, et al.A biomimetic hybrid hydrogel based on the interactions between amino hydroxyapatite and gelatin/gellan gum[J].Macromolecular Materials and Engineering, 2020, 305(9):2000188.
[21] CHEN Y, LI L Z, CHEN L, et al.Gellan gum-gelatin scaffolds with Ca2+ crosslinking for constructing a structured cell cultured meat model[J].Biomaterials, 2023, 299:122176.
[22] SOW L C, PEH Y R, PEKERTI B N, et al.Nanostructural analysis and textural modification of tilapia fish gelatin affected by gellan and calcium chloride addition[J].LWT - Food Science and Technology, 2017, 85:137-145.
[23] SOW L C, KONG K, YANG H S.Structural modification of fish gelatin by the addition of gellan, κ-carrageenan, and salts mimics the critical physicochemical properties of pork gelatin[J].Journal of Food Science, 2018, 83(5):1280-1291.
[24] LI L T, SAMPATHKUMAR K, WONG J H, et al.Divalent cations are antagonistic to survivability of freeze-dried probiotics encapsulated in cross-linked alginate[J].Food and Bioproducts Processing, 2020, 124:369-377.
[25] ZHAO H B, CHEN J, HEMAR Y, et al.Improvement of the rheological and textural properties of calcium sulfate-induced soy protein isolate gels by the incorporation of different polysaccharides[J].Food Chemistry, 2020, 310:125983.
[26] DA SILVA P T, MARTINS FRIES L L, DE MENEZES C R, et al.Microencapsulation of probiotics by spray drying:evaluation of survival in simulated gastrointestinal conditions and availability under different storage temperatures[J].Ciencia Rural, 2015, 45(7):1342-1347.