米糠是稻谷加工的主要副产物,我国每年因加工产生的米糠高达1 000多万t,大多用于动物或渔业饲料,甚至被直接废弃[1]。研究表明,米糠中的多酚、黄酮、膳食纤维等表现出良好的生物活性[2-3]。此外,米糠蛋白含量丰富且来源广泛,是制备生物活性肽的优质来源。与米糠蛋白相比,米糠多肽具有抗氧化[4]、免疫调节[5]、抗肿瘤[6]、降血压[7]等多种生理功效。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)是氧化还原反应所需的重要辅酶之一,广泛存在于人体细胞中。具有DNA修复、促进细胞代谢以及抗氧化等作用[8]。随着年龄的增长,NAD+水平呈现下降趋势,导致与衰老相关疾病的出现。NAD+含量受NAD+合成酶或NAD+降解酶共同调控,靶向NAD+降解途径或提高NAD+水平有助于其参与细胞抗氧化过程。最近研究发现,CD38是一种NAD+降解酶,是导致衰老过程中NAD+下降的主要原因[9]。抑制CD38活性可以恢复NAD+水平,逐渐成为抗衰老研究的热门方向。
目前米糠多肽的提取大多采用单一酶处理,很少利用物理手段进行预处理,从而导致多肽得率较低。在相关的研究报道中,存在采用超声辅助酶解制备米糠多肽的案例[10],但鲜见高压均质辅助酶解工艺的详细研究。高压均质能够破坏蛋白质中大分子聚集体,提高其溶解性与稳定性,从而提高酶解效率。此外,目前针对不同品种米糠多肽的抗氧化活性研究鲜见报道。本文以不同稻米品种来源的米糠为原料,采用高压均质-酶法制备工艺提取多肽,将此条件下得到的抗氧化活性最高的米糠多肽进行分离纯化并鉴定。并且为探究米糠多肽的分子机制,解释米糠多肽的抗氧化机制和研发抗衰老靶向药物提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
籼稻菁两优溢香丝苗、莹香两优268、协和优香66。粳稻天隆优11569、港优1号、天隆优663:产地江苏盱眙(北纬32°43′~33°13′、东经118°11′~118°54′),由天津天隆科技股份有限公司提供。
1.1.2 试剂
碱性蛋白酶(20万 U/g)、铁氰化钾、FeCl3、三氯乙酸,KH2PO4、K2HPO4、NaOH、HCl,95%(体积分数)乙醇,DPPH,ABTS,葡聚糖凝胶(Sephadex G-25),以上试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
GL16-FW-100多功能粉碎机,北京海富达科技有限公司;ATS高压均质机,安拓思纳米技术有限公司;ZWY-2102C恒温培养振荡器,上海智城分析仪器制造有限公司;BY-600C低速离心机,湖南湘仪实验室仪器有限公司;Epoch2酶标仪,美国Thermo公司;ALPHA1-2LD冷冻干燥机,德国Christ公司。
1.3 实验方法
1.3.1 米糠预处理
将新鲜米糠通过粉碎机粉碎,根据PHONGTHAI等[11]的方法对米糠进行脱脂,将脱脂米糠晾干,备用。
1.3.2 高压均质预处理参数的筛选
脱脂米糠粉加入去离子水配成一定料液比的米糠悬浮液,研究均质压力与料液比对米糠悬浮液影响。探究料液比1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL),均质压力(20、40、60、80、100 MPa)对肽含量的影响。
1.3.3 单因素试验
固定时间2 h、pH 10、温度55 ℃,考察加酶量(2 000、2 400、2 800、3 200、3 600 U/g)对肽含量及还原力的影响。
固定加酶量3 200 U/g、时间2 h、温度55 ℃,考察pH值(9、9.5、10、10.5、11)对肽含量及还原力的影响。
固定加酶量3 200 U/g、时间2 h、pH 10,考察温度(40、45、50、55、60 ℃)对肽含量及还原力的影响。
固定加酶量3 200 U/g、pH 10、温度55 ℃,考察时间(0.5、1、1.5、2、2.5 h)对肽含量及还原力的影响。
1.3.4 正交试验
以酶解液的还原力为指标,基于单因素的试验结果,分别选取3个水平,进行L9(34)的正交试验。试验因素及水平见表1。
表1 正交试验因素及水平
Table 1 Factors and levels of orthogonal test

水平A加酶量/(U/g)B温度/℃CpHD时间/h12 800509.51.523 2005510233 6006010.52.5
1.3.5 多肽及蛋白质含量的测定
取适量米糠酶解液,加入等体积的100 g/L三氯乙酸溶液,室温静置20 min,5 000 r/min离心10 min。采用Lowry法[12]测定多肽含量,多肽含量的计算如公式(1)所示:
肽含量/mg/g米糠![]()
(1)
1.3.6 还原力测定
参考XIAO等[13]的方法并加以修改,1 mL的样品加入1 mL的0.2 mol/L的磷酸盐缓冲液和1 mL的10 g/L的铁氰化钾溶液,50 ℃水浴20 min,加入1 mL的100 g/L的三氯乙酸溶液,3 000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL的蒸馏水和0.5 mL的1 g/L的FeCl3溶液,700 nm测定溶液的吸光值。
1.3.7 DPPH自由基清除率测定
参考WANG等[14]的方法,1 mL样品加入1 mL的0.1 mmol/L的DPPH乙醇溶液,避光静置30 min,517 nm处测定吸光值A1。等体积的乙醇溶液代替DPPH作为空白组A2,等体积的蒸馏水代替样品溶液作为对照组A0。其计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
1.3.8 ABTS阳离子自由基清除率测定
参考CARRILLO等[15]的方法。将7 mmol/L的ABTS试剂与等体积的2.45 mmol/L的过硫酸钾溶液混合为ABTS母液,4 ℃避光条件下反应12~16 h,备用。将ABTS母液用去离子水稀释,直到在734 nm处吸光值达到0.7±0.02,即得ABTS工作液。1 mL样品加入3 mL ABTS工作液混匀,避光反应6 min,在734 nm处测定吸光值A1。等体积的蒸馏水代替样品溶液作为空白组A0,其计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
1.3.9 羟自由基(·OH)清除率测定
参考XU等[16]的方法,1 mL的样品加入0.5 mL的10 mmol/L的水杨酸溶液、0.5 mL的10 mmol/L的FeSO4溶液和0.5 mL的8.8 mmol/L的H2O2溶液,在510 nm处测吸光值A1。蒸馏水代替水杨酸溶液在溶液作为空白组A2,等体积的蒸馏水代替样品溶液作为对照组A0。其计算如公式(4)所示:
·OH清除率![]()
(4)
1.3.10 超滤分离
使用截留相对分子质量为3、10 kDa的超滤管对米糠蛋白酶解液进行超滤,得到UF1(Mw<3 kDa)、UF2(3 kDa<Mw<10 kDa)和UF3(Mw>10 kDa)3个不同的组分。测定各组分的抗氧化活性。
1.3.11 凝胶色谱分离
参考FENG等[17]的方法稍作修改,对超滤后抗氧化活性最高的组分用超纯水配制成80 mg/mL的溶液,经0.22 um的水膜过滤后,利用Sephadex G-25凝胶色谱柱进行分离。参数设置如下:上样量1.5 mL,洗脱液为超纯水,流速0.5 mL/min,检测波长280 nm,按峰收集洗脱液。冷冻干燥后测定抗氧化活性,选取活性最高的组分用于后续分析。
1.3.12 LC-MS/MS鉴定
委托科学指南针平台完成纯化肽的结构鉴定。质谱采用Q Exactive质谱仪(Thermo Fisher)进行质谱分析,分析时长:60 min。检测方式:正离子。质谱测试原始文件用软件MaxQuant 1.5.5.1检索相应的数据库,最后得到蛋白质鉴定及定量分析结果。
利用PeptideRanker对质谱鉴定的肽段进行生物活性评分,评分>0.5时,结果具有可靠性。
1.3.13 分子对接
通过检索PDB蛋白数据库(www.rcsb.org/)获取CD38(PDB ID:3DZK)的蛋白晶体结构,使用Discovery Studio软件对受体蛋白处理。多肽的3D结构由Chem Draw 7.0构建。根据结合能大小对结果进行排序和可视化分析。
1.3.14 数据处理
数据均采用Excel 2016和SPSS 25.0统计软件进行处理,实验结果重复3次,数据结果以平均值±标准差表示,使用Origin 2019软件作图。
2 结果与分析
2.1 高压均质单因素试验
由图1-a可知,均质压力在20~60 MPa时,米糠肽含量随压力的升高不断增加,压力为60 MPa时,含量达到最高,与未均质的米糠悬浮液相比,米糠肽的含量提升了2.5倍左右。随着压力继续升高,由于蛋白受到压力过大,蛋白质暴露的亲疏水基团的平衡被打破,导致蛋白质沉淀,溶肽含量降低[18];由图1-b可知,随着料液比的增大,肽含量呈下降趋势,当料液比为1∶10(g∶mL)时,肽含量虽增加,但由于溶液浓度较大,均质过程中会引起机器堵塞,造成机器损伤。因此选择均质压力为60 MPa,料液比为1∶15(g∶mL)。
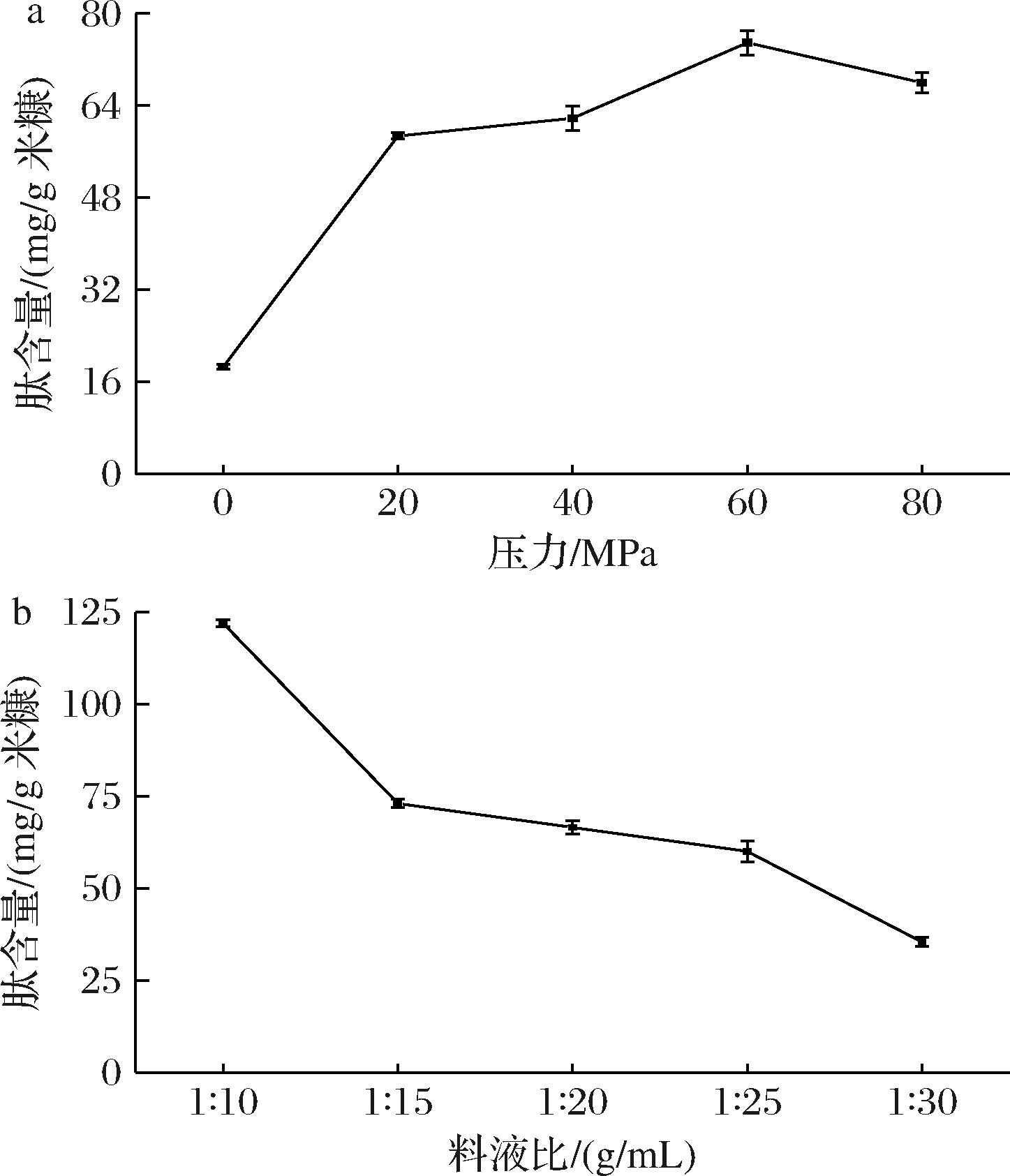
a-压强;b-料液比
图1 不同均质条件对肽含量的影响
Fig.1 Effects of different homogenization conditions on peptide content
2.2 酶解单因素试验结果
如图2-a所示,加酶量为2 000~3 200 U/g时,肽含量与还原力逐渐增加,加酶量为3 200 U/g时,肽含量以及抗氧化活性最高,大于3 200 U/g时,出现下降趋势。可能是因为体系中加酶量过高,导致酶与酶之间产生竞争,导致肽的生成量减少,抗氧化活性降低[19]。此外,酶本身作为一种蛋白质,结构复杂,当加酶量过高时,酶分子之间作用更加频繁,可能导致酶发生降解,酶解效率下降[20]。因此确定最佳加酶量为3 200 U/g。

a-加酶量;b-pH;c-温度;d-时间
图2 不同提取条件对肽含量和还原力的影响
Fig.2 Effects of different extraction conditions on peptide content and reducing power
如图2-b所示,随着pH的升高,肽含量以及还原力呈上升趋势,pH=10时,肽含量以及还原力最高,pH>10时,两者均会下降。原因可能是,由于酶的催化作用需要一定的pH,超出这个范围,酶的空间结构受到干扰,从而降低酶活力[21],所以确定最佳反应pH值为10。
如图2-c所示,随着温度的升高,肽含量以及还原力不断升高,55 ℃时达到最高,随后下降。这是由于当温度过高时,酶的天然构象受到破坏,酶的活性受到抑制甚至失去活性,抑制了多肽的生成[22]。因此确定最佳反应温度为55 ℃。
如图2-d所示,随着时间的增加,肽含量以及还原力不断升高,酶解时间为2 h时,达到最高,继续增加酶解时间,肽含量以及还原力出现下降。可能由于酶解时间过长,蛋白质发生聚集沉淀,导致提取率降低[23]。因此选择最佳酶解时间为2 h。
2.3 正交试验结果
由表2可知,因素主次顺序为:B>C>D>A,即影响米糠多肽还原力的因素主次顺序为:酶解温度>pH>酶解时间>加酶量,最佳酶解条件是A2B2C2D2,即加酶量3 200 U/g,酶解温度为55 ℃、pH 10、酶解时间2 h。在此条件下进行3次平行试验,还原力可达0.762。根据最佳工艺提取不同品种米糠多肽,米糠肽含量分别是:莹香两优268为46.82 mg/g米糠、协和优香66为59.86 mg/g米糠、菁两优溢香丝苗为62.84 mg/g米糠、天隆优663为73.71 mg/g米糠、港优一号为73.97 mg/g米糠、天隆优11569为89.95 mg/g米糠。
表2 正交试验分析结果
Table 2 Results of orthogonal test
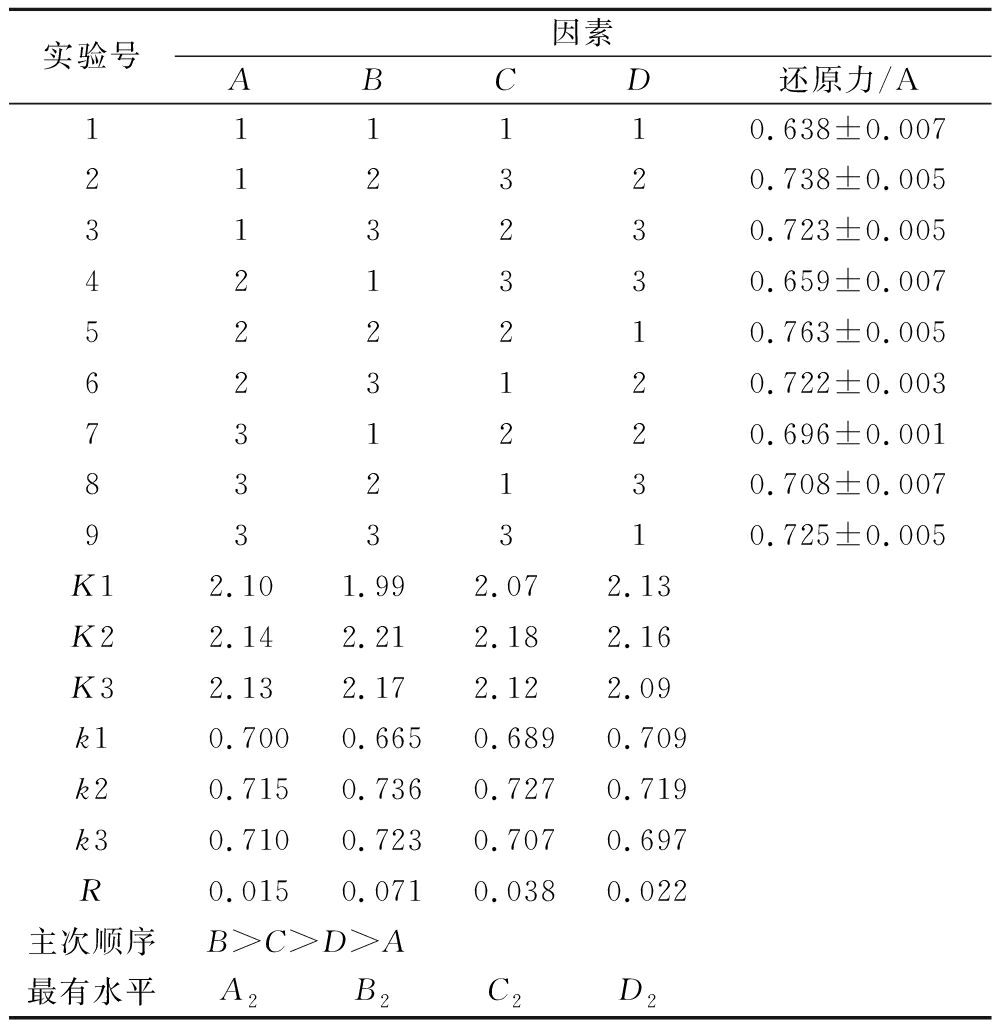
实验号因素ABCD还原力/A111110.638±0.007212320.738±0.005313230.723±0.005421330.659±0.007522210.763±0.005623120.722±0.003731220.696±0.001832130.708±0.007933310.725±0.005K12.101.992.072.13K22.142.212.182.16K32.132.172.122.09k10.7000.6650.6890.709k20.7150.7360.7270.719k30.7100.7230.7070.697R0.0150.0710.0380.022主次顺序B>C>D>A最有水平A2B2C2D2
2.4 不同来源的米糠多肽的抗氧化活性比较
如表3所示,粳稻中港优一号抗氧化活性高于粳稻其他品种;籼稻中菁两优溢香丝苗的抗氧化活性高于籼稻其他品种。菁两优溢香丝苗DPPH自由基、ABTS阳离子自由基清除率显著高于港优一号(P<0.05),·OH与还原力无显著性差异(P>0.05)。此外,在所有品种的抗氧化活性比较中,与天隆优663相比,菁两优溢香丝苗的DPPH自由基、ABTS阳离子自由基、·OH清除率分别提高了71.78%、11.94%、23.77%;还原力提高了6.06%。因此,菁两优溢香丝苗显示出良好的抗氧化性能,可能具有潜在的抗衰老作用,进而开展后续实验进行功能表征。
表3 不同品种多肽抗氧化活性对比
Table 3 Comparison of antioxidant activity of peptides from different varieties
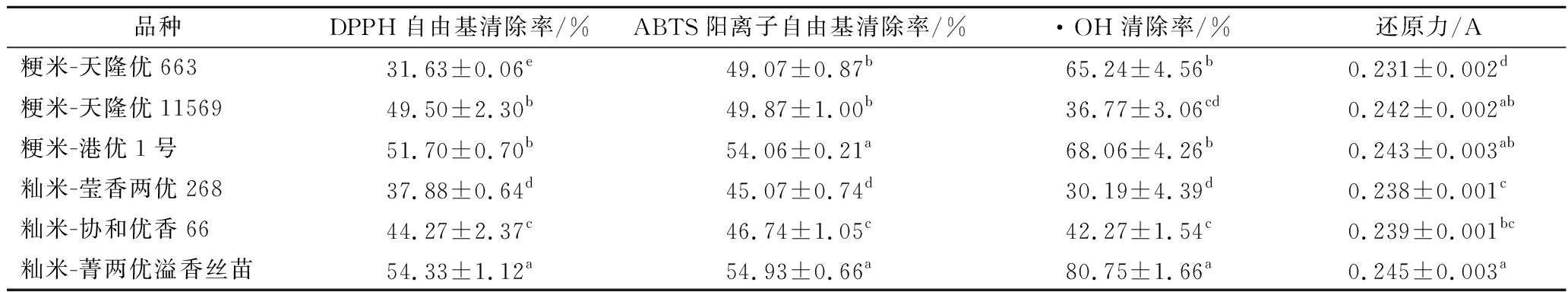
品种DPPH自由基清除率/%ABTS阳离子自由基清除率/%·OH清除率/%还原力/A粳米-天隆优66331.63±0.06e49.07±0.87b65.24±4.56b0.231±0.002d粳米-天隆优1156949.50±2.30b49.87±1.00b36.77±3.06cd0.242±0.002ab粳米-港优1号51.70±0.70b54.06±0.21a68.06±4.26b0.243±0.003ab籼米-莹香两优26837.88±0.64d45.07±0.74d30.19±4.39d0.238±0.001c籼米-协和优香6644.27±2.37c46.74±1.05c42.27±1.54c0.239±0.001bc籼米-菁两优溢香丝苗54.33±1.12a54.93±0.66a80.75±1.66a0.245±0.003a
注:同一列的不同上标字母表示显著差异(P<0.05)。
2.5 分离纯化
由图3可知,超滤分离后得到UF1(Mw<3 kDa)、UF2(3 kDa<Mw<10 kDa)和UF3(Mw>10 kDa)3个组分,UF1组分的抗氧化活性最好,显著高于其他组分(P<0.05),其DPPH自由基清除率为76.6%,还原力为0.06。研究表明,分子质量小的多肽抗氧化活性更高,可能是由于分子质量小的多肽具有较小的空间位阻,可以作为更好的电子供体,与自由基发生反应,将其转化为更稳定的产物[24]。UF1组分经Sephadex G-25分离后,得到2个组分F1、F2(图4),收集测定各组分的抗氧化活性。由图5可知,F2组分的抗氧化活性显著高于F1组分(P<0.05)。因此选取F2组分进行下一步分析。
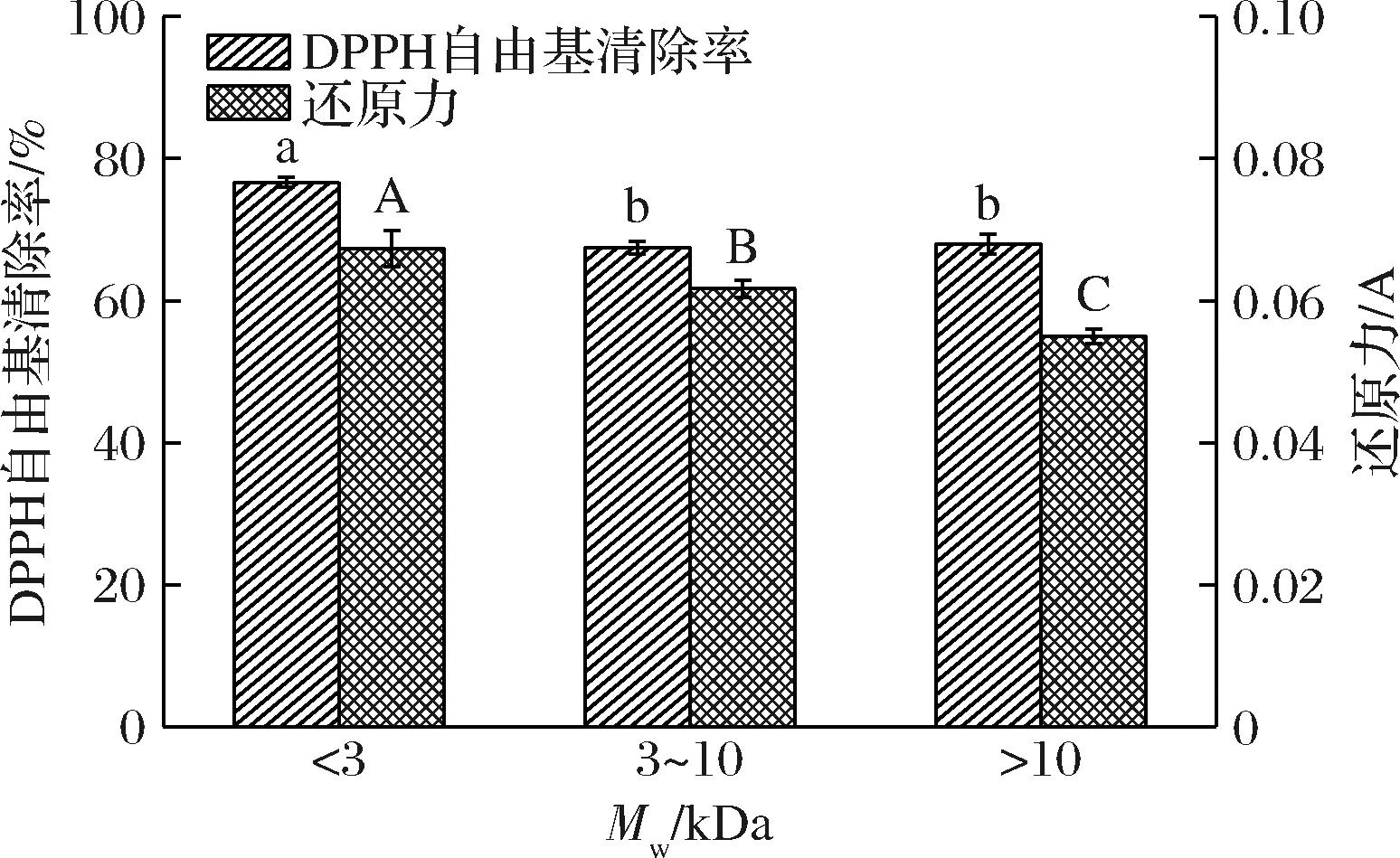
图3 不同超滤组分的抗氧化活性
Fig.3 Antioxidant activity of different ultrafiltration components
注:不同小写字母表示差异显著(P<0.05)(下同)。
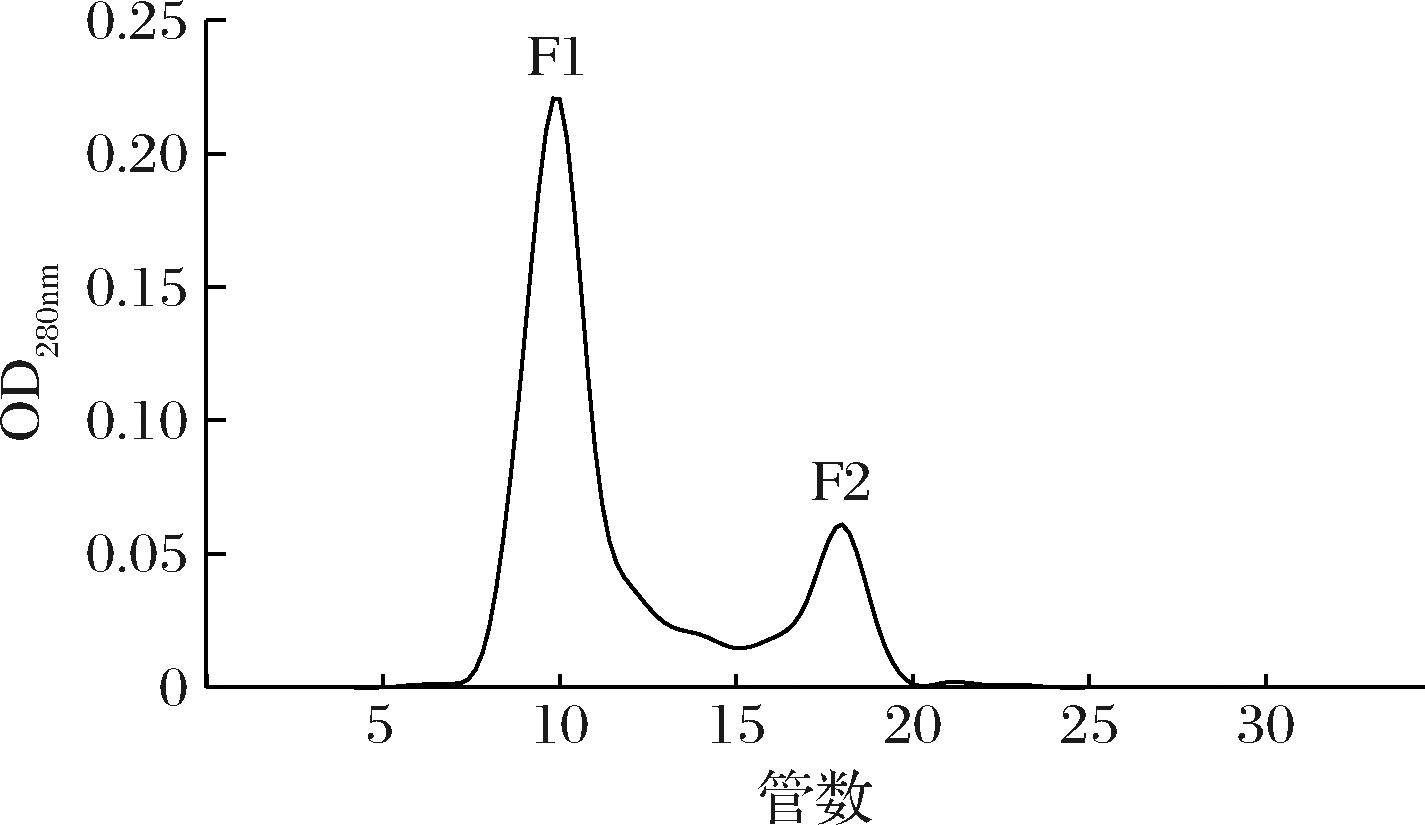
图4 Sephadex G-25凝胶过滤层析洗脱曲线
Fig.4 Elution profile of hydrolysate separated with gel filtration on Sephadex G-25
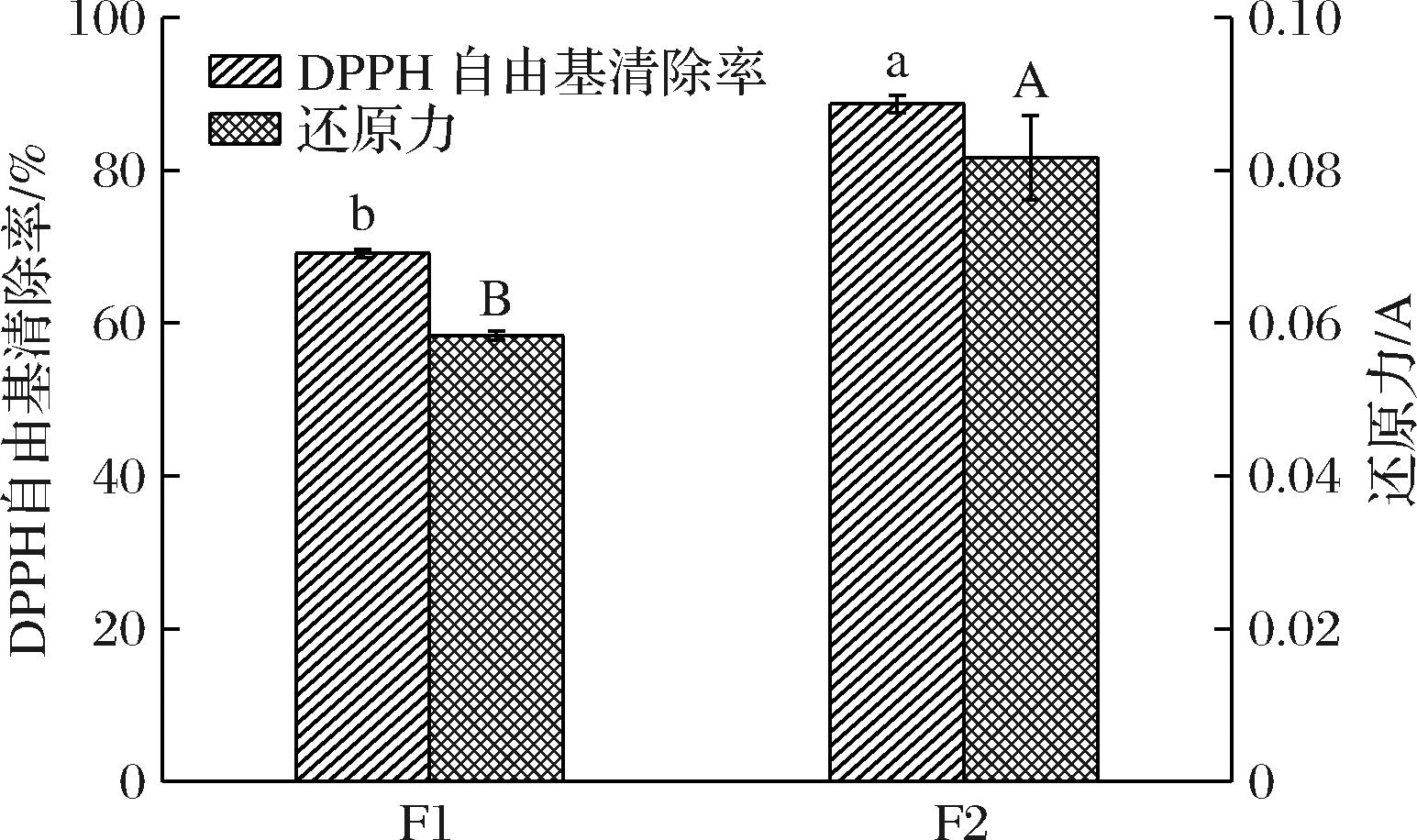
图5 Sephadex G-25凝胶过滤层析各组分的抗氧化活性
Fig.5 Antioxidant activities of components in Sephadex G-25 gel filtration chromatography
2.6 多肽的结构鉴定及虚拟筛选
通过LC-MS/MS共鉴定出979条多肽序列。检测到的肽段分子质量在399~2 517 Da,根据PeptideRanker活性评分结果,筛选出60条多肽序列。将得到的配体与CD38蛋白进行分子对接,按照对接结果的-CDOCKER_ENERGY数值进行排序,对接结合能如表4所示。
表4 米糠多肽序列鉴定结果
Table 4 Sequence identification of rice bran peptides
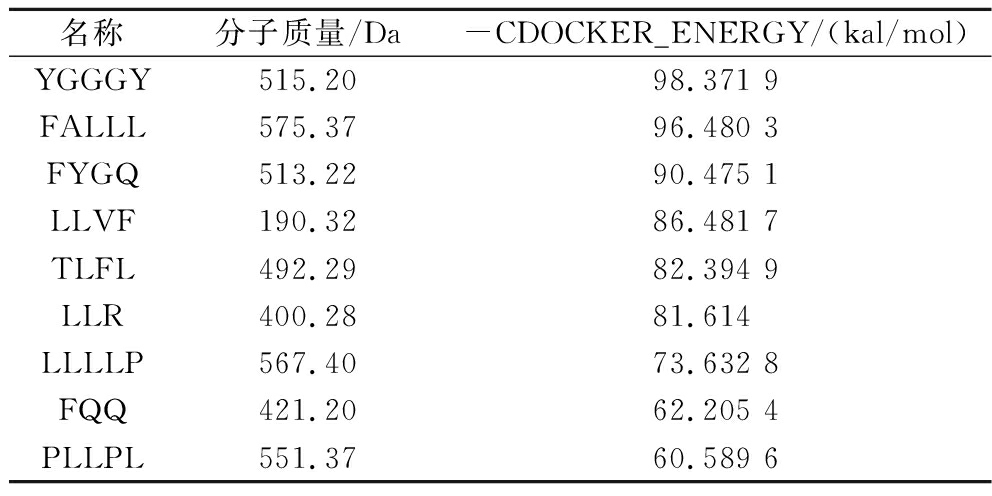
名称分子质量/Da-CDOCKER_ENERGY/(kal/mol)YGGGY515.2098.371 9FALLL575.3796.480 3FYGQ513.2290.475 1LLVF190.3286.481 7TLFL492.2982.394 9LLR400.2881.614LLLLP567.4073.632 8FQQ421.2062.205 4PLLPL551.3760.589 6
2.7 分子对接
分子对接用于表明多肽与CD38的确切结合位点。对结合能最高的YGGGY进行可视化分析,如图6所示。
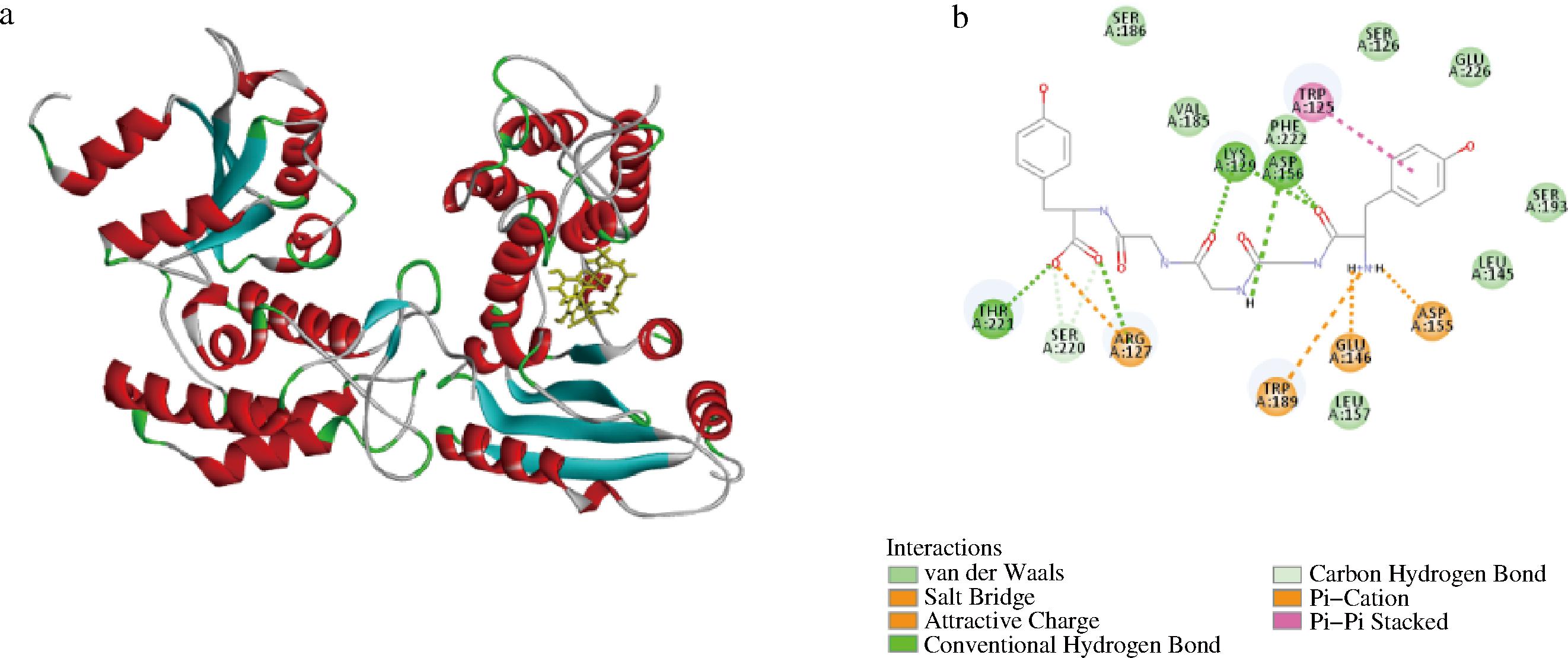
a-三维图;b-二维图
图6 多肽YGGGY与CD38分子对接图
Fig.6 Molecular docking diagram of peptide YGGGY and CD38 protein
YGGGY与CD38的关键氨基酸残基Thr221、Lys129、Asp156形成氢键作用,与Trp125形成π-π相互作用,与氨基酸残基Trp189、Glu146、Arg127、Asp155形成盐桥相互作用,还与CD38的一些残基形成范德华相互作用,包括Leu157、Leu145、Val185等。多肽YGGGY含有芳香环,芳香环能与·OH发生反应,增强抗氧化功效[25]。多肽YGGGY的N端为酪氨酸,研究发现Tyr位于肽的N端比C端抗氧化能力更好,这与GIRGIH等[26]研究结果相仿。综上所述,目标肽在CD38蛋白的活性位点与CD38蛋白形成较强的氢键网络,抑制了NAD+降解酶的活性,从而发挥了抗氧化作用。
3 结论
采用均质-酶法提取米糠多肽,通过单因素与正交试验确定了最佳提取条件。将提取的的多肽进行抗氧化活性测定发现,不同品种之间抗氧化活性差异较大,其中籼米中菁两优溢香丝苗多肽的抗氧化活性最好。分子对接结果发现,多肽YGGGY与CD38蛋白结合良好,暗示多肽可能通过抑制NAD+降解酶的活性来促进抗氧化。由于分子对接是一种虚拟筛选的方法,后续可通过果蝇、线虫等生物进行体内实验进一步验证多肽的抗氧化能力,从而深入研究抗衰老机制。
[1] GONG X X, AN Q, LE L Q, et al.Prospects of cereal protein-derived bioactive peptides:Sources, bioactivities diversity, and production[J].Critical Reviews in Food Science and Nutrition, 2022, 62(11):2855-2871.
[2] WANG Z M, HAO J, DENG Y Y, et al.Viscoelastic properties, antioxidant activities and structure of wheat gluten modified by rice bran[J].LWT, 2021, 150:112003.
[3] YAO W Z, GONG Y F, LI L H, et al.The effects of dietary fibers from rice bran and wheat bran on gut microbiota:An overview[J].Food Chemistry:X, 2022, 13:100252.
[4] FATHI P, MOOSAVI-NASAB M, MIRZAPOUR-KOUHDASHT A, et al.Generation of hydrolysates from rice bran proteins using a combined ultrasonication-Alcalase hydrolysis treatment[J].Food Bioscience, 2021, 42:101110.
[5] ALI R, SHIH F F, RIAZ M N.Bioactive Proteins and Peptides as Functional Foods and Nutraceuticals[M].Blackwell Publishing Ltd.and Institute of Food Technologists, 2010:233-246.
[6] YU Y H, GAINE G K, ZHOU L Y, et al.The classical and potential novel healthy functions of rice bran protein and its hydrolysates[J].Critical Reviews in Food Science and Nutrition, 2022, 62(30):8454-8466.
[7] WANG X M, CHEN H X, FU X G, et al.A novel antioxidant and ACE inhibitory peptide from rice bran protein:Biochemical characterization and molecular docking study[J].LWT, 2017, 75:93-99.
[8] CAMPAGNA R, VIGNINI A.NAD+ homeostasis and NAD+-consuming enzymes:Implications for vascular health[J].Antioxidants, 2023, 12(2):376.
[9] CHINI C C S, PECLAT T R, WARNER G M, et al.CD38 ecto-enzyme in immune cells is induced during aging and regulates NAD+ and NMN levels[J].Nature Metabolism, 2020, 2(11):1284-1304.
[10] WANG T, CHEN X, WANG W N, et al.Effect of ultrasound on the properties of rice bran protein and its chlorogenic acid complex[J].Ultrasonics Sonochemistry, 2021, 79:105758.
[11] PHONGTHAI S, LIM S T, RAWDKUEN S.Ultrasonic-assisted extraction of rice bran protein using response surface methodology[J].Journal of Food Biochemistry, 2017, 41(2):e12314.
[12] WATERBORG J H.The Lowry Method for Protein Quantitation[M].The Protein Protocols Handbook, New Jersey:Humana Press, 2003:7-10.
[13] XIAO F, XU T, LU B Y, et al.Guidelines for antioxidant assays for food components[J].Food Frontiers, 2020, 1(1):60-69.
[14] WANG L Y, MA M T, YU Z P, et al.Preparation and identification of antioxidant peptides from cottonseed proteins[J].Food Chemistry, 2021, 352:129399.
[15] CARRILLO C, WILCHES-PÉREZ D, HALLMANN E, et al.Organic versus conventional beetroot.Bioactive compounds and antioxidant properties[J].LWT, 2019, 116:108552.
[16] XU Y Q, NIU X J, LIU N Y, et al.Characterization, antioxidant and hypoglycemic activities of degraded polysaccharides from blackcurrant (Ribes nigrum L.) fruits[J].Food Chemistry, 2018, 243:26-35.
[17] FENG Y X, WANG Z C, CHEN J X, et al.Separation, identification, and molecular docking of tyrosinase inhibitory peptides from the hydrolysates of defatted walnut (Juglans regia L.) meal[J].Food Chemistry, 2021, 353:129471.
[18] TAN M N, XU J J, GAO H L, et al.Effects of combined high hydrostatic pressure and pH-shifting pretreatment on the structure and emulsifying properties of soy protein isolates[J].Journal of Food Engineering, 2021, 306:110622.
[19] ZHANG Y F, TSITKOV S, HESS H.Complex dynamics in a two-enzyme reaction network with substrate competition[J].Nature Catalysis, 2018, 1:276-281.
[20] COLGRAVE M L, CRAIK D J.Thermal, chemical, and enzymatic stability of the cyclotide kalata B1:The importance of the cyclic cystine knot[J].Biochemistry, 2004, 43(20):5965-5975.
[21] NOMAN A, XU Y S, AL-BUKHAITI W Q, et al.Influence of enzymatic hydrolysis conditions on the degree of hydrolysis and functional properties of protein hydrolysate obtained from Chinese sturgeon (Acipenser sinensis) by using papain enzyme[J].Process Biochemistry, 2018, 67:19-28.
[22] CHAVAN S, GAIKWAD A.Optimization of enzymatic hydrolysis of bamboo biomass for enhanced saccharification of cellulose through Taguchi orthogonal design[J].Journal of Environmental Chemical Engineering, 2021, 9(1):104807.
[23] ZHANG Y D, JING X, CHEN Z J, et al.Purification and identification of antioxidant peptides from millet gliadin treated with high hydrostatic pressure[J].LWT, 2022, 164:113654.
[24] LI P, XU F R, ZHOU H, et al.Evolution of antioxidant peptides and their proteomic homology during processing of Jinhua ham[J].LWT, 2022, 166:113771.
[25] ZOU T B, HE T P, LI H B, et al.The structure-activity relationship of the antioxidant peptides from natural proteins[J].Molecules, 2016, 21(1):72.
[26] GIRGIH A T, HE R, MALOMO S, et al.Structural and functional characterization of hemp seed (Cannabis sativa L.) protein-derived antioxidant and antihypertensive peptides[J].Journal of Functional Foods, 2014, 6:384-394.