6-α-葡萄糖基转移酶(6-α-glucosyltransferase,6-α-GT)属于糖苷水解酶31家族,具有催化α-1,4-葡聚糖非还原端的外切水解和转糖基化功能,可通过转糖基反应产生非还原端连有单个或数个α-1,6键的α-葡聚糖。自2002年在B.globisporus C11[1]中发现第一个6-α-GT,随后从2003—2005年,在B.globisporus N75[2]、Bacillus sp.NRRL B-21195[3]和Arthrobacter globiformis A19[4]中接连报道3个6-α-GT。已报道的4个来源不同的6-α-GT均能作用于淀粉或麦芽糊精,在糖链非还原端通过转苷作用连接一个α-1,6键产生异麦芽基-α-1,4-葡聚糖,再与3-α-异麦芽糖基转移酶协同作用生产环交替糖及其分支衍生物,其中的α-1,6和α-1,3键赋予了产物抗消化酶水解作用的特性,可作为新型功能寡糖[1-5]。最后在2017年再次发现了一个新型6-α-GT,该6-α-GT来源于Paenibacillus sp.598K [6],且能通过连续转苷作用连接2~5个α-1,6键产生异麦芽寡糖基-α-1,4-葡聚糖,并进一步与环异麦芽寡糖葡聚糖转移酶共同作用生成环右旋糖酐。6-α-GT在食品、医药等领域具有广泛的应用价值[6-7]。目前报道的6-α-GT种类较少,且由野生菌发酵[1,3-4,8]或在Escherichia coli[2,6]中重组表达获得,但是由于6-α-GT在野生菌株中的产量较低,发酵液酶活力最高仅达0.272 U/mL[4];而E.coli易产生内毒素,不属于食品安全级菌株。因此,上述2种方式得到的6-α-GT难以满足食品工业生产和应用的需求。
枯草芽孢杆菌(Bacillus subtilis)具有遗传背景清晰、易于基因操作、高效率、高表达、无致病性、无外毒素和内毒素等优势,被美国食品和药物管理局认定为是食品安全级菌株(generally recognized as safe,GRAS),目前已被广泛应用于工业酶制剂和药用蛋白等的高效重组生产[9],但外源蛋白的表达量受表达元件[10]与发酵条件等因素的影响[11]。目前,已有通过构建底盘细胞[10]、优化发酵条件来提高外源蛋白在B.subtilis中的重组表达的相关研究,比如通过敲除胞外蛋白酶来减少重组蛋白在B.subtilis中的降解,过表达胞内伴侣蛋白来抑制多肽链的非正常聚集、降低多肽链的错误折叠量等[9]。
本实验室前期在B.subtilis 168菌株的基础上通过敲除蛋白酶基因、共表达伴侣蛋白等手段构建了一系列可用于提高外源蛋白重组表达量的底盘细胞,并采用了优化培养基配方和发酵条件等方式进一步提高了普鲁兰酶[12-13]、α-淀粉酶[14]的表达量和活力。为了扩大6-α-GT在食品领域的应用,本研究对来源于B.globisporus N75的6-α-GT在B.subtilis中进行了重组表达,并依次通过筛选宿主、优化发酵温度和化学分子伴侣的种类及浓度、发酵时间进一步提高了6-α-GT的表达量。
1 材料与方法
1.1 材料与试剂
重组菌株E.coli BL21(DE3)/pET-20b(+)-6-α-gt、E.coli BL21(DE3)/pET-24a(+)-lbmp,克隆宿主B.subtilis SCK6,分别缺失了6、6、8个胞外蛋白酶基因的表达宿主B.subtilis WS9(ΔaprE、ΔnprB、Δbpr、Δepr、Δmpr、ΔnprE)、WHS9(ΔaprE、ΔnprB、Δbpr、Δepr、Δmpr、ΔnprE、ΔhrcA,HrcA是Dnak和GroE系列的胞内伴侣蛋白的负调控因子)和WS11(ΔaprE、ΔnprB、Δbpr、Δepr、Δmpr、ΔnprE、Δvpr、ΔwprA)为实验室前期工作构建保藏。
酵母粉、蛋白胨为英国Oxoid品牌,上海维塔化学试剂有限公司;卡那霉素,生工生物工程(上海)有限公司;质粒小提试剂盒,天根生化科技有限公司;蛋白胶配制试剂盒,南京诺唯赞生物科技股份有限公司;标准分子质量蛋白Marker、标准DNA Marker,宝生物工程(大连)有限公司;葡萄糖测定试剂盒(葡萄糖氧化酶法),荣盛生物科技有限公司;其他常规试剂,国药集团化学试剂有限公司。
LB液体培养基(g/L):5酵母粉,10蛋白胨,10 NaCl。
LB固体培养基:在LB液体培养基中加入质量分数为1.5%~2%的琼脂粉。
TB培养基(g/L):酵母粉24,蛋白胨12,K2HPO4·3H2O 16.4,KH2PO4 2.3,甘油5。
1.2 仪器与设备
PCR仪、Mini Protein 3蛋白胶电泳仪,美国Bio-Rad公司;DYY-6C型核酸电泳仪,北京六一电泳仪厂;台式离心机,德国Eppendorf公司;空气摇床、恒温培养箱,上海知楚仪器有限公司;紫外可见分光光度计,上海美谱达仪器有限公司;分析天平、pH 计,瑞士梅特勒托利多有限公司;恒温水浴锅,上海森信仪器有限公司。
1.3 实验方法
1.3.1 6-α-GT重组菌株的构建
使用在LB中过夜培养的菌液E.coli BL21(DE3)/pET-20b(+)-6-α-gt提取质粒pET-20b(+)-6-α-gt,并以其和质粒pUB110-PamyQ′-SP-amyq为模板,设计引物,将6-α-gt基因连接在载体pUB110-PamyQ′-SP上,引物序列如表1所示。
表1 构建重组质粒pUB110-PamyQ′-SP-6-α-gt引物序列
Table 1 The constructional primer sequences of recombinant plasmid pUB110-PamyQ′-SP-6-α-gt
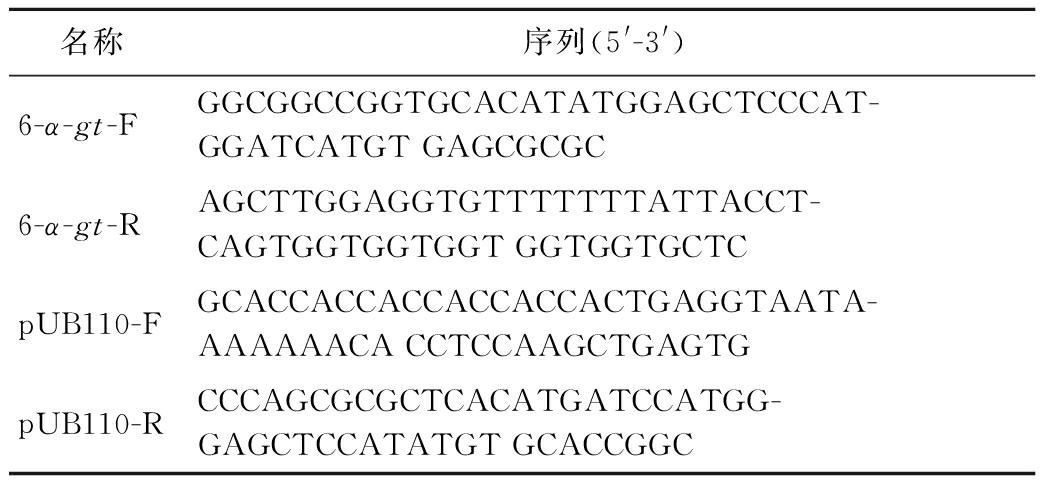
名称序列(5'-3')6-α-gt-FGGCGGCCGGTGCACATATGGAGCTCCCAT-GGATCATGT GAGCGCGC6-α-gt-RAGCTTGGAGGTGTTTTTTTATTACCT-CAGTGGTGGTGGT GGTGGTGCTCpUB110-FGCACCACCACCACCACCACTGAGGTAATA-AAAAAACA CCTCCAAGCTGAGTGpUB110-RCCCAGCGCGCTCACATGATCCATGG-GAGCTCCATATGT GCACCGGC
以6-α-gt-F、6-α-gt-R为上下游引物,扩增目的基因6-α-gt;以pUB110-F、pUB110-R为上下游引物,扩增线性化载体pUB110-PamyQ′-SP。将基因和载体分别胶回收后,采用POE-PCR法[15]进行连接,连接产物转化SCK6,涂布于含有卡那霉素(30 μg/mL)抗性的固体平板上,在37 ℃培养箱中培养10~12 h,挑选单克隆至LB中培养10~12 h后保菌提质粒,并将质粒进行酶切验证和测序验证,验证正确的即为重组质粒pUB110-PamyQ′-SP-6-α-gt。
将重组质粒pUB110-PamyQ′-SP-6-α-gt电转至WS9、WHS9和WS11感受态细胞中[14],涂布于含有卡那霉素(30 μg/mL)抗性的固体平板上,37 ℃恒温培养10~12 h,挑选转化子至LB中培养10~12 h后用质量分数为50%的甘油保藏菌株后提取质粒,并将质粒进行酶切验证,验证正确的即为重组菌株WS9/WHS9/WS11-pUB110-PamyQ′-SP-6-α-gt,分别命名为WS9/PG、WHS9/PG和WS11/PG,再将验证正确的菌株保存在-80 ℃冰箱中。此外,将载体片段胶回收后,构建不含6-α-gt的空载体pUB110-PamyQ′-SP,空载菌株分别命名为WS9/P、WHS9/P和WS11/P。
1.3.2 重组菌株的摇瓶发酵及重组6-α-GT的制备
从-80 ℃冰箱中取出重组菌株甘油管,按体积分数为0.2%的接种量接种至含有卡那霉素(30 μg/mL)抗性的LB中,在37 ℃、200 r/min摇床中培养10~12 h后,再以体积分数为5%的接种量转接至含有卡那霉素(30 μg/mL)抗性的TB中,在37 ℃、200 r/min摇床中培养2 h后,改为33 ℃、200 r/min发酵48 h。发酵结束后将菌液稀释一定倍数,测定其在600 nm处的吸光值,计算OD600值,并取5OD样品,以12 000 r/min离心2 min后,分离发酵上清液和5OD菌体。在5OD菌体中加入1 mL 50 mmol/L、pH 6.0的CH3COOH-CH3COONa缓冲液,吹吸重悬后加入40 μL溶菌酶,混匀后设定135 W,破碎周期7 min,破碎3 s,间隔2 s的程序进行超声破壁,结束后以12 000 r/min离心2 min后,分离破壁上清液和破壁沉淀,其中,发酵上清液和破壁上清液即为6-α-GT粗酶液。
1.3.3 6-α-GT活力测定
6-α-GT活力测定方法如前所述[2],用50 mmol/L、pH 6.0的CH3COOH-CH3COONa缓冲液配制20 g/L的麦芽三糖溶液为底物,取200 μL底物于50 ℃恒温水浴锅中孵育10 min,随后加入200 μL适当稀释的6-α-GT酶液/缓冲液,反应1 h后水浴煮沸10 min,再加入0.8 mL pH 7.0的Na2HPO4-柠檬酸缓冲液,于40 ℃恒温水浴锅中孵育10 min,加入0.3 U麦芽糖磷酸化酶,反应1 h后再次水浴煮沸10 min。结束后12 000 r/min离心10 min后,用葡萄糖氧化酶试剂盒测定上清液中葡萄糖含量。1个单位的6-α-GT活力被定义为每分钟释放1 μmol麦芽糖所需的酶量。
1.3.4 SDS-PAGE凝胶电泳分析
取待分析的上清液样品20 μL加入蛋白缓冲液5 μL,沉淀样品加入蛋白缓冲液20 μL,吹吸混匀后,沸水浴10 min。配制12.5%的SDS-PAGE胶,在pH 8.3的Tris-HCl缓冲液以及120 V的电压下进行蛋白电泳。电泳结束后,用0.1%考马斯亮蓝G250染色液煮沸染色1次,然后将蛋白胶用清水洗净,浸没于脱色液中脱色,当脱色液颜色较深后更换,多次更换脱色液直至蛋白胶上条带清晰,观察并拍照。
1.3.5 6-α-GT重组菌株的发酵条件优化
发酵温度优化:除发酵温度分别改为20、22、25、28、30、33 ℃外,将重组菌株WS9/PG、WHS9/PG和WS11/PG按1.3.2节所示方法进行摇瓶发酵获取酶液后进行酶活力测定和SDS-PAGE分析。
化学分子伴侣种类优化:在TB培养基中分别加入20 mmol/L的海藻糖、β-环糊精、甜菜碱、硫代甜菜碱、甘氨酸、脯氨酸,0.5 mmol/L Ca2+、Mg2+和0.1 mmol/L Ni2+后,将重组菌株按1.3.2节所示方法在适当温度中进行摇瓶发酵获取酶液后进行酶活力测定和SDS-PAGE分析。
化学分子伴侣浓度优化:在TB培养基中分别加入0、5、10、15、20、25、30、35 mmol/L的最佳化学分子伴侣后,将重组菌株按1.3.2节所示方法在适当温度中进行摇瓶发酵获取酶液后进行酶活力测定和SDS-PAGE分析。
发酵时间优化:在TB培养基中加入最佳浓度的化学分子伴侣后,将重组菌株按1.3.2节所示方法在适当温度中摇瓶发酵12、24、36、48、60、72 h后取样获取酶液后进行酶活力测定和SDS-PAGE分析。
1.3.6 启动子种类优化
含有不同启动子的6-α-GT重组菌株的构建:以质粒pUB110-PamyQ′-SP-6-α-gt为模板,使用引物V1-F/V1-R~V5-F/V5-R扩增线性化载体pUB110-SP-6-α-gt;以B.subtilis WS9菌液为模板,使用引物P1-F/P1-R~P5-F/P5-R(表2)分别扩增启动子PahpF、P43、PtufA、PspovG和PnprE,将载体和启动子分别胶回收后,采用POE-PCR法[15]进行连接,连接产物转化SCK6。然后挑选单克隆提质粒测序,正确的即为分别含有启动子PahpF、P43、PtufA、PspovG和PnprE的重组质粒PG1-至PG5。将PG1-至PG5电转至表达宿主后,挑选单克隆提取质粒酶切验证,验证正确的即为分别由启动子PahpF、P43、PtufA、PspovG和PnprE介导的重组菌株WHS9/PG1至WHS9/PG5。
表2 构建重组质粒PG1-PG5引物序列
Table 2 The constructional primer sequences of recombinant plasmid PG1-PG5

名称序列(方向为5'-3')V1-FTACATTTTTAGGAGGAATATACATTATGAGAAAAAAGATTACGTTAGCATGCV1-RAAACTGACCGTGTTTTTAATACAGGGATCCAGGAGAACAAAAACGATTTTGV2-FAAGCGCGCGATTATGTAAAATATAAATGAGAAAAAAGATTACGTTAGCATGCV2-RACGCCCATTTCTAAAAATGTAAAATGATCCAGGAGAACAAAAACGATTTTGV3-FAAAAGCTCTTAAGGAGGATTTTAGAATGAGAAAAAAGATTACGTTAGCATGCV3-RTACTTGAGTTAAGCGGCAAAATCAAGATCCAGGAGAACAAAAACGATTTTGV4-FTATAGGGAAAAGGTGGTGAACTACTATGAGAAAAAAGATTACGTTAGCATGCV4-RGCATGTTTTGTGTGGACTGCTTTTGGATCCAGGAGAACAAAAACGATTTTGV5-FGTATTTTCAAAAAGGGGGATTTATTATGAGAAAAAAGATTACGTTAGCATGCV5-RCAGCGCACAATGTTCTTGGCGGGTGGATCCAGGAGAACAAAAACGATTTTGP1-FAAAATCGTTTTTGTTCTCCTGGATCCCTGTATTAAAAACACGGTCAGTTTCP1-RATGCTAACGTAATCTTTTTTCTCATAATGTATATTCCTCCTAAAAATGTATTAGAAAGCP2-FAAAATCGTTTTTGTTCTCCTGGATCATTTTACATTTTTAGAAATGGGCGTGP2-RATGCTAACGTAATCTTTTTTCTCATTTATATTTTACATAATCGCGCGCTTTTTTTCP3-FAAAATCGTTTTTGTTCTCCTGGATCTTGATTTTGCCGCTTAACTCAAGTATAACP3-RATGCTAACGTAATCTTTTTTCTCATTCTAAAATCCTCCTTAAGAGCTTTTAATTAGTAATGP4-FAAAATCGTTTTTGTTCTCCTGGATCCAAAAGCAGTCCACACAAAACATGCP4-RATGCTAACGTAATCTTTTTTCTCATAGTAGTTCACCACCTTTTCCCTATATAAAAGCP5-FAAAATCGTTTTTGTTCTCCTGGATCCACCCGCCAAGAACATTGTGP5-RATGCTAACGTAATCTTTTTTCTCATAATAAATCCCCCTTTTTGAAAATACTGAAAAC
含有不同启动子的重组菌株按1.3.2节所示方法在适当温度中摇瓶发酵适当时间后取样获取酶液后进行酶活力测定和SDS-PAGE分析。
2 结果与分析
2.1 6-α-GT在不同B.subtilis宿主菌中的重组表达
按1.3.1节所示方法获得重组菌株WS9/PG、WHS9/PG与WS11/PG和空载菌株WS9/P、WHS9/P与WS11/P。并将6个菌株在33 ℃下摇瓶发酵48 h后,测定OD600值和胞内外6-α-GT的活力。结果表明,发酵温度为33 ℃时,WS9/PG、WHS9/PG与WS11/PG胞内外6-α-GT总活力均较低,分别为0.018、0.016、0.010 U/mL;其中WS9/PG胞外6-α-GT活力略高于WHS9/PG和WS11/PG,为0.007 4 U/mL;WHS9/PG的胞内活性最高,为0.013 U/mL;而空载菌株WS9/P、WHS9/P与WS11/P胞内外均未检测到6-α-GT活力(图1)。对3种重组菌株胞内外蛋白样品及破壁沉淀进行SDS-PAGE分析,结果如图2所示,WS9/PG、WHS9/PG与WS11/PG的发酵上清液和破壁上清液中均未明显观察到与6-α-GT分子质量大小对应(134.38 kDa)的蛋白条带,这与3个菌株胞内外6-α-GT总活力较小结果一致,但在破壁沉淀中均有相应分子质量大小的蛋白条带,表明破壁沉淀中含有未能正确折叠的6-α-GT包涵体。因此,6-α-GT均能在WS9、WHS9和WS11中重组表达,但33 ℃发酵不利于重组菌株将多肽链正确折叠成可溶性6-α-GT,大部分多肽链形成包涵体,可溶性表达较少,导致6-α-GT活力较低。
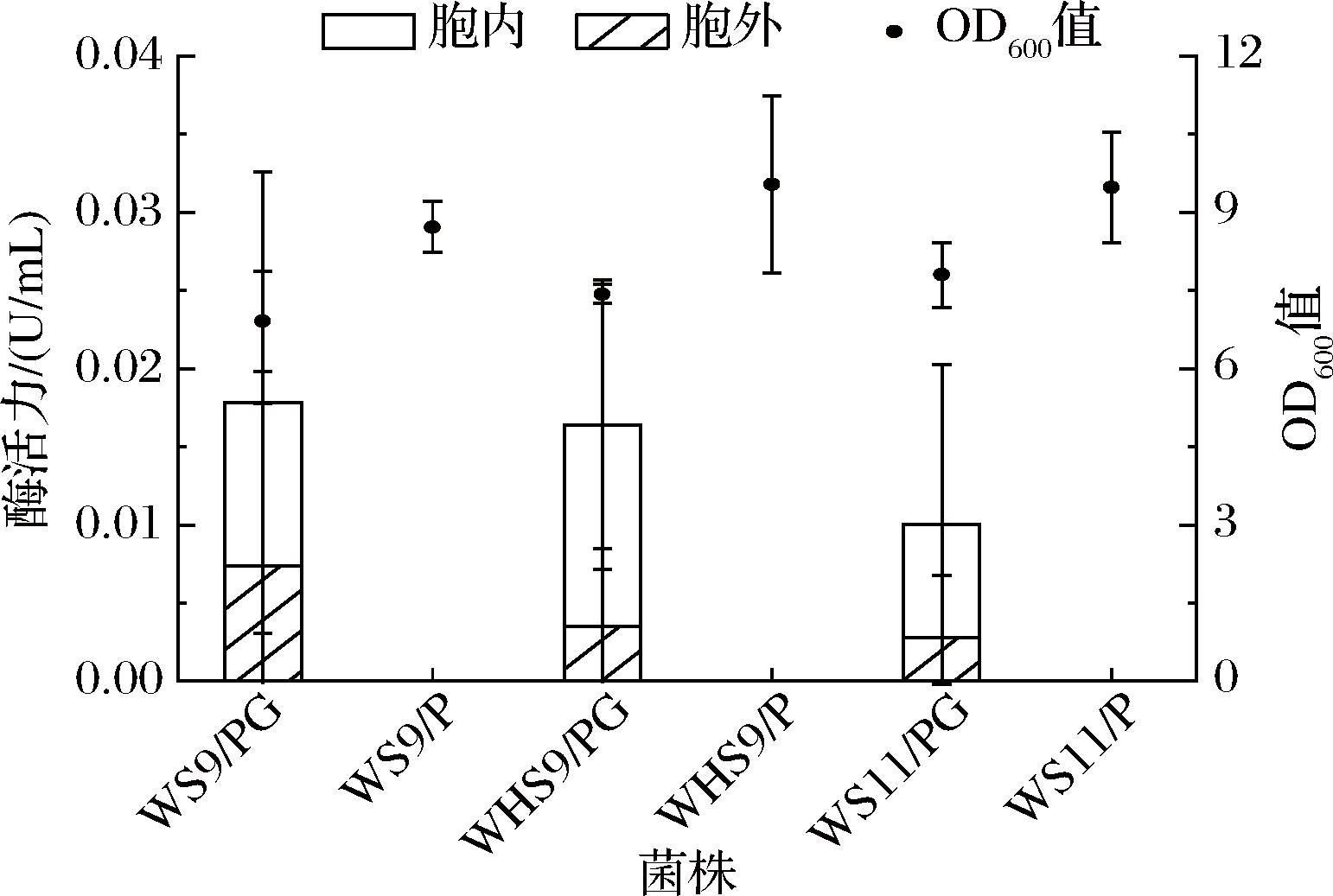
图1 不同B.subtilis宿主菌对6-α-GT表达的影响
Fig.1 Effects of different B.subtilis host strains on 6-α-GT expression
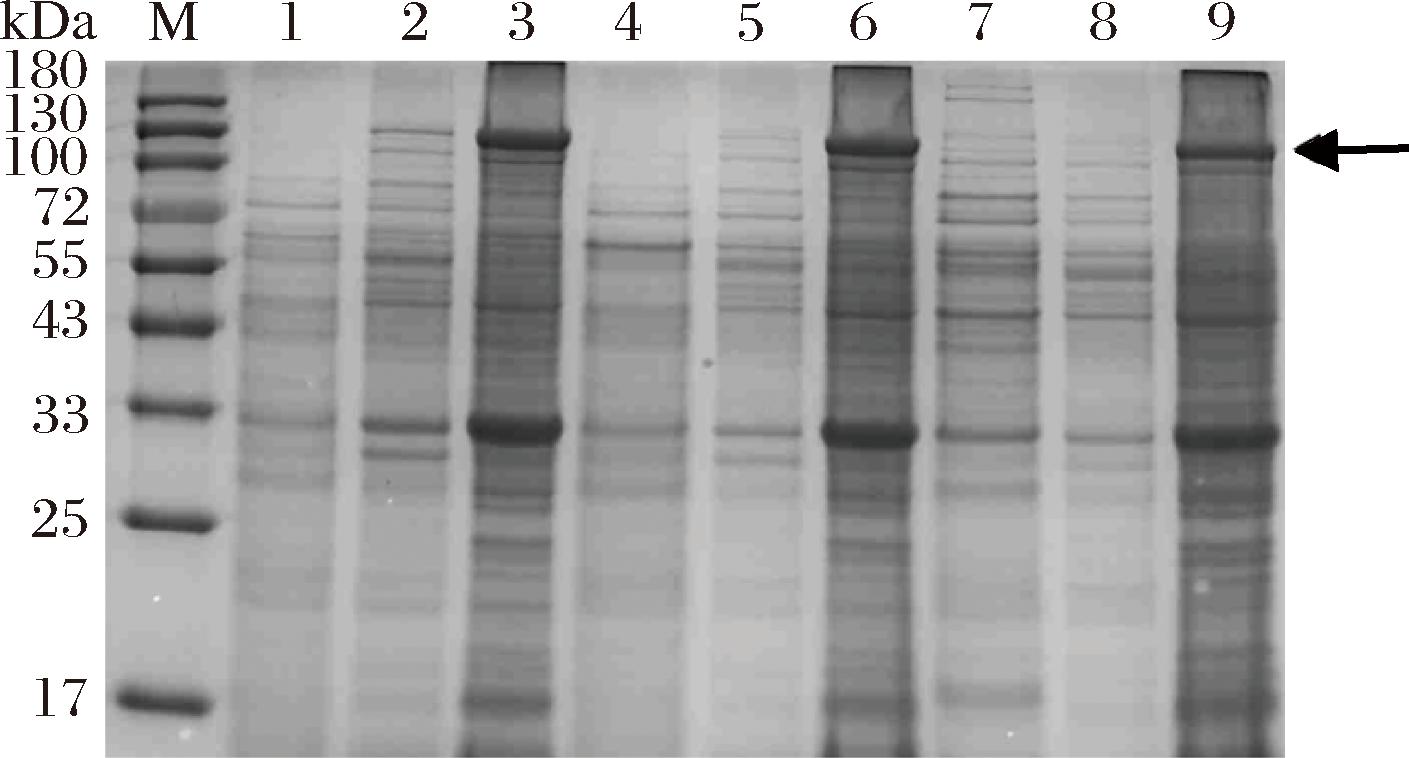
图2 不同重组菌株的SDS-PAGE分析
Fig.2 SDS-PAGE electrophoresis analysis of different recombinant strains
注:M-蛋白Marker;1、2、3-WS9/PG的发酵上清液、破壁上清液和 破壁沉淀;4、5、6-WHS9/PG的发酵上清液、破壁上清液和破壁沉淀;7、8、9-WS11/PG的发酵上清液、破壁上清液和破壁沉淀;6-α-GT理论分子质量为134.38 kDa;箭头指向目标蛋白的条带。
2.2 不同6-α-GT重组菌株的发酵温度优化
当mRNA翻译速率大于多肽链折叠速率或者多肽链错误折叠时,折叠中间体易通过疏水相互作用力等聚集形成包涵体[16]。研究表明适度低温培养会降低DNA的转录和mRNA的翻译速率,且对微生物细胞的能量代谢、蛋白质折叠和分泌、蛋白质降解和聚集有良好作用[17]。
为了获得6-α-GT可溶性功能蛋白和更有利于6-α-GT重组表达的菌株,本研究将重组菌株WS9/PG、WHS9/PG与WS11/PG分别在20、22、25、28、30、33 ℃下进行摇瓶发酵,结果如图3所示,3个重组菌株的6-α-GT胞外活力均低于胞内活力,且胞内活力随发酵温度的升高而降低,而OD600值也随发酵温度的升高而降低。其中,在20 ℃发酵48 h时,菌株WS9/PG、WHS9/PG与WS11/PG的OD600值分别为14.22、14.74和13.56,生长情况并未有显著差异;但是WHS9/PG与WS11/PG的胞内活力分别为1.98、1.80 U/mL,分别是WS9/PG(0.45 U/mL)的4.40、4.00倍;此外,WHS9/PG在不同温度下的6-α-GT总活力均略高于WS11/PG。因此,通过选择宿主菌种和优化发酵温度,6-α-GT较佳的重组表达宿主为WHS9,当发酵温度为20 ℃时,可溶性总酶活力可提高至2.11 U/mL,其中,胞外活力为0.13 U/mL,胞内活力为1.98 U/mL。
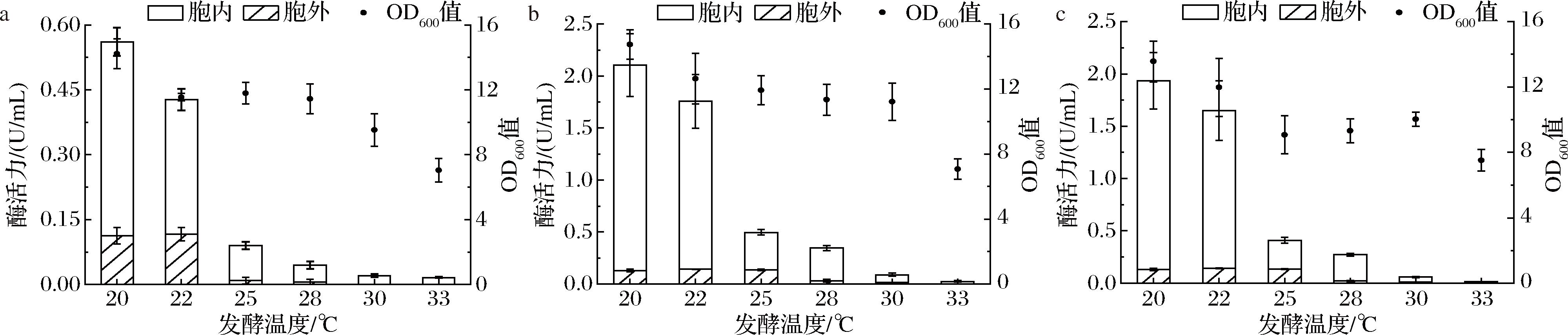
a-WS9/PG;b-WHS9/PG;c-WS11/PG
图3 不同发酵温度对6-α-GT表达的影响
Fig.3 Effects of different fermentation temperatures on 6-α-GT expression
对WHS9/PG在不同温度下的发酵样品进行SDS-PAGE分析,结果表明(图4),所有温度条件下的菌体破壁沉淀中均存在6-α-GT包涵体;在20~25 ℃之间,随着温度升高,蛋白合成增加,包涵体增多,可溶表达降低;在28~33 ℃,随着温度升高,蛋白合成降低,包涵体减少,可溶表达减少。说明25~28 ℃有利于蛋白合成。在20~33 ℃时,随着温度升高,6-α-GT胞内、外可溶性总酶活力逐渐降低,表明低温更有利于6-α-GT多肽链的正确折叠,但是考虑到成本和方案可实施性,后续研究选用25 ℃为研究条件。
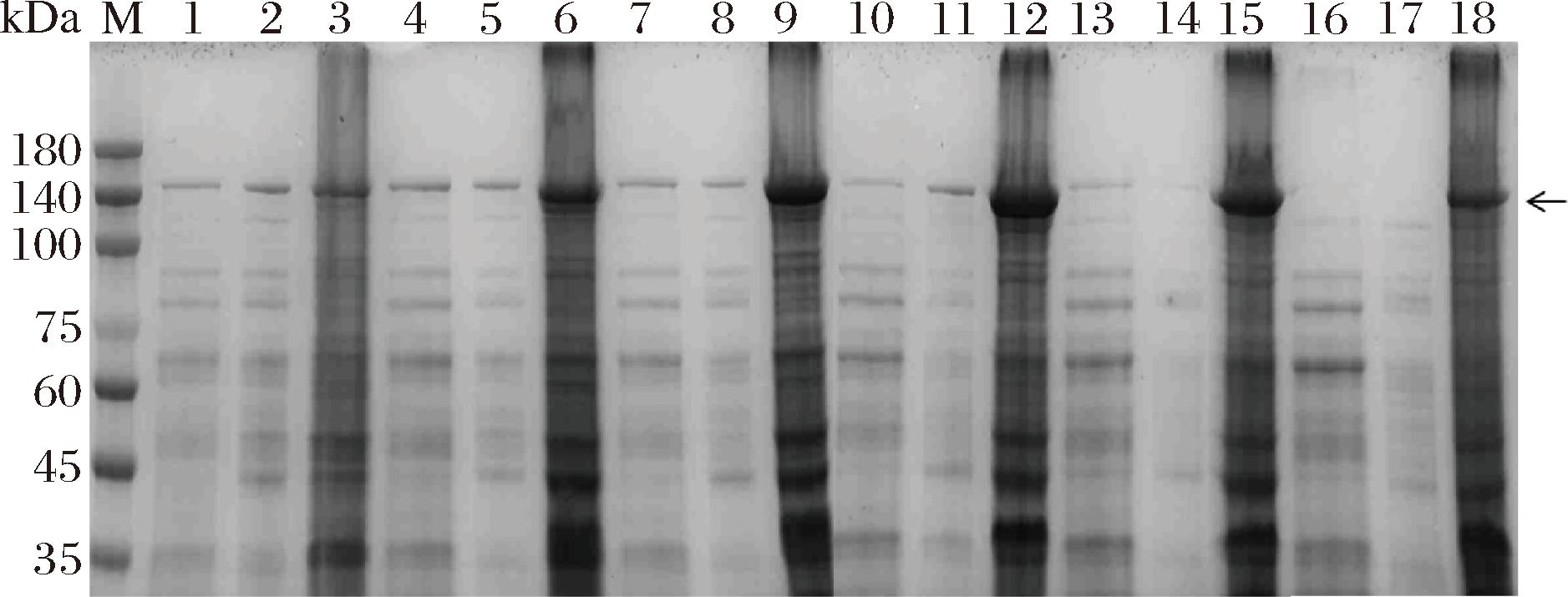
图4 WHS9/PG在不同发酵温度下的SDS-PAGE电泳图
Fig.4 SDS-PAGE electrophoresis analysis of WHS9/PG under different fermentation temperatures
注:M-蛋白Marker;1、2、3-20 ℃的发酵上清液、破壁上清液和破壁沉淀;4、5、6-22 ℃的发酵上清液、破壁上清液和破壁沉淀;7、8、9-25 ℃的发酵上清液、破壁上清液和破壁沉淀;10、11、12-28 ℃的发酵上清液、破壁上清液和破壁沉淀;13、14、15-30 ℃的发酵上清液、破壁上清液和破壁沉淀;16、17、18-33 ℃的发酵上清液、破壁上清液和破壁沉淀;6-α-GT理论分子质量为134.38 kDa;箭头指向目标蛋白的条带。
B.subtilis是冷适应型菌株[18],重组宿主对环境胁迫的适应机制通常会导致外源蛋白产量的增加,Norma等在B.subtilis中采用20 ℃发酵条件表达β-半乳糖苷酶时,酶活力相比于33 ℃发酵时显著提高,证明了B.subtilis可在低温下过表达外源基因[19]。胞内伴侣蛋白可维持胞内蛋白前体处于非完全折叠的可跨膜转运状态,防止其在细胞质中非正常聚集;过表达胞内伴侣蛋白可有效减少目的蛋白包涵体的产生[14]。目前,由dnaK和groE操纵子编码的Dnak系列和GroE系列的胞内伴侣蛋白复合物是芽孢杆菌中研究最多的胞内伴侣蛋白,而HrcA因子负调控dnaK和groE操纵子,敲除hrcA基因可同时实现Dnak系列和GroE系列的胞内伴侣蛋白的过表达[20]。姚动邦等[14]通过敲除hrcA证明了α-淀粉酶前体未折叠的可转运状态的维持有利于提高α-淀粉酶胞外表达量。相比于菌株WS9/PG,WHS9/PG过表达了Dnak系列和GroE系列的胞内伴侣蛋白,更好地将6-α-GT蛋白前体维持在非完全折叠的可跨膜转运状态,抑制了多肽链的非正常聚集,减少了包涵体的产生,进而提高了胞内活性。
2.3 启动子种类对6-α-GT重组表达的影响
为了进一步提高6-α-GT的重组表达产量,选取启动子PahpF、P43、PtufA、PspovG和PnprE替换原启动子PamyQ′,分别获得不同启动子介导的重组菌株WHS9/PG1至WHS9/PG5。在25 ℃摇瓶发酵48 h后测定OD600值和胞内外6-α-GT活力,结果如图5所示。重组菌株WHS9/PG至WHS9/PG5的6-α-GT胞内外可溶性总酶活力分别为0.50、0.017、0、0.013、0.15、0.013 U/mL。对不同启动子介导下的重组菌株进行SDS-PAGE分析,结果表明,WHS9/PG1至WHS9/PG5胞内外均不能显著观察到6-α-GT的可溶性条带(图6)。因此,相比于原启动子PamyQ′,替换后的PahpF、P43、PtufA、PspovG和PnprE均不能进一步提高6-α-GT的可溶性表达。
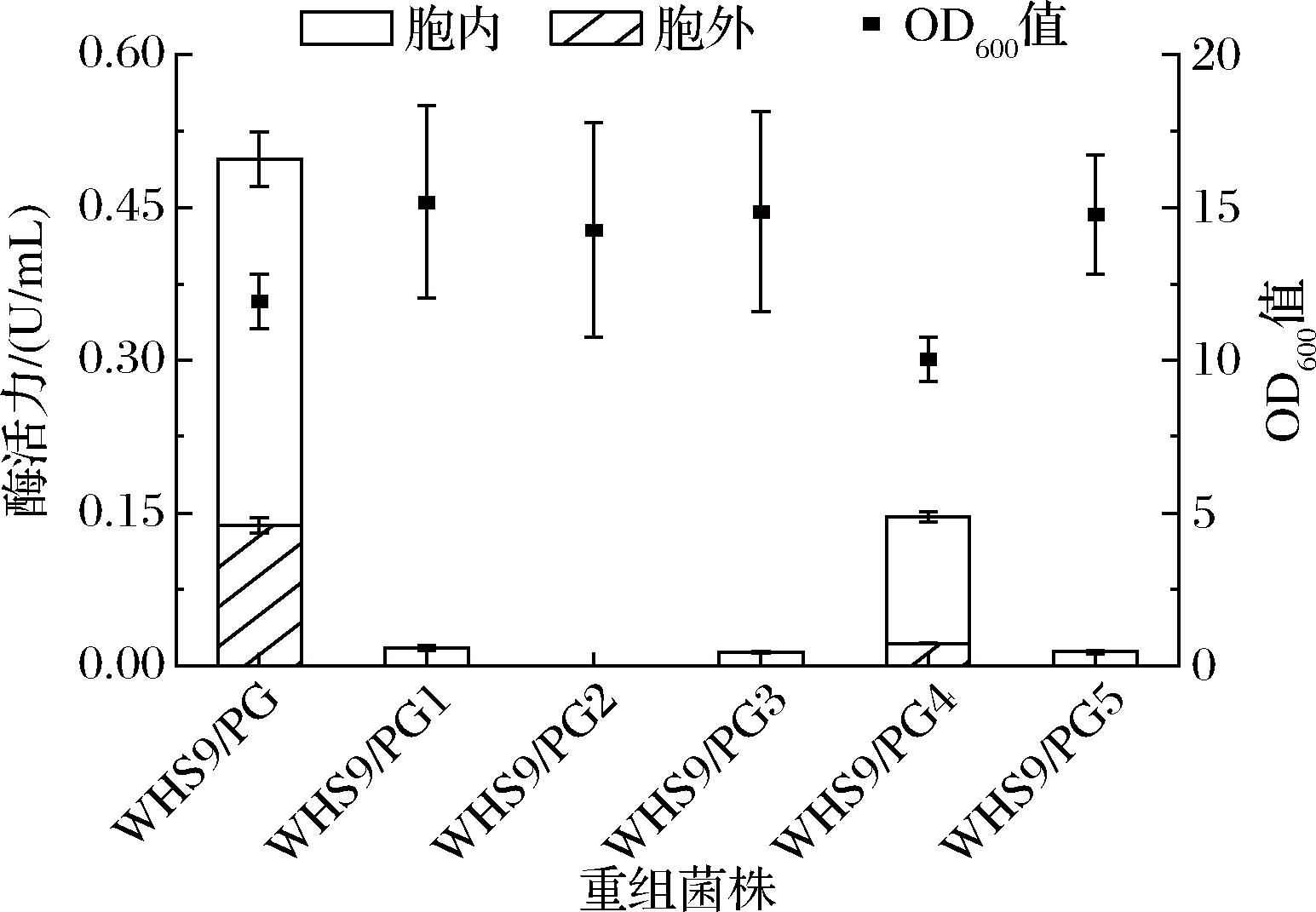
图5 不同启动子对6-α-GT表达的影响
Fig.5 Effects of different promoters on 6-α-GT expression
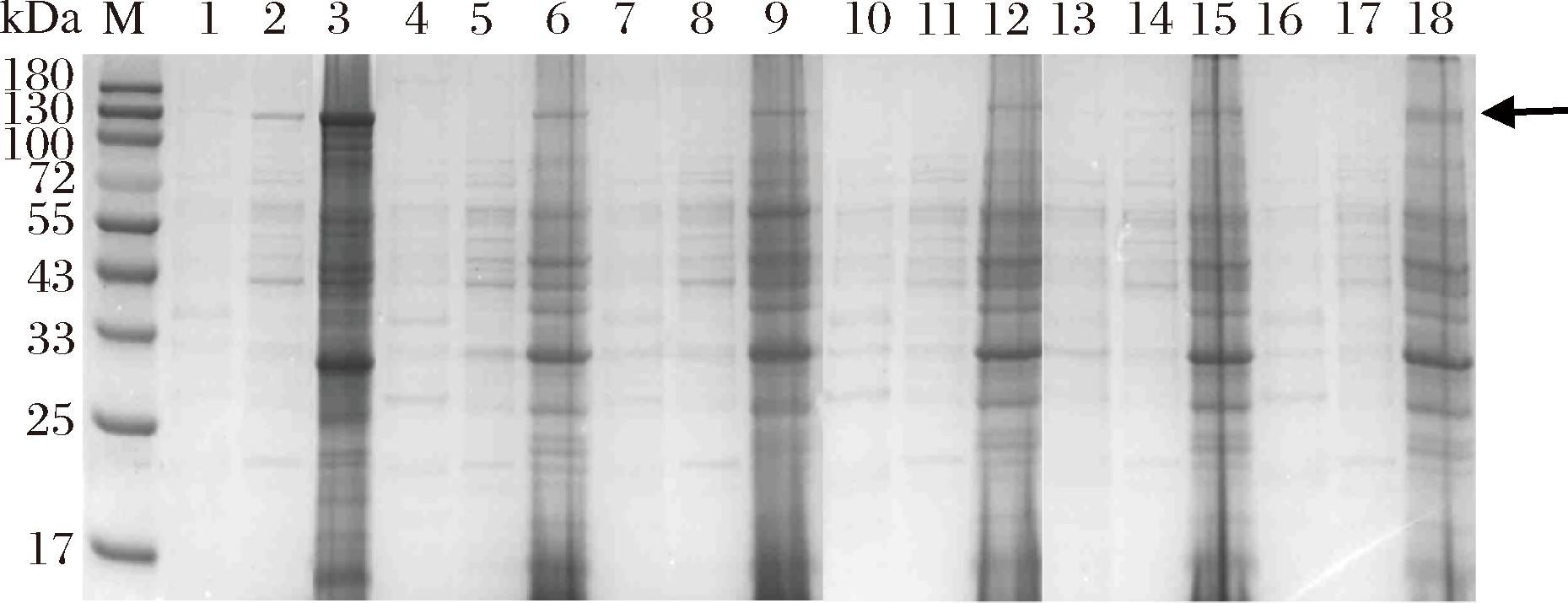
图6 含有不同启动子的重组菌株SDS-PAGE电泳图
Fig.6 SDS-PAGE electrophoresis analysis of recombinant strains containing different promoter
注:M-蛋白Marker;1、2、3-WHS9/PG的发酵上清液、破壁上清液和破壁沉淀;4、5、6-WHS9/PG1的发酵上清液、破壁上清液和破壁沉淀;7、8、9-WHS9/PG2的发酵上清、破壁上清和破壁沉淀;10、11、12-WHS9/PG3的发酵上清液、破壁上清液和破壁沉淀;13、14、15-WHS9/PG4的发酵上清液、破壁上清液和破壁沉淀;16、17、18-WHS9/PG5的发酵上清液、破壁上清液和破壁沉淀;6-α-GT理论分子质量为134.38 kDa;箭头指向目标蛋白的条带。
上述不同表达宿主选择和发酵温度优化结果表明,过表达胞内伴侣蛋白和低温表达有利于促进6-α-GT多肽链的正确折叠,减少包涵体的产生,提高可溶性表达,因此,多肽链能否正确折叠是6-α-GT可溶性表达水平高低的主要影响因素。而更换启动子后并未提高6-α-GT活力,表明多肽链合成量不是可溶性表达产量限制性影响因素。综上所述,多肽链折叠是6-α-GT重组表达的限速步骤。
2.4 化学分子伴侣的种类及浓度对6-α-GT重组表达的影响
在上述发酵温度优化的结果中(图3),菌株WHS9/PG在20 ℃下发酵48 h时,6-α-GT可溶性总酶活力最高,为2.11 U/mL,但考虑到实际生产中,20 ℃的低温条件难以实现且成本较高,因此选择在25 ℃下优化其他发酵条件。而在25 ℃发酵时,6-α-GT胞外、胞内活性分别为0.14、0.36 U/mL;与20 ℃下相比,胞外活性无显著差异,但胞内活性低4.5倍,且形成的包涵体更多(图4)。化学分子伴侣能够促进非折叠多肽的复性过程,进而减少重组蛋白包涵体的形成,提高可溶性蛋白的产量[21];但是化学分子伴侣不是对所有蛋白都具有促进折叠作用[22]。因此,为进一步促进多肽链正确折叠,减少包涵体的产生,提高6-α-GT活力,本研究选择海藻糖[23]、β-环糊精[24]、甜菜碱[25]、硫代甜菜碱[26]、脯氨酸[27]、甘氨酸[28]、Ca2+、Mg2+和Ni2+[7](在目前解析出的6-α-GT三维结构中,PDB:5x7o,存在Ca2+、Mg2+和Ni2+结合位点)作为化学分子伴侣,探究其对重组6-α-GT可溶性表达的影响。结果如图7所示,添加海藻糖、β-环糊精、Ca2+、Mg2+和Ni2+均可促进菌株生长,OD600值分别达到16.14、10.76、11.43、11.54、12.42。对照TB培养基发酵时,6-α-GT胞外、胞内活力分别为0.14和0.36 U/mL,除海藻糖外,这些化学分子伴侣对6-α-GT胞内外活力的影响均不显著,而添加海藻糖时,胞外酶活力无明显变化,但胞内酶活力为2.08 U/mL,是对照的5.77倍。因此,添加海藻糖提高6-α-GT可溶性活性的效果最为显著。
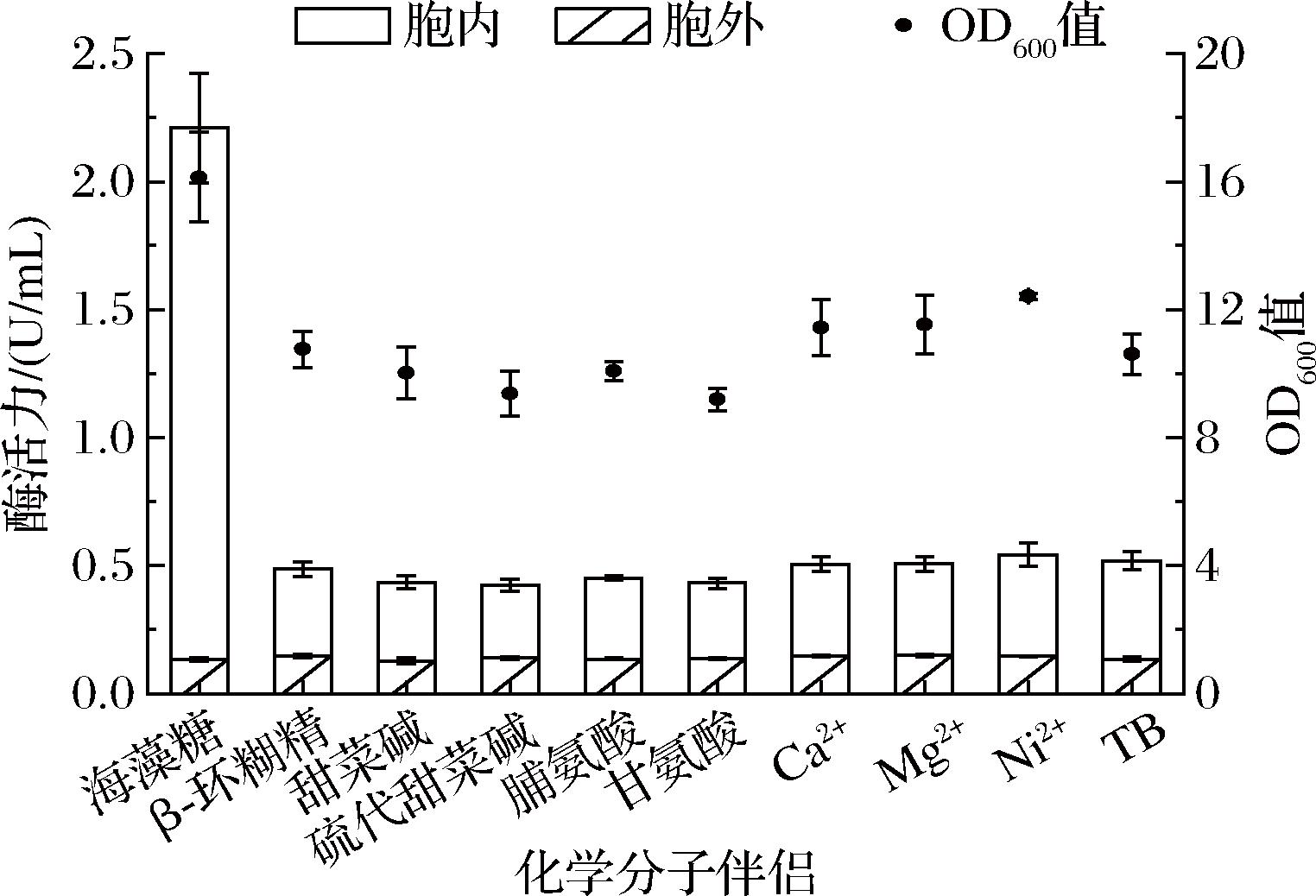
图7 不同化学分子伴侣对6-α-GT表达的影响
Fig.7 Effect of different chemical chaperones on 6-α-GT synthesis
对WHS9/PG在添加不同化学分子伴侣下的发酵样品进行SDS-PAGE分析,结果表明(图8),相比于添加其他化学分子伴侣和对照,添加海藻糖时,6-α-GT胞内可溶性条带在总蛋白中的占比更大,包涵体显著减少。而添加其他化学分子伴侣时,胞内、外条带和包涵体与对照无显著差异。因此,海藻糖可最为有效地促进6-α-GT的正确折叠,提高可溶性表达,减少包涵体的形成。

图8 WHS9/PG在添加不同化学分子伴侣下的SDS-PAGE电泳图
Fig.8 SDS-PAGE electrophoresis analysis of WHS9/PG under different chemical chaperones
注:M-蛋白Marker;1、2、3-添加海藻糖的发酵上清液、破壁上清液和破壁沉淀;4、5、6-添加β-环糊精的发酵上清液、破壁上清液和破壁沉淀;7、8、9-添加甜菜碱的发酵上清液、破壁上清液和破壁沉淀;10、11、12-添加硫代甜菜碱的发酵上清液、破壁上清液和破壁沉淀;13、14、15-添加脯氨酸的发酵上清液、破壁上清液和破壁沉淀;16、17、18-添加甘氨酸的发酵上清液、破壁上清液和破壁沉淀;19、20、21-添加Ca2+的发酵上清液、破壁上清液和破壁沉淀;22、23、24-添加Mg2+的发酵上清液、破壁上清液和破壁沉淀;25、26、27-添加Ni2+的发酵上清液、破壁上清液和破壁沉淀;28、29、30-对照组的发酵上清液、破壁上清液和破壁沉淀;6-α-GT理论分子质量为134.38 kDa;箭头指向目标蛋白的条带。
研究表明,海藻糖有利于促进蛋白质的正确折叠,维持蛋白质的构象稳定,从而在一定程度上减少包涵体的形成,提高可溶性功能蛋白的比例[23]。为进一步提高6-α-GT活性,本研究分别添加0、5、10、15、20、25、30、35 mmol/L海藻糖,探究有利于重组6-α-GT可溶性表达的最佳浓度,结果如图9所示。添加海藻糖,有利于促进菌株WHS9/PG的生长,且海藻糖浓度从0增加至35 mmol/L时,6-α-GT胞外活性也从0.13 U/mL逐渐提高至0.16 U/mL,但胞内活性呈现先提高后降低的趋势。当海藻糖浓度为0~20 mmol/L时,6-α-GT胞内活性逐渐提高至2.08 U/mL;当浓度为20~35 mmol/L时,6-α-GT胞内活性逐渐降低至0.78 U/mL。因此,添加20 mmol/L海藻糖最为有利6-α-GT在WHS9/PG中的可溶性重组表达,总酶活力可达2.21 U/mL,是对照组(不加海藻糖组)的4.42倍。
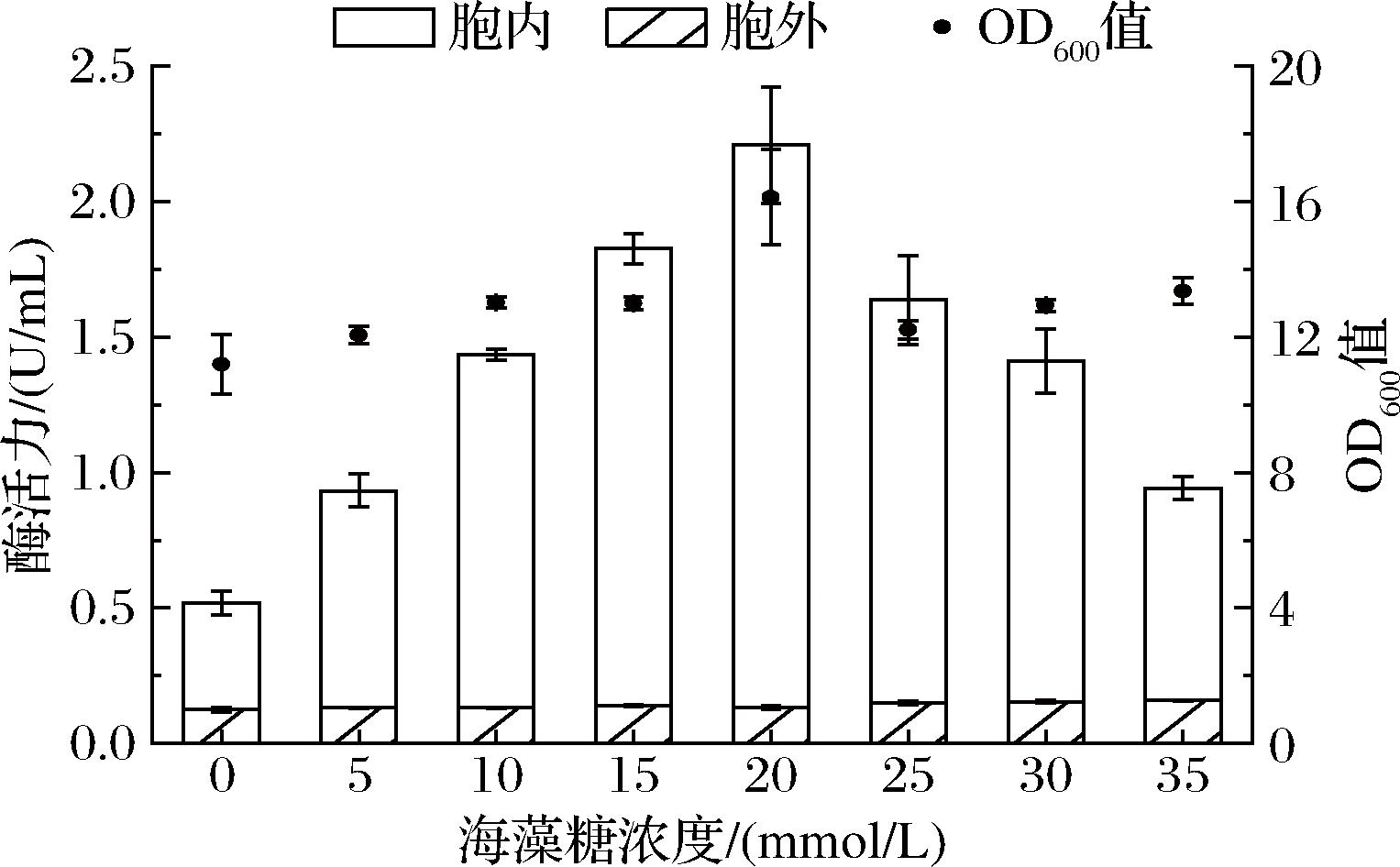
图9 不同海藻糖浓度对6-α-GT表达的影响
Fig.9 Effect of different trehalose concentrations on 6-α-GT synthesis
2.5 发酵时间对6-α-GT重组表达的影响
前期发酵优化结果显示,多肽链的正确折叠是6-α-GT重组表达的限速步骤,胞内伴侣蛋白、低温培养、海藻糖可以通过辅助6-α-GT的正确折叠,减少包涵体的产生,从而有效提高重组表达产量和活性。但是正确折叠的6-α-GT不能长期稳定存在,随着发酵时间延长,大部分细胞逐渐衰亡、活力下降,细胞裂解物中的蛋白酶会水解重组蛋白,导致表达量和活性降低。因此,有必要通过优化重组菌株的发酵时间来提高6-α-GT的表达量。本研究每隔12 h取样检测菌株WHS9/PG的生长情况和6-α-GT活力,结果如图10 所示。在12~36 h,OD600值和6-α-GT胞内、外活力均随着发酵时间延长而增加;而在36~72 h,随着发酵时间延长,胞外活性无显著变化,但是OD600值和胞内均降低。综上所述,发酵36 h时,WHS9/PG生长状况最适宜和6-α-GT重组表达量最高,OD600值和总活力分别为14.86和3.14 U/mL,总活力是优化前的WHS9产酶的196倍。
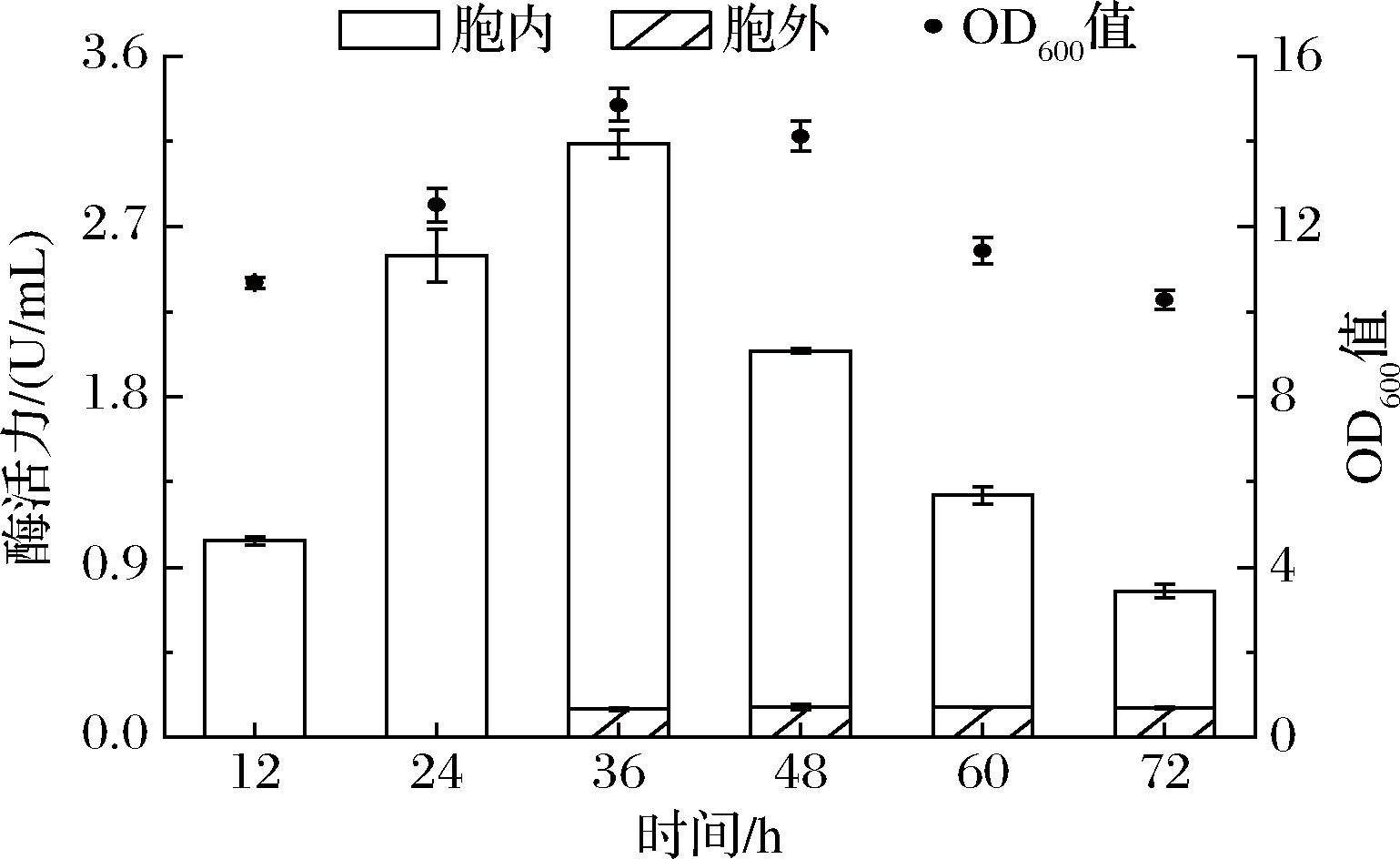
图10 不同发酵时间对6-α-GT表达的影响
Fig.10 Effects of different fermentation periods on 6-α-GT synthesis
3 结论
本研究在B.subtilis三种底盘细胞WS9、WHS9和WS11中重组表达了来源于B.globisporus N75的6-α-GT,在33 ℃发酵48 h后胞内外6-α-GT总活性均较低,分别为0.018、0.016、0.010 U/mL,SDS-PAGE分析显示3个重组菌株均产生较多包涵体,无法显著观察到胞内、胞外可溶性条带。随后通过表达宿主筛选和发酵温度优化,敲除hrcA因子、过表达了胞内伴侣蛋白的WHS9为6-α-GT较佳的重组表达宿主,在20 ℃发酵48 h时,重组菌株WHS9/PG的OD600值和胞内外可溶性总酶活力均最大,分别为14.74、2.11 U/mL,说明过表达胞内伴侣蛋白和低温培养有利于抑制6-α-GT多肽链的非正常聚集,促进肽链正确折叠,从而减少包涵体产生,提高可溶性酶活力。更换启动子后,6-α-GT可溶性活性并未提高。化学分子伴侣种类及浓度优化结果表明,WHS9/PG在25 ℃下添加20 mmol/L海藻糖发酵48 h后,6-α-GT总酶活力可达到2.21 U/mL,表明海藻糖可以辅助6-α-GT的正确折叠。最后优化发酵时间后,发现在36 h时,6-α-GT总酶活力可达3.14 U/mL,是优化前WHS9表达酶活力的196倍。综上所述,本研究实现了6-α-GT在B.subtilis中的重组表达。
[1] NISHIMOTO T, AGA H, MUKAI K, et al.Purification and characterization of glucosyltransferase and glucanotransferase involved in the production of cyclic tetrasaccharide in Bacillus globisporus C11[J].Bioscience, Biotechnology, and Biochemistry, 2002, 66(9):1806-1818.
[2] AGA H, NISHIMOTO T, KUNIYOSHI M, et al.6-alpha-glucosyltransferase and 3-alpha-isomaltosyltransferase from Bacillus globisporus N75[J].Journal of Bioscience &Bioengineering, 2003, 95(3):215-224.
[3] KIM Y K, KITAOKA M, HAYASHI K, et al.A synergistic reaction mechanism of a cycloalternan-forming enzyme and a D-glucosyltransferase for the production of cycloalternan in Bacillus sp NRRL B-21195[J].Carbohydrate Research, 2003, 338(21):2213-2220.
[4] MUKAI K, MARUTA K, SATOUCHI K, et al.Cyclic tetrasaccharide-synthesizing enzymes from Arthrobacter globiformis A19[J].Bioscience, Biotechnology, and Biochemistry, 2004, 68(12):2529-2540.
[5] WATANABE H, NISHIMOTO T, AGA H, et al.Enzymatic synthesis of a novel cyclic pentasaccharide consisting of α-D-glucopyranose with 6-α-glucosyltransferase and 3-α-isomaltosyltransferase[J].Carbohydrate Research, 2005, 340(9):1577-1582.
[6] ICHINOSE H, SUZUKI R, MIYAZAKI T, et al.Paenibacillus sp.598K 6-α-glucosyltransferase is essential for cycloisomaltooligosaccharide synthesis from α-(1→4)-glucan[J].Applied Microbiology &Biotechnology, 2017, 101(10):4115-4128.
[7] FUJIMOTO Z, SUZUKI N, KISHINE N, et al.Carbohydrate-binding architecture of the multi-modular α-1,6-glucosyltransferase from Paenibacillus sp.598K, which produces α-1,6-glucosyl-α-glucosaccharides from starch[J].Biochemical Journal, 2017, 474(16):2763-2778.
[8] AGA H, HIGASHIYAMA T, WATANABE H, et al.Production of cyclic tetrasaccharide from starch using a novel enzyme system from Bacillus globisporus C11[J].Journal of Bioscience &Bioengineering, 2002, 94(4):336-342.
[9] CUI W J, HAN L C, SUO F Y, et al.Exploitation of Bacillus subtilis as a robust workhorse for production of heterologous proteins and beyond[J].World Journal of Microbiology &Biotechnology, 2018, 34(10):145.
[10] LI Y, WU Y K, LIU Y F, et al.A genetic toolkit for efficient production of secretory protein in Bacillus subtilis[J].Bioresource Technology, 2022, 363:127885.
[11] 金亮, 李利宏, 张荣珍, 等.重组枯草芽孢杆菌发酵生产乳铁蛋白N叶工艺优化[J].生物工程学报, 2022, 38(7):2628-2638.JIN L, LI L H, ZHANG R Z, et al.Fermentation optimization for production of lactoferrin N-lobe by recombinant Bacillus subtilis[J].Chinese Journal of Biotechnology, 2022, 38(7):2628-2638.
[12] ZHANG K, SU L Q, DUAN X G, et al.High-level extracellular protein production in Bacillus subtilis using an optimized dual-promoter expression system[J].Microbial Cell Factories, 2017, 16(1):32.
[13] 张康. 枯草芽孢杆菌菌株改造、启动子优化和普鲁兰酶的高效制备研究[D].无锡:江南大学, 2018.ZHANG K.Modification of Bacillus subtilis strain, promoter optimization and high-level expression of pullulanase[D].Wuxi:Jiangnan University, 2018.
[14] 姚动邦. Bacillus stearothermophilus α-淀粉酶在芽孢杆菌中高效胞外表达的研究[D];无锡:江南大学, 2021.YAO D B.High-efficient extracellular expression of Bacillus stearothermophilus α-amylase in Bacillus[D].Wuxi:Jiangnan University, 2021.
[15] ZHANG X Z, ZHANG Y.Simple, fast and high-efficiency transformation system for directed evolution of cellulase in Bacillus subtilis[J].Microbial Biotechnology, 2011, 4(1):98-105.
[16] 王钢, 陈尘, 李强.大肠杆菌体系外源蛋白表达速度的调控策略[J].过程工程学报, 2013, 13(6):1075-1080.WANG G, CHEN C, LI Q. Regulation strategies of expression rate of heterologous proteins in E.coli system[J]. The Chinese Journal of Process Engineering, 2013, 13(6):1075-1080.
[17] ZEPEDA A B, PESSOA A, FAR AS J G.Carbon metabolism influenced for promoters and temperature used in the heterologous protein production using Pichia pastoris yeast[J].Brazilian Journal of Microbiology, 2018, 49:119-127.
AS J G.Carbon metabolism influenced for promoters and temperature used in the heterologous protein production using Pichia pastoris yeast[J].Brazilian Journal of Microbiology, 2018, 49:119-127.
[18] BUDDE I,STEIL L, SCHARF C, et al.Adaptation of Bacillus subtilis to growth at low temperature:A combined transcriptomic and proteomic appraisal[J].Microbiology, 2006, 152(3):831-853.
[19] WELSCH N, HOMUTH G, SCHWEDER T. Stepwise optimization of a low-temperature Bacillus subtilis expression system for “difficult to express” proteins[J]. Applied Microbiology and Biotechnology, 2015, 99(15):6363-6376.
[20] YUAN G, WONG S L.Isolation and characterization of Bacillus subtilis groE regulatory mutants:Evidence for orf39 in the dnaK operon as a repressor gene in regulating the expression of both groE and dnaK[J].Journal of Bacteriology, 1995, 177(22):6462-6468.
[21] 段绪果, 张玉华, 黄婷婷, 等.化学分子伴侣及诱导条件协同强化Thermotoga maritima α-葡聚糖磷酸化酶可溶性表达[J].生物技术通报, 2021, 37(8):233-242.DUAN X G, ZHANG Y H, HUANG T T, et al.Synergetic enhancing the soluble expression of Thermotoga maritima α-glucan phosphorylase by chemical chaperones and induction condition optimization[J].Biotechnology Bulletin, 2021, 37(8):233-242.
[22] DUAN X G, ZHANG X Y, SHEN Z Y, et al.Efficient production of aggregation prone 4-α-glucanotransferase by combined use of molecular chaperones and chemical chaperones in Escherichia coli[J].Journal of Biotechnology, 2019, 292:68-75.
[23] RAO D M, WANG L, HUO R T, et al.Trehalose promotes high-level heterologous expression of 4,6-a-glucanotransferase GtfR2 in Escherichia coli and mechanistic analysis[J].International Journal of Biological Macromolecules, 2022, 210:315-323.
[24] WANG L, CHEN S, WU J.Cyclodextrin enhanced the soluble expression of Bacillus clarkii γ-CGTase in Escherichia coli[J].BMC Biotechnology, 2018, 18(1):72.
[25] DUAN X G, CHEN J, WU J.Optimization of pullulanase production in Escherichia coli by regulation of process conditions and supplement with natural osmolytes[J].Bioresource Technology, 2013, 146:379-385.
[26] WANGKANONT K, FOREST K T, KIESSLING L L.The non-detergent sulfobetaine-201 acts as a pharmacological chaperone to promote folding and crystallization of the type II TGF-β receptor extracellular domain[J].Protein Expression and Purification, 2015, 115:19-25.
[27] MATSUNAGA R, TSUMOTO K.Addition of arginine hydrochloride and proline to the culture medium enhances recombinant protein expression in Brevibacillus choshinensis:The case of RBD of SARS-CoV-2 spike protein and its antibody[J].Protein Expression and Purification, 2022, 194:106075.
[28] ZOU C, DUAN X G, WU J.Enhanced extracellular production of recombinant Bacillus deramificans pullulanase in Escherichia coli through induction mode optimization and a glycine feeding strategy[J].Bioresource Technology, 2014, 172:174-179.