鱼明胶是鱼皮、鱼骨、鱼鳞等鱼类加工副产物中胶原蛋白适度断裂得到的生物高聚物,因其功能性质和哺乳动物明胶相似且没有饮食习俗的限制,被认为是最具有潜力的哺乳动物明胶替代品和升级品[1-2]。然而,与哺乳动物明胶相比,鱼明胶的凝胶性能较差,其应用范围受到限制。为了克服这些缺点,有研究提出通过酶(微生物谷氨酰胺转氨酶、酪氨酸酶、漆酶等)、化学(磷酸化、醛、酚类反应等)和物理(电解质、非电解质、机械处理等)以及复合修饰等方法来改善鱼明胶的凝胶性和流变性[3]。其中,多糖对鱼明胶的修饰被认为是最简单、最具有前景的方法[4]。近年来有许多研究表明,基于静电相互作用的离子多糖可以改善鱼明胶的凝胶性、流变性等[5-6]。如适量的阿拉伯胶、黄原胶和κ-卡拉胶对鱼明胶的凝胶强度、硬度、表观黏度、胶融温度有积极的改善作用[5]。鱼明胶-多糖复合体系在食品包装、伤口敷料和药物运输等方面也广泛应用[7]。
透明质酸是由葡萄糖醛酸和乙酰氨基己糖结合为双糖,并由此双糖为单位聚合产生的一种高分子酸性黏多糖,带一定的负电荷[8]。透明质酸广泛存在于人体的各种组织中,具有保湿、润滑和抗衰老等多种生理功能,被广泛应用于医药和化妆用品[8-9]。透明质酸钠是透明质酸的钠盐形式,我国于2008年批准透明质酸钠为新资源食品,但仅作为保健食品原料。2021年1月,国家卫生健康委员会发文,批准扩大透明质酸钠的使用范围,可应用于乳制品、糖果、巧克力等普通食品[10]。国内外已有少量关于透明质酸应用于食品的研究。SUTARIYA等[11]研究了透明质酸对牛奶流变学、蛋白质稳定性和凝乳酶凝胶特性等性质的影响,发现全脂牛奶的黏度随着透明质酸浓度增加而增加;ZAJ![]() C等[12]探究透明质酸影响肉类乳液的流变性和持水能力,结果表明添加0.05、0.1 g/kg 的透明质酸会导致烟熏香肠水分流失,从而降低肉类乳液的产量和稳定性;WANG等[13]研究了不同浓度透明质酸和3%乳清分离蛋白之间非共价相互作用对水包油乳液稳定性影响;周海栋等[14]研究结果表明,透明质酸能显著提高乳酸的持水力、爽滑性以及细腻度;RAZZAK等[15]研究了鱼明胶与透明质酸在水溶液中的相互作用,发现当溶液的pH处于临界点(pHΦ)以上时,鱼明胶和透明质酸会通过静电相互作用形成可溶性的复合物。然而,透明质酸修饰鱼明胶提高其凝胶性能的研究尚未报道,有待深入系统研究。
C等[12]探究透明质酸影响肉类乳液的流变性和持水能力,结果表明添加0.05、0.1 g/kg 的透明质酸会导致烟熏香肠水分流失,从而降低肉类乳液的产量和稳定性;WANG等[13]研究了不同浓度透明质酸和3%乳清分离蛋白之间非共价相互作用对水包油乳液稳定性影响;周海栋等[14]研究结果表明,透明质酸能显著提高乳酸的持水力、爽滑性以及细腻度;RAZZAK等[15]研究了鱼明胶与透明质酸在水溶液中的相互作用,发现当溶液的pH处于临界点(pHΦ)以上时,鱼明胶和透明质酸会通过静电相互作用形成可溶性的复合物。然而,透明质酸修饰鱼明胶提高其凝胶性能的研究尚未报道,有待深入系统研究。
基于上述分析,本文以鱼明胶为原料,利用不同分子质量(200~400、800~1 000、1 000~1 800、>1 800 kDa)的透明质酸对鱼明胶修饰,探究透明质酸对鱼明胶凝胶-融胶转变温度、凝胶强度的影响,并对凝胶动力学和表观黏度进行评价。此外,利用红外光谱和扫描电镜对鱼明胶-透明质酸复合体系结构进行分析,探讨透明质酸对鱼明胶修饰改性的内在原因,为扩大鱼明胶的性能提升和应用扩展提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
罗非鱼皮明胶(260~270 Bloom),吉利鼎海洋生物科技有限公司(中国苏州);透明质酸(钠盐,分子质量分别为200~400、800~1 000、1 000~1 800、>1 800 kDa),上海阿拉丁生化科技股份有限公司;其他化学试剂均为分析纯及以上级别。
1.2 仪器与设备
SHJ-6A型磁力搅拌恒温水浴锅,常州金坛良友仪器有限公司;TA.XT plus质构分析仪,英国Stable Micro Systems公司;MCR302流变仪,奥地利Anton Paar公司;Spectrum-one型傅里叶变换红外光谱仪,美国Perkin Elmer公司;S-3400 N型扫描电子显微镜,日本Hitachi公司。
1.3 实验方法
1.3.1 样品制备
参照HUANG等[16]方法略作修改,称取适量鱼明胶,按照质量浓度为100 g/L的比例加入一定量的去离子水,40 ℃水浴溶解至完全。分别称取适量不同分子质量(200~400、800~1 000、1 000~1 800、>1 800 kDa)的透明质酸,按照质量浓度为5 g/L比例加入去离子水,40 ℃磁力搅拌恒温水浴溶解至完全,再加入至鱼明胶溶液中得到鱼明胶-透明质酸体系,分别命名为FG-HA20~40W、FG-HA80~100W、FG-HA100~180W、FG-HA>180W。此时,混合体系中鱼明胶浓度为50 g/L,透明质酸浓度为2 g/L,且设置未添加透明质酸的样品为对照组FG。随后,鱼明胶-透明质酸混合体系在40 ℃下磁力搅拌1 h,使其反应完全。
1.3.2 凝胶-融胶转变温度测定
参照HUANG等[16]的方法,采用流变仪对制备的样品进行温度扫描,测定鱼明胶的凝胶-融胶转变温度。移取15 mL的混合溶液置于流变仪的CC27圆筒中,温度扫描测量分别在40~5 ℃的降温阶段和5~40 ℃的升温阶段进行,冷却/加热速率为0.5 ℃/min,应变力为0.5%,频率为1 Hz。
1.3.3 凝胶强度测定
参照HU等[17]的方法,将15 mL混合溶液置于烧杯中(胶体为33 mm×22 mm,直径×长度),在4 ℃下孵育16~17 h。用探头(P/0.5R)对胶体进行凝胶强度测试,测前、测试、测后速度均为1 mm/s。以探头进入胶体深度为4 mm时所受的最大力定义为凝胶强度。
1.3.4 凝胶动力学测定
参照TONG等[4]的方法对样品进行凝胶动力学测定。移取15 mL的混合溶液置于流变仪的CC27圆筒中,并于40 ℃保持5 min,设置最终温度为4 ℃,以0.5 ℃/min的速度降温至4 ℃,保持3 h,频率为1 Hz,应变力为0.5%。构建储能模量(G′)随时间动态变化方程为凝胶动力学方程,如公式(1)所示:
Gt=kgelln(tgel-A)+C
(1)
式中:kgel为凝胶速率;tgel为凝胶时间,min;A、C为常数。
1.3.5 表观黏度测定
参照HUANG等[16]的方法稍作修改,对样品进行表观黏度测定。使用MCR302流变仪,在25 ℃恒温3 min,CC27转子的剪切速率从0.01 s-1升至100.00 s-1的条件下测定混合溶液的表观黏度(mPa·s)。
1.3.6 傅里叶红外光谱测定
参照HU等[17]的方法稍作修改测定样品的红外光谱。将冻干后的鱼明胶-透明质酸混合样品和KBr粉末以1∶100(质量比)在玛瑙研钵中研磨至细腻,之后压成透明片状。混合样品的红外光谱图采集的波长为4 000~500 cm-1,分辨率为4 cm-1,扫描8次,得到的数据绘制成y轴为透过率(%)和x轴为波数(cm-1)的图谱。
1.3.7 扫描电镜测定
参照LI等[18]的方法稍作修改,对样品的微观结构进行观察。将配制好的样品溶液置于4 ℃凝冻16~18 h后,将凝冻的胶体切成1 mm厚的胶体片,置于含有体积分数为2.5%戊二醛的磷酸盐缓冲液(0.2 mol/L,pH 7.0)中,4 ℃下固定12 h。固定完成之后的样品干燥后贴于样品台的导电胶带上并镀金,扫面电镜的加速电压为15 kV,放大倍数为200倍。
1.4 统计学分析
所有实验中,每组样品重复测定3次,实验结果以平均值±标准偏差表示。使用Origin 2023作图,采用SPSS 26软件处理数据,其中不同字母表示显著差异(P<0.05)。
2 结果与分析
2.1 凝胶-融胶转变温度
在凝胶-融胶过程中不同分子质量透明质酸对鱼明胶流变性的影响如图1所示。G′和损耗模量(G″)分别代表鱼明胶的弹性和黏度[19]。如图1所示,在降温过程中,所有样品的G′和G″均随温度降低而升高,当两者形成交点时对应的温度为凝胶温度,表明胶体正在形成;在升温过程中,所有样品的G′和G″均随温度升高而降低,当两者形成交点时所对应的温度为胶融温度,表明胶体开始融化[17]。通过图1-a和图1-c可知,随着添加的透明质酸分子质量增加,鱼明胶-透明质酸混合体系的G′逐渐升高,当分子质量>1 800 kDa时,G′明显偏高且变化最显著。通过图1-b和1-d可知,在降温和升温过程的不同温度区间中,G″的变化随透明质酸分子质量的增加呈现一定规律。在40~22.5 ℃时,随着添加的透明质酸分子质量增加,鱼明胶-透明质酸混合体系的G″逐渐升高。在22.5~18.5 ℃时,添加的透明质酸分子质量越大,混合体系的G″随温度变化的速率越低。当温度为18.5~5 ℃时,随着添加的透明质酸分子质量增加,G″值反而降低。但在整个变温过程中,鱼明胶-透明质酸混合体系的G′和G″均高于对照组鱼明胶(未添加透明质酸),说明透明质酸与鱼明胶相互作用对鱼明胶的黏弹性有较大影响,且与透明质酸的分子质量有关。

a-降温过程中储能模量变化;b-降温过程中损耗模量变化;c-升温过程中储能模量变化;d-升温过程中损耗模量变化
图1 透明质酸对鱼明胶储能模量和损耗模量的影响
Fig.1 Effect of hyaluronic acid on storage modulus and loss modulus of fish gelatin
在降温和升温阶段,G′和G″交点对应的温度分别为凝胶温度和胶融温度[19]。如图2-b所示,在测试方法和参数相同的情况下,透明质酸可以提高鱼明胶的胶融温度和凝胶温度。随着透明质酸分子质量的增加,鱼明胶-透明质酸复合胶体的胶融温度与凝胶温度逐步升高,其中FG-HA>180W的胶融温度(33 ℃)最高,超过哺乳动物明胶的胶融温度(28~31 ℃)[20]。在水溶液中,鱼明胶和多糖产生的相行为与鱼明胶的类型、多糖的物理化学特性(如分子质量等)以及外部因素(如温度、pH、离子种类和强度等)有关[21]。通过调节这些因素可以改变鱼明胶和多糖之间的分子间相互作用,从而使混合凝胶表现多种物理性质和微观结构,达到凝胶性能的改善。透明质酸是阴离子多糖,易与鱼明胶通过静电相互作用生成复合物[15]。随着透明质酸分子质量增加,鱼明胶-透明质酸往往占据更大的流体动力学体积,两者更容易发生相互作用,促进彼此的络合和凝聚,从而形成良好凝胶网状结构,有利于鱼明胶胶融温度和凝胶温度的提高[21]。这与CHENG等[19]的结果类似,其报道鱼明胶与阴离子多糖κ-卡拉胶通过静电作用和氢键以螺旋形式聚集,可以形成良好的凝胶网络,从而体现出良好的凝胶性能。因此,经透明质酸修饰可以提高鱼明胶的胶融温度和凝胶温度,且分子质量越大效果越明显。
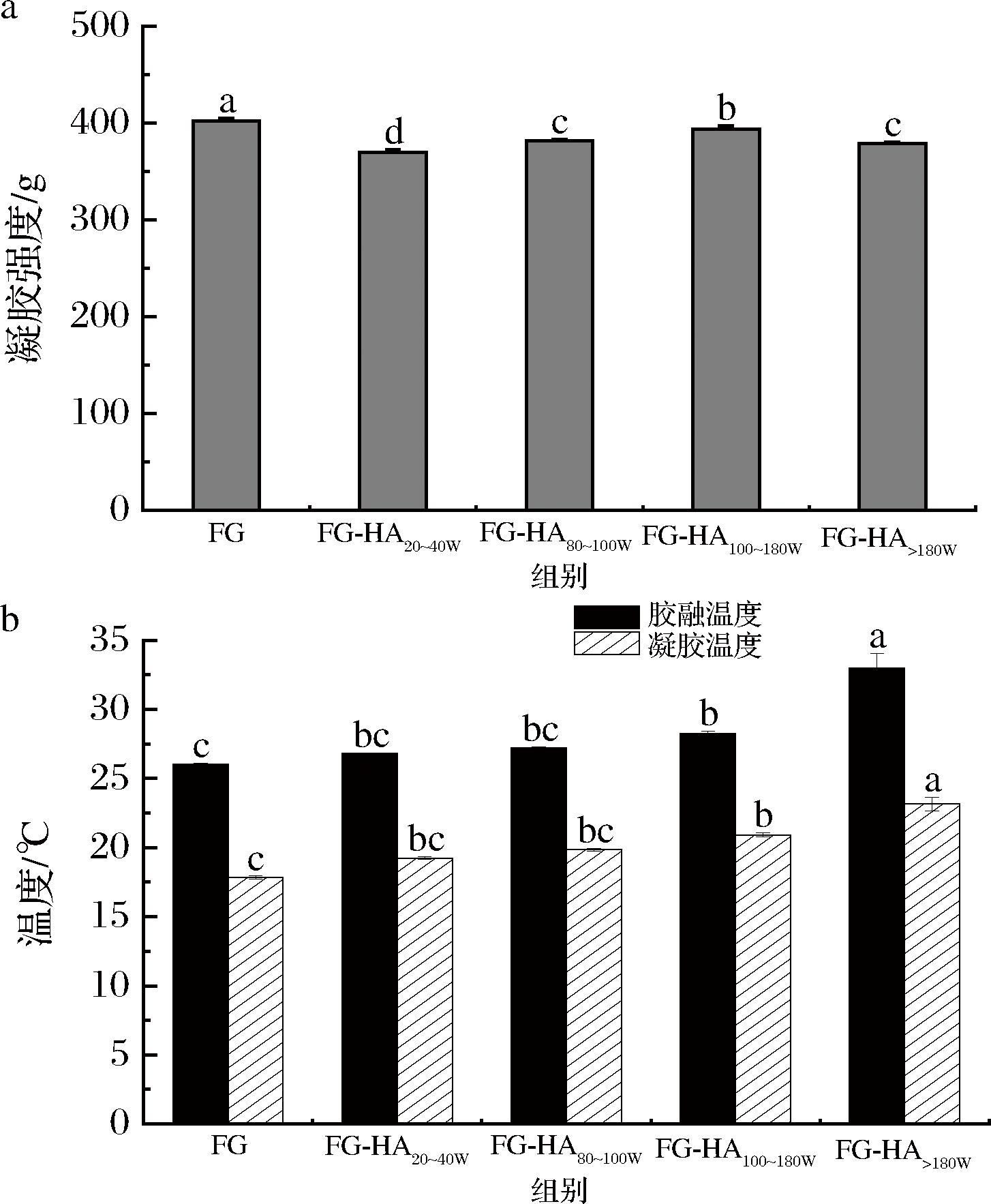
a-不同鱼明胶-透明质酸复合体的凝胶强度;b-不同鱼明胶-透明质酸复合体的凝胶-融胶转变温度
图2 透明质酸对鱼明胶凝胶强度和凝胶-融胶转变温度的影响
Fig.2 Effect of hyaluronic acid on gel strength and gel-sol transition temperature of fish gelatin
2.2 凝胶强度
不同分子质量透明质酸对鱼明胶凝胶强度的影响如图2所示,对照组鱼明胶的凝胶强度最高,说明添加透明质酸会降低鱼明胶的凝胶强度,降低幅度在8.1%以内。并且,在鱼明胶-透明质酸混合体系中,凝胶强度随透明质酸分子质量的增加呈现先升高后降低的现象,其中FG-HA100~180W的凝胶强度相对最高。阴离子多糖与鱼明胶可以通过静电相互作用和氢键改善复合胶体的凝胶性能,且氢键对改善明胶凝胶性能起着重要作用[19]。然而,鱼明胶-透明质酸混合凝胶的凝胶强度均低于对照组。这可能是因为透明质酸与鱼明胶通过静电作用形成鱼明胶-透明质酸复合体,但这种复合体可能阻碍了鱼明胶分子间氢键的形成。在鱼明胶-透明质酸混合体系中,凝胶强度随着透明质酸分子质量的增加呈现先升高后降低的趋势,这可能是因为低分子质量透明质酸与鱼明胶之间的静电相互作用弱,体系中以鱼明胶-鱼明胶复合体为主体,而鱼明胶-低分子质量透明质酸复合体可能对胶体网状结构的形成影响不大,反而因为阻碍了鱼明胶分子间的氢键形成,使得胶体凝胶强度降低。随着添加的透明质酸分子质量增大,鱼明胶与透明质酸之间的静电相互作用力逐渐增强,混合体系中以鱼明胶-高分子质量透明质酸复合体为主体,阻碍了鱼明胶分子间氢键的形成,但也进一步影响胶体的网状结构,凝胶强度最终表现为相对升高。当分子质量>1 800 kDa时,鱼明胶-透明质酸复合物阻碍鱼明胶分子间氢键的形成更加显著,凝胶强度降低。
2.3 凝胶动力学
凝胶过程中时间对G′、G″的影响如图3所示。在前50 min内,所有凝胶体系的G′和G″都以较快的速度增长,随后以较小的速度继续增长。冷却过程中,当G′>G″时,预示着胶体正在形成,明胶分子从无规则卷曲转变为三股螺旋,三股螺旋含量主要受pH、浓度、温度等因素的影响[20]。
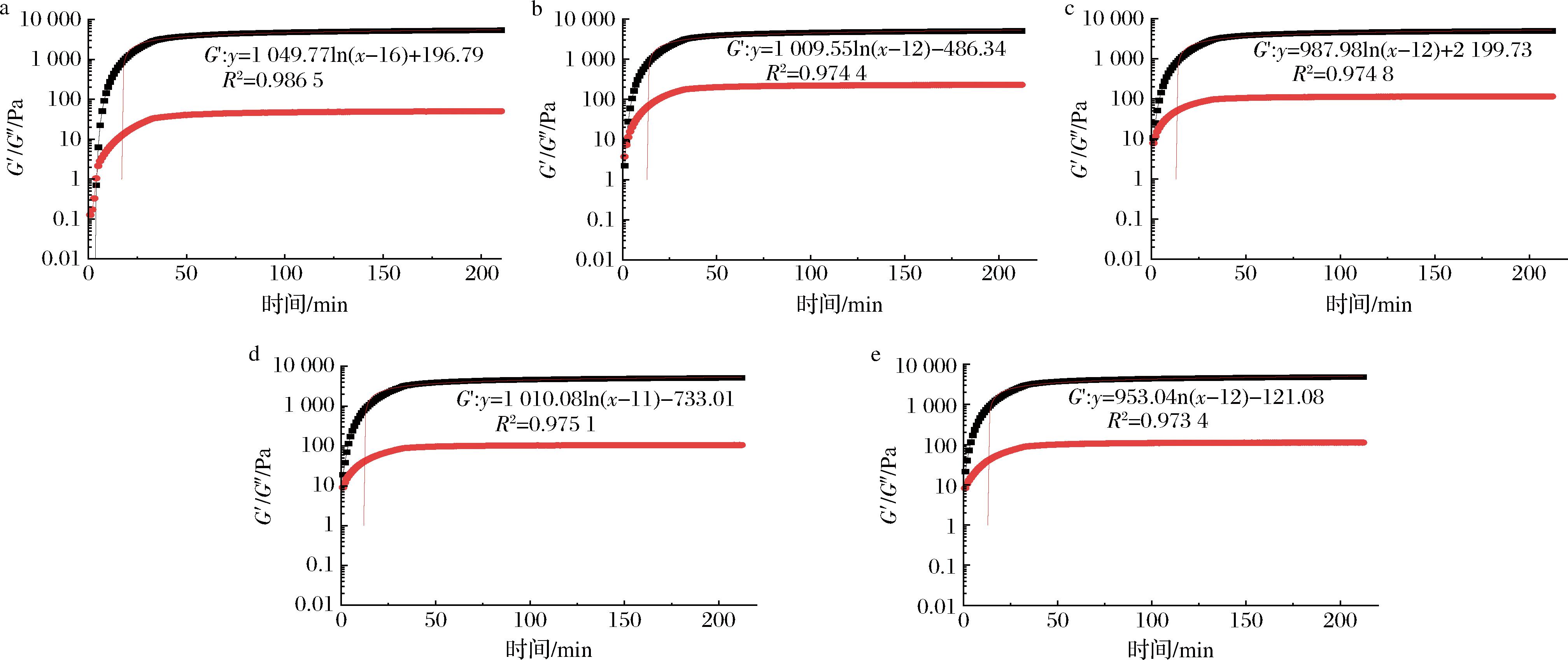
a-FG;b- FG-HA20~40W;c-FG-HA80~100W;d-FG-HA100~180W;e-FG-HA>180W
图3 透明质酸对鱼明胶凝胶动力学的影响
Fig.3 Effect of hyaluronic acid on gel kinetics of fish gelatin
凝胶速率可用于了解明胶在凝胶过程中模量的变化,与明胶三股螺旋的形成和含量密切相![]() 值越大,表明形成的三股螺旋含量越多[23]。所有凝胶体系的凝胶动力学分析数据如表1所示,对照组鱼明胶的凝胶速率(kgel)和
值越大,表明形成的三股螺旋含量越多[23]。所有凝胶体系的凝胶动力学分析数据如表1所示,对照组鱼明胶的凝胶速率(kgel)和![]() 值分别为1 049.77 Pa/min、5 384.6 Pa,均高于鱼明胶-透明质酸混合体系,说明添加透明质酸会降低鱼明胶胶体的凝胶速率和
值分别为1 049.77 Pa/min、5 384.6 Pa,均高于鱼明胶-透明质酸混合体系,说明添加透明质酸会降低鱼明胶胶体的凝胶速率和![]() 值。这可能是因为在凝胶过程中,添加的透明质酸可以通过静电相互作用与鱼明胶形成复合物,这种复合物限制鱼明胶分子链的灵活性,阻碍明胶分子从无规则卷曲到三股螺旋的转变[4,17]。透明质酸是阴离子黏多糖,添加透明质酸不仅会增加混合体系的黏度,导致鱼明胶分子链移动速率降低;还可能会在鱼明胶分子中引入负电荷,破坏鱼明胶分子链之间典型的氢键[17]。因此,在相同情况下,添加透明质酸会降低鱼明胶体系中三股螺旋的含量,导致凝胶速率和
值。这可能是因为在凝胶过程中,添加的透明质酸可以通过静电相互作用与鱼明胶形成复合物,这种复合物限制鱼明胶分子链的灵活性,阻碍明胶分子从无规则卷曲到三股螺旋的转变[4,17]。透明质酸是阴离子黏多糖,添加透明质酸不仅会增加混合体系的黏度,导致鱼明胶分子链移动速率降低;还可能会在鱼明胶分子中引入负电荷,破坏鱼明胶分子链之间典型的氢键[17]。因此,在相同情况下,添加透明质酸会降低鱼明胶体系中三股螺旋的含量,导致凝胶速率和![]() 值减低。凝胶动力学分析与凝胶强度结果相对应,说明透明质酸通过与鱼明胶形成鱼明胶-透明质酸复合物,破坏典型的氢键,减少三股螺旋的含量,导致鱼明胶的凝胶强度降低。此外,添加透明质酸后,鱼明胶分子链的移动受到限制,凝胶速率降低,会使鱼明胶的网络结构更加稳定[24],这可能与鱼明胶凝胶温度和胶融温度的提高有关。
值减低。凝胶动力学分析与凝胶强度结果相对应,说明透明质酸通过与鱼明胶形成鱼明胶-透明质酸复合物,破坏典型的氢键,减少三股螺旋的含量,导致鱼明胶的凝胶强度降低。此外,添加透明质酸后,鱼明胶分子链的移动受到限制,凝胶速率降低,会使鱼明胶的网络结构更加稳定[24],这可能与鱼明胶凝胶温度和胶融温度的提高有关。
表1 鱼明胶-透明质酸复合胶体的流变学特性分析
Table 1 Analysis of rheological properties of fish gelatin-hyaluronic acid composite colloid
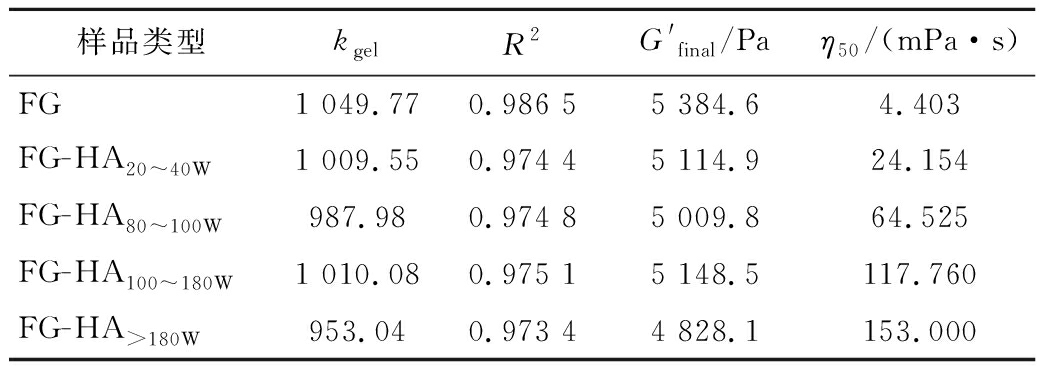
样品类型kgelR2G'final/Paη50/(mPa·s)FG1 049.770.986 55 384.64.403FG-HA20~40W1 009.550.974 45 114.924.154FG-HA80~100W987.980.974 85 009.864.525FG-HA100~180W1 010.080.975 15 148.5117.760FG-HA>180W953.040.973 44 828.1153.000
2.4 表观黏度
黏度可以反映明胶产品的加工特性,是评价明胶品质的关键指标之一,主要受剪切速率、pH、温度、剪切压力和时间等因素的影响[17]。表观黏度的变化也反映了分子间相互作用力的变化,分子间吸引力越强,蛋白质的表观黏度就越高[22]。剪切速率为50 s-1时所对应的黏度(η50)被广泛认为与食物黏度、润滑性等品质相关[4]。黏度不随剪切速率增大而改变的溶液为牛顿流体;黏度随着剪切速率增大而改变的溶液为非牛顿流体。
如图4所示,在流动扫描过程中,所有样品的表观黏度均随剪切速率增大发生变化,属于非牛顿流体。此外,由图4和表1可知,鱼明胶-透明质酸混合体系的表观黏度、η50均高于对照组鱼明胶,并与透明质酸的分子质量成正比。这表明透明质酸可以改变鱼明胶分子间的相互作用力。随着透明质酸分子质量的增大,鱼明胶-透明质酸的流体动力学体积越大,更容易发生分子间的作用,使得分子吸引力增强,黏度更高[21-22]。因此,透明质酸与鱼明胶相互作用可以显著改善鱼明胶的表观黏度,赋予鱼明胶更好的感官品质,且分子质量越大效果越明显,与鱼明胶凝胶温度和胶融温度的提升效果一致。
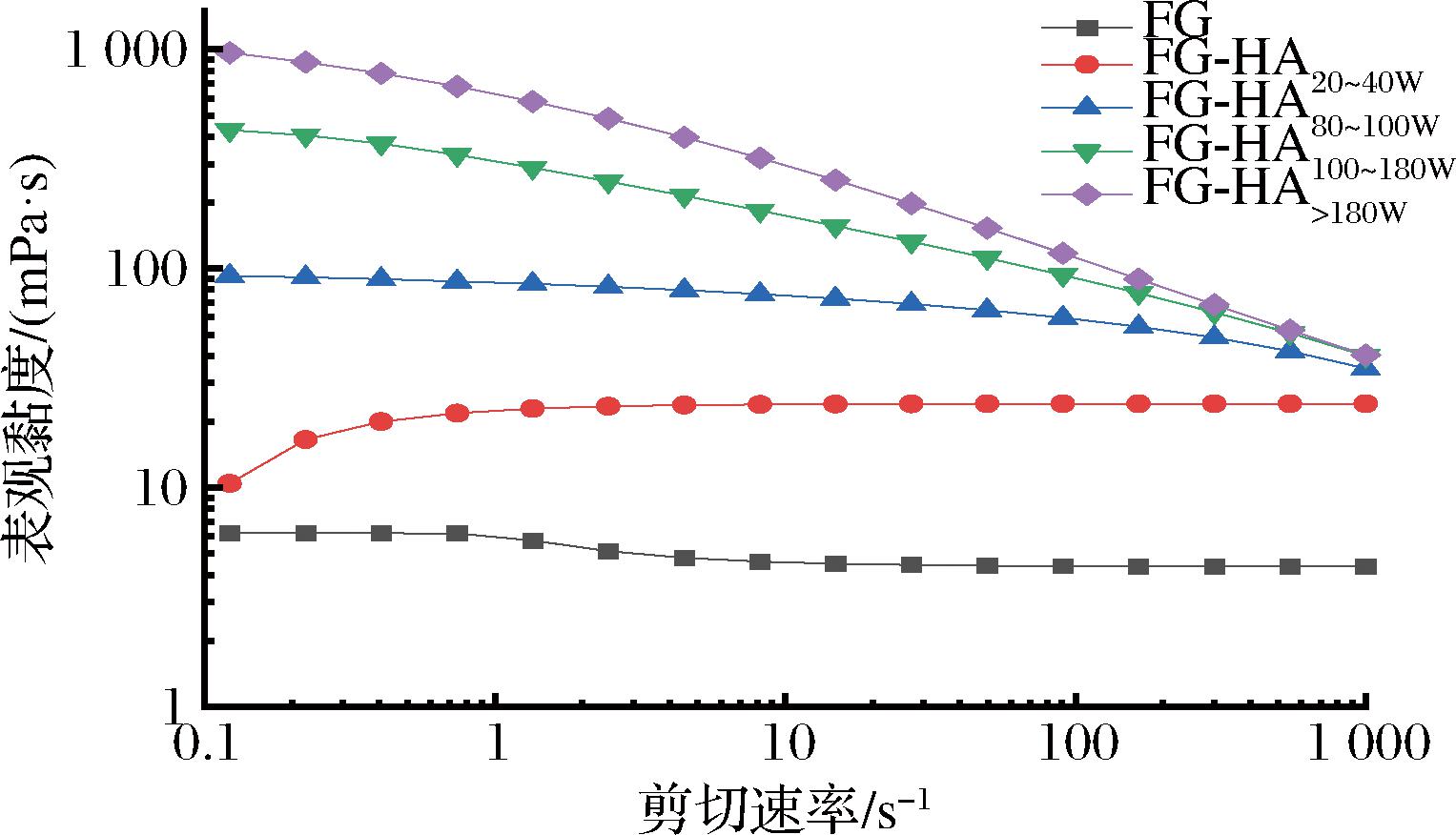
图4 透明质酸对鱼明胶表观黏度的影响
Fig.4 Effect of hyaluronic acid on apparent viscosity of fish gelatin
2.5 傅立叶红外光谱
红外光谱通常能够反映蛋白质的官能团和二级结构,不同分子质量透明质酸与鱼明胶混合胶体的红外光谱如图5所示。总体而言,5个鱼明胶样品在酰胺区均有吸收,表现出相似的红外谱图。所有样品在红外谱图中显示的特征酰胺带与HASSAN等[25]报道的鱼明胶特征峰相似,显示有酰胺A(3 600~3 200 cm-1)、酰胺Ⅰ(1 700~1 600 cm-1)、酰胺Ⅱ(1 560~1 335 cm-1)、酰胺Ⅲ(1 330~670 cm-1)的特征吸收峰,表明透明质酸的添加不会破坏鱼明胶典型的官能团。
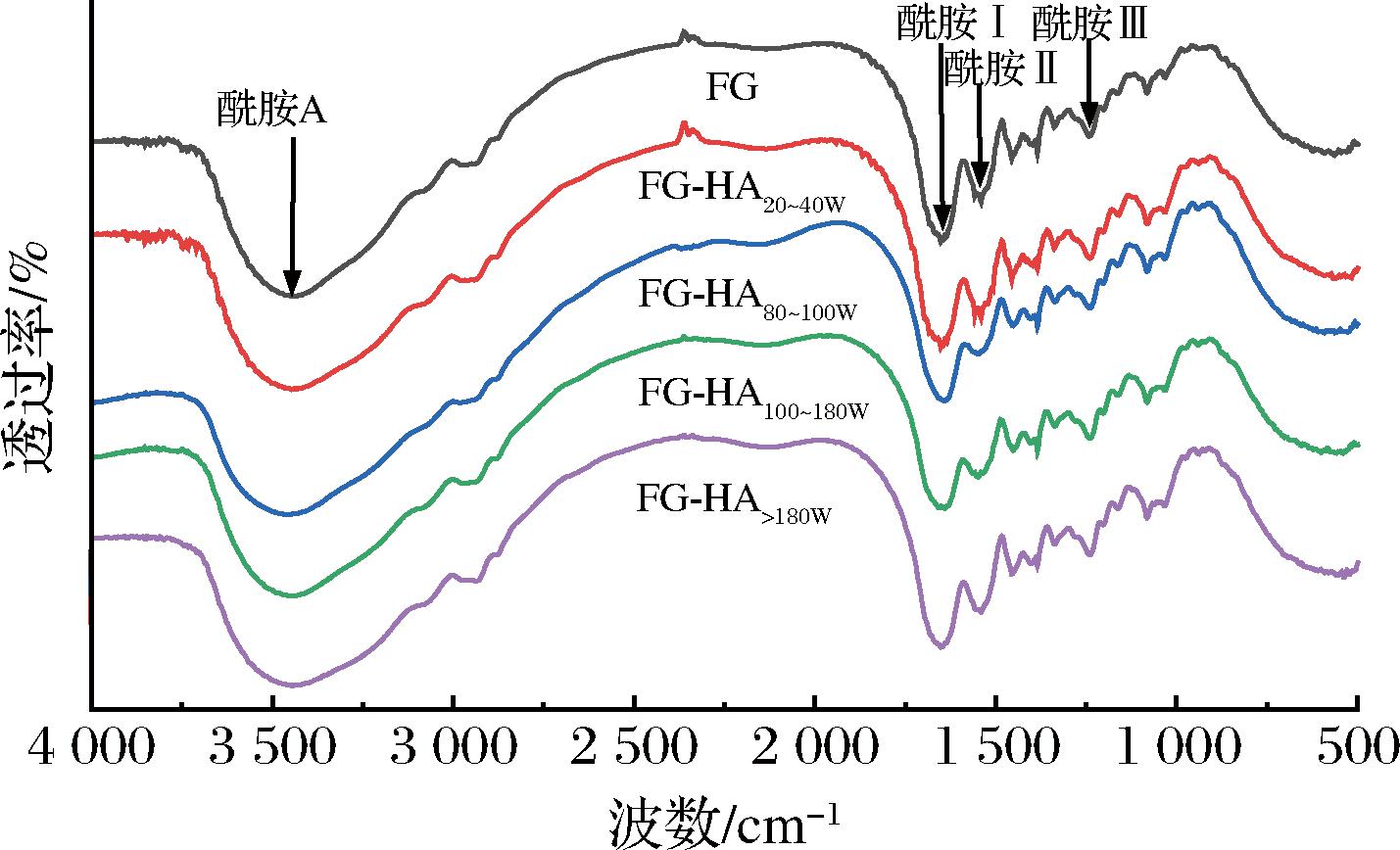
图5 鱼明胶-透明质酸复合胶体的红外光谱图
Fig.5 Infrared spectrum of fish gelatin-hyaluronic acid composite colloid
酰胺A与N—H伸缩振动有关,当—NH基团参与氢键形成时,该吸收峰将会向较低波数移动[26]。由图5可知,对照组鱼明胶(未添加透明质酸)的酰胺A带在3 446.2 cm-1处,添加不同分子质量透明质酸后鱼明胶的酰胺A带波数依次为3 446.2、3 455.8、3 453.9、3 444.2 cm-1。与对照组鱼明胶相比,FG-HA20~40W的酰胺A带无变化,FG-HA80~100W、FG-HA100~180W的酰胺A带向高波数移动,这表明添加分子质量为800~1 000 kDa和1 000~1 800 kDa的透明质酸,复合胶体中氢键减少。SOW等[27]认为,较强的化学键(如静电相互作用等),可以缩短—NH官能团的键长,导致波数增加。因此,当添加的透明质酸分子质量较大时(800~1 000、1 000~1 800 kDa),鱼明胶与透明质酸之间静电引力更加明显,形成的复合物阻碍了鱼明胶分子间氢键的形成。然而,当添加分子质量>1 800 kDa的透明质酸时,FG-HA>180W酰胺A带向低波数稍有移动,说明合胶体中存在氢键。值得说明的是,鱼明胶-透明质酸复合胶体凝胶强度依然低于鱼明胶,可能是因为鱼明胶-透明质酸之间的氢键弱于鱼明胶分子间的氢键。相似地,GADOMSKA等[28]的研究结果显示,透明质酸与牛清蛋白混合制膜时,酰胺A带向低波数移动,两者之间存在氢键,但机械性能却下降。该作者认为透明质酸与牛清蛋白间形成的氢键作用力弱于透明质酸分子间的氢键作用力。
酰胺Ⅰ与C![]() O的伸缩振动有关,是蛋白质具有二级结构的重要吸收峰,可反映明胶的结构[26]。对照组鱼明胶酰胺Ⅰ带在1 652.2 cm-1处,FG-HA20~40W、FG-HA80~100W、FG-HA100~180W、FG-HA>180W的酰胺Ⅰ带波数分别为1 652.2、1 641.4、1 641.1、1 652.2 cm-1,表明不同分子质量的透明质酸对鱼明胶的结构影响不同。酰胺Ⅱ代表N—H弯曲振动或C—N的伸缩振动[5]。对照组鱼明胶酰胺Ⅱ带在1 540.9 cm-1处,FG-HA20~40W、FG-HA80~100W、FG-HA100~180W、FG-HA>180W的波数分别为1 540.9、1 548.6、1 548.9、1 541.1 cm-1。分子质量为800~1 000、1 000~1 800、>1 800 kDa透明质酸的加入,使复合凝胶的酰胺Ⅱ带向高波数移动,说明鱼明胶和透明质酸之间的相互作用增强[19]。此外,各组鱼明胶-透明质酸复合体系与对照组鱼明胶的酰胺Ⅲ相比,波数发生变化,表明透明质酸带负电的羧基基团可能与鱼明胶带正电的酰胺基团相互作用形成聚电解质络合物[19]。
O的伸缩振动有关,是蛋白质具有二级结构的重要吸收峰,可反映明胶的结构[26]。对照组鱼明胶酰胺Ⅰ带在1 652.2 cm-1处,FG-HA20~40W、FG-HA80~100W、FG-HA100~180W、FG-HA>180W的酰胺Ⅰ带波数分别为1 652.2、1 641.4、1 641.1、1 652.2 cm-1,表明不同分子质量的透明质酸对鱼明胶的结构影响不同。酰胺Ⅱ代表N—H弯曲振动或C—N的伸缩振动[5]。对照组鱼明胶酰胺Ⅱ带在1 540.9 cm-1处,FG-HA20~40W、FG-HA80~100W、FG-HA100~180W、FG-HA>180W的波数分别为1 540.9、1 548.6、1 548.9、1 541.1 cm-1。分子质量为800~1 000、1 000~1 800、>1 800 kDa透明质酸的加入,使复合凝胶的酰胺Ⅱ带向高波数移动,说明鱼明胶和透明质酸之间的相互作用增强[19]。此外,各组鱼明胶-透明质酸复合体系与对照组鱼明胶的酰胺Ⅲ相比,波数发生变化,表明透明质酸带负电的羧基基团可能与鱼明胶带正电的酰胺基团相互作用形成聚电解质络合物[19]。
2.6 扫描电镜
透明质酸对鱼明胶微观结构的影响如图6所示,对照组鱼明胶和FG-HA20~40W凝胶微观结构疏松,呈海绵状,并且表面分布有小颗粒和小孔。与对照组相比,当添加的透明质酸分子质量为800~1 000 kDa时,鱼明胶凝胶的微观结构已经发生了明显变化,呈蜂窝状,蜂窝边缘由多孔堆积而成。随着添加的透明质酸分子质量增加,复合凝胶的微观结构变得更加致密、均匀,逐渐呈现多孔网络结构。其中,当添加的透明质酸分子质量>1 800 kDa时,胶体结构呈现更为多孔、致密的网状结构。LI等[29]认为,这种多孔网络结构可能是鱼明胶与多糖之间静电吸引引起的。透明质酸分子质量越大,与鱼明胶之间的静电相互作用越强,形成的网络结构越致密。因此,添加的透明质酸分子质量越大,越有利于鱼明胶与透明质酸彼此聚合,形成更致密、均匀的凝胶网络结构,具有更好的凝胶特性(胶融温度、凝胶温度、表观黏度等)。

a-FG;b-FG-HA20~40W;c-FG-HA80~100W;d-FG-HA100~180W;e-FG-HA>180W
图6 透明质酸对鱼明胶微观结构的影响
Fig.6 Effect of hyaluronic acid on microstructure of fish gelatin
3 结论
本文探讨了不同分子质量(200~400、800~1 000、1 000~1 800、>1 800 kDa)透明质酸对鱼明胶凝胶性能和结构特征的影响。研究结果表明,透明质酸修饰鱼明胶可以提高其凝胶温度和胶融温度。随着透明质酸分子质量的增加,提高效果逐渐明显,当透明质酸分子质量>1 800 kDa 时,鱼明胶凝胶温度和胶融温度分别达到最大值23.32 ℃、32.48 ℃,超过了哺乳动物的凝胶-融胶转变温度。透明质酸分子质量越大,混合体系黏度越高,鱼明胶分子链移动受到限制。同时,两者形成的鱼明胶-透明质酸复合物可阻碍凝胶过程中三股螺旋的形成,导致体系中三股螺旋含量降低,凝胶速率降低,形成的网络结构更加稳定。扫描电镜结果也显示,添加透明质酸时胶体凝胶网络结构趋于致密、均匀,其中FG-HA>180W复合胶体的网络结构最致密。鱼明胶经透明质酸修饰后,其凝胶强度轻微降低,但降低幅度在8.1%以内。与对照组鱼明胶相比,FG-HA20~40W的酰胺A带无变化,FG-HA80~100W、FG-HA100~180W的酰胺A带向高波数移动,FG-HA>180W酰胺A带向低波数稍有移动,但鱼明胶-透明质酸复合胶体凝胶强度依然低于鱼明胶。综上所述,透明质酸修饰能够显著改善鱼明胶的某些凝胶性能(凝胶温度、胶融温度等),使其优于哺乳动物明胶。本文可为扩大鱼明胶的性能提升和应用扩展提供一定的理论基础。此外,经透明质酸改性后的鱼明胶在食品方面的应用有待进一步深入研究。
[1] YANG H J, WANG H F, HUANG M, et al.Repurposing fish waste into gelatin as a potential alternative for mammalian sources:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2):942-963.
[2] 巫丽君, 黄邵丰, 周涛, 等.鱼明胶改性技术及其产品在食品包装中应用研究进展[J].食品与发酵工业, 2022, 48(21):341-348.WU L J, HUANG S F, ZHOU T, et al.Research process on fish gelatin modification technologies and its application in food packaging[J].Food and Fermentation Industries, 2022, 48(21):341-348.
[3] 杨慧娟, 赵巧灵, 王萍亚, 等.鱼明胶替代哺乳动物明胶的研究进展[J].中国食品学报, 2021, 21(10):334-342.YANG H J, ZHAO Q L, WANG P Y, et al.Research progress of fish gelatin as a substitute for mammalian gelatin[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):334-342.
[4] TONG L, KANG X Z, FANG Q, et al.Rheological properties and interactions of fish gelatin-κ-carrageenan polyelectrolyte hydrogels:The effects of salt[J].Journal of Texture Studies, 2022, 53(1):122-132.
[5] 鲁金佩, 丁可盈, 郭雯雯, 等.不同离子多糖对鱼明胶凝胶特性和结构的影响[J].食品与发酵工业, 2021, 47(17):140-147.LU J P, DING K Y, GUO W W, et al.Effects of different ionic polysaccharides on the gel and structural properties of fish gelatin[J].Food and Fermentation Industries, 2021, 47(17):140-147.
[6] FENG J W, TIAN H, CHEN X, et al.Interaction between fish gelatin and tremella polysaccharides from aqueous solutions to complex coacervates:Structure and rheological properties[J].Food Hydrocolloids, 2023, 138:108439.
[7] SHI X D, HUANG J J, WU J L, et al.Fabrication, interaction mechanism, functional properties, and applications of fish gelatin-polysaccharide composites:A review[J].Food Hydrocolloids, 2022, 122:107106.
[8] 黄小忠, 管国强.透明质酸生理功能及其应用研究进展[J].畜牧与饲料科学, 2015, 36(1):21-25.HUANG X Z, GUAN G Q.Research progress of physiological functions and application of hyaluronic acid[J].Animal Husbandry and Feed Science, 2015, 36(1):21-25.
[9] 王钊, 徐康, 王方, 等.经口给予透明质酸的生理功能及其作用机制研究进展[J].食品科学, 2021, 42(23):1-10.WANG Z, XU K, WANG F, et al.Progress in research on physiological function and mechanism of oral hyaluronic acid[J].Food Science, 2021, 42(23):1-10.
[10] 国家卫生健康委. 关于蝉花子实体(人工培植)等15种“三新食品”的公告[EB/OL]. https://zwfw.nhc.gov.cn/kzx/tzgg/xspylsp_225/202101/t20210108_1688.html,2021-01-07/2023-11-21.the National Health Commission. Notice on 15 “Three Novel Foods” including Cicada Flower fruiting bodies(artificial cultured)[EB/OL]. https://zwfw.nhc.gov.cn/kzx/tzgg/xspylsp_225/202101/t20210108_1688.html,2021-01-07/2023-11-21.
[11] SUTARIYA S G, SALUNKE P.Effect of hyaluronic acid on milk properties:Rheology, protein stability, acid and rennet gelation properties[J].Food Hydrocolloids, 2022, 131:107740.
[12] ZAJ![]() C M, KULAWIK P, TKACZEWSKA J, et al.The effect of hyaluronic acid addition on the properties of smoked homogenised sausages[J].Journal of the Science of Food and Agriculture, 2017, 97(8):2316-2326.
C M, KULAWIK P, TKACZEWSKA J, et al.The effect of hyaluronic acid addition on the properties of smoked homogenised sausages[J].Journal of the Science of Food and Agriculture, 2017, 97(8):2316-2326.
[13] WANG N Z, ZHAO X, JIANG Y Q, et al.Enhancing the stability of oil-in-water emulsions by non-covalent interaction between whey protein isolate and hyaluronic acid[J].International Journal of Biological Macromolecules, 2023, 225:1085-1095.
[14] 周海栋, 唐善虎, 李思宁, 等.不同分子质量透明质酸对酸乳品质的影响[J].食品科学, 2023, 44(20):189-197.ZHOU H D, TANG S H, LI S N, et al.Effect of adding hyaluronic acid with various molecular masses on the quality of yogurt[J].Food Science, 2023, 44(20):189-197.
[15] RAZZAK M A, KIM M, KIM H J, et al.Deciphering the interactions of fish gelatine and hyaluronic acid in aqueous solutions[J].International Journal of Biological Macromolecules, 2017, 102:885-892.
[16] HUANG T, TU Z C, WANG H, et al.Pectin and enzyme complex modified fish scales gelatin:Rheological behavior, gel properties and nanostructure[J].Carbohydrate Polymers, 2017, 156:294-302.
[17] HU Z Z, SHA X M, HUANG T, et al.Microbial transglutaminase (MTGase) modified fish gelatin-γ-polyglutamic acid (γ-PGA):Rheological behavior, gelling properties, and structure[J].Food Chemistry, 2021, 348:129093.
[18] LI X F, GUO C, LI P Y, et al.Structural characteristics of gluconic acid δ-lactone induced casein gels as regulated by gellan gum incorporation[J].Food Hydrocolloids, 2021, 120:106897.
[19] CHENG Z H, ZHANG B J, QIAO D L, et al.Addition of κ-carrageenan increases the strength and chewiness of gelatin-based composite gel[J].Food Hydrocolloids, 2022, 128:107565.
[20] 黄涛. 蛋白质修饰技术改善鱼明胶理化特性及其应用的研究[D].南昌:南昌大学, 2018.HUANG T. Study on the improvement of physical and chemical properties of fish gelatin by protein modification technology and its application[D]. Nanchang: Nanchang University, 2018.
[21] YANG X, LI A Q, LI D, et al.Applications of mixed polysaccharide-protein systems in fabricating multi-structures of binary food gels-a review[J].Trends in Food Science &Technology, 2021, 109:197-210.
[22] HUANG T, TU Z C, SHANGGUAN X C, et al.Rheological behavior, emulsifying properties and structural characterization of phosphorylated fish gelatin[J].Food Chemistry, 2018, 246:428-436.
[23] ZHAO H Z, KANG X Z, ZHOU X L, et al.Glycosylation fish gelatin with gum Arabic:Functional and structural properties[J].LWT, 2021, 139:110634.
[24] 李杨, 满慧, 贾亦佳, 等.不同多糖条件下大豆蛋白-绿原酸凝胶特性研究[J].农业机械学报, 2023, 54(5):387-395.LI Y, MAN H, JIA Y J, et al.Characterization of soy protein-chlorogenic acid gels under different polysaccharide conditions[J].Transactions of the Chinese Society for Agricultural Machinery, 2023, 54(5):387-395.
[25] HASSAN N, AHMAD T, ZAIN N M, et al.A fuzzy graph based chemometrics method for gelatin authentication[J].Mathematics, 2020, 8(11):1969.
[26] CAI L Y, FENG J H, REGENSTEIN J, et al.Confectionery gels:Effects of low calorie sweeteners on the rheological properties and microstructure of fish gelatin[J].Food Hydrocolloids, 2017, 67:157-165.
[27] SOW L C, KONG K, YANG H S.Structural modification of fish gelatin by the addition of gellan, κ-carrageenan, and salts mimics the critical physicochemical properties of pork gelatin[J].Journal of Food Science, 2018, 83(5):1280-1291.
[28] GADOMSKA M, MUSIA K, BE
K, BE DOWSKI P, et al.New materials based on molecular interaction between hyaluronic acid and bovine albumin[J].Molecules, 2022, 27(15):4956.
DOWSKI P, et al.New materials based on molecular interaction between hyaluronic acid and bovine albumin[J].Molecules, 2022, 27(15):4956.
[29] LI Y, ZHANG X Y, ZHAO Y, et al.Investigation on complex coacervation between fish skin gelatin from cold-water fish and gum arabic:Phase behavior, thermodynamic, and structural properties[J].Food Research International, 2018, 107:596-604.