木聚糖(xylan,Xyl)作为一种植物多糖,天然来源十分丰富,其研究与开发倍受关注。研究发现木聚糖具有不同的生物活性,如抗氧化、抗肿瘤、益生元等[1-3],因此在食品、医药和化妆品等领域具有潜在的营养和药用价值。大量研究表明,多糖的生物活性很大程度上取决于其分子质量、单糖组成、支化构型、构象以及其他结构特征。因此,虽然木聚糖的生物活性种类繁多,但其固有的结构局限性导致生物活性的表现度较低。目前,已开发许多改性方法和技术来解决木聚糖生物活性较低的难题。例如,LIU等[4]利用物理挤压改性裂解木聚糖的主链引起构象变化,以提高其抗氧化活性;CHEN等[5]通过化学修饰引入羧甲基改变木聚糖的分子链提高其水溶性,并增强其抑菌活性;RAVN等[6]采用酶改性的方法,用阿拉伯呋喃糖苷酶修饰改变阿拉伯木聚糖,改善其益生元活性。近年来,通过对木聚糖结构改性已取得巨大成功,与结构修饰类似,多糖复合物的形成亦可以改变其结构特征,同时改善其生物学特性。
金属离子参与绝大多数的生物过程,在人体生长发育中扮演至关重要的角色,各种衰老疾病、生理障碍都与金属离子在体内的状态、含量和功能有关。据调查显示,儿童、青少年及中老年人缺乏钙铁锌的这一现象趋于普遍化[7-8],而传统的钙铁锌营养补充剂以小分子有机配体金属配合物为主,其水溶性和安全性不如大分子多糖金属配合物。多糖与金属离子的协同作用不仅可以改变多糖的物理性质和增强生物活性,还可以通过降低机体内无机金属元素的含量,减小金属离子的毒性,避免传统的钙铁锌营养补充剂因生物利用率低而造成危害胃肠道健康等副作用。譬如,SHEN等[9]合成以钠盐形式存在的多糖钙配合物,提高其水溶性和稳定性;黄芪多糖铁配合物[10]的补铁效率高、溶解度好,被公认为用于治疗缺铁性贫血的新型铁补充剂;夏枯草多糖锌配合物[11]对人乳腺癌细胞具有高抗增殖活性。尽管多糖金属配合物具有许多突出的生物活性,但其益生元活性的相关研究却很少见。碳源竞争是影响微生物群落组装、多样性、共存、操作和演化的重要因素[12]。有报道称,改良益生元与益生菌,能增强胃肠道应激抵抗力,协同缓解结肠炎[13];益生元和后生元具有协同治疗结肠炎作用[14]。然而,具有益生元潜力的多糖金属配合物对益生菌的协同益生作用的研究仍未有过报道。
因此,本文以木聚糖为试验对象,通过金属络合将Ca2+、Fe3+、Zn2+接枝到Xyl中,改变Xyl的理化性质。为充分发挥木聚糖钙配合物(xylan-calcium complex,Xyl-Ca)、木聚糖铁配合物(xylan-iron complex,Xyl-Fe)、木聚糖锌配合物(xylan-zinc complex,Xyl-Zn)协同益生作用,利用响应面优化设计考察复合木聚糖金属配合物对三联益生菌促增殖效果的影响,确定Xyl-Ca、Xyl-Fe、Xyl-Zn的最佳质量配比,以期为开发新的钙铁锌膳食补充剂、治疗胃肠道疾病的药物材料提供潜在的途径。
1 材料与方法
1.1 材料与试剂
木聚糖,中国科学院广西植物研究所[15];葡萄糖(glucose,Glu)、半乳糖(galactose,Gal)、鼠李糖(rhamnose,Rha)、甘露糖(mannose,Man)、岩藻糖(fucose,Fuc)、木糖(xylose,Xylo)、阿拉伯糖(arabinose,Ara)、葡萄糖醛酸(glucuronic acid,GluA)、半乳糖醛酸(galacturonic acid,GalA)标准品均为色谱纯,上海源叶生物科技有限公司;葡聚糖标准品(分子质量:20、40、70、150、250、500及2 000 kDa)为色谱纯,美国Sigma-Aldrich公司;钙标准溶液、铁标准溶液、锌标准溶液均为优级纯,上海阿拉丁生化科技有限公司;三联活菌片(含长型双歧杆菌、保加利亚乳杆菌和嗜热链球菌),内蒙古双奇药业股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HKYT-799型电感耦合等离子体发射光谱仪,北京华科易通分析仪器有限公司;LC-20A型高效液相色谱仪,日本Shimadzu公司;KQ-400KDE型立式压力蒸汽灭菌锅,上海申安医疗器械有限公司;LRH-250-Z型振荡培养箱,韶关市泰宏医疗器械有限公司;UV760CRT型紫外可见分光光度计,上海傲谱分析仪器有限公司;HH-S2型数显恒温水浴锅,金坛市医疗仪器有限公司;ALpHA1-2LD型冷冻干燥仪,德国Martin Christ公司;Zetasizer Nano ZS90型激光粒度仪,河北神威药业集团有限公司。
1.3 实验方法
1.3.1 木聚糖及其金属配合物的制备
Xyl-Ca的制备方法及工艺优化部分正在投稿中,此处作简要描述:将200 mg Xyl与1.1 g无水氯化钙(Xyl∶CaCl2=1∶5.5)溶于100 mL蒸馏水中,在pH=10,60 ℃水浴的条件下,搅拌反应90 min。反应结束后,醇沉,离心,取上层清液,流水透析,冷冻干燥,得Xyl-Ca。
Xyl-Fe按照团队前期探索的方法制备:将120 mg Xyl与40 mg柠檬酸钠(Xyl∶柠檬酸钠=3∶1)溶于100 mL蒸馏水中,在反应体系pH=8的条件下,缓慢加入2.0 mol/L FeCl3溶液,直至棕红色沉淀生成,70 ℃水浴反应1 h,离心,取上层清液,流水透析,冷冻干燥,得Xyl-Fe。
Xyl-Zn按照团队前期探索的方法制备:将200 mg Xyl与176 mg ZnSO4·7H2O(Xyl∶Zn=5∶1)溶于100 mL蒸馏水中,在反应体系pH=6的条件下,60 ℃水浴反应2 h,流水透析,冷冻干燥,得Xyl-Zn。
1.3.2 木聚糖及其金属配合物的理化性质
1.3.2.1 钙、铁、锌含量测定
参照GB 5009.268—2016《食品中多元素的测定》第二法 电感耦合等离子体发射光谱法(inductively coupled plasma-optical emission spectroscopy,ICP-OES),检测木聚糖及其金属配合物的钙、铁、锌含量。
标准曲线:精确吸取适量Ca、Fe、Zn标准溶液(1 000 μg/mL),用HNO3溶液(50 mL HNO3加入950 mL去离子水中)逐级稀释,分别配制成0.00、1.00和10.00 mg/L的Ca、Fe、Zn标准工作溶液,后续用于标准曲线的绘制。
样品制备:准确称取100 mg多糖样品于坩埚中,置于550 ℃的马弗炉中灰化6~8 h,冷却,加入1 mL HNO3溶液(HNO3与H2O体积比1∶1)溶解,用去离子水定容至100 mL,测定木聚糖及其金属配合物中的钙、铁、锌含量。每次测定均为3份。
上机检测工作参数:射频功率1.2 kW,射频频率40.68 MHz,等离子气流量13.0 L/min,载气流量0.6 L/min,光栅刻线密度4 320线/mm,出射、入射狭缝20、25 μm;扫描积分时间30 ms,高压稳定时间100 ms。
1.3.2.2 灰分含量测定
参照2020年版《中国药典》总灰分测定法测定木聚糖及其金属配合物的总灰分含量。
将坩埚炽灼至恒重,标号、记录每个坩埚在室温下的质量。准确称取0.10 g多糖样品于坩埚中,马弗炉缓慢升温至550 ℃,煅烧10~12 h,至样品呈白灰状(表明样品已完全灰化),冷却至室温。记录盛有残渣的坩埚质量,各样品平行测定3次。木聚糖及其金属配合物的总灰分含量的计算如公式(1)所示:
总灰分含量![]()
(1)
式中:M1为未煅烧前的样品和坩埚总质量,mg;M2为完全灰化后的样品和坩埚总质量,mg。
1.3.2.3 基本化学成分测定
总糖含量:采用苯酚-硫酸法[16]进行测定;蛋白质含量:采用考马斯亮蓝法[17]进行测定;糖醛酸含量:采用间羟基联苯法[18]进行测定;还原糖含量:采用3,5-二硝基水杨酸法[19]进行测定。
1.3.2.4 分子质量测定
参照SUN等[20]的方法稍作修改,测定木聚糖及其金属配合物的分子质量。称取2 mg多糖样品溶于1 mL流动相中,静置12 h,摇匀后使用0.22 μm的滤膜进行过滤,置于液相进样瓶中,等待检测。以分子质量大小不同的葡聚糖作为标准品。
上机检测:TSK gel G-4000 SWXL凝胶色谱柱(内径7.8 mm×长度30 cm,粒度5 μm),RID-20A示差折光检测器,柱温40 ℃,流动相0.2 mol/L NaCl,流速0.6 mL/min,进样量50 μL。
1.3.2.5 单糖组成测定
参照HUSSAIN等[21]的方法稍作修改,对木聚糖及其金属配合物的单糖组成进行分析。称取2 mg多糖样品,加入1 mL 4 mol/L三氟乙酸,在121 ℃下酸解6 h。在45 ℃下,加入少量的无水乙醇,减压蒸发除去多余的三氟乙酸,重复3~5次,直至残留的三氟乙酸被完全蒸除。样品酸水解完成后,在干燥的样品中加入0.5 mL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP)和等量0.3 mol/L NaOH,70 ℃水浴反应30 min,冷却,加入0.5 mL 0.3 mol/L HCl和等量超纯水,充分混匀。加入2 mL三氯甲烷萃取除去PMP,水层使用0.22 μm的滤膜进行过滤。取20 μL置于液相进样瓶中,采用Shimadzu高效液相色谱仪(LC-20ATvp泵,SPD-20AVD紫外光检测器)进行检测。以葡萄糖、半乳糖、鼠李糖、甘露糖、岩藻糖、木糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸作为标准品。
1.3.2.6 溶解特性测定
粒径测定:将10 mg的多糖样品溶于5 mL蒸馏水中,混匀后的多糖水溶液置于石英四通光比色皿,在25 ℃下,通过纳米粒度仪检测溶液粒径。
黏度测定[20]:在25 ℃下,以蒸馏水为溶剂,使用乌氏黏度计测定多糖样品的特性黏度η。根据公式(2)计算多糖样品的黏度值:
(2)
式中:η为多糖黏度值,mL/g;t1为样品平均流出时间,s;t0为蒸馏水留出时间,s;C为测试溶液的质量浓度,g/mL。
1.3.3 协同益生作用
1.3.3.1 三联益生菌活化
MRS液体培养基的配制(g/L):蛋白胨10.0,牛肉膏粉10.0,酵母粉5.0,乙酸钠5.0,柠檬酸三铵2.0,吐温-80 1.0,磷酸氢二钾2.0,硫酸镁0.58,硫酸锰0.25,葡萄糖20.0(无碳培养基不加),加热溶解,调整pH值为7.0,于121 ℃下高温灭菌20 min。
三联活菌片的菌株活化:在无菌操作台中,将0.5 g活菌片碾碎成粉末,接种到200 mL MRS液体培养基中进行活化,37 ℃恒温培养48 h后,3 500 r/min离心10 min,弃去上清液,用0.9%无菌生理盐水洗涤沉淀数次(去除片剂中含有的碳源,如乳糖、葡萄糖和低聚果糖等),最后加入10 mL 0.9%无菌生理盐水重悬菌体制成菌悬液备用。
菌落总数标准曲线的绘制:将菌悬液分别稀释(以质量浓度为0.9%无菌生理盐水作为稀释液)为1∶1、1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000和1∶1 000 000七个稀释度,采用血球计数板计数益生菌个数,并测定各稀释液在λ=600 nm处的OD值,平行测定3次。益生菌个数为横坐标,OD600nm为纵坐标,绘制三联活菌片的菌落总数标准曲线。
1.3.3.2 单因素试验设计
空白对照组、Xyl-Ca、Xyl-Fe和Xyl-Zn组,每组均设计5个质量浓度:10、15、20、25、30 mg/mL,用Xyl补齐总糖含量(消除因总糖浓度不同而引起的实验误差),使总糖浓度为30 mg/mL。
将菌株浓度为1×108 CFU/mL的菌悬液,以4.0%(体积分数)的接种量,分别接种至含不同碳源的培养基中,37 ℃培养48 h后,测定各培养液在λ=600 nm处的OD值,每个样品重复测定3次。
1.3.3.3 响应面试验设计
在单因素试验结果的基础上,选择20、25、30 mg/mL 3个水平,确定复合木聚糖金属配合物的总糖质量浓度为30 mg/mL。以三联益生菌株在不同多糖配比下培养48 h后的OD600nm为响应值,Xyl-Ca(A)、Xyl-Fe(B)、Xyl-Zn(C)为自变量,按照Box-Behnken响应面试验设计原理,进行三因素三水平的响应面实验设计,优化复合木聚糖金属配合物的最佳配比。表1所示为试验的因素与水平编码。
表1 响应面试验因素与水平的设计
Table 1 Design of response surface test factors and levels

水平因素A(Xyl-Ca)/(mg/mL)B(Xyl-Fe)/(mg/mL)C(Xyl-Zn)/(mg/mL)-120202002525251303030
1.4 数据分析
所有数据均为3次重复试验的平均值,表示为平均值±标准差(X±SD)。采用SPSS Statistics 26软件进行单因素方差分析,使用Origin 2021软件作图,利用Design-Expert 13.0.1软件进行响应面试验设计与数据分析。
2 结果与分析
2.1 钙、铁、锌及灰分含量分析
通过电感耦合等离子体发射光谱技术测定木聚糖及其金属配合物中的金属元素含量。标准曲线根据浓度分别为0.00、1.00、10.00 mg/L的标准曲线点进行绘制,得到钙、铁、锌3种金属元素标准曲线的相关参数(表2)。木聚糖及其金属配合物的金属元素含量及灰分含量列于表3。Xyl中Ca、Fe、Zn含量极低,Xyl-Ca中Ca含量为(7.57±0.03) mg/g,Xyl-Fe中Fe含量为(6.26±0.06) mg/g,Xyl-Zn中Zn含量为(3.21±0.02) mg/g,说明Xyl与Ca、Fe、Zn已发生络合反应。其中,Xyl-Ca和Xyl-Fe中络合的金属元素含量远高于Xyl-Zn,出现这种差异的原因可能是Xyl与不同金属离子的结合能力不同。多糖样品的灰分主要是由无机元素或氧化物组成,Xyl与金属元素络合后,其金属元素含量增大,因此木聚糖金属配合物的灰分含量高于Xyl。总灰分含量大小排序为:Xyl-Fe[(12.83±0.85)%]>Xyl-Ca[(8.13±0.80)%]>Xyl-Zn[(7.4±0.45)%]>Xyl[(0.8±0.08)%]。
表2 金属元素标准曲线
Table 2 Standard curve of metallic elements
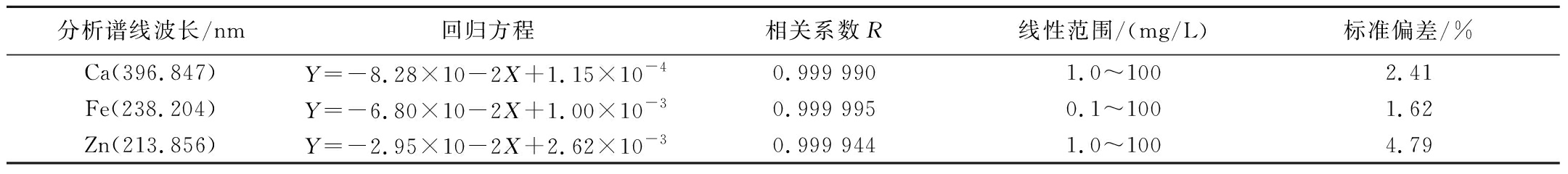
分析谱线波长/nm回归方程相关系数R线性范围/(mg/L)标准偏差/%Ca(396.847)Y=-8.28×10-2X+1.15×10-40.999 9901.0~1002.41Fe(238.204)Y=-6.80×10-2X+1.00×10-30.999 9950.1~1001.62Zn(213.856)Y=-2.95×10-2X+2.62×10-30.999 9441.0~1004.79
表3 木聚糖及其金属配合物的金属和灰分含量
Table 3 Metal and ash content of xylan and its metal complexes

指标XylXyl-CaXyl-FeXyl-ZnCa含量/(mg/g)0.003 1±0.01b7.570 3±0.03a0.017 8±0.01b0.016 6±0.00bFe含量/(mg/g)0.000 8±0.01b0.005 1±0.00b6.256 1±0.06a0.000 7±0.00bZn含量/(mg/g)0.000 4±0.00b0.002 3±0.00b0.004 1±0.00b3.206 2±0.02a总灰分含量/% 0.80±0.08c 8.13±0.80b 12.83±0.85a 7.40±0.45b
注:同行不同小写字母表示差异显著(P<0.05)。
2.2 基本化学成分分析
总糖、蛋白质、糖醛酸和还原糖的标准曲线回归方程及其相关系数如表4所示。表5为木聚糖及其金属配合物的基本化学组成。Xyl的总糖含量为(83.64±0.60)%,而蛋白质、糖醛酸和还原糖含量均较低。经Ca、Fe、Zn修饰后,3种木聚糖金属配合物的总糖含量显著降低,分别为Xyl-Ca(44.92±0.92)%、Xyl-Fe(35.32±0.80)%、Xyl-Zn(34.93±0.77)%,蛋白质、糖醛酸和还原糖含量则发生不同程度的改变。尽管XIAN等[22]报告显示经铁螯合的海藻硫酸化多糖,其总糖含量与未螯合前的多糖无统计学差异,但其蛋白质含量较未螯合前的多糖显著降低。可见多糖经金属元素络合的化学组成变化与多糖品种、来源以及络合方式等都有密切联系。
表4 理化性质标准曲线
Table 4 Standard curve of physicochemical properties

基本化学成分标准曲线相关系数总糖Y=14.446 0 X+0.025 80.998 9蛋白质Y=0.522 4 X+0.027 90.990 2糖醛酸Y=5.014 7X-0.004 10.998 3还原糖Y=0.710 8X-0.018 30.995 8
表5 木聚糖及其金属配合物的化学成分
Table 5 Chemical composition of xylan and its metal complexes

指标多糖样品XylXyl-CaXyl-FeXyl-Zn总糖含量/%83.64±0.60a44.92±0.92b35.32±0.80c34.93±0.77c蛋白质含量/%1.55±0.16a0.78±0.16b0.40±0.27b0.53±0.32b糖醛酸含量/%4.14±0.34a3.21±0.32b3.48±0.41ab3.54±0.25ab还原糖含量/%2.09±0.54c2.86±0.51bc6.75±0.11a3.65±0.07b
注:同行不同小写字母表示差异显著(P<0.05)。
2.3 分子质量和单糖组成分析
表6所示,Xyl、Xyl-Ca、Xyl-Fe和Xyl-Zn的分子质量分别为1 449.97、1 567.96、1 568.66和1 510.17 kDa,表明Ca、Fe、Zn与Xyl络合后,均可提高Xyl的分子质量,这一结果与FENG等[23]报道Zn2+螯合可以提高浒苔多糖分子质量的结果相符。木聚糖及其金属配合物主要由木糖、阿拉伯糖、葡萄糖和半乳糖组成,Xyl和Xyl-Ca含量最高为木糖,其比例分别为85.51%和51.77%,Xyl-Fe和Xyl-Zn含量最高为阿拉伯糖,其比例分别为41.20%和53.10%。Xyl被修饰成Xyl-Ca、XyL-Fe、Xyl-Zn后,木糖含量均下降,阿拉伯糖、葡萄糖和半乳糖的含量均上升,这可能是因为金属离子与Xyl侧链取代基的相互作用,导致单糖组成发生变化。CHEN等[24]研究得出益生元作用可能与多糖分子质量、链构象等结构特性有关的结论,WANG等[25]报道多糖的单糖组成会影响其益生元作用,且益生元多糖通常由半乳糖、葡萄糖、果糖和木糖组成,这与LEE等[26]发现由葡萄糖、木糖、果糖和阿拉伯糖组成的开心果壳多糖显示出可观益生元能力的结果类似,这些结果均揭示了木聚糖及其金属配合物作为益生元多糖的潜力。
表6 木聚糖及其金属配合物的分子质量和单糖组成
Table 6 Molecular weight and monosaccharide composition of xylan and its metal complexes

指标多糖样品XylXyl-CaXyl-FeXyl-Zn分子质量/kDa1 449.971 567.961 568.661 510.17Xyl/%85.5151.7731.3938.35Ara/%12.5137.6141.2053.10Glu/%1.249.6417.886.67Gal/%0.730.989.541.88
注:未列出的单糖检出结果低于方法的最低限值。
2.4 溶解特性分析
Xyl、Xyl-Ca、Xyl-Fe和Xyl-Zn的粒径大小如图1所示,分别为(4.02±0.48)、(8.46±0.42)、(12.86±0.15)和(6.24±0.29) nm,木聚糖金属配合物的粒径较大可能是由于多糖与金属离子交联的增加所致[23]。多糖粒径越大,粒子之间的相互作用力相对较大,液体流动性变小,黏度也随之增大[27],木聚糖及其金属配合物的黏度大小与粒径大小呈正相关,其黏度大小分别为:Xyl(8.63±0.63) mL/g、Xyl-Ca(26.10±1.54) mL/g、Xyl-Fe(38.16±1.20) mL/g、Xyl-Zn(18.80±1.40) mL/g。KANEKIYO等[28]研究发现,多糖溶液的分子质量越大,其特性黏度也越大,结合分子质量分析结果可知,木聚糖及其金属配合物的分子质量、粒径和黏度大小排序均为:Xyl-Fe>Xyl-Ca>Xyl-Zn>Xyl。

图1 木聚糖及其金属配合物的粒径及黏度
Fig.1 Particle size and viscosity of xylan and its metal complexes
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.5 单一碳源对三联益生菌的增殖作用
三联益生菌活化后,以益生菌个数为横坐标,OD600nm为纵坐标,绘制得到菌落总数的标准曲线为:Y=2×10-13X+0.257,R2=0.993 8。
2.5.1 Xyl-Ca对三联益生菌增殖作用的影响
Xyl-Ca对三联益生菌增殖作用的影响见图2。多糖作为益生元,可以被益生菌利用和发酵[29]。部分多糖在一定的多糖浓度范围内与益生菌生长具有正相关关系[30],在Xyl-Ca质量浓度为10~25 mg/mL,不添加Xyl-Fe和Xyl-Zn的条件下,培养液OD值随着Xyl-Ca浓度的增大呈明显上升趋势,由0.51±0.02逐渐增大至0.88±0.06。多糖浓度较高时,益生菌生长对多糖浓度的依赖性消失,Xyl-Ca质量浓度增大至25 mg/mL后,OD值的增长趋于平稳,质量浓度为25 mg/mL的OD值(0.88±0.06)与30 mg/mL的OD值(0.90±0.02)无显著差异(P>0.05),原因可能是多糖浓度过高引起渗透压的增加和代谢物的积累,从而导致Xyl-Ca的促增殖作用减弱。因此在响应面试验中,确定Xyl-Ca的配比质量浓度为20、25和30 mg/mL。
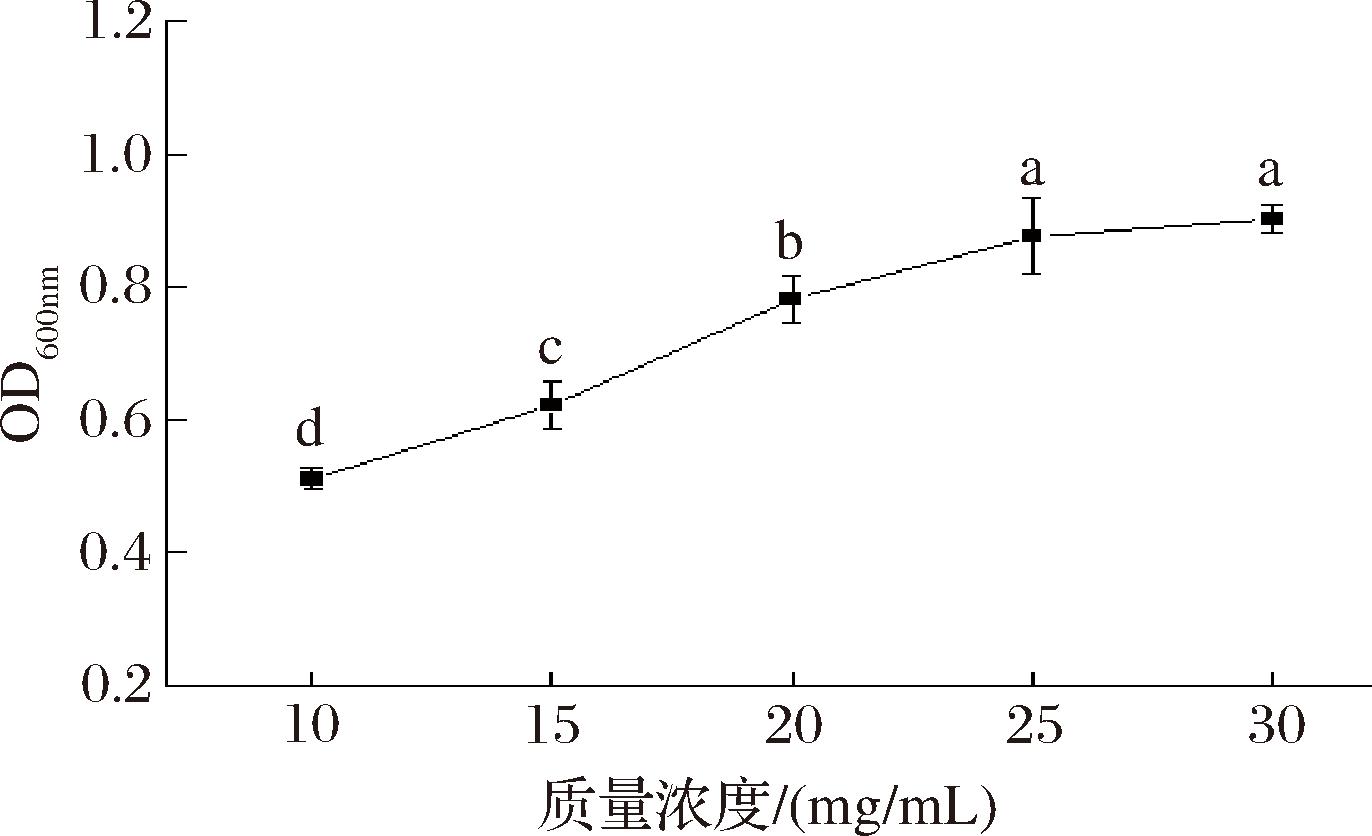
图2 Xyl-Ca对三联益生菌增殖作用的影响
Fig.2 Effect of Xyl-Ca on the proliferation of triple probiotics
2.5.2 Xyl-Fe对三联益生菌增殖作用的影响
Xyl-Fe对三联益生菌增殖作用的影响见图3。从整体上看,随着Xyl-Fe质量浓度从10 mg/mL增加到30 mg/mL,OD值的变化呈先升后降的趋势。在Xyl-Fe质量浓度为25 mg/mL时,OD值达到最大,为0.98±0.02。培养基中碳源添加量过少,益生菌增殖所需的营养不足,导致益生菌生长缓慢;培养基中多糖浓度过高,培养液的渗透压过大,引起抑制益生菌增殖的现象。因此选取Xyl-Fe配比质量浓度为20、25、30 mg/mL作为响应面因素考察水平。

图3 Xyl-Fe对三联益生菌增殖作用的影响
Fig.3 Effect of Xyl-Fe on the proliferation of triple probiotics
2.5.3 Xyl-Zn对三联益生菌增殖作用的影响
Xyl-Zn对三联益生菌增殖作用的影响见图4。已有临床研究表明,益生菌和锌补充剂可以改变肠道菌群丰富度。由图4可知,随着Xyl-Zn浓度的增大,培养液的OD值呈上升趋势,从0.65±0.02上升至1.00±0.04。HUANG等[31]研究发现浓度为5~20 mg/mL的龙眼多糖显示出逐渐增加的益生元活性,与Xyl-Zn在质量浓度为10~20 mg/mL时的促增殖效果相符,且Xyl-Zn在质量浓度为20~30 mg/mL时,对益生菌的生长仍发挥有效作用,培养液的OD值有显著提升(P>0.05)。因此,综合考虑后,选择20、25和30 mg/mL的Xyl-Zn配比质量浓度作为后续响应面试验的3个水平。

图4 Xyl-Zn对三联益生菌增殖作用的影响
Fig.4 Effect of Xyl-Zn on the proliferation of triple probiotics
2.6 响应面优化复合木聚糖金属配合物的最佳配比
2.6.1 响应面试验设计及结果
Xyl-Ca(A)、Xyl-Fe(B)和Xyl-Zn(C)的浓度配比是三联益生菌增殖情况的主要影响因素。根据单因素试验确定的最优水平范围,以培养液的OD值为响应值,采用Box-Behnken试验设计,得到17个试验组三因素三水平的优化模型,按照试验方案中不同浓度的多糖配比进行试验,每组平行重复3次,得到的试验结果见表7。
表7 响应面试验设计方案及结果
Table 7 Experimental design scheme and results of response surface

试验号A(Xyl-Ca)B(Xyl-Fe)C(Xyl-Zn)多糖质量比OD600nm110-1A1∶B1∶C1=6∶5∶40.939 62000A2∶B2∶C2=1∶1∶11.381 33000A3∶B3∶C3=1∶1∶11.198 64000A4∶B4∶C4=1∶1∶11.195 35-110A5∶B5∶C5=4∶6∶51.028 56000A6∶B6∶C6=1∶1∶11.366 57-1-10A7∶B7∶C7=4∶4∶50.579 28110A8∶B8∶C8=6∶6∶51.164 39011A9∶B9∶C9=5∶6∶61.032 910000A10∶B10∶C10=1∶1∶11.242 211101A11∶B11∶C11=6∶5∶51.109 8120-11A12∶B12∶C12=5∶4∶60.937 413-101A13∶B13∶C13=4∶5∶60.972 71401-1A14∶B14∶C14=5∶6∶40.895 7151-10A15∶B15∶C15=6∶4∶50.978 116-10-1A16∶B16∶C16=4∶5∶40.551 6170-1-1A17∶B17∶C17=5∶4∶40.466 9
2.6.2 响应面回归模型的建立及方差分析
根据表7结果,使用Design-Expert 13.0.1软件对试验数据进行二次多项式回归拟合,以OD600nm作为响应值,得到二次多项回归方程:OD600nm=1.28+0.132 5A+0.145 0B+0.149 9C-0.065 8AB-0.062 7AC-0.083 3BC-0.139 5A2-0.199 7B2-0.243 8C2。
回归分析和方差分析可以帮助拟合模型并检验试验意义。由表8可以看出,回归模型的F值为24.89,P值为0.000 2(P<0.01),表明该模型具有较高的显著性。失拟项的P值为0.975 9(P>0.05),从而证实了模型的有效性。决定系数R2用于解释模型的数据变异性比例,该模型的R2=0.969 7和![]() 相近,且均大于0.9,表示回归方程具有可靠性。此外,变异系数(C.V.)为7.00%,数值较低,表明该模型具有高精度和可重复性。模型中一次项A、B、C和二次项A2、B2、C2对三联益生菌培养液OD值的影响极显著(P<0.01),交互项BC对三联益生菌培养液OD值的影响显著(P<0.05),交互项AB和AC对三联益生菌培养液OD值的影响不显著(P>0.05)。
相近,且均大于0.9,表示回归方程具有可靠性。此外,变异系数(C.V.)为7.00%,数值较低,表明该模型具有高精度和可重复性。模型中一次项A、B、C和二次项A2、B2、C2对三联益生菌培养液OD值的影响极显著(P<0.01),交互项BC对三联益生菌培养液OD值的影响显著(P<0.05),交互项AB和AC对三联益生菌培养液OD值的影响不显著(P>0.05)。
表8 回归模型的建立及方差分析
Table 8 Establishment of regression models and analysis of variance

方差来源平方和自由度均方F值P值模型1.1090.122 724.890.000 2**A(Xyl-Ca)0.140 410.140 428.480.001 1**B(Xyl-Fe)0.168 110.168 134.100.000 6**C(Xyl-Zn)0.179 710.179 736.450.000 5**AB0.017 310.017 33.510.103 2AC0.015 710.015 73.190.117 1BC0.027 810.027 85.630.049 4*A20.082 010.082 016.630.004 7**B20.167 910.167 934.060.000 6**C20.250 310.250 350.770.000 2**残差0.034 570.004 9失拟项0.001 630.000 50.064 50.975 9纯误差0.032 940.008 2总离差1.1416R2=0.969 7R2Adj=0.930 7R2Pre=0.932 4C.V.%=7.00
注:*表示影响显著P<0.05;**表示影响极显著P<0.01。
根据F值大小可以得出影响三联益生菌培养液响应值的因素顺序为:Xyl-Zn(36.45)>Xyl-Fe(34.10)>Xyl-Ca(28.48)。
2.6.3 各因素两两交互作用分析
以三维响应面曲线图和二维等高线图作为因变量之间的关系说明,曲线图表面的陡峭程度表示变量之间的交互作用程度是否显著,曲面图陡峭程度越高,等高线图越倾向椭圆形,曲面图投射到等高图的等高线数量越多,说明变量之间的相互作用越显著。由图5可知,随着Xyl-Ca和Xyl-Fe配比浓度的增加,三联益生菌培养液OD值随之增大,在Xyl-Ca和Xyl-Fe配比浓度超过一定值后,增加缓慢并呈现平滑趋势;随着Xyl-Ca和Xyl-Zn配比浓度的增加,三联益生菌培养液OD值呈现先增大而后趋于平缓趋势,可知交互项AB和AC对三联益生菌增殖作用无显著影响。随着Xyl-Fe和Xyl-Zn配比浓度的增加,三联益生菌培养液OD值呈先升高后降低的趋势,曲线图陡峭、等高线图更接近椭圆,且等高线图投射的等高线数量较多,可知交互项BC的交互作用显著,与统计分析数据结果一致。

图5 各因素交互作用对三联益生菌培养液OD值的影响的响应面图和等高图
Fig.5 Response surface and contour plots of the effect of the interaction of various factors on the OD value of triple probiotic culture
2.6.4 木聚糖金属配合物最佳配比的确定与验证
根据响应面回归方程,预测出复合木聚糖金属配合物对三联益生菌促增殖作用的最佳质量配比为:Xyl-Ca∶Xyl-Fe∶Xyl-Zn=22.14∶24.17∶27.85,该配比拟合得到的OD600nm值为1.153 9±0.07。为了试验的实际可操作性,将其进行调整,即当总糖含量为30 mg/mL时,加入的复合木聚糖金属配合物为:8.9 mg Xyl-Ca,9.8 mg Xyl-Fe,11.3 mg Xyl-Zn,在此配比下验证试验,得实际OD600nm值为1.125 5±0.08,与预测值吻合较好,进一步验证了该模型的准确性和可靠性。
3 结论
本研究通过与钙、铁、锌螯合改变木聚糖的结构构型,制备Xyl-Ca、Xyl-Fe和Xyl-Zn,探究其理化性质,并在单因素试验考察下,采用响应面优化法优化复合木聚糖金属配合物对三联益生菌的增殖作用。3种木聚糖金属配合物显示出的不同化学组成和溶解特性等理化性质,可能是引起益生元活性差异的原因,也可能是影响复合木聚糖金属配合物协同促增殖作用的主要因素,通过响应面法得到复合木聚糖金属配合物影响三联益生菌培养液OD值的最佳质量配比为:Xyl-Ca∶Xyl-Fe∶Xyl-Zn=8.9∶9.8∶11.3。综上所述,通过钙、铁、锌络合可以改变木聚糖的理化性质,且得到的Xyl-Ca、Xyl-Fe、Xyl-Zn作为益生元多糖,确定最佳质量配比后,在一定程度上能提高其益生元活性。木聚糖金属配合物可以作为人体必需金属元素补充剂及治疗肠道疾病的新型生物活性分子进行探索,本文为后续研究和应用提供了相应的理论参考。
[1] DENG Y N, LIU Q, DANG T T, et al.Preparation, structural characterization and bioactivity of 4-O-Methylglucuronoxylan from Artemisia sphaerocephala Krasch[J].Carbohydrate Polymers, 2019, 222:115009.
[2] PAESANI C, DEGANO A L, SALVUCCI E, et al.Soluble arabinoxylans extracted from soft and hard wheat show a differential prebiotic effect in vitro and in vivo[J].Journal of Cereal Science, 2020, 93:102956.
[3] MAITY G N, MAITY P, DASGUPTA A, et al.Structural and antioxidant studies of a new arabinoxylan from green stem Andrographis paniculata (Kalmegh)[J].Carbohydrate Polymers, 2019, 212:297-303.
[4] LIU H M, WEI Y N, LI H Y, et al.Structural changes of polysaccharides isolated from corn bran by hydrothermal treatment after twin-screw extrusion[J].BioResources, 2020, 15(1):1323-1337.
[5] CHEN T, LIU H T, LIU J, et al.Carboxymethylation of polysaccharide isolated from Alkaline Peroxide Mechanical Pulping (APMP) waste liquor and its bioactivity[J].International Journal of Biological Macromolecules, 2021, 181:211-220.
[6] RAVN J L, GLITSØ V, PETTERSSON D, et al.Combined endo-β-1,4-xylanase and α-L-arabinofuranosidase increases butyrate concentration during broiler cecal fermentation of maize glucurono-arabinoxylan[J].Animal Feed Science and Technology, 2018, 236:159-169.
[7] S NCHEZ-PIMIENTA T G, L
NCHEZ-PIMIENTA T G, L PEZ-OLMEDO N, RODR
PEZ-OLMEDO N, RODR GUEZ-RAM
GUEZ-RAM REZ S, et al.High prevalence of inadequate calcium and iron intakes by mexican population groups as assessed by 24-hour recalls[J].Journal of Nutrition, 2016, 146(9):1874-1880.
REZ S, et al.High prevalence of inadequate calcium and iron intakes by mexican population groups as assessed by 24-hour recalls[J].Journal of Nutrition, 2016, 146(9):1874-1880.
[8] ZHANG C, GAO Z, HU C L, et al.Antioxidant, antibacterial and anti-aging activities of intracellular zinc polysaccharides from Grifola frondosa SH-05[J].International Journal of Biological Macromolecules, 2017, 95:778-787.
[9] SHEN Q S, ZHANG C H, MO H Z, et al.Fabrication of chondroitin sulfate calcium complex and its chondrocyte proliferation in vitro[J].Carbohydrate Polymers, 2021, 254:117282.
[10] JIA N, QIAO H R, ZHU W, et al.Antioxidant, immunomodulatory, oxidative stress inhibitory and iron supplementation effect of Astragalus membranaceus polysaccharide-iron (III) complex on iron-deficiency anemia mouse model[J].International Journal of Biological Macromolecules, 2019, 132:213-221.
[11] LI C, HUANG Q, XIAO J, et al.Preparation of Prunella vulgaris polysaccharide-zinc complex and its antiproliferative activity in HepG2 cells[J].International Journal of Biological Macromolecules, 2016, 91:671-679.
[12] YANG C L, DONG Y, FRIMAN V P, et al.Carbon resource richness shapes bacterial competitive interactions by alleviating growth-antibiosis trade-off[J].Functional Ecology, 2019, 33(5):868-875.
[13] XIE A Q, JI H H, LIU Z Y, et al.Modified prebiotic-based “Shield” armed probiotics with enhanced resistance of gastrointestinal stresses and prolonged intestinal retention for synergistic alleviation of colitis[J].ACS Nano, 2023, 17(15):14775-14791.
[14] YANG K L, WANG X C, HUANG R K, et al.Prebiotics and postbiotics synergistic delivery microcapsules from microfluidics for treating colitis[J].Advanced Science, 2022, 9(16):2104089.
[15] WANG L, QIN X X, MIAO X Y, et al.Synthesis and nondestructive detailed structure characterization of carboxymethyl xylan from bagasse[J].Journal of Carbohydrate Chemistry, 2020, 39(4):131-144.
[16] YUE F F, ZHANG J R, XU J X, et al.Effects of monosaccharide composition on quantitative analysis of total sugar content by phenol-sulfuric acid method[J].Frontiers in Nutrition, 2022, 9:963318.
[17] SAIDFERN NDEZ S, GONZ
NDEZ S, GONZ LEZ-GARZA M T, MATA-C
LEZ-GARZA M T, MATA-C RDENAS B D, et al.A multipurpose solid-phase method for protein determination with coomassie brilliant blue G-250[J].Analytical Biochemistry, 1990, 191(1):119-126.
RDENAS B D, et al.A multipurpose solid-phase method for protein determination with coomassie brilliant blue G-250[J].Analytical Biochemistry, 1990, 191(1):119-126.
[18] MATSUHASHI S, HATANAKA C.Difference between the free and conjugated galacturonate residues in their color-reaction with carbazole or meta-hydroxybiphenyl reagents[J].Bioscience Biotechnology and Biochemistry, 1992, 56(7):1142-1143.
[19] TSEGAYE B, BALOMAJUMDER C, ROY P.Alkali pretreatment of wheat straw followed by microbial hydrolysis for bioethanol production[J].Environmental Technology, 2019, 40(9):1203-1211.
[20] SUN Y J, YANG K, ZHANG X, et al.In vitro binding capacities, physicochemical properties and structural characteristics of polysaccharides fractionated from Passiflora edulis peel[J].Food Bioscience, 2022, 50(Part A):102016.
[21] HUSSAIN M, ULLAH KHAN A, SAEED F, et al.Physicochemical characterization of cereal bran cell wall with special reference to its rheological and functional properties[J].International Journal of Food Properties, 2022, 25(1):305-314.
[22] XIAN H, WANG P, JING H, et al.Comparative study of components and anti-oxidative effects between sulfated polysaccharide and its iron complex[J].International Journal of Biological Macromolecules, 2018, 118(Part A):1303-1309.
[23] FENG Y Y, WU Y Y, DUAN R, et al.Structural characterization and anti-inflammatory effects of Enteromorpha prolifera polysaccharide-Fe/Zn complexes[J].International Journal of Biological Macromolecules, 2023, 253:127166.
[24] CHEN P L, YOU Q X, LI X, et al.Polysaccharide fractions from Fortunella margarita affect proliferation of Bifidobacterium adolescentis ATCC 15703 and undergo structural changes following fermentation[J].International Journal of Biological Macromolecules, 2019, 123:1070-1078.
[25] WANG X, HUANG M Y, YANG F, et al.Rapeseed polysaccharides as prebiotics on growth and acidifying activity of probiotics in vitro[J].Carbohydrate Polymers, 2015, 125:232-240.
[26] LEE Y K, JUNG S K, CHANG Y H.Rheological properties of a neutral polysaccharide extracted from maca (Lepidium meyenii Walp.) roots with prebiotic and anti-inflammatory activities[J].International Journal of Biological Macromolecules, 2020, 152:757-765.
[27] ZHANG X X, LIAO B Y, GUAN Z J, et al.Interaction between gelatin and mulberry leaf polysaccharides in miscible system:Physicochemical characteristics and rheological behavior[J].Foods, 2022, 11(11):1571.
[28] KANEKIYO K, LEE J B, HAYASHI K, et al.Isolation of an antiviral polysaccharide, nostoflan, from a terrestrial cyanobacterium, Nostoc flagelliforme[J].Journal of Natural Products, 2005, 68(7):1037-1041.
[29] YOU S Y, MA Y C, YAN B W, et al.The promotion mechanism of prebiotics for probiotics:A review[J].Frontiers in Nutrition, 2022, 9:1000517.
[30] SUN Y J, GUAN Y, KHOO H E, et al.In vitro assessment of chemical and pre-biotic properties of carboxymethylated polysaccharides from Passiflora edulis peel, xylan, and citrus pectin[J].Frontiers in Nutrition, 2021, 8:778563.
[31] HUANG F, LIU H J, ZHANG R F, et al.Physicochemical properties and prebiotic activities of polysaccharides from Longan pulp based on different extraction techniques[J].Carbohydrate Polymers, 2019, 206:344-351.