生物胺(biogenic amines, BAs)是一类有毒的低分子质量碱性含氮化合物,由某些氨基酸的代谢形成,通常是脱羧反应[1]。生物胺包括单胺(酪胺、组胺和色胺)、二胺(腐胺、尸胺)和多胺(胍丁胺、精胺和亚精胺)共8种,在生物生长过程中起着至关重要的作用[2]。然而,摄入过量生物胺会对人体造成不良反应,包括恶心头痛、心律失常、高血压、心悸、肾中毒、腹泻等不良反应,严重者会危害生命[2-4]。
酱油作为我国传统发酵食品,由于其特有的香气和浓郁的鲜味,已成为世界上最受欢迎的调味品[5]。酱油发酵过程中游离氨基酸在微生物的作用下发生脱羧反应形成生物胺。酱油中生物胺以β-苯乙胺、腐胺和酪胺为主。邹阳等[6]对国内市售的10种酱油8种BAs含量进行检测,部分产品的生物胺含量高于安全值1 000 mg/L[7-8]。目前,酱油中生物胺控制主要采用物理、化学及微生物技术,即通过发酵条件控制和外源添加生物素、有机酸(如乳酸或乙酸等)、黄酮等化学物质抑制产脱羧酶微生物的生长[9-10]。其中微生物降生物胺是当前研究的热点。研究表明具有生物胺氧化酶活性的乳酸菌有植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)和戊糖片球菌(Pediococcus pentosaceus)等[11-12]。QI等[13]发现QH-17和嗜盐杆菌CGMCC 3792可显著降低粤式酱油中苯乙胺、组胺和酪胺的含量;王雪郦等[14]采用筛选的干酪乳杆菌可显著降解酱油中的色胺和尸胺;GUO等[15]通过鲁氏接合酵母和假丝酵母复合发酵以减少酱油中生物胺。因此,利用乳酸菌强化调控酱油中生物胺是切实可行且安全稳定的[16-17],筛选具有优良生物胺降解能力的乳酸菌对于酱油安全品质的提升具有重大意义。
本文以酱油和酱醪为研究对象,采用双层显色培养法、生物胺氧化酶定性检测和LC-MS/MS定量分析筛选具有降生物胺功能的乳酸菌,经形态学、生理生化和16S rDNA分子生物学对其进行鉴定,同时研究其生长曲线、耐盐、耐酸等生长特性,获得降生物胺功能且耐受性优良的乳酸菌,从而为酱油中生物胺降解菌株的筛选、发酵剂的应用与生产质量安全调控提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
发酵时间为3、6、9、12个月的酱油、酱醪,由龙牌食品股份有限公司提供。
1.1.2 试剂
革兰氏染色试剂盒、3% H2O2还原酶试剂盒、硫化氢试剂盒、明胶试剂盒、硝酸盐(还原)试剂盒、靛基质试剂盒、尿素-靛基质-动力(urea indole motility medium,UIM)培养管、硫化氢-靛基质-动力(hydrogen sulfide indole motility medium,SIM)培养管、细菌学蛋白胨、酵母浸膏、牛肉浸膏、琼脂粉,广东环凯微生物科学研究所;丙三醇,西陇化工股份有限公司;一水D(+)-葡萄糖、七水硫酸镁、一水硫酸锰、七水硫酸亚铁、柠檬酸铵、磷酸氢二钾、盐酸硫胺、L-组氨酸、L-色氨酸、L-赖氨酸、L-苯丙氨酸、L-精氨酸,上海沪试实验室器材股份有限公司;5-磷酸吡哆醛、L-酪氨酸、L-鸟氨酸盐酸盐,上海麦克林生化科技股份有限公司;溴甲酚紫、N,N-二甲基对苯二胺盐酸盐,天津市致远化学世界有限公司;1-萘酚,北京沃凯生物科技有限公司;0.1 mol/L盐酸标准溶液、1.0 mol/L盐酸标准溶液,深圳市博林达科技有限公司;标准品亚精胺、精胺、酪胺、组胺、色胺、β-苯乙胺、尸胺、腐胺,TMStandard。
1.1.3 培养基
MRS培养基:蛋白胨、牛肉膏粉、酵母膏粉、葡萄糖、吐温80、磷酸氢二钾、乙酸钠、柠檬酸三铵、硫酸镁(MgSO4·7H2O)、硫酸锰(MnSO4·4H2O)、琼脂。
MRS肉汤培养基:酪蛋白酶消化物、牛肉膏粉、酵母膏粉、柠檬酸三铵、乙酸钠、硫酸镁(MgSO4·7H2O)、硫酸锰(MnSO4·4H2O)、磷酸氢二钾、葡萄糖、吐温80。
生物胺双层显色培养基(g/L):上层培养基溴甲酚紫0.06,琼脂20.0,pH 5.2。121 ℃灭菌10 min;下层培养基(g/L):蛋白胨5.0,酵母膏5.0,牛肉膏5.0,NaCl 2.5,葡萄糖0.5,吐温80 1 mL,MgSO4 0.4,MnSO4 0.03,K2HPO4 2.0,柠檬酸三铵2.0,CaCO3 0.1,FeSO4 0.04,盐酸硫胺0.01,磷酸吡哆醛0.05,琼脂21.0。色氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、组氨酸各2.5,pH 5.2。120 ℃高压灭菌15 min。
1.2 仪器与设备
PHS-3C型pH计,上海仪电科学仪器股份有限公司;WP-UP-WF-20型超纯水制备机,四川沃特尔水处理设备有限公司;SW-CJ-1B型超净工作台,苏州净化设备有限公司;LX-B100 L型立式压力蒸汽灭菌锅,合肥华泰有限公司;生化培养箱,中仪国科(北京)科技有限公司;Agilent Bio-Tek型酶标仪,美国Agilent公司;ACQUITY UPLC TQD三重四级杆超高效液相色谱串联质谱,美国Waters公司。
1.3 实验方法
1.3.1 乳酸菌初筛
称取1 g固体样品或1 mL液体样品于10 mL MRS肉汤培养基,37 ℃培养1 d,取1 mL培养液经梯度稀释后,从10-3、10-4、10-5、10-6稀释度中分别吸取0.1 mL涂布在MRS固体培养基上,37 ℃培养2~3 d。选取单菌落进行平板划线分离,纯化2~3次。选取乳酸菌相似形态菌株进行过氧化氢接触酶实验、革兰氏染色及显微镜观察,挑取革兰氏呈阳性、且无芽孢和接触酶阴性的菌株甘油保藏在-80 ℃冰箱备用[18]。
1.3.2 不产胺乳酸菌初筛
参考牛天娇等[19]方法,将初筛乳酸菌接种至MRS液体培养基中活化3次,取0.1 mL涂布于生物胺双层显色下层培养基,培养3 d后,倒入50 ℃的上层显色培养基,并在5 min内观察显色情况,显紫色的为生物胺阳性,不变色即黄色的为阴性,以不接种的培养基为空白对照组。选取阴性菌进行后续实验。
1.3.3 生物胺氧化酶检测
参考马宇霞等[20]、刘玉晗等[21]方法,对初筛获得的不产胺乳酸菌进行生物胺氧化酶检验。取白色洁净滤纸蘸取单菌落,加1%(质量分数)盐酸二甲基对苯二胺溶液1滴,呈现粉红色且逐渐加深,再加1%(体积分数)α-萘酚乙醇溶液1滴,阳性于 0.5 min内呈蓝色,阴性于2 min内不变色。取阳性菌株进行后续实验。
1.3.4 降解生物胺乳酸菌复筛
将生物胺氧化酶阳性菌株接种至MRS液体培养基中活化3次,以2%(体积分数,下同)接种量接入8种生物胺(亚精胺、精胺、酪胺、组胺、色胺、苯乙胺、尸胺、腐胺)质量浓度均为25 mg/L的MRS肉汤培养基,37 ℃培养3 d,8 000 r/min离心5 min取上清液,采用LC-MS/MS测定生物胺含量,以未添加菌株的培养基为对照,选取降解生物胺种类多且降解能力强的菌株。生物胺降解率的计算如公式(1)所示:
(1)
式中:X,生物胺降解率,%;A,对照组生物胺含量,mg/L;A1,实验组生物胺含量,mg/L。
1.3.5 LC-MS/MS测定生物胺含量
参考陈召桂等[22]前处理方法,取1 mL培养液用5%(体积分数)三氯乙酸溶液定容至50 mL,混匀后8 000 r/min离心5 min,取上清液过0.22 μm聚四氟乙烯滤膜,滤液待测。空白对照组设置为不接入菌液的生物胺质量浓度均为25 mg/L的MRS肉汤。
色谱条件:色谱柱:C18;柱温:35 ℃;流动相(体积分数):流动相A:0.1%甲酸溶液;流动相B:乙腈,采用梯度洗脱:0~0.5 min,90% A线性变化至85% A;0.5~4 min 85% A线性变化至15% A;4~5 min 85% A保持不变;5~5.1 min 15% A线性变化至85% A;5.1~7 min 85% A保持不变。柱温:35 ℃。流速:0.3 mL/min。进样量:2 μL。
质谱条件:电喷雾离子(electrospray ionization, ESI)源,正电离模式;毛细管电压3.5 kV;锥孔电压40 V;碰撞能量22 V;反吹气N2;源温度120 ℃;脱溶剂温度400 ℃;脱溶剂气流量800 L/h;反吹气气流量50 L/h。
1.3.6 生物胺降解乳酸菌的鉴定
1.3.6.1 形态学鉴定
将筛选得到的生物胺降解菌株接于MRS固体培养基中,37 ℃培养48 h后观察并记录菌株形态特征,经革兰氏染色后置于显微镜下观察。
1.3.6.2 生理生化鉴定
采用靛基质、硫化氢、明胶和硝酸盐(还原)试剂盒检测5株菌的生理生化特性。碳源利用能力采用API 50 CHL和API 50 CH试纸条对筛得菌株进行鉴定,检测菌株对49种不同碳源的发酵能力,记录培养24 h和48 h的结果,利用API细菌鉴定系统(analytic products inc bacterial identification system,API LABPlus)鉴定。
1.3.6.3 分子生物学鉴定
采用CTAB法提取菌株DNA。16S rDNA扩增采用通用引物。测序引物为:27F:AGTTTGATCMTGGCTCAG;1492R:GGTTACCTTGTTACGACTT。PCR反应体系(共25 μL):10×PCR Buffer,dNTP (each 10 mmol/L),Taq Plus DNA Polymerase(5 U/μL)和50 mmol/L MgSO4共12.5 μL;引物F (10 μmol/L)1 μL;引物R (10 μmol/L)1 μL;Template (DNA)1 μL;ddH2O 9.5 μL。PCR反应体系为:95 ℃预变性5 min;94 ℃变性30 s;57 ℃退火30 s;72 ℃延伸90 s,共循环30次;最后72 ℃延伸10 min。PCR扩增产物纯化后送至生工生物工程(上海)股份有限公司测序,将测序结果与NCBI中GeneBank数据库进行基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)对比,采用MEGA 7.0构建系统发育树。
1.3.7 生长曲线测定
将活化后的菌株以2%接种量接种于MRS肉汤培养基中37 ℃培养24 h,每隔2 h使用酶标仪测定OD600nm值,以培养时间为横坐标,OD600nm值为纵坐标绘制菌株生长曲线[23]。
1.3.8 耐盐能力测定
将活化后的菌株以2%接种量接种于NaCl质量浓度分别为60、80、100、150、200 g/L的MRS肉汤培养基中,37 ℃恒温培养24 h测定OD600nm值。
1.3.9 耐酸能力测定
参考秦雅莉等[24]的方法,将活化后的菌株以2%接种量接种于pH 3的MRS肉汤培养基中,于37 ℃恒温培养24 h测定OD600nm值。
1.3.10 降生物胺特性研究
1.3.10.1 不同温度对乳酸菌降生物胺能力的影响
将活化后菌株L2112和L41B以2%接种量分别接入8种生物胺(亚精胺、精胺、酪胺、组胺、色胺、苯乙胺、尸胺、腐胺)质量浓度均为25 mg/L的MRS肉汤培养基中,22、27、32、37、42 ℃培养3 d后。参考1.3.4节的方法测定生物胺含量。
1.3.10.2 不同盐含量对乳酸菌降生物胺能力的影响
将活化后的菌株L2112和L41B以2%接种量分别接入8种生物胺(亚精胺、精胺、酪胺、组胺、色胺、苯乙胺、尸胺、腐胺)质量浓度均为25 mg/L的MRS肉汤培养基中,于37 ℃分别在NaCl质量浓度为40、70、100、130、160 g/L的环境下培养3 d后。参考1.3.4节的方法测定生物胺含量。
1.3.10.3 不同生物胺浓度对乳酸菌降生物胺能力的影响
将活化后的菌株L2112和L41B以2%接种量分别接入8种生物胺(亚精胺、精胺、酪胺、组胺、色胺、苯乙胺、尸胺、腐胺)单胺质量浓度分别为12.5、25、37.5、50、62.5 mg/L即总质量浓度分别为100、200、300、400、500 mg/L的MRS肉汤培养基中,于37 ℃培养3 d后。参考1.3.4节的方法测定生物胺含量。
2 结果与分析
2.1 初筛乳酸菌
酱油和酱醪样本经梯度稀释后,采用MRS培养基培养,共筛选得到45株乳酸菌相似形态菌株,其中革兰氏阳性菌株38株,过氧化氢接触酶阴性菌株34株、阳性菌株11株。
2.2 降解生物胺菌株筛选
2.2.1 不产生物胺菌株初筛
在低酸或营养缺乏的生长环境中,具有氨基酸脱羧酶活性的乳酸菌为了维持自身生长繁殖,受胁迫机制调控将氨基酸脱羧产生生物胺[25]。双层显色法即利用氨基酸产生碱性生物胺,碱性物质使培养基的pH值增加,指示剂溴甲酚紫由黄色变为紫色,具有氨基酸脱羧酶的产生物胺菌株在显色培养基中呈现紫色,不产生物胺或降解生物胺菌株在显色培养基上不变色[26]。38株革兰氏阳性菌的双层显色结果如图1所示,其中16株菌呈阴性,不变色(呈黄色),为不产胺菌,22株菌表现为阳性,变紫色,为产胺菌。

图1 生物胺显色反应
Fig.1 Color reaction of biogenic amines
2.2.2 生物胺氧化酶测定
在双层显色反应中,由于细菌可以利用葡萄糖产生乳酸,影响培养基的最终pH值,可能呈现假阴性,因此,需要进行氧化酶实验来消除假阴性菌株。如图2所示,16株不产生物胺菌株生物胺氧化酶实验结果均为阳性,呈蓝色,说明菌株均具有生物胺氧化酶活性,可作为下一步实验的潜在降解生物胺的功能菌株。

图2 生物胺氧化酶阳性试验
Fig.2 Biogenic amine oxidase test
2.2.3 降解生物胺菌株复筛
将筛选出的16株不产生物胺的菌株接种至添加生物胺的MRS液体培养基,以不接种菌的生物胺质量浓度为25 mg/L的MRS液体培养基作为对照组,采用LC-MS/MS分析其生物胺降解能力。由表1可知,14株乳酸菌均具有降解总胺的能力,L2112的总胺降解能力最强,可达27.97%。从8种单胺的降解能力来看,16株不产生物胺乳酸菌的降解能力呈现出明显差异,亚精胺、精胺、腐胺和尸胺的降解能力明显优于酪胺、组胺、苯乙胺和色胺。
表1 不同菌株的生物胺降解率 单位:%
Table 1 Degradation rate of biogenic amines by different strains
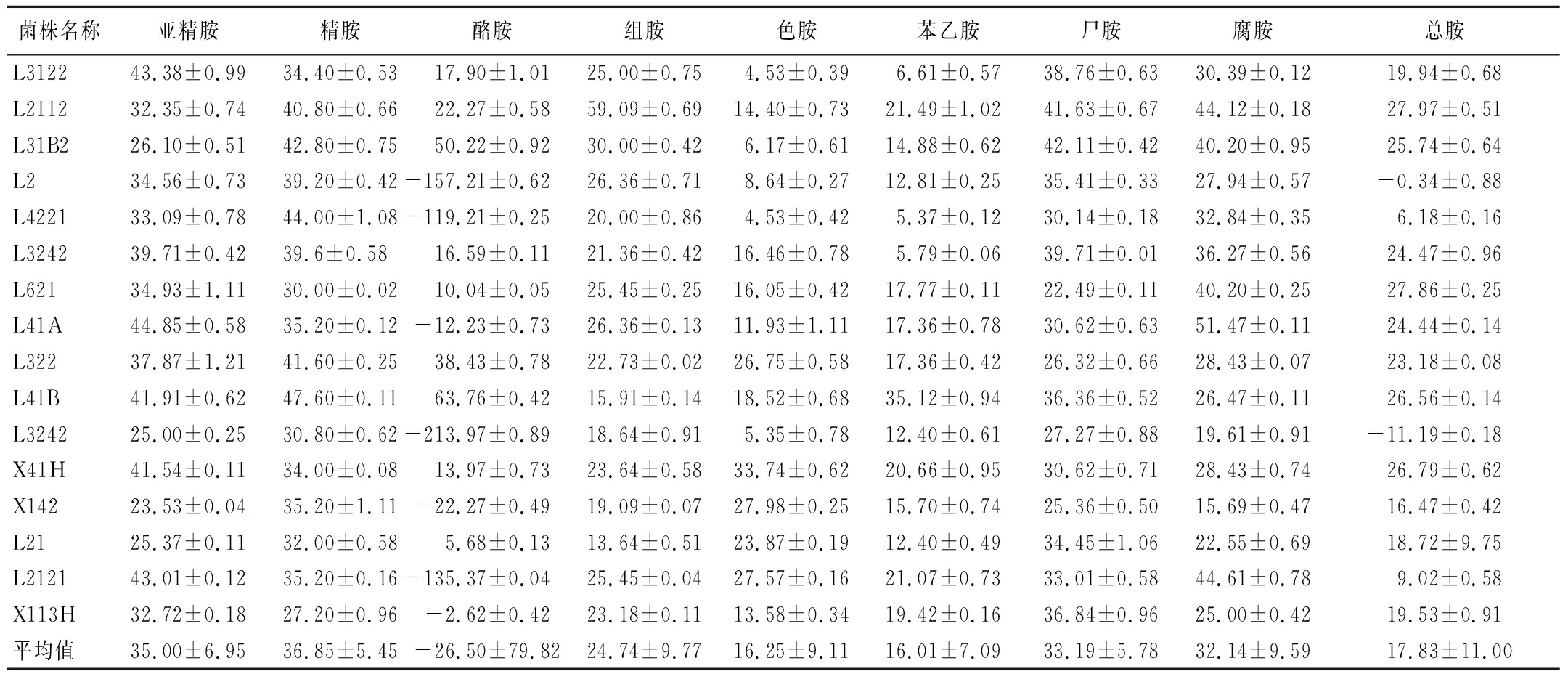
菌株名称亚精胺精胺酪胺组胺色胺苯乙胺尸胺腐胺总胺L312243.38±0.9934.40±0.5317.90±1.0125.00±0.754.53±0.396.61±0.5738.76±0.6330.39±0.1219.94±0.68L211232.35±0.7440.80±0.6622.27±0.5859.09±0.6914.40±0.7321.49±1.0241.63±0.6744.12±0.1827.97±0.51L31B226.10±0.5142.80±0.7550.22±0.9230.00±0.426.17±0.6114.88±0.6242.11±0.4240.20±0.9525.74±0.64L234.56±0.7339.20±0.42-157.21±0.6226.36±0.718.64±0.2712.81±0.2535.41±0.3327.94±0.57-0.34±0.88L422133.09±0.7844.00±1.08-119.21±0.2520.00±0.864.53±0.425.37±0.1230.14±0.1832.84±0.356.18±0.16L324239.71±0.4239.6±0.5816.59±0.1121.36±0.4216.46±0.785.79±0.0639.71±0.0136.27±0.5624.47±0.96L62134.93±1.1130.00±0.0210.04±0.0525.45±0.2516.05±0.4217.77±0.1122.49±0.1140.20±0.2527.86±0.25L41A44.85±0.5835.20±0.12-12.23±0.7326.36±0.1311.93±1.1117.36±0.7830.62±0.6351.47±0.1124.44±0.14L32237.87±1.2141.60±0.2538.43±0.7822.73±0.0226.75±0.5817.36±0.4226.32±0.6628.43±0.0723.18±0.08L41B41.91±0.6247.60±0.1163.76±0.4215.91±0.1418.52±0.6835.12±0.9436.36±0.5226.47±0.1126.56±0.14L324225.00±0.2530.80±0.62-213.97±0.8918.64±0.915.35±0.7812.40±0.6127.27±0.8819.61±0.91-11.19±0.18X41H41.54±0.1134.00±0.0813.97±0.7323.64±0.5833.74±0.6220.66±0.9530.62±0.7128.43±0.7426.79±0.62X14223.53±0.0435.20±1.11-22.27±0.4919.09±0.0727.98±0.2515.70±0.7425.36±0.5015.69±0.4716.47±0.42L2125.37±0.1132.00±0.585.68±0.1313.64±0.5123.87±0.1912.40±0.4934.45±1.0622.55±0.6918.72±9.75L212143.01±0.1235.20±0.16-135.37±0.0425.45±0.0427.57±0.1621.07±0.7333.01±0.5844.61±0.789.02±0.58X113H32.72±0.1827.20±0.96-2.62±0.4223.18±0.1113.58±0.3419.42±0.1636.84±0.9625.00±0.4219.53±0.91平均值35.00±6.9536.85±5.45-26.50±79.8224.74±9.7716.25±9.1116.01±7.0933.19±5.7832.14±9.5917.83±11.00
生物胺的降解率与微生物的产胺和降解能力有关,研究发现生物胺含量的动态变化取决于发酵过程中产胺菌和降解菌的动态平衡。酱油中生物胺来自两方面,一是微生物生长代谢过程中能产生一定量的生物胺,生物胺种类与含量与微生物种类有关,通常这一途径产生的生物胺含量不是很高;另一重要来源是微生物分泌的氨基酸脱羧酶催化发酵底物中氨基酸发生氨基酸脱羧反应形成不同生物胺,这是酱油等发酵制品中生物胺的主要来源。同时具有生物胺氧化酶的乳酸菌可将生物胺分解为乙醛、氨、过氧化氢,从而降低生物胺含量[27-28]。本研究中筛选到16株乳酸菌均不产生物胺,其生物胺降解与其生物胺氧化酶的活性密切相关,L3122、L2112、L31B2、L41B和X41H表现出较好的降解生物胺能力,L3122降解亚精胺的效果最好,降解率为43.38%;L2112降解精胺、组胺、尸胺和腐胺的效果较好,降解率分别为40.80%、59.09%、41.63%和44.12%;L31B2降解精胺和酪胺的效果较好,降解率分别为42.80%和50.22%;L41B的酪胺和苯乙胺降解率分别为63.76%和35.12%;X41H的色胺降解率达33.74%。与HERRERO-FRESNO等[12]报道干酪乳杆菌降解36.2%组胺和47.9%酪胺的降解能力相比,L2112降解组胺能力更强,L31B2降解酪胺能力更强。与徐佳敏等[29]筛得的植物乳杆菌对腐胺、尸胺、组胺、酪胺、精胺的降解率分别为27.67%、25.00%、29.44%、27.96%、24.48%的降解能力相比,L2112降解腐胺和尸胺的能力更强,L31B2降解酪胺和精胺的降解能力更强。与张雁凌等[30]使用嗜盐四联球菌和鲁氏接合酵母降解8.49%总胺的降解率相比,具有更强的总胺降解能力。
2.3 菌株鉴定
2.3.1 形态学鉴定
菌株L3122、L2112、L31B2、L41B、X41H的菌落形态如图3所示,平皿底为黄色,菌落中等大小,凸起,菌落呈圆形、表面光滑、边缘整齐,颜色呈白色。
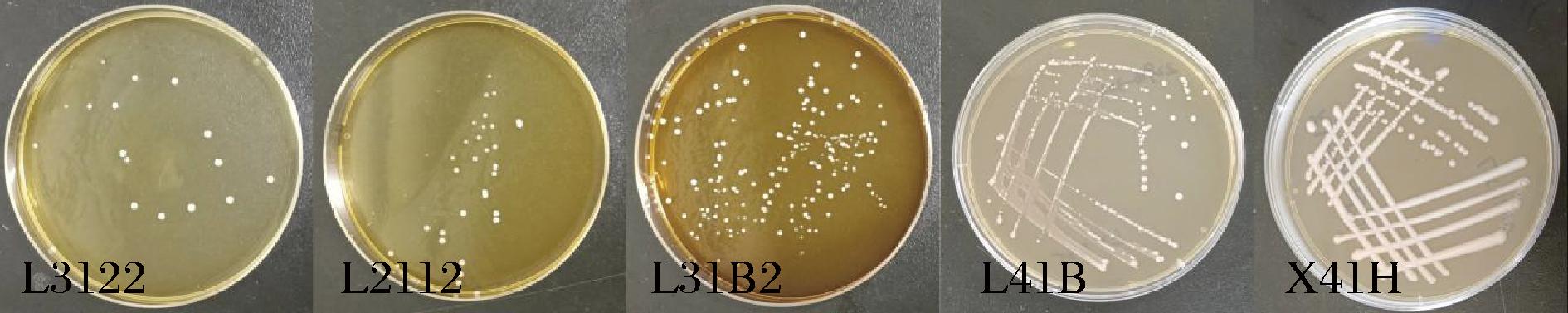
图3 菌落形态
Fig.3 Colony characteristics of strain
2.3.2 生理生化鉴定
采用靛基质、硫化氢、明胶和硝酸盐(还原)试剂盒检测5株菌的生理生化特性,靛基质、硫化氢、明胶试验所有的菌株均表现阴性;L31B2、L41B和L2112为硝酸盐还原阴性,表明这3株菌均不能将硝酸盐还原为亚硝酸盐,其余2株为阳性,则产亚硝酸盐。亚硝酸盐可与食品中蛋白质分解产生的中间产物仲胺反应形成亚硝胺,亚硝胺可诱发多种癌症。
利用API试纸条测定菌株对49 种碳源的利用能力,将对照作为阴性,底物可以利用的反应均为阳性,试验结果见表2。其中L-阿拉伯糖、D-核糖、D-木糖、D-半乳糖、D-葡萄糖、D-果糖、D-甘露糖、七叶灵(柠檬酸铁)、D-麦芽糖、D-乳糖、D-密二糖、D-蔗糖、D-海藻糖、D-棉子糖、葡萄糖酸钾15项检测结果均呈阳性,丙三醇、赤藓糖醇、D-阿拉伯糖、L-木糖、D-核糖醇、甲基-β-D-吡喃木糖苷、L-山梨糖、L-鼠李糖、卫矛醇、肌醇、甘露醇、山梨醇、甲基-α-D-吡喃甘露糖苷、甲基-α-D-吡喃葡萄糖苷、N-乙酰葡萄糖胺、苦杏仁苷、熊果苷、水杨苷、D-纤维二糖、菊粉、D-松三糖、淀粉、糖原、木糖醇、D-龙胆二糖、D-土伦糖、D-来苏糖、D-塔格糖、D-岩藻糖、L-岩藻糖、D-阿拉伯醇、L-阿拉伯醇、2-酮基葡萄糖酸钾、5-酮基葡萄糖酸钾34项检测结果为阴性。于法国梅里埃公司官网利用API LABPlus自动判读系统对其进行鉴定,5株菌株均为乳酸杆菌属(Limosilactobacillus),推测均为发酵乳酸杆菌(Limosilactobacillus fermentum)。
表2 生理生化结果
Table 2 Physiological and biochemical results

序号名称L31B2L41BL2112L3122X41H1阴性对照-----2丙三醇-----3赤藓糖醇-----4D-阿拉伯糖-----5L-阿拉伯糖+++++6D-核糖+++++7D-木糖+++++8L-木糖-----9D-核糖醇-----10甲基-β-D-吡喃木糖苷-----11D-半乳糖+++++12D-葡萄糖+++++13D-果糖+++++14D-甘露糖+++++15L-山梨糖-----16L-鼠李糖-----17卫矛醇-----18肌醇-----19甘露醇-----20山梨醇-----21甲基-α-D-吡喃甘露糖苷-----22甲基-α-D-吡喃葡萄糖苷-----
续表2

序号名称L31B2L41BL2112L3122X41H23N-乙酰葡萄糖胺-----24苦杏仁苷-----25熊果苷-----26七叶灵(柠檬酸铁)+++++27水杨苷-----28D-纤维二糖-----29D-麦芽糖+++++30D-乳糖+++++31D-密二糖+++++32D-蔗糖+++++33D-海藻糖+++++34菊粉-----35D-松三糖-----36D-棉子糖+++++37淀粉-----38糖原-----39木糖醇-----40D-龙胆二糖-----41D-土伦糖-----42D-来苏糖-----43D-塔格糖-----44D-岩藻糖-----45L-岩藻糖-----46D-阿拉伯醇-----47L-阿拉伯醇-----48葡萄糖酸钾+++++492-酮基葡萄糖酸钾-----505-酮基葡萄糖酸钾-----51靛基质-----52硫化氢-----53明胶-----54硝酸盐(还原)---++
注:表中+代表阳性,-代表阴性。
2.3.3 分子生物学鉴定
将L3122、L2112、L31B2、L41B和X41H菌株进行 16S rDNA 序列分析,结果见图4。
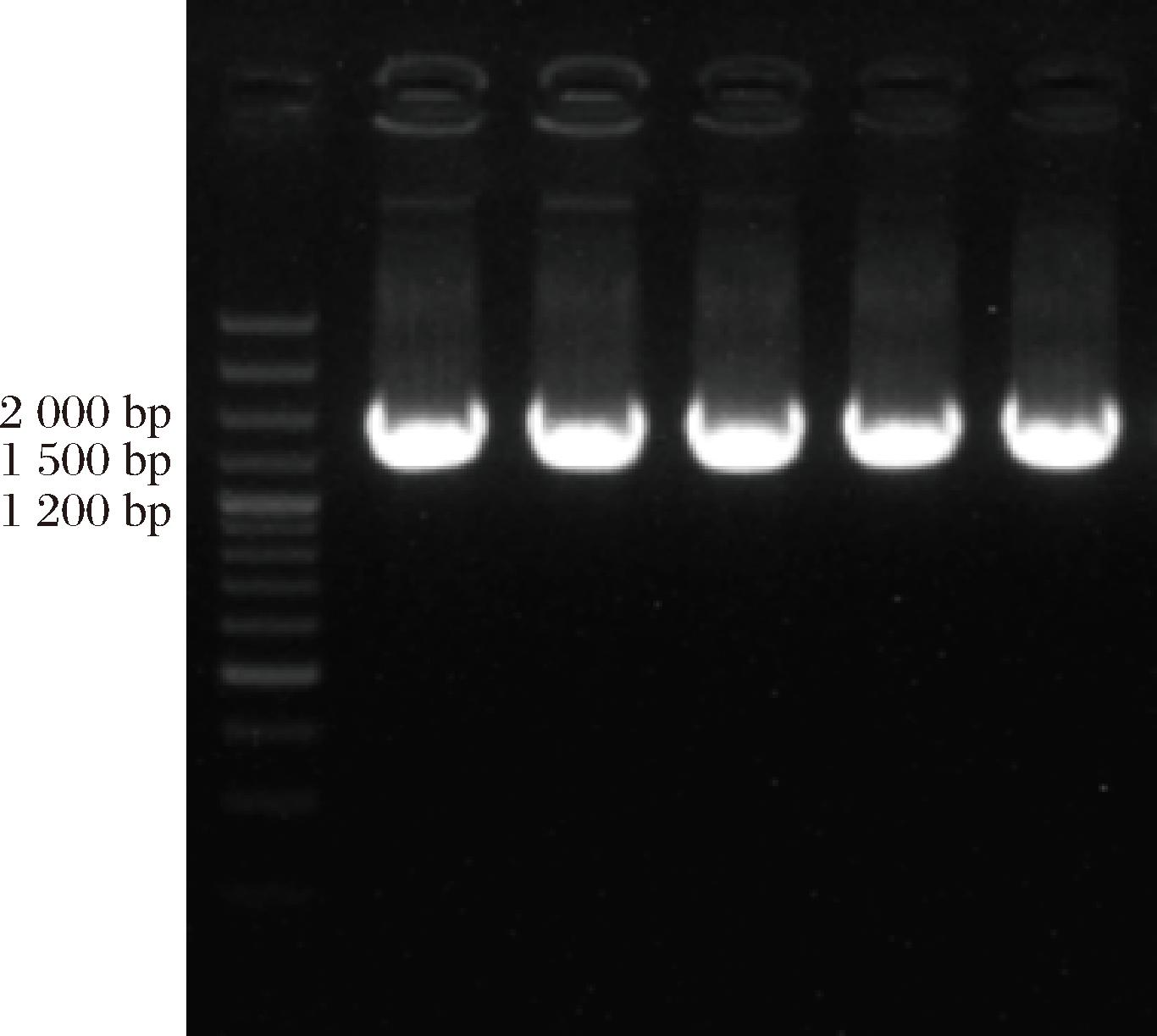
图4 16 s rDNA结果
Fig.4 Results of 16S rDNA
由图4可知,PCR产物条带清晰,片段长为1 510、1 483、1 493、1 489、1 484 bp,具有典型的16S rDNA特征,符合测序要求。
利用NCBI的BLAST软件,将5株菌的16S rDNA与GenBank数据库中基因序列进行比对,构建发育树,结果见图5。菌株L3122、L2112、L31B2、L41B和X41H的亲缘关系相近,5株菌与发酵乳杆菌属模式菌株NR 113335.1达到100%的同源性。结合形态学及生理生化试验结果,5株乳酸菌菌株均为发酵乳酸杆菌(Limosilactobacillus fermentum)。
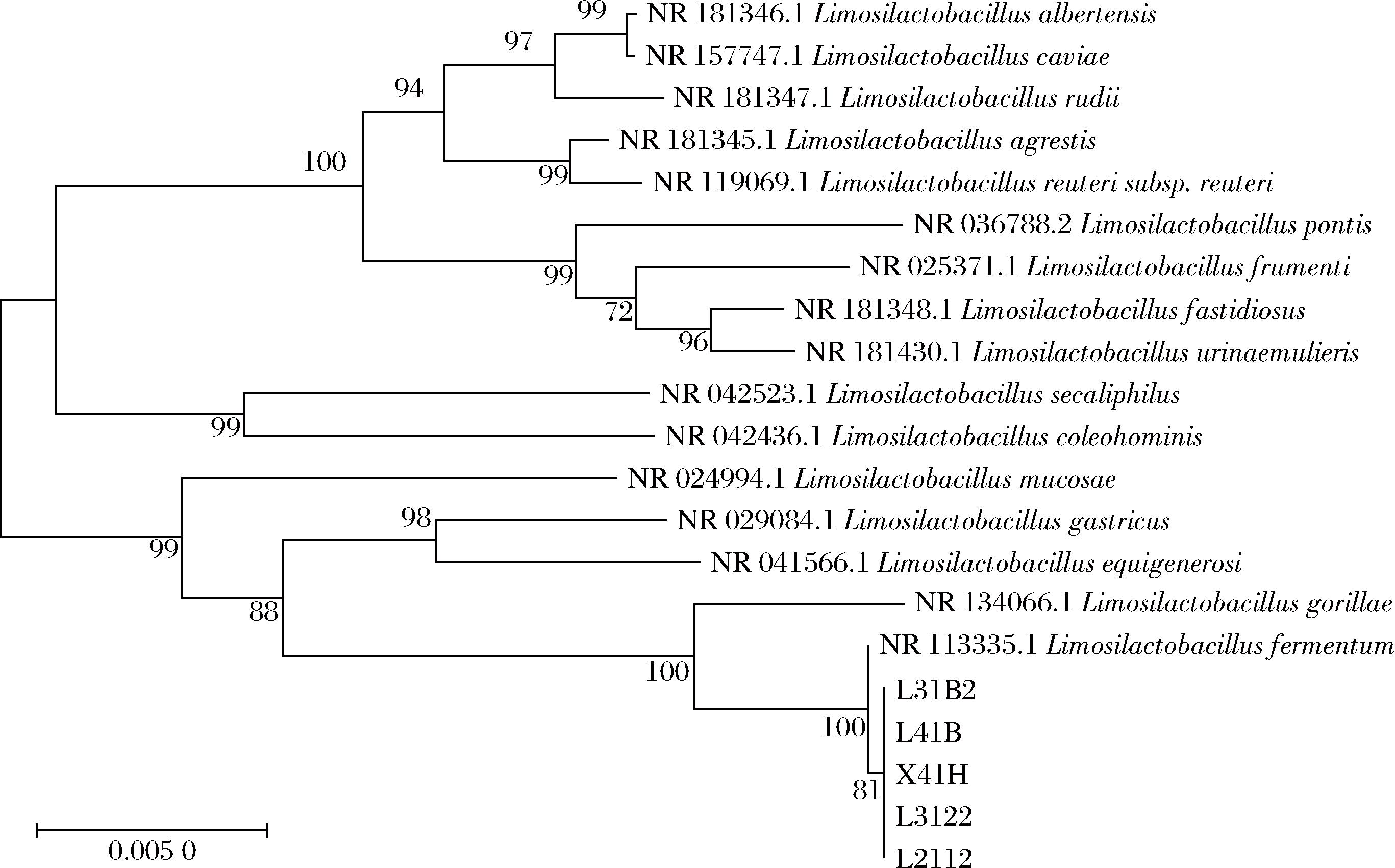
图5 菌株系统发育树
Fig.5 Phylogenetic tree of strains
2.3.4 生长曲线测定
菌株的生长曲线反映了菌株的生长能力。由图6可知,5株菌在MRS肉汤中均生长良好,0~4 h,为乳酸菌进入新环境的适应阶段,生长较缓慢,处于迟缓期;4~12 h,乳酸菌的生长速度更快,进入对数生长期,也是最活跃的时期;12 h后乳酸菌达到稳定期,OD600nm值一直保持较高水平,但不再显著增加;24 h内没有进入衰亡期。其中,菌株L31B2、X41H在10 h时OD600nm达到最大值,分别为1.432、1.450;菌株L3122在12 h时OD600nm达到最大值,为1.449;菌株L2112在14 h时OD600nm达到最大值,为1.461;菌株L41B在16 h时OD600nm达到最大值,为1.433。5株乳酸菌的生长强度由强到弱排序为:L2112>X41H>L3122>L41B>L31B2。

图6 菌株生长曲线测定
Fig.6 Growth curve capacity of strains
2.3.5 耐盐性实验
目前,我国规模化的酱油酿造多采用现代高盐稀态发酵工艺,主要特征是发酵酱醪盐分含量高,因此选育的菌种需要具备一定的耐盐性[31]。研究发现,随着酱油发酵体系中NaCl质量浓度的增加,BAs的含量随之减少,将高盐稀态酱油体系中的NaCl质量浓度提高至200 g/L,可以有效降低BAs的产生,但传统酱油体系为了保证风味和咸度一般将NaCl质量浓度控制在160~180 g/L[32]。由表3可以看出,5株菌株在60 g/L NaCl质量浓度生长较好,24 h时OD600nm值为1.233~1.260;80 g/L NaCl质量浓度下OD600nm值为0.249~0.428,与60 g/L NaCl质量浓度相比,生长受到抑制,其中L41B OD600nm值最低(P<0.05),表明其耐盐能力相对较弱;100 g/L NaCl质量浓度含盐量对菌株影响较大,5株菌生长明显受到抑制,OD600nm值为0.109~0.117;150 g/L和200 g/L NaCl质量浓度环境下,5株菌株的OD600nm在0.093~0.102,在高盐环境下仍可以生长,具有一定的高盐耐受性。这说明5株菌株均能在高盐发酵环境存活,酱油发酵中的NaCl质量浓度可以从低盐的100 g/L达到高盐的160 g/L及以上,5株菌株在100~160 g/L NaCl质量浓度下可以生长但生长能力较差,如应用于酱油生产还需要在高盐环境中驯化,进一步提高其耐盐性等。
表3 五株乳酸菌在不同含盐量下生长情况
Table 3 Growth situation of 5 LAB strains under different concentration of NaCl
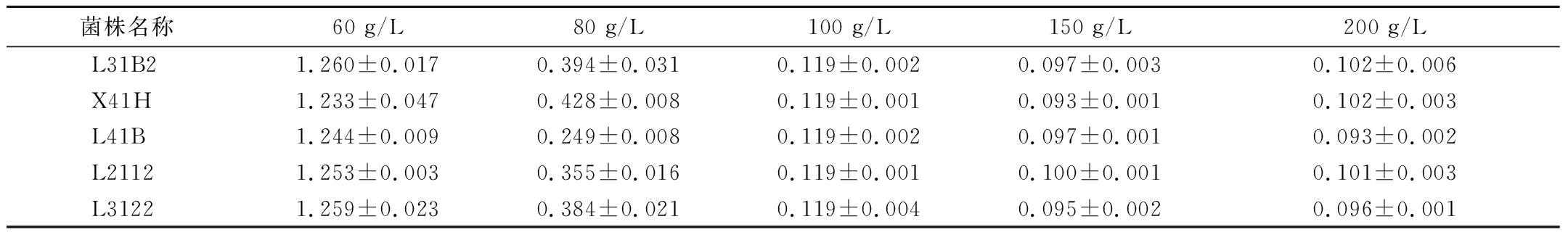
菌株名称60 g/L80 g/L100 g/L150 g/L200 g/LL31B21.260±0.0170.394±0.0310.119±0.0020.097±0.0030.102±0.006X41H1.233±0.0470.428±0.0080.119±0.0010.093±0.0010.102±0.003L41B1.244±0.0090.249±0.0080.119±0.0020.097±0.0010.093±0.002L21121.253±0.0030.355±0.0160.119±0.0010.100±0.0010.101±0.003L31221.259±0.0230.384±0.0210.119±0.0040.095±0.0020.096±0.001
注:表中数据为培养24 h的OD600nm值。
2.3.6 耐酸性实验
乳酸菌生长代谢过程中产生有机酸,使其环境pH值降低,具有较强的耐酸能力。酱油发酵过程中,乳酸菌代谢产生的丰富种类的有机酸,使得入池发酵后pH值快速下降,同时细菌脱羧酶在酸性环境下活性较强导致生物胺浓度增加,因此乳酸菌在酱油发酵过程中存活需要有较好的耐酸能力[33]。将MRS肉汤培养基调至pH 3进行实验[34],从图7可以看出,5株菌株生长受酸度影响较小,OD600nm值为0.977~1.132,证明5株菌的耐酸能力较强,可适应酱油体系发酵中后期快速下降的pH环境,其中L41B的OD600nm值显著低于其他4株,说明其耐酸能力与其他4株相比较弱。
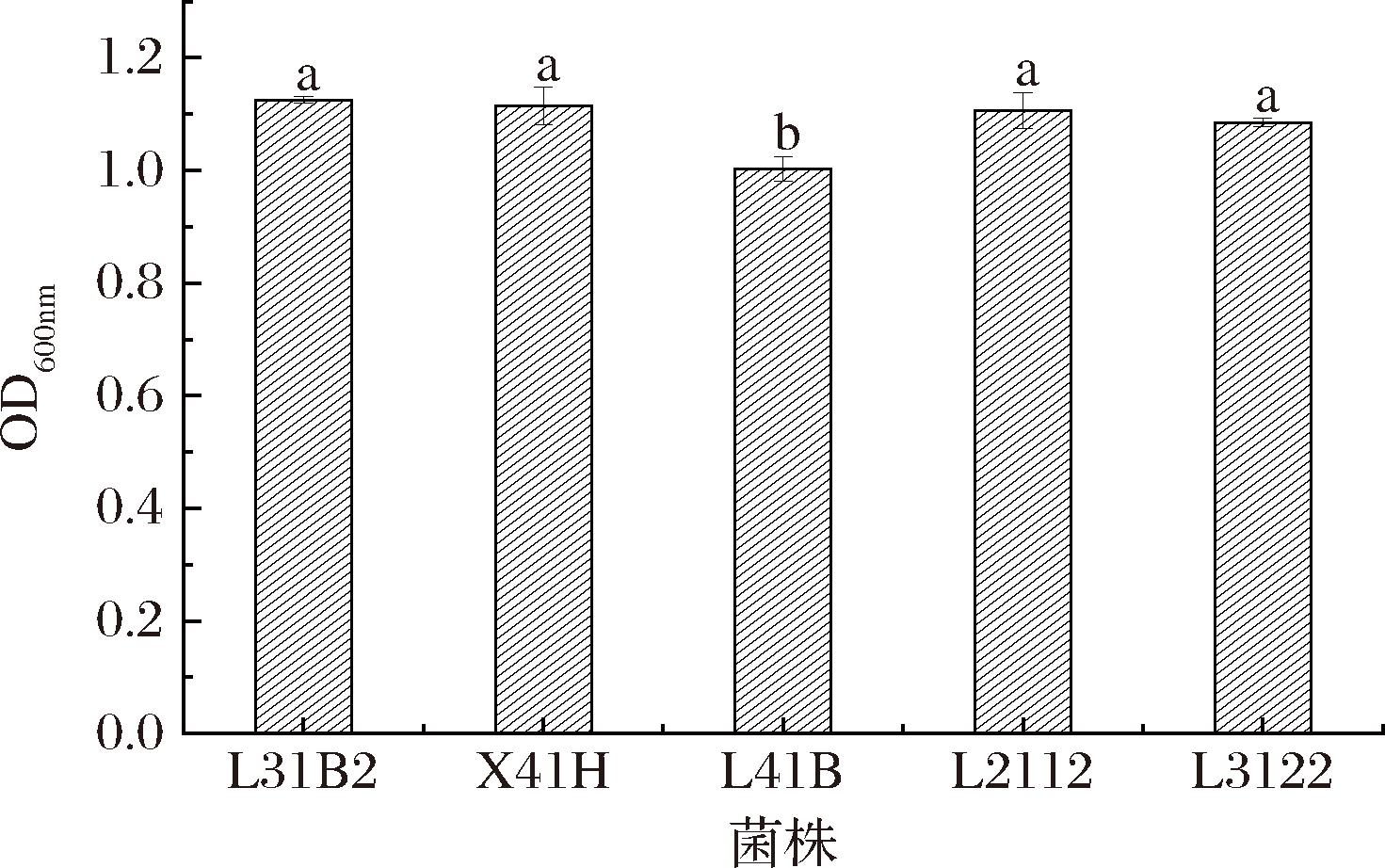
图7 pH 3条件下菌株生长情况
Fig.7 Growth situation of strains at pH 3
注:图中不同小写字母代表差异显著(P<0.05)。
2.3.7 发酵乳杆菌降生物胺特性研究
研究表明龙牌酱油样品中含量较高的生物胺为组胺、酪胺、亚精胺和苯乙胺,综合菌株对主要生物胺降解率和耐盐耐酸能力考虑,选择发酵乳杆菌L2112和L41B进行环境对菌株降解生物胺能力的评价研究。依据酱油生产的环境影响因素,选定温度、盐含量和环境生物胺含量3个因素,探究菌株L2112和L41B生物胺降解能力的最佳条件。
2.3.7.1 温度对发酵乳杆菌降解生物胺能力的影响
温度会显著影响酱油中微生物的代谢和酶活性,从而影响酱油中生物胺的降解能力[32]。菌株在不同环境温度下生物胺降解率结果如表4所示,2株菌的总胺降解能力均在37 ℃时达到最高,分别为28.06%和28.35%。除菌株L41B的精胺、组胺和酪胺降解率在42 ℃时达到最高,其余单胺降解率均在37 ℃时达到最高。
表4 不同温度下发酵乳杆菌L2112、L41B降生物胺能力 单位:%
Table 4 BAs degradation ability of Lactobacillus fermentum L2112 and L41B under different temperatures

温度/℃菌株名称亚精胺精胺酪胺组胺色胺苯乙胺尸胺腐胺总胺22L211214.88±1.0622.58±2.7815.53±1.3027.04±0.920.40±0.282.81±0.7411.37±0.7819.44±0.3211.11±1.18L41B24.79±1.257.26±0.5921.59±0.3329.63±1.121.99±0.473.21±0.7121.57±2.3730.56±0.8713.03±1.2827L211222.31±0.68-4.03±0.6835.61±2.9027.78±0.3711.16±0.456.82±0.535.88±0.6431.35±0.9410.45±0.85L41B13.64±0.852.42±1.0730.68±1.5326.30±0.4114.74±0.3714.46±0.1420.78±0.2134.13±1.2815.00±0.8232L211214.05±0.7510.48±1.7520.40±0.4238.15±0.457.97±0.215.62±0.5414.51±0.7927.38±0.4015.01±1.13L41B19.01±0.744.84±0.4627.65±1.6530.74±0.9115.54±0.6211.24±1.3926.27±0.2130.16±0.2515.17±0.6737L211248.76±0.6151.21±0.7118.94±1.4350.37±1.1618.73±0.418.84±0.6133.33±0.3140.08±0.5728.06±0.55L41B57.44±0.5748.39±0.2928.03±0.9229.63±0.2321.12±0.6714.06±0.8225.10±0.7436.11±0.1728.35±0.7142L211239.67±0.0449.19±0.3926.52±1.1732.96±1.2216.73±0.419.64±0.4320.00±0.7536.51±0.6622.06±0.52L41B39.26±0.5252.02±0.2139.77±0.4533.70±0.1618.73±0.2614.06±0.6221.96±0.4935.32±0.5127.63±0.42
2.3.7.2 盐含量对发酵乳杆菌降解生物胺能力的影响
发酵乳杆菌L2112、L41B在不同盐含量下生物胺降解能力如表5所示。发酵乳杆菌L2112在40 g/L NaCl质量浓度降生物胺能力最强,总胺降解率可达到23.82%,随着盐含量的上升生物胺降解能力有所下降,100 g/L NaCl质量浓度生物胺降解能力最差,后随着盐含量上升,生物胺降解能力又有所上升,在160 g/L NaCl质量浓度总胺降解率可达21.59%。发酵乳杆菌L41B的降生物胺能力随盐含量上升而上升,在130 g/L NaCl质量浓度时总胺降解率达到最高为18.56%。综上所述,发酵乳杆菌L2112、L41B均在高盐环境下有较好的降生物胺能力,有应用于实际酱油生产环境中的前景。
表5 不同盐含量下发酵乳杆菌L2112、L41B降生物胺能力 单位:%
Table 5 BAs degradation ability of Lactobacillus fermentum L2112 and L41B under different concentration of NaCl

NaCl质量浓度/(g/L)菌株名称亚精胺精胺酪胺组胺色胺苯乙胺尸胺腐胺总胺40L211221.60±0.2843.95±0.6514.77±0.6236.30±0.251.99±0.4114.86±0.3227.84±0.4141.67±0.2523.82±1.32L41B18.00±0.3117.34±0.8913.26±0.2518.52±1.13-0.80±0.6411.24±0.9814.90±0.7523.41±0.239.90±0.5870L211222.80±0.7520.16±0.3029.17±0.4925.93±1.080.80±0.14-2.01±0.6916.47±1.2215.08±0.5615.35±1.04L41B1.20±0.6916.53±0.5616.67±0.3923.70±0.518.37±1.369.24±0.9226.67±0.6819.44±0.6114.55±0.73100L21125.60±0.8915.32±0.6210.32±0.8124.44±0.771.99±0.253.21±1.0933.73±0.5219.84±0.5513.35±0.64L41B12.60±0.7812.90±0.4129.55±0.7327.78±0.313.59±0.6813.65±0.3227.06±1.5217.86±0.3516.85±0.95130L211229.60±0.6824.19±0.3729.55±0.4828.89±0.210.40±0.7616.06±2.0529.41±1.7225.79±0.7519.46±1.07L41B20.40±0.2524.09±0.4121.97±0.1224.07±0.943.98±0.2113.65±0.9435.29±0.5716.67±1.3118.56±1.61160L211227.20±0.9227.02±0.5932.20±1.8930.00±1.270.40±0.0811.65±0.5230.59±2.0437.13±0.5821.59±1.18L41B4.80±0.4511.29±1.0529.92±0.5129.63±1.350.40±0.1513.65±0.2531.76±0.4320.24±1.0216.57±0.72
2.3.7.3 环境生物胺浓度对发酵乳杆菌降解生物胺能力的影响
酱油产品的发酵受多种因素影响,其生物胺含量不尽相同[6],选择不同生物胺浓度研究其对发酵乳杆菌L2112、L41B降生物胺能力的影响,结果如表6所示。发酵乳杆菌L2112在生物胺300 mg/L时,总胺降解率达到最高,为33.40%。发酵乳杆菌L41B在生物胺500 mg/L时,总胺降解率达到最高,为35.05%,2株菌在高浓度生物胺环境下均有较好的降生物胺能力,总胺降解率可达到28%及以上,对酱油中的主要生物胺组胺、酪胺和亚精胺也保持了较好的降解水平。
表6 不同生物胺浓度下发酵乳杆菌L2112、L41B降生物胺能力 单位:%
Table 6 BAs degradation ability of Lactobacillus fermentum L2112 and L41B under different concentration of BAs

生物胺质量浓度/(mg/L)序号亚精胺精胺酪胺组胺色胺苯乙胺尸胺腐胺总胺100L211211.20±0.8631.69±0.626.45±1.1421.80±1.325.66±0.2526.15±0.6223.78±0.4543.54±1.1013.55±0.98L41B31.20±0.2543.66±1.007.20±0.4526.32±0.933.10±0.2925.38±1.0730.49±1.1243.15±1.2223.66±0.68200L211245.20±1.8946.77±0.5732.20±0.9949.63±0.941.48±0.4623.20±0.8318.04±1.0238.89±1.3127.84±1.14L41B41.32±1.3135.89±1.4515.91±0.5830.74±1.555.58±0.4325.30±1.2420.78±0.8839.29±1.2125.83±1.62300L211245.07±1.2249.07±1.6924.80±1.7847.20±2.418.00±1.5025.33±1.4934.93±2.0149.60±1.6533.40±1.79L41B35.73±3.2940.27±0.5425.60±1.98 31.47±2.537.47±1.4725.87±2.5341.60±1.2441.87±2.8230.18±1.83400L211238.08±3.0646.00±3.5724.25±2.1430.60±2.600.40±2.0422.40±2.4730.40±1.5835.73±3.1129.24±2.36L41B41.40±1.7252.74±1.3619.74±1.9536.20±1.572.48±0.2617.55±1.2736.40±1.8842.92±1.5133.05±1.55500L211230.40±2.5447.52±2.7827.84±1.4436.80±1.880.64±0.4119.04±2.3431.68±2.4146.88±2.0928.83±1.67L41B40.64±0.7354.45±1.8833.60±2.0635.68±2.539.44±1.1326.08±2.6846.08±2.8247.20±2.4835.05±2.61
目前已发现影响乳酸菌降解生物胺能力的因素有:温度、pH、乙醇含量和盐含量等。王雪郦等[14]发现干酪乳杆菌FV006的降生物胺能力受乙醇体积分数和盐浓度影响,在乙醇体积分数为4%和NaCl质量量浓度50 g/L时,降解生物胺效果最好,对组胺、亚精胺、苯乙胺、腐胺、尸胺、酪胺和色胺的降胺率分别为9.44%、23.39%、16.27%、13.68%、19.14%、18.16%和12.45%。徐佳敏等[29]发现植物乳杆菌NXU-Q12在pH=4.5时生物胺降解能力最好,对腐胺、尸胺、组胺、酪胺、精胺的降解率分别为27.67%、25.00%、29.44%、27.96%、24.48%。柳佳娜等[35]发现发酵柠檬乳杆菌FSCBAD033在温度30~40 ℃有较好的生物胺降解能力。本研究探究温度、盐含量和环境生物胺浓度这3个因素分别对菌株L2112和菌株L41B降生物胺能力的影响,发现菌株L2112降生物胺能力分别在37 ℃、40 g/L NaCl质量浓度和300 mg/L生物胺质量浓度时达到最佳,总胺降解率最高为33.40%,总胺降解能力可达菌株L41B的降生物胺能力分别在37 ℃、130 g/L NaCl质量浓度和500 mg/L生物胺质量浓度时达到最佳,总胺降解率最高为35.05%。
3 结论
本研究从酱醪和酱油中筛选获得45株疑似乳酸菌菌株,经过革兰氏染色、镜检、生理生化试验和双层显色培养基试验筛得16株培养基不变色乳酸菌。通过生物胺氧化酶检测和LC-MS/MS对降生物胺能力进行测定,筛得5株综合降生物胺能力较强的乳酸菌,其中,L2112、L31B2和L41B对酱油中的主要生物胺——酪胺、组胺、亚精胺和苯乙胺的降解率分别达到63.76%、59.09%、43.38%和35.12%。经形态学、生理生化和分子生物学鉴定其均为发酵乳杆菌;5株菌在60 g/L NaCl质量浓度下生长良好,80、100 g/L NaCl质量浓度下受抑制,150、200 g/L NaCl质量浓度的高盐环境下仍能存活;pH 3的环境下均生长较好,其中L41B菌株耐盐、耐酸能力相对较弱。研究环境因素对菌株L2112和L41B降解生物胺降解能力的影响,L2112在37 ℃、40 g/L NaCl质量浓度和300 mg/L生物胺质量浓度时生物胺降解能力最佳,L41B在37 ℃、130 g/L NaCl质量浓度和400 mg/L生物胺质量浓度时生物胺降解能力最佳。综上,发酵乳杆菌L2112、L41B具有良好的降生物胺能力和耐酸、耐盐特性,有望应用于酱油生产中降解生物胺。
[1] BENKERROUM N. Biogenic amines in dairy products: Origin, incidence, and control means[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(4):801-826.
[2] RUIZ-CAPILLAS C, JIMÉNEZ-COLMENERO F. Biogenic amines in meat and meat products[J]. Critical Reviews in Food Science and Nutrition, 2004, 44(7-8):489-499.
[3] LIU Y N, HE Y Q, LI H, et al. Biogenic amines detection in meat and meat products: The mechanisms, applications, and future trends[J]. Journal of Future Foods, 2024, 4(1):21-36.
[4] QIN S, ZENG X M, JIANG M, et al. Genomic and biogenic amine-reducing characterization of Lactiplantibacillus planatraum JB1 isolated from fermented dry sausage[J]. Food Control, 2023, 154:109971.
[5] ZHU Y, TRAMPER J. Koji-where East meets West in fermentation[J]. Biotechnology Advances, 2013, 31(8):1448-1457.
[6] 邹阳, 赵谋明, 赵海锋. 高效液相色谱法同时测定酱油中的8种生物胺[J]. 现代食品科技, 2012, 28(5):570-573.ZOU Y, ZHAO M M, ZHAO H F. Simultaneous determination of 8 kinds of biogenic amines in soy sauce by HPLC[J]. Modern Food Science and Technology, 2012, 28(5):570-573.
[7] 李志军. 食品中生物胺及其产生菌株检测方法研究[D]. 青岛: 中国海洋大学, 2007.LI Z J. Methods for determination of genetic amines in food and amine-producing bacteria and its appficafion[D]. Qingdao: Ocean University of China, 2007.
[8] MOWER H F, BHAGAVAN N V, PONTIUS E B, et al. Tyramine content of Asian and Pacific foods determined by high performance liquid chromatography[J]. Food Chemistry, 1989, 31(4):251-257.
[9] MAH J H, PARK Y K, JIN Y H, et al. Bacterial production and control of biogenic amines in Asian fermented soybean foods[J]. Foods, 2019, 8(2):85.
[10] 张永生, 刘冬敏, 王建辉, 等. 植源性天然产物在食品中降生物胺作用研究进展[J]. 食品科学, 2022, 43(3):315-324.ZHANG Y S, LIU D M, WANG J H, et al. Advances in understanding the effects of plant-derived natural products on biogenic amine reduction in foods[J]. Food Science, 2022, 43(3):315-324.
[11] SUN L N, GUO W R, ZHAI Y J, et al. Screening and the ability of biogenic amine-degrading strains from traditional meat products in Inner Mongolia[J]. LWT, 2023, 176:114533.
[12] HERRERO-FRESNO A, MART NEZ N, S
NEZ N, S NCHEZ-LLANA E, et al. Lactobacillus casei strains isolated from cheese reduce biogenic amine accumulation in an experimental model[J]. International Journal of Food Microbiology, 2012, 157(2):297-304.
NCHEZ-LLANA E, et al. Lactobacillus casei strains isolated from cheese reduce biogenic amine accumulation in an experimental model[J]. International Journal of Food Microbiology, 2012, 157(2):297-304.
[13] QI Q, HUANG J, ZHOU R Q, et al. Exploring a degradation strategy for biogenic amines based on the Cantonese soy sauce production method[J]. Food Control, 2021, 130:108281.
[14] 王雪郦, 雷超, 申开卫, 等. 干酪乳杆菌(Lactobacillus casei)FV006对发酵食品中生物胺的降解性能[J]. 食品工业科技, 2023, 44(14):137-144.WANG X L, LEI C, SHEN K W, et al. Degradation performance of biogenic amines in fermented food by Lactobacillus casei FV006[J]. Science and Technology of Food Industry, 2023, 44(14):137-144.
[15] GUO J, LUO W, FAN J, et al. Co-inoculation of Staphylococcus piscifermentans and salt-tolerant yeasts inhibited biogenic amines formation during soy sauce fermentation[J]. Food Research International, 2020, 137:109436.
[16] COOPER R A. On the amine oxidases of Klebsiella aerogenes strain W70[J]. FEMS Microbiology Letters, 1997, 146(1):85-89.
[17] JAGUEY-HERN NDEZ Y, AGUILAR-ARTEAGA K, OJEDA-RAMIREZ D, et al. Biogenic amines levels in food processing: Efforts for their control in foodstuffs[J]. Food Research International, 2021, 144:110341.
NDEZ Y, AGUILAR-ARTEAGA K, OJEDA-RAMIREZ D, et al. Biogenic amines levels in food processing: Efforts for their control in foodstuffs[J]. Food Research International, 2021, 144:110341.
[18] 叶陵, 李勇, 王蓉蓉, 等. 剁辣椒中优良乳酸菌的分离鉴定及其生物学特性分析[J]. 食品科学, 2018, 39(10):112-117.YE L, LI Y, WANG R R, et al. Isolation, identification and biological characteristics of excellent lactic acid bacteria from fermented hot pepper[J]. Food Science, 2018, 39(10):112-117.
[19] 牛天娇, 陈历水, 孔杭如, 等. 传统发酵肉制品中降解生物胺菌株的筛选鉴定与应用研究[J]. 中国酿造, 2019, 38(9):43-48.NIU T J, CHEN L S, KONG H R, et al. Screening, identification and application of biogenic amine degrading strains derived from traditional fermented meat products[J]. China Brewing, 2019, 38(9):43-48.
[20] 马宇霞, 卢士玲, 李开雄, 等. 熏马肠中生物胺氧化酶菌株的筛选与鉴定[J]. 现代食品科技, 2014, 30(5):49-55.MA Y X, LU S L, LI K X, et al. Screening and identification of amine oxidase productive strains from smoked horse intestine[J]. Modern Food Science and Technology, 2014, 30(5):49-55.
[21] 刘玉晗, 卢士玲, 陆静, 等. 乳酸菌中生物胺氧化酶菌株的筛选[J]. 现代食品科技, 2016, 32(4):106-113.LIU Y H, LU S L, LU J, et al. Screening of amine oxidase-producing strains from lactic acid bacteria[J]. Modern Food Science and Technology, 2016, 32(4):106-113.
[22] 陈召桂, 郑国建, 朱玲琳. 液相色谱-串联质谱法测定腐乳中的生物胺[J]. 中国酿造, 2020, 39(12):160-163.CHEN Z G, ZHENG G J, ZHU L L. Determination of biogenic amine in sufu by LC-MS/MS[J]. China Brewing, 2020, 39(12):160-163.
[23] 孙世鑫, 李科, 骆鹏飞, 等. 制备富含γ-氨基丁酸酸奶的乳酸菌筛选及相关特性分析[J]. 现代食品科技, 2021, 37(3):106-114; 285.SUN S X, LI K, LUO P F, et al. Screening and characteristics of lactic acid bacteria for preparing γ-aminobutyric acid-rich yogurt[J]. Modern Food Science and Technology, 2021, 37(3):106-114; 285.
[24] 秦雅莉, 赵笑颍, 沈圆圆, 等. 酸笋中具有抗炎活性乳酸菌的筛选及鉴定[J]. 食品科学, 2022, 43(8):121-127.QIN Y L, ZHAO X Y, SHEN Y Y, et al. Screening and identification of anti-inflammatory lactic acid bacteria from sour bamboo shoot[J]. Food Science, 2022, 43(8):121-127.
[25] 王强, 周真江, 曾维友, 等. 生物胺降解乳酸菌的筛选与特性研究[J]. 中国酿造, 2021, 40(3):115-119.WANG Q, ZHOU Z J, ZENG W Y, et al. Screening and characteristics of lactic acid bacteria degrading biogenic amines[J]. China Brewing, 2021, 40(3):115-119.
[26] 李恒, 王泽亮, 邓维琴, 等. 甜瓣子中生物胺产生菌株和降解菌株的筛选[J]. 中国食品学报, 2022, 22(10):190-198.LI H, WANG Z L, DENG W Q, et al. Screening of biogenic amines producing and degrading strains in broad bean past-meju[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(10):190-198.
[27] FONG F L Y, LAM K Y, SAN LAU C, et al. Reduction in biogenic amines in Douchi fermented by probiotic bacteria[J]. PLoS One, 2020, 15(3): e0230916.
[28] LI B B, LU S L. The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods: A review[J]. Process Biochemistry, 2020, 99:331-339.
[29] 徐佳敏, 周桂珍, 田晓菊. 葡萄酒酿造中降解生物胺乳酸菌的筛选、鉴定及其特性[J]. 食品与发酵工业, 2022, 48(21):48-53.XU J M, ZHOU G Z, TIAN X J. Screening, identification, and characteristics of lactic acid bacteria with biogenic amines degrading activity in wine brewery[J]. Food and Fermentation Industries, 2022, 48(21):48-53.
[30] 张雁凌, 张雁南, 刘刚. 乳酸菌和酵母菌的添加对低盐酱油品质的影响[J]. 中国调味品, 2020, 45(12):45-47; 51.ZHANG Y L, ZHANG Y N, LIU G. Effects of the addition of lactic acid bacteria and yeast on the quality of low-salt soy sauce[J]. China Condiment, 2020, 45(12):45-47; 51.
[31] LIU H, YANG S J, LIU J, et al. Effect of salt concentration on Chinese soy sauce fermentation and characteristics[J]. Food Bioscience, 2023, 53:102825.
[32] 刘威, 董浩, 曾晓房, 等. 酱油发酵过程中生物胺生成影响因素及其调控研究进展[J]. 中国调味品, 2022, 47(12):201-204; 208.LIU W, DONG H, ZENG X F, et al. Research progress on influencing factors and regulation of biogenic amines production during soy sauce fermentation[J]. China Condiment, 2022, 47(12):201-204; 208.
[33] MILICEVIC B, DANILOVIC B, ZDOLEC N, et al. Microbiota of the fermented sausages: Influence to product quality and safety[J]. Bulgarian Journal of Agricultural Science, 2014, 20: 1061-1078.
[34] 李丹, 王娅琴, 赵海锋, 等. 盐水浓度及pH对高盐稀态酱油酿造初期酱醪理化性质影响的研究[J]. 现代食品科技, 2011, 27(4): 380-383.LI D, WANG Y Q, ZHAO H F, et al. Effects of brine salt concentration and pH on physicochemical properties during the early fermentation of high-salt diluted soy sauce[J]. Modern Food Science and Technology, 2011, 27(4): 380-383.
[35] 柳佳娜, 张宾, 刘宇, 等. 高效降解生物胺乳酸菌的筛选、鉴定及特性研究[J]. 中国酿造, 2021, 40(7):141-147.LIU J N, ZHANG B, LIU Y, et al. Screening, identification and characteristics of a high efficient biogenic amines-degrading lactic acid bacteria[J]. China Brewing, 2021, 40(7):141-147.