高尿酸血症是以血尿酸水平过高为特征的一种代谢紊乱疾病[1]。高尿酸血症伴有尿酸盐结晶沉积于关节和肾脏的症状,是导致痛风性关节炎、尿酸性肾结石、心血管、肾脏疾病等多种疾病的主要因素[2]。随着高尿酸血症和痛风病发率呈逐年增加且年轻化的趋势,高尿酸血症被看成是继高血压、高血脂和糖尿病“三高”之后的第4个重要的危险因素[3]。
尿酸是嘌呤核苷酸分解的最终产物。黄嘌呤氧化酶(xanthine oxidase,XOD)是催化嘌呤生成尿酸的关键酶[4-5]。目前临床针对高尿酸血症的药物治疗主要从减少尿酸生成或促进尿酸代谢2条途径进行,抑制尿酸生成的药物如别嘌呤醇[6-7],促进尿酸排泄的药物如苯溴马隆[8-9]。XOD抑制剂类药物(例别嘌呤醇)在大多数患者中是有效的并且一直延用至今,但其副作用也不容忽视,应用后病人会伴有发热、过敏性皮疹、腹痛、腹泻、白细胞及血小板减少,甚至肝功能损伤等[10-11]。因此,寻求一种温和、无毒副作用的方式来有效缓解或辅助治疗高尿酸血症具有十分重要的意义。
乳酸菌具有安全、无毒副作用、可食用等特点,其对高尿酸血症的作用功效及途径近几年被陆续报道[12]。崔方超等[13]通过实验验证了乳酸菌代谢物中的有机酸可以有效抑制XOD活性。牛春华等[14]研究发现植物乳杆菌UA149能够降低XOD活性,并通过降低白三烯、血栓素和炎症因子水平来减缓炎症反应,从而对实验大鼠的高尿酸血症起到预防和辅助治疗作用;呼静等[15]和王佳彬等[16]分别筛选到能够高效降解核苷的罗伊氏乳杆菌NL02和短乳杆菌LB1lac20,其细胞代谢物和内容物对XOD酶均有一定的抑制效果,具有潜在的降尿酸能力。WANG等[17]研究发现基因组中存在肌苷水解酶基因的短乳杆菌DM9218可以有效降解肌苷,降低由高果糖饮食诱导的小鼠血清尿酸水平,同时能够健全肠道屏障并减少脂多糖的产生,降低XOD酶活性。
如上所述,目前已有大量乳酸菌株被证实对于高尿酸血症具有辅助治疗作用,但高效菌种资源的不断丰富及作用机制的进一步阐明仍将是该领域研究的重点。西藏开菲尔粒,又称“西藏灵菇”,主要是由多种乳酸菌、酵母菌共生在一起,偶尔也会含有醋酸菌等微生物,并以乳酸菌为优势菌形成的形似花椰菜的乳白色团状聚合的复杂共生体,是可用于酸奶制作的优质天然野生菌种资源[18]。开菲尔粒中所含有的丰富多样的乳酸菌资源为具有核苷降解能力乳酸菌的挖掘与开发提供了无限可能。本研究旨在自西藏开菲尔粒中分离筛选能够高效降核苷的乳酸菌,并结合非靶代谢组学确定其代谢物并从中筛选出XOD抑制剂,进而明确菌株的降尿酸机制,为高尿酸血症的辅助治疗提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
本实验所用的开菲尔粒采集自西藏林芝地区牧民传统发酵酸奶。
1.1.2 试剂
革兰氏试剂,北京索莱宝科技有限公司;肌苷、鸟苷、1-羟基-2-萘甲酸、吲哚丙酮酸、3-吲哚丙烯酸,上海麦克林生化科技股份有限公司;腺苷、鸟嘌呤、腺嘌呤、黄嘌呤、次黄嘌呤,北京酷来搏科技有限公司;MRS培养基,青岛海博生物技术有限公司;细菌基因组提取试剂盒,南京诺唯赞生物科技股份有限公司;细菌通用引物27F-1492R,生工生物工程(上海)股份有限公司;Master Mix,南京诺唯赞生物科技股份有限公司;甲醇、乙腈,CNW Technologies;乙酸铵,SLGMA-ALDRICH;氨水,Fisher Chemical;均为LC-MS级。
1.2 仪器与设备
LC-20A高效液相色谱仪,日本岛津仪器有限公司;UV-5500PC紫外分光光度计,上海元析仪器有限公司;5424R高速冷冻低温离心机,德国艾本德;Regulus8220扫描电镜,日本日立集团;BXM-30R灭菌锅,金博仕生物技术有限公司;TS-UR摇床,浙江华源仪器有限公司;Vanquish超高效液相、Orbitrap Exploris 120高分辨质谱,Thermo Fisher Scientific;C1000 Touch PCR仪,美国伯乐Biorad。
1.3 实验方法
1.3.1 西藏开菲尔粒中乳酸菌培养与分离
将4 ℃保藏的西藏开菲尔粒按1∶10(g∶mL)接种全脂灭菌乳中,25 ℃静置24 h,然后用灭菌水清洗已发酵的牛乳,将开菲尔粒按比例重新接种到牛乳中,继续按照上述方法培养。取100 mg开菲尔粒加入无菌离心管中充分研磨,加入400 μL无菌生理盐水混匀,梯度稀释。取适当梯度的稀释液100 μL涂布到MRS固体培养基上,30 ℃静置培养 4~5 d。在固体培养基上选取单菌落,分别接种到MRS液体培养基中,30 ℃静置培养72 h,菌液4 ℃保藏备用。
1.3.2 降核苷乳酸菌的筛选
将1.3.1节中保藏的菌株活化于MRS液体培养基中,37 ℃静置培养24 h,将OD600值调至1,然后以2%(体积分数)的接种量接种于MRS液体培养基中,37 ℃静置培养48 h,取2 mL培养液于4 ℃、8 000 r/min条件下离心5 min,收集菌体。收集的菌体用无菌生理盐水重悬清洗,再在4 ℃、8 000 r/min条件下离心5 min收集菌体;菌体清洗2次;向清洗好的菌体中加入750 μL的反应液(肌苷、鸟苷、腺苷质量浓度均为0.5 g/L),重悬菌体后于37 ℃、180 r/min摇床中反应1 h,反应结束时迅速将反应液置于100 ℃下处理5 min终止反应,4 ℃、12 000 r/min离心2 min,收集上清液,用0.22 μm微孔滤膜过滤上清液,利用HPLC法测定3种核苷的含量。色谱条件为:色谱柱Aligent Zorbax SB-C18,柱温为35 ℃,流速为1 mL/min,进样量10 μL,检测波长为260 nm,流动相为 V(水)∶V(色谱甲醇)=95∶5,pH值为4.7。
按公式(1)计算计算菌株对3种核苷的降解率:
降解率![]()
(1)
式中:c为质量浓度,g/L。
1.3.3 高效降核苷菌株的鉴定
将菌株接种于MRS肉汤中,培养48 h后,稀释涂布,革兰氏染色镜检;取发酵液离心收集菌体,用2.5%(体积分数)戊二醛固定(4 ℃,4 h),固定结束后用生理盐水清洗菌体3次,分别用30%、50%、70%、90%、100%乙醇进行梯度脱水,最后用乙酸异戊酯置换水分20 min,将处理好的菌体置入干燥器进行干燥后放置于扫描电子显微镜样品台上,金溅射涂覆,在高真空环境下进行观察和分析。结合五糖发酵实验和《伯杰细菌鉴定手册》进行初步鉴定。利用细菌基因组DNA提取试剂盒提取基因组,用细菌通用引物27F-1492R扩增16S rRNA基因全长序列,由上海生工生物有限公司进行序列测定。将获得的16S rRNA序列与NCBI网站上已知序列进行比对,运用MEGA7.0软件构建系统发育树。PCR扩增条件如表1所示。
表1 PCR扩增条件
Table 1 PCR amplification conditions

PCR扩增体系PCR扩增程序Master Mix15 μL预变性95 ℃5 minDNA1 μL变性95 ℃15 s上游引物1 μL退火55 ℃15 s35个循环下游引物1 μL延伸72 ℃1 minddH2O12 μL再延伸72 ℃5 min总计30 μL冷却4 ℃
1.3.4 菌株对核苷的降解及其降解产物测定
将活化好的ZD103菌株分别与1.5 g/L的肌苷、腺苷溶液和0.7 g/L的鸟苷(本实验所用鸟苷在水中的最大溶解度为0.7 g/L)溶液反应2 h(具体方法同1.3.2节),10 min间隔取样,测定乳酸菌降解核苷与时间的关系,并进一步测定3种核苷的降解产物。
1.3.5 发酵粘液乳杆菌ZD103代谢产物的获得
取冰箱中保藏的菌株2%接种于20 mL MRS肉汤中,培养至OD600=1,以2%接种于20 mL MRS肉汤中,取第2代对数生长期培养液20 mL于离心管中,8 000 r/min,4 ℃离心10 min,取上清液,经0.22 μm无菌过滤器过滤后得到乳酸菌胞外代谢产物;将弃去上清液之后的菌体沉淀用PBS缓冲液(pH=7.4)洗涤菌体2次,将菌体重悬于20 mL PBS缓冲液(pH=7.4)中,用超声波细胞破碎仪破碎细胞。超声破碎的条件为:在冰浴的条件下,功率200 W,(工作5 s,停5 s)的脉冲破碎20 min。将超声后得到的液体于4 ℃、8 000 r/min离心10 min,收集上清液,经0.22 μm无菌过滤器过滤后得到乳酸菌胞内代谢产物。取100 μL代谢物样品至EP管中,加入400 μL提取液[V(甲醇)∶V(乙腈)=1∶1,含同位素标记内标混合物],涡旋混匀30 s,超声10 min(冰水浴),-40 ℃静置1 h,将样品4 ℃、12 000 r/min离心15 min,取上清液使用Vanquish (Thermo Fisher Scientific)超高效液相色谱仪,通过Waters ACQUITY UPLCBEH Amide (2.1 mm×50 mm, 1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A相为水相,含25 mmol/L乙酸铵和25 mmol/L氨水,B相为乙腈。样品盘温度:4 ℃,进样体积:2 μL。
1.3.6 代谢产物对XOD抑制作用的测定
实验设计如下:空白组(XP)为黄嘌呤X(800 μL)+PBS(200 μL);对照组(XPO)为X(800 μL)+PBS(80 μL)+XOD(120 μL);实验组(XMO)为X(800 μL)+代谢产物(80 μL)+XOD(120 μL),将XOD与代谢产物/PBS混匀,于37 ℃反应30 min,之后加入黄嘌呤充分混合后于37 ℃反应1 h,反应结束后,将反应管放在95 ℃灭酶5 min,灭酶后用HPLC法检测体系中剩余黄嘌呤的含量。为进一步确定代谢物中发挥抑制作用的有效成分,分别对代谢物进行高温灭酶以及pH值调节。
1.3.7 分子对接
分子对接可以通过研究分子间相互作用从而预测分子间的结合方式因此被广泛地应用于分析小分子配体与蛋白相互作用的结合机制以及进行抑制剂的筛选。从PDB数据库(https://www.rcsb.org/)下载XOD的3D结构,从tcmsp中下载酸类物质结构。XOD催化中心包括1个钼蝶呤中心、2个铁-硫中心和1个黄素腺嘌呤二核苷酸,其中钼蝶呤中心是黄嘌呤氧化酶催化黄嘌呤生成尿酸的关键位点[19]。以钼蝶呤中心的Arg880为中心,将XOD与ZD103发酵黏液乳杆菌胞外代谢物中的酸类物质进行对接打分。
1.3.8 XOD抑制效果的验证
对分子对接筛选出的代谢物进行验证,分别配制1 g/L的1-羟基-2-萘甲酸、3-吲哚丙烯酸、吲哚丙酮酸溶液,并稀释至不同浓度,按1.3.6节的方法进行XOD抑制效果的验证。如公式(2)所示:
抑制率![]()
(2)
式中:c为黄嘌呤质量浓度,μg/mL。
2 结果与分析
2.1 西藏开菲尔粒中乳酸菌的分离及高效降嘌呤核苷菌株筛选
从西藏开菲尔粒中分离纯化得到28株菌。由表2可知,对肌苷降解率在30%以上的有3株,60%以上的1株,对鸟苷降解率在30%及以上的有4株,60%以上的有1株,对腺苷降解率在30%以上的有7株,60%以上的有2株。其中ZD103菌株在60 min时对质量浓度分别为0.5 g/L 3种核苷的降解率均在60%以上,后续对菌株ZD103进行深入研究。
表2 菌株对核苷降解能力的测定结果
Table 2 Determination of nucleoside degradation ability of strains

菌株编号降解率/%肌苷鸟苷腺苷ZD826.12±1.056.70±1.2715.70±1.21ZD838.24±0.5612.60±0.8522.91±1.56ZD8415.41±2.8216.13±3.1115.08±0.12ZD856.40±0.966.08±0.027.12±1.14ZD868.00±1.139.15±0.1310.89±0.23ZD876.21±0.026.96±0.068.06±0.74ZD8814.82±1.6212.88±1.2932.19±1.60ZD895.69±0.656.05±0.0913.83±0.55ZD9035.46±0.0541.73±1.2855.20±0.93ZD9118.73±0.1422.04±0.1128.75±1.05ZD928.09±0.778.15±0.0511.26±0.62ZD9321.64±1.2328.17±1.7928.13±0.01ZD9427.64±1.8630.02±0.0833.61±0.19ZD9514.72±0.0120.11±0.1225.01±1.03ZD9618.03±0.1716.98±0.0917.22±0.13ZD9723.66±0.5626.22±3.2431.99±1.10ZD9810.21±0.039.79±1.1510.04±0.03ZD995.97±0.136.85±0.319.17±0.88ZD10022.03±0.2428.03±0.1831.07±0.29ZD1012.87±0.014.19±0.097.16±0.81ZD10257.04±1.1646.68±1.4776.21±2.33ZD10361.79±0.9964.20±1.1371.89±0.57ZD1049.68±0.0212.05±0.028.97±0.16ZD1055.67±0.236.92±0.427.96±0.14ZD1069.21±0.218.01±0.1410.08±1.07ZD10717.63±1.0920.93±1.5524.77±0.36ZD1084.07±0.767.20±0.7820.72±1.11ZD1098.15±0.138.73±0.169.01±0.77
2.2 高效降嘌呤核苷菌株的鉴定
在MRS平板上,ZD103菌落呈圆形、乳白色,边缘完整,表面光滑(图1-a)。革兰氏染色后镜检呈紫色,为革兰氏阳性细菌(图1-b),结合扫描电子显微镜图判断其为革兰氏阳性杆菌(图1-c)。糖发酵实验结果显示(表3),ZD103菌株能发酵麦芽糖、蔗糖、棉子糖、菊糖、乳糖产酸,结合《伯杰细菌鉴定手册》,判定ZD103菌株为乳酸杆菌。将菌株ZD103的16S rRNA序列输入NCBI数据库中进行BLAST比对发现,菌株ZD103与发酵粘液乳杆菌(Limosilactobacillus fermentum strain CIP 102980)同源性达到99.78%,MEGA7软件构建的系统发育树如图2所示,菌株ZD103与发酵粘液乳杆菌同属一个分支,亲缘关系最近,因此判定该菌为发酵粘液乳杆菌,并将其命名为发酵粘液乳杆菌ZD103。
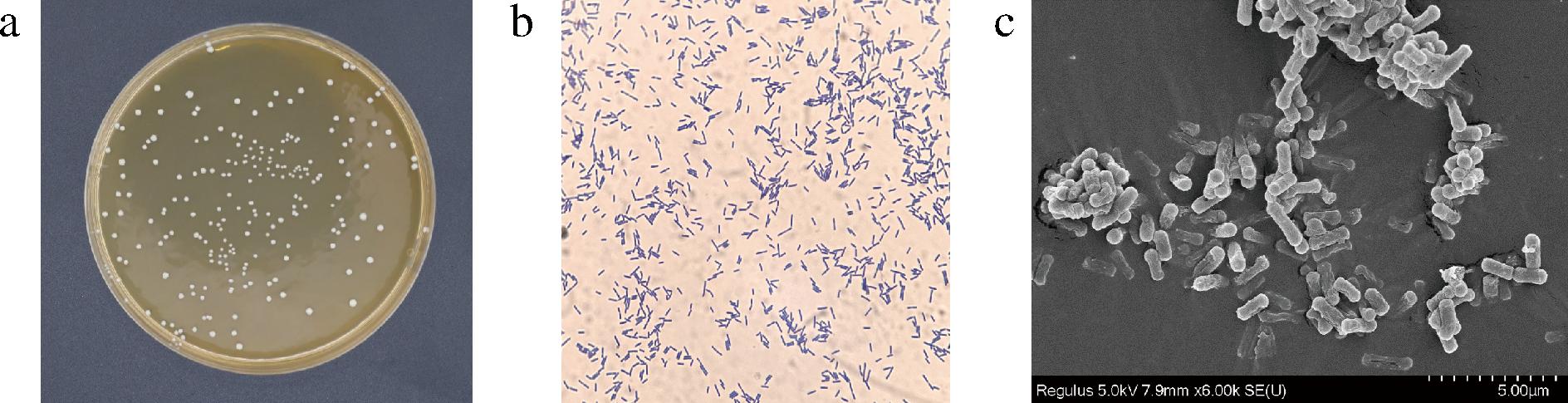
a-ZD103菌落图;b-革兰氏镜检图;c-扫描电子显微镜图
图1 菌株ZD103菌落和菌体形态
Fig.1 Colony and morphology of strain ZD103

图2 ZD103的16S rRNA基因序列系统发育树
Fig.2 Phylogenetic relationship of 16S rRNA gene sequence of ZD103
表3 ZD103糖发酵实验结果
Table 3 Results of ZD103 sugar fermentation experiment

糖类菌株ZD103七叶苷 -纤维二糖-麦芽糖 +甘露醇 -水杨苷 -山梨醇 -蔗糖 +棉子糖 +菊糖 +乳糖 +
2.3 发酵粘液乳杆菌ZD103对嘌呤核苷的降解及其机制研究
由图3-a可知,发酵粘液乳杆菌ZD103在90 min时可以将3种质量浓度均为0.5 g/L的混合核苷质量浓度降为0 g/L。发酵粘液乳杆菌ZD103对肌苷、鸟苷和腺苷3种核苷的降解为同步进行,不存在先后顺序。由图3-b可知,发酵粘液乳杆菌ZD103在100 min 时可以百分百降解质量浓度为1.5 g/L的肌苷浓度,40 min内完全降解质量浓度为0.7 g/L的鸟苷,110 min内完全降解质量浓度为1.5 g/L的腺苷浓度。

a-ZD103对混合核苷的降解;b-ZD103对单一核苷的降解
图3 ZD103对核苷的降解图
Fig.3 Degradation rate of nucleosides by ZD103
由图4可知,发酵粘液乳杆菌ZD103与3种核苷反应后,随着3种核苷峰面积的减小,出现了3种新的产物,HPLC结果显示分别为次黄嘌呤、鸟嘌呤、腺嘌呤,说明发酵粘液乳杆菌ZD103降低嘌呤核苷的机制是将其转化成了对应的嘌呤碱基。嘌呤碱基与嘌呤核苷相比不易被肠道吸收[20],因此发酵粘液乳杆菌ZD103可以通过间接降低肠道对嘌呤核苷的吸收从而减少尿酸的生成。
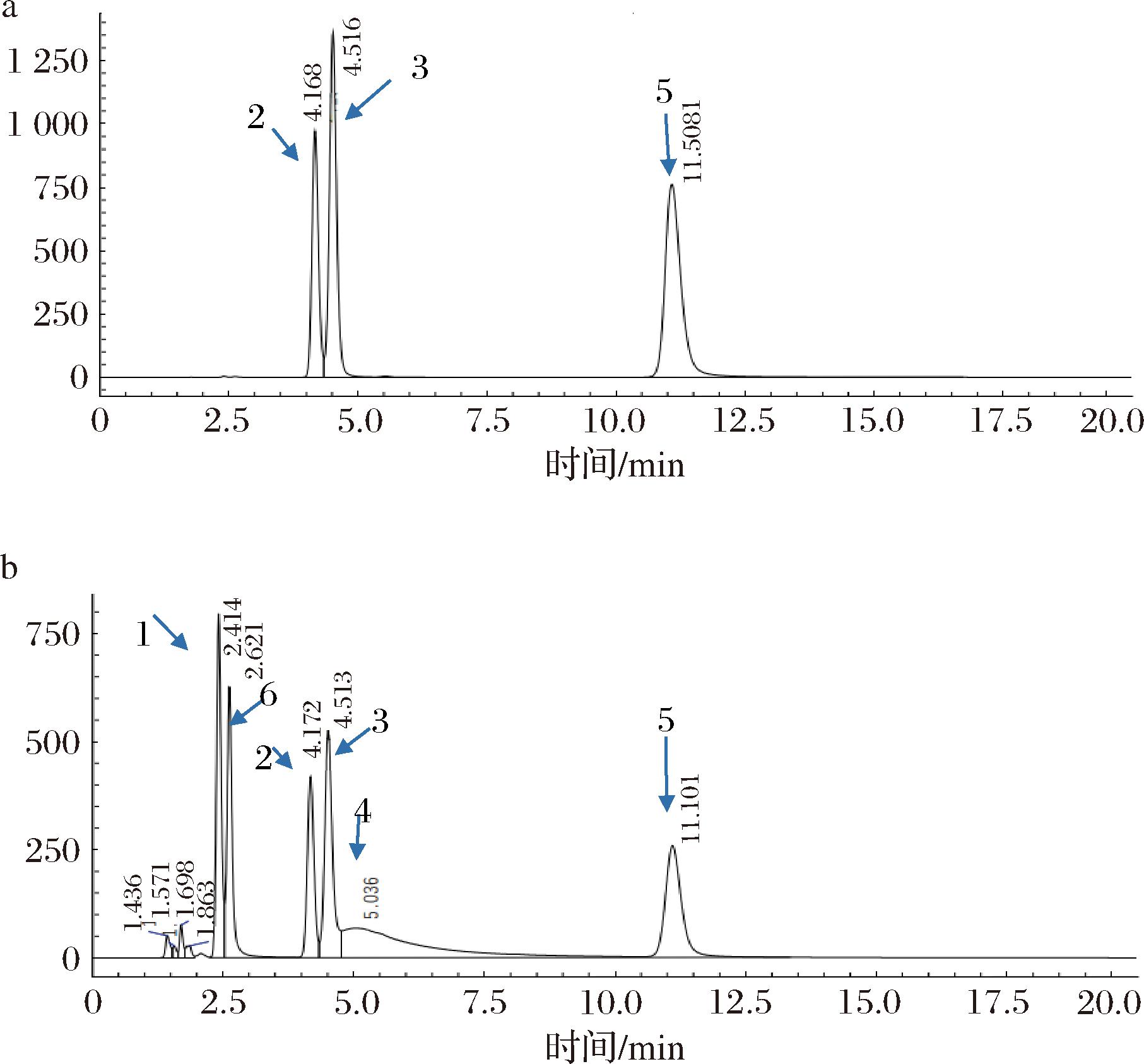
1-次黄嘌呤;2-肌苷;3-鸟苷;4-腺嘌呤;5-腺苷;6-鸟嘌呤
a-未接种ZD103核苷峰图;b-接种ZD103核苷峰图
图4 ZD103降解核苷产物峰图
Fig.4 Peak map of products degradated by ZD103
2.4 发酵粘液乳杆菌ZD103代谢产物对XOD的作用
如图5-a所示,XPO组的黄嘌呤浓度显著低于只有黄嘌呤的空白组,说明在此反应条件下,XOD具有较好的酶活。XMO组的黄嘌呤浓度显著高于XPO组,说明了ZD103的代谢产物抑制了XOD的活性;而灭酶处理的代谢产物仍对XOD有显著抑制作用,由此推断发酵粘液乳杆菌ZD103代谢产物对XOD的抑制不是酶类物质在发挥作用;用氢氧化钠中和后的代谢产物失去了对XOD的抑制作用,由此判断发酵粘液乳杆菌ZD103抑制XOD是其中的酸类物质在发挥作用。图5-b显示,XMO(胞外)组的黄嘌呤浓度显著高于XPO组,而XMO(胞内)组的黄嘌呤浓度与XPO组无显著差异,说明ZD103的胞外代谢物显著抑制了XOD活性,进一步证实了发挥抑制作用的酸类物质存在于ZD103的胞外代谢物中。

a-不同处理的ZD103代谢产物对XOD的影响;b-ZD103胞内、胞外代谢产物对XOD的影响
图5 ZD103代谢产物对XOD的作用
Fig.5 Effect of metabolites of ZD103 on XOD
注:不同小写字母表示显著性差异(P<0.05)。
2.5 分子对接
根据发酵液非靶代谢组学检测结果,发酵粘液乳杆菌ZD103发酵液中共有包括脂肪酸类、有机酸类、氨基酸类、芳香类化合物等在内的387种物质,其中酸类物质共有52种。将这52种酸类物质与XOD进行分子对接(表4),选择与XOD作用力较强(负值越大,说明与XOD作用力越强)的3种物质进行验证,根据表4的对接结果,最终选择了1-羟基-2-萘甲酸(1-hydroxy-2-naphthoic acid)、3-吲哚丙烯酸(3-indoleacrylic acid)、吲哚丙酮酸(indolepyruvate)3种物质进行后续验证。
表4 分子对接结果
Table 4 The results of molecular docking

序号物质名称分值序号物质名称分值1(R)-3-hydroxybutyric acid-4.727beta-guanidinopropionic acid-5.121-hydroxy-2-naphthoic acid-8.328byssochlamic acid-5.832-(methylamino)benzoic acid-5.729caproic acid-5.142,3-dihydroxybutanedioic acid-4.730cis,cismuconic acid-5.152,4,6-octatriynoic acid-5.531cis-aconitic acid-5.762-aminobenzoic acid-6.932citraconic acid-5.172-aminoheptanedioic acid-6.133D-malic acid-4.582-ethylacrylic acid-5.234gluconic acid-5.392-hydroxy-3-methylbutyric acid-5.035glycolic acid-3.6102-hydroxybutyric acid-4.436glyoxylic acid-3.2112-ketobutyric acid-4.637hydantoin-5-propionic acid-6.2123-aminobutanoic acid-4.738hygric acid-5.0 133-furoicacid-5.239indoleacrylic acid-8.7143-hydorxy-3-methylglutaric acid-5.440indolelactic acid-7.3153-hydroxydecanoic acid-5.341indolepyruvate-7.5163-hydroxyisovaleric acid-4.542isocitric acid-5.6173-indoleacrylic acid-8.743itaconic acid-4.8184-acetamidobutyric acid-5.144L-azetidine-2-carboxylic acid-4.4194-aminobutyric acid-4.545L-lactic acid-4.0 204-hydroxybenzoic acid-6.946malonic acid-4.3214-pyridoxic acid-6.847methyl acrylate-3.8225-aminovaleric acid-5.048nicotinic acid-5.9235-hydroxyindoleacetic acid-7.449oxoglutaric acid-4.924alpha-hydroxyisobutyric acid-4.350pyruvic acid-4.0 25alpha-ketoisovaleric acid-4.451succinic acid-4.826aminoadipic acid-5.552syringic acid-4.7
图6-a为1-羟基-2-萘甲酸和XOD的相互作用模式图,其中1-羟基-2-萘甲酸与XOD的氨基酸残基GLU1261形成氢键相互作用力,并与氨基酸残基LEU1014、VAL1011形成疏水相互作用。图6-b为3-吲哚丙烯酸与XOD的相互作用模式图,其中3-吲哚丙烯酸与XOD的氨基酸残基ALA1079之间形成氢键相互作用和疏水相互作用。图6-c为吲哚丙酮酸与XOD的相互作用模式图,吲哚丙酮酸与XOD的氨基酸残基GLY1260、GLN1194形成氢键相互作用,与氨基酸残基MET1038之间形成疏水相互作用。这3种物质与黄嘌呤氧化酶之间形成的化学键有助于小分子发挥作用,从而对酶产生一定的促进或抑制作用。

a-1-羟基-2-萘甲酸;b-3-吲哚丙烯酸;c-吲哚丙酮酸
图6 不同代谢物与XOD活性中心结合位点2D模式图
Fig.6 2D pattern diagram of binding sites between different metabolites and XOD active centers
2.6 代谢产物对黄嘌呤氧化酶抑制效果的验证
经验证,1-羟基-2-萘甲酸、3-吲哚丙烯酸、吲哚丙酮酸在0.1~1 g/L浓度范围内均对XOD有不同程度的抑制作用(图7)。其中,1-羟基-2-萘甲酸在0.8 g/L时抑制率达到最大[(98.66±1.63)%],表现出很强的XOD抑制能力;3-吲哚丙烯酸在0.8 g/L时抑制率达到最大[(53.87±1.38)%],当质量浓度高于0.8 g/L时,抑制率开始下降;吲哚丙酮酸对XOD的抑制率呈先上升后下降的趋势,在质量浓度低于0.5 g/L时对XOD无抑制作用,在0.5~0.9 g/L浓度范围内对XOD的抑制随着浓度的升高抑制效果越好,在0.9 g/L时达到最大抑制率[(20.40±0.71)%],这也为发酵粘液乳杆菌ZD103代谢产物的XOD抑制活性提供了理论依据。

a-1-羟基-2-萘甲酸的抑制曲线;b-3-吲哚丙烯酸的抑制曲线;c-吲哚丙酮酸的抑制曲线
图7 不同代谢物的抑制曲线
Fig.7 Inhibition curves of different metabolites
3 结论
本研究自西藏开菲尔粒中分离得到的发酵粘液乳杆菌ZD103对肌苷、鸟苷、腺苷的降解率均可达到100%,核苷降解后生成的嘌呤类物质与核苷相比不易被肠道吸收,所以ZD103可能会通过改变核苷形态以减少肠道对其的吸收来减少血尿酸的生成,从而达到缓解高尿酸血症的效果。发酵粘液乳杆菌ZD103代谢物中的1-羟基-2-萘甲酸、3-吲哚丙烯酸、吲哚丙酮酸对XOD的抑制率分别为(98.66±1.63)%、(53.87±1.38)%和(20.40±0.71)%,具有良好的XOD抑制能力,可以阻碍黄嘌呤到尿酸的转化。综上,发酵粘液乳杆菌ZD103是一株具有降尿酸潜力的乳酸菌株,未来有望应用到高尿酸血症的预防和治疗中。
[1] ZHAOH Y, LU Z X, LU Y J.The potential of probiotics in the amelioration of hyperuricemia[J].Food &Function, 2022, 13(5):2394-2414.
[2] LI Z J, XUE Y B, WANG N F, et al.High uric acid model in Caenorhabditis elegans[J].Food Science and Human Wellness, 2019, 8(1):63-66.
[3] 劳文艳, 赵建, 郭豫, 等.辣木叶等配方提取物对酵母膏诱导小鼠高尿酸血症的影响[J].北京联合大学学报, 2020, 34(3):83-88.LAO W Y, ZHAO J, GUO Y, et al.The effect of moringa leaf formula extracts on yeast extract-induced hyperuricemia mice[J].Journal of Beijing Union University, 2020, 34(3):83-88.
[4] HOU C W, LEE Y C, HUNG H F, et al.Longan seed extract reduces hyperuricemia via modulating urate transporters and suppressing xanthine oxidase activity[J].The American Journal of Chinese Medicine, 2012, 40(5):979-991.
[5] ZHAO R, CHEN D, WU H L.Pu-erh ripened tea resists to hyperuricemia through xanthine oxidase and renal urate transporters in hyperuricemic mice[J].Journal of Functional Foods, 2017, 29:201-207.
[6] CHAO J, TERKELTAUB R.A critical reappraisal of allopurinol dosing, safety, and efficacy for hyperuricemia in gout[J].Current Rheumatology Reports, 2009, 11(2):135-140.
[7] CHOHAN S, BECKER M A, MACDONALD P A, et al.Women with gout:Efficacy and safety of urate-lowering with febuxostat and allopurinol[J].Arthritis Care Research, 2012, 64(2):256-261.
[8] KURAJOH M, KOYAMA H, SHOJI T, et al.Relationship between serum allantoin and urate in healthy subjects and effects of benzbromarone in gout patients[J].International Journal of Clinical Pharmacology and Therapeutics, 2012, 50(4):265-271.
[9] 彭本君, 李艳玲.苯溴马隆治疗痛风伴高尿酸血症的临床效果观察[J].中国社区医师, 2023, 39(27):32-34.PENG B J, LI Y L.Clinical effect observation of benzbromarone in treatment of gout with hyperuricemia[J].Chinese Community Doctors, 2023, 39(27):32-34.
[10] 高天舒, 胡伟凤, 肖愉箫, 等.黄嘌呤氧化酶抑制剂的研究进展[J].药学研究, 2022, 41(9):605-610.GAO T S, HU W F, XIAO Y X, et al.Research progress of xanthine oxidase inhibitors[J].Journal of Pharmaceutical Research, 2022, 41(9):605-610.
[11] 王春辉, 李松.黄嘌呤氧化酶抑制剂的研究进展[J].国外医学药学分册, 2006, 33(5):351-353;357.WANG C H, LI S.Research progress of xanthine oxidase inhibitors[J].Foreign Medical Sciences Section of Pharmacy, 2006, 33(5):351-353;357.
[12] 李杰, 张鹏霞, 周健, 等.传统泡菜中高效降解核苷乳酸菌的筛选及其特性研究[J/OL].食品与发酵工业, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.036916.LI J, ZHANG P X, ZHOU J, et al.Isolation of efficient nucleoside-degrading lactic acid bacteria from traditional pickles and their probiotic properties[J/OL].Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.036916.
[13] 崔方超, 韩瑜娟, 李婷婷, 等.乳酸菌代谢物中黄嘌呤氧化酶抑制剂的筛选[J].中国食品学报, 2022, 22(8):11-21.CUI F C, HAN Y J, LI T T, et al.Screening of xanthine oxidase inhibitors from lactic acid bacteria metabolites[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(8):11-21.
[14] 牛春华, 肖茹雪, 赵子健, 等.植物乳杆菌UA149的降尿酸作用[J].现代食品科技, 2020, 36(2):1-6;217.NIU C H, XIAO R X, ZHAO Z J, et al.Serum uric acid lowering effect of lactobacillus plantarum UA149 on hyperuricemic rats[J].Modern Food Science and Technology, 2020, 36(2):1-6;217.
[15] 呼静, 崔鹏月, 双全.高效降尿酸乳酸菌的筛选及其益生特性研究[J].食品与发酵工业, 2022, 48(16):150-155.HU J, CUI P Y, SHUANG Q.Screening of lactic acid bacteria with high ability of uric acid-lowering and evaluation of its probiotic properties[J].Food and Fermentation Industries, 2022, 48(16):150-155.
[16] 王家彬, 潘力.降解核苷作用乳酸菌的筛选及其潜在降尿酸功能[J].食品科学, 2022, 43(10):199-206.WANG J B, PAN L.Screening and uric acid-lowering potential of nucleoside-degrading lactic acid bacteria[J].Food Science, 2022, 43(10):199-206.
[17] WANG H N, MEI L, DENG Y, et al.Lactobacillus brevis DM9218 ameliorates fructose-induced hyperuricemia through inosine degradation and manipulation of intestinal dysbiosis[J].Nutrition, 2019, 62:63-73.
[18] 卢曼, 陈小兵, 王兴兴, 等.西藏开菲尔粒中酵母菌的分离与初步鉴定[J].上海海洋大学学报, 2015, 24(1):138-145.LU M, CHEN X B, WANG X X, et al.Isolation and characterization of yeasts in Tibetan kefir grains[J].Journal of Shanghai Ocean University, 2015, 24(1):138-145.
[19] 姜楠, 张晓琳, 田金英, 等.具有黄嘌呤氧化酶抑制作用的天然产物之研究进展[J].药学学报, 2021, 56(5):1229-1237.JIANG N, ZHANG X L, TIAN J Y, et al.Recent studies on the natural products with xanthine oxidase inhibitory effect[J].Acta Pharmaceutica Sinica, 2021, 56(5):1229-1237.
[20] YAMADA N, SAITO-IWAMOTO C, NAKAMURA M, et al.Lactobacillus gasseri PA-3 uses the purines IMP, inosine and hypoxanthine and reduces their absorption in rats[J].Microorganisms, 2017, 5(1):10.