羊肉营养丰富,胆固醇含量低,磷脂及氨基酸含量高,同时含有丰富的钙、铁、多种维生素等。随着人们生活质量的提高,消费者对畜肉品质的要求越来越高,羊肉及其制品的市场需求将越来越大[1]。
肌原纤维蛋白在肌肉蛋白质中约占55%~65%,其结构和功能特性对肉品保水性、嫩度、风味等品质变化发挥着重要作用[2]。不同腌制方法的腌制效率有一定差异,肌原纤维蛋白的结构及功能特性也会有把不同的变化,最终导致肉制品的品质产生影响[3]。目前关于羊肉腌制的方法有干腌和湿腌。干腌是指将腌制配料均匀涂抹在肉的表面进行处理,而湿腌是将肉置于腌制液中浸泡腌制。研究发现,超声波辅助腌制技术可以有效缩短腌制时间,加快肌原纤维蛋白的降解,提高产品的理化和感官品质[4]。高子武等[5]研究了静置、超声波和真空滚揉腌制对牛肉肌原纤维蛋白特性的影响,发现超声波腌制促进了牛肉肌原纤维蛋白氧化降解,增强了牛肉保水性,改善了牛肉嫩度。ZHOU等[6]对山黑猪肉进行不同腌制处理后发现超声波腌制可以显著影响肌原纤维蛋白,加速蛋白分子结构展开。SALEEM等[7]研究发现超声可以改变肌原纤维蛋白结构和凝胶性,显著提高凝胶保水性。ZOU等[8]发现超声波结合碳酸氢钠辅助腌制可以有效增加鸡肉肌原纤维小片化指数(myofibrillar fragmentation index,MFI),降低剪切力。
目前,关于不同腌制方式对羊肉肌原纤维蛋白品质特性的影响鲜有报道,所以本研究选择羊肉作为研究对象,对比研究了干腌、湿腌和超声波腌制对羊肉肌原纤维蛋白理化和分子特性的影响,探讨了腌制方式对羊肉肌原纤维蛋白理化和分子特性产生影响的内在原因,为提高羊肉及其制品的加工质量,明确不同腌制方法对肉类肌原纤维蛋白的影响提供理论依据。
1 材料与方法
1.1 材料与试剂
选用新鲜羊后腿肉,乌鲁木齐市北园春农贸市场;氯化钾、盐酸胍、三氯甲烷、溴酚蓝、2,4-二硝基苯肼、三氯乙酸、乙酸乙酯、盐酸、尿素缓冲液、牛血清蛋白,以上试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
KQ-250DE型超声波清洗仪,昆山市超声仪器有限公司;721型可见分光光度计,上海菁华科技仪器有限公司;DYY-7C型电泳仪,北京市六一仪器厂;脱色摇床,金坛市医疗仪器厂;LC-45N-30C真空冷冻干燥机,邦熙地衣仪器科技有限公司。
1.3 实验方法
1.3.1 样品的处理
腌制液配方(以下均为质量分数):食盐3%、复合磷酸盐0.25%、抗坏血酸0.02%、亚硝酸钠0.003%。
将新鲜羊后腿肉切成5 cm×5 cm×5 cm的肉块,分别进行处理,为了保证腌制效果,腌制液配方和超声波条件通过预实验进行确定。具体处理方法如下:干腌是利用混合腌制盐,均匀地涂擦在肉块的表面上,放置于腌制盒中在4 ℃下腌制12、24 h;湿腌时将切分好的羊肉块浸泡在预先配制好的混合腌制盐溶液中,在4 ℃下腌制12、24 h;超声波腌制是指将羊肉块放入装有混合腌制盐溶液的密封袋中,置于超声波清洗机中,在4 ℃、40 kHz下超声30、60 min;空白对照为0~4 ℃冷藏备用的生鲜肉。
1.3.2 肌原纤维蛋白提取
将羊肉剪碎,取去除筋膜的肉样5 g,加入pH 6.8的磷酸盐缓冲液,在10 000 r/min条件下匀浆20 s,2 000×g离心15 min,取沉淀并重复操作4次;在沉淀中加入磷酸盐缓冲液(含1% Triton X-100)匀浆10 s,4 000×g离心10 min,弃上清重复3次;沉淀中加入2倍体积的0.01 mol/L KCl溶液,使用玻璃棒剧烈搅拌后4 000×g离心10 min,取沉淀重复2次;将沉淀与8倍体积的0.1 mol/L NaCl溶液混合,并剧烈振荡,4 000×g离心5 min,重复2次,沉淀即为肌原纤维蛋白。
1.3.3 表面疏水性测定
参考LI等[9]的方法,将40 μL 1 mg/mL溴酚蓝溶液加入到羊肉肌原纤维蛋白质量浓度为1 mg/mL的1 mL溶液,1 mL磷酸盐缓冲液(pH 7.0)替代羊肉肌原纤维蛋白作为对照,其余同上,使用漩涡混合器振荡10 min,在4 000×g下离心15 min,弃沉淀后稀释合适的倍数后,于595 nm处读取样品吸光度,计算如公式(1)所示:
表面疏水性![]()
(1)
1.3.4 总巯基含量测定
根据LIU等[10]的方法并适当修改,取0.5 mL质量浓度为5 mg/mL羊肉肌原纤维蛋白溶液,加入2.5 mL的混合液[含0.02 mL 4 mg/mL 5,5′-二硫代双(2-硝基苯甲酸)],使用漩涡混合器混匀,将溶液置于25 ℃水浴锅反应30 min,最后在412 nm处测定吸光度(A412)。空白对照为不含5,5′-二硫代双(2-硝基苯甲酸)的样品。总疏基含量的计算如公式(2)所示:
总巯基含量![]()
(2)
式中:13 600为摩尔消光系数,L·cm/mol;c为蛋白质量浓度,mg/mL。
1.3.5 羰基含量测定
参考李德海等[11]方法并适当修改,将提取的肌原纤维蛋白配制成5 mg/mL蛋白液,取0.1 mL加入0.5 mL 2,4-二硝基苯肼(2 mol/L盐酸,0.02 mol/L二硝基苯肼),在25 ℃水浴锅中反应40 min,空白样品为2 mol/L HCl溶液;然后将0.5 mL 200 g/L三氯乙酸加入反应液,振荡摇匀后冷冻离心(11 000×g,5 min)取沉淀;使用体积比为1∶1的乙醇-乙酸乙酯溶液洗涤蛋白沉淀3次;最后将6 mol/L盐酸胍溶液与蛋白质沉淀混合,在37 ℃反应30 min,弃沉淀之后在370 nm下测定吸光度。
1.3.6 Zeta电位测定
参考CAI等[12]方法并适当修改,将4%(体积分数)固相萃取储备溶液和复合溶液的pH分别调节至2.0、3.0、4.0、5.0、6.0、7.0、8.0和9.0。在测量之前,将所有样品以相同的pH稀释10倍。将适量的配制样品添加到墨尔文比色皿的玻璃电极管中。管内无气泡,气密性好。将比色皿放入马尔文纳米粒度仪中,一式三份进行Zeta电位测量。测量数据通过Malvern Zetasizer软件获得,并取平均值。
1.3.7 粒径测定
参考张琼[13]并适当修改,将处理过的羊肉肌原纤维蛋白样品溶解在蒸馏水中,制备10 mg/mL羊肉肌原纤维蛋白溶液。在700 r/min磁力搅拌2 h后,将溶液在4 ℃下贮存12 h。蛋白质的折射率和水相折射率分别设定为1.45和1.322;吸收指数设定为0.1;使用不规则形状。所有测定均在25 ℃下进行,每个样品独立测试5次。
1.3.8 红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定
按照张海璐等[14]的方法并略作修改,使用真空冷冻干燥机冷冻干燥(-36 ℃,12 Pa,80 h),将冻干粉(4 mg)和KBr(400 mg)完全研磨混合,然后混合粉末压榨并用于光谱分析。使用FT-IR进行扫描,波数范围为400~4 000 cm-1,重复测量3次,并显示代表性曲线。
1.3.9 肌原纤维小片化指数的测定
按照ILIAN等[15]的方法并略作修改,称取0.5 g样品,加入适当体积的缓冲液(0.1 mol/L KCI、0.02 mol/L Na2HPO4、0.001 mol/L EDTA、0.001 mol/L MgCl2,pH 7.1),2 000 r/min冰浴匀浆1 min,3 000×g冷冻离心15 min,取沉淀重复上述操作1次后,将最终沉淀用缓冲液重悬,采用双缩脲法测定蛋白质量浓度,并调至0.5 mg/mL,在540 nm测蛋白质OD值,MFI的计算如公式(3)所示:
MFI=OD540nm×200
(3)
1.3.10 SDS-PAGE
使用SDS-PAGE分析羊肉肌原纤维蛋白组成。将羊肉肌原纤维蛋白质量浓度调整为4 mg/mL,加入2×上样缓冲液,沸水浴5 min;浓缩胶(4%)恒压90 V,分离胶(15%)电压为140 V。电泳结束后使用考马斯亮蓝染色1 h、过夜脱色。
1.4 数据分析
所有试验均重复3次,利用Origin 2019软件和SPSS 20.0进行图表绘制和统计分析,试验数据采用Excel 2016进行整理,均以均值±标准差表示,P<0.05为差异显著。
2 结果与分析
2.1 不同腌制方式对羊肉肌原纤维蛋白总巯基含量的影响
二硫键的形成会导致肌原纤维蛋白中的总巯基含量降低,因此总巯基含量可用来表征蛋白氧化程度[16]。干腌和湿腌处理组的羊肉肌原纤维蛋白总巯基含量与空白对照组相比显著降低(P<0.05),可能是腌制过程中氧化破坏了肌原纤维蛋白空间结构,将总巯基转化为二硫键,使蛋白质的持水能力的降低,对羊肉品质间接的产生影响,XIONG等[17]研究表明,巯基含量与蛋白质的氧化相关,巯基含量越低,说明蛋白氧化的程度越高。如图1所示,超声30~60 min时,总巯基含量开始显著下降,可能是因为随着腌制时间的延长,超声波空化产生的机械作用加快了半胱氨酸巯基基团的损失,二硫键不断形成,最后导致总巯基含量下降。WANG等[18]在研究超声波对鸡肉肌原纤维蛋白的影响中发现了类似结论。
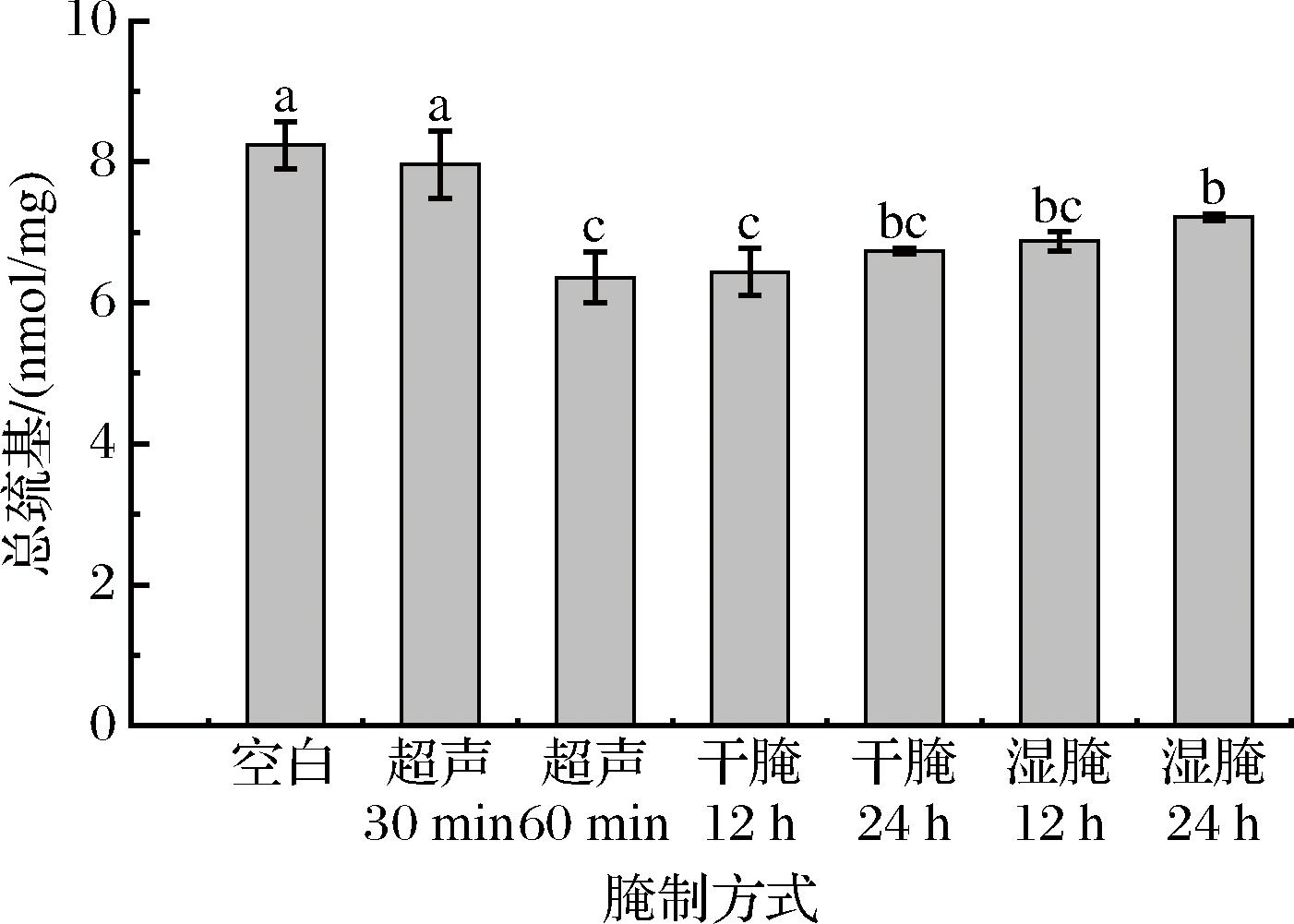
图1 不同腌制方式对羊肉肌原纤维蛋白总巯基的影响
Fig.1 Effect of different marinades on the total sulfhydryl groups of myogenic fiber proteins of mutton
注:小写字母不同表示差异显著(P<0.05)(下同)。
2.2 不同腌制方式对羊肉肌原纤维蛋白羰基含量的影响
羊肉肌原纤维蛋白氧化过程中产生的自由基会攻击一些氨基酸使其形成羰基衍生物,从而使羰基含量增加,所以羰基含量可以用来判断蛋白质氧化的程度[19]。如图2所示,超声处理组羰基含量随时间延长而增加,且显著高于对照组,可能是由于超声波腌制过程中的脂肪氧化产物促进了蛋白的氧化,导致肌原纤维蛋白的羰基含量增加。干腌处理组与空白对照组相比显著提高(P>0.05),这可能是由于干腌处理会导致蛋白质的侧链上带有NH-或NH2-部分的氨基酸与脂解产生的氧化自由基反应,转化为羰基。湿腌处理组较空白对照组羊肉肌原纤维蛋白中羰基含量显著提高(P>0.05),且羰基含量随时间的延长而增加,可能是湿腌过程中的蛋白质氧化产生的自由基攻击了一些氨基酸,生成羰基衍生物,从而使羰基含量增加,这与张英[20]研究的脉冲电场辅助湿腌对肌原纤维蛋白羰基含量的结果一致。
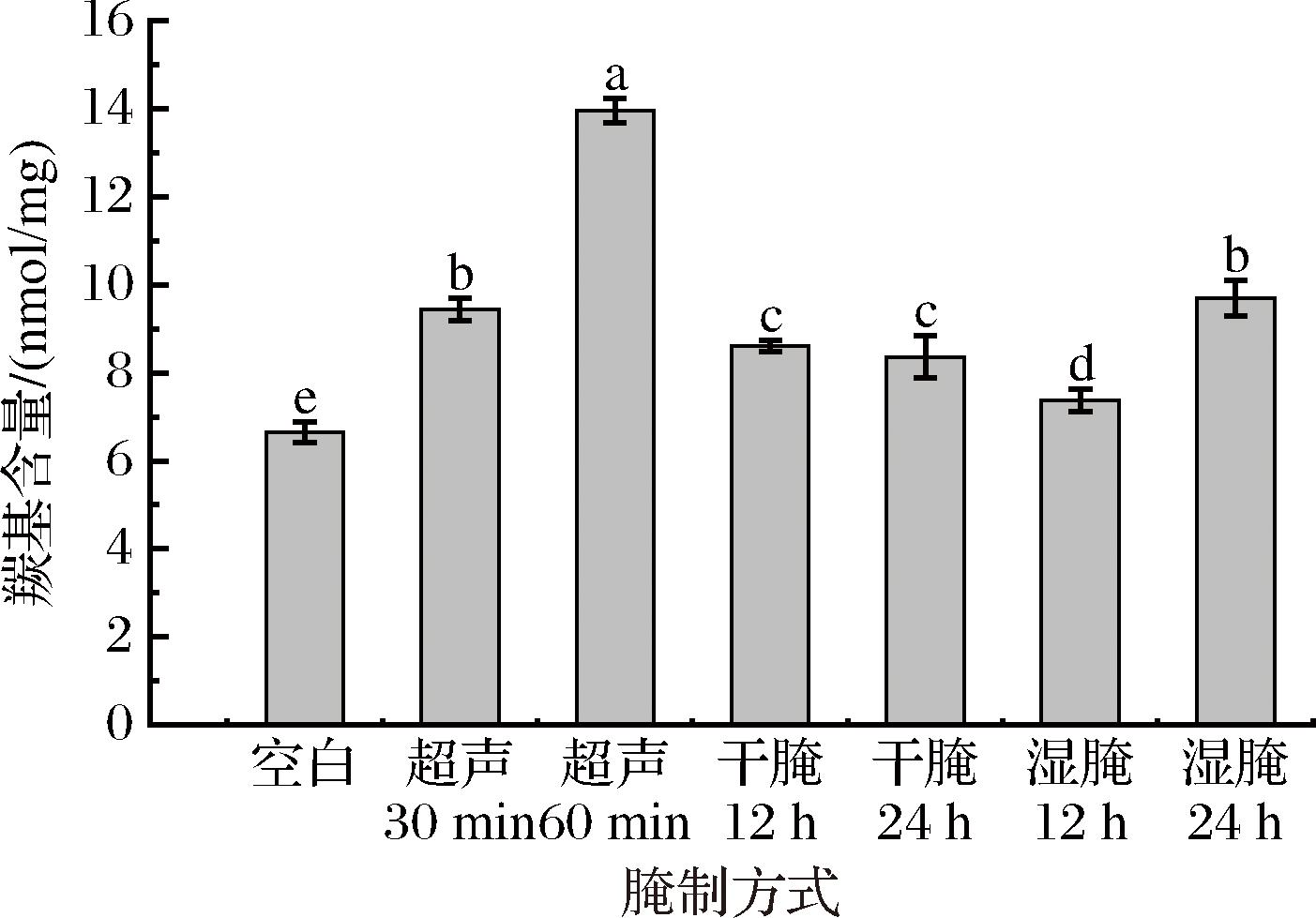
图2 不同腌制方式对羊肉肌原纤维蛋白羰基的影响
Fig.2 Effect of different curing methods on the carbonyl group of myogenic fiber protein in mutton
2.3 不同腌制方式对羊肉肌原纤维蛋白表面疏水性的影响
如图3所示,蛋白质表面疏水性可以通过与溴酚蓝结合表达肌原纤维蛋白氧化与变性情况[21]。干腌、湿腌和超声60 min的表面疏水性显著高于空白对照组;干腌、湿腌处理组中,腌制24 h的溴酚蓝结合量低于同一腌制方式下腌制12 h,这可能是由于干腌、湿腌随着腌制液的渗入,肌纤维间隙逐渐扩大,蛋白质不断溶解,溶解蛋白与疏水基团之间形成一种新的包埋结构,从而表面疏水性降低。超声处理60 min羊肉肌原纤维蛋白的表面疏水性高于超声处理30 min处理组,这可能是由于超声波空化效应引起的机械力使得蛋白质分子内部的疏水性氨基酸暴露,从而使溴酚蓝结合量增加,导致表面疏水性呈增加趋势;超声处理羊肉肌原纤维蛋白表面疏水性和其他腌制方式处理组相比较低,有研究表明蛋白质表面疏水性可以表征蛋白质水合能力,溴酚蓝结合量越小,肌原纤维蛋白与水分子的结合能力越强[19],由此说明羊肉的保水性得到提高。
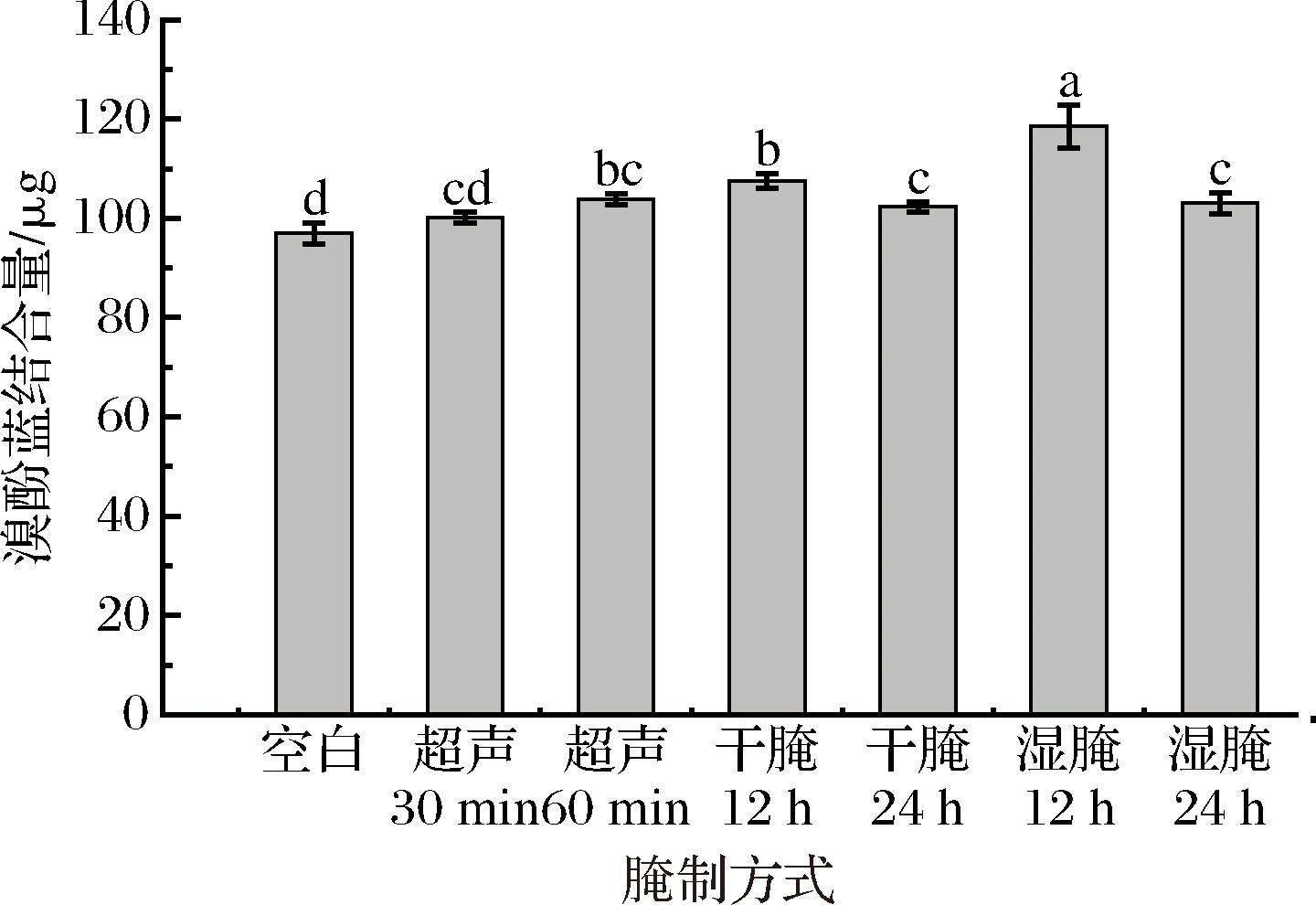
图3 不同腌制方式对羊肉肌原纤维蛋白表面疏水性的影响
Fig.3 Effect of different marinades on the surface hydrophobicity of myofibrillar proteins in mutton
2.4 不同腌制方式对羊肉肌原纤维蛋白Zeta电位的影响
Zeta电位可以反映蛋白溶液中的电动势大小,其绝对值越大,代表羊肉肌原纤维蛋白的稳定性高[22]。如图4所示,干腌处理组的电位绝对值低于空白对照组,可能是因为干腌过程中羊肉肌原纤维蛋白相互之间的吸引力超过排斥力,肌原纤维蛋白的分散状态开始趋向凝聚,最终肌原纤维蛋白的稳定性下降;湿腌处理组的电位绝对值相比于空白对照组和干腌处理组显著提高,可能是因为湿腌处理抑制了蛋白的进一步折叠,减少了分子内的相互作用,让更多的带电基团暴露在表面;与空白对照组相比,超声波腌制电位绝对值随时间延长而增加,可能是由于超声处理后羊肉肌原纤维蛋白结构展开,将更多带电氨基酸暴露在蛋白分子表面。
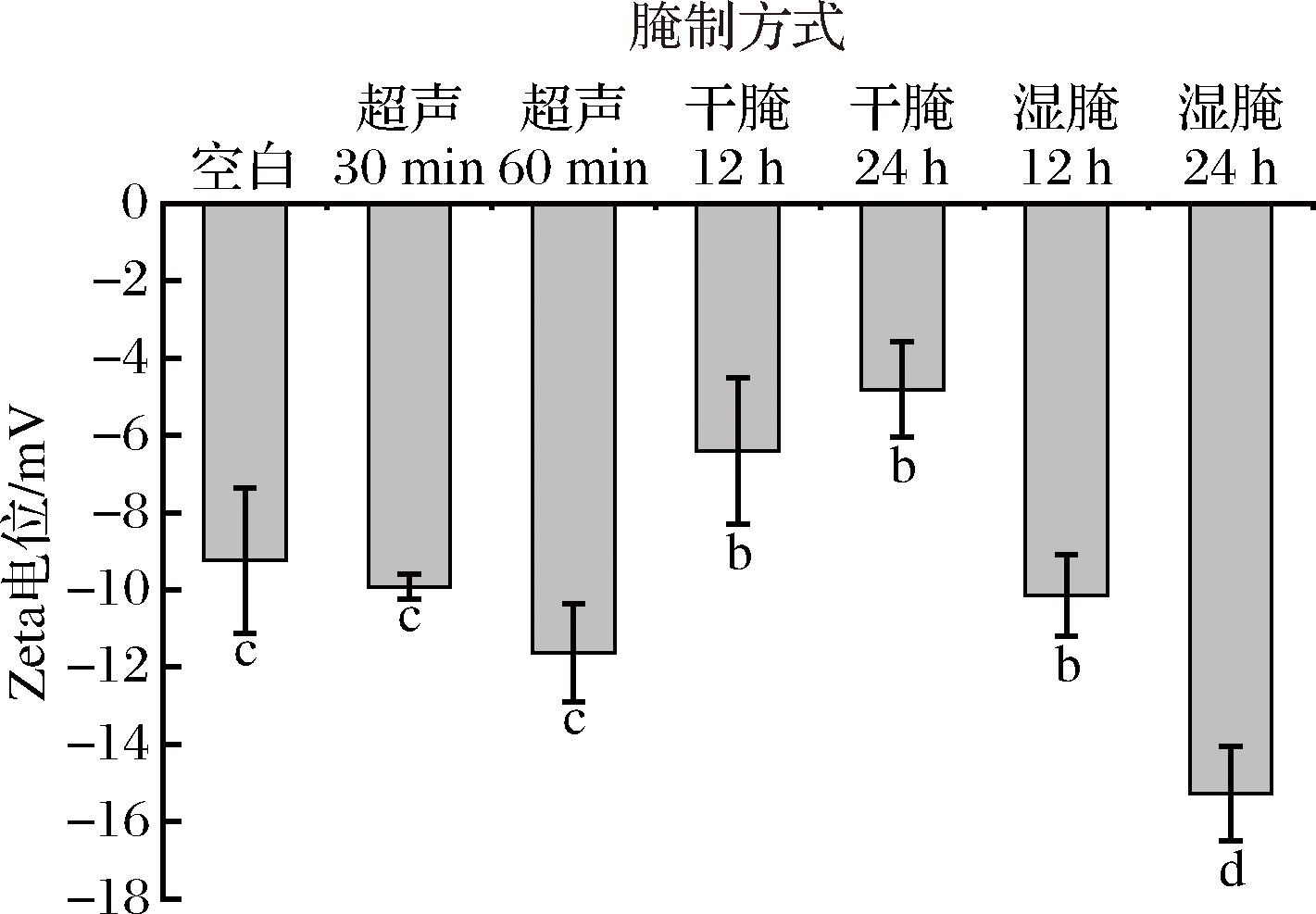
图4 不同腌制方式对羊肉肌原纤维蛋白Zeta电位的影响
Fig.4 Effect of different marinades on the zeta potential of mutton myofibrillar protein
2.5 不同腌制方式对羊肉肌原纤维蛋白粒径的影响
粒径可以反映肌原纤维蛋白的颗粒大小和蛋白质的聚集情况。由表1可知,经过3种腌制方式的粒径D(3,2),D(4,3)均随处理时间延长而降低,其中超声波腌制、干腌处理的粒径均低于对照组,超声波腌制效果最为显著,可能是因为超声波处理时,其空化作用力和剪切力破碎了蛋白质颗粒,使粒径减小。湿腌的粒径则高于对照组,说明湿腌对羊肉肌原纤维蛋白空间构型有影响,但不显著。有研究表明[23]蛋白粒径减小会导致蛋白质持水性增强、蒸煮损失减小、嫩度增加等功能特性增加,说明3种腌制方式均可以提高肉品品质,其中超声波腌制方式最佳。
表1 不同腌制方式对羊肉肌原纤维蛋白粒径的影响 单位:nm
Table 1 Effect of different curing methods on the particle size of myofibrillar protein of mutton
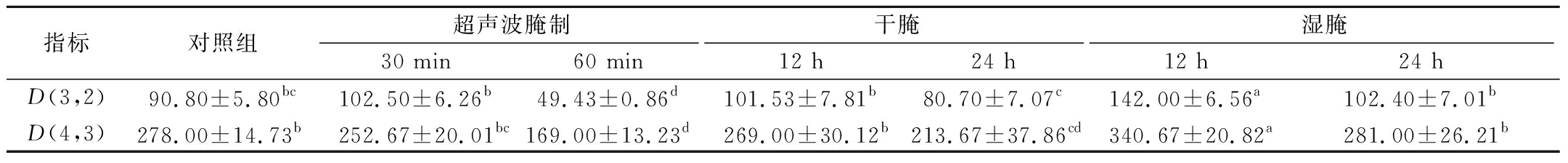
指标对照组超声波腌制干腌湿腌30 min60 min12 h24 h12 h24 hD(3,2)90.80±5.80bc102.50±6.26b49.43±0.86d101.53±7.81b80.70±7.07c142.00±6.56a102.40±7.01bD(4,3)278.00±14.73b252.67±20.01bc169.00±13.23d269.00±30.12b213.67±37.86cd340.67±20.82a281.00±26.21b
注:不同小写字母肩标表示差异显著(P<0.05)。
2.6 不同腌制方式对羊肉肌原纤维蛋白二级结构的影响
对羊肉肌原纤维蛋白进行傅立叶变换红外光谱仪全波段扫描分析(400~4 000 cm-1),其中1 600~1 700 cm-1的峰代表酰胺Ⅰ带,主要是由C![]() O、C—N的伸缩振动引起的,可以反映蛋白质二级结构变化过程[24]。由图5可知,不同处理的红外光图谱趋势相似,其中超声波腌制60 min的酰胺Ⅰ带变化较大,可能是超声波破坏了分子内氢键,使螺旋结构部分展开,从而导致β-折叠结构向β-转角转化。
O、C—N的伸缩振动引起的,可以反映蛋白质二级结构变化过程[24]。由图5可知,不同处理的红外光图谱趋势相似,其中超声波腌制60 min的酰胺Ⅰ带变化较大,可能是超声波破坏了分子内氢键,使螺旋结构部分展开,从而导致β-折叠结构向β-转角转化。
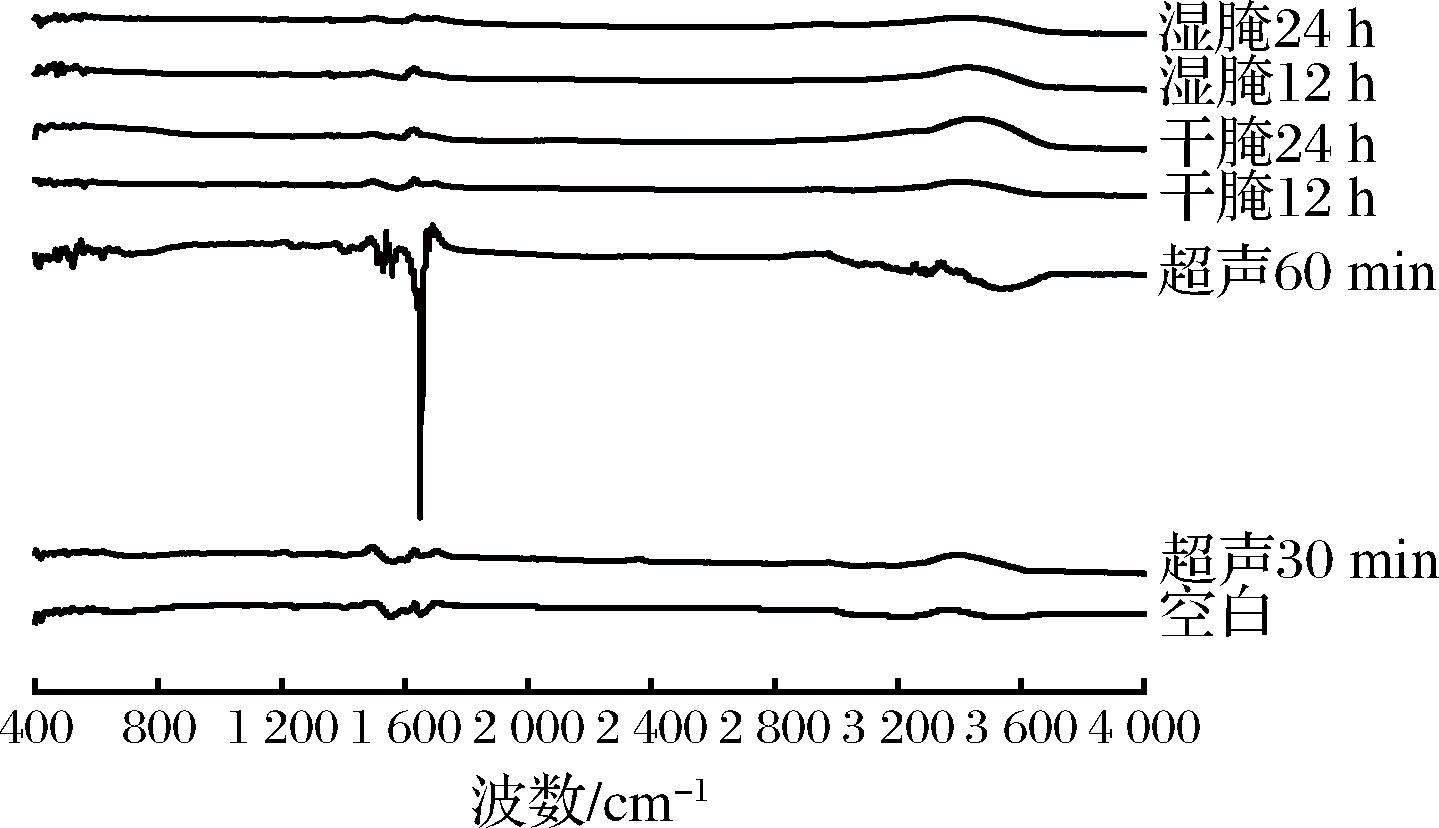
图5 不同腌制方式对羊肉肌原纤维蛋白红外光图谱的影响
Fig.5 Effect of different marinades on the infrared spectra of myofibrillar proteins of mutton
一般认为蛋白质二级结构在酰胺I带,主要是C![]() O的伸缩振动引起,可以准确反映对蛋白质二级结构变化。通常情况下,β-转角吸收峰在1 664~1 681 cm-1,β-折叠吸收峰在1 615~1 637 cm-1和1 682~1 700 cm-1,α-螺旋吸收峰在1 646~1 664 cm-1,无规则卷曲吸收峰在1 637~1 645 cm-1[25]。加图6所示,蛋白二级结构中β-折叠结构呈下降趋势,β-转角含量上升。超声处理羊肉肌原纤维蛋白的中β-转角结构含量显著增加(P<0.05),可能超声波的空化效应粉碎了保持结构稳定的氢键,从而使羊肉蛋白由有序转为无序。干腌、湿腌的β-转角和α-螺旋结构随时间延长而增加,β-折叠结构相对减少,可能随时间延长促进了腌制传质,提高了羊肉中的NaCl含量,最终蛋白二级结构发生变化。
O的伸缩振动引起,可以准确反映对蛋白质二级结构变化。通常情况下,β-转角吸收峰在1 664~1 681 cm-1,β-折叠吸收峰在1 615~1 637 cm-1和1 682~1 700 cm-1,α-螺旋吸收峰在1 646~1 664 cm-1,无规则卷曲吸收峰在1 637~1 645 cm-1[25]。加图6所示,蛋白二级结构中β-折叠结构呈下降趋势,β-转角含量上升。超声处理羊肉肌原纤维蛋白的中β-转角结构含量显著增加(P<0.05),可能超声波的空化效应粉碎了保持结构稳定的氢键,从而使羊肉蛋白由有序转为无序。干腌、湿腌的β-转角和α-螺旋结构随时间延长而增加,β-折叠结构相对减少,可能随时间延长促进了腌制传质,提高了羊肉中的NaCl含量,最终蛋白二级结构发生变化。
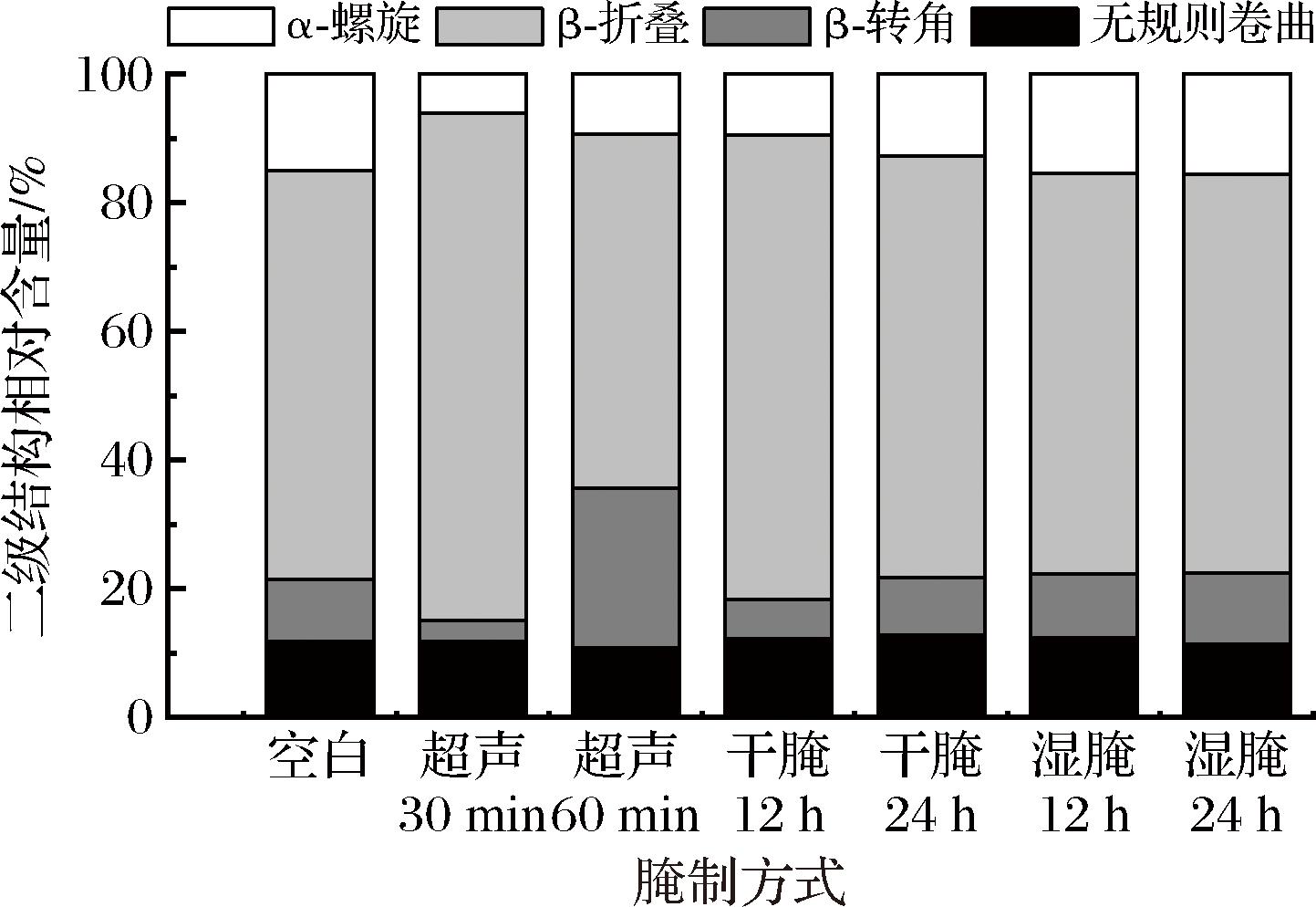
图6 不同腌制方式对羊肉肌原纤维蛋白二级结构相对含量的影响
Fig.6 Effect of different curing methods on the relative content of secondary structure of myofibrillar proteins in mutton
2.7 不同腌制方式对羊肉肌原纤维MFI的影响
不同腌制处理下,肌原纤维的降解会使蛋白小分子化,影响蛋白功能特性并且改变肉品品质[26]。图7所示为同腌制方式制作的羊肉肌原纤维MFI,随着腌制时间延长,超声波腌制的MFI显著降低,干腌和湿腌组的MFI随时间延长而增加,3种腌制方式与对照组相比MFI显著增加,湿腌组最高,干腌组最低,说明湿腌对肌原纤维降解的程度最高,干腌方式下的羊肉肌原纤维降解程度最低。

图7 不同腌制方式对羊肉肌原纤维蛋白MFI的影响
Fig.7 Effects of different marinades on MFI of myofibrillar proteins in mutton
2.8 不同腌制方式对羊肉肌原纤维蛋白SDS-PAGE的影响
通过凝胶电泳可知羊肉肌原纤维蛋白的降解情况。如图8所示,羊肉肌原纤维蛋白SDS-PAGE图谱中存在多条相同条带,其中3条谱带最为明显,分别为肌球蛋白重链、肌动蛋白和原肌球蛋白[27]。干腌处理组肌原纤维蛋白条带随时间的延长而变浅,这与SUN等[28]研究的广式香肠蛋白质降解结果相似。这可能是由于羊肉中大分子蛋白质降解成小分子片段,使原有的蛋白质结构发生变化,进而间接影响干腌羊肉的细胞结构。湿腌处理组的羊肉肌原纤维蛋白在肌球蛋白重链和肌动蛋白处出现轻微扩散,随时间延长出现了新的条带,说明湿腌处理在一定程度上提高了肌原纤维蛋白的降解程度。与空白对照组相比,超声波腌制羊肉肌原纤维蛋白在肌球蛋白重链、肌动蛋白发生了明显的扩散现象,这可能是超声波产生的空化效应促使细胞中的内源性蛋白酶释放,导致羊肉肌原纤维蛋白溶出降解,最终引起蛋白质分子质量变化。

图8 不同腌制方式处理羊肉肌原纤维蛋白的SDS-PAGE图谱
Fig.8 SDS-PAGE profiles of myofibrillar proteins of mutton treated with different marination methods
3 结论
通过研究发现,干腌羊肉肌原纤维蛋白总巯基增加、表面疏水性降低;湿腌组羊肉肌原纤维蛋白表面疏水性、总巯基增加、羰基含量增高;超声波腌制羊肉肌原纤维蛋白表面疏水性、羰基增加、总巯基降低,蛋白氧化程度最高。超声波腌制和湿腌的Zeta电位绝对值增加,干腌Zeta电位绝对值降低;3种腌制处理均减小了蛋白粒径。3种腌制方式的β-折叠结构向β-转角结构转化,其中超声波腌制最显著(P<0.05)。超声波腌制的MFI降低,干腌和湿腌的MFI增高。干腌蛋白条带随着时间延长而变浅,湿腌和超声波腌制羊肉肌原纤维蛋白肌球蛋白重链、肌动蛋白条带处有加深现象。综上,3种腌制方式会加快肌原纤维蛋白氧化,加速蛋白质降解,其中超声波腌制能更好地改善羊肉嫩度,同时对提高羊肉深加工产品品质有着重要影响。
[1] 刘文营, 王守伟.羊肉生产及加工工艺对肉及肉制品品质的影响研究进展[J].食品科学, 2020, 41(1):304-311.LIU W Y, WANG S W.Recent progress in understanding the effect of mutton production and processing technologies on the quality of meat and meat products[J].Food Science, 2020, 41(1):304-311.
[2] 韩格, 孔保华.功率超声对肌原纤维蛋白功能特性及肉品品质的影响研究进展[J].食品科学, 2022, 43(13):361-369.HAN G, KONG B H.Effect of power ultrasound on the functional properties of myofibrillar protein and meat quality:A review[J].Food Science, 2022, 43(13):361-369.
[3] 曹锦轩, 张玉林, 韩敏义, 等.腊肉加工过程中肌原纤维蛋白结构的变化[J].中国农业科学, 2013,46(18):3871-3877.CAO J X, ZHANG Y L, HAN M Y, et al.Changes of the construction of myofibrillar proteins in Chinese traditional bacon during processing[J].Scientia Agricultura Sinica, 2013,46(18):3871-3877.
[4] KAJAREKAR B R, GOGATE P R.Ultrasound assisted intensification of streptomycin production based on fermentation[J].Chemical Engineering and Processing-Process Intensification, 2022, 171:108748.
[5] 高子武, 吴丹璇, 王恒鹏, 等.腌制方式对牛肉肌原纤维蛋白特性及水分分布的影响[J].食品与发酵工业, 2021, 47(24):179-186.GAO Z W, WU D X, WANG H P, et al.Effects of curing process on myofibrillar protein characteristics and water distribution of beef[J].Food and Fermentation Industries, 2021, 47(24):179-186.
[6] ZHOU Y J, HU M Q, WANG L.Effects of different curing methods on edible quality and myofibrillar protein characteristics of pork[J].Food Chemistry, 2022, 387:132872.
[7] SALEEM R, AHMAD R.Effect of ultrasonication on secondary structure and heat-induced gelation of chicken myofibrils[J].Journal of Food Science &Technology, 2016, 53(8):3340-3348.
[8] ZOU Y, SHI H B, XU P P, et al.Combined effect of ultrasound and sodium bicarbonate marination on chicken breast tenderness and its molecular mechanism[J].Ultrasonics Sonochemistry, 2019, 59:104735.
[9] LI K, FU L, ZHAO Y Y, et al.Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J].Food Hydrocolloids, 2020, 98:105275.
[10] LIU G, XIONG Y L, BUTTERFIELD D A.Chemical, physical, and gel-forming properties of oxidized myofibrils and whey and soy protein isolates[J].Journal of Food Science, 2000, 65(5):811-818.
[11] 李德海, 徐颖, 顾嘉琳, 等.黑木耳多糖对猪肉糜质构及氧化特性的影响[J].食品科学, 2016, 37(15):88-93.LI D H, XU Y, GU J L, et al.Effect of Auricularia auricular polysaccharides (AAP) on the texture of minced pork and their antioxidant potential[J].Food Science, 2016, 37(15):88-93.
[12] CAI L Y, NIAN L Y, ZHAO G H, et al.Effect of herring antifreeze protein combined with chitosan magnetic nanoparticles on quality attributes in red sea bream (Pagrosomus major)[J].Food and Bioprocess Technology, 2019, 12(3):409-421.
[13] 张琼. 超声波协同半胱氨酸促进木瓜蛋白酶嫩化肉块的应用研究[D].成都:成都大学, 2021.ZHANG Q. Study on the application of ultrasound combined with cysteine to promote the tenderization of meat pieces by papain[D]. Chengdu: Chengdu University, 2021.
[14] 张海璐, 黄翔, 杨燃, 等.氧化对羊肉肌原纤维蛋白分子与理化特性的影响[J].食品科学, 2020, 41(23):8-14.ZHANG H L, HUANG X, YANG R, et al.Effect of oxidation on molecular and physicochemical properties of mutton myofibrillar protein[J].Food Science, 2020, 41(23):8-14.
[15] ILIAN M A, BEKHIT E D, BICKERSTAFFE R.The relationship between meat tenderization, myofibril fragmentation and autolysis of calpain 3 during post-mortem aging[J].Meat Science, 2004, 66(2):387-397.
[16] ZHANG R Y, XING L J, KANG D C, et al.Effects of ultrasound-assisted vacuum tumbling on the oxidation and physicochemical properties of pork myofibrillar proteins[J].Ultrasonics Sonochemistry, 2021, 74:105582.
[17] XIONG Y L, PARK D, OOIZUMI T.Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J].Journal of Agricultural &Food Chemistry, 2009, 57(1):153-159.
[18] WANG J Y, YANG Y L, TANG X Z, et al.Effects of pulsed ultrasound on rheological and structural properties of chicken myofibrillar protein[J].Ultrasonics Sonochemistry, 2017, 38:225-233.
[19] KANG D C, ZOU Y H, CHENG Y P, et al.Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J].Ultrasonics Sonochemistry, 2016, 33:47-53.
[20] 张英. 脉冲电场辅助湿腌对牛肉品质的影响研究[D].广州:华南理工大学, 2022.ZHANG Y.Effect of pulsed electric field (PEF) assisted wet pickling on beef quality[D].Guangzhou:South China University of Technology, 2022.
[21] LI C Q, XIONG Y L, CHEN J.Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J].Journal of Agricultural &Food Chemistry, 2012, 60(32):8020-8027.
[22] CEYLAN Z, UNAL SENGOR G F, ![]() O, et al. A novel approach to extend microbiological stability of sea bass (Dicentrarchus labrax) fillets coated with electrospun chitosan nanofibers[J]. LWT-Food Science and Technology, 2017, 79:367-375.
O, et al. A novel approach to extend microbiological stability of sea bass (Dicentrarchus labrax) fillets coated with electrospun chitosan nanofibers[J]. LWT-Food Science and Technology, 2017, 79:367-375.
[23] SUN W Z, ZHOU F B, SUN D W, et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology, 2013, 6(7):1703-1712.
[24] ZHANG T, LI Z J, WANG Y M, et al.Effects of konjac glucomannan on heat-induced changes of physicochemical and structural properties of surimi gels[J].Food Research International, 2016, 83:152-161.
[25] LI F F, WANG B, LIU Q, et al.Changes in myofibrillar protein gel quality of porcine longissimus muscle induced by its stuctural modification under different thawing methods[J].Meat Science, 2019, 147:108-115.
[26] RAJAGOPAL K, OOMMEN G.Myofibril fragmentation index as an immediate postmortem predictor of buffalo meat tenderness[J].Journal of Food Processing and Preservation, 2015, 39(6):1166-1171.
[27] 程述震, 王晓拓, 张洁, 等.电子束剂量率对牛肉蛋白结构和理化性质的影响[J].食品科学, 2018, 39(3):150-156.CHENG S Z, WANG X T, ZHANG J, et al.Effect of electron beam dose rate on myofibrillar protein structure and physicochemical characteristics of chilled beef[J].Food Science, 2018, 39(3):150-156.
[28] SUN W Z, CUI C, ZHAO M M, et al.Effects of composition and oxidation of proteins on their solubility, aggregation, and proteolytic susceptibility during processing of Cantonese sausage[J].Food Chemistry, 2011, 124(1):336-341.