枇杷(Eriobotrya japonica Lindl.),蔷薇科苹果亚科枇杷属植物,起源于中国[1]。川渝地区是我国枇杷主产区之一,其主要栽培品种中大五星枇杷占比超过80%[2]。大五星枇杷色泽金黄、味美多汁,同时具有健胃润肺、清热止咳等功效,备受消费者青睐。然而,大五星枇杷成熟在初夏高温时节,采后携带大量田间热,新陈代谢旺盛,容易滋生病菌,发生衰老腐败。因此,如何延长枇杷的贮藏时间并保持良好的贮藏品质,是当前亟待解决的问题。
预冷是保持果蔬采后质量的第一步,可以迅速散去田间热,使代谢维持在较低水平。ZHANG等[3]的研究表明,黄桃采后预冷可以保持可滴定酸(titritable acidity,TA)、抗坏血酸(ascorbic acid,ASA)和可溶性固形物的含量(soluable solid content,SSC),增加超氧化物歧化酶(superoxide dismutase,SOD)的活性,延缓多酚氧化酶(polyphenol oxidase,PPO)活性的增加,减少黄桃在贮存过程中的品质劣化。然而,低温贮藏才是目前普及最广的保鲜方法。研究表明,低温可以延缓苹果[4]、梨[5]、橙[6]等果实的衰老质变。然而,不适宜的低温会导致果实冷害。例如,蜜桔1 ℃下贮藏会聚集乙醇并产生异味[7]。香蕉在6 ℃下贮藏会发生果皮褐变[8]。枇杷属于冷敏性水果,低温冷藏时也容易遭遇冷害,出现褐变和木质化[9]。对此,有学者认为,可以通过锻炼水果的低温适应性,增强耐冷性,抑制冷害形成[10]。
因此,本实验以大五星枇杷为研究对象,先对枇杷进行梯度预冷以散去田间热并锻炼低温适应性,再继续低温贮藏。通过评估对枇杷贮藏品质的影响,探究梯度预冷复合低温贮藏保鲜枇杷的可行性,为枇杷采后贮藏提供理论依据和技术支持。
本实验所用的‘大五星’枇杷果实采自四川省汉源县安乐镇。于采摘当天运达实验室,选取大小相近、外观完好、色泽均匀、无病虫害与机械损伤、成熟度基本一致的枇杷作为实验原材料,备用。
硫酸、盐酸、草酸、核黄素、二甲酚橙、硫代巴比妥酸等试剂(均为分析纯),成都浩博优科技有限公司。
双门制冷保鲜柜,山东迈巴克电器有限公司;DW-86L626超低温冰箱,中国HaierBio-medical公司;Varioskan Flash荧光酶标仪,美国Thermo Fisher Scientific公司;TA.XTPLus物性分析仪,英国Stabie Micro Systems公司;RJ-TGL-2000R台式高速冷冻离心机,无锡市瑞江分析仪器有限公司;BS-2F恒温振荡培养箱,金坛市精达仪器制造有限公司。
1.3.1 实验材料处理方法
将枇杷果实随机均分为4组,分别为T8、T5、T2和CK组。T8组,11→8 ℃,即将枇杷放入11 ℃下预冷2 d,再转入8 ℃下预冷并贮藏。T5组,11→8→5 ℃,即将枇杷放入11 ℃下预冷2 d,再转入8 ℃下预冷2 d,再转入5 ℃下预冷并贮藏。T2组,11→8→5→2 ℃,即将枇杷放入11 ℃下预冷2 d,再转入8 ℃下预冷2 d,再转入5 ℃下预冷2 d,最终转入2 ℃下预冷并贮藏。CK组枇杷不经预冷,直接放在常温(20 ℃)下贮藏。
在贮藏的第0、7、14、21、28、35天进行取样,每次随机选取30个枇杷用于测定品质指标,随机选取10个枇杷切碎混匀后用液氮速冻并置于-80 ℃保存为冻样,用于测定后续相关指标。
1.3.2 果肉褐变度测定
果肉褐变度的测定参考黄欣莉等[11]的方法。
1.3.3 硬度、木质素含量测定
硬度的测定参照宋肖琴等[12]的方法,采用TA.XTPlus物性分析仪测定枇杷的硬度,每个处理组取10个果实,每个果实重复测8次。
木质素含量的测定参照朱海英等[13]的方法并稍作修改,称取1 g冻样(m1),研磨后加入6 ml 70%(体积分数)硫酸,在恒温震荡培养箱中35 ℃、240 r/min振荡1 h,用208 mL蒸馏水加热煮沸1 h,冷却后用预先烘干至恒重的砂芯漏斗抽滤(m2),于60 ℃干燥箱中干燥至恒重(m3)。每组重复3次测量取平均值。以公式(1)计算木质素含量:
木质素含量![]()
(1)
1.3.4 SSC、TA、ASA、出汁率测定
SSC、TA、ASA含量的测定均参照曹建康等[14]的方法。
出汁率的测定,称取约10 g枇杷果肉,记质量为m4。将果肉研磨后放入离心管中12 000×g离心15 min,弃上清液,记录残渣质量m5。按照公式(2)计算果肉出汁率:
果肉出汁率![]()
(2)
1.3.5 丙二醛(malondialdehyde,MDA)含量测定
MDA含量的测定采用曹建康等[14]的方法。
![]() 产生速率和H2O2含量测定
产生速率和H2O2含量测定
超氧阴离子![]() 产生速率的测定参考曹建康等[14]的方法。H2O2含量的测定参照李忠光等[15]的二甲酚橙法。
产生速率的测定参考曹建康等[14]的方法。H2O2含量的测定参照李忠光等[15]的二甲酚橙法。
1.3.7 苯丙氨酸解氨酶(phenylalamine ammonia lyase,PAL)、PPO、SOD和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性测定
PAL、PPO、SOD和APX活性的测定,均参考曹建康等[14]的方法。
采用Excel 2010进行原始数据的基础处理,采用SPSS 27.0软件对数据进行统计分析和ANOVA检验,P<0.05表示差异显著,作图采用Origin 2021绘图软件。
如图1所示,第0天时,新鲜采摘的枇杷外观圆润,色泽明亮,果皮呈金黄色。经过35 d的贮藏后,T2组的果实显现出明显的冷害褐变和木质化症状;T8组的果实出现褐变症状,同时伴有轻微的果皮皱缩和腐烂;CK组的果实表现出明显的衰老和褐变,果肉严重腐烂并长霉。相比之下,T5组的果实外观保持良好。

图1 不同温度对枇杷外观的影响
Fig.1 Effect of different temperatures on appearance of loquats
如图2所示,各组果肉褐变度整体呈上升趋势。贮藏0~7 d,果肉褐变度迅速增加。随后,CK组的褐变度呈波动上升,实验组的褐变度呈先上升后下降趋势。贮藏35 d时,各组的褐变度排序为CK组>T8组>T2组>T5组。其中,T5组显著抑制了果肉组织的氧化褐变程度(P<0.05),保持了较好的果实品质。
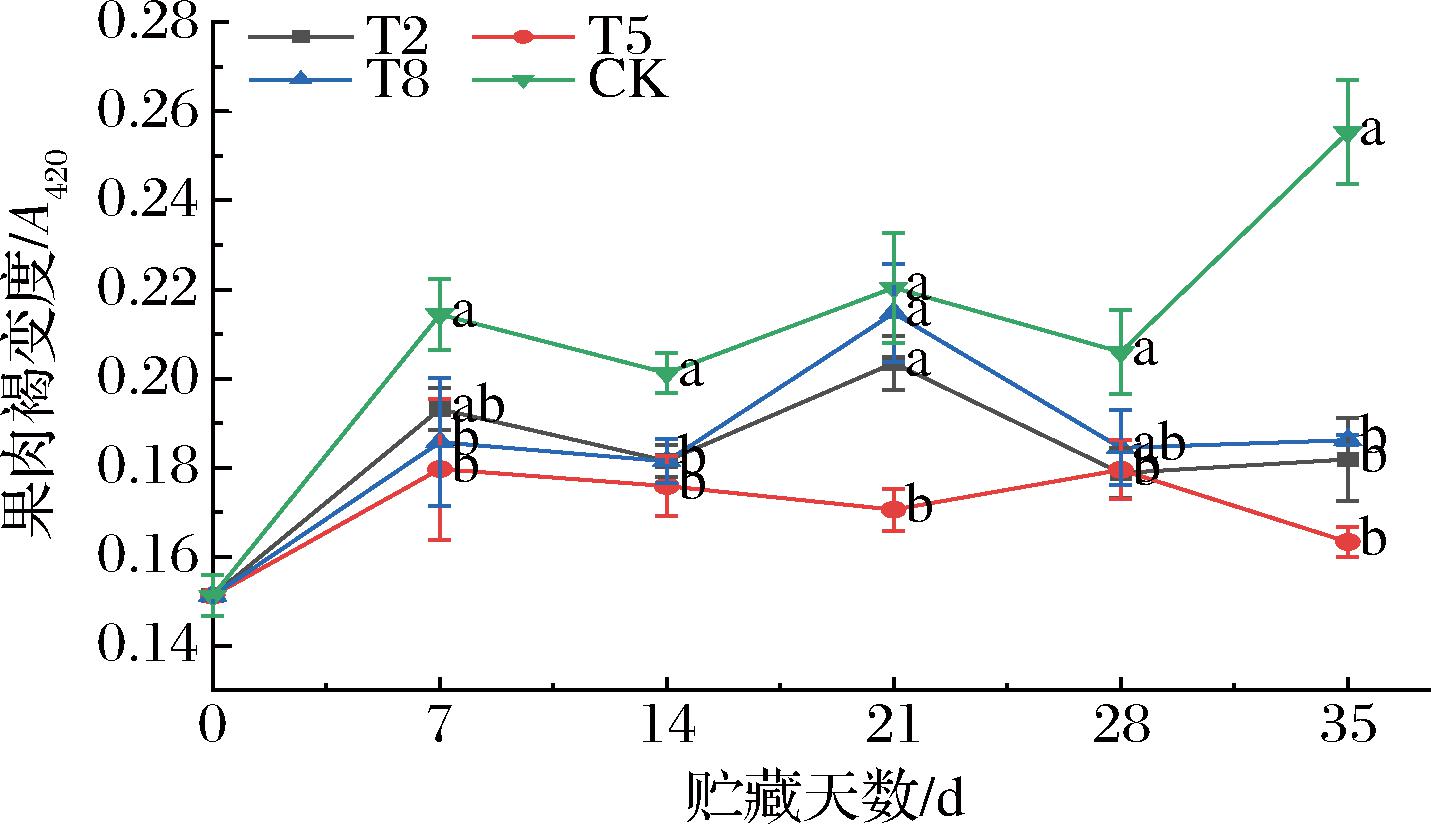
图2 不同温度对枇杷果肉褐变度的影响
Fig.2 Effect of different temperatures on browning degree of loquat pulp
注:不同小写字母代表差异显著,P<0.05(下同)。
如图3-A所示,CK组和T8组的硬度呈先上升后下降,表明CK组在0~21 d发生老化木质化,T8组在0 ~28 d发生冷害木质化,之后逐渐软化腐烂;T5组和T2组的硬度整体呈上升趋势,第35天时,T5组比T2组的枇杷硬度低2.08%。这说明,T5组在抑制枇杷软烂的同时还能减缓果实木质化。

A-硬度;B-木质素含量
图3 不同温度对枇杷硬度和木质素含量的影响
Fig.3 Effect of different temperatures on hardness and lignin content of loquats
如图3-B所示,枇杷果实的木质素含量不断增加。这将导致果实木质化加剧,口感变粗糙。在第35 天时,T5的木质素含量分别比T2组低10.75%,显著抑制了木质素的合成(P<0.05),延缓枇杷木质化。
SSC能直接反映果实的成熟程度和品质状况。如图4-A所示,各组的SSC均表现为先上升后下降。这可能是因为在贮藏初期,枇杷内部的淀粉等大分子碳水化合物转化为糖和其他可溶性物质,引起SSC升高。随后,果实的呼吸作用等消耗有机物质,SSC逐渐降低。在贮藏结束时,各组SSC从高到低依次为T5组>T2组>T8组>CK组。可知,T5组在贮藏期间维持了较高的SSC,保持了较好的贮藏品质。

A-SSC含量;B-TA含量;C-ASA含量;D-果肉出汁率
图4 不同温度对枇杷SSC、TA、ASA和出汁率的影响
Fig.4 Effect of different temperatures on SSC, TA, ASA, and juice percentage of loquats
TA是果实风味品质的重要影响因素,对果实的风味和贮藏性等具有重要作用。如图4-B所示,TA含量在贮藏过程中整体呈现下降趋势。贮藏到35 d时,T5组的TA含量比T8组、T2组和CK组分别高出9.38%、19.94%和44.23%(P<0.05)。这说明T5组贮藏抑制了TA的分解,有效保持了枇杷的风味和口感品质。
ASA是水果的营养品质和贮藏效果的评价指标之一。如图4-C可知,在贮藏过程中,ASA整体呈下降趋势。在第35天时,T2组、T5组、T8组和CK组分别下降了31.52%、27.13%、32.04%和34.98%。这说明低温可以延缓ASA的分解,其中T5组处理显著抑制了枇杷的氧化反应(P<0.05),减缓了ASA的降解速率,保持较高的ASA含量,保持枇杷良好的抗氧化能力和营养品质。
出汁率对果实品质的影响很大。如图4-D所示,CK组的出汁率呈现先下降后上升的趋势。这可能是因为在贮藏初期,贮藏环境温度较高,果实新陈代谢旺盛,水分流失快。在第21~35天,果实逐渐腐烂,果胶等细胞间质物质降解,胞内水分释放。实验组的出汁率呈现先上升后下降的趋势,在第35天时,T2、T5和T8组的出汁率比第0天分别降低3.76%、1.55%和2.33%,有效保持了枇杷的出汁率。
MDA是膜脂过氧化作用的产物之一,可以反映细胞膜脂过氧化的程度和逆境伤害的强弱。如图5所示,MDA含量随着贮藏时间的延长而增加。实验组的MDA含量始终低于CK组,T5组的MDA含量稳定维持在较低水平。说明T5组处理可以显著抑制枇杷MDA含量的积累(P<0.05),从而降低枇杷的膜脂过氧化程度。

图5 不同温度对枇杷MDA含量的影响
Fig.5 Effect of different temperatures on MDA content in loquats
如图6-A所示,贮藏期间![]() 产生速率呈现先增加再减少后增加的变化趋势。这可能是贮藏初期的贮藏室内氧气含量充足,氧化反应活跃,
产生速率呈现先增加再减少后增加的变化趋势。这可能是贮藏初期的贮藏室内氧气含量充足,氧化反应活跃,![]() 产生速率上升。随后,抗氧化物质的逐渐释放或活性增加,抑制了氧化反应,
产生速率上升。随后,抗氧化物质的逐渐释放或活性增加,抑制了氧化反应,![]() 产生速率下降。最后,抗氧化物质逐渐耗竭或失效,氧化反应重新占据主导地位,
产生速率下降。最后,抗氧化物质逐渐耗竭或失效,氧化反应重新占据主导地位,![]() 产生速率再次增加。这期间,T5组的
产生速率再次增加。这期间,T5组的![]() 产生速率显著低于另外3组(P<0.05),维持在较低水平。
产生速率显著低于另外3组(P<0.05),维持在较低水平。
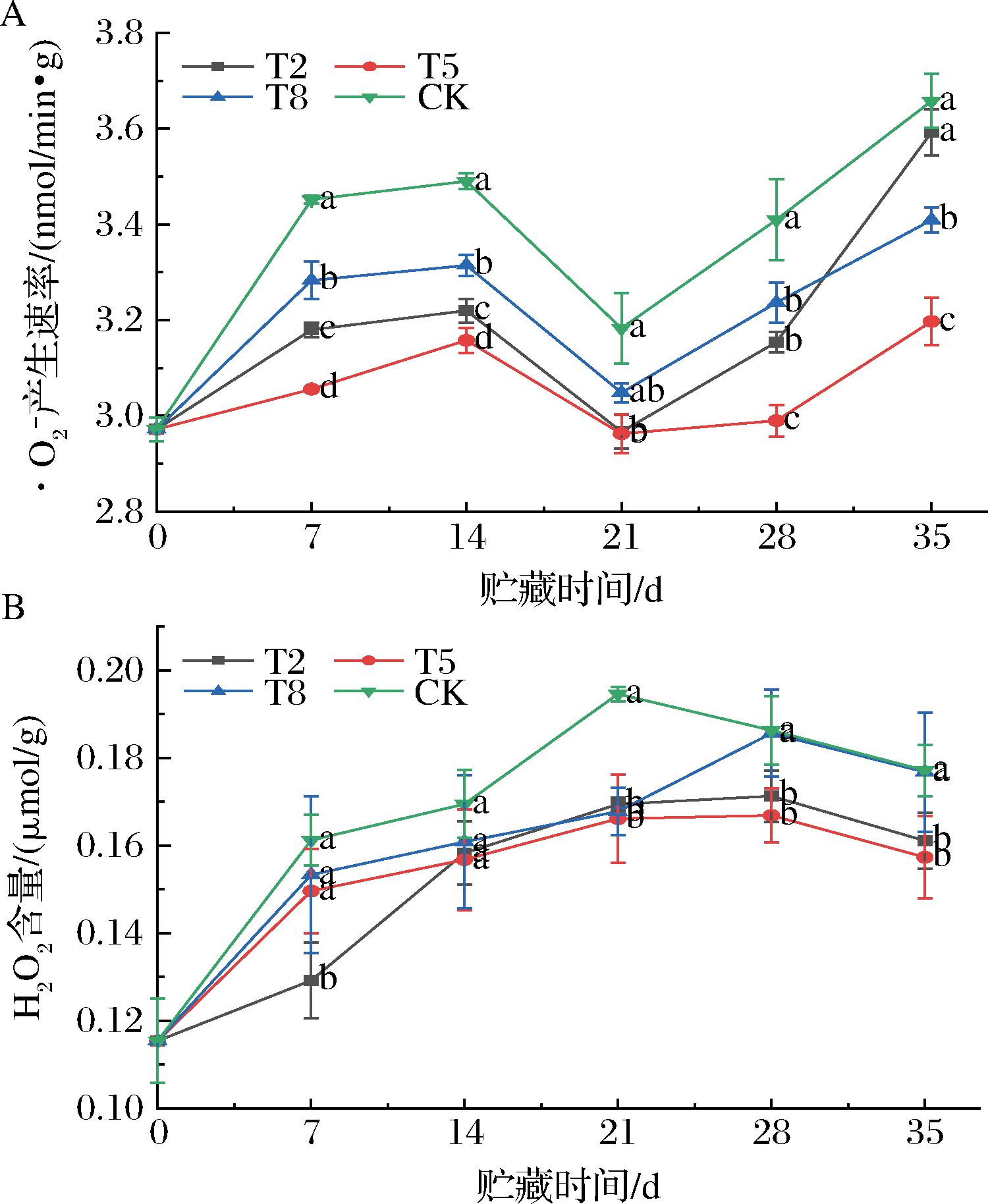
![]() 产生速率;B-H2O2含量
产生速率;B-H2O2含量
图6 不同温度对枇杷![]() 产生速率和H2O2含量的影响
产生速率和H2O2含量的影响
Fig.6 Effect of different temperatures ![]() production rate and H2O2 content of loquats
production rate and H2O2 content of loquats
如图6-B所示,H2O2含量整体呈现先增加后减少的趋势,其中实验组的H2O2含量一直低于对照组。这可能是因为低温下酶活性减缓、代谢受抑制以及抗氧化酶系统运作更有效,从而减缓氧化反应速率,降低了H2O2的生成。在第21天时,T2、T5、T8和CK组的H2O2含量分别为0.169、0.166、0.167、0.194 μmol/g,实验组与CK组的差异明显(P<0.05)。可见,实验组处理有助于延缓氧化反应,减少H2O2的生成,维持较好的枇杷品质。
PAL是木质素合成的关键酶。如图7-A所示,PAL活性整体呈现上升趋势。贮藏至28 d时,T2、T5、T8和CK组的PAL活性分别为49.57、38.57、45.56、31.87 U/g FW;贮藏至35 d时,T2、T5、T8和CK组的PAL活性分别为55.60、46.10、43.42、39.21 U/g FW。这与贮藏过程中枇杷硬度和木质素含量的变化趋势一致。

A-PAL活性;B-PPO活性;C-SOD活性;D-APX活性
图7 不同温度对枇杷PAL、PPO、SOD和APX活性的影响
Fig.7 Effect of different temperatures on PAL, PPO, SOD, and APX activities of loquats
PPO与果实的组织褐变密切相关。如图7-B所示,各组的PPO活性变化均呈现先上升后下降的规律。PPO活性在第21天达到最高,此时T2、T5、T8和CK的酶活性分别为18.82、12.97、20.82、23.98 U/g FW。此后,PPO活性呈下降趋势。在整个贮藏过程中,T5组的PPO活性始终低于其他处理组,显著抑制枇杷果实的酶促褐变(P<0.05)。
SOD可以专一地清除细胞中的![]() 减少自由基对有机体的毒害。如图7-C所示,SOD活性呈现先上升后下降趋势。在第21天时,T2、T5、T8和CK组的SOD活性均达到最大值,分别为4.92、5.82、5.28、4.52 U/g FW。其中,T5组的SOD活性始终高于其他组,使枇杷具有更高的
减少自由基对有机体的毒害。如图7-C所示,SOD活性呈现先上升后下降趋势。在第21天时,T2、T5、T8和CK组的SOD活性均达到最大值,分别为4.92、5.82、5.28、4.52 U/g FW。其中,T5组的SOD活性始终高于其他组,使枇杷具有更高的![]() 清除能力,减少自由基对机体的毒害。
清除能力,减少自由基对机体的毒害。
APX能催化ASA与H2O2反应,分解清除H2O2。如图7-D所示,随贮藏时间的延长,APX活性呈下降趋势。贮藏至35 d时,T2、T5、T8和CK组的酶活性分别降低24.38%、22.98%、27.66%和46.72%。由此可见,实验组能显著抑制APX活性的下降(P<0.05),保持果实较好的抗氧化能力。
有研究表明冷锻炼可以增强果实的低温适应性,减轻冷害症状[16]。本研究表明,通过梯度预冷快速散去田间热和增强低温适应性,再复合低温贮藏处理,可以在延缓枇杷衰老腐败的同时缓解冷害发生,保持良好的采后品质。
枇杷的SSC、TA、ASA和出汁率被认为是枇杷的重要的品质特征。本试验发现,随着贮藏时间的延长,枇杷果实中的SSC、TA和维生素C含量逐渐降低,这与在脐橙[17]和椪柑[18]等水果中的研究一致。与CK组相比,实验组显著抑制了SSC、TA和维生素C含量的降低,保持了良好的贮藏品质。在CK组中,贮藏初期,木质素含量上升而出汁率下降。这可能是因为环境温度较高,枇杷发生老化木质化,木质素合成并沉积,细胞结构空隙减少,果汁被束缚在细胞内,出汁率下降;贮藏后期,木质素含量稳定而出汁率下降,这可能是随着时间的延长,果实逐渐软化腐烂,细胞壁分解,促进果汁释放。在实验组中,木质素含量持续上升,出汁率则呈现先上升后下降的趋势。这可能是经过梯度预冷的低温锻炼,刺激了细胞内水分等物质蓄积,使果肉出汁率上升;而贮藏后期,不适宜的低温或在低温下贮藏时间过长,果实遭受冷害木质化,游离水被束缚,出汁率下降[19]。这些结果表明,与常温贮藏相比,梯度预冷复合低温贮藏能够保持枇杷果实良好的贮藏品质。
不适宜的低温或长期低温贮藏极可能导致果实冷害。研究认为,寒冷引起果蔬自身的氧化应激反应,活性氧因清除效率低下而积累到有害水平,引起氧化损伤和膜脂过氧化,导致产品品质劣变[20-21]。其中,褐变和木质化是枇杷冷害的典型症状[22],PPO和PAL是表征枇杷冷害的主要酶类。PPO能催化简单酚类物质氧化形成醌类物质,聚合后形成呈褐色聚合物,导致果实组织褐变。PAL是控制植物木质素积累的关键酶,在苯丙烷代谢途径中催化苯丙氨酸脱氨转化为肉桂酸化合物。SOD和APX则是果实体内的抗氧化酶类。SOD可以专一地歧化![]() 为H2O2和O2,并阻止生成毒性更强的OH-;APX能催化ASA与H2O2反应,分解清除H2O2。SOD和APX等抗氧化酶相互协调,及时清除
为H2O2和O2,并阻止生成毒性更强的OH-;APX能催化ASA与H2O2反应,分解清除H2O2。SOD和APX等抗氧化酶相互协调,及时清除![]() 和H2O2,使活性氧维持在较低水平,防止活性氧对细胞的毒害。在本研究中,T5组的MDA含量
和H2O2,使活性氧维持在较低水平,防止活性氧对细胞的毒害。在本研究中,T5组的MDA含量![]() 产生速率和H2O2含量均低于T2和T8组,说明T5组处理减轻了果实的细胞膜相变和活性氧代谢失调;果肉褐变度、硬度、木质素含量均低于T2和T8组,说明T5组处理有效缓解了低温贮藏过程中的冷害症状;PAL和PPO活性均低于其他组,SOD和APX活性均高于其他组,说明T5组处理通过抑制PAL活性来减少木质素生成和延缓果肉硬度增加,通过抑制PPO活性来延缓组织褐变;通过增强SOD活性来提升清除
产生速率和H2O2含量均低于T2和T8组,说明T5组处理减轻了果实的细胞膜相变和活性氧代谢失调;果肉褐变度、硬度、木质素含量均低于T2和T8组,说明T5组处理有效缓解了低温贮藏过程中的冷害症状;PAL和PPO活性均低于其他组,SOD和APX活性均高于其他组,说明T5组处理通过抑制PAL活性来减少木质素生成和延缓果肉硬度增加,通过抑制PPO活性来延缓组织褐变;通过增强SOD活性来提升清除![]() 和阻止OH-生成的能力;通过增强APX性来促进H2O2发生氧化还原反应,分解清除H2O2,从而减缓活性氧对枇杷的伤害。因此,T5组处理可以通过调控相关酶的活性来缓解果实衰老腐败和冷害症状。这与GILL等[23]对冷害的研究结果一致。
和阻止OH-生成的能力;通过增强APX性来促进H2O2发生氧化还原反应,分解清除H2O2,从而减缓活性氧对枇杷的伤害。因此,T5组处理可以通过调控相关酶的活性来缓解果实衰老腐败和冷害症状。这与GILL等[23]对冷害的研究结果一致。
综上所述,T5组处理能够维持良好的果实外观,抑制SSC、TA、ASA和出汁率下降,抑制硬度、木质素含量、褐变度、MDA含量![]() 产生速率和H2O2含量的增加,抑制PAL和PPO活性的增加,增强SOD和APX活性。从而实现延长的枇杷保质期和减轻冷害的发生,保持良好的贮藏品质。
产生速率和H2O2含量的增加,抑制PAL和PPO活性的增加,增强SOD和APX活性。从而实现延长的枇杷保质期和减轻冷害的发生,保持良好的贮藏品质。
[1] 林顺权. 栽培枇杷国际传播史考[J].果树学报, 2020, 37(2):272-277.LIN S Q.Verification of the international introduction of cultivated loquats[J].Journal of Fruit Science, 2020, 37(2):272-277.
[2] 廖秋红, 吴上游, 赵金凤, 等.川渝地区枇杷产业发展现状及对策思考[J].中国果业信息, 2020, 37(2):18-20;27.LIAO Q H, WU S Y, ZHAO J F, et al.Current situation and countermeasures of loquat industry development in Sichuan and Chongqing area[J].China Fruit News, 2020, 37(2):18-20;27.
[3] ZHANG Y C, GUO M J, MEI J, et al.Effects of different postharvest precooling treatments on cold-storage quality of yellow peach (Amygdalus persica)[J].Plants, 2022, 11(18):2334.
[4] LU L, ZUO W F, WANG C C, et al.Analysis of the postharvest storage characteristics of the new red-fleshed apple cultivar ‘Meihong’[J].Food Chemistry, 2021, 354:129470.
[5] LI D, CHENG Y D, DONG Y, et al.Effects of low temperature conditioning on fruit quality and peel browning spot in ‘Huangguan’pears during cold storage[J].Postharvest Biology and Technology, 2017, 131:68-73.
[6] CARMONA L, SULLI M, DIRETTO G, et al.Improvement of antioxidant properties in fruit from two blood and blond orange cultivars by postharvest storage at low temperature[J].Antioxidants, 2022, 11(3):547.
[7] MORALES J, BERMEJO A, BESADA C, et al.Physicochemical changes and chilling injury disorders in ‘Tango’mandarins stored at low temperatures[J].Journal of the Science of Food and Agriculture, 2020, 100(6):2750-2760.
[8] XIAO L, JIANG X Y, DENG Y C, et al.Study on characteristics and lignification mechanism of postharvest banana fruit during chilling injury[J].Foods, 2023, 12(5):1097.
[9] ZHANG S, SUN H M, WANG J Y, et al.The regulatory mechanisms and control technologies of chilling injury and fungal diseases of postharvest loquat fruit[J].Plants, 2022, 11(24):3472.
[10] ZHANG Z K, ZHU Q G, HU M J, et al.Low-temperature conditioning induces chilling tolerance in stored mango fruit[J].Food Chemistry, 2017, 219:76-84.
[11] 黄欣莉, 韩延超, 陈杭君, 等.1-甲基环丙烯通过调控香菇能量代谢抑制其采后褐变[J].食品科学, 2022, 43(13):192-198.HUANG X L, HAN Y C, CHEN H J, et al.1-Methylcyclopropene inhibits postharvest browning of Lentinus edodes by regulating energy metabolism[J].Food Science, 2022, 43(13):192-198.
[12] 宋肖琴, 张波, 徐昌杰, 等.采后枇杷果实的质构变化研究[J].果树学报, 2010, 27(3):379-384.SONG X Q, ZHANG B, XU C J, et al.Texture profile analysis of postharvest loquat fruit[J].Journal of Fruit Science, 2010, 27(3):379-384.
[13] 朱海英, 李人圭, 王隆华, 等.丝瓜果实发育中木质素代谢及有关导管分化的生理生化研究[J].华东师范大学学报(自然科学版), 1997, (1):87-94.ZHU H Y, LI R G, WANG L H, et al.Physiological and biochemical studies on lignin metabolism and its treachary element differentiation of fruit of Luffa cylindrica[J].Journal of East China Normal University(Natural Science), 1997, (1):87-94.
[14] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007:24-142.CAO J K, JIANG W B, ZHAO Y M.Post-Harvest Physiological and Biiochemical Laboratory Guidance for Fruits and Vegetables [M].Beijing:China Light Industry Press, 2007:24-142.
[15] 李忠光, 宋玉泉, 龚明.二甲酚橙法用于测定植物组织中的过氧化氢[J].云南师范大学学报(自然科学版), 2007, 27(3):50-54.LI Z G, SONG Y Q, GONG M.Xylenol orange method used for the measurement of hydrogen peroxide in plant tissue[J].Journal of Yunnan Normal University(Natural Sciences Edition), 2007, 27(3):50-54.
[16] ZHANG W L, JIANG H T, CAO J K, et al.Advances in biochemical mechanisms and control technologies to treat chilling injury in postharvest fruits and vegetables[J].Trends in Food Science &Technology, 2021, 113:355-365.
[17] SUN Y, LI Y Y, XU Y, et al.The effects of storage temperature, light illumination, and low-temperature plasma on fruit rot and change in quality of postharvest Gannan navel oranges[J].Foods, 2022, 11(22):3707.
[18] CAI N, WAN C P, CHEN J Y, et al.Evaluation of postharvest storability of Ponkan mandarins stored at different temperatures[J].Folia Horticulturae, 2021, 33(2):354-364.
[19] 陈婷, 雷龑, 黄新忠, 等.枇杷采后果肉木质化研究进展[J].福建果树, 2011(1):53-56.CHEN T, LEI Y, HUANG X Z, et al.Development of flesh lignify on loquat [J].Fujian Fruits, 2011(1):53-56.
[20] DARRAS A I.The chilling injury effect in cut flowers:A brief review[J].The Journal of Horticultural Science and Biotechnology, 2020, 95(1):1-7.
[21] NUKUNTORNPRAKIT O A, LUENGWILAI K, SIRIPHANICH J.Chilling injury in pineapple fruit is related to mitochondrial antioxidative metabolism[J].Postharvest Biology and Technology, 2020, 170:111330.
[22] PAREEK S, BENKEBLIA N, JANICK J, et al.Postharvest physiology and technology of loquat (Eriobotrya japonica Lindl.) fruit[J].Journal of the Science of Food and Agriculture, 2014, 94(8):1495-1504.
[23] GILL S S, TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry, 2010, 48(12):909-930.