目前,广泛采用的一次性缓冲包装材料仍以不可降解的发泡塑料制品为主,如聚乙烯(expanded polystyrene,EPS)、聚苯乙烯(polystyrene,PS)等[1]。由于发泡塑料制品回收利用难,自然条件下难以降解,在自然环境中长期存在,甚至在海洋生物、鸟类体内、食品、饮用水中均检测出不同材质的微塑料颗粒[2],造成严重的“白色污染”[3],对野生动物和人类健康造成极大的威胁。为此国家陆续出台了多项限塑政策。而以可再生、可在自然条件下降解的生物质材料替代塑料制品是最好的解决方案且刻不容缓。目前常见的可降解塑料(在塑料中加入淀粉、纤维素等添加剂)存在消耗粮食、处理困难等问题[4]。而菌丝体复合材料(mycelium-base composites,MBCs)以天然的植物秸秆或纤维为主要原料,以食用菌菌丝体为结合剂而制成,具有可循环、可持续发展的特点[5],是一种可百分之百降解的理想的发泡塑料替代品。
MBCs是指结合食用菌栽培技术,将食用菌接种到农副产品(如秸秆)为主要原料的固态基质培养制成的一种生物质复合材料。固态基质既提供营养又起机械强化作用[6],菌丝体是食用菌的营养器官,可以在生物质基质中汲取养分、生长定殖[7],将基质颗粒链接,使松散的颗粒形成一个整体[8],经过干燥处理使真菌失活、材料定型。MBCs作为缓冲包装材料机械性能优异,压缩强度约是EPS缓冲材料的2.3倍[9],冲击韧性约是PS材料的10倍[10],通过调整菌种种类[11]、基质配方[12]等,还可应用于保温[13]、吸声[14]等场景,满足包装、建筑等领域的需求。
树灵芝(Ganoderma sessile)是灵芝科灵芝属真菌,主要分布在广东地区[15]。灵芝属真菌的子实体多是名贵中草药,利用液态深层发酵技术可从发酵液中提取次级代谢产物,如三萜类[16]、可溶性膳食纤维[17]、生物碱类[18]等物质,其发酵液冻干粉具有细胞修复[19]、抗氧化[20]等功能。灵芝菌液态深层发酵技术是将灵芝菌丝体接种于液态培养基中,在摇瓶或发酵罐中通过控制营养条件和培养条件参数使菌种迅速生长以获得大量的菌丝体或次级代谢产物的一种培养方式[21]。通过液态发酵技术,控制碳氮源、pH等条件,可以使菌种培养在最佳条件下进行,保证目标产物的产量及质量[22]。本研究所用树灵芝液态发酵种子接种至固态基质,从固态发酵到最终菌丝体复合材料成型总耗时为8 d,而糙皮侧耳菌1103需固态发酵约20 d[9],3802平菇需固态发酵15 d[23],木耳菌需固态发酵20 d以上[24],以树灵芝作为发酵菌发酵耗时较短,生长速度较快,可大大缩短生产周期提高生产效能。
本研究对树灵芝液态发酵培养基和发酵条件进行优化以获得大量有活力的菌丝体,将发酵液分别接种于麻秆、玉米秸秆为主要原料的固态基质培养,以制备以制备菌丝体-麻杆(H-MBCs)和菌丝体-玉米秸秆(C-MBCs),以菌丝体生物量为指标对液态发酵培养基和发酵条件进行优化,对MBCs产品的力学性能及热稳定进行测定,为菌丝体复合材料替代发泡塑料应用于缓冲包装提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
树灵芝(Ganoderma sessile,SCAU-My1),保存于华南农业大学食品学院应用微生物实验室。
1.1.2 化学试剂和原料
麻秆、秸秆、甘蔗糖蜜,市售;玉米淀粉,上海麦克林生化科技有限公司;磷酸二氢钾、七水硫酸镁、无水葡萄糖、蔗糖,广州化学试剂厂;玉米浆干粉,上海博飞美科化学科技有限公司;乳糖,天津市永大化学试剂有限公司;小麦淀粉、可溶性淀粉、黄豆粉,上海源叶生物科技有限公司;蛋白胨,北京奥博星生物技术有限公司;酵母提取粉、胰蛋白胨、牛肉浸膏,广东环凯微生物科技有限公司;D-果糖、麦芽糖,上海迈瑞尔生化科技有限公司。
1.1.3 培养基
母种培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基;液态种子培养基:马铃薯葡萄糖水(potato dextrose broth,PDB)培养基,广东环凯微生物科技有限公司;基础发酵培养基(g/L):可溶性淀粉20,玉米浆干粉10,KH2PO4 3、7H20·MgSO4 3,121 ℃灭菌20 min。
1.2 仪器与设备
YXQ-LS-75SII立式压力蒸汽灭菌器,上海博讯实业有限公司;UTM5504电子万能试验机,中国深圳三思纵横科技;TG209F1LibraTM热重分析仪,德国耐驰仪器制造有限公司;MQD-B1T振荡培养箱,上海旻泉仪器有限公司;EM ACE600真空镀膜仪,德国Leica徕卡仪器有限公司;EVO MA 15扫描式电子显微镜,ZEISS;MGC350HP人工气候箱,上海一恒科学仪器有限公司;HS-1300-U-II洁净工作台,苏州安泰空气技术有限公司;DHG-9140A电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 工艺流程
工艺流程如下:
树灵芝母种→液态种子培养→液态发酵优化及培养→发酵液接种至破碎、灭菌后的固态基质→28 ℃、95%空气湿度下避光发酵5 d直至基质长满菌丝→重新破碎后装填到塑料模具→模具内培养2 d塑型→脱模培养2 d使菌丝长满材料外表面→干燥灭活、定型
1.3.2 菌丝体液态种子制备
将树灵芝接种于PDA培养基,28 ℃避光培养3 d,菌丝长满4/5平板时挑取3块大小相同(约0.5 cm×0.5 cm)菌苔接入液体种子PDB培养基中,装瓶量为100 mL/250 mL三角瓶,28 ℃摇床150 r/min避光培养4 d。
1.3.3 菌丝体液态种子培养基优化
通过替代基础发酵培养基中的碳源、氮源的种类及添加量,探讨不同碳源、氮源及添加量对菌丝体生物量的影响,以优化液态发酵培养基。将培养好的种子液接入基础发酵培养基中,接种量为5%,装瓶量为150 mL/500 mL三角瓶,初始pH值为5,发酵温度为25 ℃,转速为150 r/min避光培养4 d。
保持其他条件不变,分别以不同碳源(葡萄糖、蔗糖、乳糖、D-果糖、甘蔗糖蜜、麦芽糖、玉米淀粉、小麦淀粉)替代基础发酵培养基中的可溶性淀粉,确定最适碳源;而后固定最适碳源不变,以不同氮源(黄豆粉、酵母提取粉、蛋白胨、胰蛋白胨、牛肉浸膏、硫酸铵、硝酸铵)替代基础发酵培养基中的玉米浆干粉,筛选出最适氮源。
将玉米淀粉添加量固定为20 g/L,研究不同质量浓度梯度黄豆粉添加量(2、4、6、8、10、12、14、16、18 g/L)对菌丝体生物量的影响,确定黄豆粉添加量为14 g/L。固定黄豆粉添加量14 g/L不变,研究不同梯度玉米淀粉添加量(10、15、20、25、30、35、40、45、50 g/L)对菌丝体生物量的影响,最终确定玉米淀粉添加量为25 g/L。
1.3.4 菌丝体液态种子培养条件优化
1.3.4.1 单因素试验
基于优化后的液态发酵培养基,研究不同梯度的发酵温度(22、25、28、31、34、37 ℃)、初始pH值(3、4、5、6、7、8)、接种量(2%、5%、8%、11%、14%)、转速(60、90、120、150、180、210 r/min)、装瓶量(50、100、150、200、250、300 mL/500 mL)对菌丝体生物量的影响,进行发酵条件的优化。单因素变化时,其他发酵参数固定,发酵温度设为25 ℃,初始pH值设为5,接种量设为5%,转速设为150 r/min,装瓶量设为150 mL/500 mL,发酵时间设为4 d。
1.3.4.2 Plackett-Burman(PB)试验
基于单因素试验结果,以树灵芝菌丝体生物量为考察指标,选取初始pH(A)、装瓶量(B)、转速(C)、发酵温度(D)、接种量(E)5个因素进行PB试验,以确定对菌丝体生物量影响显著的因素,PB试验各因素水平如表1所示。
表1 PB试验设计表
Table 1 The design of PB experiments

水平因素A(初始pH)B(装瓶量)/(mL/500 mL)C(转速)/(r/min)D(发酵温度)/℃E(接种量)/%-1410015025216200210318
1.3.4.3 Box-Behnken试验
根据PB试验结果,对初始pH(A)、接种量(B)以及发酵温度(C)进行3因素3水平Box-Behnken试验,以菌丝体生物量为响应值,得到最优发酵条件,响应面实验各因素水平如表2所示。
表2 Box-Behnken试验设计表
Table 2 The design of Box-Behnken experiments

水平因素A(初始pH)B(接种量)/%C(发酵温度)/℃-142250552816831
1.3.5 菌丝体复合材料制备与表征
菌丝体复合材料培养基质配方为:玉米秸秆或麻秆80%,麸皮19.8%,生石灰0.2%,按质量比1∶1加入三级水混匀后装入聚丙烯薄膜袋,一般装至袋高的3/4,上下用力晃动使松紧度一致,放置过夜,125 ℃灭菌60 min,冷却至室温。在洁净工作台中将树灵芝发酵液接种到固态基质,接种量为10%,手动混匀装入聚丙烯薄膜袋,在28 ℃、95%空气湿度的人工气候箱中避光培养4 d,整袋基质长满白色的菌丝体,将其取出手动捏碎后装填于塑料模具,覆上保鲜膜密封,置于前述条件的人工气候箱中二次培养2 d,待长满致密的菌丝体后脱模再培养2 d,90 ℃烘干6 h即可得到成型的菌丝体缓冲材料。
1.4 指标测定
1.4.1 种子液菌丝体生物量测定
将培养好的发酵液用60目筛网过滤得到菌丝球,三级水洗涤3次,在80 ℃电热恒温鼓风干燥箱中烘干至恒重,即为菌丝体生物量。
1.4.2 菌丝体复合材料性能测试
采用扫描电镜分析观察菌丝体复合材料的微观结构,取5 mm×5 mm左右大小干燥样品真空镀金后,使用扫描电镜在5 kV加速电压下进行拍摄;压缩应力-应变曲线参考GB/T 8168—2008《包装用缓冲材料静态压缩试验方法》测试;抗拉强度-拉伸量曲线参考GB/T 17657—2013《人造板及饰面人造板理化性能试验方法》测试;热稳定性通过热重分析仪进行表征,N2氛围(99.99%),流量为20 mL/min,以10 ℃/min的速率从30 ℃加热至600 ℃。
1.5 数据处理
每次试验均设置3次重复,数据处理、统计分析使用Excel 2019、SPSS 26和Design-Expert 10软件,图标绘制使用Origin 2019。
2 结果与分析
2.1 菌丝体液态种子培养基优化
以不同碳源替代基础发酵培养基中的可溶性淀粉对树灵芝液态发酵菌丝体生物量的影响如图1-a所示。结果表明,优化前(可溶性淀粉组)菌丝体生物量为13.90 g/L,当以玉米淀粉作为碳源时,菌丝体生物量为15.79 g/L,显著高于其他处理组(P<0.05),玉米淀粉较易降解且价格较低,在工业生产中性价比较高,因此选择玉米淀粉作为最适碳源。以玉米淀粉为碳源,不同氮源对菌丝体生物量的影响如图1-b所示。结果表明,黄豆粉组菌丝体生物量为15.53 g/L、玉米浆干粉组为15.79 g/L、酵母提取粉组为15.98 g/L,3组结果无显著性差异(P>0.05),从经济性考虑黄豆粉的使用成本更低,因此选择黄豆粉作为最适氮源。玉米淀粉添加量设定为20 g/L,不同梯度黄豆粉添加量对菌丝体生物量的影响如图1-c所示。黄豆粉添加量在14 g/L时,发酵液菌丝体生物量达到最高17.95 g/L,由于氮源受限或过量均对菌丝体生长不利[25],因此选择黄豆粉添加量为14 g/L进行后续试验。固定黄豆粉添加量为14 g/L,不同梯度玉米淀粉添加量对菌丝体生物量的影响如图1-d所示。玉米淀粉添加量>40 g/L时,发酵4 d后发酵液中仍有可见的不溶物,使测定结果偏大。当玉米淀粉添加量为25 g/L时,发酵液菌丝体生物量较高,为18.87 g/L,综合分析误差范围及成本因素,选择玉米淀粉的添加量为25 g/L。

a-碳源筛选;b-氮源筛选;c-黄豆粉添加量;d-玉米粉添加量
图1 不同碳源、氮源及其添加量对菌丝体生物量的影响
Fig.1 The effects of different carbon sources, nitrogen sources, and their ratio on mycelial biomass
注:不同小写字母代表差异显著(P<0.05)(下同)。
综上,优化后的液态发酵配方为:玉米淀粉25 g/L,黄豆粉14 g/L,七水硫酸镁3 g/L,磷酸二氢钾3 g/L。
2.2 菌丝体液态培养条件优化
2.2.1 单因素试验
基于优化后的液态发酵培养基,不同梯度的发酵温度、初始pH、接种量、转速、装瓶量对树灵芝液态发酵菌丝体生物量的影响如图2所示。结果表明,随着发酵温度的升高,菌丝体生物量呈现先增后减的趋势,当发酵温度为28 ℃时达到最大值19.53 g/L;初始pH值为5时,生物量达到峰值18.87 g/L,初始pH值大于或小于5,菌丝体生物量均降低,尤其是碱性条件下(pH为8)菌丝体生物量迅速降低。发酵温度过高、初始pH过酸或过碱,菌丝体生物量急剧下降,可能是由于过高的发酵温度以及初始pH环境抑制了菌丝体无法生长,甚至使其结构发生自溶。

a-发酵温度;b-初始pH;c-接种量;d-转速;e-装瓶量
图2 不同因素对菌丝体生物量的影响
Fig.2 Effects of different factors on mycelial biomass
如图2-c所示,随着种子液接种量的提高,菌丝体生物量呈现缓慢上升的趋势,当接种量为14%时,生物量达到最高20.13 g/L,但此时所需的种子液较多,种子液中树灵芝的代谢废物也会随接种进入下一级的发酵环境中,且相较接种量为8%时的生物量(19.15 g/L)提升不明显。
摇床转速和装瓶量影响发酵液中的溶氧量,转速及装瓶量对菌丝体生物量的影响如图2-d和图2-e所示。随着转速的提高,菌丝体生物量呈现先上升后下降的趋势,当转速为180 r/min时,菌丝体生物量达到最大值19.53 g/L,转速的提高会增加溶氧,但过高的转速产生的剪切力(210 r/min以上)会影响菌丝体的生长从而使生物量降低。装瓶量的提高会降低发酵液的溶氧量,随着装瓶量的提高,菌丝体生物量逐渐下降,当装瓶量为300 mL/500 mL时,生物量最低11.73 g/L。
2.2.2 PB试验设计与结果
由表3可知,模型P值为0.034 4<0.05,有显著性差异,具有统计学意义。从各因素P值可知,影响树灵芝菌丝体生物量的主次因素为接种量>初始pH>发酵温度>转速>装瓶量,其中接种量、初始pH、发酵温度对菌丝体生物量影响显著(P<0.05),其他因素则影响不显著(P>0.05)。因此,选择接种量、初始pH、发酵温度进行响应面试验,转速和装瓶量则分别参照单因素试验的结果。
表3 PB试验结果显著性分析
Table 3 Significance analysis of PB experiment results

因素平方和预估系数均方F值P值显著性模型58.0811.625.210.034 4*A17.27-2.399 217.277.740.031 9*B0.041 20.117 20.041 20.018 50.896 4C7.961.628 57.963.570.107 8D13.98-2.158 713.986.270.046 3*E18.832.505 518.838.440.027 1*残差项13.382.23总差71.46R2=0.812 7R2Adj=0.656 7R2Pred= 0.251 0
注:“*”表示对结果影响显著(P<0.05)(下同)。
2.2.3 响应面实验设计与结果
菌丝体生物量与初始pH值、接种量、发酵温度的二次多项式回归方程为:Y=16.52+0.456A+0.48B+3.58C-0.656AB-0.688AC-0.48BC-1.53A2-2.28B2+0.164 8C2。
由表4可知,模型P值<0.000 1,说明该模型极显著,模型的失拟项不显著(0.469 0>0.05),决定系数R2=0.986 7,说明真实情况与该模型拟合度较高,能较好地预测菌丝体生物量。由F值可得出,各因素对树灵芝液态发酵菌丝体生物量的影响程度为:C(发酵温度)>B(接种量)>A(初始pH)。
表4 回归模型方差分析
Table 4 Analysis of variance of regression model

方差来源平方和自由度均方F值P值显著性模型144.28916.0358.19<0.000 1**A(初始pH)1.6611.666.040.043 6*B(接种量)1.8411.846.690.036 1*C(发酵温度)102.761102.76373.00<0.000 1**AB1.7211.726.250.041 0*AC1.8911.896.870.034 3*BC0.9210.923.350.110 1A29.8719.8735.830.000 5**B221.95121.9579.67<0.000 1**C20.1110.110.420.539 9残差1.9370.28失拟差0.8430.281.030.469 0纯误差1.0940.27总离差146.2016
注:“**”表示对结果影响极显著(P<0.01)。
2.2.4 响应面交互分析
根据响应面实验设计原理,三维曲面弯曲程度越大,表明两因素交互作用对菌丝体生物量的影响越显著。响应面实验等高线图为三维曲线在底部的投影,可以反映出因素之间交互相的强弱,为椭圆则表明两因素之间交互作用显著,呈圆形则与之相反,结果如图3所示。

a-A(pH)与B(接种量)交互;b-B(接种量)与C(发酵温度)交互;c-A(pH)与C(发酵温度)交互
图3 各因素交互作用对菌丝体生物量影响的响应面图
Fig.3 Response surface diagram of interaction of various factors on mycelial biomass
根据Design Expert 12软件所建立的模型进行参数最优化分析,得到最佳的发酵条件为发酵温度27.77 ℃,接种量4.59%,初始pH 5.64,此条件下菌丝体生物量理论值为19.22 g/L。为便于实际操作,调整发酵条件为发酵温度28 ℃,接种量5%,初始pH 5.5,重复3次试验,此条件下菌丝体生物量为18.73 g/L,与理论值相差2.5%,证明了其优化发酵条件的可靠性,较优化前的13.90 g/L,提高约34.7%。
2.3 菌丝体复合材料性能表征
2.3.1 扫描电镜观察MBCs的微观结构
不同放大倍数下扫描电镜(scanning electron microscope,SEM)观察MBCs的微观结构如图4所示。由图4-a可知,树灵芝菌丝体附着在固体基质的颗粒表面,在颗粒间隙之间生长蔓延,形成致密的网状结构,将散碎的基质颗粒编织成一个整体,形成了MBCs。由图4-b可知,树灵芝菌丝呈扁平状中空腔体结构,菌丝粗壮,拥有许多分枝形成锁状联合,分枝结构相互交叉、缠绕最终形成牢固的三维网状结构。

a-放大1 000倍下基质表面的菌丝缠绕;b-放大7 000倍下菌丝的分支与交叉
图4 菌丝体复合材料扫描电子显微镜图像
Fig.4 The SEM images of mycelium base composites
2.3.2 菌丝体复合材料力学性能测试
不同原料基质制备菌丝体复合材料的压缩向应力-应变关系如图5-a所示。整体看,C-MBCs和H-MBCs压缩向的机械性能都优于EPS。C-MBCs在形变发生50%时压缩应力约是EPS的5.4倍,约是H-MBCs的0.6倍,说明MBCs的承重能力优于EPS材料。但在形变前期(约0%~17%)H-MBCs的机械性能优于C-MBCs,可能是因为麻秆基质的颗粒较小,硬度比秸秆基质硬。而秸秆基质纤维较长、韧性较好,随着压力的加大,C-MBCs内部孔隙减小,材料抗压能力迅速上升,在形变发生后其应力迅速上升,说明C-MBCs的承重能力较强,适用于质量大的物体的缓冲包装。不同原料基质制备菌丝体复合材料抗拉强度-拉伸量关系曲线如图5-b所示。EPS材料在拉伸量为1.40 mm时材料断裂,抗拉强度达到最大0.313 9 MPa,而后急剧下降;C-MBCs在拉伸量为1.88 mm 时开始断裂,抗拉强度达到最大0.231 0 MPa,而后逐渐降低;H-MBCs在拉伸量1.99 mm时达到最大抗拉强度0.195 7 MPa。EPS材料的最大抗拉强度高于C-MBCs和H-MBCs,但在抗拉强度达峰后迅速下降,EPS材料直接断开,而2种菌丝体复合材料均表现出逐渐撕裂的曲线趋势,说明菌丝体复合材料内部缠绕交织的菌丝体的存在提升了材料的韧性。

a-MBCs应力-应变曲线;b-抗拉强度-拉伸量曲线
图5 菌丝体复合材料力学性能分析
Fig.5 Mechanical performance analysis of mycelium base composites
2.3.3 菌丝体复合材料热重分析
不同基质制备菌丝体复合材料的热重分析结果如图6所示。TGA曲线显示了H-MBCs、C-MBCs和EPS在35~600 ℃受热后降解的过程。第一阶段(35~120 ℃)H-MBCs质量下降不到2%,C-MBCs下降不到5%,EPS下降约6%,这一阶段MBCs主要是水分蒸发造成的质量变化,随着温度的升高,材料质量逐渐减小。第二阶段(260~350 ℃),H-MBCs和C-MBCs的质量损失速率开始提升,这一阶段主要是纤维素、半纤维素等成分的降解[26]。350 ℃后MBCs的质量损失开始趋缓,EPS材料迅速降解,在400 ℃左右质量仅剩不到2%,直到升温终点,C-MBCs质量剩余约39%,H-MBCs质量剩余约33%,EPS材料为1.08%。MBCs质量剩余率大,即成炭率较高,阻燃效果较好。
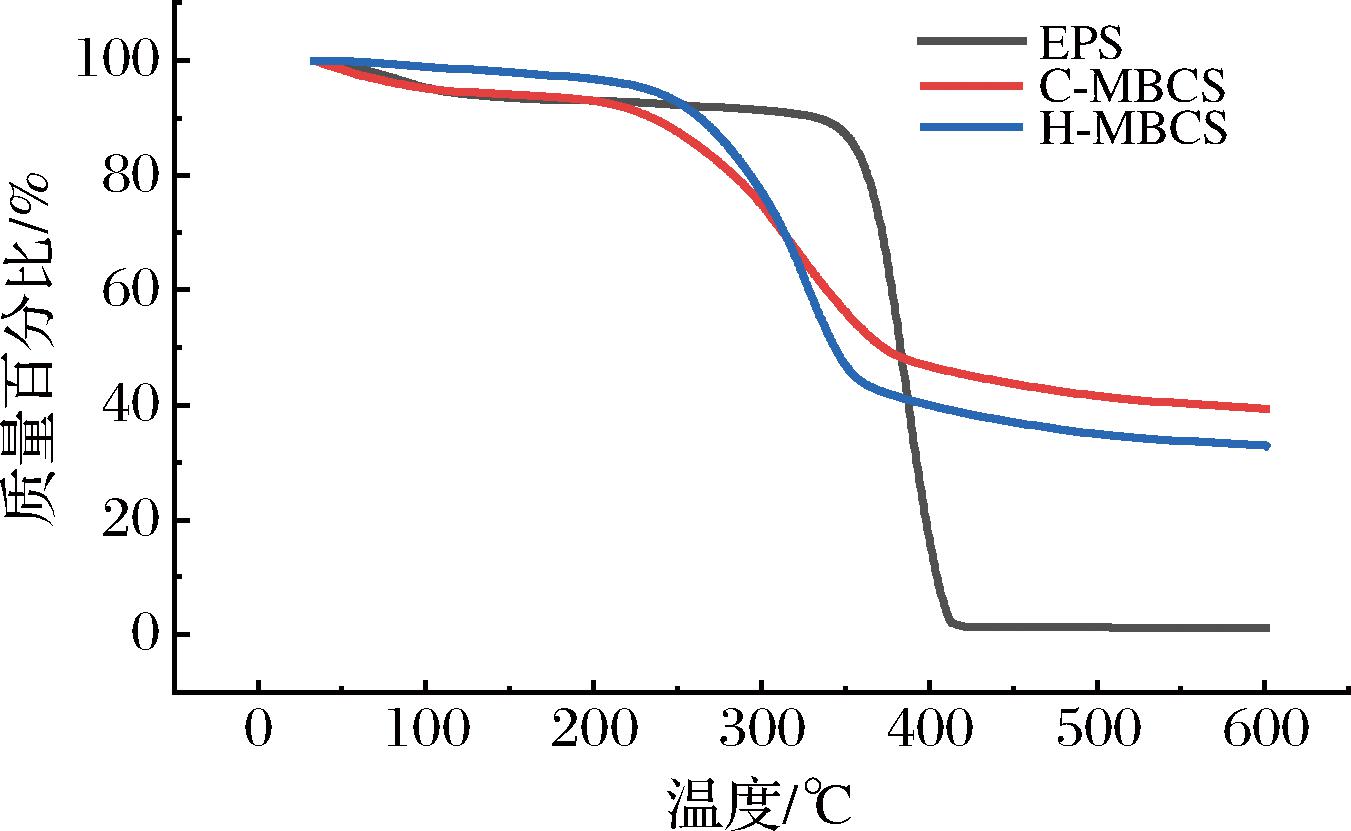
图6 菌丝体复合材料的TGA曲线
Fig.6 TGA of mycelium base composites
3 结论与讨论
将树灵芝(Ganoderma sessile)的菌丝体种子液接种到以农副产品(玉米秸秆、麻秆)为主要原料的固态基质制备MBCs。对树灵芝菌丝体液态种子培养基与培养条件进行优化,得到的最佳液态种子培养基配方为:玉米淀粉25 g/L、黄豆粉14 g/L、KH2PO4 3 g/L、7H2O·MgSO4 3 g/L;最佳发酵条件:发酵温度28 ℃,接种量5%,初始pH 5.5,装瓶量150 mL/500 mL,转速为180 r/min。
固态发酵制备的菌丝体复合材料C-MBCs在形变发生50%时压缩应力为EPS的5.4倍,为H-MBCs的0.6倍,说明玉米秸秆和麻秆制成的MBCs承重能力均优于EPS材料。C-MBCs和H-MBCs的最大抗拉强度不如EPS材料,但2种菌丝体复合材料均表现出逐渐撕裂的曲线趋势,内部缠绕交织的菌丝体提升了材料的韧性。在热处理至600 ℃后,C-MBCs质量剩余约39%,H-MBCs质量剩余约33%,而EPS材料仅剩约1.08%,说明MBCs的热稳定性远高于EPS材料,在火灾发生后阻燃性能较EPS材料更好。本研究将树灵芝菌丝体种子液接种到农副产品(玉米秸秆与麻秆)制备可生物降解的菌丝体复合材料,为替代发泡塑料用于缓冲包装提供了参考依据。
[1] 李文波. 白色污染的现状分析及其绿色化防治[J].当代化工研究, 2022(3):60-62.LI W B.Present situation analysis of white pollution and its green prevention and control[J].Modern Chemical Research, 2022(3):60-62.
[2] 张丽, 王成龙.降解塑料产业发展趋势研究[J].化学工业, 2022, 40(1):46-52.ZHANG L, WANG C L.Research report on the development trend of degradable plastics industry[J].Chemical Industry, 2022, 40(1):46-52.
[3] 袁大辉, 孙玲.可降解塑料现状及前景展望[J].橡塑技术与装备, 2022, 48(10):1-5.YUAN D H, SUN L.Status and prospect of degradable plastics[J].China Rubber/Plastics Technology and Equipment, 2022, 48(10):1-5.
[4] 王集合. 生物包装材料前程远大[J].绿色包装, 2018(1):76-78;83.WANG J H.Biological packaging materials have a bright future[J].Green Packaging, 2018(1):76-78;83.
[5] 唐小华, 胡斌, 李雪玲, 等.食药用菌菌丝体应用研究进展[J].食用菌学报, 2021, 28(4):116-122.TANG X H, HU B, LI X L, et al.Research progress on application of mycelium of edible and medicinal fungi[J].Acta Edulis Fungi, 2021, 28(4):116-122.
[6] ISLAM M R, TUDRYN G, BUCINELL R, et al.Mechanical behavior of mycelium-based particulate composites[J].Journal of Materials Science, 2018, 53(24):16371-16382.
[7] 张倩, 孙瑞祥, 席寅生, 等.两种食用菌菌丝体复合材料机械、物理和生物降解特性[J].食用菌学报, 2023, 30(4):88-96.SUN Q, SUN R X, XI Y S, et al.Mechanical, physical and biodegradation properties of two mycelium-based composites[J].Acta Edulis Fungi, 2023, 30(4):88-96.
[8] 陈晨伟, 丁榕, 彭柳城, 等.外源营养物对菌丝体生物质材料的生长研究及其性能表征[J].农业工程学报, 2021, 37(21):295-302.CHEN C W, DING R, PENG L C, et al.Effects of exogenous nutrients on the growth of mycelial biomass materials and its characterization[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(21):295-302.
[9] 丁嘉耀, 赵婕, 张建峰. 预处理玉米秸秆提高糙皮侧耳菌丝基缓冲材料性能的研究[J]. 菌物学报, 2023, 42(12): 2470-2480.DING J Y, ZHAO J, ZHANG J F. Improving the performance of Pleurotus ostreatus mycelium-based cushioning materials by corn straw pretreatment[J]. Mycosystema, 2023, 42(12): 2470-2480.
[10] AIDUANG W, KUMLA J, SRINUANPAN S, et al.Mechanical, physical, and chemical properties of mycelium-based composites produced from various lignocellulosic residues and fungal species[J].Journal of Fungi, 2022, 8(11):1125.
[11] AIDUANG W, CHANTHALUCK A, KUMLA J, et al.Amazing fungi for eco-friendly composite materials:A comprehensive review[J].Journal of Fungi, 2022, 8(8):842.
[12] HOENERLOH A, OZKAN D, SCOTT J.Multi-organism composites:Combined growth potential of mycelium and bacterial cellulose[J].Biomimetics, 2022, 7(2):55.
[13] 闫薇, 于兰芳, 李晓, 等.基于菌丝体的生物质保温材料研究现状[J].林产工业, 2019, 56(12):34-37.YAN W, YU L F, LI X, et al.Research status of biomass thermal insulation materials based on fungal mycelium[J].China Forest Products Industry, 2019, 56(12):34-37.
[14] PELLETIER M G, HOLT G A, WANJURA J D, et al.Acoustic evaluation of mycological biopolymer, an all-natural closed cell foam alternative[J].Industrial Crops and Products, 2019, 139:111533.
[15] 国家药典委员会. 中华人民共和国药典-一部: 2020年版[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China[M]. Beijing: The medicine science and technology press of China, 2020.
[16] 刘莉莹, 王洪庆, 刘超, 等.树灵芝中三萜类成分及其保肝作用研究[J].天然产物研究与开发, 2017, 29(4):584-589.LIU L Y, WANG H Q, LIU C, et al.Triterpenoids of Ganoderma sessile and their hepatoprotective activities[J].Natural Product Research and Development, 2017, 29(4):584-589.
[17] 刘蔚, 王征, 丰来.灵芝菌发酵紫甘薯渣获得可溶性膳食纤维的工艺优化[J].食品与发酵工业, 2012, 38(2):131-134.LIU W, WANG Z, FENG L.Optimization of fermentation conditions with purple sweet potato slag for soluble dietary fiber by Ganoderma lucidum[J].Food and Fermentation Industries, 2012, 38(2):131-134.
[18] 赵丽媛, 祝芙蓉, 黄梓芮, 等.灵芝活性成分及其对肠道菌群和机体代谢影响的研究进展[J].食品与发酵工业, 2022, 48(11):297-302.ZHAO L Y, ZHU F R, HUANG Z R, et al.Research progress on active ingredients of Ganoderma and their effects on intestinal microbiota and organism metabolism[J].Food and Fermentation Industries, 2022, 48(11):297-302.
[19] 张影, 孟宪瑶, 杨云丽, 等.灵芝双向发酵液对于HaCaT细胞中波紫外线损伤的修复研究[J].食品与发酵工业, 2022, 48(24):220-225.ZHANG Y, MENG X Y, YANG Y L, et al.Repair of UVB light damage in HaCaT cells by Ganoderma lucidum bidirectional fermentation broth[J].Food and Fermentation Industries, 2022, 48(24):220-225.
[20] 张影, 孟宪瑶, 李忠峰, 等.灵芝双向发酵液冻干粉抑制环氧化酶-2及抗氧化活性的研究[J].食品与发酵工业, 2023, 49(1):47-52.ZHANG Y, MENG X Y, YANG Y L, et al.Inhibition of cyclooxygenase-2 and antioxidant activity of lyophilized powder of Canoderma lucidum bidirectional fermentation broth[J].Food and Fermentation Industries, 2023, 49(1):47-52.
[21] 赵雪. 液体发酵灵芝菌丝体生物活性的研究[D]. 长春: 吉林农业大学, 2017.ZHAO X. Study on biological activity of Ganoderma lucidum mycelium by liquid fermentation[D]. Changchun: Jilin Agricultural University, 2017.
[22] 朱戎, 陈向东, 兰进. 药用真菌液体发酵研究进展[J]. 中药材, 2003, 26(1):55-57.ZHU R, CHEN X D, LAN J. Advance in the study on liquid fermentation for medicinal fungi[J]. Journal of Chinese Medicinal Materials, 2003, 26(1):55-57.
[23] 于庆宇, 于子淇, 龚笛翔, 等. 平菇菌丝纤维生长速度的影响因素及用作缓冲包装材料的试验研究[J]. 化纤与纺织技术, 2022, 51(3):19-21.YU Q Y, YU Z Q, GONG D X, et al. Experimental study on the factors affecting the growth rate of mycelium fiber of Pleurotus ostreatus and its use as cushioning packaging material[J]. Chemical Fiber &Textile Technology, 2022, 51(3):19-21.
[24] 夏慧敏,张显权.真菌菌丝-木屑复合材料的物理力学性能——以灵芝菌、木耳菌为例[J].东北林业大学学报, 2018, 46(4):63-66.XIA H M, ZHANG X Q.Mechanical properties of fungal hyphae/wood particle composites—Taking Ganoderma lucidum and Auricularia auricular as example[J].Journal of Northeast Forestry University, 2018, 46(4):63-66.
[25] HSIEH C, TSENG M H, LIU C J.Production of polysaccharides from Ganoderma lucidum (CCRC 36041) under limitations of nutrients[J].Enzyme and Microbial Technology, 2006,38(1-2):109-117.
[26] 闫薇, 于兰芳, 曹春红, 等.菌丝体生物泡沫材料防火特性研究[J].消防科学与技术, 2021, 40(8):1239-1242.YAN W, YU L F, CAO C H, et al.Study on fire performance of mycelium bio-foam[J].Fire Science and Technology, 2021, 40(8):1239-1242.