原生的裸藻(Euglena gracilis)是一种无细胞壁的单细胞微藻,因此被科学家命名为裸藻,具有光自养、异养或光异养等营养模式[1]。裸藻细胞中含有多种营养成分,例如裸藻多糖、维生素、类胡萝卜素、必需氨基酸、矿物质等,这些成分具有抗氧化、抗肿瘤、降胆固醇等作用[2]。
裸藻多糖(Euglena gracilis polysaccharide, EGP)又被称为副淀粉,其结构类似于淀粉,但遇碘不变蓝。这种多糖体主要由线性β-1,3-葡聚糖构成,是裸藻中的储能物质。裸藻多糖X射线衍射和密度测量表明,裸藻多糖由3股螺旋葡聚糖链形成,核磁共振光谱表明裸藻多糖由100%葡萄糖组成,其在天然状态下具有非常高的结晶度(约90%)[3]。
裸藻多糖的多种生物活性已被研究学者证实,例如护肝[4]、抗病毒[5]、抗肿瘤[6]、抗炎[7]、免疫调节[8]。但目前国内涉及到裸藻多糖提取的研究却十分有限,张延林等[9]通过微酸溶解、微碱皂化然后通过醇沉提取裸藻多糖。葛智超等[10]用超声波辅助酶法提取裸藻多糖,离心取上清液并醇沉得到裸藻粗多糖。国外一般通过细胞破碎和高效分离得到裸藻多糖颗粒,日本东京裸藻公司采用超声波破碎,通过离心获得裸藻粗多糖,用1%(质量分数)SDS溶液95 ℃ 处理1 h,再用0.1% SDS在50 ℃处理30 min,进一步离心获得裸藻多糖[11]。
本文将超声破碎与碱提取结合,以提高裸藻多糖的提取率,并优化裸藻多糖的提取工艺参数,探究其参数对于裸藻多糖提取率的影响和相互之间的作用,并探究了EGP的结构及抗氧化活性,为EGP未来的研究及应用提供了一定的参考。
1 材料与方法
1.1 材料与试剂
裸藻粉,东台市赐百年生物工程有限公司;硫酸亚铁、抗坏血酸、过硫酸钾(分析纯),天津市科密欧化学试剂有限公司;DPPH(分析纯),山东西亚化学股份有限公司;三氯化铁标准液、过氧化氢标准液,福州韦伯康生物科技有限公司。其余试剂均为分析纯。
1.2 仪器与设备
TGL-15B高速离心机,上海安亭科学仪器厂;722 N可见分光光度计,上海仪电分析仪器有限公司;台式扫描电镜,日本日立高新技术公司;赛默飞ICS600离子色谱仪,赛默飞世尔科技有限公司;傅立叶变换红外光谱仪,德国BRUKER公司;凝胶渗透色谱仪,美国Waters公司。
1.3 实验方法
1.3.1 EGP超声碱提工艺
准确称取一定量的裸藻粉末于离心管中,加入适量的NaOH溶液,超声处理一段时间后恒温水浴处理,8 000 r/min离心10 min,取上清液即多糖溶液,稀释后采用苯酚-硫酸法测定多糖浓度,并根据公式(1)计算其得率。
1.3.2 单因素试验
考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50、1∶60,g∶mL)、水浴温度(40、50、60、70、80、90 ℃)、水浴时间(0.5、1、1.5、2、2.5、3 h)、NaOH溶液浓度(0.1、0.3、0.5、0.7、0.9、1.1 mol/L)、超声功率(40、80、120、160、200、240、280 W)和超声时间(1、2、3、4、5、6 min)对提取率的影响。
1.3.3 Plackett-Burman(PB)试验设计
在单因素试验结果的基础上,以EGP提取率(Y1)为指标,使用Design-Expert 13.0.4软件对超声碱提工艺中的6个工艺参数进行PB试验设计,每组试验设置3个平行,因素及水平见表1。
表1 Plackett-Burman试验设计因素及水平
Table 1 Factors and levels for Plackett-Burman test design

水平因素A(料液比)(g∶mL)B(水浴温度)/℃C(水浴时间)/hD(NaOH溶液浓度)/(mol/L)E(超声功率)/WF(超声时间)/min-1300.5400.78021501.5601.11604
1.3.4 Box-Behnken(BB)响应面试验设计
根据PB试验结果,选取水浴温度(A)、水浴时间(B)、NaOH溶液浓度(C)对EGP提取率影响最大的3个因素为自变量,使用Design-Expert 13.0.4软件进行3因素3水平的响应面试验设计,因素及水平见表2。
表2 Box-Behnken响应面试验设计因素及水平
Table 2 Factors and levels for Box-Behnken response surface design

水平因素A(水浴温度)/℃B(水浴时间)/hC(NaOH溶液浓度)/(mol/L)-1400.50.705010.91601.51.1
1.3.5 EGP提取率的计算
1.3.5.1 葡萄糖标曲的制作
量取100 mg葡萄糖溶于去离子水,定容至100 mL,量取10 mL溶液用去离子水定容至100 mL,制备葡萄糖标准溶液,抽取0、0.2、0.4、0.6、0.8、1、1.2 mL标准溶液于试管中,用蒸馏水将每个试管补至2.0 mL后加入现配的5%(体积分数)苯酚(1 mL),摇匀后加入浓H2SO4(5 mL),用涡轮振荡器充分振荡,冷却至室温后,在490 nm处测吸光度值并绘制标准曲线。测得葡萄糖标准曲线的回归方程为y=0.009x+4×10-5,R2=0.998 5。
1.3.5.2 EGP得率的计算
EGP得率的计算如公式(1)所示:
(1)
式中:W表示EGP得率,%;c表示根据吸光度值计算出的溶液质量浓度,mg/mL;D表示溶液稀释倍数;V表示多糖溶液总体积,mL;m表示裸藻粉取样量,mg。
1.3.6 EGP理化性质
1.3.6.1 相对分子质量测定
采用凝胶渗透色谱仪测定多糖的分子质量。将多糖充分溶解,过0.22 μm滤膜后进样。色谱条件:PL aquagel-OH 30,8 μm(7.5 mm×300 mm);进样量20 μL;流动相为四氢呋喃,流速1.0 mL/min,柱温:40 ℃。
1.3.6.2 单糖组成分析
称取20 mg EGP样品,加入10 mL三氟乙酸(3 mol/L),120 ℃水解3 h,取出多糖溶液后氮气吹干,加入1 mL超纯水溶解,再用超纯水稀释20倍,离心后取上清液检测多糖的单糖组成。
色谱条件为:赛默飞ICS600,色谱柱为PA20(150 mm×3.0 mm),进样量5 μL;流动相A为水,流动相B为15 mmol/L NaOH、100 mmol/L NaOAc,流速0.5 mL/min;柱温:30 ℃。检测器:电化学检测器。
1.3.6.3 傅里叶变换红外光谱(Fourier transform infrared spectrometry, FT-IR)分析
将1 mg干燥的EGP与KBr以质量比100∶1混合研磨,压片后采用傅里叶变换红外光谱对EGP进行表征,测定波数为400~4 000 cm-1。
1.3.6.4 扫描电镜(scanning electron microscope, SEM)分析
将裸藻多糖粉末用导电胶固定在样品台后进行喷金处理,在10 kV加速电压下观察裸藻多糖表面形貌。
1.3.7 抗氧化活性
1.3.7.1 羟自由基清除活性
将1 mL不同质量浓度的EGP溶液(0.1、0.2、0.4、0.6、0.8、1、1.2 mg/mL),与1.8 mmol/L的FeSO4(2 mL)、1.8 mmol/L的水杨酸-乙醇溶液(1.5 mL)和0.3%(体积分数)H2O2(1 mL)混合,37 ℃水浴30 min,3 000 r/min离心5 min,在510 nm处测定上清吸光度。以抗坏血酸为阳性对照,清除率计算如公式(2)所示:
清除率![]()
(2)
式中:A0为用水代替EGP溶液试验得到的空白吸光度;A1为样品溶液的吸光度;A2为用乙醇代替水杨酸-乙醇溶液测定EGP溶液得到的吸光度。
1.3.7.2 DPPH自由基清除活性
将2 mL不同质量浓度的EGP溶液(0.1、0.2、0.4、0.6、0.8、1、1.2 mg/mL)与0.1 mmol/L的DPPH溶液(4 mL)混合,在室温下避光静置30 min,在517 nm 处测定所得溶液的吸光度,以抗坏血酸为阳性对照。每个浓度的EGP溶液做3组平行试验,根据公式(2)计算DPPH自由基清除率。
DPPH自由基清除率的计算公式与公式(2)一致,A2为用乙醇代替DPPH溶液测定EGP溶液得到的吸光度。
1.3.7.3 还原力测定
将1 mL不同浓度的EGP溶液(0.1、0.2、0.4、0.6、0.8、1、1.2 mg/mL)与0.2 mmol/L的PBS缓冲液(pH 6.6,2.5 mL)和1%(体积分数)铁氰化钾溶液(2.5 mL)混合,50 ℃水浴20 min后加入2.5 mL 100 g/L的三氯乙酸溶液后,在3 000 r/min下离心10 min。取2.5 mL上清液,加入2.5 mL蒸馏水和0.5 mL 1 g/L的FeCl3溶液。10 min后在700 nm处测定所得溶液吸光度。
1.3.7.4 ABTS阳离子自由基清除活性
7 mmol/L ABTS与2.45 mmol/L过硫酸钾以1∶1的体积比混合可生成ABTS阳离子自由基,然后在室温下避光保存16 h。使用前,将ABTS自由基阳离子溶液用无水乙醇稀释至734 nm处吸光度为0.7~0.8。取1 mL不同质量浓度的EGP溶液(20、40、60、80、100、120 μg/mL),加入4 mL ABTS阳离子自由基溶液,室温避光静置5 min。在734 nm处测定所得溶液的吸光度,以抗坏血酸为阳性对照。
ABTS阳离子自由基清除率计算公式与公式(2)一致。A2为用蒸馏水代替ABTS阳离子自由基溶液测定EGP溶液得到的吸光度。
1.3.7.5 超氧阴离子自由基清除活性
取1 mL不同质量浓度的EGP溶液(0.05、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL),加入0.05 mol/L Tris-HCl缓冲液(pH 8.2,3 mL),25 ℃水浴10 min,然后加入30 mmol/L的邻苯三酚(200 μL),25 ℃水浴4 min,加入0.5 mL浓HCl终止反应,在329 nm处测定所得溶液的吸光度,以抗坏血酸为阳性对照。
超氧阴离子自由基清除率计算公式与公式(2)一致。A2为用蒸馏水代替邻苯三酚测定EGP溶液得到的吸光度。
1.4 数据处理
每次试验做3个平行,使用Origin 2022、Design-Expert 13.0.4进行作图以及数据处理分析。
2 结果与分析
2.1 单因素试验结果与分析
由图1-a可知,EGP提取率在料液比为1∶40(g∶mL)时达到峰值,可能是由于在提取初期随着提取溶剂体积的增加,促进了EGP向外扩散,加速了EGP的提取[12],随着料液比继续增加,EGP提取率呈现下降趋势,这可能归因于过高的料液比会加速多糖的分散,导致多糖提取率下降。由图1-b可知,当NaOH溶液浓度为0.9 mol/L时,EGP提取率达到最高,但随着NaOH溶液浓度升高,提取率呈现下降的趋势,有可能是碱溶液浓度过高导致部分多糖降解[13]。

a-料液比对提取率的影响;b-NaOH溶液浓度对提取率的影响;c-水浴时间对提取率的影响;d-水浴温度对提取率的影响;e-超声功率对提取率的影响;f-超声时间对提取率的影响
图1 各单因素对EGP提取率的影响
Fig.1 The effect of single factors on the extraction rate of EGP
由图1-c和图1-d可看出,EGP提取率随着水浴温度升高和时间的延长呈现先上升后下降的趋势,这是由于升高温度或延长时间可能提高了EGP的扩散系数和溶解度,从而提高了EGP的提取率[14],当温度超过50 ℃或者时间超过1 h时,EGP提取率大幅下降,也许是温度过高或者提取时间过长时,会导致多糖产生大量的降解。
由图1-e和图1-f可看出,随着超声时间延长及功率的增加,EGP提取率呈现出上升而后趋于平稳的趋势,造成这种现象的原因可能是由于超声波空化气泡的压力分解了裸藻的细胞膜[15-16]。当超声时间超过3 min或者超声功率超过120 W后,多糖的提取率趋于平缓,因此超声时间选择3 min,超声功率选择120 W。
2.2 Plackett-Burman(PB)试验结果分析
2.2.1 PB试验设计及结果
使用Design-Expert 13.0.4软件进行PB试验设计。PB试验设计及结果见表3,每组试验做3个平行。
表3 Plackett-Burman试验设计及结果
Table 3 Experimental design and results of Plackett-Burman design
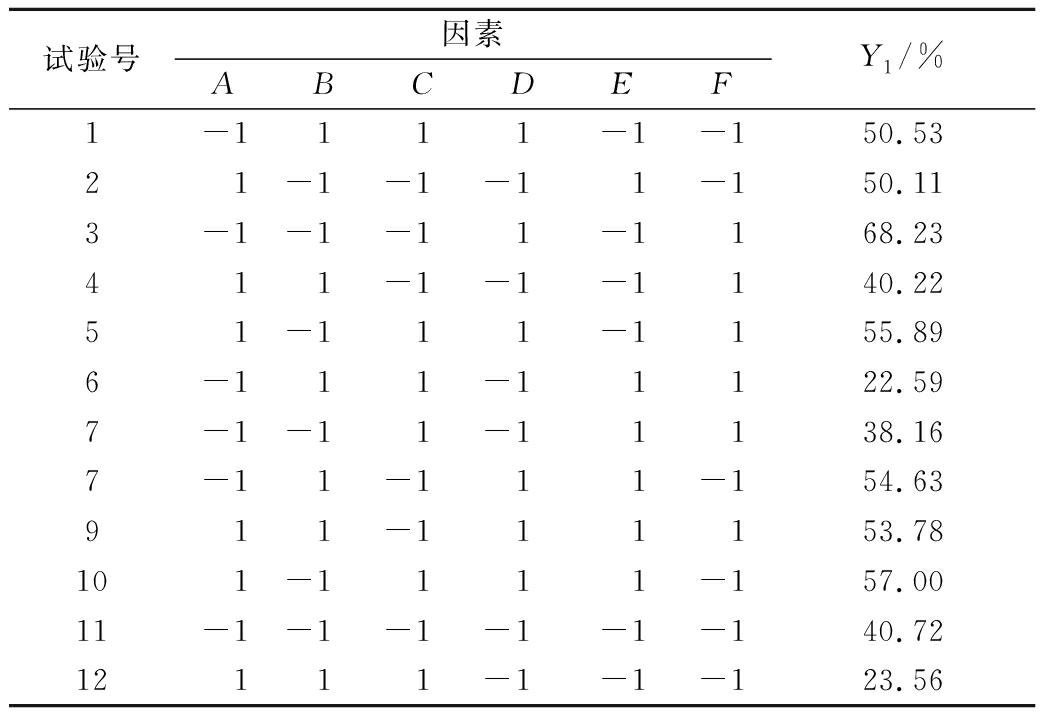
试验号因素ABCDEFY1/%1-1111-1-150.5321-1-1-11-150.113-1-1-11-1168.23411-1-1-1140.2251-111-1155.896-111-11122.597-1-11-11138.167-11-111-154.63911-111153.78101-1111-157.0011-1-1-1-1-1-140.7212111-1-1-123.56
2.2.2 显著性分析
PB试验设计分析结果见表4,模型的P值小于0.01,R2=0.958 6,可知该回归方程模型的拟合度良好,具有统计学意义。由表4结果可看出,水浴温度对EGP提取率具有显著影响(P<0.05),水浴时间和NaOH浓度对EGP提取率具有极显著影响(P<0.01),因此选取B(水浴时间)、C(水浴温度)、D(NaOH溶液浓度)3个因素进行进一步优化处理,其余因素水平设定为料液比1∶40(g∶mL)、超声功率120 W、超声时间3 min。
表4 Plackett-Burman试验设计分析
Table 4 Plackett-Burman test design analysis

来源 P值模型0.002 6**A(料液比)0.927 4B(水浴时间)0.008 2**C(水浴温度)0.011 4*D (NaOH浓度)0.000 3**E(超声功率)0.633 9F(超声时间)0.660 7
注:P<0.05,差异显著*;P<0.01,差异极显著**(下同)。
2.3 Box-Behnken响应面试验结果分析
2.3.1 响应面试验设计及结果
结合单因素试验及PB试验结果,以水浴温度(A)、水浴时间(B)、NaOH溶液浓度(C)为自变量,使用Design-Expert 13.0.4软件进行3因素3水平的试验设计。实验设计及结果见表5,每组做3次平行。
表5 Box-Behnken试验设计及结果
Table 5 Experimental design and results of Box-Behnken design

试验号因素ABCY1/%1-10-155.73210-138.3630-1-146.31400057.24500056.07601-146.22700058.40811042.479-11059.291001153.021100058.56120-1158.221300060.4414-1-1059.51151-1048.331610151.9317-10163.27
2.3.2 回归模型的建立及显著性分析
使用Design-Expert 13.0.4软件对表5的实验数据进行多元回归拟合,得到二次项方程Y1=-36.103 84+0.575 562A+53.246 67B+138.590 27C-0.282 22AB+1.005 54AC-12.777 75BC-0.019 322A2-15.240 06B2-84.694 74C2。
由表6可知模型P值<0.000 1,呈极显著水平;失拟项P=0.938 9>0.05不显著,此模型具有显著统计学意义。此模型的相关系数R2为![]() 为0.966 9,由此可知在最佳条件下,实际值与预测值的偏差较小。由表3可看出,A、C、B2、C2的P值<0.01,呈极显著水平;B、AC、A2的P值<0.05,呈显著水平;AB、BC不显著(P>0.05);因此各因素对EGP提取率的影响为水浴温度>NaOH溶液浓度>水浴时间。
为0.966 9,由此可知在最佳条件下,实际值与预测值的偏差较小。由表3可看出,A、C、B2、C2的P值<0.01,呈极显著水平;B、AC、A2的P值<0.05,呈显著水平;AB、BC不显著(P>0.05);因此各因素对EGP提取率的影响为水浴温度>NaOH溶液浓度>水浴时间。
表6 回归模型方差分析结果
Table 6 Variance analysis results of regression model

来源平方和自由度均方F值P值Model795.06988.3452.99<0.000 1**A430.871430.87258.45<0.000 1**B16.18116.189.710.017*C178.811178.81107.26<0.000 1**AB7.9617.964.780.065 1AC16.18116.189.70.017*BC6.5316.533.920.088 3A215.72115.729.430.018*B261.12161.1236.660.000 5**C248.32148.3228.990.001**残差11.6771.67失拟项1.0230.339 60.127 50.938 9纯误差10.6542.66总回归806.7316
2.3.3 响应面图分析
3个因素(水浴温度、水浴时间和NaOH溶液浓度)两两交互的响应曲面图如图2所示,响应曲面的陡峭程度与等高线的疏密程度反映了两因素之间的交互作用,曲面陡峭程度越大、等高线分布越不均匀说明交互作用越显著,图2-b中响应曲面颇为陡峭,说明水浴温度与NaOH溶液浓度的交互作用对EGP提取率影响显著(P<0.05),图2-a和图2-c中响应曲面坡度较小,表明水浴温度与水浴时间的交互作用和水浴时间与NaOH溶液浓度的交互作用对EGP提取率的影响不显著(P>0.05),与回归模型中的方差分析结果一致。

a-水浴温度与水浴时间交互作用响应面图;b-水浴温度与NaOH溶液交互作用响应面图;c-水浴时间与NaOH溶液交互作用响应面图
图2 两两因素交互作用对EGP提取率影响的响应面图
Fig.2 Response surface map of the interaction of pairwise factors on the extraction rate of EGP
2.3.4 EGP提取工艺的验证试验
通过Design-Expert 13.0.4软件分析得出EGP最佳提取工艺为水浴时间为0.89 h,水浴温度为41 ℃,NaOH溶液浓度为1.01 mol/L,在实际生产应用中,工艺参数改为水浴时间为0.9 h,水浴温度为41 ℃,NaOH溶液浓度为1 mol/L,其他工艺条件分别为料液比为1∶40(g∶mL),超声功率为120 W,超声时间为3 min,EGP提取率最佳值为63.60%。在此条件下,做3组平行实验,得到EGP提取率为(62.84±0.49)%,与预测值偏差较小,说明该模型的预测条件与实际情况相吻合,提取工艺可行。
2.4 EGP理化性质表征
2.4.1 相对分子质量测定
由图3-a可知,EGP呈多峰分布,为非均一性多糖,如表7所示,EGP的Mn、Mw、Mp、Mz分别为7.51×103、2.13×104、2.26×104、4.08×104Da,分散系数为2.842 9,与报道的裸藻多糖分子质量(1.9×105 Da)相比[17],本研究中EGP的分子质量较小,有可能是因为提取方法的不同导致这种差异。

a-EGP分子质量色谱图;b-EGP红外色谱图;c-EGP单糖组成色谱图
图3 EGP表征色谱图
Fig.3 Characterization chromatograms of EGP
表7 EGP的分子质量参数
Table 7 Molecular mass parameters of EGP

样品Mn/(×103 Da)Mw/(×104 Da)Mp/(×104 Da)Mz/(×104 Da)Mw/MnEGP7.512.132.264.082.842 9
2.4.2 傅里叶变换红外光谱分析
如图3-b所示,EGP位于3 200~3 600 cm-1处的强吸收峰来自多糖和水的O—H的伸缩振动,同时也是糖类的特征峰,在2 927 cm-1处的吸收峰是C—H的伸缩振动,1 641 cm-1处的峰值为C![]() O伸缩振动吸收峰[18],1 400 cm-1处的特征吸收峰为C—H弯曲振动吸收峰[19],1 000~1 200 cm-1内的的峰值为C—O—C伸缩振动的特征吸收峰,说明样品中存在D-吡喃型糖环[17],890 cm-1处的吸收峰说明样品中存在β-糖苷键[20]。
O伸缩振动吸收峰[18],1 400 cm-1处的特征吸收峰为C—H弯曲振动吸收峰[19],1 000~1 200 cm-1内的的峰值为C—O—C伸缩振动的特征吸收峰,说明样品中存在D-吡喃型糖环[17],890 cm-1处的吸收峰说明样品中存在β-糖苷键[20]。
2.4.3 单糖组成分析
采用离子色谱(ion chromatography, IC)分析EGP的单糖组成,结果如图3-c所示,EGP由100%的葡萄糖组成,这与BARSANTI等[21]和鞠海军[17]的核磁共振结果一致,但葛智超等[10]的结果显示,EGP包含有9种单糖,并非由100%的葡萄糖组成;文愉熙等[22]所分离出的非水溶性多糖含有4种单糖,其中葡萄糖摩尔含量最高,而分离出的2种水溶性多糖至少含有9种多糖,二者单糖组成类型相同,但摩尔比有些许差异。
2.4.4 扫描电镜分析
如图4所示,在1 000倍放大下,EGP颗粒没有明显的棱角,呈近似椭圆形态,经过3 000倍放大后,可观测到EGP颗粒堆积在一起,表面相对光滑,较大的颗粒呈扁平圆状,较小的颗粒较圆润饱满。

a-扫描电镜1 000倍放大图;b-扫描电镜3 000倍放大图
图4 EGP扫描电镜图
Fig.4 SEM result of EGP
2.5 抗氧化活性试验结果与分析
2.5.1 EGP对羟自由基清除率的测定
由图5-a可看出,在质量浓度为0.1~1.2 mg/mL时,当EGP质量浓度低于0.2 mg/mL时,清除能力为0,随着多糖浓度增加,其羟自由基清除率也随之升高,当EGP质量浓度为1.2 mg/mL时,羟自由基清除清除率为95.00%,与抗坏血酸相当,与栗晓庆等[23]所报道的质量浓度为1.0 mg/mL时清除能力为93.7%结果接近,猜测EGP中多糖链上的氢原子可与羟自由基结合产生水,从而去除羟自由基,因此表现出较强的羟自由基清除能力。

a-EGP对羟基自由基的清除活性;b-EGP对DPPH自由基的清除活性;c-EGP的总还原力;d-EGP对ABTS自由基的清除活性;e-EGP对超氧阴离子自由基的清除活性
图5 EGP体外抗氧化活性
Fig.5 Antioxidant activity of EGP
2.5.2 EGP对DPPH自由基清除率的测定
由图5-b可知,在质量浓度为0.1~1.2 mg/mL时,EGP对DPPH自由基清除率随多糖浓度的增加而快速升高,当EGP质量浓度为1.2 mg/mL时,其对DPPH自由基的清除率达到94.74%,与抗坏血酸的清除能力相当,但葛智超等[10]关于EGP的抗氧化研究中的报道中表明,其超滤分离所得的>10 kDa、5~10 kDa、3~5 kDa 3个分子质量段的EGP均无DPPH自由基清除活性(清除率均为0),DPPH自由基通常用于评价新型抗氧化剂的自由基清除能力,可以将抗氧化剂的氢原子接收,从而形成稳定的分子,导致溶液颜色变浅,从而表现出抗氧化活性,试验结果表明,EGP可以提供氢原子,对DPPH自由基具有较强的清除作用。
2.5.3 EGP还原力的测定
由图5-c可知,在质量浓度为0.1~1.2 mg/mL时,EGP的还原力随着质量浓度的增加而增加,在1.2 mg/mL达到最大,吸光度值为0.84,当抗坏血酸质量浓度超过0.6 mg/mL时,吸光度值达到1.78,随着浓度的增加其吸光度值稳定不变,根据文献报道,桂七青芒果皮多糖在质量浓度为4.3 mg/mL时还原力为0.455[24],香菇多糖质量浓度为1.0 mg/mL时还原力为0.17[25],与本文的EGP相比,还原力较低。试验结果说明,在还原过程中,EGP可能不仅能够作为电子供体与自由基反应,还可能通过与过渡金属离子催化剂螯合等机制发挥作用。
2.5.4 EGP对ABTS阳离子自由基清除率的测定
EGP中含有的大量羟基,可以提供电子将ABTS阳离子自由基还原为更稳定的形式。由图5-d可知,在20~120 μg/mL时,EGP对ABTS阳离子自由基清除率随着质量浓度的增加而上升,在120 μg/mL时,EGP对ABTS阳离子自由基的清除率达到92.49%,与抗坏血酸接近,表明低质量浓度的EGP仍然具有较强的ABTS阳离子自由基清除活性。根据文献报道,刺梨果多糖在质量浓度为250 μg/mL时对ABTS阳离子自由基清除率为81.92%,具有显著的量效关系[26],椰子皮多糖对ABTS阳离子自由基清除率在质量浓度为3.2 mg/mL时达到89.58%[27],EGP清除ABTS阳离子自由基的活性明显高于文献报道的其他多糖,这可能是由于自由基模型的性质不同所导致的。
2.5.5 EGP对超氧阴离子自由基清除率的测定
如图5-e所示,当多糖质量浓度超过0.4 mg/mL时,EGP对超氧阴离子自由基的清除能力逐渐上升,多糖质量浓度为1.0 mg/mL时清除率达到最高为35.67%,远低于抗坏血酸,根据文献[28]报道,羊栖菜多糖的超氧阴离子自由基清除率在质量浓度为2 mg/mL时低于5%,商佳琦等[29]报道了5种食用菌多糖单糖组成与抗氧化活性之间的关系,结果表明岩藻糖含量与多糖超氧阴离子清除能力的IC50呈正相关。单糖组成分析分析结果EGP为同一性多糖,由100%的葡萄糖组成,不含有岩藻糖,可能是其对超氧阴离子自由基的清除能力较低的原因。
2.5.6 EGP抗氧化活性总结
IC50值可反映出EGP的抗氧化活性,IC50值越小,表明其抗氧化活性越强。由表8可知,EGP对ABTS阳离子自由基的清除活性最好,IC50值为0.069 mg/mL,对羟自由基、DPPH自由基、还原力及超氧阴离子自由基的IC50值分别为0.56、2.68、2.49、1.58 mg/mL,但均低于阳性对照抗坏血酸的抗氧化活性。抗氧化活性试验结果表明,EGP具有良好的抗氧化活性,作为天然的抗氧化剂具有较大的开发潜力。
表8 EGP体外抗氧化活性
Table 8 Antioxidant activity of EGP

抗氧化活性抗坏血酸标准曲线回归方程抗氧化活性回归方程IC50/(mg/mL)VCEAC/(mg/mL)羟自由基Y=80.44X+19.428 45Y=97.03X-10.680.560.43DPPH自由基Y=3.34X+94.008Y=65.54X+23.82.682.106 11×10-5还原力Y=0.914X+0.933Y=0.64X+0.082.490.24ABTS阳离子自由基Y=0.14X+81.65Y=0.39X+47.500.0690.005 9超氧阴离子自由基Y=86.61X+25.33Y=37.36X-2.231.580.18
注:VCEAC表示维生素C等效抗氧化能力。
3 结论
本研究采用超声波搭配碱提法提取EGP,通过单因素试验、PB试验以及响应面法优化设计,确定了超声搭配碱提取的最佳工艺条件,料液比为1∶40(g∶mL)、水浴时间0.9 h、水浴温度41 ℃、NaOH溶液浓度1 mol/L、超声功率120 W、超声时间3 min,在此条件下,EGP提取率达到(62.84±0.49)%。通过凝胶渗透色谱、离子交换色谱、傅里叶变换红外光谱以及扫描电镜对EGP进行表征,此外,EGP的抗氧化试验结果表明EGP具有良好的抗氧化活性,EGP清除羟自由基、DPPH自由基、还原力和超氧阴离子自由基的IC50值分别为0.56、2.68、2.49、1.58 mg/mL,ABTS阳离子自由基的IC50值为0.069 mg/mL,且与浓度呈正向线性关系。本文的研究结果为今后EGP的提取及应用提供了一定的数据支持。
[1] DAI J J, HE J Y, CHEN Z X, et al.Euglena gracilis promotes Lactobacillus growth and antioxidants accumulation as a potential next-generation prebiotic[J].Frontiers in Nutrition, 2022, 9:864565.
[2] KOTTUPARAMBIL S, THANKAMONY R L, AGUSTI S.Euglena as a potential natural source of value-added metabolites.A review[J].Algal Research, 2019, 37:154-159.
[3] SHIMADA R, FUJITA M, YUASA M, et al.Oral administration of green algae, Euglena gracilis, inhibits hyperglycemia in OLETF rats, a model of spontaneous type 2 diabetes[J].Food &Function, 2016, 7(11):4655-4659.
[4] XIE Y H, LI J, QIN H, et al.Paramylon from Euglena gracilis prevents lipopolysaccharide-induced acute liver injury[J].Frontiers in Immunology, 2022, 12:797096.
[5] NAKASHIMA A, SUZUKI K, ASAYAMA Y, et al.Oral administration of Euglena gracilis Z and its carbohydrate storage substance provides survival protection against influenza virus infection in mice[J].Biochemical and Biophysical Research Communications, 2017, 494(1-2):379-383.
[6] IIDA M, DESAMERO M J, YASUDA K, et al.Effects of orally administered Euglena gracilis and its reserve polysaccharide, paramylon, on gastric dysplasia in A4 gnt knockout mice[J].Scientific Reports, 2021, 11(1):13640.
[7] BRUN P, PIOVAN A, CANIATO R, et al..Anti-inflammatory activities of Euglena gracilis extracts[J].Microorganisms, 2021, 9(10):2058.
[8] IEIRI H, KAMEDA N, NAITO J, et al.Paramylon extracted from Euglena gracilis EOD-1 augmented the expression of SIRT1[J].Cytotechnology, 2021, 73(5):755-759.
[9] 张延林, 赵璐, 钟进义.一种裸藻多糖的提取方法:中国, CN105542031B[P].2017-12-15.ZHANG Y L, ZHAO L, ZHONG J Y.Extraction method of naked algal polysaccharides:China, CN105542031B[P].2017-12-15.
[10] 葛智超, 郎蒙, 李燕.裸藻多糖的分离纯化、单糖组成及其抗氧化活性[J].上海海洋大学学报, 2021, 30(3):564-571.GE Z C, LANG M, LI Y.Isolation, purification, monosaccharide composition and antioxidant activity analysis of Euglena gracilis polysaccharides[J].Journal of Shanghai Ocean University, 2021, 30(3):564-571.
[11] MARCHESSAULT R H, DESLANDES Y.Fine structure of (1→3)-β-D-glucans:Curdlan and paramylon[J].Carbohydrate Research, 1979, 75:231-242.
[12] LI P C, XUE H K, XIAO M, et al.Ultrasonic-assisted aqueous two-phase extraction and properties of water-soluble polysaccharides from Malus hupehensis[J].Molecules, 2021, 26(8):2213.
[13] SANG Y M, HAO Z T, DAI S S, et al.Optimization of aqueous two-phase extraction of polysaccharides from hawthorn by response surface methodology coupled with genetic algorithm and its antioxidant activity[J].Starch-Stärke, 2023, 75(11-12):2300094.
[14] LIN Y Y, ZENG H Y, WANG K, et al.Microwave-assisted aqueous two-phase extraction of diverse polysaccharides from Lentinus edodes:Process optimization, structure characterization and antioxidant activity[J].International Journal of Biological Macromolecules, 2019, 136:305-315.
[15] ZHU C P, ZHAI X C, LI L Q, et al.Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J].Food Chemistry, 2015, 177:139-146.
[16] JALILI F, JAFARI S M, EMAM-DJOMEH Z, et al.Optimization of ultrasound-assisted extraction of oil from canola seeds with the use of response surface methodology[J].Food Analytical Methods,2018, 11(2):598-612.
[17] 鞠海军. 裸藻多糖分离提取、结构鉴定及生物活性研究[D].上海:华东理工大学,2020.JU H J.Separation, structure identification of paramylon and study on its bioactivities[D].Shanghai:East China University of Science and Technology, 2020.
[18] HE P F, ZHANG A Q, ZHANG F M, et al.Structure and bioactivity of a polysaccharide containing uronic acid from Polyporus umbellatus Sclerotia[J].Carbohydrate Polymers, 2016, 152:222-230.
[19] ZHANG Z, GUO L, YAN A P, et al.Fractionation, structure and conformation characterization of polysaccharides from Anoectochilus roxburghii[J].Carbohydrate Polymers, 2020, 231:115688.
[20] 姚艳婷, 杨小兵, 陈旭洁, 等.富硒蛹虫草多糖的结构表征及体外免疫调节活性[J].食品科学, 2023, 44(22):39-48.YAO Y T, YANG X B, CHEN X J, et al.Structural characterization and in vitro immunomodulatory activity of polysaccharides from selenium-enriched Cordyceps militaris[J].Food Science, 2023, 44(22):39-48.
[21] BARSANTI L, PASSARELLI V, EVANGELISTA V, et al.Chemistry, physico-chemistry and applications linked to biological activities of β-glucans[J].Natural Product Reports, 2011, 28(3):457-466.
[22] 文愉熙, 黄晓舟, 林晓思.裸藻非水溶性和水溶性多糖的化学组成及抗氧化活性分析[J].食品工业科技, 2022, 43(5):105-113.WEN Y X, HUANG X Z, LIN X S.Analysis of chemical composition and antioxidant activities of water-insoluble and water-soluble polysaccharides from Euglena gracilis[J].Science and Technology of Food Industry, 2022, 43(5):105-113.
[23] 栗晓庆, 吕俊平, 刘琪, 等.裸藻多糖碱提工艺优化及其体外抗氧化活性研究[J].食品科技, 2019, 44(9):209-215.LI X Q, LYU J P, LIU Q, et al.Optimization of alkaline extraction and antioxidant activities of paramylon in vitro[J].Food Science and Technology, 2019, 44(9):209-215.
[24] 李珊, 梁俭, 冯群, 等.桂七青芒果皮多糖提取工艺的响应面优化及其体外抗氧化活性[J].食品工业科技, 2019, 40(4):220-225;231.LI S, LIANG J, FENG Q, et al.Optimization of polysaccharides from Guiqi-mango peels by response surface methodology and its antioxidant activity in vitro[J].Science and Technology of Food Industry, 2019, 40(4):220-225;231.
[25] 赵茹, 康明丽, 张琴, 等.酶解辅助提取香菇多糖工艺优化及其抗氧化活性[J].食品研究与开发, 2023, 44(12):116-121.ZHAO R, KANG M L, ZHANG Q, et al.Enzymatic hydrolysis-assisted extraction and antioxidant activity of polysaccharide from Lentinus edodes[J].Food Research and Development, 2023, 44(12):116-121.
[26] 李倩倩, 程婷婷, 刘涵, 等.刺梨果多糖提取工艺优化及抗氧化活性研究[J].粮食与油脂, 2022, 35(11):104-108;113.LI Q Q, CHENG T T, LIU H, et al.Study on the extraction technology and antioxidant activity of polysaccharides from Rosa roxburghii Tratt fruit[J].Cereals &Oils, 2022, 35(11):104-108;113.
[27] ZHOU S Y, HUANG G L.Extraction, structure characterization and biological activity of polysaccharide from coconut peel[J].Chemical and Biological Technologies in Agriculture, 2023, 10(1):15.
[28] 刘洪超, 应苗苗, 周雨暪, 等.羊栖菜多糖提取条件优化及其抗氧化活性的研究[J].食品工业科技, 2017, 38(6):245-249;255.LIU H C, YING M M, ZHOU Y M, et al.Optimization of extraction process of Sargassum fusiforme polysaccharide and antioxidant activity[J].Science and Technology of Food Industry, 2017, 38(6):245-249;255.
[29] 商佳琦, 邹丹阳, 滕翔宇, 等.5种食用菌多糖的结构特征及抗氧化活性对比[J].食品工业科技, 2020, 41(15):77-83;89.SHANG J Q, ZOU D Y, TENG X Y, et al.Structural characterization and antioxidant activity of five kinds of edible fungus polysaccharides[J].Science and Technology of Food Industry, 2020, 41(15):77-83;89.