奶酪是一种营养价值较高的发酵乳制品,富含优质蛋白、钙和维生素等多种营养物质,具有多种健康功能,包括抗氧化、抗炎、抗菌和免疫调节等功能[1]。在奶酪生产、贮藏过程中,乳酸菌可以通过酶的作用,产生多肽、氨基酸和脂肪酸等易被消化吸收的小分子活性化合物,改善奶酪的功能特性[2]。目前,奶酪功能特性的研究多集中于成熟奶酪,如抗氧化、抗菌、抗高血压和免疫活性的研究[3-4],其中提高抗氧化特性的技术手段,主要有添加具有抗氧化特性的菌株作为发酵剂或附属发酵剂[5];提取富含多酚的农副产品作为奶酪的原料[6];采用不同包装材料或涂层增强奶酪的抗氧化特性[7],以及喷射干燥的富含抗氧化特性化合物的水果粉等方法[8]。然而,成熟奶酪高酸、高盐的环境及较长的成熟期限制了许多乳酸菌的生长,因此新鲜奶酪被认为比成熟奶酪更适合作为有益菌株的载体[9]。夸克奶酪是一种常见的酸凝新鲜奶酪,质地柔软、口感顺滑、风味清爽并伴有温和的酸味[10],与中国传统清淡口味相契合,当前针对夸克奶酪的研究主要集中在风味、工艺优化和延长保质期的探究[11-12],未见以夸克奶酪为模型,探究抗氧化菌株对其品质影响的报道。
本研究以实验室前期获得的12株优良乳酸菌为筛选对象,以菌株产酸能力、蛋白水解度、蛋白酶活力以及抗氧化活性为指标,筛选出适宜作为夸克奶酪附属发酵剂的菌株,将其添加至奶酪,旨在探讨贮藏过程中高抗氧化特性菌株对夸克奶酪理化指标、滴定酸度、质构和抗氧化活性的影响。此研究不仅为合理开发利用抗氧化乳酸菌奠定理论基础,又为功能性奶酪的开发提供应用参考及新方向。
1 材料与方法
1.1 材料与试剂
新鲜牛乳购自光明乳业股份有限公司;商业发酵剂CHOOZITTM MA 14购自丹麦科汉森股份有限公司;实验所用12株菌如表1所示,均来自乳业生物技术国家重点实验室菌种库。
表1 实验所用菌株信息
Table 1 Information of strains used in this study
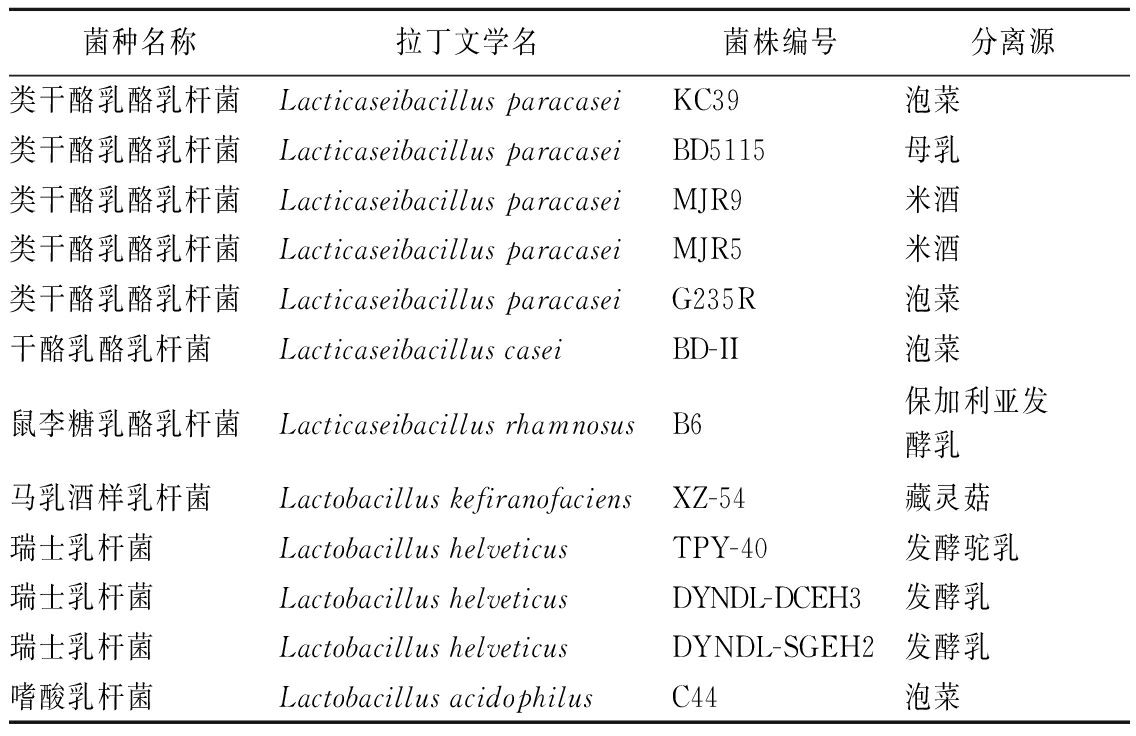
菌种名称拉丁文学名菌株编号分离源类干酪乳酪乳杆菌Lacticaseibacillus paracaseiKC39泡菜类干酪乳酪乳杆菌Lacticaseibacillus paracaseiBD5115母乳类干酪乳酪乳杆菌Lacticaseibacillus paracaseiMJR9米酒类干酪乳酪乳杆菌Lacticaseibacillus paracaseiMJR5米酒类干酪乳酪乳杆菌Lacticaseibacillus paracaseiG235R泡菜干酪乳酪乳杆菌Lacticaseibacillus caseiBD-II泡菜鼠李糖乳酪乳杆菌Lacticaseibacillus rhamnosusB6保加利亚发酵乳马乳酒样乳杆菌Lactobacillus kefiranofaciensXZ-54藏灵菇瑞士乳杆菌Lactobacillus helveticusTPY-40发酵驼乳瑞士乳杆菌Lactobacillus helveticusDYNDL-DCEH3发酵乳瑞士乳杆菌Lactobacillus helveticusDYNDL-SGEH2发酵乳嗜酸乳杆菌Lactobacillus acidophilusC44泡菜
MRS肉汤培养基、ROGOSA琼脂培养基、M17培养基和琼脂粉,海博生物技术有限公司;总抗氧化能力检测试剂盒,上海碧云天生物技术有限公司;邻苯二甲醛(O-phthalaldehyde,OPA)、丝氨酸、DPPH、ABTS,西格玛奥德里奇(上海)贸易有限公司;NaOH标准滴定溶液和酚酞指示剂,国药化学试剂有限公司。
1.2 仪器与设备
HVE-50高压蒸汽灭菌锅,日本HIRAYAMA公司;TA-XT plus质构分析仪,英国Stable Micro Systems公司;Spectramax M5酶标仪,美国Molecular Devices公司;Free Zone 12真空冷冻干燥机,美国LABCONCO公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 菌株的活化与培养
从-80 ℃冰箱取出菌株,按接种量3%接种到MRS肉汤培养基中,振荡摇匀后,在37 ℃下培养24 h,得到1代活化菌液,重复活化至3代备用。将活化至3代的菌液,离心(4 000 r/min,4 ℃,10 min)弃上清液,经无菌生理水洗涤2次后,制成菌悬液,4 ℃保藏备用。
1.3.2 菌株产酸能力测定
将活化好的菌株按1%的接种量接种于10%灭菌脱脂乳培养基中,32 ℃培养24 h,分别测定脱脂乳培养基的初始pH0和24 h脱脂乳的pH1,通过测定Δ pH=pH0-pH1,计算菌株的产酸能力。
1.3.3 菌株蛋白酶活力测定
将活化好的菌株按3%的接种量接种于灭菌的10%脱脂乳培养基中37 ℃培养24 h,离心(6 000 r/min,4 ℃,15 min),收集上清液过滤,即为蛋白酶液,参照国标GB/T 23527—2009《蛋白酶制剂》中福林法测定蛋白酶活力。
1.3.4 菌株蛋白水解度的测定
参考唐蓉等[13]的方法,利用OPA法测定菌株的蛋白水解度,对应标准曲线的丝氨酸浓度来表示OPA指数。将12株乳酸菌(lactic acid bacteria,LAB)的菌悬液按3%的接种量接种于灭菌后的10%灭菌脱脂乳中,37 ℃发酵24 h,取1 mL发酵样品与1 mL蒸馏水混匀后,加入2.5 mL 0.75 mol/L三氯乙酸溶液混匀,静置10 min后离心(4 ℃、6 000 r/min、10 min),留上清液备用。取400 μL上清液与3 mL的OPA试剂混匀,室温避光反应 2 min后,测定OD340值。丝氨酸标准曲线方程为:Y=0.006 1X+0.090 6(R2=0.993 7),X表示丝氨酸质量浓度(mg/L),Y表示340 nm处吸光度。
1.3.5 菌株抗氧化活性的测定
参考高利娥[14]的方法制备发酵上清液(fermentation supernatant, FS)和无细胞提取物(cell-free extract, CFE)。菌株总抗氧化能力的测定:DPPH法、FRAP法、ABST法参照试剂盒的方法。FRAP法测定总抗氧化能力,以FeSO4标准溶液浓度表示,所得标准曲线方程为:Y=0.204 3X+0.076 4(R2=0.990 4),X表示FeSO4浓度(mmol/mL),Y表示593 nm处吸光度;ABTS法以水溶性维生素E(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)作为标准品,样品的抗氧化能力用Trolox当量表示,所得标准曲线方程为:Y=-0.338 0X+0.714 4(R2=0.993 2),X表示Trolox质量浓度(mg/mL),Y表示405 nm处吸光度。
1.3.6 夸克奶酪制备工艺
夸克奶酪制备工艺如下:
新鲜牛乳→巴氏杀菌(60 ℃,30 min)→冷却至35 ℃→添加发酵剂0.01%(质量分数)和3%(体积分数)附属发酵剂→32 ℃发酵(发酵终点pH=4.6)→4 ℃吊带排乳清,控制奶酪的水分含量在70%~75%→4 ℃贮藏
夸克奶酪的保质期为3周,因此选取贮藏初期、中期、末期(1、11、21 d)的奶酪样品进行跟踪观察,空白对照组为不添加XZ-54的夸克奶酪,记为C,实验组为添加XZ-54的夸克奶酪,记为E。
1.3.7 奶酪理化指标的测定
蛋白含量测定参照GB 5009.5—2016《食品中蛋白质的测定》凯氏定氮法;脂肪含量测定参考GB5009.6—2016《食品中脂肪的测定》碱水解法;水分含量测定参考GB 5009.3—2016《食品中水分的测定》直接干燥法;灰分含量测定参照GB 5009.4—2016《食品中灰分的测定》直接干燥法;碳水化合物的测定采用减差法;钠含量测定参照GB 5009.91—2017《食品中钾、钠的测定》火焰原子发射光谱法;钙含量测定参照GB 5009.92—2016《食品中钙的测定》;奶酪的滴定酸度采用国家标准GB 5009.239—2016《食品酸度的测定》酚酞指示剂法进行测定。
1.3.8 奶酪活菌数的测定
取5 g奶酪样品与45 mL无菌水混合均匀,进行梯度稀释后,吸取100 μL菌液涂抹于M17培养基上,在32 ℃培养48 h计数乳酸乳球菌的活菌数;另吸取100 μL菌液在ROGOSA培养基上,37 ℃培养48 h计数马乳酒样乳杆菌XZ-54的活菌数。
1.3.9 奶酪质构的测定
从4 ℃冰箱中取冷藏1、11、21 d的夸克奶酪进行质构测试,测量模式为下压,每次平行不少于5次。质构仪参数设定如下:测量前探头下降速度1.0 mm/s;测试速度3.0 mm/s;测量后探头回程速度10 mm/s;测试距离20 mm;感应力0.5 g;探头类型P45C(5 mm的圆柱型挤压检测探头),测定数据采用Texture ExPonent32进行分析。
1.3.10 奶酪抗氧化活性的测定
1.3.10.1 干酪水溶性提取物(water-soluble extract, WSE)的制备
取10 g不同贮藏期的奶酪溶于30 mL去离子水中,分散机匀浆5 min,过滤撇去油脂层,离心(4 ℃,8 000 r/min,20 min)取上清液,上清液通过0.22 μm的水系滤膜过滤,滤液冷冻干燥后,在-80 ℃贮存备用。
1.3.10.2 DPPH自由基清除率的测定
参考L PEZ-VILLAFA
PEZ-VILLAFA A等[15]的方法,并略作调整,取0.1 mL WSE(20 mg/mL)水溶液与3.9 mL新鲜配制的DPPH 乙醇溶液(60 μmol/L)混合,室温避光放置60 min,测定517 nm处的吸光度,去离子水作为空白对照组。DPPH自由基清除率按公式(1)计算:
A等[15]的方法,并略作调整,取0.1 mL WSE(20 mg/mL)水溶液与3.9 mL新鲜配制的DPPH 乙醇溶液(60 μmol/L)混合,室温避光放置60 min,测定517 nm处的吸光度,去离子水作为空白对照组。DPPH自由基清除率按公式(1)计算:
(1)
式中:Y,样品的DPPH自由基清除率,%;As,样品组的吸光度;Ac,空白组的吸光度。
1.3.10.3 ABTS阳离子自由基清除率的测定
参照YANG等[16]的方法,将 20 μL WSE(20 mg/mL)与180 μL的ABTS混合,暗处反应6 min,测定734 nm处吸光值,去离子水作为空白对照组。ABTS阳离子自由基清除率按公式(2)计算:
(2)
式中:Y,样品的ABTS阳离子自由基清除率,%;Ae,样品组的吸光度;Ac,空白组的吸光度。
1.3.10.4 羟自由基清除率的测定
参照李宁宁等[17]的水杨酸法测定,并略作修改,试管中依次加入100 μL 10 mmol/L水杨酸-乙醇、100 μL 10 mmol/L七水硫酸亚铁溶液,再加入100 μL WSE(20 mg/mL)、1.5 mL蒸馏水,最后加入100 μL 10 mmol/L H2O2启动反应,混匀后37 ℃水浴加热30 min,测定510 nm处吸光度,羟自由基清除率按公式(3)计算:
(3)
式中:Z,样品羟自由基清除率,%;Ai,样品组的吸光度;A0,去离子水代替样品的的吸光度;Aj,离子水替代体系中H2O2溶液的吸光度。
1.4 数据分析
所有实验均重复测定3次及以上,使用IBM SPSS Statistics 26对数据进行方差及ANOVA差异显著分析,结果以![]() 表示,P<0.05代表差异显著,P>0.05代表差异不显著。使用Origin Pro 2023进行主成分分析(principal component analysis, PCA),并绘图。
表示,P<0.05代表差异显著,P>0.05代表差异不显著。使用Origin Pro 2023进行主成分分析(principal component analysis, PCA),并绘图。
2 结果与分析
2.1 菌株筛选结果
2.1.1 菌株产酸能力
夸克奶酪生产过程中主要依靠发酵剂产酸进行,因此筛选的附属发酵剂菌株产酸能力不能太强,防止酸化过度,影响奶酪感官特性[18]。12株乳酸菌的产酸能力如图1所示,所有待选菌株24 h内ΔpH值均有显著差异(P<0.05),产酸能力较低的有马乳酒样乳杆菌XZ-54、瑞士乳杆菌H2和类干酪乳酪乳杆菌MJR5。
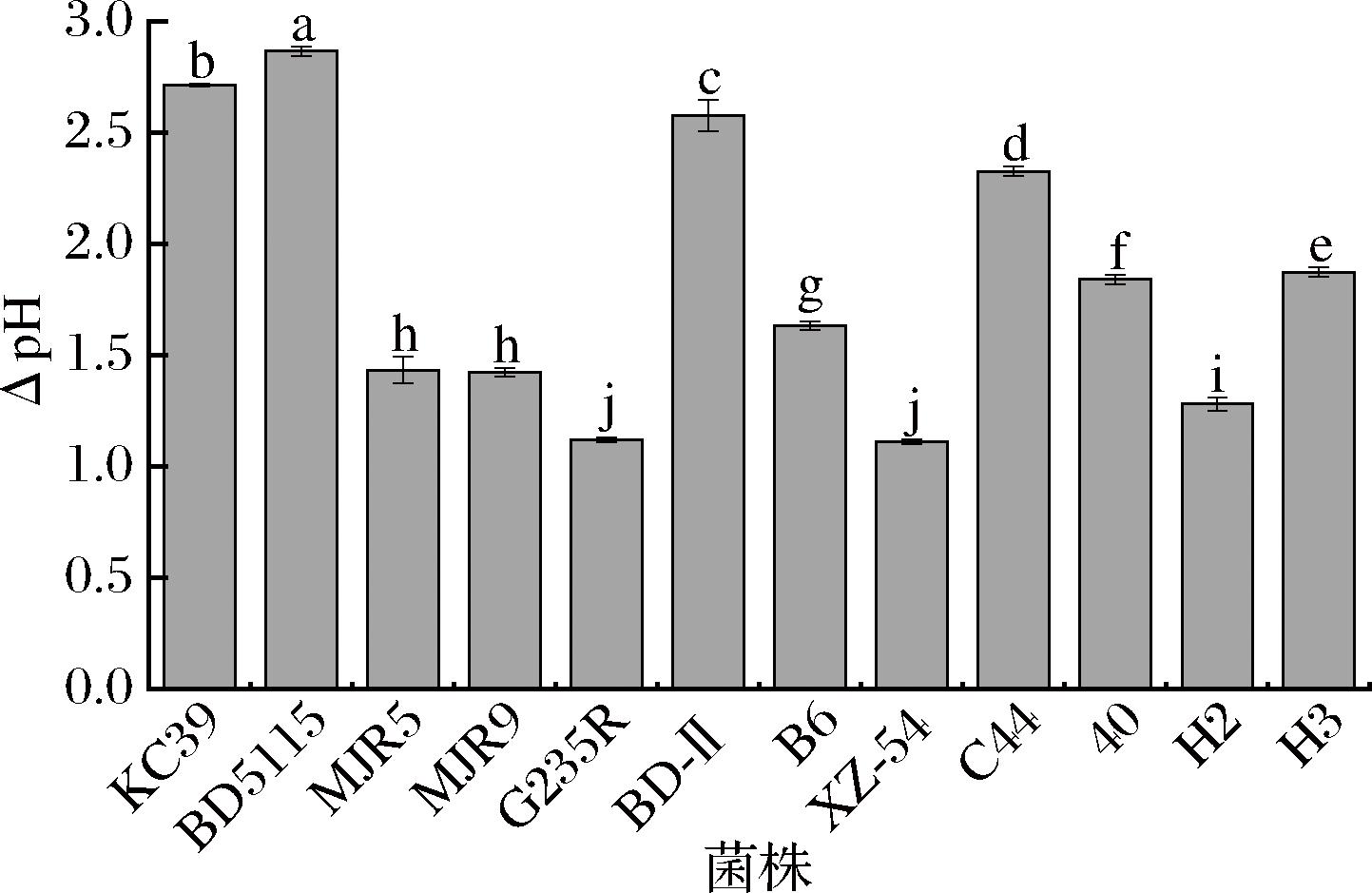
图1 十二株乳酸菌的产酸能力
Fig.1 The acid production capacity of 12 LAB strains
注:不同小写字母代表存在显著差异(P<0.05)(下同)。
2.1.2 菌株蛋白酶活力
菌株的高活性蛋白酶可以有效水解牛奶中的蛋白质,产生各种活性肽,赋予奶酪更高的营养价值。由图2可知,12株乳酸菌的蛋白酶活力存在显著差异(P<0.05),其中马乳酒样乳杆菌XZ-54的蛋白酶活力最大,高达(51.36±2.19) U/mL,显著高于其余11株乳酸杆菌。
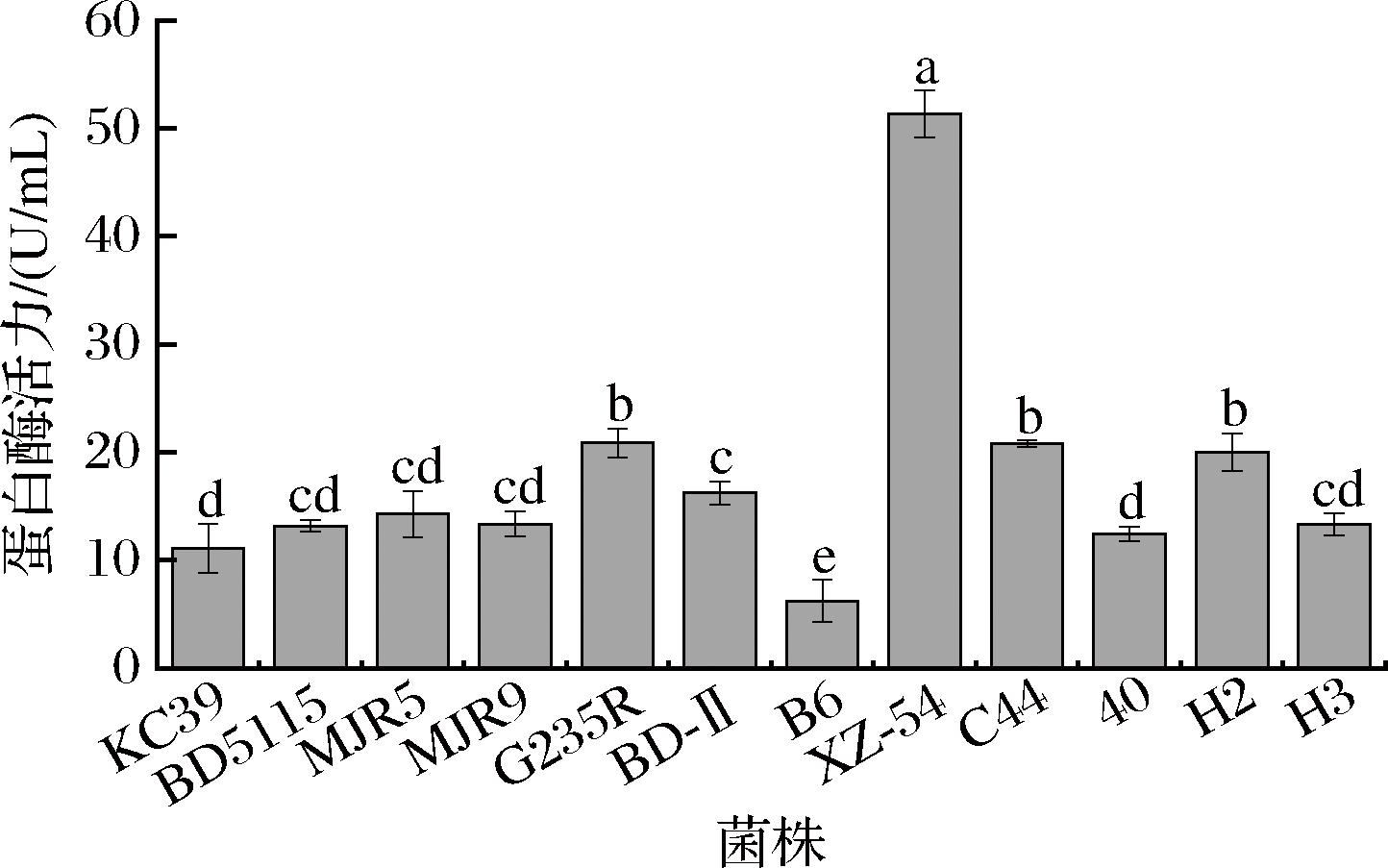
图2 十二株乳酸菌的蛋白酶活力
Fig.2 The protease activity of 12 LAB strains
2.1.3 菌株蛋白水解能力
蛋白水解能力强弱直接影响蛋白质水解后释放多肽、游离氨基酸的程度[19]。本实验考察了12株菌株的蛋白水解能力,结果如图3所示。12株待选菌株的蛋白水解能力存在显著性差异(P<0.05),其中蛋白水解能力较强的菌株有马乳酒样乳杆菌XZ-54、类干酪乳酪乳杆菌G235R和嗜酸乳杆菌C44,水解度依次为44.33、35.01、33.02 mg/mL。
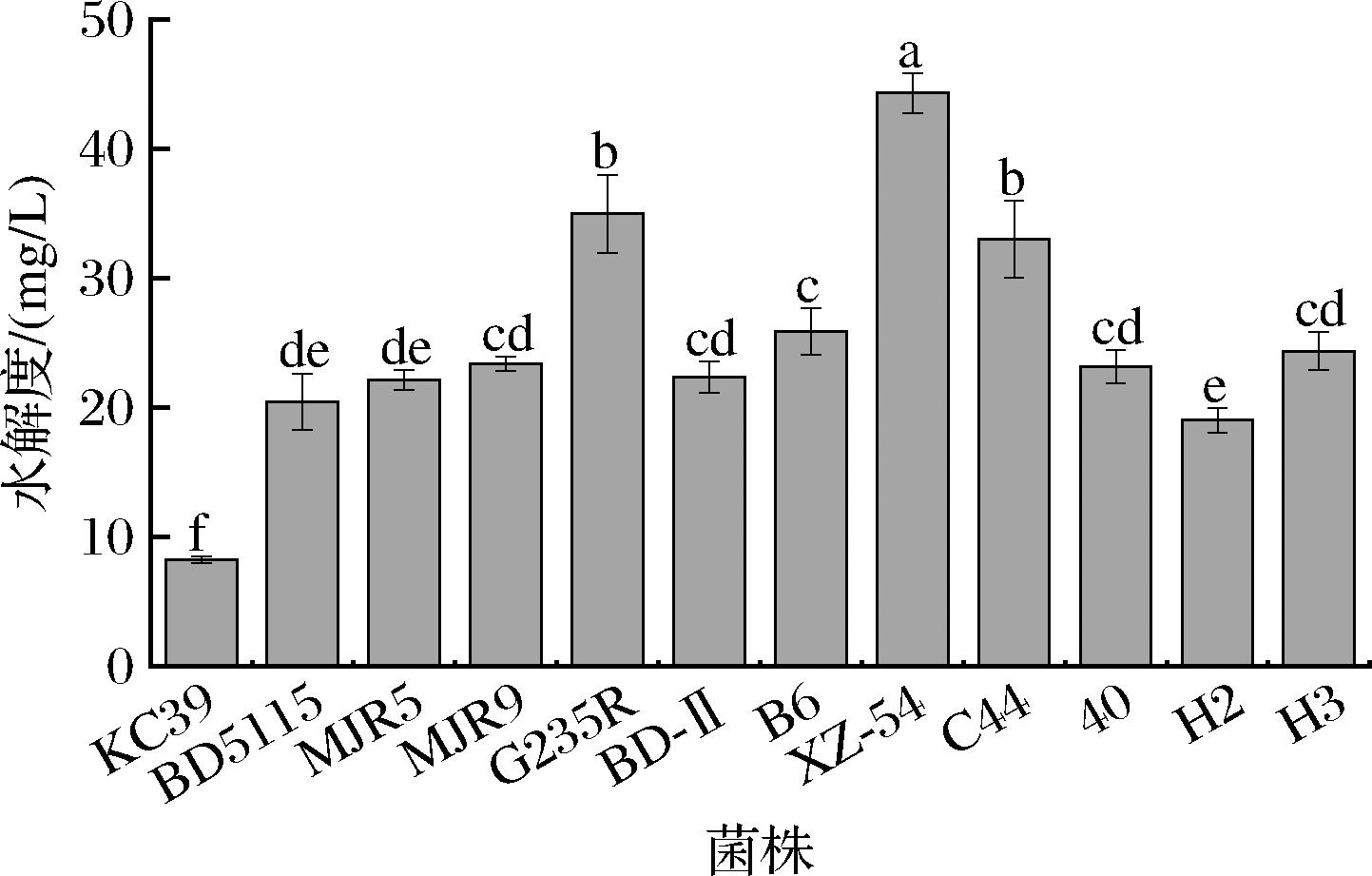
图3 十二株乳酸菌的水解度
Fig.3 The proteolytic activities of 12 LAB strains
2.1.4 菌株抗氧化能力
由表2可知,12株菌的抗氧化能力存在显著差异(P<0.05),且大部分组中FS的总抗氧化能力显著高于CFE的,与陈漪汶等[20]的研究结果一致。同时观察到在ABTS法、DPPH法和FRAP法下,菌株的抗氧化特性强弱不同。具体地,类干酪乳酪乳杆菌BD5115的FS和CFE在ABTS法中抗氧化特性最弱,而在FRAP法中抗氧化特性显示最强;类干酪乳酪乳杆菌GR35R的FS在ABTS法和DPPH法中抗氧化能力较强,在FRAP中抗氧化能力最弱。但是在3种测定方法下,马乳酒样乳杆菌XZ-54的FS和CFE的抗氧化能力均最强,且CFE的抗氧化性均显著高于FS,表明菌株的DPPH、ABTS阳离子自由基清除能力主要来自于其代谢产物而非胞内物质,王小鹏等[21]也得类似结论,并推测这与菌体分泌的胞外多糖以及各种氧化酶类代谢产物有关。不同菌株之间抗氧化活性的差异,可能是因为不同菌株代谢产生的抗氧化种类或含量物质不同导致[22]。
表2 十二株乳酸菌抗氧化能力
Table 2 Antioxidant activity of 12 LAB strains

菌株ABTS法DPPH法FRAP法FS/(Trolox mmol/L)CFE/(Trolox mmol/g)FS/%(DPPH自由基清除率)CFE/%(DPPH自由基清除率)FS/(FeSO4 mmol/L)CFE/(FeSO4 mmol/g)KC391.58±0.09Ca1.26±0.02Bb51.02±2.43Ca30.33±1.53Cb2.70±0.08Da1.50±0.03CDbBD51151.05±0.09Ea0.56±0.04Eb31.10±1.00Fa10.67±2.08EFb4.15±0.15Aa1.91±0.01AbMJR51.25±0.05Da0.87±0.04Db36.13±2.65Ea14.67±0.58Db3.25±0.13Ba1.78±0.02BbMJR91.07±0.03Ea1.11±0.03Ca36.20±2.01Ea11.01±1.11EFb1.65±0.05Ha1.54±0.02CDbG235R1.66±0.11Ba1.25±0.04Bb57.33±2.52Ba42.33±1.53Bb1.76±0.06GHa1.47±0.06DbBD-Ⅱ1.59±0.05Ca1.12±0.03Cb52.67±1.53Ca31.67±1.53Cb1.84±0.04Ga1.34±0.04EbB61.26±0.38Da1.11±0.05Ca41.00±1.13Da32.33±3.06Cb2.31±0.04Ea1.59±0.09CbXZ-542.96±0.32Aa1.84±0.04Ab66.67±1.53Aa48.67±3.51Ab4.18±0.08Aa1.92±0.11AbC441.85±0.10Ba1.25±0.04Bb56.67±1.53Ba41.00±2.65Bb3.03±0.07Ca1.60±0.02Cb401.27±0.01Da1.26±0.01Ba42.33±2.08Da31.33±2.08Cb4.04±0.08Aa1.57±0.07CDbH21.04±0.01Eb1.11±0.04Ca36.67±1.16Ea8.13±1.21Gb2.10±0.11Fa1.25±0.06EbH31.26±0.06Da1.12±0.04Cb42.33±1.53Da14.12±3.61Db2.57±0.15Da1.53±0.03CDb
注:同列不同大写字母代表菌株抗氧化活性存在显著差异,同行不同小写字母代表发酵上清液和无细胞提取物抗氧化活性存在显著差异(P<0.05)。
2.1.5 PCA法综合筛选附属发酵剂
本文利用PCA法综合评价乳酸菌的基本特性与抗氧化能力,以菌株的产酸能力、蛋白酶活力、蛋白水解度和3种抗氧化活性为指标进行主成分分析,筛选具有潜在提高奶酪抗氧化活性的附属发酵剂。结果如图4所示,所有样本均分布在95%的置信区间,能够解释大部分变量,马乳酒样乳杆菌XZ-54产酸能力较弱、蛋白酶活性、蛋白水解度和抗氧化能力较强,与上文的研究结果一致。因此,综合几种因素考虑,12株乳酸杆菌中XZ-54比较适合用于添加到夸克奶酪中作为附属发酵剂用于后续实验。
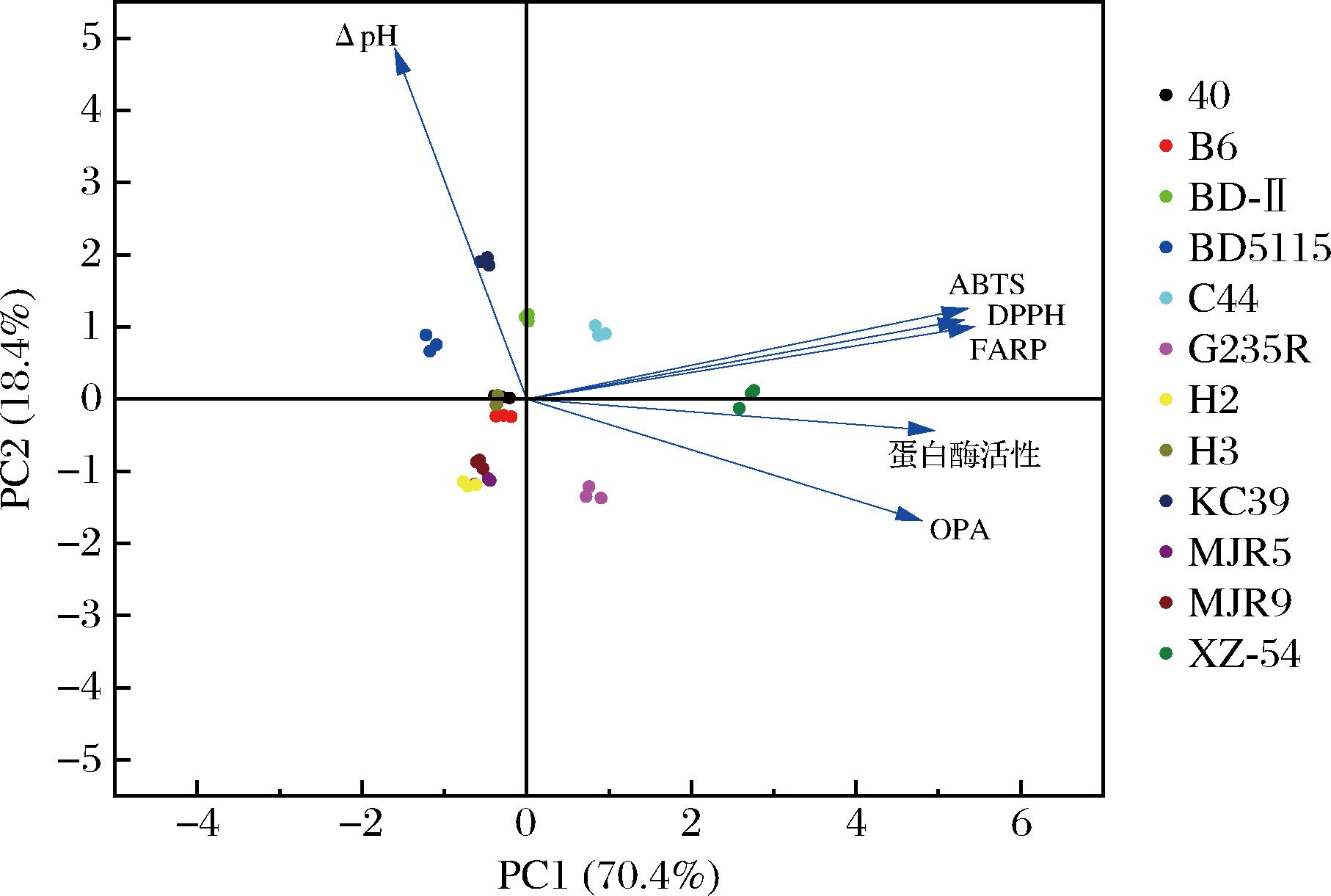
图4 主成分分析法筛选潜在附属发酵剂的双标图
Fig.4 The biplot of screening the potential adjunct culture by the principal component analysis
2.2 菌株对奶酪品质的影响
2.2.1 理化特性
将筛选得到的马乳酒样乳杆菌XZ-54作为附属发酵剂进行夸克奶酪制备,奶酪的理化指标如表3所示。E组与空白对照C组的理化指标未观察到显著差异(P>0.05),并且干物质中的脂肪含量和水分含量均符合GB 5420—2021《食品安全国家标准干酪》规定。表明添加马乳酒样乳杆菌XZ-54对夸克奶酪的理化指标不产生显著影响。
表3 奶酪的理化检测
Table 3 Physicochemical detection of quark cheese
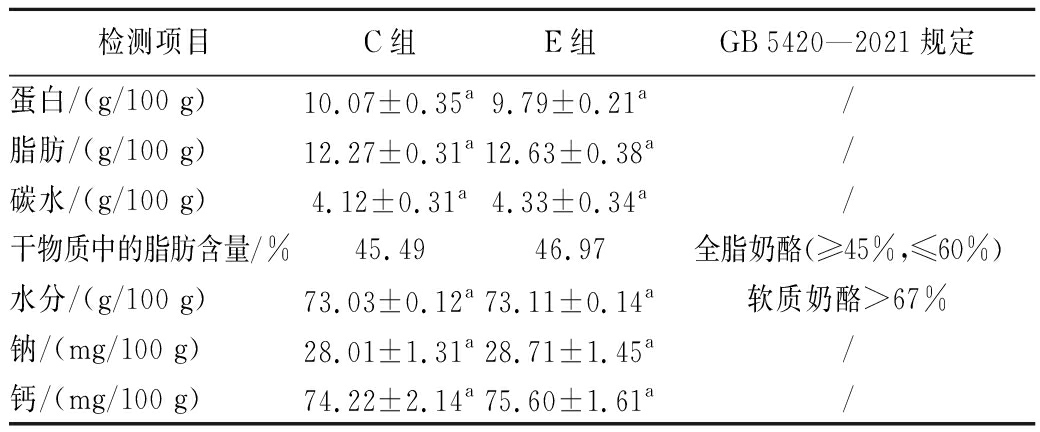
检测项目C组E组GB 5420—2021规定蛋白/(g/100 g)10.07±0.35a9.79±0.21a/脂肪/(g/100 g)12.27±0.31a12.63±0.38a/碳水/(g/100 g)4.12±0.31a4.33±0.34a/干物质中的脂肪含量/%45.4946.97全脂奶酪(≥45%,≤60%)水分/(g/100 g)73.03±0.12a73.11±0.14a软质奶酪>67%钠/(mg/100 g)28.01±1.31a28.71±1.45a/钙/(mg/100 g)74.22±2.14a75.60±1.61a/
注:同行不同小写字母代表差异显著(P<0.05)。
2.2.2 滴定酸度
贮藏期间夸克奶酪的滴定酸度的变化如表4所示,随贮存时间的延长,两组奶酪的滴定酸度显著降低(P<0.05),且同一贮藏期,E组奶酪的滴定酸度均显著高于C组,说明附属发酵剂XZ-54的添加会提高奶酪的酸度,王维哲等[23]在羊乳发酵乳制品中也得到类似的结论,添加植物乳杆菌作为附属发酵剂的酸乳滴定酸度显著高于对照组。滴定酸度的差异可能是由奶酪中乳酸菌活性不同造成的,在贮藏期间乳酸菌持续分解奶酪中的乳糖和脂肪酸,产生乳酸和脂肪酸,从而使奶酪的滴定酸度降低[24]。
表4 不同贮藏期奶酪的滴定酸度变化
Table 4 Changes in the titration acidity of quark cheese during storage

贮藏时间/dC组E组168.13±0.35Cb71.56±0.38Ca1180.03±0.55Bb85.20±0.38Ba2182.70±0.66Ab88.10±0.61Aa
注:同列不同大写字母代表在不同贮藏期样品滴定酸度存在显著差异,同行不同小写字母代表同一贮藏期样品间滴定酸度存在显著差异(P<0.05)。
2.2.3 微生物情况
为观察发酵剂和附属发酵剂在奶酪贮藏期间的存活情况,对乳酸乳球菌和马乳酒样乳杆菌XZ-54进行平板计数,结果如表5所示。两组奶酪中乳酸乳球菌和XZ-54的活菌数在21 d贮藏期内均呈下降趋势,并且在贮藏初期E组乳酸乳球菌活菌数显著低于C组(P<0.05),这说明在贮藏初期附属发酵剂XZ-54会抑制发酵剂菌株的生长,与LI等[25]在哈萨克奶酪中的研究结果一致。贮藏期内奶酪中乳酸菌活菌数持续降低,可能是由于奶酪贮藏期间乳糖降解导致酸度增加,从而抑制乳酸菌的生长,并且随贮藏时间延长,奶酪中营养物质被消耗,乳酸菌可利用的碳源减少,生存受限[26]。
表5 不同贮藏期奶酪中乳酸菌数量的变化
Table 5 Changes in the number of lactic acid bacteria on in quark cheese during storage
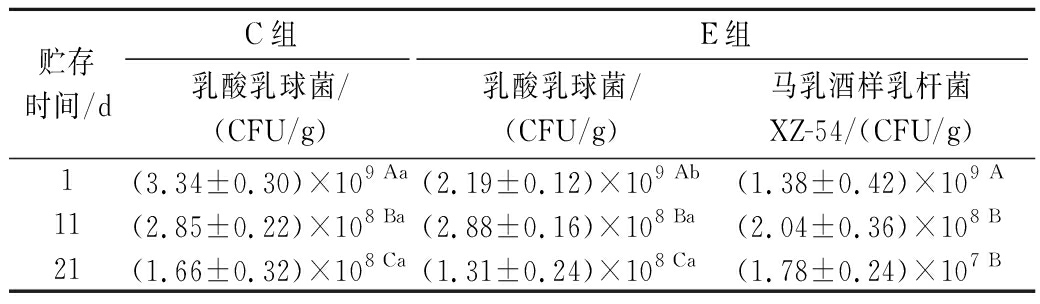
贮存时间/dC组E组乳酸乳球菌/(CFU/g)乳酸乳球菌/(CFU/g)马乳酒样乳杆菌XZ-54/(CFU/g)1(3.34±0.30)×109 Aa(2.19±0.12)×109 Ab(1.38±0.42)×109 A11(2.85±0.22)×108 Ba(2.88±0.16)×108 Ba(2.04±0.36)×108 B21(1.66±0.32)×108 Ca(1.31±0.24)×108 Ca(1.78±0.24)×107 B
注:同行不同小写字母代表同一时期样品中活菌数存在显著差异,同列不同大写字母代表不同时期样品中活菌数存在显著差异(P<0.05)。
2.2.4 质构特征
为考察添加马乳酒样乳杆菌XZ-54对夸克奶酪质构的影响,测定奶酪贮藏期内硬度、涂抹功、黏性、黏附功的变化,结果如表6所示。在贮藏中期两组奶酪的硬度、涂抹功和黏性均显著高于贮藏初期和末期,而黏附功仅在贮藏中后期有显著差异(P<0.05)。与空白对照C组相比,添加XZ-54的E组黏性和黏附功显著降低,其余质构指标在两组之间不存在显著差异。这表明添加附属发酵剂XZ-54对奶酪的硬度和涂抹性没有显著影响,但是会降低奶酪的黏性。贮藏中期奶酪的硬度、涂抹功、黏性较大的可能与贮藏过程中水分蒸发和脂肪氧化有关,增强了体系内蛋白、脂肪和碳水化合物之间的相互作用[27]。而贮藏中后期奶酪的硬度、涂抹功、黏性降低是因为蛋白质逐渐水解,酪蛋白胶束交联度降低,蛋白网络结构强度及刚性下降导致[28]。
表6 不同贮藏期奶酪的质构特征
Table 6 Texture characteristics of quark cheese during storage
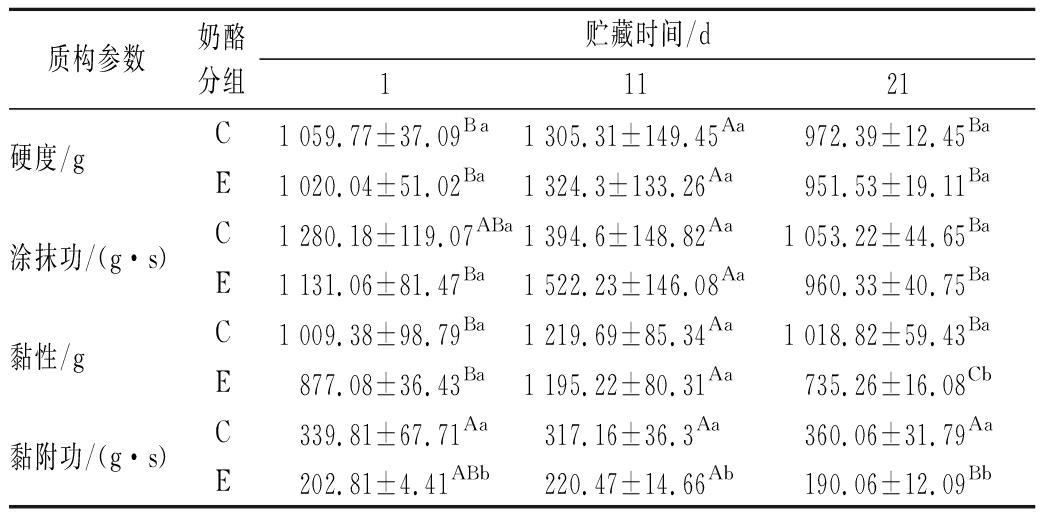
质构参数奶酪分组贮藏时间/d11121硬度/gC1 059.77±37.09Ba1 305.31±149.45Aa972.39±12.45BaE1 020.04±51.02Ba1 324.3±133.26Aa951.53±19.11Ba涂抹功/(g·s)C1 280.18±119.07ABa1 394.6±148.82Aa1 053.22±44.65BaE1 131.06±81.47Ba1 522.23±146.08Aa960.33±40.75Ba黏性/gC1 009.38±98.79Ba1 219.69±85.34Aa1 018.82±59.43BaE877.08±36.43Ba1 195.22±80.31Aa735.26±16.08Cb黏附功/(g·s)C339.81±67.71Aa317.16±36.3Aa360.06±31.79AaE202.81±4.41ABb220.47±14.66Ab190.06±12.09Bb
注:同行不同大写字母代表奶酪在不同贮藏期质构存在显著差异;同列不同小写字母表示奶酪在同一贮藏期质构存在显著差异(P<0.05)。
2.2.5 抗氧化特性
为测定马乳酒样乳杆菌XZ-54添加对奶酪抗氧化特性的影响,本实验测定1、11、21 d奶酪DPPH自由基、ABTS阳离子自由基和羟自由基清除率变化,结果如表7所示。两组夸克奶酪在贮藏中期的DPPH自由基和ABTS阳离子自由基清除率均显著高于贮藏初期和末期(P<0.05),而羟自由基清除率则是贮藏末期>贮藏中期>贮藏初期。在同一贮藏期内,E组的DPPH自由基和羟自由基清除能力均显著强于空白对照C组,而ABTS阳离子自由基清除率仅在贮藏中期两组存在显著差异。BANIASADI等[29]在开菲尔和酸奶样品中也观察到类似现象,4 ℃冷藏期间样品的DPPH和ABTS阳离子自由基清除能力均有所提高;KOCAK等[30]利用不同附属发酵剂(干酪乳杆菌、植物乳杆菌和保加利亚乳杆菌)混合商业发酵剂制备山羊奶腌制奶酪,也发现奶酪贮藏中后期DPPH自由基清除能力最强,且添加附属发酵剂的奶酪DPPH自由基清除率显著高于空白对照(P<0.05)。
表7 贮藏期奶酪抗氧化指标的测定 单位:%
Table 7 Determination of antioxidant activity of quark cheese during storage

贮存时间/dDPPH自由基清除率ABTS阳离子自由基清除率羟自由基清除率CECECE162.30±0.26Bb65.34±0.32Ba38.27±0.64Ba40.83±0.76Ba78.37±0.55Cb85.73±0.64Ca1164.02±0.33Ab66.77±0.36Aa41.47±0.50Ab45.12±1.12Aa80.50±0.50Bb87.46±0.42Ba2159.46±0.29Cb65.26± 0.23Ba38.67±0.71Ba39.83±0.76Ca83.83±0.66Ab90.33±0.57Aa
注:同列不同大写字母代表奶酪在不同贮藏期存在显著差异;同行不同小写字母表示奶酪同一贮藏期存在显著差异(P<0.05)。
以上实验结果表明,筛选到的附属发酵剂XZ-54可以显著提升夸克奶酪贮藏期的抗氧化活性,这可能与XZ-54较高的蛋白水解度和蛋白酶活性有关,TAGLIAZUCCHI等[31]也有类似的结论,在发酵乳制品中微生物通过水解蛋白产生一些具有抗氧化活性的小分子肽和氨基酸,进而增加乳制品的抗氧化潜力。而同组样品在不同贮藏期间抗氧化能力的差异可能是由奶酪中微生物活力不同造成的,贮藏前期具有抗氧化能力的乳酸菌活力较高,能产生丰富的抗氧化代谢物,而随贮藏期延长,奶酪体系酸度升高,菌株的活性受到抑制,从而影响奶酪整体的抗氧化特性[32]。不同抗氧化指标之间的关联度较低,是因为DPPH自由基、APTS阳离子自由基和羟自由基产生的途径不同,抗氧化剂清除这些自由基的机制也不同,在多种抗氧化物质综合作用下,不同抗氧化指标的结果存在差异[33]。
3 结论
本研究从12株乳酸菌中筛选出一株产酸能力弱,蛋白酶、蛋白水解活性和抗氧化活性突出的马乳酒样乳杆菌XZ-54,将其与商业发酵剂进行复配制备夸克奶酪,对奶酪的理化指标、滴定酸度、发酵菌株的活菌数、质构特征和抗氧化特性进行分析,结果显示,XZ-54的添加对夸克奶酪理化无显著影响,在贮藏末期奶酪的硬度和黏性均能与贮藏初期的接近,但会显著减低奶酪的滴定酸度。随贮藏时间延长,两组奶酪中发酵剂菌株和XZ-54的活菌数都有显著降低,但在贮藏末期,XZ-54的活菌数仍能维持在107 CFU/g以上。此外,XZ-54的添加可以显著提升奶酪的DPPH自由基、ABTS阳离子自由基和羟自由基清除率。以上结果表明,马乳酒样乳杆菌XZ-54是一株优良的附属发酵剂菌株,作为附属发酵剂应用于夸克奶酪,能有效改善奶酪的抗氧化特性,其开发与应用前景广阔。
[1] CHOURASIA R, ABEDIN M M, CHIRING PHUKON L, et al.Biotechnological approaches for the production of designer cheese with improved functionality[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):960-979.
[2] ANDRADE R P, OLIVEIRA D R, LOPES A C A, et al.Survival of Kluyveromyces lactis and Torulaspora delbrueckii to simulated gastrointestinal conditions and their use as single and mixed inoculum for cheese production[J].Food Research International, 2019, 125:108620.
[3] HAO X Y, XIA Y, WANG Y X, et al.The addition of probiotic promotes the release of ACE-I peptide of Cheddar cheese:Peptide profile and molecular docking[J].International Dairy Journal, 2023, 137:105507.
[4] MUSHTAQ M, GANI A, MASOODI F A.Himalayan cheese (Kalari/Kradi) fermented with different probiotic strains:In vitro investigation of nutraceutical properties[J].LWT, 2019, 104:53-60.
[5] YOUSEFI L, DOVOM M R E, NAJAFI M B H, et al.Antioxidant activity of ultrafiltered-Feta cheese made with adjunct culture during ripening[J].Journal of Food Measurement and Characterization, 2021, 15(5):4336-4342.
[6] DIFONZO G, ANTONINO C, SQUEO G, et al.Application of agri-food by-products in cheesemaking[J].Antioxidants, 2023, 12(3):660.
[7] AKAN E, YERLIKAYA O, AKPINAR A, et al.The effect of various herbs and packaging material on antioxidant activity and colour parameters of whey (Lor) cheese[J].International Journal of Dairy Technology, 2021, 74(3):554-563.
[8] SHELKE G N, KAD V P, YENGE G B, et al.Physicochemical attributes, antioxidant activity, and sensory responses of low-fat cheese supplemented with spray-dried Jamun juice (Syzygium cumini L.) powder[J].Frontiers in Sustainable Food Systems, 2023, 7:1243477.
[9] HOMAYOUNI A, ANSARI F, AZIZI A, et al.Cheese as a potential food carrier to deliver probiotic microorganisms into the human gut:A review[J].Current Nutrition &Food Science, 2020, 16(1):15-28.
[10] OZTURKOGLU-BUDAK S, AKAL H C, TÜRKMEN N.Use of kefir and buttermilk to produce an innovative quark cheese[J].Journal of Food Science and Technology, 2021, 58(1):74-84.
[11] GUNESER O.Characterization of Quark-like probiotic cheese produced from a mixture of buffalo milk and cow milk[J].Mljekarstvo, 2022, 72(3):172-188.
[12] SONG X Y, ZHENG Y R, ZHOU X F, et al.Quark cheese processed by dense-phase carbon dioxide:Shelf-life evaluation and physiochemical, rheological, microstructural and volatile properties assessment[J].Foods, 2022, 11(15):2340.
[13] 唐蓉, 王康, 郭元晟, 等.酵母菌与乳酸菌发酵马乳产ACE抑制肽[J].食品科学, 2022, 43(6):236-245.TANG R, WANG K, GUO Y S, et al.Optimized co-fermentation of horse milk by yeast and lactic acid bacteria to produce angiotensin converting enzyme-inhibiting peptides[J].Food Science, 2022, 43(6):236-245.
[14] 高利娥. 青藏高原传统发酵牦牛乳中乳酸菌的多样性及抗氧化特性研究[D].兰州:兰州大学, 2020.GAO L E.Biodiversity and antioxidant properties of lactic acid bacteria from spontaneously fermented yak milk in the Qinghai-Tibet Plateau[D].Lanzhou:Lanzhou University, 2020.
[15] L PEZ-VILLAFA
PEZ-VILLAFA A B P, ROJAS-GONZ
A B P, ROJAS-GONZ LEZ S, EL
LEZ S, EL AS-ROM
AS-ROM N R D, et al.The evolution of antioxidative properties of protein-derived peptides of Mexican Panela goat and cow milk cheese during its shelf life[J].CyTA-Journal of Food, 2023, 21(1):57-63.
N R D, et al.The evolution of antioxidative properties of protein-derived peptides of Mexican Panela goat and cow milk cheese during its shelf life[J].CyTA-Journal of Food, 2023, 21(1):57-63.
[16] YANG W S, HAO X Y, ZHANG X X, et al.Identification of antioxidant peptides from cheddar cheese made with Lactobacillus helveticus[J].LWT, 2021, 141:110866.
[17] 李宁宁, 王正荣, 孙春晓, 等.牛蒡多糖对发酵乳品质和抗氧化性的影响[J].食品与发酵工业, 2019, 45(10):97-103.LI N N, WANG Z R, SUN C X, et al.Burdock polysaccharides enhanced the quality and antioxidative activity of fermented milk[J].Food and Fermentation Industries, 2019, 45(10):97-103.
[18] SEYED-MOSLEMI S A, HESARI J, PEIGHAMBARDOUST S H, et al.Effect of microbial lipase and transglutaminase on the textural, physicochemical, and microbial parameters of fresh quark cheese[J].Journal of Dairy Science, 2021, 104(7):7489-7499.
[19] FUGLSANG A, RATTRAY F P, NILSSON D, et al.Lactic acid bacteria:Inhibition of angiotensin converting enzyme in vitro and in vivo[J].Antonie Van Leeuwenhoek, 2003, 83(1):27-34.
[20] 陈漪汶, 方若楠, 朱剑锋, 等.5种乳酸菌及其灭活态体外抗氧化能力的比较研究[J].食品工业科技, 2019, 40(11):85-90;97.CHEN Y W, FANG R N, ZHU J F, et al.Comparative studies on antioxidant activity in vitro of five species of active and inactived lactic acid bacterial[J].Science and Technology of Food Industry.2019, 40(11):85-90;97.
[21] 王小鹏, 闫爽, 高亚欣, 等.人源乳酸菌的筛选鉴定及抗氧化活性研究[J].中国乳品工业, 2022, 50(6):16-21;64.WANG X P, YAN S, GAO Y X, et al.Identification and antioxidant analysis of Lactobacillus from elder people intestine[J].China Dairy Industry, 2022, 50(6):16-21;64.
[22] KHUBBER S, MARTI-QUIJAL F J, TOMASEVIC I, et al.Lactic acid fermentation as a useful strategy to recover antimicrobial and antioxidant compounds from food and by-products[J].Current Opinion in Food Science, 2022, 43:189-198.
[23] 王维哲, 任荣, 惠媛媛, 等.自主筛选的植物乳杆菌对酸羊乳品质与功能特性的影响[J].乳业科学与技术, 2022, 45(3):1-8.WANG W Z, REN R, HUI Y Y, et al.Effects of Lactobacillus plantarum isolated in our laboratory on the quality and functional properties of goat milk yogurt[J].Journal of Dairy Science and Technology, 2022, 45(3):1-8.
[24] ESEN M K, GÜZELER N.The effects of the use of whey protein as a fat replacer on the composition, proteolysis, textural, meltability, microstructural, and sensory properties of reduced-fat Boru-type Künefe cheese during storage[J].International Dairy Journal, 2023, 137:105519.
[25] LI S, LI Y D, DU Z X, et al.Impact of NSLAB on Kazakh cheese flavor[J].Food Research International, 2021, 144:110315.
[26] 杨阳, 郭帅, 武婷, 等.益生菌在发酵乳中的氨基酸代谢特征、发酵特性和贮藏特性[J].中国食品学报, 2023, 23(7):45-55.YANG Y, GUO S, WU T, et al.Amino acid metabolism, fermentation, and storage characteristics of probiotics in fermented milk[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(7):45-55.
[27] 陈斗艺, 邱晓敏, 林美云, 等.大豆-坚果奶酪类似物的制备及其性质研究[J/OL].现代食品科技, 2023.https://doi.org/10.13982/j.mfst.1673-9078.2024.4.0430.CHEN D Y, QIU X M, LIN M Y, et al.Preparation and properties of soybean-nut cheese analogues[J/OL].Modern Food Science and Technology, 2023.https://doi.org/10.13982/j.mfst.1673-9078.2024.4.0430.
[28] 贾丽丽, 王家栩, 李嘉欣, 等.牛羊乳比例对Malatya干酪成熟品质及抗氧化特性的影响[J].食品科学, 2023, 44(22):64-73.JIA L L, WANG J X, LI J X, et al.Effect of cow to goat milk ratio on ripening quality and antioxidant characteristics of Malatya cheese[J].Food Science, 2023, 44(22):64-73.
[29] BANIASADI M, AZIZKHANI M, SARIS P E J, et al.Comparative antioxidant potential of kefir and yogurt of bovine and non-bovine origins[J].Journal of Food Science and Technology, 2022, 59(4):1307-1316.
[30] KOCAK A, SANLI T B, ANLI E A, et al.Role of using adjunct cultures in release of bioactive peptides in white-brined goat-milk cheese[J].LWT, 2020, 123:109127.
[31] TAGLIAZUCCHI D, MARTINI S, SOLIERI L.Bioprospecting for bioactive peptide production by lactic acid bacteria isolated from fermented dairy food[J].Fermentation, 2019, 5(4):96.
[32] POURRAJAB B, FATAHI S, SOHOULI M H, et al.The effects of probiotic/synbiotic supplementation compared to placebo on biomarkers of oxidative stress in adults:A systematic review and meta-analysis of randomized controlled trials[J].Critical Reviews in Food Science and Nutrition, 2022, 62(2):490-507.
[33] GULCIN ![]() and antioxidant methods:An updated overview[J].Archives of Toxicology, 2020, 94(3):651-715.
and antioxidant methods:An updated overview[J].Archives of Toxicology, 2020, 94(3):651-715.