星康吉鳗(Conger myriaster)又称沙鳗、星鳗、繁星糯鳗等,广泛分布于中国黄海、渤海、东海海域以及日本本州沿岸和朝鲜半岛沿岸[1],是国内外经济价值较高的海洋鱼类之一[2]。星康吉鳗肉质细嫩、味道鲜美,富含优质蛋白质和脂质(如二十碳五烯酸、二十二碳六烯酸等不饱和脂肪酸)[3],可以预防心血管疾病,降低胆固醇含量,具有极高的营养价值和保健功效[4-5]。但星康吉鳗死亡后会在肌肉内源酶和环境等内外因素的作用下腐败变质[6],其中,脂质氧化是主导品质降低的重要原因之一。
新鲜星康吉鳗中脂质含量约为20%~30%,是普通鱼类的7~20倍[5,7]。星康吉鳗死亡后,分子氧、活性氮和多种自由基通过自由基链反应诱导肌肉组织中的脂质氧化,形成胆固醇和丙二醛等氧化产物[8],极大影响了星康吉鳗的食用安全性。冷冻贮藏是延缓鱼肉品质劣变的常用方法,不仅能抑制内源酶活性和微生物生长繁殖,延长保质期,还可以最大程度保留鱼类原有的风味质地。通常情况下,较低的冻藏温度能更好地维持水产品冻藏品质。JIANG等[9]基于不同冻藏温度对金枪鱼品质及氧化稳定性影响的研究发现,与-20 ℃和-30 ℃相比,-40 ℃的冻藏温度可有效抑制鱼肉色差变化,保持肌肉的持水能力和质构特性。WANG等[10]的研究也表明,与-18 ℃相比,-55 ℃对蓝鳍金枪鱼肌肉持水能力和理化性质的影响更小。然而,目前对星康吉鳗冻藏过程中品质变化的相关研究有限,尚不清楚不同冻藏温度对鱼肉脂质氧化和理化特性的具体影响及品质变化规律。因此,探究常规冻藏和超低温冻藏条件对星康吉鳗脂肪氧化的影响成为其品质控制的关键。
目前,研究人员主要通过测定初级(如过氧化物)和次级(如硫代巴比妥酸反应物质)氧化产物的含量来评估脂质的氧化程度[11]。但脂质氧化的过程相对复杂,仅凭借氧化产物的含量难以全面解析氧化作用对肌肉脂质产生的影响[12]。脂质组学是目前用于分析脂质的种类、丰度、功能和组织分布等脂质轮廓信息的一门学科[13]。利用脂质组学可以充分了解不同冻藏温度引起差异脂质物的变化情况,以此辅助选定较佳的冻藏条件。FANG等[11]利用化学和LC-MS脂质组学方法研究带鱼冻藏120 d内肌肉脂质的氧化程度,揭示了带鱼冻藏过程中主要的差异脂质及其变化规律。
本研究旨在探究冻藏温度对星康吉鳗脂质变化的影响,基于化学方法和脂质组学技术,分析-18 ℃(低温)和-60 ℃(超低温)冻藏期间脂质氧化的变化情况,揭示冻藏温度对星康吉鳗脂质组成及其动态变化的影响,阐明冻藏温度差异对星康吉鳗品质的调控作用,以期为星康吉鳗的贮藏和加工提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活的星康吉鳗[体重=(0.5±0.1) kg,体长=(38.0±3.0) cm,体宽=(3.4±0.2) cm]于2023年4月由青岛亿海丰水产品有限公司提供,利用海水保活运回实验室。
甲醇、乙腈(色谱纯),德国Merck公司;醋酸铵(色谱纯),德国CNW公司;甲酸(色谱纯),成都西亚化工股份有限公司;三氯乙酸、EDTA、硫代巴比妥酸(thiobarbituric acid,TBA)、氯仿(均为分析纯),上海麦克林生化科技股份有限公司。
1.2 仪器与设备
Thermo Vanquish UHPLC超高效液相色谱仪、Q-Exactive HF高分辨质谱、1510全波长酶标仪,美国Thermo Fisher Scientific公司;Zorbax Eclipse色谱柱,美国Agilent公司;721可见分光光度计,上海佑科仪器仪表有限公司。
1.3 实验方法
1.3.1 样品处理
同一批次的新鲜星康吉鳗活体宰杀后去除内脏、鱼骨和头部,并用蒸馏水(0~4 ℃)快速冲洗去除表面杂质。取中段厚度适中的鱼肉将其切成5.0 cm长的鱼段装入密封聚乙烯袋中,分别冻藏于-18 ℃和-60 ℃的恒温冰箱中。在第0、20、40、60、80、100、120天取出样本,4 ℃解冻3 h后对各项指标进行检测分析。
1.3.2 脂质过氧化物含量的测定
采用脂质过氧化物(lipid hydroperoxide,LPO)含量检测试剂盒对星康吉鳗的LPO含量进行测定。
1.3.3 硫代巴比妥酸反应物的测定
参考LI等[14]的方法,向4.0 g搅碎的星康吉鳗鱼肉中加入20.0 mL的75.0 g/L的三氯乙酸[含1.0 g/L的乙二胺四乙酸二钠],搅拌30 min后用滤纸过滤。取滤液5.0 mL,加入5.0 mL 0.02 mol/L硫代巴比妥酸,沸水浴加热40 min。冷却至室温时加入5.0 mL氯仿,然后快速混匀,静置分层。取上清液于532、600 nm处用分光光度计分别测定吸光度,通过公式(1)计算硫代巴比妥酸反应物(thiobarbituric reactive substances,TBARS)值,结果以每千克星康吉鳗鱼肉中丙二醛的毫克数来表示(mg MDA/kg):
![]()
(1)
式中:A532,532 nm处吸光值;A600,600 nm处吸光值。
1.4 脂质代谢物质检测
1.4.1 脂质提取
取100.0 mg星康吉鳗样品,加入400.0 μL甲醇、二氯甲烷混合液(2∶1,体积比),涡旋振荡20 s。然后加入300.0 μL二氯甲烷溶液混匀,22 ℃下平衡10 min,之后12 000 r/min离心10 min。收集下层二氯甲烷层,氮气吹干,用500.0 μL流动相复溶[V(乙腈)∶V(异丙醇)∶V(水)=65∶30∶5],经0.22 μm微孔滤膜过滤后转移到棕色进样小瓶中上机检测。
1.4.2 色谱-质谱条件
色谱条件:仪器使用Zorbax Eclipse C18(1.8 μm×2.1 mm×100 mm)色谱柱,柱温35 ℃,流速0.25 mL/min,自动进样器温度为4 ℃,进样量为2.0 μL。流动相A为V(乙腈)∶V(水)=60∶40(内含1 mg/L甲酸和10 mmol/L甲酸铵),流动相B为V(异丙醇)∶V(乙腈)=90∶10(内含1 mg/L甲酸和10 mmol/L甲酸铵)。梯度洗脱程序:0~1.5 min,68%A;1.5~3.0 min,55%A;3.0~4.0 min,48%A;4.0~6.0 min,42%A;6.0~8.5 min,34%A;8.5~11.5 min,30%A;11.5~15.0 min,25%A;15.0~19.0 min,3%A;19.0~25.0 min,68%A。
质谱条件:采集所用的高分辨率质谱仪为Q-Exactive HF,正负离子喷雾电压分别为4.35 kV和4.00 kV,鞘气流速为35 arb,辅助气流速为12 arb,毛细管温度为330 ℃。扫描模式为一级全扫描(full scan,m/z 200~1 450)和数据依赖性二级质谱扫描(dd-MS2,TopN=5),分辨率为240 000(一级质谱)和60 000(二级质谱),碰撞模式为高能量碰撞解离(high energy collision dissociation,HCD)。
使用Compound Discoverer 3.3进行保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,同时利用LIPID MAPS Structure Database(LMSD)在线数据库(http://www.lipidmaps.org/)进行物质鉴定,采用峰面积归一化法进行相对定量分析,并进行标准化处理。
1.5 数据分析
采用SPSS 26.0和GraphPad Prism 9.5软件进行数据处理和分析,每个实验重复3次,结果以平均值±标准差表示,采用单因素方差分析,并用Duncan多重极差检验比较平均值的差异显著性,P<0.05表示差异显著。使用SIMCA软件(V14.1,MKS Data Analytics Solution,Umea,Sweden)对数据进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis,OPLS-DA)。根据P<0.05,变量投影重要度(variable importance in the projection,VIP)值>1,进行差异脂质物筛选。
2 结果与分析
2.1 冻藏对星康吉鳗LPO含量的影响
LPO含量是表征鱼肉脂肪氧化程度的重要指标,通过LPO含量可定量判断鱼肉的酸败程度[15]。在冻藏过程中,不同的低温条件是影响鱼肉脂质过氧化物产生的主要因素。在120 d的冻藏过程中,不同冻藏温度对星康吉鳗LPO含量的影响如图1所示。新鲜星康吉鳗(0 d)的初始LPO含量为3.91 mmol/kg,与文献[16]的研究结果相似。随着冻藏时间的延长,2组LPO含量均有增加,说明星康吉鳗肌肉组织发生了一定程度的脂质氧化。其中,-18 ℃组星康吉鳗的LPO含量迅速增加,冻藏至100 d时,上升速度减缓甚至出现保持不变的趋势,可能是在冻藏后期脂质的初级氧化产物不稳定,进一步分解后出现这种结果[17];至120 d时,LPO含量达15.14 mmol/kg。-60 ℃组的LPO含量则始终呈缓慢上升趋势,冻藏至120 d时,LPO含量仅为7.21 mmol/kg。冻藏过程中-60 ℃组星康吉鳗的LPO含量始终低于-18 ℃组(P<0.05),表明更低的冻藏温度对脂质氧化有显著的抑制作用。这可能是由于-60 ℃冻藏条件下冰晶形成的速度快,冰晶分散性好且分散均匀,水分子迁移速度慢,对细胞的破坏作用较小,减少了促氧化剂和脂质等物质的流出,从而降低了脂质氧化的程度[18]。
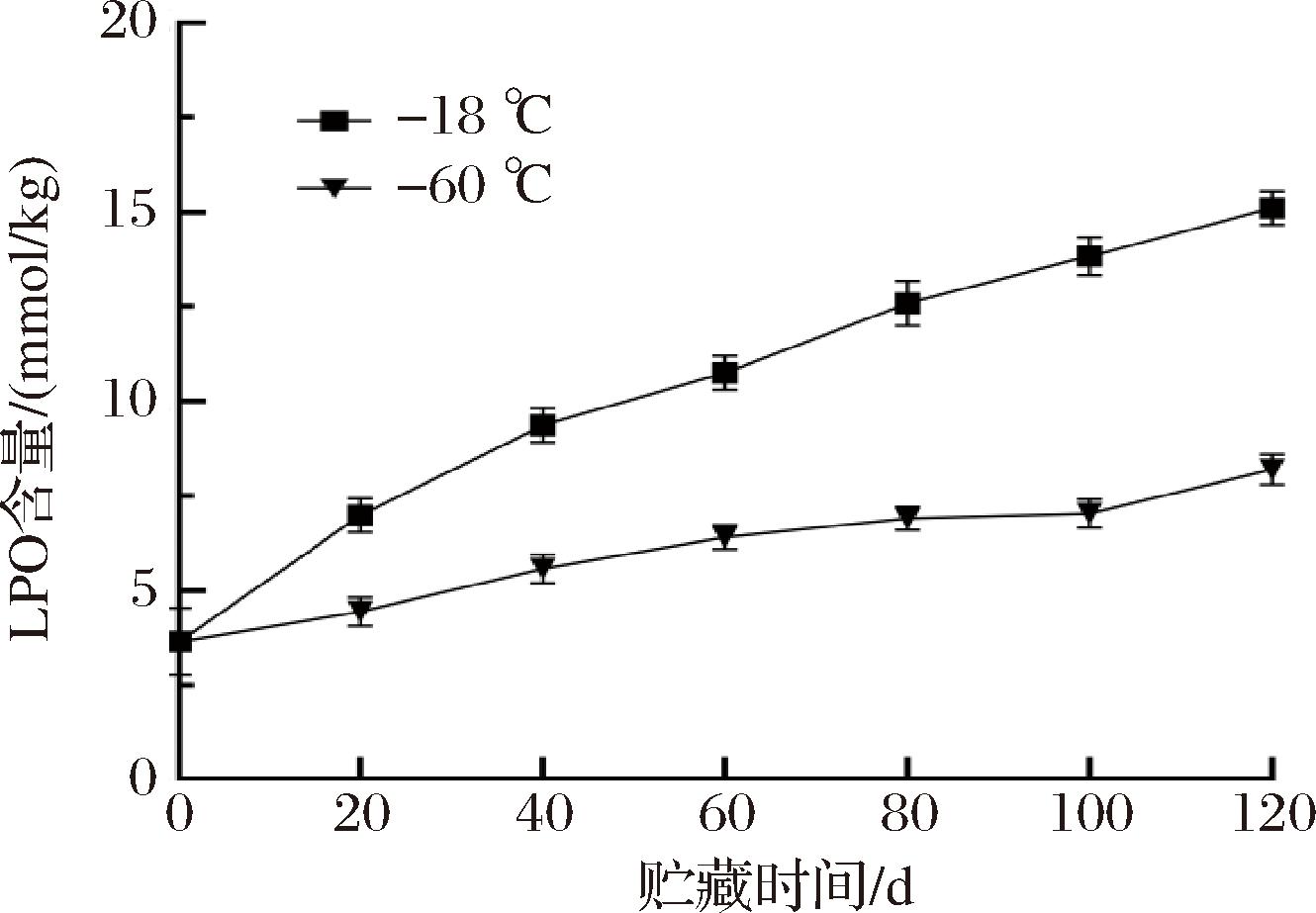
图1 冻藏过程中星康吉鳗鱼肉LPO含量的变化
Fig.1 Changes of LPO contents in whitespotted conger during frozen storage
2.2 冻藏对星康吉鳗TBARS值的影响
TBARS值可反映脂质氧化程度,是评价鱼肉品质变化的重要指标[19]。如图2所示,新鲜星康吉鳗鱼肉的TBARS初始值为0.29 mg MDA/kg。在-18 ℃和-60 ℃两种不同冻藏温度下,星康吉鳗TBARS值随冻藏时间的延长均呈上升趋势。其中,-18 ℃组鱼肉的TBARS值始终高于-60 ℃组,这可能是由于更低的温度下氧分子运动速率减慢,从而减缓了脂质的氧化过程[20];随着冻藏时间的延长,-18 ℃组的TBARS值增长幅度较大,冻藏120 d 时,上升至1.21 mg/kg(P<0.05)。而-60 ℃组增长幅度较小,至120 d时TBARS的含量仅为0.66 mg/kg。以上结果表明,-60 ℃比-18 ℃能更好地阻止TBARS的产生,降低星康吉鳗脂质的氧化程度,可能是更低的冻藏温度有效抑制了氧分子运动速率和内源酶活性的原因。另外,该实验结果与AYDIN等[21]对鳀鱼不同温度冻藏时脂质氧化的研究发现相似。
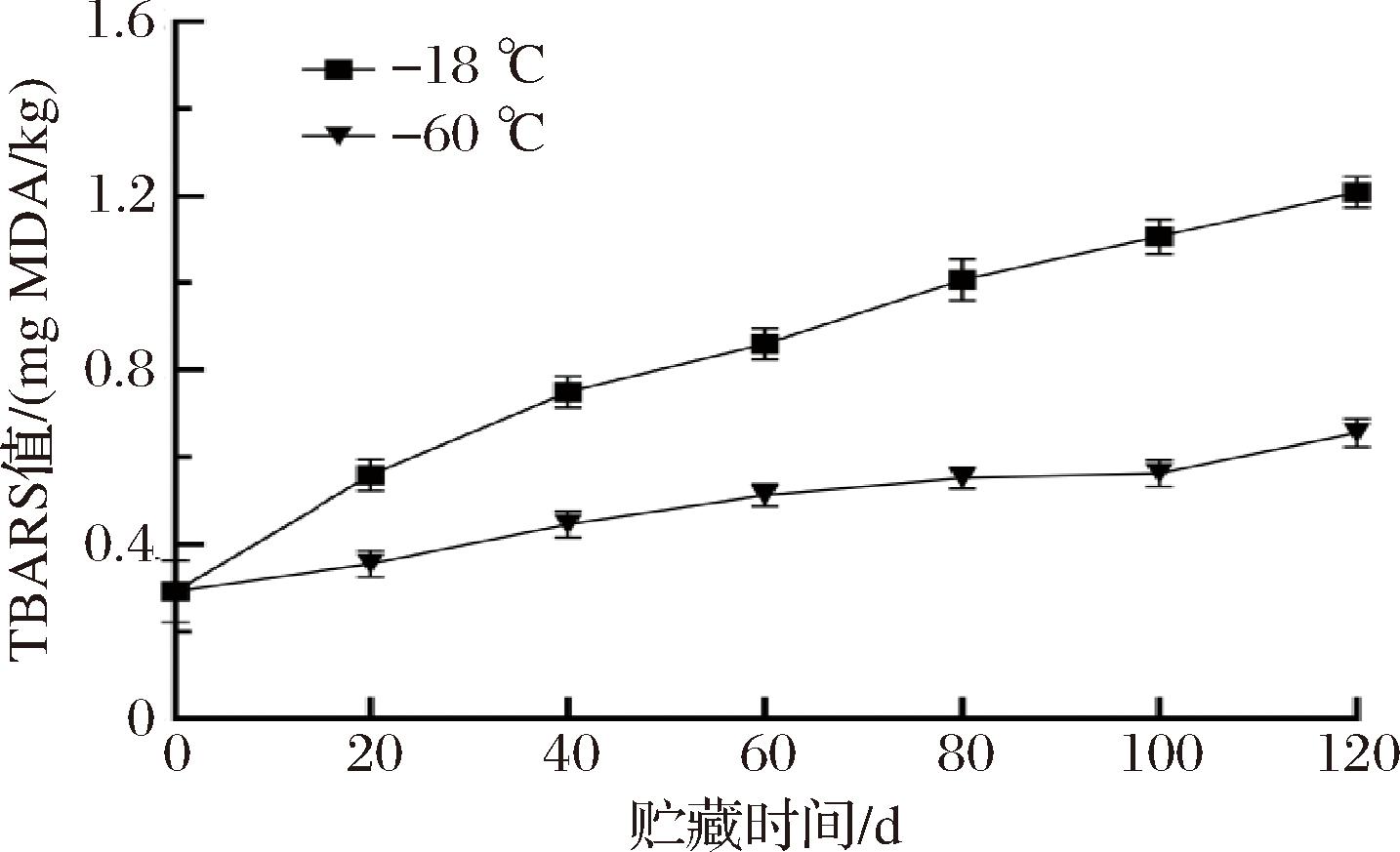
图2 冻藏过程中星康吉鳗鱼肉TBARS值的变化
Fig.2 Changes of TBARS values in whitespotted conger during frozen storage
2.3 星康吉鳗脂质代谢物组成分析
脂质组学是应用LC-MS等技术识别鉴定、量化分析脂肪氧化代谢物变化的新学科。在本次实验中,通过脂质组学方法对星康吉鳗脂质代谢物组成进行了分析。星康吉鳗肌肉组织中共鉴定出353种脂质,通过对检测到的脂质代谢物质进行注释后,得到脂质代谢物的分类信息。如图3所示,星康吉鳗样品的脂质代谢物中脂肪酰类(fatty acyls,FA)占11.33%、甘油脂类(glycerolipids,GL)占13.03%、甘油磷脂类(glycerophospholipids,GP)占57.22%、鞘脂类(sphingolipids,SP)占15.01%、固醇脂类(sterol lipids,ST)占1.98%,孕烯醇酮脂类(prenol lipids,PR)以及聚酮类(polyketides,PK)分别占0.85%和0.57%。此外,这些脂质分子又可根据极性头部的不同进一步分为不同的亚类,包括11种脂肪酰胺、9种鞘氨醇碱基、3种类异戊二烯、8种三羟甲基甘油、22种磷化鞘脂、2种甘油磷酰丝氨酸、60种甘油磷酰乙醇胺、4种脂肪醇、1种胆汁酸及其衍生物、140种甘油磷酰胆碱、16种神经酰胺、5种油酸甘油酯、33种甘油二酯、4种甾固醇、6种脂肪酸类和耦合物、6种中性鞘糖脂、1种黄酮类、14种脂肪酸酯、2种脂肪醛、1种芳香族聚酮、3种类花生酸及2种甾醇类。其中,脂质分子数量最多的脂质亚类是磷脂酰胆碱(phosphatidyl cholines,PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)、甘油二酯(diacylglycerol,DG)和鞘磷脂(sphingomyelin,SM),分别占39.66%、17.00%、9.35%和6.23%。PC、PE、DG和SM是星康吉鳗组织中的主要脂类。DG是体内脂肪代谢的内源中间产物,SM含有丰富的鞘脂和脂蛋白,是细胞膜的主要组成成分。而PC和PE作为肌肉组织中磷脂的主要成分,在调节细胞结构、细胞膜流动性和信号转导方面具有重要作用[22]。CHEN等[23]的研究发现肌肉组织中的PC和LPC与鱼类的新鲜度密切相关。值得注意的是,这些脂肪的组成及其含量即使在一个特定的物种内,也会受到多种条件的很大影响,例如肌肉的新鲜度和质量。

a-脂质分类;b-脂质亚类分类
图3 星康吉鳗脂质代谢物分类饼图
Fig.3 Pie chart of the lipid classifications of whitespotted conger
2.4 PCA和OPLS-DA分析
通过PCA和OPLS-DA模型比较星康吉鳗新鲜样本、-18 ℃组和-60 ℃组样本之间存在的总体脂质差异。如图4所示,PCA结果表明新鲜组、-18 ℃组及-60 ℃组中样品代谢物在散点图中可以明显区分开,表明冻藏时间和冻藏温度对星康吉鳗脂质代谢具有显著影响。此外,为检测OPLS-DA模型的可靠性,本次实验进行了200次排列验证,利用排列图分析进一步评估OPLS-DA模型的有效性和可信度。OPLS-DA验证模型的相关参数见表1。结果表明,随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的R2(表示所建模型对X和Y矩阵的解释率)和Q2(表示模型的预测能力)均逐渐下降,说明原模型不存在过拟合现象,模型稳健性良好,具有良好的鉴别和预测能力,后续可根据VIP值分析筛选其差异代谢物。综上所述,在PCA和OPLS-DA分析中,新鲜样品和2组冻藏样品之间的明显分离进一步证实了不同冻藏温度会导致星康吉鳗脂质发生显著变化。
表1 OPLS-DA模型参数
Table 1 Parameters of the OPLS-DA model

模型对应的分组对象R2X/cumR2Y/cumQ2/cum120 d-18_vs_0 d0.8490.990.961120 d-60_vs_0 d0.8420.9880.897120 d-60_vs_120 d-180.89410.936
注:表中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2表示模型的预测能力。

a、c、e-新鲜组与-18 ℃组、新鲜组与-60 ℃组、-18 ℃组与-60 ℃组的PCA得分图;b、d、f-新鲜组与-18 ℃组、新鲜组与-60 ℃组、-18 ℃组与-60 ℃组的OPLS-DA模型验证图
图4 PCA得分图及OPLS-DA模型验证图
Fig.4 PCA score charts and OPLS-DA model validation charts
2.5 星康吉鳗差异脂质分析
采用独立样本T检验(independent-samples,T-test)进行分析,显著性水平设定为0.05,结合OPLS-DA模型下第一主成分的VIP值>1,最终筛选得到星康吉鳗样品中差异脂质物。P值越小,VIP值越大,说明2个样品之间的脂质丰度差异越大。样品之间差异脂质物的组成和数量如图5所示,经过不同冻藏温度的处理后,星康吉鳗中差异脂质物差异倍数最大的上下调各10个物质,如果不足20个则展示所有差异脂质物。-18 ℃组和新鲜样品之间差异脂质物有16种,分别属于LPC(6种)、LPE(2种)、PC(4种)、PE(1种)、FA(2种)以及GL(1种)共六类脂质亚类。-60 ℃和新鲜样品之间差异脂质物有15种,其中LPC有3种、PE有3种、PC有7种、Cer有1种、FA有1种。-18 ℃和-60 ℃样品之间差异脂质物有19种,其中PE有7种、PC有4种、DG有4种、FA有4种。本研究中,脂质物丰度的差异变化验证了星康吉鳗在冻藏期间发生了显著的脂质氧化。结果显示,-60 ℃组与-18 ℃组样品相比,差异脂质主要集中在与鱼类新鲜度相关的LPC、PE和PC,表明-60 ℃能更好地抑制星康吉鳗脂质氧化,维持样品品质。

a、c、e-新鲜组与-18 ℃组、新鲜组与-60 ℃组、-18 ℃组与-60 ℃组的差异倍数柱状图;b、d、f-新鲜组与-18 ℃组、新鲜组与-60 ℃组、-18 ℃组与-60 ℃组的差异脂质物火山图
图5 差异倍数柱状图和差异脂质物火山图
Fig.5 Difference multiples bar charts and volcanic maps of differential lipids
注:柱状图中横坐标为差异脂质物的log2FC,纵坐标为差异脂质物的名称;火山图中纵坐标为-lg(P-value),每个点代表一个脂质物,散点大小代表VIP值;down表示显著下调的脂质物,up表示显著上调的脂质物,unchanged表示非显著差异的脂质物。
此外,对星康吉鳗样品之间的脂质物种丰度水平差异以及统计学显著性进行分析。正离子模式下,-18 ℃ vs 0 d、-60 ℃ vs 0 d、-18 ℃ vs -60 ℃组间分别鉴定出44、57、24个差异代谢物。负离子模式下,-18 ℃ vs 0 d、-60 ℃ vs 0 d、-18 ℃ vs -60 ℃组间分别鉴定出25、21、29个差异代谢物。与新鲜样品相比,-18 ℃样本中LPC(22∶2/22∶4/20∶4/22∶5/22∶6)、LPC(O-17∶0)、LPE(20∶4/22∶4/22∶6)、PC(O-20∶3)和PE(O-17∶1_20∶4)等差异脂质物具有更高的丰度水平;PC(16∶0_18∶5)、PC(O-34∶6)、PC(20∶0_22∶6)、PE(O-18∶2_20∶0)和PE(22∶6_22∶6)等,在-18 ℃组中具有显著的低丰度水平。-60 ℃组与新鲜样品相比,显著上调的差异表达脂质物有LPC(22∶2/22∶4)、LPC(O-17∶0)、PC(O-40∶4)、PC(O-35∶1)、PC(O-37∶4)、PE(O-18∶1_22∶4)、PE(O-18∶1_17∶1)、PE(O-18∶1_20∶5)和Cer(17∶1;2O/16∶0)等;-60 ℃组中差异脂质物如PC(O-40∶11)、PC(20∶3_20∶3)、PC(20∶0_22∶6)、PE(20∶5_22∶5)具有显著的低丰度水平。根据实验结果,-60 ℃组和-18 ℃组中PC、PE和LPC三种脂质亚类的脂质数量占总体差异脂质数量的70%。作为主要的差异脂质,与新鲜样品相比,-60 ℃组的下调脂质中与新鲜度相关的PC和PE脂类数量均少于-18 ℃组,-60 ℃组的上调脂质中由PC水解产生的LPC数量也低于-18 ℃组,说明-60 ℃冻藏温度能更好地抑制星康吉鳗脂质氧化,维持其品质状态[23]。
-18 ℃和-60 ℃样本之间的差异脂质变化见图5-f。在-60 ℃样本中,PE(O-18∶1_17∶1)、PE(O-18∶1_20∶0)、PC(O-36∶1)、PE(O-18∶1_22∶4)、PE(O-18∶1_20∶4)、PE(O-16∶1_16∶1)、PE(O-16∶1_17∶1)、PE(O-16∶1_18∶1)、PE(O-18∶2_17∶1)、PE(O-18∶1_22∶5)、PE(O-18∶1_20∶5)、PC(O-35∶6)和PC(O-32∶1)等差异脂质物的含量均高于-18 ℃样本。同时,DG(18∶2/18∶3/0∶0)、DG(20∶4/20∶4/0∶0)、LPE(22∶6)等差异脂质物在-18 ℃样本中丰度较高。研究发现低温/高温、氧气或自由基诱导的脂质氧化可能是导致肌肉组织中PC和PE减少的原因[24]。通过与新鲜样品对比,综合分析冻藏温度为-18 ℃和-60 ℃的差异脂质物,发现大多数PC和PE表现为下调,这可能是由于肌肉组织中发生的氧化反应,导致PC/PE链上的氢重排和α-键的C-C层断裂所引起的[25]。另外,-60 ℃组与-18 ℃组相比,PE与PC的差异丰度较高,说明-60 ℃冻藏温度能有效抑制星康吉鳗中脂质的氧化。PE、PC和LPC作为参与脂质代谢途径的关键组成部分,由于其不饱和性质容易被氧化或水解,可在一定程度上反映样品脂质的氧化情况,这与先前的研究结果一致[11,26]。
3 结论
本研究采用常规化学和脂质组学方法,测定了冻藏期间-18 ℃和-60 ℃对星康吉鳗脂质氧化的影响。化学结果表明,星康吉鳗在冻藏过程中LPO含量和TBARS值均升高,其中-60 ℃组的LPO含量和TBARS值显著低于-18 ℃组(P<0.05),说明长期冻藏过程中仍发生了脂质氧化,而-60 ℃的冻藏温度对脂质氧化的抑制作用更强。脂质组学结果显示,与新鲜组相比,-18 ℃组与-60 ℃组中的差异脂质主要是LPC、PE和PC,-60 ℃组的下调脂质中与新鲜度相关的PC和PE数量少于-18 ℃组;同时,-60 ℃组的上调脂质中的LPC和DG数量也低于-18 ℃组,说明-60 ℃冻藏温度对维持星康吉鳗品质的效果更好。综上所述,冻藏过程中不同低温条件对星康吉鳗的脂质氧化有不同程度的调控作用,而-60 ℃的超低温冻藏条件更好地抑制了脂肪氧化,维持了星康吉鳗的品质。本研究为星康吉鳗的冻藏和品质控制提供数据参考和理论依据。
[1] 杨浩, 史宝, 牛化欣, 等.星康吉鳗生物学与生态学的研发现状与展望[J].海洋科学, 2020, 44(6):152-158.YANG H, SHI B, NIU H X, et al.Advances and future prospects in Conger myriaster research[J].Marine Sciences, 2020, 44(6):152-158.
[2] MU X X, ZHANG C, ZHANG C L, et al.Age-structured otolith chemistry profiles revealing the migration of Conger myriaster in China Seas[J].Fisheries Research, 2021, 239:105938.
[3] OKU T, SUGAWARA A, CHOUDHURY M, et al.Lipid and fatty acid compositions differentiate between wild and cultured Japanese eel (Anguilla japonica)[J].Food Chemistry, 2009, 115(2):436-440.
[4] HUANG X H, FU B S, QI L B, et al.Formation and conversion of characteristic volatile compounds in grilled eel (Astroconger myriaster) during different processing steps[J].Food &Function, 2019, 10(10):6473-6483.
[5] ZHANG Y Y, WANG Y, HUANG X H, et al.Nutritional value of different parts from sea eel (Astroconger myriaster) determined by untargeted-lipidomic approach[J].Food Research International, 2023, 173:113402.
[6] XIE X, LIU X L, FEI Y, et al.Single and combined effects of tea polyphenols and edible chitosan coating on the shelf life improvement of refrigerated dagger-tooth Pike conger (Muraenesox cinereus)[J].International Journal of Food Properties, 2020, 23(1):2110-2122.
[7] 吴盟, 鲁强, 刘如聪, 等.星康吉鳗发育过程中个体形态学和卵母细胞特征变化及组织营养成分分析[J].上海海洋大学学报, 2021, 30(3):442-453.WU M, LU Q, LIU R C, et al.Changes of individual morphology and oocyte characteristics and analysis of tissue nutrient content during the ovary development of conger eel (Conger myriaster)[J].Journal of Shanghai Ocean University, 2021, 30(3):442-453.
[8] ZHANG B, YAN H B, SU L J, et al.Kappa-carrageenan oligosaccharides retard the progression of protein and lipid oxidation in mackerel (Scomber japonicus) fillets during frozen storage[J].RSC Advances, 2020, 10(35):20827-20836.
[9] JIANG Q Q, DU Y F, NAKAZAWA N, et al.Effects of frozen storage temperature on the quality and oxidative stability of bigeye tuna flesh after light salting[J].International Journal of Food Science Technology, 2022, 57(5):3069-3077.
[10] WANG J F, ZHANG H W, XIE J, et al.Effects of frozen storage temperature on water-holding capacity and physicochemical properties of muscles in different parts of bluefin tuna[J].Foods, 2022, 11(15):2315.
[11] FANG C D, CHEN H S, YAN H B, et al.Investigation of the changes in the lipid profiles in hairtail (Trichiurus haumela) muscle during frozen storage using chemical and LC/MS-based lipidomics analysis[J].Food Chemistry, 2022, 390:133140.
[12] HE C, CAO J, BAO Y Y, et al.Characterization of lipid profiling in three parts (muscle, head and viscera) of tilapia (Oreochromis niloticus) using lipidomics with UPLC-ESI-Q-TOF-MS[J].Food Chemistry, 2021, 347:129057.
[13] 崔益玮, 王利敏, 戴志远, 等.脂质组学在食品科学领域的研究现状与展望[J].中国食品学报, 2019, 19(1):262-270.CUI Y W, WANG L M, DAI Z Y, et al.Recent advances and prospect of lipidomics in food science[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(1):262-270.
[14] LI H Y, WANG Y, ZHANG J X, et al.Prediction of the freshness of horse mackerel (Trachurus japonicus) using E-nose, E-tongue, and colorimeter based on biochemical indexes analyzed during frozen storage of whole fish[J].Food Chemistry, 2023, 402:134325.
[15] 廖锦晗, 陈季旺, 谭玲, 等.冻结方式对中华鲟脂质氧化和肌纤维微观结构的影响[J].食品科学, 2023, 44(15):113-120.LIAO J H, CHEN J W, TAN L, et al.Effects of freezing methods on lipid oxidation and microstructure of muscle fibers in Acipenser sinensis[J].Food Science, 2023, 44(15):113-120.
[16] 陈晓楠. 海鳗鱼低温贮藏过程中肌肉品质特性变化及其发生规律[D].舟山:浙江海洋大学, 2022.CHEN X N.Changes and regularity of muscle quality characteristics of sea eel during cryogenic storage[D].Zhoushan:Zhejiang Ocean University, 2022.
[17] FIDALGO L G, LEMOS  T, DELGADILLO I, et al.Microbial and physicochemical evolution during hyperbaric storage at room temperature of fresh Atlantic salmon (Salmo salar)[J].Innovative Food Science and Emerging Technologies, 2018, 45(4):264-272.
T, DELGADILLO I, et al.Microbial and physicochemical evolution during hyperbaric storage at room temperature of fresh Atlantic salmon (Salmo salar)[J].Innovative Food Science and Emerging Technologies, 2018, 45(4):264-272.
[18] ZHU Z W, ZHOU Q Y, SUN D W.Measuring and controlling ice crystallization in frozen foods:A review of recent developments[J].Trends in Food Science Technology, 2019, 90:13-25.
[19] 顾赛麒, 胡彬超, 戴王力, 等.基于品质改良液处理的鳙鱼片不同温度冻藏特性研究[J].食品与发酵工业, 2023, 49(18):31-40.GU S Q, HU B C, DAI W L, et al.Study on frozen storage characteristics of bighead carp fillets at different temperatures based on quality improvement solution treatment[J].Food and Fermentation Industries, 2023, 49(18):31-40.
[20] 白雯璐, 张文海, 焦熙栋, 等.冻藏条件对带鱼鱼肉及其鱼糜凝胶特性的影响[J].食品工业科技, 2023, 44(2):98-106.BAI W L, ZHANG W H, JIAO X D, et al.Effects of frozen storage conditions on meat and surimi gel properties of hairtail[J].Science and Technology of Food Industry, 2023, 44(2):98-106.
[21] AYDIN I, GOKOGLU N.Effects of temperature and time of freezing on lipid oxidation in anchovy (Engraulis encrasicholus) during frozen storage[J].European Journal of Lipid Science and Technology, 2014, 116(8):996-1001.
[22] TOCHER D R.Metabolism and functions of lipids and fatty acids in teleost fish[J].Reviews in Fisheries Science, 2003, 11(2):107-184.
[23] CHEN J, KONG Q, SUN Z T, et al.Freshness analysis based on lipidomics for farmed Atlantic salmon (Salmo salar L.) stored at different times[J].Food Chemistry, 2022, 373:131564.
[24] LI Y, HUANG J Y, ZHOU Y Q, et al.Structure-related differential proteins identification for sous-vide cooking hairtail (Trichiurus lepturus) product[J].Food &Function, 2020, 11(11):9960-9972.
[25] LIU Y Z, CONG P X, LI B J, et al.Effect of thermal processing towards lipid oxidation and non-enzymatic browning reactions of Antarctic krill (Euphausia superba) meal[J].Journal of the Science of Food and Agriculture, 2018, 98(14):5257-5268.
[26] YU M M, GANG K Q, LI C, et al.Change of lipids in whelks (Neptunea arthritica cumingi Crosse and Neverita didyma) during cold storage[J].Food Research International, 2020, 136:109330.