随着消费者对低脂健康饮食需求的增加,高蛋白质、低脂肪、低胆固醇,且价格低廉的鸡肉及其制品在消费市场中越来越欢迎[1]。鸡肉丸、鸡肉肠、鸡肉饼等方便即食的肉糜产品已成为日常饮食的重要组成部分,而鸡肉糜的凝胶性能直接决定了此类产品质地、保水性、风味等关键品质[2]。影响鸡肉糜凝胶性能的因素较多,主要包括鸡肉原料、添加剂种类、加工工艺等,其中谷氨酰胺转胺酶、多糖、植物蛋白、盐类等添加物已受到广泛研究,且被证实对鸡肉糜的凝胶特性有较好的改善作用[3]。然而,高蛋白的鸡肉糜制品在热处理过程中极易发生氧化反应,过度氧化会进一步破坏鸡肉糜致密、稳定的三维网络结构,从而降低凝胶品质[4]。已知具有较强抗氧化活性的天然酚类物质稳定性较差,无法直接用于食品加工。因此,深入研究植物多酚微胶囊对热诱导鸡肉糜凝胶的氧化抑制作用,进而改善其凝胶特性具有重要意义。
儿茶素是一种从绿茶中提取的食品功能因子,具备良好的抗氧化性、抑菌性和安全性,可满足食品工业的需求[5]。然而,儿茶素因含多个酚羟基结构,易受温度、空气、光照、pH值等影响而发生降解、氧化聚合、异构化反应,导致其生物活性丧失[6]。因此,如何采用高效且经济的递送方式将儿茶素进行包埋和微囊化处理一直是当下的研究热点。多项研究表明,相比其他传统包封技术,蔗糖共结晶法具有新颖、灵活、经济、方便的优势,形成的固体纳米颗粒吸湿性、水分活度更低,环境稳定性更高[7]。该方法的主要原理是过饱和蔗糖溶液(95~97 °Brix)在高温(120 ℃以上)和低水分含量条件下自发快速结晶,将蔗糖从完美的晶体结构转变为不规则结构,从而方便掺入并保护活性化合物[8]。此外,蔗糖共结晶可较好地掩盖活性物质的苦味并保护它们免受环境压力,此技术在制药工业中的应用更加广泛,而在食品工业中的应用较为有限[9],可进一步加强该技术在食品基质中的基础及应用研究。
有关采用蔗糖共结晶技术包埋儿茶素,并将制备的微胶囊应用于鸡肉糜凝胶的研究报道较为鲜见。因此,本研究在表征儿茶素蔗糖共结晶微胶囊结构、功能特性和消化稳定性的基础上,比较了含不同质量分数儿茶素的共结晶微胶囊对鸡肉糜凝胶特性的影响,以期为鸡肉凝胶产品的品质改善提供理论依据和新的研究思路。
1 材料与方法
1.1 材料与试剂
冰鲜鸡胸肉(泰森牌)、食品级蔗糖(95%纯,太古牌),扬州沃尔玛超市;氯化钠、三氯乙酸、乙酸乙酯、盐酸胍、尿素、盐酸、氢氧化钠、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),分析纯,国药集团化学试剂有限公司;儿茶素(>98%纯),胃蛋白酶(酶活≥400 U/mg),胰蛋白酶(酶活1 645 U/mg),Sigma-Aldrich西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
IKA型磁力搅拌器,江苏星科元信息科技有限公司;GR15糖度计,上海卓光仪器科技有限公司;DSC 204F1型差示扫描量热仪(differential scanning calorimeter,DSC),德国耐驰公司;GeminiSEM 300型扫描电子显微镜(scanning electron microscope,SEM),德国Carl Zeiss公司;U-3900型日立紫外分光光度计,苏州德汇科学仪器有限公司;AUY 220型电子天平(1/10 000),上海凌仪生物科技有限公司;TMS-Pro型物性测试仪,美国 FTC公司;CR-400型柯尼卡美能达高精度色差仪,深圳市科维多科技有限公司;GTR16-2型高速冷冻离心机,湖南湘仪实验室仪器开发有限公司。
1.3 实验方法
1.3.1 儿茶素共结晶微胶囊制备
将市售蔗糖(150 g)与蒸馏水(25 mL)的混合物在不锈钢锅中加热至(121±2) ℃,随后移出热源并不停搅拌。当在糖浆中观察到有轻微混浊时将儿茶素(0.4%、0.8%,质量分数,下同)快速加入,立即冷却混合物,以抑制儿茶素高温氧化或异构化,在室温下保持搅拌,直到形成干燥的附聚物。将共结晶产品铺成薄层,40 ℃干燥20 h。干燥后,将获得的共晶体研磨并通过0.18~0.20 mm网筛,以获得粒度均匀的颗粒。将制备的共结晶微胶囊转移到聚乙烯袋中,并贮存在带有硅胶的琥珀色干燥器中,直到进一步测试,以不添加活性化合物的重结晶蔗糖粉末作为对照。
1.3.2 溶解度测定
参照L PEZ-C
PEZ-C RDOBA等[10]方法,略作修改,将1 g儿茶素共结晶微胶囊粉末与10 mL蒸馏水混合并进行连续搅拌,取不同溶解时间的等分溶液,使用糖度计测定溶液中溶解的蔗糖质量。
RDOBA等[10]方法,略作修改,将1 g儿茶素共结晶微胶囊粉末与10 mL蒸馏水混合并进行连续搅拌,取不同溶解时间的等分溶液,使用糖度计测定溶液中溶解的蔗糖质量。
1.3.3 热力学性质测定
称取3~5 mg共结晶微胶囊粉末于铝质坩埚中,密封后置于样品舱,加热温度从25 ℃升至250 ℃,升温速率为10 ℃/min,在初始温度处平衡2 min,以空坩埚为对照,用软件Universal Analysis 2000分析共结晶微胶囊的热力学性质,每个样品至少重复测定3次。
1.3.4 表观形貌分析
采用SEM对微胶囊样品的表观形貌进行观察,将共结晶粉末黏附到观测平台上,离子溅射喷金后分析其表观形貌。
1.3.5 体外消化稳定性
参照WEN等[11]方法,采用两步消化法建立体外胃肠消化模型,模拟消化液的具体组分见表1。
表1 模拟消化液的成分
Table 1 The composition of simulated digestive juice

胃液肠液胆汁无机溶液15.7 mL氯化钠(175.3 g/L)、3.0 mL磷酸二氢钠(88.6 g/L)、9.2 mL氯化钾(89.6 g/L)、18 mL二水氯化钙(22.2 g/L)、8.3 mL盐酸(37%体积分数,下同)40 mL氯化钠(175.3 g/L)、40 mL碳酸氢钠(84.7 g/L)、10 mL磷酸二氢钾(8 g/L)、6.3 mL氯化钾(8 g/L)、6.3 mL氯化镁(8 g/L)、180 μL盐酸(37%)、9 mL二水氯化钙(22.2 g/L)30 mL氯化钠(175.3 g/L)、68.3 mL碳酸氢钠(84.7 g/L)、4.2 mL氯化钾(8 g/L)、10 mL二水氯化钙(22.2 g/L)有机溶液10 mL葡萄糖(65 g/L)、10 mL葡萄糖醛酸(2 g/L)、3.4 mL盐酸氨基葡萄糖(33 g/L)4 mL尿素(25 g/L)10 mL尿素(25 g/L)混合添加物1 g牛血清蛋白、1 g胃蛋白酶1 g牛血清蛋白、1 g胰蛋白酶、0.5 g脂肪酶1.8 g牛血清蛋白、6 g胆汁(猪)pH1.1±0.17.8±0.18.0±0.1配制总体积1 000 mL1 000 mL1 000 mL
同步取3 g共结晶微胶囊粉末与12 mL磷酸盐缓冲液(pH 7.0)充分混匀,将15 mL待测样品与15 mL胃液混合,调节pH值至2.5,在(37±1) ℃条件下恒温振摇(95 r/min)2 h,消化完成后将pH值调节至7.0,取100 μL胃消化液与3.9 mL DPPH乙醇溶液(25 mg/L)混匀,在黑暗中室温孵育40 min后于517 nm处测量混合物的吸光度值,以无水乙醇溶液为空白样品。随后将30 mL经胃消化后的样品与27 mL十二指肠液和9 mL胆汁混合,调节pH值至7.0,在(37 ± 1) ℃条件下恒温振摇(95 r/min)2 h,完成十二指肠消化,将消化液在90 ℃条件加热10 min,以终止酶反应,进一步测定胃消化后样品的DPPH自由基清除率,计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A1为空白上清液的吸光度值;A2为样品上清液的吸光度值。
1.3.6 热诱导鸡肉糜凝胶制备
去除多余的脂肪和结缔组织,将新鲜鸡胸肉快速分割后切碎,将300 g切碎的鸡胸肉置于厨师机中1 500 r/min搅拌3 min,随后3 000 r/min搅拌6 min,搅拌过程中分3次添加质量分数为2%食盐、5%冰水和1%添加物,始终保持肉糜中心温度在10 ℃以下。采用肉丸成型设备将鸡肉糜制成直径2 cm的丸子坯,于50 ℃水浴定型5 min后再放入90 ℃水浴中煮制15 min,冷却,置于4 ℃冰箱中平衡过夜备用。实验添加组及对应编号见表2。
表2 实验添加组及对应编号
Table 2 Levels of ingredients added to chicken breast meat batters
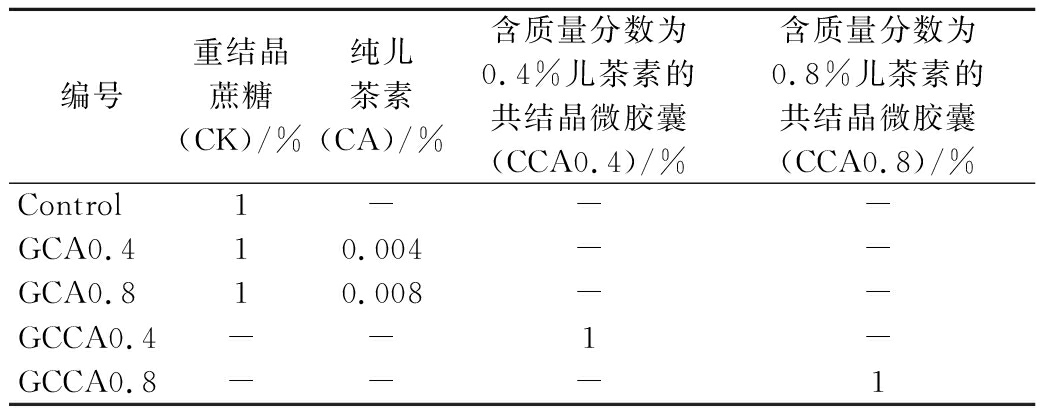
编号重结晶蔗糖(CK)/%纯儿茶素(CA)/%含质量分数为0.4%儿茶素的共结晶微胶囊(CCA0.4)/%含质量分数为0.8%儿茶素的共结晶微胶囊(CCA0.8)/%Control1---GCA0.410.004--GCA0.810.008--GCCA0.4--1-GCCA0.8---1
注:表中数据为质量分数;-代表未添加。
1.3.7 蒸煮损失率测定
鸡肉糜凝胶蒸煮损失率的计算如公式(2)所示:
蒸煮损失率![]()
(2)
式中:m1为熟制前鸡肉糜质量,g;m2为熟制后鸡肉糜质量,g。
1.3.8 持水力测定
精确称取切碎后的鸡肉丸2 g,用滤纸包好放入离心管中,冷冻离心15 min(6 000 r/min)后取出称重,计算如公式(3)所示:
持水力![]()
(3)
式中:m3为初始样品质量;m4为离心后样品质量。
1.3.9 色泽测定
用CR-400色差计测量鸡肉丸表面至少3个不同区域的亮度(L*)、红度(a*)、黄度(b*)值,具体参数为:光源D65、测量孔径8 mm、观察角度90°。白度值计算如公式(4)所示:
白度值![]()
(4)
1.3.10 质构特性测定
采用TMS-Pro物性分析仪测定鸡肉丸的质构特性,选用P/35探头,测前速度、测试速度和测后速度均调整为60 mm/min,2次压缩间隔5 s,形变量60%。分别记录鸡肉丸的硬度、黏附性、内聚性、弹性、胶黏性、咀嚼性等参数。
1.3.11 显微结构分析
取出固定好的鸡肉凝胶组织进行脱水、石蜡包埋并切成4 μm厚度的薄片,随后用二甲苯去除石蜡,使用不同浓度梯度的乙醇溶液进行脱水处理,再利用苏木精-伊红染色法染色,最后采用光学显微镜在放大40倍条件下观察,拍照。
1.3.12 羰基含量测定
取10 mL的PBS缓冲液(10 mmol/L)对1 g鸡肉丸碎样进行匀浆处理,离心后去除上清液,向溶解的样品中加入1 mL含0.2%(质量分数)DNPH的2 mol/L HCl,同时向空白样品中加入1 mL HCl(2 mol/L),并在室温下孵育1 h。随后加入0.6 mL 20%(体积分数)三氯乙酸,离心5 min(12 000×g,4 ℃),弃去上清液,用1 mL乙醇∶乙酸乙酯溶液(体积比1∶1)洗涤沉淀3次,将洗涤后的沉淀溶解于1.5 mL盐酸胍(6 mol/L)中,在37 ℃水浴中孵育30 min,然后离心5 min(12 000×g,4 ℃),在370 nm波长处测量上清液吸光度值,使用摩尔消光系数21 mmol/L·cm计算羰基含量。
1.3.13 巯基含量测定
总巯基:参照TURGUT等[12]方法并略作修改,取1 g粉碎的鸡肉丸样品,加入20 mL 0.05 mol/L磷酸盐缓冲液(8 mol/L尿素、0.6 mol/L氯化钠、6 mmol/L 乙二胺四乙酸[(ethylene diamine tetraacetic acid,EDTA),pH 7.2]进行冰浴匀浆,取1 mL匀浆液,加入9 mL缓冲液,离心16 min(6 000×g)后取3 mL上清液,加入100 μL的DTNB溶液(4 mg/mL),在40 ℃条件下避光反应15 min,于412 nm处测定吸光度值。
游离巯基:取1 g粉碎的鸡肉丸样品,加入20 mL 0.05 mol/L磷酸盐缓冲液(8 mol/L尿素、0.6 mol/L氯化钠、6 mmol/L EDTA,pH 7.2)进行冰浴匀浆,取4 mL匀浆液,直接加入100 μL的DTNB溶液(4 mg/mL),在4 ℃条件下避光反应1 h,于412 nm处测定吸光度值。总巯基和游离巯基含量的计算如公式(5)所示:
巯基含量![]()
(5)
式中:A为吸光度值;D为稀释倍数;ε为摩尔消光系数(ε=13 600 mol/L·cm);C为蛋白质浓度。
1.4 数据处理
所有实验均至少独立重复3次,在P<0.05的置信水平下,采用Duncan多重范围检验(IBM SPSS 19.0)对样品进行单因素方差分析(ANOVA)。所有图形均由Origin Pro 2018绘制。
2 结果与分析
2.1 溶解度
图1显示了含有不同质量分数的儿茶素共结晶微胶囊和蔗糖粉末样品在120 s内的溶解度。在溶解初始阶段,CK的溶解度显著高于CCA0.4、CCA0.8(P<0.05),且质量分数较高的儿茶素共结晶微胶囊样品溶解度最小,并持续至30 s。所有样品的溶解时间可设定为约45 s,因为在此时间后,折光仪读取的蔗糖质量并无显著差异(P>0.05),这与L PEZ-C
PEZ-C RDOBA等[10]研究结果一致。据报道,共结晶过程可将蔗糖致密和规则的晶体结构转变为不规则的多孔结构,且活性化合物位于产生的多孔空间中[13]。由于共结晶蔗糖基质的多孔性,水溶液可以轻易地渗透到共结晶结构中,从而释放出核心化合物用于溶解[14]。
RDOBA等[10]研究结果一致。据报道,共结晶过程可将蔗糖致密和规则的晶体结构转变为不规则的多孔结构,且活性化合物位于产生的多孔空间中[13]。由于共结晶蔗糖基质的多孔性,水溶液可以轻易地渗透到共结晶结构中,从而释放出核心化合物用于溶解[14]。

图1 儿茶素共结晶微胶囊的溶解动力学
Fig.1 Dissolution kinetics of catechin co-crystallized microcapsules
2.2 热力学性质
使用DSC分析获得儿茶素(CA)、重结晶蔗糖粉末(CK)和不同质量分数儿茶素共结晶微胶囊(CCA0.4、CCA0.8)的热力学图谱。由图2可知,CA熔化的峰值温度为157 ℃,其中吸热峰开始于154 ℃,结束于161.5 ℃,仅出现一个较窄的吸热峰,表明该化合物纯度较高,且结构稳定。CK样品和CCA0.4、CCA0.8均出现2个典型吸热峰,其中CK第1个吸热峰值在157 ℃左右,此时蔗糖晶体发生吸热融化,但仍具备重结晶的功能,第2个吸热峰值在186 ℃左右,此时蔗糖进一步脱水缩合形成焦糖。在CCA0.4、CCA0.8热分析图谱中未观察到儿茶素单独的熔融峰,这可能与共结晶微胶囊中的儿茶素浓度较低有关。巴拉圭茶的纯提取物及其共结晶微胶囊具有与本研究相似的热力学曲线,该提取物的吸热峰与蔗糖的熔融峰发生了合并[15]。此外,CCA0.4、CCA0.8的吸热峰温度较CK样品均有所降低,且第2个吸热峰的热焓值较对照组降低近23%,主要由于在不规则的共结晶蔗糖基质中引入无定形物质会改变蔗糖的熔化特性[16]。

图2 儿茶素共结晶微胶囊的DSC图谱
Fig.2 DSC spectra of catechin co-crystallized microcapsules
2.3 表观形貌
为了更直观地表征儿茶素的包埋效果,采用扫描电镜分析儿茶素共结晶微胶囊的表观形貌。如图3所示,未添加儿茶素的重结晶蔗糖粉末(CK)具有一定的团簇表面和空隙空间,但大多具有整齐的晶体边缘。含有不同质量分数的儿茶素共结晶微胶囊样品(CCA0.4、CCA0.8)会形成不规则的多孔结构,儿茶素在该结构的表面和多孔空间内簇状附聚(黄色箭头指向附聚物),其中CCA0.4显示出团聚体的粗糙表面,没有整齐的边缘,而CCA0.8形成的附聚物分散度更高,具有一定的整齐边缘。上述结果与TZATSI等[17]研究结果一致,并进一步证实了蔗糖共结晶法制备儿茶素微胶囊的可行性。

A-放大500倍;B-放大1 000倍
图3 儿茶素共结晶微胶囊的表观形貌
Fig.3 Apparent morphology of catechin co-crystallized microcapsules
2.4 消化稳定性
为进一步验证儿茶素共结晶微胶囊在胃肠消化体系中的稳定性,建立体外消化模型,对比消化过程中样品的抗氧化活性。由图4可知,蔗糖粉末的抗氧化活性较低,其DPPH自由基清除率在消化过程中并无明显变化。消化前,所有儿茶素样品的DPPH自由基清除率均高达90%以上,其中质量分数为0.8%的游离儿茶素(CA0.8)显著高于其他样品组(P<0.05)。随着消化过程中的进行,所有游离或被包埋的儿茶素样品的抗氧化活性均出现不同程度降低,其中CA0.8的DPPH自由基清除率在胃消化阶段的降幅最大,接近55%,其次为质量分数为0.4%的游离儿茶素(CA0.4)。与游离儿茶素相比,体外消化过程对儿茶素共结晶微胶囊的抗氧化活性影响较小,其中CCA0.4经肠消化后的DPPH自由基清除率仍高达85%左右,而CCA0.8的抗氧化活性在肠消化后有明显降低,但显著高于CA样品(P<0.05)。由此可知,蔗糖共结晶法是一种提升儿茶素环境稳定性的有效包埋方式。

图4 体外消化过程中儿茶素共结晶微胶囊的抗氧化活性
Fig.4 Antioxidant activity of catechin co-crystallized microcapsules during in vitro digestion
注:不同小写字母表示组间差异显著(P<0.05),不同大写字母表示组内差异显著(P<0.05)(下同)。
2.5 鸡肉糜凝胶蒸煮损失率和持水力
由图5可知,GCA0.8的蒸煮损失率高达9.76%,与其余处理组差异显著(P<0.05),而GCCA0.4、GCCA0.8的蒸煮损失率可较GCA0.8处理组降低近50%,表明儿茶素共结晶微胶囊的添加可促进鸡肉糜致密三维凝胶网络的形成。与Control相比,GCA0.4、GCA0.8样品的持水力有明显降低,表明添加任何比例的游离儿茶素并无法改善鸡肉糜凝胶的保水性能。此外,与蒸煮损失的结果对应,GCCA0.4、GCCA0.8样品的持水力较Control有所改善,而2个添加组间无显著差异(P>0.05),且无明显剂量效应,可能与蔗糖分子的多羟基结构有关[18]。综合看来,儿茶素共结晶微胶囊的添加可显著降低鸡肉糜凝胶的蒸煮损失,并改善其持水力和稳定性。

图5 儿茶素共结晶微胶囊添加对鸡肉糜凝胶蒸煮损失和持水力的影响
Fig.5 Effects of catechin co-crystallized microcapsules on cooking loss and water-holding capacity of chicken batters
2.6 鸡肉糜凝胶色泽
产品色泽是影响消费者购买欲的重要指标,肉制品中的亮度(L*)与其中含有的氧化肌红蛋白和自由水含量有关[19]。由表3可知,添加游离儿茶素及共结晶微胶囊的鸡肉糜凝胶亮度值均显著低于Control(P<0.05),主要与活性物质既可抑制氧化肌红蛋白含量的降低,又可吸收鸡肉凝胶中的自由水有关。与Control相比,GCA0.4、GCA0.8样品的红度(a*)显著提高(P<0.05),可能与游离儿茶素与鸡肉糜凝胶的结合度不高,其在受热后易发生氧化异构有关。GCCA0.4、GCCA0.8的a*值有明显降低(P>0.05),这与赵泽润等[20]研究结果一致。所有添加活性物质的鸡肉糜凝胶黄度(b*)均显著低于Control(P<0.05),其中GCCA0.8样品b*值最低、白度值最高,进一步表明经蔗糖共结晶包埋后的儿茶素稳定性明显提升,可在热处理过程中发挥出较强的抗氧化作用。
表3 儿茶素共结晶微胶囊添加对鸡肉糜凝胶色泽的影响
Table 3 Effects of catechin co-crystallized microcapsules on colour of chicken batters
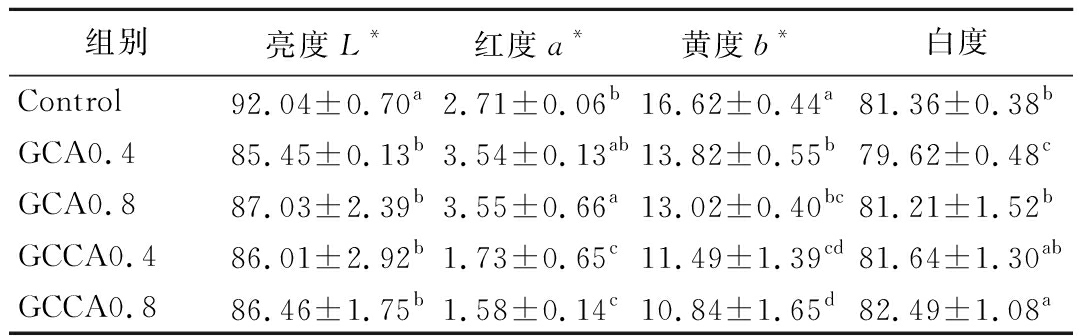
组别亮度L*红度a*黄度b*白度Control92.04±0.70a2.71±0.06b16.62±0.44a81.36±0.38bGCA0.485.45±0.13b3.54±0.13ab13.82±0.55b79.62±0.48cGCA0.887.03±2.39b3.55±0.66a13.02±0.40bc81.21±1.52bGCCA0.486.01±2.92b1.73±0.65c11.49±1.39cd81.64±1.30abGCCA0.886.46±1.75b1.58±0.14c10.84±1.65d82.49±1.08a
注:同一列标注字母不同者表示差异显著(P<0.05)(下同)。
2.7 鸡肉糜凝胶质构特性
质构特性是鸡肉凝胶制品重要的品质指标之一。由表4可知,与Control相比,添加游离儿茶素的样品硬度、内聚性、胶黏性和咀嚼性均显著降低(P<0.05),且随着儿茶素添加量的增加降幅明显,可能由于游离儿茶素在鸡肉糜基质和加热过程中极易发生氧化,反而破坏了蛋白质分子间的相互作用,不利于鸡肉糜致密凝胶网络的形成,这与蒸煮损失和持水力的结果对应。此外,鸡肉糜凝胶的硬度、黏附性、胶黏性和咀嚼性在共结晶儿茶素添加后均得到了显著提升(P<0.05),且硬度和咀嚼性随着儿茶素浓度的升高有一定的增加趋势,表明共结晶儿茶素可通过抑制肌肉氧化来保护凝胶结构的完整性,从而有效改善鸡肉糜凝胶的质构特性,这与CUNHA等[21]研究结果一致。
表4 儿茶素共结晶微胶囊添加对鸡肉糜凝胶质构特性的影响
Table 4 Effects of catechin co-crystallized texture characteristics on colour of chicken batters

组别硬度/N黏附性/mJ内聚性/ratio弹性/mm胶黏性/N咀嚼性/mJControl124.30±7.93b1.17±0.44d0.41±0.032a9.52±0.48ab51.70±2.13b491.77±21.09cGCA0.492.27±3.68c1.61±0.22c0.34±0.010b9.81±0.08a30.67±3.50c317.72±18.45dGCA0.882.43±3.17d2.02±0.05a0.31±0.015b8.57±0.94c25.87±1.96d220.97±13.88eGCCA0.4135.70±4.09a1.93±0.77a0.42±0.026a9.59±0.64ab57.90±4.32a525.64±8.20abGCCA0.8141.86±7.12a1.84±0.10ab0.43±0.031a9.64±0.37a57.87±9.08a555.46±13.17a
2.8 鸡肉糜凝胶显微结构
不同添加物对鸡肉糜凝胶显微结构的影响如图6所示,其中黑色箭头指向滴水通道,白色箭头指向凝胶孔隙。Control样品的滴水通道较多,孔隙较大且分布不均,而添加游离儿茶素并无法明显改善鸡肉糜凝胶结构,其中GCA0.8的样品孔隙最大,并出现较大的滴水通道,可能因游离儿茶素产生较高程度的氧化异构,引起部分蛋白质分子无法进行有序重组,使得凝胶网状结构变得松散与不规则[22],由此导致鸡肉糜凝胶性能减弱,截留水分子的能力降低,这进一步解释了GCA0.8样品保水性差和质构劣化的本质原因。相比Control和GCA0.4、GCA0.8,GCCA0.4、GCCA0.8孔隙明显变小,且分布更加均匀,由热处理引起的滴水通道消失。此外,鸡肉糜凝胶的组织结构因较高浓度的儿茶素共结晶微胶囊的添加变得更加致密,这与蒸煮损失、持水力和质构特性的结果相一致。

A-CK;B-GCA0.4;C-GCA0.8;D-GCCA0.4;E-GCCA0.8
图6 儿茶素共结晶微胶囊添加对鸡肉糜凝胶显微结构的影响(40×)
Fig.6 Effects of catechin co-crystallized microcapsules on light microscopy of chicken batters (40×)
2.9 鸡肉糜凝胶蛋白质氧化程度
由图7-A可知,GCA0.4、GCA0.8的羰基含量显著高于其他处理组(P<0.05),其中GCA0.8样品的羰基含量最高(0.89 nmol/mg),表明将儿茶素直接添加到鸡肉糜基质中并不利于发挥该活性物质的抗氧化作用,反而会促进鸡肉糜凝胶的氧化。与Control相比,添加儿茶素共结晶微胶囊显著降低了鸡肉糜凝胶的羰基含量(P<0.05),其中GCCA0.8处理组的羰基含量降至最低(0.32 nmol/mg)。

A-羰基含量;B-总巯基和游离巯基含量
图7 儿茶素共结晶微胶囊添加对鸡肉糜凝胶蛋白质氧化的影响
Fig.7 Effects of catechin co-crystallized microcapsules on protein oxidation of chicken batters
图7-B显示,随着游离儿茶素添加量的增加,样品中的总巯基和游离巯基含量而明显降低,这与羰基的结果一致,可能因添加游离儿茶素加速了鸡肉蛋白的氧化进程,导致半胱氨基酸残基上的巯基氧化产生二硫键及硫醇类氧化产物[23]。此外,游离儿茶素与肌原纤维蛋白产生共价交联,儿茶素中的羟基很容易被氧化生成邻醌,巯基会和醌反应生成巯基-醌共价产物[24],从而降低了巯基含量。然而,添加儿茶素共结晶微胶囊的样品总巯基和游离巯基含量得到显著提升(P<0.05),其中GCCA0.8处理组的总巯基和游离巯基含量较Control分别提高了151.86%和121.77%,进一步表明采用蔗糖共结晶法包埋儿茶素可有效保证该活性物质在加工过程中继续发挥抗氧化作用。
3 结论
本研究采用共结晶技术制备了包含不同质量分数儿茶素的共结晶微胶囊,其中溶解动力学、DSC、SEM和体外消化模型证实了共结晶蔗糖所形成的多孔结构可显著增强儿茶素的溶解性、分散性和稳定性。进一步探究了游离儿茶素和儿茶素共结晶微胶囊对热诱导鸡肉糜凝胶特性的影响,结果显示游离儿茶素难以在鸡肉糜凝胶体系中发挥作用,反而会促凝胶氧化,导致致密的凝胶网络结构遭破坏。与其他处理组相比,GCCA0.8为最优处理组,添加质量分数为0.8%的儿茶素共结晶微胶囊可有效改善因热处理产生的凝胶孔隙和滴水通道,同时极大降低鸡肉糜凝胶的蛋白质氧化程度,进而明显提升了凝胶的保水性、白度值和质构特性。
[1] 孙京新, 雷甜甜, 丁翠云, 等.不同配方对鸡肉丸品质的影响[J].肉类研究, 2009,23(3):30-33.SUN J X, LEI T T, DING C Y, et al.Influence of different ingredients on the quality of chicken meatball[J].Meat Research, 2009,23(3):30-33.
[2] 李宁宁, 李钊, 赵圣明, 等.地皮菜添加量对鸡胸肉糜凝胶特性的影响[J].食品科学, 2021, 42(2):53-59.LI N N, LI Z, ZHAO S M, et al.Effect of Nostoc commune on gelation and rheological properties of chicken breast meat batters[J].Food Science, 2021, 42(2):53-59.
[3] ZHU D Y, KANG Z L, MA H J, et al.Effect of sodium chloride or sodium bicarbonate in the chicken batters:A physico-chemical and Raman spectroscopy study[J].Food Hydrocolloids, 2018, 83:222-228.
[4] BANERJEE R, VERMA A, SIDDIQUI M, et al. Natural Antioxidants[M]. America: CRC Press, 2016:95-140.
[5] GADKARI P V, BALARAMAN M.Catechins:Sources, extraction and encapsulation:A review[J].Food and Bioproducts Processing, 2015,93:122-138.
[6] WANG D L, WANG J J, SUN J C, et al.Degradation kinetics and isomerization of 5-O-caffeoylquinic acid under ultrasound:Influence of epigallocatechin gallate and vitamin C[J].Food Chemistry:X, 2021,12:100147.
[7] RAI K, CHHANWAL N, SHAH N N, et al.Encapsulation of ginger oleoresin in co-crystallized sucrose:Development, characterization and storage stability[J].Food &Function, 2021, 12(17):7964-7974.
[8] YANG L, SHEN S Y, WANG Z N, et al.New value-added sugar and brown sugar products from sugarcane:A commercial approach[J].Sugar Tech, 2020, 22(5): 853-857.
[9] CHEZANOGLOU E, GOULA A M.Co-crystallization in sucrose:A promising method for encapsulation of food bioactive components[J].Trends in Food Science &Technology, 2021, 114:262-274.
[10] L PEZ-C
PEZ-C RDOBA A, DELADINO L, AGUDELO-MESA L, et al.Yerba mate antioxidant powders obtained by co-crystallization:Stability during storage[J].Journal of Food Engineering, 2014, 124:158-165.
RDOBA A, DELADINO L, AGUDELO-MESA L, et al.Yerba mate antioxidant powders obtained by co-crystallization:Stability during storage[J].Journal of Food Engineering, 2014, 124:158-165.
[11] WEN S Y, ZHOU G H, LI L, et al.Effect of cooking on in vitro digestion of pork proteins:A peptidomic perspective[J].Journal of Agricultural and Food Chemistry, 2015, 63(1):250-261.
[12] TURGUT S S, SOYER A, I
 KÇ
KÇ F.Effect of pomegranate peel extract on lipid and protein oxidation in beef meatballs during refrigerated storage[J].Meat Science, 2016, 116:126-132.
F.Effect of pomegranate peel extract on lipid and protein oxidation in beef meatballs during refrigerated storage[J].Meat Science, 2016, 116:126-132.
[13] L PEZ-C
PEZ-C RDOBA A, GALLO L, BUCAL
RDOBA A, GALLO L, BUCAL V, et al.Co-crystallization of zinc sulfate with sucrose:A promissory strategy to render zinc solid dosage forms more palatable[J].Journal of Food Engineering, 2016, 170:100-107.
V, et al.Co-crystallization of zinc sulfate with sucrose:A promissory strategy to render zinc solid dosage forms more palatable[J].Journal of Food Engineering, 2016, 170:100-107.
[14] BEHNAMNIK A, VAZIFEDOOST M, DIDAR Z, et al.Evaluation of physicochemical, structural, and antioxidant properties of microencapsulated seed extract from Securigera securidaca by co-crystallization method during storage time[J].Biocatalysis and Agricultural Biotechnology, 2021, 35:102090.
[15] DELADINO L, NAVARRO A S, MARTINO M N.Microstructure of minerals and yerba mate extract co-crystallized with sucrose[J].Journal of Food Engineering, 2010, 96(3):410-415.
[16] BHANDARI B R, HARTEL R W.Co-crystallization of sucrose at high concentration in the presence of glucose and fructose[J].Journal of Food Science, 2002, 67(5):1797-1802.
[17] TZATSI P, GOULA A M.Encapsulation of extract from unused chokeberries by spray drying, co-crystallization, and ionic gelation[J].Waste and Biomass Valorization, 2021, 12(8):4567-4585.
[18] SHARMA G, SHARMA S, KUMAR A, et al.Guar gum and its composites as potential materials for diverse applications:A review[J].Carbohydrate Polymers, 2018, 199:534-545.
[19] ZHANG M C, XIA X F, LIU Q, et al.Changes in microstructure, quality and water distribution of porcine longissimus muscles subjected to ultrasound-assisted immersion freezing during frozen storage[J].Meat Science, 2019, 151:24-32.
[20] 赵泽润, 邢通, 赵雪, 等.大豆分离蛋白添加量对低盐木质化鸡肉糜凝胶特性的影响[J].食品科学, 2022, 43(6):49-56.ZHAO Z R, XING T, ZHAO X, et al.Effect of addition of soy protein isolate on the gelation properties of low-salt wooden chicken breast meat batter[J].Food Science, 2022, 43(6):49-56.
[21] CUNHA L C M, MONTEIRO M L G, COSTA-LIMA B R C, et al.Effect of microencapsulated extract of pitaya (Hylocereus costaricensis) peel on color, texture and oxidative stability of refrigerated ground pork patties submitted to high pressure processing[J].Innovative Food Science &Emerging Technologies, 2018, 49:136-145.
[22] 杨玉玲, 周磊, 游远, 等.氧化对肌原纤维蛋白热诱导凝胶质构特性及保水性的影响[J].中国农业科学, 2018, 51(18):3570-3581.YANG Y L, ZHOU L, YOU Y, et al.The effects of oxidation on textural properties and water holding capacity of heat-induced myofibrillar protein gel[J].Scientia Agricultura Sinica, 2018, 51(18):3570-3581.
[23] CAVALLIERI A L F, DA CUNHA R L.The effects of acidification rate, pH and ageing time on the acidic cold set gelation of whey proteins[J].Food Hydrocolloids, 2008, 22(3):439-448.
[24] JONGBERG S, GISLASON N E, LUND M N, et al.Thiol-quinone adduct formation in myofibrillar proteins detected by LC-MS[J].Journal of Agricultural and Food Chemistry, 2011, 59(13):6900-6905.