芝麻香型白酒因其风味具有类似烘烤芝麻香而得名[1],其酿造过程如图1[2]所示,有着合理配料、多微共酵、泥底砖窖的工艺特点[3]。

图1 芝麻香型白酒酿酒过程流程图[2]
Fig.1 Flow chart of the brewing process of sesame-flavored Baijiu[2]
在白酒生产这种固态发酵的环境体系中,酵母与细菌对酒精发酵与风味物质的形成起着至关重要的作用[4]。比如毕赤酵母属是芝麻香型、酱香型、浓香型等白酒发酵过程中的主要功能酵母属[5],其产生的某些代谢物可以对固态发酵体系中其他微生物的生长形成一定的促进或抑制作用,因此其对酿造微生态中菌群演替具有调控作用[6]。而酒糟是白酒酿造过程中重要的副产物,有着相对较高的产量以及丰富的营养成分,其在白酒、饲料等行业作为一种优质的生物质资源运用广泛,在目前国家可持续发展的提倡号召下,酒糟的利用已成为一个新的研究热点[7-8]。由于发酵原料种类及原料比例、生产工艺各不相同,造成了固态法发酵白酒产生的酒糟中营养成分种类与含量千差万别[9]。酒糟中有着丰富的酸性物质以及纤维素,将其与新鲜原料混合使用,能够使新原料的淀粉被充分稀释,使得发酵过程更加平衡[10]。李小龙[11]通过关联分析揭示酒醅理化因子对微生物群落结构演变的解释率,表明酸度在芝麻香型白酒发酵的前5 d是群落演替最关键推动力。在产酒阶段,起始酸度通过影响酒醅理化指标和微生物群落的变化来推动发酵进行,其中以酵母真菌群落变化最为明显,且适宜的起始酸度可提高原料的淀粉出酒率并提升白酒风味,将酒糟添加到高粱中进行堆积发酵可以为微生物生长提供较好的酸性环境,对其风味物质的形成有一定的促进作用[12]。
综合目前国内外研究发现,将添加酒糟与高梁混合堆积的方法用于芝麻香型白酒的酿造中的研究较少,对加入酒糟后芝麻香型白酒中主要微生物的相互作用也尚不明确,同时,对糟醅堆积发酵过程中风味物质的调控以及该过程中生物降酸的现象也没有很好的解释。本文通过取样测序确定芝麻香型白酒中的主要微生物,以纯菌复配固态发酵的形式,研究在酒糟添加前后,糟醅在堆积发酵不同阶段下微生物数量、理化指标以及挥发性成分的变化,同时对酒糟的比例进行了进一步探究。
1 材料与方法
1.1 材料
1.1.1 原料
高粱、稻壳、酒糟均取自江苏玉祁酒业有限公司,取回后真空密封,酒糟放在-20 ℃冰箱保存。其中酒糟为该酒厂芝麻香型白酒中层发酵酒醅经蒸馏之后的样品。
1.1.2 主要试剂
乳酸、乙酸、乙醇、亚铁氰化钾等试剂(分析纯),国药集团化学试剂有限公司;白酒36组分混标、2.0%乙酸正丁酯溶液(内标),兰州东立龙信息技术有限公司;酵母浸出粉葡萄糖琼脂培养基,海博生物技术有限公司。
1.2 仪器与设备
SPX-250B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;SORVALL-ST-16 R型超高速冷冻离心机,赛默飞世尔科技有限公司;GC-2010 Plus型气相色谱仪,日本SHIMADZU公司;SW-CJ-2 FD型超净工作台,苏州净化气团安泰公司;1260 infinity液相色谱仪, Agilent科技有限公司。
1.3 实验方法
1.3.1 酒醅取样测序
取样位置分为上中下3层,上层取样点(距窖顶0.4 m处)、中层取样点(距窖顶1 m处)、下层取样点(距窖顶1.5 m处)。取样时使用取样器通过取样口直接插入酒醅进行取样,取出后封上封口泥,盖好蒙布,踩好窖。将取完的酒醅样品混合均匀进行分装。
通过扩增子测序技术分析发酵过程中微生物群落结构。将酒醅样品使用自封袋分装后采用低温转运的方式委托上海派森诺生物科技有限公司进行Illumina NovaSeq 高通量测序。对于真菌,取酒厂发酵0 d(入池前)、1、5、10 d酒醅样品,选用ITS3/ITS4引物对 ITS2区域进行扩增;对于细菌,取酒厂发酵0 d(入池前)、5、10、20 d酒醅样品,选用338 F/806R对16S rRNA的V3~V4区域进行扩增。
1.3.2 菌株活化
本研究使用菌株:酿酒酵母(Saccharomyces cerevisiae YJ1)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii JM6),枯草芽孢杆菌(Bacillus subtilis YB-3)、副干酪乳杆菌(Lacticaseibacillus paracasei RS-14)均来源于江苏省玉祁酒业芝麻香型白酒酒醅中,由本实验室保存。芽孢杆菌使用LB培养基活化,37 ℃、200 r/min摇床培养1 d;乳酸菌使用MRS培养基活化,37 ℃静置培养3 d,酵母菌使用YPD培养基活化,30 ℃、200 r/min摇床培养2 d。
1.3.3 实验室模拟发酵
1.3.3.1 润粮及蒸粮
取粉碎的高粱,加入原料质量70%的70 ℃的蒸馏水,混匀,保鲜膜密封后润粮1 h 40 min,再加入高梁质量10%的稻壳,混匀,继续润粮20 min后再蒸粮40 min。
1.3.3.2 堆积发酵及取样
将高粱摊晾,添加与高梁同等质量的酒糟,混匀后按照不同的组别进行菌液接种。按照100 mL/kg糟醅的比例进行酶液的添加,再次混匀后将糟醅分装至高30 cm的堆积罐,放入30 ℃恒温培养箱堆积48 h,在24 h时进行一次翻混。堆积结束之后,将糟醅混匀,入罐发酵,保持无氧条件,放入30 ℃培养箱发酵30 d。定时取样,混匀后放入-70 ℃冰箱保存。
接种组合采用单S.cerevisiae发酵(sc)、单P.kudriavzevii发酵(pi)、两种酵母共同发酵(sc+pi)以及两种酵母与两种细菌共同发酵(hj)的形式进行,如表1所示。
表1 接种组合及初始接种量 单位:CFU/g
Table 1 Vaccination combination and initial inoculation amount

菌种scpisc+pihjSaccharomyces cerevisiae YJ1106106106106Pichia kudriavzevii JM6--106106Bacillus subtilis YB-3---106Lacticaseibacillus paracasei RS-14---106
注:-表示对应组合下该菌种的初始接种量为0。
1.3.3.3 酶液配制
取适当的原酶溶液(酶活力为2.6×105 U/mL)用10%(体积分数)pH=4.6的醋酸-醋酸钠溶液定容至100.0 mL。
1.3.4 理化指标[13-14]及微生物数量测定
堆积阶段的取样时间点为0、12、24、36、48 h;入罐发酵阶段取样时间点为1、3、5、7、12、15、20、25、30 d。微生物数量及理化指标测完后留样放入-70 ℃冰箱留存。
微生物数量根据T/CBJ 004—2018固态发酵酒醅通用分析方法进行测定。
1.3.5 乳酸含量检测[15]
采用HPLC方法进行检测。HPLC条件如下所示:使用流动相为pH 2.5的30 mmol/L磷酸二氢钠溶液,流速1 mL/min,检测波长210 nm,柱温30 ℃,进样体积20 μL。乳酸标准曲线:y=511 x+20.348, R2=0.999 5。
1.3.6 有机代谢物质的测定[16-17]
1.3.6.1 酒醅预处理
取10.0 g酒醅,35 mL的80%乙醇及70 μL内标乙酸正丁酯溶液,混匀后,超声波处理30 min,4 ℃下10 000 r/min离心10 min。用0.22 μm有机滤膜过滤上清液到棕色气相瓶,放在4 ℃冰箱保存。
1.3.6.2 气相色谱分析条件
LZP-930色谱柱(长度30 m×内径0.32 mm;df:1 μm);进样口温度220 ℃,FID检测器温度230 ℃;升温程序为:50 ℃保持6 min,再以5 ℃/min的速度升温至200 ℃,保持10 min;进样量为0.3 μL,分流比为10,载气为高纯氮气,尾吹流量30 mL/min,氢气流量40 mL/min,空气流量400 mL/min。
1.3.6.3 物质的相对定量
本次定量采用内标定量法。计算如公式(1)、公式(2)所示:
(1)
(2)
式中:Ai为混标中测定物质的峰面积;Cn为混标中内标的峰面积;An为混标中内标的峰面积;Ci为混标中测定物质的已知浓度;Ki为测定物质的相关常数系数;![]() 为样品中待测样品的峰面积;
为样品中待测样品的峰面积;![]() 为待测物质相对含量,μg/g酒醅;
为待测物质相对含量,μg/g酒醅;![]() 为内标的质量浓度,
为内标的质量浓度,![]() 为样品中内标的峰面积;3.507为每克酒醅中萃取的样品体积数,mL/g酒醅。
为样品中内标的峰面积;3.507为每克酒醅中萃取的样品体积数,mL/g酒醅。
1.4 数据分析
通过simca 14.1进行正交偏最小二乘法判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),计算预测变量重要性投影(variable importance in projection,VIP);通过origin 2023b整理数据并绘制热图;利用SPSS 25软件进行显著性差异分析。
2 结果与分析
2.1 芝麻香型白酒主要微生物的确定
将平均相对丰度>1%的属定义为优势微生物,平均相对丰度>10%的属定义为绝对优势微生物。微生物群落结构的变化规律如图2所示。

a-真菌;b-细菌
图2 发酵过程菌落结构(属水平)分析
Fig.2 Analysis of colony structure (genus level) during fermentation
由测序结果分析得到优势微生物中真菌属有7个,细菌属有8个。由图2-a可知在发酵前期真菌属中Picha、Saccharomyces是绝对优势微生物,由图2-b可知细菌属中在发酵前期的绝对优势微生物为Bacillus、在发酵中后期Lactobacillus占据了主导地位,为主要绝对优势微生物。因此,在后续实验中,分别选取Picha、Saccharomyces、Bacillus、Lactobacillus中的一株菌通过不同的复配方式进行模拟固态发酵实验。
2.2 添加酒糟进行不同菌种复配固态发酵
2.2.1 加入酒糟前后单菌与混菌堆积过程中微生物数量及酸度变化
利用模拟芝麻香型白酒固态发酵工艺的方法,在纯高粱样品以及添加了同等质量酒糟的高梁样品中分别进行接菌。以单S.cerevisiae发酵(sc)、单P.kudriavzevii发酵(pi)、单Bacillus subtilis发酵(bac)、单 Lacticaseibacillus paracasei发酵(lab)以及4种菌混合发酵的方式分别进行堆积发酵实验,其堆积过程中微生物数量变化以及酸度变化如图3所示。

a-单菌堆积阶段各微生物数量变化;b-单菌堆积阶段酸度变化;c-混菌堆积阶段各微生物数量变化;d-混菌堆积阶段酸度变化
图3 加入酒糟前后单菌与混菌堆积过程中微生物数量及酸度变化
Fig.3 Changes in the number of microorganisms and acidity during the accumulation of single bacteria and mixed bacteria before and after adding distiller′s grains
由图3-a可知,在堆积阶段,酒糟的加入对单独发酵的4株菌的初始数量以及堆积结束的数量都有不同程度的影响。在加入酒糟后,S.cerevisiae堆积结束的菌体量由(8.42±0.13) lg CFU/g酒醅下降至(8.08±0.11) lg CFU/g酒醅,B.subtilis堆积结束的菌体量由(8.29±0.07) lg CFU/g酒醅下降至(7.53±0.10) lg CFU/g酒醅,而从P.kudriavzevii与L.paracasei堆积结束后的数量来看,其在酒糟加入前后变化较小,说明在这4株菌中,酒糟的添加对S.cerevisiae、B.subtilis抑制作用较为明显,对P.kudriavzevii、Lacticaseibacillus paracasei的数量只是在堆积前期有所抑制,堆积结束后依然能达到和纯高粱发酵样品中相近的菌体量。由图3-b可知,加入酒糟后的初始酸度相较于纯高粱样品有了大幅提高,而初始酸度的升高可能是导致堆积过程中菌体数量受到抑制的原因,推测S.cerevisiae、B.subtilis相对于其他两株菌来说其耐酸能力较弱,此外,可以从图3明显看出,在酒糟添加后,P.kudriavzevii单菌堆积过程中酸度有较大幅度的下降,由(2.10±0.25) mmol NaOH/10 g酒醅降低至(0.95±0.43) mmol NaOH/10 g酒醅,说明P.kudriavzevii在酒糟加入后起到了一定的降酸作用。
从图3-c混菌发酵的结果来看,酒糟的加入也对混菌发酵中4株菌的初始数量有抑制作用,但与单菌培养时相比不同的点是S.cerevisiae与B.subtilis在堆积结束后的数量要高于其单菌堆积的数量,结合图3-d的酸度变化来看,可能是由于混菌发酵使酒糟样品酸度下降,减少了对S.cerevisiae与B.subtilis的抑制作用。
2.2.2 酒糟添加后挥发性物质OPLS-DA分析
OPLS-DA是一种将数据可视化的分析方法,通过数据之间的相关性来量化样品之间的差异程度。模型对X和Y矩阵的解释率用R2X和R2Y表示,模型的预测能力用Q2表示,R2和Q2越靠近1.0,说明模型的拟合性越好[18]。以挥发性组分作为因变量,不同组别作为自变量,通过OPLS-DA,可以实现在添加酒糟后不同组合微生物对挥发性成分的有效区分。经过200次置换检验,如图4-a所示,Q2回归线与纵轴的相交点小于0,说明模型不存在过拟合,模型验证有效,认为该结果可用于不同微生物组合产生的挥发性成分分析[19]。
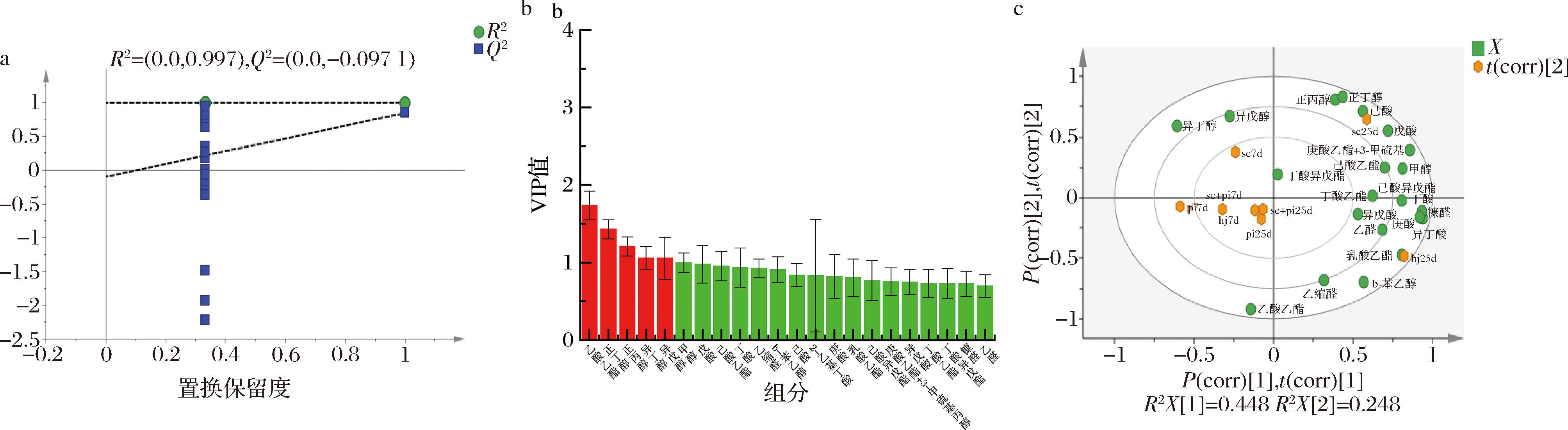
a-置换检验图;b-基于OPLS-DA模型分析的VIP预测值分布图;c-基于OPLS-DA模型分析的得分图
图4 酒糟加入后不同发酵组合挥发性成分OPLS-DA分析图
Fig.4 OPLS-DA analysis of volatile components of different fermentation combinations after the addition of distiller's grains
VIP值常用作OPLS-DA模型关键变量分析,VIP值越大,说明贡献率越大。各关键组分的VIP值结果见图4-b,其中VIP值>1的挥发性成分有乙酸乙酯、正丁醇、正丙醇、异丁醇、异戊醇。
结合表2可知,与sc相比,sc+pi组中乙酸乙酯含量在发酵第7天和第25天分别增加了(72.4±2.33) mg/L和(113.43±0.86) mg/L,正丁醇的含量分别减少了(1.04±0.03) mg/L和(1.43±0.87) mg/L,正丙醇的含量分别减少了(8.97±0.56) mg/L和(7.88±0.58) mg/L,说明P.kudriavzevii与S.cerevisiae共同发酵具有高产乙酸乙酯与低产正丙醇与正丁醇的作用;同理,与sc+pi相比,hj组中异丁醇含量在发酵第7天和第25天分别减少了(3.69±1.32) mg/L和(5.99±0.50) mg/L,异戊醇含量分别减少了(7.33±0.67) mg/L和(9.30±2.33) mg/L,说明这两株细菌与酵母共培养具有降低异丁醇与异戊酵含量的效果。
表2 不同组合中VIP值大于1的5种风味物质在糟醅发酵7 d与25 d时的含量 单位:mg/L
Table 2 Contents of five flavor compounds with VIP value greater than 1 in different combinations fermented on 7 days and 25 days after fermentation

成分sc(7 d)sc+pi(7 d)hj(7 d)sc(25 d)sc+pi(25 d)hj(25 d)乙酸乙酯17.30±0.88b89.70±3.21a87.20±4.29a15.87±1.12b129.3±1.98c121.90±2.44c正丁醇 2.21±0.14a1.17±0.11b2.24±0.58a4.21±0.21c2.78±1.08a3.21±0.22ac正丙醇 14.80±1.21a8.33±0.65b10.20±1.09b23.20±0.19c15.32±0.77a19.20±0.45ac异丁醇 19.20±0.88a19.89±1.44a16.2±2.76b23.21±0.39c24.20±1.39c18.21±0.89b异戊醇 39.10±1.67b38.43±2.01b31.10±1.34a43.49±1.11b42.11±2.98b32.81±0.66a
注:同一行数据上标不同字母表示差异显著(P<0.05)。
2.3 对P.kudriavzevii降低堆积糟醅酸度现象的探究
按照酒糟与高梁的比例为1∶1时的酸度,设置酸度为0.50~2.50 mmol NaOH/10 g酒醅。分别用乳酸和乙酸将高粱醅设置成3个梯度:rs1、rs2、rs3;ys1、ys2、ys3,将P.kudriavzevii接入到高粱醅中进行单菌固态培养,其酒醅堆积过程中的酸度变化、乙酸乙酯变化、乳酸含量变化以及菌体量变化如图5所示。

a-堆积过程酸度变化;b-堆积过程乙酸乙酯含量变化;c-乳酸含量变化;d-堆积过程P.kudriavzevii菌体量变化
图5 堆积醅中酸度、乙酸乙酯、乳酸含量以及菌体数量变化
Fig.5 Changes in acidity, ethyl acetate, lactic acid content, and number of cells in the stacked paste
由图5-a可知,堆积结束后rs1、rs2、rs3 3个堆积醅样品的酸度都有较为明显的下降,而添加乙酸的ys1、ys2、ys3 3个样品堆积结束之后酸度变化幅度较小(<0.2 mmol NaOH/10 g酒醅),结合图5-c的乳酸含量变化情况,推测糟醅中酸度下降是由于P.kudriavzevii降解了糟醅体系中的乳酸。DENG等[20]研究指出在液态发酵中乳酸可以通过乳酸脱氢酶转化为丙酮酸,P.kudriavzevii通过丙酮酸代谢途径增强了乳酸脱氢酶相关基因的转录,将高浓度的乳酸降解为丙酮酸,P.kudriavzevii在固态发酵可能中也有相似的作用。
白酒发酵过程中乙酸酯的形成是由丙酮酸氧化脱羧为乙酰辅酶A,乙酰辅酶A在醇酰基转移酶(alcohol acyltransferase,AATase)的作用下与醇合成乙酸酯[21],结合图5-b,堆积结束后乙酸乙酯的含量随着乳酸含量的增多而增多,推测是P.kudriavzevii将一定量的乳酸降解为丙酮酸后,发酵体系中存在较多的丙酮酸从而促进了乙酸酯的合成。从图5-d可以看出,在堆积结束后,在3个不同的乳酸梯度下P.kudriavzevii的菌体量都很接近,而在ys2、ys3的乙酸梯度下P.kudriavzevii的菌体量都受到了不同程度的抑制,推测在该实验酸度区间下,P.kudriavzevii对乳酸的耐受性高于对乙酸的耐受性。
2.4 在纯高粱及不同酒糟比例下混菌发酵实验探究
在纯高粱(gl)中以及酒糟与高梁质量比为2∶1、1∶1、1∶2、1∶3的条件下依次接入混菌后进行堆积发酵实验,测其堆积发酵过程中的淀粉、酸度、酒精含量以及菌体量的变化,结果如图6所示。

a-发酵过程淀粉含量与淀粉利用率;b-堆积过程酸度及菌体数量;c-发酵过程酒精含量及菌体数量
图6 不同酒糟与高梁比例堆积发酵过程中的淀粉、酸度、酒精含量以及菌体量的变化
Fig.6 Changes in starch, acidity, alcohol content and bacterial mass during fermentation with different ratios of distiller′s grains and sorghum
由图6-a可以看出淀粉含量在发酵前期迅速下降,在发酵15 d后趋于平缓。整个发酵期间,1∶1比例样品淀粉利用率始终最高,在发酵结束淀粉利用率为71.32%,而纯高粱样品与2∶1样品淀粉利用率都较低,在发酵结束时都在55%以下。结合图6-b、图6-c来看,2∶1比例样品菌体数量明显低于其他4个样品,可能是由于酸度过高抑制了其菌体的生长代谢,从而使淀粉利用率过低。而纯高粱样品堆积阶段酸度最低,其堆积过程中菌体生长速度要高于加酒糟的4个样品。从酒醅中酒精含量来看,当酒糟与高梁比例为2∶1时其发酵酒醅中酒精含量出现明显下降,1∶1、1∶2、1∶3样品与纯高粱样品在发酵后期酒精含量没有太大的差异。
将堆积结束(A)、发酵7 d(B)、与发酵30 d(C)的不同比例样品挥发性成分含量进行热图绘制。如图7所示,2∶1比例样品中由于微生物数量较少,其代谢产生的酯类与醇类物质含量在堆积与发酵阶段都较少,而gl样品可能是由于缺少酒糟的添加,其酸类与酯类的含量与1∶1、1∶2、1∶3这3个加入酒糟进行发酵的样品相比而言都较低。根据热图分析结果,1∶1比例样品酯类、醇类与酸类物质最为丰富。因此,结合图6与图7,可以看出,当酒糟与高粱比例为1∶1时进行堆积发酵,其淀粉利用率最高,同时挥发性风味物质也最为丰富。
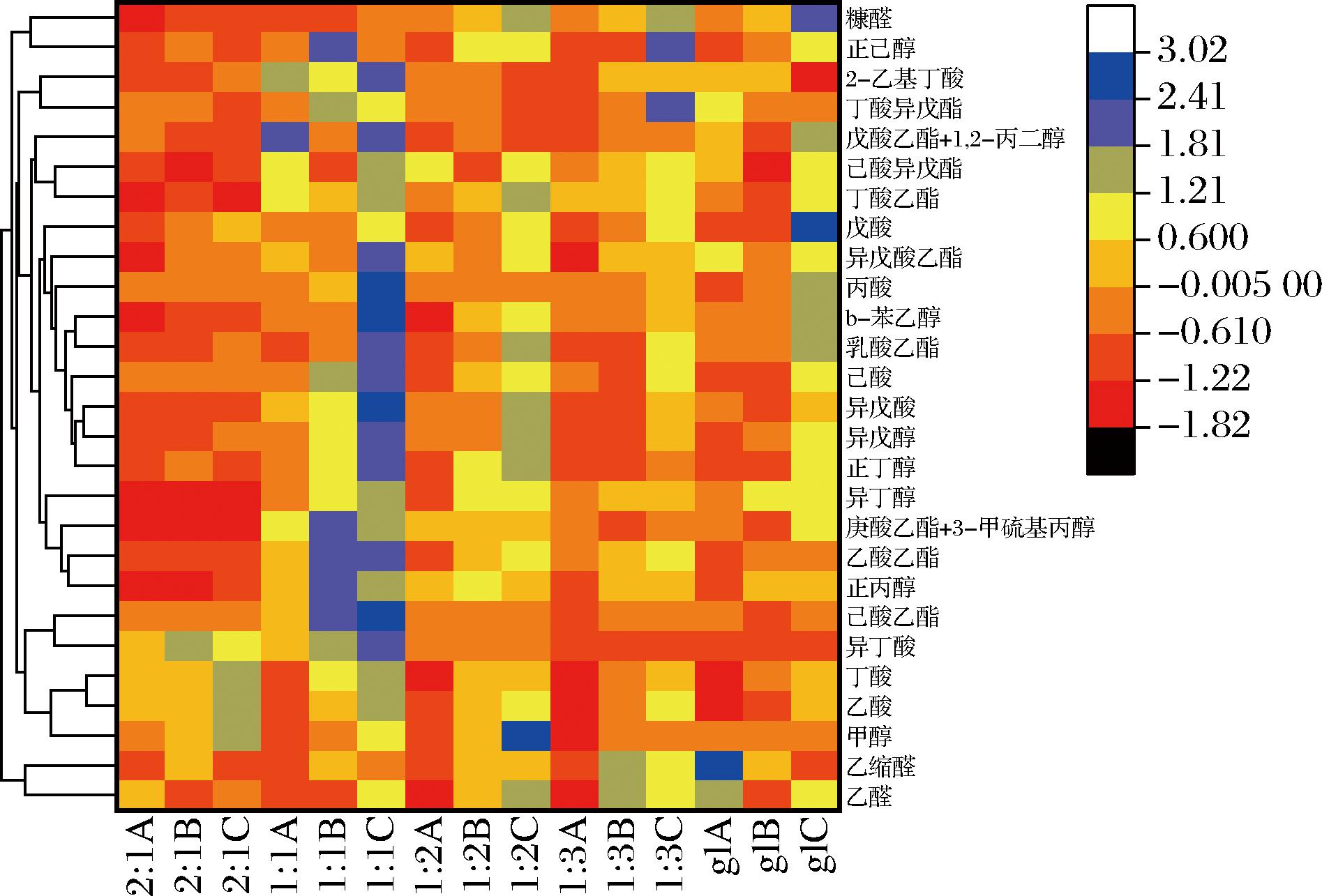
图7 不同酒糟与高梁比例堆积发酵过程中挥发性风味成分热图
Fig.7 Heat map of volatile flavor components during fermentation with different ratios of distiller′s grains and sorghum
注:A为堆积结束;B为发酵7 d;C为发酵30 d;gl为纯高粱堆积发酵样品。
3 结论与讨论
近年来,对于发酵酒糟再次利用的研究越来越多,但在芝麻香型白酒中的应用较为缺乏。本研究首先通过测序确定芝麻香型白酒主要微生物,加入酒糟进行堆积发酵,研究其发酵糟醅中微生物对于理化指标以及风味物质的影响。经过纯菌模拟发酵后可知,与纯高粱样品相比,酒糟的添加对S.cerevisiae、B.subtilis抑制作用较为明显,对P.kudriavzevii、L.paracasei的数量只是在堆积前期有所抑制,堆积结束后依然能达到和纯高粱发酵样品中相近的菌体量;通过OPLS-DA分析表明乙酸乙酯、正丁醇、正丙醇、异丁醇、异戊醇是添加酒糟后的不同组别间重要挥发性风味成分(VIP值>1),并且通过添加乳酸实验初步指出了糟醅酸度下降的原因是由于P.kudriavzevii对乳酸有降解作用,酸度降低的同时提高了乙酸乙酯的含量;与纯高梁发酵对比可以看出酒糟的加入对风味物质的丰富程度有明显提升,并且通过不同糟醅比发酵实验确定当酒糟与高梁比例为1∶1时其发酵酒醅的淀粉利用率最高(71.32%)且风味物质最为丰富。因此,本研究明确了加入酒糟后芝麻香型白酒中主要微生物的作用以及相对于纯高粱发酵时的变化,同时,对糟醅堆积发酵过程中风味物质的调控以及该过程中酸度的调控也进行了新的尝试和探索。
[1] ZHENG Y, SUN B G, ZHAO M M, et al.Characterization of the key odorants in Chinese Zhima aroma-type Baijiu by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission studies[J].Journal of Agricultural and Food Chemistry, 2016, 64(26):5367-5374.
[2] 岳腾飞, 程伟, 张杰, 等.芝麻香型白酒的酿造生产及其工艺创新研究进展[J].酿酒, 2018, 45(2):6-10.YUE T F, CHENG W, ZHANG J, et al.Research progress on brewing and technological innovation of sesame flavor liquor[J].Liquor Making, 2018, 45(2):6-10.
[3] 高传强. 芝麻香型白酒的典型工艺特征[J].酿酒, 2022, 49(2):3-15.GAO C Q.Typical technological characteristics of sesame flavor Baijiu:A review[J].Liquor Making, 2022,49(2):3-15.
[4] 曹润洁, 何宏魁, 葛向阳, 等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报, 2019, 46(6):1371-1380.CAO R J, HE H K, GE X Y, et al.Change of microbial community during stacking fermentation of sesame-flavor Jiupei[J].Microbiology China, 2019, 46(6):1371-1380.
[5] DOUGLASS A P, OFFEI B, BRAUN-GALLEANI S, et al.Population genomics shows no distinction between pathogenic Candida kru sei and environmental Pichia kudriavzevii:One species, four names[J].PLoS Pathogens, 2018, 14(7):e1007138.
[6] YOU L, ZHAO D, ZHOU R Q,et al.Distribution and function of dominant yeast species in the fermentation of strong-flavor Baijiu[J].World Journal of Microbiology & Biotechnology, 2021, 37(2):26.
[7] HUANG X N, FAN Y, LU T, et al.Composition and metabolic functions of the microbiome in fermented grain during light-flavor Baijiu fermentation[J].Microorganisms, 2020, 8(9):1281.
[8] 张彬, 武金华, 陈建文, 等.芝麻香型白酒丢糟的再利用研究[J].酿酒, 2012, 39(4):50-52.ZHANG B,WU J H,CHEN J W, et al.Research on the reuse of distiller’s grains from sesame flavor liquor making[J].Liquor Making.2012, 39(4):50-52.
[9] 卢皓, 田金平, 吕一铮, 等.白酒酿造固体废弃物资源化利用新进展[J].环境工程, 2022, 40(11):231-236;250.LU H,TIAN J P,LV Y Z,et al.Review on research progress of resource recovery Baijiu distiller′s grain[J].Environmental Engineering, 2022, 40(11):231-236;250.
[10] 王鹏晓, 肖进彬, 刘晓杰, 等.白酒酒糟资源化利用现状及展望[J].现代食品, 2022, 28(17):1-4.WANG P X, XIAO J B, LIU X J, et al.Status and prospect of resource utilization of Baijiu distiller’s grains[J].Modern Food, 2022, 28(17):1-4.
[11] 李小龙. 芝麻香型白酒发酵过程微生物群落演替及其驱动因素[D].无锡:江南大学, 2018.LI X L.Microbial community succession and its drivers during roasted sesame-flavor liquor fermentation[D].Wuxi:Jiangnan University, 2018.
[12] 姚亚林. 酸度对白酒固态发酵产酒的影响[D].自贡:四川轻化工大学,2021.YAO Y L.Effect of acidity on liquor production by solid-state fermentation[D].Zigong:Sichuan University of Science &Engineering, 2021.
[13] YAN S B, WANG S C, WEI G G, et al.Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J].Journal of the Institute of Brewing, 2015, 121(1):145-154.
[14] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社, 2015.SHEN Y F.Complete Book of Liquor Production Technology[M].Beijing:China Light Industry Press, 2015.
[15] 熊君燕, 李小东, 谢圣凯,等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报, 2017, 44(8):1767-1776.XIONG J Y,LI X D,XIE S K,et al.Interaction between lactic acid bacteria and yeasts in light-aroma liquor[J].Microbiology China,2017, 44(8):1767-1776.
[16] 曹云刚, 马丽, 杜小威, 等.汾酒酒醅发酵过程中有机酸的变化规律[J].食品科学, 2011, 32(7):229-232.CAO Y G, MA L,DU X W, et al.Variation of organic acids in fermented grains during fermentation of Fen liquor[J].Food Science, 2011, 32(7):229-232.
[17] ZHI Y, WU Q, DU H, et al.Biocontrol of geosmin-producing Streptomyces spp.by two Bacillus strains from Chinese liquor[J].International Journal of Food Microbiology, 2016, 231:1-9.
[18] 邵淑贤, 徐梦婷, 林燕萍, 等.基于电子鼻与HS-SPME-GC-MS技术对不同产地黄观音乌龙茶香气差异分析[J].食品科学, 2023, 44(4):232-239.SHAO S X, XU M T, LIN Y P, et al.Differential analysis of aroma components of Huangguanyin oolong tea from different geographical origins using electronic nose and headspace solid-phase microextraction-gas chromatography-mass spectrometry[J].Food Science, 2023, 44(4):232-239.
[19] 杨学博, 陈秋翰, 刘寿春, 等. 基于气相色谱-离子迁移谱和偏最小二乘判别分析技术分析酵母-藿香复合对罗非鱼脱腥效果的影响[J]. 食品与发酵工业, 2024, 50(12):319-326.YANG X B, CHEN Q H, LIU S C, et al. Effect of yeast-Agastache Rugosus complex on deodorization of Tilapia based on gas chromatography ion mobility spectroscopy and partial least squares discriminant analysis[J]. Food and Fermentation Industries, 2024, 50(12):319-326.
[20] DENG N, DU H, XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation.[J].Journal of Agricultural and Food Chemistry,2020,68(17): 4903-4911.
[21] GUAN T W, WU X T, HOU R, et al.Application of Clostridium butyricum, Rummeliibacillus suwonensis, and Issatchenkia orientalis for Nongxiangxing Baijiu fermentation:Improves the microbial communities and flavor of upper fermented grain[J].Food Research International, 2023, 169:112885.