乙醛(CH3CHO)是一种有毒化合物,对人类有致癌性[1-2], 国际癌症研究机构已经将乙醛列为一级致癌物[3]。乙醛会破坏细胞的DNA结构,诱导基因突变,甚至引起染色体重排[4-5]。此外,乙醛的积累会损伤视网膜微血管以及阻碍葡萄糖代谢[6]。在酿酒发酵和燃料(香烟、柴油和丁醇等)燃烧过程中会产生乙醛[7-8],因此,乙醛也成为评估食品安全和空气环境质量的重要指标之一。迄今为止已经开发出多种方法用于乙醛的检测。最常用的方法为HPLC和GC检测,其最高精度能够达到0.005 mg/L[9]。但是,色谱法具有繁琐、耗时费力等缺点,阻碍其在乙醛实时检测中的应用。生物传感器测定方法具有操作简单、灵敏度高和稳定性好等特点,近年来已广泛应用于环境监测、食品安全和医疗诊断等领域的有毒化合物分析[10]。
乙醛脱氢酶(acetaldehyde dehydrogenase, ALDH)是一类重要的氧化还原酶,主要参与醛类与酸类物质的相互转化,能够在 NAD(P)+存在的条件下催化有毒的乙醛脱氢生成无毒的乙酸[11]。目前,已在动植物和微生物内鉴定和表达多种乙醛脱氢酶[12-17]。PENG等[18]从热带假丝酵母(Candida tropicalis)LBBE-W1中鉴定出一种新的乙醛脱氢酶,经过突变筛选后酶活力得到提升,在已报道的乙醛脱氢酶中,该乙醛脱氢酶突变体具有最高酶活力。微生物细胞表面展示作为一种能够在细胞表面展示多肽和蛋白质的技术,是提高酶的生物活性、稳定性以及实现成本效益的有效策略[19],已成功用于生物传感器的构建[20]。微生物表面展示的主要宿主包括噬菌体、细菌、酿酒酵母和枯草芽孢杆菌芽孢等,但是上述宿主载体存在各自的不足与缺陷[21-23]。
酿酒酵母作为一种安全菌株,其在营养匮乏的条件下会形成4个单倍体的孢子[24]。酿酒酵母孢子壁具有4层结构(由内而外分别为甘露糖层、葡聚糖层、壳聚糖层和二酪氨酸层)。由于孢子的特殊结构,与信号肽Spr1(来源于酿酒酵母产孢特异性的外切β-葡聚糖酶)融合表达的可溶性蛋白或酶[25],能被分泌至孢子壁的二酪氨酸层和壳聚糖层之间[26-27],形成孢子 “微胶囊”(图1),并且osw2Δ孢子由于二酪氨酸层更为疏松,催化活性比野生型孢子更高[25-27]。
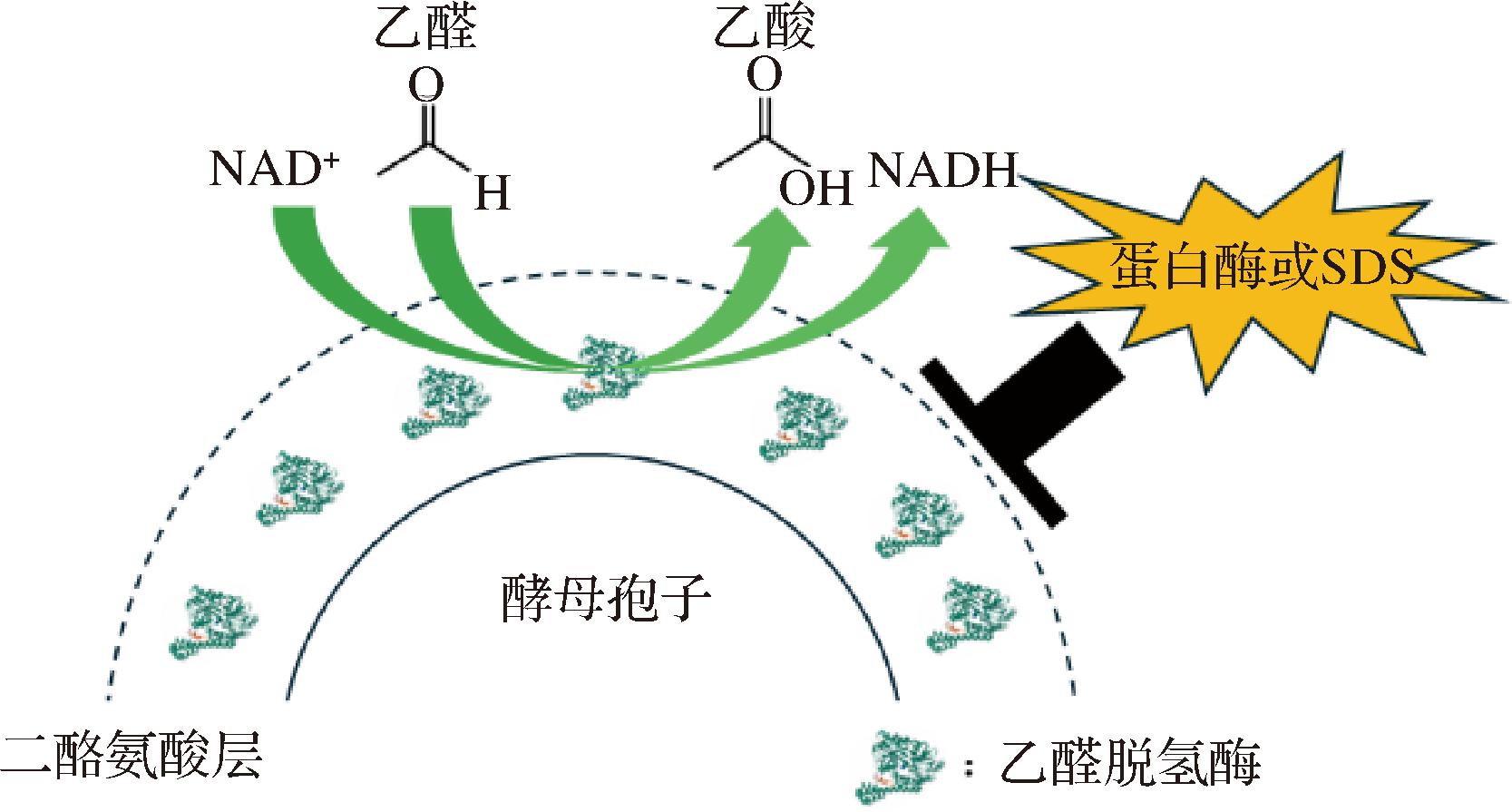
图1 酿酒酵母“微胶囊”示意图
Fig.1 Schematic diagram of “microcapsules” of S.cerevisiae spores
本研究采用酿酒酵母osw2Δ孢子“微胶囊”表面展示C.tropicalis LBBE-W1来源的乙醛脱氢酶突变体,将其作为生物传感器,构建一种新颖的检测乙醛的方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本研究中所使用的质粒扩增菌株为大肠杆菌(Escherichia coli) DH5α,蛋白表达菌株为枯草芽孢杆菌(Bacillus subtilis)WB800,酿酒酵母(Saccharomyces cerevisiae)HW83(osw2Δ)是快速产孢的SK-1背景菌株,以上菌株均保藏于本实验室;研究中所使用和构建的菌株和质粒如表1和表2所示,所用引物均由苏州金唯智生物科技有限公司合成,引物如表3所示。
表1 本研究所使用的菌株
Table 1 Strains used in this study

菌株描述来源E.coli DH5αlacZΔM15 hsdR recA本实验室B.subtilis WB800TrpC2nprE aprE epr bpr mpr nprB,EmR本实验室S.cerevisiae HW83(osw2Δ)MATα/MATa ARG4/arg4-NspI his3ΔSK/his3ΔSK ho::LYS2/ho::LYS2 leu2/leu2 lys2/lys2 RME1/rme1::LEU2 trp1::hisG/trp1::hisG ura3/ura3 osw2Δ::his5+/osw2Δ::his5+本实验室B.subtilis WB800/ALDHB.subtilis WB800 含有质粒 pP43 NMK-P43-aldh本研究 B.subtilis WB800/对照B.subtilis WB800含有质粒 pP43 NMK-P43本研究 osw2Δ/ALDH酿酒酵母osw2Δ菌株含有质粒 pRS306-PTEF1-aldh-3HA本研究 osw2Δ/ALDH-GFP酿酒酵母osw2Δ菌株含有质粒pRS306-PTEF1-aldh-gfp本研究
表2 本研究所使用的质粒
Table 2 Plasmids used in this study

质粒描述来源pP43 NMK-P43pP43 NMK载体含有 P43 启动子本实验室pP43 NMK-P43-aldhpP43 NMK-P43含有C端融合6×His的aldh基因本研究 pRS306-PTEF1-ss-3×HApRS306载体含有N端信号肽ss、TEF1 启动子、ADH1 终止子和 3×HA标签本实验室pRS426-PTEF1-ss- gfppRS426载体含有N端信号肽ss、TEF1 启动子、ADH1 终止子和 gfp基因本实验室pRS306-PTEF1-ss-aldh-3×HApRS306-PTEF1-3×HA 含有aldh基因本研究 pRS306-PTEF1-ss-aldh-gfppRS306-PTEF1-aldh-3×HA含有gfp基因本研究
表3 本研究使用的引物
Table 3 Primers used in this study

引物序列 (5'→3')P43-FGAGATTTTTTTGAGCAACTGGATCCTGATAGGTGGTATGTTTTCGCTTGP43-RAGTGTACATTCCTCTCTTACCTATAATGGTACCGCTATCACTTpP43-ALDH-FGTAAGAGAGGAATGTACACTATGTTTAAAAAGGCTTTGCCATTpP43-ALDH-RGCTATGACCATGATTACGC-CAAGCTTTCATCTTAATGGTGATGGTGATGATGTGGCAATGGATTCAATTTCATpRS306-ALDH-FCCCAAGCTTATGTTTAAAAAGGCTTTGCCATpRS306-ALDH-RCCGCTCGAGTGGCAATGGATTCAATTTCATTCALDH-GFP-FTGAAATTGAATCCATTGCCACTCGAGATGGTGAGCAAGGGCGAGGAALDH-GFP-RACTAAAGGGAACAAAAGCTGGGTACCCCGGTAGAGGTGTGGTCAATAAGAGALDH-(GFP)-RTCCTCGCCCTTGCTCACCATCTCGAGTGGCAATGGATTCAATTTC
1.1.2 酶、试剂和设备
限制性内切酶(BamH I、HindI II、Xho I和Stu I)、DNA 聚合酶、蛋白Marker (Blue Plus II)、DNA Marker (1 kb plus、DL2000)、Ligation-Mix连接酶,宝生物工程(大连)有限公司;辅酶NAD+、NADH、质粒抽提及纯化试剂盒、抗生素,生工生物工程(上海)股份有限公司;抗-HA-鼠、抗-鼠-HRP,全式金生物技术有限公司;藤黄节杆菌溶壁酶 (Arthrobacter luteus lyticase),Sigma-Aldrich公司;乙醛等其他试剂,国药集团化学试剂有限公司。
JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;PowerPacTMHC蛋白电泳仪,Bio-Rad 公司;synergy H4多功能酶标仪,美国伯腾仪器有限公司;DS-Ri2共聚焦荧光显微镜,Nikon 公司;FD-100冷冻干燥机,EYELA公司。
1.1.3 培养基
LB 培养基(g/L):胰蛋白胨 10,氯化钠 10,酵母提取物5,琼脂粉 20 (固体培养基);TB 培养基(g/L):胰蛋白胨 12,酵母提取物 24,甘油4 mL/L,KH2PO4 2.31,K2HPO4 12.53;SD-Ura 缺陷型培养基(g/L):无氨基酸酵母氮源6.7,只缺 Ura 的氨基酸混合物粉末2,葡萄糖20,琼脂粉 20 (固体培养基);SD-Arg-Leu 缺陷型培养基(g/L):无氨基酸酵母氮源6.7,缺 Arg和Leu的氨基酸混合物粉末2,葡萄糖20,琼脂粉20(固体培养基);YPAD培养基(g/L):酵母提取物10,蛋白胨20,腺嘌呤0.03,葡萄糖20,琼脂粉 20(固体培养基);YPAce培养基(g/L):酵母提取物10,蛋白胨20,腺嘌呤0.03,乙酸钾20;产孢培养基(g/L):乙酸钾20。
1.2 实验方法
1.2.1 质粒构建
ALDH来源于C.tropicalis LBBE-W1,选用其突变体,基因序列 (1 497 bp) 由苏州金唯智生物科技有限公司合成,并根据酿酒酵母密码子偏好性进行优化。用pP43-ALDH-F/R扩增C端带有6×His的aldh基因,以实验室保存的pP43 NMK-P43为模板,用引物P43-F/R扩增出P43启动子基因,用引物P43-F和pP43-ALDH-R以P43启动子基因和aldh基因为模板进行融合PCR扩增出P43-aldh基因,经BamH I和HindⅢ双酶切后连接至pP43 NMK-P43质粒载体上,得到质粒pP43 NMK-P43-aldh。用引物pRS306-ALDH-F/R扩增出aldh基因,经Xho I和HindⅢ双酶切后连接至pRS306-PTEF1-3×HA载体上,得到质粒pRS306-PTEF1-ss-aldh-3×HA。以引物ALDH-GFP-F/R扩增出gfp基因,用引物pRS306-ALDH-F/ALDH-(GFP)-R扩增出包含gfp基因同源臂的aldh基因,用引物pRS306-ALDH-F/ALDH-GFP-R将aldh基因和gfp基因进行融合PCR获得aldh-gfp基因,经Xho I和HindⅢ双酶切后连接至pRS306-PTEF1-3×HA载体上,得到质粒pRS306-PTEF1-ss-aldh-gfp。
1.2.2 蛋白表达
用Spizizen法[28]将成功构建的质粒pP43 NMK-P43与空载质粒pP43 NMK-P43-ALDH分别转入B.subtilis WB800中获得菌株B.subtilis WB800/对照和B.subtilis WB800/ALDH,将B.subtilis WB800/ALDH接种至带有50 μg/mL卡那霉素的5 mL LB培养基中,在37 ℃、220 r/min条件下过夜培养后,以2%的接种量转接至含50 μg/mL卡那霉素的100 mL TB培养基中继续培养12 h,在7 000×g条件下离心3 min收集菌体,再用PBS(pH 7.2~7.4)清洗并离心2次后,用PBS缓冲液(pH 7.2~7.4)重悬后置于冰上进行超声至菌体完全破碎。之后,在9 000×g、30 min条件下离心获得粗酶液,并用 Ni2+亲和层析柱对重组蛋白进行纯化。以含有梯度的咪唑的Tris-HCl 缓冲液(50 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.4)洗脱重组蛋白,收集60 mmol/L咪唑和100 mmol/L咪唑Tris-HCl 缓冲液洗脱的蛋白进行超滤浓缩,并用PBS缓冲液(pH 7.2~7.4)进行脱盐,纯化后蛋白用10%(体积分数)甘油保存在-80 ℃冰箱中,SDS-PAGE用来分析蛋白的表达水平和纯度。
1.2.3 ALDH的表面展示与荧光定位
使用醋酸锂(LiAc)转化法将质粒转入酿酒酵母中,osw2Δ/ALDH-GFP菌株产孢后,用PBS缓冲液(pH 7.2~7.4)洗涤3次,并用PBS缓冲液(pH 7.2~7.4)重悬,使用荧光显微镜观察蛋白在孢子中的定位。osw2Δ/ALDH菌株产孢后使用藤黄节杆菌溶壁酶在37 ℃、220 r/min条件下反应3 h。用0.6 mmol /L NaCl缓冲液洗涤孢子2次后,进行超声破碎获得单个孢子。之后用0.5% Triton X-100在3 000×g、30 s条件下洗涤2次,冷冻干燥获得冻干纯化孢子,在-20 ℃条件下贮存待用。用蛋白提取缓冲液(0.2 mol/L 山梨醇,50 mmol/L Tris-HCl (pH 7.5),1 mmol/L EDTA)重悬20 mg孢子,加入细玻璃珠与蛋白酶抑制剂,使用冷冻研磨机破碎,在4 000×g、10 min条件下离心取上清液并测浓度,以100 μg蛋白的上样量进行Western Bloting检测。
1.2.4 ALDH的酶活力测定
反应缓冲液中包含30 μL Tris-HCl (pH 9.2, 1 mol/L)、30 μL 辅酶 NAD+ (20 mmol/L), 30 μL 乙醛溶液 (100 mmol/L),10 μL KCl (3 mol/L),3 μL β-巯基乙醇(1 mmol/L)和0.09 mg游离ALDH或4.5 mg 孢子,最后用超纯水定容至300 μL。在40 ℃下反应10 min,通过离心终止反应。使用不同质量浓度的孢子(1、2、5、10、15、20、30、40 g/L)进行反应,获得最适反应的孢子浓度。酶活力定义:在40 ℃下,每分钟 340 nm处吸光值发生0.001的数量变化定义为1个活力单位。
1.2.5 温度和pH对游离ALDH与osw2Δ孢子表面展示ALDH的影响
使用1.2.4节的反应体系,在30~90 ℃检测不同温度对游离ALDH与osw2Δ孢子表面展示ALDH的影响;对于温度稳定性的分析,以未孵育的游离ALDH与osw2Δ孢子表面展示ALDH为对照,将游离ALDH与osw2Δ孢子表面展示ALDH分别在30~90 ℃不同温度条件下孵育120 min后, 检测其残余活性。在不同pH范围(磷酸盐缓冲液(pH 6.0~7.0),Tris-HCI缓冲液(pH 7.5~9.5),Gly-NaOH缓冲液(pH 10.0~11.0),终浓度均为100 mmol/L)内检测pH对游离ALDH与osw2Δ孢子表面展示ALDH的影响;对于pH稳定性的分析,以未孵育的游离ALDH与osw2Δ孢子表面展示ALDH为对照,将游离ALDH与osw2Δ孢子表面展示ALDH分别在不同pH条件下孵育120 min后,检测其残余活性。温度与pH对游离ALDH与osw2Δ孢子表面展示ALDH影响,以最高酶活力为100%;温度与pH稳定性分析中,以未孵育的游离ALDH与osw2Δ孢子表面展示ALDH活性为100%,计算相对活性。
1.2.6 金属离子与不同底物对游离ALDH与osw2Δ孢子表面展示ALDH的影响
使用1.2.4节的反应体系,向反应体系中加入终浓度为5 mmol/L的金属离子(Na+、K+、Ca2+、Co2+、Ni2+、Cu2+、Mg2+、Mn2+和Zn2+),检测不同金属离子对游离ALDH与osw2Δ孢子表面展示ALDH的影响;向反应体系中加入终浓度为10 mmol/L的不同底物(乙醛、甲醛、乙二醛、丙醛、戊二醛、丙酮醛、水扬醛和苯甲醛),检测游离ALDH与osw2Δ孢子表面展示ALDH对不同底物的酶活力;以最高酶活力为100%计算相对酶活力。
1.2.7 osw2Δ孢子表面展示ALDH抗逆性与重复使用性研究
为检测游离ALDH与osw2Δ孢子表面展示ALDH对十二烷基硫酸钠(sodium dodecyl sulfate,SDS)耐受性,将游离ALDH与osw2Δ孢子表面展示ALDH重悬于10% SDS缓冲液中,在4 ℃条件下孵育60 min,以未处理的样品活性定义为100%。为检测游离ALDH与osw2Δ孢子表面展示ALDH对蛋白酶K耐受性,将游离ALDH与osw2Δ孢子表面展示ALDH重悬于蛋白酶K缓冲液(50 mmol/L Tris-HCl(pH 7.5)、10 mmol/L CaCl2)中,添加终浓度为8 U/mL的蛋白酶K,在37 ℃条件下反应60 min,以未处理的样品活性定义为100%。
为检测osw2Δ孢子表面展示ALDH的可重复使用性,以1.2.4节的反应体系进行反应,反应结束后,在7 000×g、10 min条件下离心收集孢子,使用PBS缓冲液(pH 7.2~7.4)洗涤3次后进行下一轮的反应,相对酶活力以第1次反应测得的酶活力为100%。
1.2.8 osw2Δ孢子表面展示ALDH对乙醛的检测研究
为检测osw2Δ孢子表面展示ALDH对乙醛的灵敏性,以1.2.4节的反应体系和不同的乙醛浓度(0~500 μmol/L)下反应,测量在340 nm处的吸光值,并进行线性拟合。
2 结果与分析
2.1 ALDH在枯草芽孢杆菌中的表达
构建pP43 NMK-P43-aldh重组质粒,其质粒图谱如图2-a所示。空载质粒pP43 NMK-P43与pP43 NMK-P43-aldh转入B.subtilis WB800中获得菌株B.subtilis WB800/对照和重组蛋白表达菌株B.subtilis WB800/ALDH。与对照菌株相比,B.subtilis WB800/ALDH在分子质量大约为55 kDa的位置上有明显的蛋白条带,证明ALDH在 B.subtilis WB800获得表达。纯化后的重组ALDH在凝胶上显示为1条约为55 kDa的单带,与理论值大小基本一致。

a-pP43 NMK-P43-aldh 质粒图谱;b-ALDH蛋白表达与纯化(M-Marker;1-对照菌株;2-重组ALDH表达菌株;3-细胞破碎后沉淀;4-细胞破碎后上清液;5-纯化后蛋白)
图2 pP43 NMK-P43-aldh质粒构建与ALDH蛋白表达纯化
Fig.2 pP43 NMK-P43-ALDH plasmid construction and ALDH protein expression and purification
2.2 ALDH在酿酒酵母孢子中的定位表达与最适孢子浓度研究
构建重组质粒pRS306-PTEF1-ss-aldh-3HA和pRS306-PTEF1-ss-aldh-gfp用于确定ALDH在酵母中的表达与定位,质粒图谱如图3-a所示。将质粒pRS306-PTEF1-ss-aldh-3HA转入osw2Δ酿酒酵母中,以未转入质粒的osw2Δ孢子作为对照,基于western bloting检测的条带在50~70 kDa(图3-b),与理论大小一致,因此证明ALDH在osw2Δ酿酒酵母孢子中正常表达。为检测ALDH在osw2Δ酿酒酵母孢子中的定位,将N端融合Spr1分泌信号肽(ss)的融合蛋白ALDH-GFP进行表达。如图3-c所示,由荧光结果可知,蛋白ALDH-GFP大部分定位在osw2Δ酿酒酵母孢子的表面,表明ALDH能够分泌并定位到osw2Δ孢子的表面。

a-质粒图谱;b-Western Bloting检测ALDH表达;c-荧光检测ALDH定位
图3 质粒构建与ALDH在osw2Δ酿酒酵母孢子表面的定位与表达
Fig.3 Plasmid construction and localization and expression of ALDH on the surface of osw2Δ S.cerevisiae spores
在确认ALDH在osw2Δ孢子的表面表达后,首先对不同孢子浓度进行研究,按照1.2.4节的反应体系,以1、2、5、10、15、20、30、40 g/L不同孢子浓度进行反应。如图4所示,在随着孢子浓度不断增加,酶活力同步增加,当孢子质量浓度高于15 g/L时,其相对酶活力增加缓慢,15 g/L的孢子质量浓度为较适反应浓度,因此选用15 g/L的孢子质量浓度用于进一步酶学性质测定与研究。

图4 osw2Δ孢子表面展示ALDH的最适孢子浓度
Fig.4 Optimum concentration of osw2Δ spores with surface displayed ALDH
2.3 温度与pH对游离ALDH与osw2Δ孢子表面展示ALDH的影响
由图5-a可知,osw2Δ孢子表面展示ALDH和游离ALDH最适温度为40 ℃。当温度高于50 ℃后,游离ALDH迅速失活,而osw2Δ孢子表面展示ALDH在40~60 ℃之间显示更好的活性。osw2Δ孢子表面展示ALDH和游离ALDH在不同温度(30~90 ℃)条件下孵育120 min后,结果如图5-b所示:在70 ℃孵育后,游离ALDH几乎完全失活,而osw2Δ孢子表面展示ALDH仍残余约60%的活性,由此表明osw2Δ孢子表面展示ALDH比游离ALDH具有更好的温度稳定性。

a-最适反应温度;b-热稳定性;c-最适反应pH;d-pH稳定性
图5 osw2Δ孢子表面展示ALDH与游离ALDH酶学性质
Fig.5 Enzymatic properties of osw2Δ spores with surface-displayed ALDH and free ALDH
随后研究不同pH(6.0~11.0)对osw2Δ孢子表面展示ALDH的影响,结果如图5-c所示,osw2Δ孢子表面展示ALDH与游离ALDH的最适pH均为9.0,同时在偏碱性的pH值区间(7.5~9.5),osw2Δ孢子表面展示ALDH比游离ALDH具有更高的活性。为探究osw2Δ孢子表面展示ALDH与游离ALDH的pH稳定性,将两者分别在不同pH(7.0~11.0)条件下孵育120 min,结果如图5-d所示,osw2Δ孢子表面展示ALDH与游离ALDH的最适贮存pH值均为9.0,在不同pH(6.0~11.0)条件下osw2Δ孢子表面展示ALDH比游离ALDH具有更好的pH稳定性。从以上结果可以看出,osw2Δ孢子表面展示能够提高ALDH的活性以及ALDH的温度与pH稳定性,与前期研究得出的结论一致[27]。
2.4 金属离子与不同底物对游离ALDH与孢子表面展示ALDH的影响
以游离ALDH为对照,探究不同金属离子对osw2Δ孢子表面展示ALDH的影响。由图6-a所示,向反应体系中加入5 mmol/L的Na+和K+对osw2Δ孢子表面展示ALDH和游离ALDH的活性均有不同程度的提升,表明Na+和K+对osw2Δ孢子表面展示ALDH和游离ALDH具有激活作用。然而加入Ni2+、Cu2+、Mn2+、Co2+和Zn2+后,osw2Δ孢子表面展示ALDH和游离ALDH的酶活力出现不同程度的下降,甚至失活,这些金属可能影响到ALDH的必需基团或活性部位而抑制ALDH活力[29]。

a-金属离子对osw2Δ孢子表面展示ALDH与游离ALDH的影响;b-osw2Δ孢子表面展示ALDH与游离ALDH的底物特异性
图6 金属离子对osw2Δ孢子表面展示ALDH与游离ALDH的影响以及底物特异性
Fig.6 Effect of metal ions and substrate specificity on ALDH displayed on the osw2Δ spore surface and free ALDH
为探究osw2Δ孢子表面展示ALDH的底物特异性,选取八种不同底物,以游离ALDH为对照,结果如图6-b所示,osw2Δ孢子表面展示ALDH和游离ALDH的最适底物为乙醛,对丙醛有一定的活性,而对其他的底物仅有微弱或几乎没有活性。由于孢子表面二酪氨酸层的拦截作用[26-27],对于较大的底物,如苯甲醛等,osw2Δ孢子表面展示ALDH比游离ALDH的活性低。
2.5 游离ALDH与osw2Δ孢子表面展示ALDH抗逆性研究
SDS是一种能使蛋白质变性的化合物,用10% SDS处理osw2Δ孢子表面展示ALDH和游离ALDH,从而研究osw2Δ孢子表面展示ALDH的抗逆性。经10% SDS处理60 min后,结果如图7-a所示,游离ALDH的酶活力降低约50%,而osw2Δ孢子表面展示ALDH仍残余约90%的活性。由于osw2Δ孢子最外层具有二酪氨酸层[27],能够有效阻止SDS对ALDH的影响。

a-10% SDS耐受性;b-蛋白酶K耐受性
图7 osw2Δ孢子表面展示ALDH和游离ALDH对10% SDS与蛋白酶K的耐受性
Fig.7 Proteinase K and 10% SDS tolerance of ALDH displayed on the osw2Δ spore surface and free ALDH
蛋白酶K是一种高活性的蛋白水解酶。为检测osw2Δ孢子表面展示ALDH和游离ALDH对蛋白酶的耐受性,按照1.2.7节的方法分别对osw2Δ孢子表面展示ALDH和游离ALDH进行处理,检测剩余酶活力。结果如图7-b所示,游离ALDH在经过蛋白酶K处理后仅剩余约20%的酶活力,而osw2Δ孢子表面展示ALDH还保持约80%的活性,这是由于osw2Δ孢子最外层具有二酪氨酸层能够作为屏障抵御各种大分子化合物。
2.6 孢子表面展示ALDH重复使用性研究
可重复使用性是评估固定化酶的重要指标,在应用中极其重要。osw2Δ孢子表面展示ALDH在经过5轮重复使用后,结果如图8所示,osw2Δ孢子表面展示ALDH在经过4轮重复使用后仍保持约60%的活性,这一结果表明,osw2Δ孢子表面展示酶ALDH重复使用性能良好。

图8 表面展示ALDH的孢子重复使用能力
Fig.8 Reusability of ALDH displayed on the spore surface
2.7 osw2Δ孢子表面展示ALDH检测乙醛潜力研究
在本研究的最适实验条件下,测定osw2Δ孢子表面展示ALDH作为生物传感器检测乙醛浓度的灵敏性。osw2Δ孢子表面展示ALDH在不同浓度乙醛存在下340 nm的吸光值如图9所示,随着乙醛浓度的不断增加, 反应液在340 nm处的吸光值也不断增加。在0~500 μmol/L,340 nm处的吸光值和乙醛浓度之间存在极好的线性关系,线性回归方程为y=0.000 993 9x+0.016 87,相关系数R2为0.999 2,osw2Δ孢子表面展示ALDH作为生物传感器具有较高的潜力。

图9 孢子表面展示ALDH检测乙醛的潜在应用
Fig.9 Potential application of ALDH displayed on the spore surface for the detection of acetaldehyde
3 结论与讨论
本研究使用酿酒酵母osw2Δ孢子为载体,将C.tropicalis LBBE-W1来源的ALDH突变体展示到孢子“微胶囊”表面。与游离ALDH相比,osw2Δ孢子表面展示ALDH能够提高酶的活性以及酶的温度与pH稳定性,同时能够耐受高浓度的SDS与蛋白酶K,且具有较高的重复使用性能。该方法利用osw2Δ孢子表面展示ALDH催化乙醛氧化为乙酸,并在 340 nm 处通过光谱法检测生成的NADH,显示出宽泛的线性范围 (0~500 μmol/L)。使用osw2Δ孢子“微胶囊”展示ALDH作为生物传感器检测乙醛简便、高效且避免使用昂贵的设备,在乙醛检测方面具有较高的潜力。
[1] GARAYCOECHEA J I, CROSSAN G P, LANGEVIN F, et al.Alcohol and endogenous aldehydes damage chromosomes and mutate stem cells[J].Nature, 2018, 553(7687):171-177.
[2] ZENKI K C, MUSSULINI B H M, RICO E P, et al.Effects of ethanol and acetaldehyde in zebrafish brain structures:An in vitro approach on glutamate uptake and on toxicity-related parameters[J].Toxicology in Vitro, 2014, 28(5):822-828.
[3] TRAMACERE I, SCOTTI L, JENAB M, et al.Alcohol drinking and pancreatic cancer risk:a meta-analysis of the dose-risk relation[J].International Journal of Cancer, 2010, 126(6):1474-1486.
[4] SHERIDAN M K, ELIAS R J.Exogenous acetaldehyde as a tool for modulating wine color and astringency during fermentation[J].Food Chemistry, 2015, 177:17-22.
[5] IOANNIDOU M D, SAMOURIS G, ACHILIAS D S.Acetaldehyde contamination of water, alcoholic, and non-alcoholic beverages stored in glass or plastic bottles[J].Toxicological &Environmental Chemistry, 2016, 98(10):1183-1190.
[6] WOHLFART D P, LOU B, MIDDEL C S, et al.Accumulation of acetaldehyde in aldh2.1 zebrafish causes increased retinal angiogenesis and impaired glucose metabolism[J].Redox Biology, 2022, 50:102249.
[7] FONTARAS G, KARAVALAKIS G, KOUSOULIDOU M, et al.Effects of low concentration biodiesel blends application on modern passenger cars.Part 2:Impact on carbonyl compound emissions[J].Environmental Pollution, 2010, 158(7):2496-2503.
[8] SEEMAN J I, DIXON M, HAUSSMANN H-J.Acetaldehyde in mainstream tobacco smoke: Formation and occurrence in smoke and bioavailability in the smoker[J].Chemical Research in Toxicology, 2002, 15(11):1331-1350.
[9] LIU C F, LI Q, NIU C T, et al.Simultaneous determination of diethylacetal and acetaldehyde during beer fermentation and storage process[J].Journal of the Science of Food and Agriculture, 2018, 98(12):4733-4741.
[10] YE Y L, GUO H Y, SUN X L.Recent progress on cell-based biosensors for analysis of food safety and quality control[J].Biosensors and Bioelectronics, 2019, 126:389-404.
[11] SOPHOS N A, VASILIOU V.Aldehyde dehydrogenase gene superfamily:The 2002 update[J].Chemico-biological Interactions, 2003, 143-144:5-22.
[12] 黄世平, 曾幼玲.植物醛脱氢酶在逆境胁迫中的研究进展[J].生物技术通报, 2015,31(12):8-14.HUANG S P, ZENG Y L.Research progress on plant aldehyde dehydrogenase under adversity stresses[J].Biotechnology Bulletin, 2015, 31(12):8-14.
[13] 李小荣, 鲜维, 谭鑫, 等.线粒体ALDH2通过调控自噬对缺氧性肺动脉高压的保护机制研究[J].蚌埠医学院学报, 2023, 48(1):66-71.LI X R, XIAN W, TAN X, et al.Protective mechanism of mitochondrial ALDH2 on hypoxic pulmonary hypertension by regulating autophagy[J].Journal of Bengbu Medical College, 2023, 48(1):66-71.
[14] LU J, ZHU X Y, ZHANG C, et al.Co-expression of alcohol dehydrogenase and aldehyde dehydrogenase in Bacillus subtilis for alcohol detoxification[J].Food and Chemical Toxicology, 2020, 135:110890.
[15] LYU Y, LAPOINTE G, ZHONG L, et al.Heterologous expression of aldehyde dehydrogenase in Lactococcus lactis for acetaldehyde detoxification at low pH[J].Applied Biochemistry and Biotechnology, 2017, 184(2):570-581.
[16] LYU Y B, ZHONG L, LIU Y N, et al.Protective effects of Lactococcus lactis expressing alcohol dehydrogenase and acetaldehyde dehydrogenase on acute alcoholic liver injury in mice[J].Journal of Chemical Technology &Biotechnology, 2018, 93(5):1502-1510.
[17] SHORTALL K, DURACK E, MAGNER E, et al.Study of ALDH from Thermus thermophilus—expression, purification and characterisation of the non-substrate specific, thermophilic enzyme displaying both dehydrogenase and esterase activity[J].Cells, 2021, 10(12):3535.
[18] PENG Z, WANG R, XIA X F, et al.Engineered acetaldehyde dehydrogenase for the efficient degradation of acetaldehyde[J].Journal of Environmental Management, 2023, 331:117258.
[19] VAN BLOOIS E, WINTER R T, KOLMAR H, et al.Decorating microbes:Surface display of proteins on Escherichia coli[J].Trends in Biotechnology, 2011, 29(2):79-86.
[20] MIN P.Surface display technology for biosensor applications:A review[J].Sensors (Basel), 2020, 20(10):2275.
[21] 蔡锟, 储引娣, 黄丕英, 等.基于蛋白质跨外膜自转运系统的细菌细胞表面蛋白展示技术研究进展[J].微生物学报, 2022, 62(2):458-475.CAI K, CHU Y, HUANG P, et al.Trend of bacterial cell surface display:the autodisplay technology[J].Acta Microbiologica Sinica, 2022, 62(2):458-475.
[22] YANG X Y, TANG H T, SONG M H, et al.Development of novel surface display platforms for anchoring heterologous proteins in Saccharomyces cerevisiae [J].Microbial Cell Factories, 2019, 18(1):85.
[23] 李威杰, 刘明刚, 李建臻, 等.枯草芽孢杆菌表面展示技术用于黏膜疫苗的研究进展[J].微生物学报, 2022, 62(1):65-76.LI W J, LIU M G, LI J Z, et al.Research progress on Bacillus subtilis surface display technology for mucosal vaccine[J].Acta Microbiologica Sinica 2022, 62(1):65-76.
[24] PIEKARSKA I, RYTKA J, REMPOLA B.Regulation of sporulation in the yeast Saccharomyces cerevisiae[J].Acta Biochimica Polonica, 2010, 57(3):241-250.
[25] ZHANG H N, TACHIKAWA H, GAO X D, et al.Applied usage of yeast spores as chitosan beads[J].Applied and Environmental Microbiology, 2014, 80(16):5 098-5 105.
[26] LI Z J, LI Y, DUAN S L, et al.Bioconversion of D-glucose to D-psicose with immobilized D-xylose isomerase and D-psicose 3-epimerase on Saccharomyces cerevisiae spores[J].Journal of Industrial Microbiology and Biotechnology, 2015, 42(8):1117-1128.
[27] LIU X X, LI Z J, CHEN Z, et al.Production of L-ribulose using an encapsulated L-arabinose isomerase in yeast spores[J].Journal of Agricultural and Food Chemistry, 2019, 67(17):4868-4875.
[28] ANAGNOSTOPOULOS C, SPIZIZEN J.Requirements for transformation in Bacillus subtilis[J].Journal of Bacteriology, 1961, 81(5):741-746.
[29] 李云成, 汤岳琴, 木田建次.“组学”技术在燃料乙醇生产用酿酒酵母菌株构建中的应用[J].中国生物工程杂志, 2014, 34(2):118-128.LI Y C, TANG Y Q, KIDA K.Application of OMICS technology in construction of Saccharomyces cerevisiae strains for ethanol production[J].China Biotechnology, 2014, 34(2):118-128.