虾青素(3,3′-二羟基-4,4′-二酮基-β′,β-胡萝卜素)是一种酮式类胡萝卜素,呈橘红色,具有脂溶性,不溶于水,可溶于有机溶剂。虾青素不仅有较强的着色能力,还具有高效的单线态氧猝灭能力和抗氧化能力。如虾青素的抗氧化能力是维生素C的6 000倍,已被认为是自然界中最强的抗氧化剂[1]。虾青素可以清除二氧化氮、硫化物、二氧化硫等,也可以有效抑制自由基引起的脂质过氧化。除此之外,虾青素还具有延缓衰老、抑制肿瘤发生、增强机体免疫力、预防心血管疾病、清除体内自由基等生理作用,对紫外线引起的皮肤癌有很好的治疗效果[2]。国际上已将其应用于保健品、高档化妆品、医药、水产养殖等领域中。其中,饲料是虾青素应用最广泛的领域[3]。2018年饲料中虾青素消耗量达241 t,分析师预测2026年虾青素消耗量可以达到343 t,足以证明虾青素作为类胡萝卜素的第二大品种,其全球市场需求巨大。由于虾青素合成路径复杂,价格昂贵,其市场售价约1 000美金/千克,预计至2030年,虾青素的产值可以达到72.8亿元。
目前生产虾青素的方法主要包括化学合成、自然提取和生物合成[4]。虾青素广泛存在于一些海洋动物,如螃蟹壳、虾壳、鲑鱼、鳟鱼及某些藻类、真菌等生物中[5]。通过在蟹壳、虾壳等中提取天然虾青素的传统方法面临提取效率低、成本高等问题,已不能满足市场对虾青素高的需求量。市场上的虾青素主要是以化学合成为主。例如,Hoffmann-LaRoche和BASF等公司主要是以化学合成方法工业化生产虾青素[6]。化学合成的虾青素不仅价格昂贵,生物学功能、应用效果等与天然虾青素存在显著差异,同时也存在中间体和副产品残留、安全性低等问题。目前化学合成虾青素尚未被批准应用于营养保健品[7]。随着合成生物学的快速发展,利用生物技术手段合成虾青素具有转化效率高、环境友好、且结构和功能与天然虾青素相似等优点,已经成为合成虾青素的主要研究方向。
与利用细菌等原核生物为底盘细胞合成虾青素相比,酵母具有生长速度快、培养条件简单、底物谱广等优点。近年来,利用代谢工程及合成生物学技术,以酵母细胞作为底盘细胞,通过重构和优化萜类物质合成途径,进而实现目标产物的高效合成已经成为一项新的研究热点。例如,解脂耶氏酵母已经成为合成生物学研究中备受关注且极具潜力的底盘细胞之一,已广泛用于天然产物,如萜类化合物等的合成。对比常规酵母如酿酒酵母等,解脂耶氏酵母具有很多优势,如可以利用多种廉价碳源、乙酰辅酶A代谢通量高等。
因此,本文系统综述了利用酵母合成虾青素的研究进展。另外,还介绍了利用低廉生物质,如常见的蔬菜、水果废弃物和食物废弃物等生产虾青素的最新进展。最后,讨论了虾青素的重要性、来源、化学结构及其在化妆品行业的应用潜力。
1 酵母中虾青素的合成途径
虾青素属于类胡萝卜素家族,在类胡萝卜素的两大类别中,虾青素被归入叶黄素。叶黄素是含氧衍生物,氧原子以羟基和酮羰基的形式存在,虾青素有2个末端由多烯系统链连接的六元环。虾青素化学结构两端的β-紫罗兰酮环中所包含的羟基和酮羰基,使其具有亲水性。2个末端环之间的长多烯链,其行为类似于亲脂区[8]。多烯链中的共轭键可以提供电子来中和活性物质氧,因此,使虾青素具有更大的抗氧化潜力,同时共轭双键体系也是该化合物呈粉红色的原因[9]。
虾青素在C3和C3′位置具有2个不对称的碳,分子的两端都携带有羟基(图1)。由于C3和C3′位置上有2个手性中心,虾青素存在3种构型异构体——2种对映体(3R, 3′R和3S, 3′S)和一种介观形式(3R, 3′S)[10]。在这些异构体中,3S和3′S异构体在天然虾青素中含量最多,该异构体的抗氧化活性也是三者中最强的,其次是(3R, 3′R)和(3R, 3S)[11]。合成虾青素则是由(3R, 3′R)、(3S, 3′S)和(3R, 3′S)这3种异构体组成的外消旋混合物。类胡萝卜素是高度亲脂的,在自然界中很少以自由形式存在,因为它们大多与蛋白质结合或与脂肪酸酯化以增加溶解度和稳定性。因此,人工合成虾青素的抗氧化能力远低于天然虾青素,只能作为着色剂用于水产养殖。

图1 虾青素的化学结构[12]
Fig.1 Chemical structure of astaxanthin
在虾青素原生生产酵母菌株中,虾青素主要是通过甲羟戊酸途径(mevalonate pathway,MVA途径)合成。以黄叶菌为例,该途径以乙酰辅酶A为起点(图2),3个乙酰辅酶A缩合形成一个甲羟戊酸,形成的甲羟戊酸进一步转化为异戊烯基焦磷酸,是合成路径中所需的前体物质之一。除了异戊烯基焦磷酸,二甲基丙烯基焦磷酸也是一种必需的萜类前体[13],但是其生物合成途径不同,主要通过非甲羟酸或1-脱氧-D-木糖5-磷酸(methylerythritol 4-phosphate,MEP)途径合成[14]。异戊烯基焦磷酸和二甲丙烯基焦磷酸分子可以通过连续的酶催化步骤进一步缩合成香叶基香叶基焦磷酸。首先,利用植物烯合成酶将2个香叶基香叶基焦磷酸分子转化为植物烯;其次,利用去饱和酶进一步转化为番茄红素;番茄红素β-环化酶进一步将番茄红素转化为β-胡萝卜素[15];最后,通过β-胡萝卜素酮醇酶对β-胡萝卜素进行2次酮化,形成角黄质;角黄质被β-胡萝卜素羟化酶羟基化2次,形成虾青素。目前,对于不同的酵母,获得合成β-胡萝卜素所需要的前体物质的方法相同,存在区别的是从β-胡萝卜素转变至虾青素的步骤[16]。

图2 酵母中虾青素的合成途径
Fig.2 Synthesis pathway of astaxanthin in yeast
由crtE基因编码的香叶基香叶基焦磷酸合成酶可以催化法尼基焦磷酸合成香叶基香叶基焦磷酸(也被称为牻牛儿基牻牛儿基焦磷酸)。融合基因crtYB编码一种双功能蛋白,主要负责将香叶基香叶基焦磷酸转化为植物烯,并参与番茄红素环化为β-胡萝卜素的过程[17]。crtI可以编码八氢番茄红素脱氢酶,催化植物烯脱氢和环化成番茄红素。在黄叶菌中,由crtS编码的双功能酶P450可以催化β-胡萝卜素转化为虾青素,该酶被称为虾青素合成酶,由基因crtR编码的细胞色素P450还原酶可促进它的活力[18]。
2 虾青素合成的酵母菌株
2.1 野生型酵母菌株
现在,被广泛应用于发酵产虾青素的酵母菌株是黄叶菌(Xanthophyllomyces dendrorhous),也被称为红法夫酵母。该菌株是研究者于20世纪60年代末从美国阿拉斯加的高山采集得到,以Phaffia rhodozyma 为代表。研究表明,X.dendrorhous 的最适生长温度为18~22 ℃,生物量可以达到10~20 g/L,虾青素的产量可以达到每升几毫克至几十毫克[19]。FANG等[20]的研究表明X.dendrorhous的产量仅有1.5 mg/L,但是HU等[21]通过调控发酵过程pH,使虾青素的产量可以提高到27 mg/L。X.dendrorhous是现有报道中唯一能够原生生产虾青素的酵母菌株,然而由于它的虾青素产量和发酵温度较低,大规模工业化生产虾青素还存在诸多挑战。
2.2 诱变酵母菌株
应用野生型酵母合成虾青素的途径存在产量低、成本高等弊端,科研工作者开始寻找新的途径来提高虾青素的产量。当前应用最广泛的就是诱变育种,这也是一种操作简单、成本低的技术选择。通常采用紫外诱变(ultraviolet mutagenesis,UV)、甲基磺酸乙酯(ethyl methylsulfone,EMS)诱变、X射线诱变、大气和室温等离子体诱变(atmospheric and room temperature plasma,ARTP)等方法进行诱变。有研究报道,经过1-甲基-3-硝基-亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine,MNNG)诱变得到的X.dendrorhous诱变菌株(红法夫菌株)的胡萝卜素含量可达1.54 mg/g DCW,但是原始菌株仅能产生0.38 mg/g胡萝卜素。用亚硝基胍(nitroso-guanidin,NTG)对原始菌株P.rhodozyma CBS-6938进行诱变处理获得诱变菌株P.rhodozyma NCHU-FS301,其虾青素产量为1.5 mg/g,较原始菌株提高了3倍[20]。除此之外,EMS突变菌株的胡萝卜素产量与MNNG突变菌株相比并不理想,反向突变率较高。
与此同时,多轮诱变也被广泛应用于获取虾青素高产菌株。例如,通过紫外和NTG联合诱变获得遗传稳定的突变株X.dendrorhous YZUXHONG686。经过发酵条件优化之后,该突变株虾青素的干生物量为2.56 mg/g。利用二苯胺作为筛菌试剂,经过ARTP和UV联合诱变[22]得到虾青素高产突变株X.dendrorhous Y1,该菌株虾青素的产量和含量分别达54.38 mg/L和5.38 mg/g,对比原始菌株分别提高了19.02%和21.20%。除了联合诱变,双阶段诱变也可以产生一些虾青素高产突变株[23],如利用UV处理得到的突变株产量可以提高1.7倍,进一步进行NTG诱变则可以使其产量提高至原始菌株的2倍以上。
在筛选、培育虾青素高产突变菌株的同时,还可通过此策略获得耐高温突变株。众所周知,目前野生型X.dendrorhous最佳发酵温度为18~22 ℃,如果进行工业化生产,会增加其冷却成本。因此,研究人员通过诱变技术选育得到了可以在25 ℃正常生长的红法夫突变菌株。例如,用MNNG和Co60诱变后获得了一个中等温度突变体X.dendrorhous MK19,该突变菌株在25 ℃条件下虾青素产量可以达到25.8 mg/L,较野生型在17~21 ℃条件下提高了17倍,可显著降低发酵过程成本[24]。
近年来,人们为获得虾青素高产品种不断研究与尝试,寻找更加高效的方法。常规诱变与代谢工程和适应性进化相结合的策略是有潜力的选择之一。如GASSEL等[25]通过亚硝胺诱变和代谢工程,利用过量表达番茄红素环化酶(crtYB产物)来提高类胡萝卜素产量,获得了虾青素高产菌株AXJ-20/crtYB。突变菌株虾青素含量最终达到9.7 mg/g DCW。JIANG等[26]通过引入虾青素代谢合成途径,将ARTP诱变与重组酿酒酵母AX15的适应性进化相结合,使得虾青素产量进一步提高,在5 L发酵罐中产量可以达到404.78 mg/L。
2.3 基因工程改造酵母菌株
2.3.1 红法夫酵母
作为天然虾青素的原生生产者,过量表达合成虾青素相关的基因,如催化β-胡萝卜素转化为虾青素的crtS、crtR,并敲除甲羟戊酸途径中具有反馈抑制的基因如CYP61是提高红法夫酵母生产虾青素的2个重点领域。对比亲本菌株MK19,过表达crtS的X.dendrorhous CSR虾青素产量增加了33.5%。利用DNA组装方法,通过同源重组技术,可成功地将虾青素合成酶(crtS)基因片段组装到X.dendrorhous基因组中。过表达crtS的重组X.dendrorhous中虾青素产量可提高到179.21 μg/g DCW[27]。
红法夫酵母中虾青素的合成途径主要是MVA途径,增强MVA途径的代谢通量是提高虾青素产量的有效途径。但是MVA合成途径受到麦角甾醇的抑制,解除麦角甾醇在MVA途径中的抑制作用也是提高虾青素合成效率的有效措施。有研究表明,编码C-22甾醇去饱和酶的CYP61基因参与麦角甾醇的合成,在红法夫酵母中敲除该基因和目标二倍体基因可以促使虾青素产量增加1.4倍[28]。
2.3.2 马克斯克鲁维酵母
与传统酵母相比,作为非传统酵母的马克斯克鲁维酵母具有耐高温、生长速率快、底物谱宽等优点。马氏克鲁维酵母能够在52 ℃以上的温度发酵,这大大减少了发酵过程中的污染风险和冷却成本。同时,它具有合适的糖基化系统和较强的信号肽,具有较高的分泌能力,不仅可以分泌菊粉酶等多种水解酶,也可以分泌DPPH自由基及羟自由基等[29]。采用重复整合的方法可在马克斯克鲁维酵母中增加莱茵衣藻β-胡萝卜素酮化酶基因的拷贝数和雨芽胞菌(H.pluvialis, Hpchyb) β-胡萝卜素羟化酶基因的拷贝数,这可以使β-胡萝卜素向虾青素的碳通量增加。通过位点定向诱变对Hpchyb进行进一步修饰,可提高酶的表达效率,防止异源蛋白被泛素化降解。最终,在5 L发酵罐中,重组K.marxianus S3-2可产生9.97 mg/g DCW的(3S,3S′)虾青素[30]。
LIN等[31]通过利用双温度调控策略控制细胞生长以及利木糖诱导启动子来降低脂溶性类胡萝卜素对细胞的毒性。并且对类胡萝卜素生物合成途径进行进一步优化,使其利用葡萄糖和木糖进行发酵,最终生产142.9 mg/L虾青素。另外,采用非灭菌、非解毒的木糖母液或玉米芯水解物,经氮源优化后,分别生产了86.4 mg/L和56.8 mg/L虾青素[32]。在该团队的研究中,酵母利用木质纤维素生物质合成虾青素的产量也高于以前的报道。
在自然界中,X.dendrorhous是唯一一个虾青素的原生生产酵母。虽然野生型红法夫酵母发酵生产的虾青素的市场认知度较高,但是它的产量还需要提升。目前,马克斯克鲁维酵母的虾青素产量远高于红法夫酵母,具有大规模生产虾青素的潜力。
2.3.3 解脂耶氏酵母
解脂耶氏酵母是一种非常规酵母,属于半子囊菌类。众所周知,能够应用于食品工业中的微生物必须为非致病菌并且被广泛认为是安全的,解脂耶氏酵母就是被美国食品药品监督管理局列入生物安全的菌种之一。目前,研究人员已经成功对解脂耶氏酵母进行基因改造使其生产虾青素。例如,通过在解脂耶氏酵母中表达β-胡萝卜素合成的基因——番茄红素环化酶(crtYB)和八氢番茄红素去饱和酶(crtI),可实现异源合成虾青素。为了增加类胡萝卜素的积累,可进一步增强3-羟基-3-甲基戊二酰辅酶A还原酶和香叶基香叶基二磷酸合成酶(GGS1/crtE)在解脂耶氏酵母中的表达。
Paracoccussp.N81106中的β-胡萝卜素酮化酶(crtW)和Pantoea ananatisto中的羟化酶(crtZ)可以将β-胡萝卜素转化为虾青素。通过在解脂耶氏酵母中对crtZ和crtW的基因拷贝数进行优化,重组菌株最终积累了3.5 mg/g DCW (54.6 mg/L)虾青素,这是首例利用重组解脂耶氏酵母生产虾青素的报道[33]。虾青素的产量也可以通过增强虾青素生物合成途径的代谢通量,尤其是在解脂耶氏酵母的亚细胞器中进一步提升[34]。MA等[4]评估了在脂质体、内质网或过氧化物酶体的隔室中单独或联合表达相关基因对虾青素产生的影响,发现虾青素代谢途径靶向所有3个细胞器时效果最好。靶向亚细胞器虾青素通路不仅加速了β-胡萝卜素向虾青素的转化,而且显著减少了类酮胡萝卜素中间体的积累。最终,通过醋酸锂法转化线性化质粒的方法构建了重组菌株YL17,经分批补料发酵,最终虾青素产量可以达到858 mg/L,含量达到16.7 mg/g。在WANG等[35]研究中,通过增加解脂耶氏酵母基因组中的基因整合轮次来微调crtW和crtZ的转录表达,并应用了crtW和crtZ的模块化酶组装。最终,在分批补料条件下,重组解脂耶氏酵母的虾青素产量达到3.3 g/L,干细胞质量含量达到41.3 mg/g。
2.3.4 酿酒酵母
一些模式酵母如酿酒酵母具有成熟的遗传工具、快速的生长速度和广泛的底物谱等优点,常常被用作生产虾青素的宿主。β-胡萝卜素转化为虾青素是一个比较复杂的过程,主要依靠β-胡萝卜素羟化酶(crtZ)和β-胡萝卜素酮化酶(crtW)分别两次催化羟基化和酮化反应完成。如通过将雨生红球藻的β-胡萝卜素羟化酶(crtZ)和β-胡萝卜素酮化酶(Bkt)基因连续导入到产β-胡萝卜素的酿酒酵母中,构建了产虾青素的酿酒酵母,最终虾青素含量可达4.7 mg/g DCW[36]。由于β-胡萝卜素羟化酶和β-胡萝卜素酮化酶的催化活性较低以及中间体的积累,酿酒酵母生产虾青素目前处于瓶颈阶段,为了降低β-胡萝卜素转化为虾青素过程中中间体的含量,研究人员成功构建融合酶[37],虾青素产量从0.49 mg/g DCW提高到0.76 mg/g DCW。ZHOU等[38]通过在酿酒酵母中过表达香叶基香叶基焦磷酸合成酶(crtE03M)阳性突变体与另外3种限速酶tHMG1、crtI和crtYB,增加了前体β-胡萝卜素的供应;然后通过定向进化增加β-胡萝卜素酮酶活力,实现β-胡萝卜素向虾青素的有效转化;通过调整限速酶的拷贝数进一步平衡代谢通量。最后,所得的二倍体菌株产生二倍体菌株酿酒酵母YastD-01摇瓶发酵可以合成 8.10 mg/g DCW (47.18 mg/L)(3S,3S′)虾青素。ZHOU等[39]对β-胡萝卜素酮酶和β-胡萝卜素羟化酶开展定向进化研究,并进一步引入了基于酿酒酵母半乳糖操控系统(Gal4M9)的温度响应调节系统,以便将虾青素的产生与细胞生长分离开。最后,通过两阶段高密度发酵,重组酿酒酵母可合成235 mg/L的虾青素。
虾青素是亲脂性的化合物,这与酿酒酵母等模式微生物亲脂性物质的有限贮存能力相冲突。因此,可通过增强脂质合成使脂滴膨胀,从而提供更多的贮存空间;同时,它可以将代谢通量从目标途径转移。LI等[40]利用三功能(clustered regularly interspaced short palindromic repeats,CRISPR)系统筛选了脂质代谢相关基因文库,发现opi3和hrd1是通过适度而非过度上调脂质合成促进虾青素合成的新工程靶点。在此基础上,他们对β-胡萝卜素羟化酶和酮醇酶的表达进行平衡,构建了重组酿酒酵母。最终,采用两段控温发酵,重组酿酒酵母在5 L的发酵罐中可合成446.4 mg/L虾青素。目前能够生产虾青素的菌株及产量见表1。
表1 虾青素的不同生产菌株及其产量
Table 1 summarizes the different strains of astaxanthin and their yields
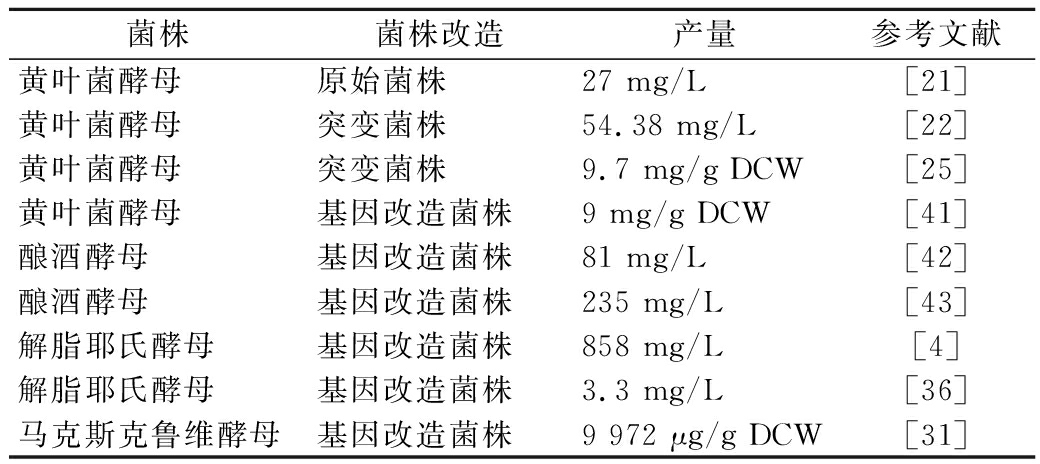
菌株菌株改造产量参考文献黄叶菌酵母原始菌株27 mg/L[21]黄叶菌酵母突变菌株54.38 mg/L[22]黄叶菌酵母突变菌株9.7 mg/g DCW[25]黄叶菌酵母基因改造菌株9 mg/g DCW[41]酿酒酵母基因改造菌株81 mg/L[42]酿酒酵母基因改造菌株235 mg/L[43]解脂耶氏酵母基因改造菌株858 mg/L[4]解脂耶氏酵母基因改造菌株3.3 mg/L[36]马克斯克鲁维酵母基因改造菌株9 972 μg/g DCW[31]
3 发酵条件优化提高虾青素产量
3.1 培养基成分
对红法夫酵母发酵培养基及发酵工艺进行优化也是提高虾青素产量的有效途径之一。不同碳氮源及碳氮源比例、pH、促进剂、接种量、发酵时间、补料方式等对酵母发酵产虾青素有显著的影响。如降低红法夫酵母培养基中铵、磷的含量,添加适量的柠檬酸,能有效促进虾青素的积累。当以葡萄糖、蔗糖、木糖等不同碳源为底物培养X.dendrorhous NRRL Y-17268进行测试时,木糖组处理得到的类胡萝卜素浓度最高[44],达到3.60 mg/L。其中,虾青素含量占总类胡萝卜素的82%。以木糖作为红法夫酵母生长的唯一碳源时,还可以实现虾青素和木糖醇的共生。红法夫酵母可以利用41.7 g木糖产生2.5 mg/L的虾青素和22 g/L的木糖醇[45],同时甘油也可用作生产虾青素的碳源。通过优化培养基pH和初始甘油浓度后,虾青素的产量可达到33.7 mg/L。
除碳源外,不同氮源对微生物的生长和虾青素的积累的影响也存在差异。例如,0.28 g/L (NH4)2SO4、0.49 g/L KNO3和1.19 g/L牛肉提取物组成的混合氮源可使红法夫酵母总生物量和虾青素产量分别达到7.71 mg/g和1 mg/g。此外,发酵培养基成分的确定中,碳、氮源的选择至关重要,两者的比例也同样重要[46]。碳氮源比(C/N)可以影响红法夫酵母生物量和虾青素含量。研究表明,在较低C/N条件下培养红法夫酵母 Y-2409菌株,可以得到较高的虾青素含量,这是因为虾青素合成关键酶的活力较高[47]。
微量元素在培养基中也是不可或缺的。当细胞进入成熟阶段时,增加微量元素和维生素浓度可以降低细胞干重的损失,适当增加虾青素的产量。如,当发酵培养基中微量元素和维生素浓度增加一倍时,细胞干重损失减少60 %,虾青素产量略有增加[48]。
3.2 环境压力
在藻类和微生物中,虾青素的合成是机体对环境胁迫的一种天生的自我保护机制。比如,当这些生物被强烈的紫外线照射过度,或者环境的温度和压力变得不适合生存的时候,虾青素就会发挥作用以避免机体氧中毒。因此,通过在培养基中添加一些环境压力诱导剂,可以促进虾青素的合成。例如,活性氧发生器TiO2的加入有助于在X.dendrorhous培养过程中形成氧胁迫环境,虾青素产量可提高到14.74 mg/L,是对照组的2倍。TiO2的添加对X.dendrorhous的总生物量和细胞凋亡没有影响[49]。
过氧化氢是一种强氧化剂,利用X.dendrorhous抗氧化应激的原理,可在其生物合成虾青素的过程中使用过氧化氢进行刺激[50]。结果显示,在0 h或24 h添加过氧化氢可以显著提高虾青素产量[51]。有研究表明,适量浓度的H2O2可显著促进红法夫酵母早期的虾青素合成。H2O2对虾青素生物合成的诱导作用会被H2O2清除剂完全阻断;同样的,雨生红球藻中H2O2和其他活性氧产生的氧化应激可促进虾青素的产生,而这种刺激会被碘化钾等特异性自由基清除剂阻断。有研究人员认为,这种增强的原因可能是氧化应激诱导了生成胡萝卜素酶的激活,如一些ROS物质(羟自由基)直接参与了生成胡萝卜素的反应。在酵母细胞中,虾青素含量随H2O2剂量的增加而增加,而β-胡萝卜素含量随H2O2剂量的增加而减少,说明在H2O2的作用下,其他一些类胡萝卜素如β-胡萝卜素也可能转化为虾青素。在X.dendrorhous酵母培养物中,杜醌(一种超氧阴离子产生剂)的剂量增加了主要叶黄素(如虾青素)的比例,但减少了胡萝卜素(β-胡萝卜素和γ-胡萝卜素)的比例。AN等[52]也提出,一些类胡萝卜素可能是红法夫酵母抗霉素突变体虾青素生物合成的前体。在微藻培养中,一些活性氧可以增强β-胡萝卜素羟化酶的活力,这种酶负责将角黄素转化为虾青素。然而,目前还没有实验证据表明活性氧能够增强β-胡萝卜素羟化酶的活力。另一个可能的原因是虾青素是一种比 β-胡萝卜素更有效的抗氧化剂,它的产生将更有利于细胞抵御氧化应激和反应性物种[52]。
3.3 工艺条件
发酵过程中溶解氧、pH、温度和培养基组成对虾青素的产量也有不同程度的影响,如通过对pH、温度和碳、氮源浓度等进行优化,X.dendrorhous中虾青素的产量可以提高92 %。在适宜的pH范围内(4.0~6.8),pH值仅影响X.dendrorhous的生长;降低培养pH可以提高虾青素的产量,如调节pH为3.5,不仅可以提高虾青素的纯度,还可以促进X.dendrorhous合成虾青素。成熟期将培养液pH由5.5降至3.5,虾青素产量可提高至0.7 g/kg。目前,pH调控策略也已被广泛用于指导虾青素合成。有研究报道,在X.dendrorhous发酵过程中应用pH调控策略,虾青素的最大浓度可以达到27.05 mg/L,比恒pH条件下提高了24.1%。当X.dendrorhous将葡萄糖耗尽时,醋酸作为pH缓冲剂比H2SO4能够更大程度提高虾青素的产量[21]。
X.dendrorhous与其他酵母菌株不同,光照强度对其虾青素的生产也有影响,如在强光照射下,会抑制X.dendrorhous的生长和类胡萝卜素的合成。这将影响后续类胡萝卜素的组成,会增加β-玉米胡萝卜素含量,导致β-胡萝卜素和叶黄素含量减少,其中包括虾青素和腓尼黄质[53]。STACHOWIAK[54]研究了光照强度对X.dendrorhous DSM 5626及其在胡萝卜提取物培养基上培养物中生长的4个突变体合成虾青素的影响。在获得的培养物中评估细胞浓度、总类胡萝卜素和虾青素产量,利用收集的数据建立了回归模型,并确定最佳光照强度为660~1 000 lx。结果表明,产虾青素酵母的生物量浓度随着光照强度的增加而增加,保持光照强度在660~1 000 lx时,虾青素的合成是最有效的,在光照强度为1 000 lx时达到最大值0.44 mg/g DCW。当光照强度过高时,胡萝卜素的合成会受到抑制。当光照强度达到5 000 lx时,会导致部分诱变菌株的死亡。光照类型也会影响X.dendrorhous产生虾青素,白光和紫外光可以促进虾青素的产生和提高虾青素的纯度。这其实是一种抗氧化应激反应,是细胞用来保护自身免受光胁迫产生的活性氧的侵害的方式[55]。RODR GUEZ-S
GUEZ-S IZ等[55]的研究发现,对X.dendrorhous进行连续白光照射处理并发酵,虾青素产量有所提升,最大为4.7 mg/g干重(420 mg/L)。DOM
IZ等[55]的研究发现,对X.dendrorhous进行连续白光照射处理并发酵,虾青素产量有所提升,最大为4.7 mg/g干重(420 mg/L)。DOM NGUEZ等[56]研究发现,与12∶12 h的明暗循环相比,连续照明有利于虾青素的积累,而显著黑暗期的照明策略不利于生物虾青素的积累。当把10 μmol光子 (相对较低的光强)下生长的原始培养(预培养)细胞转移到30 μmol光子 (相对较高的光强)的新鲜培养基中时,虾青素<10 min从初始中心位置重新分布到细胞的整个边缘部分[57]。这也就说明,光强度以某种方式作为一种记忆储存在藻类细胞中。当这种光节律(指光强度,而不是光周期或持续时间)发生变化时,细胞代谢就会被触发,从而产生虾青素[1]。
NGUEZ等[56]研究发现,与12∶12 h的明暗循环相比,连续照明有利于虾青素的积累,而显著黑暗期的照明策略不利于生物虾青素的积累。当把10 μmol光子 (相对较低的光强)下生长的原始培养(预培养)细胞转移到30 μmol光子 (相对较高的光强)的新鲜培养基中时,虾青素<10 min从初始中心位置重新分布到细胞的整个边缘部分[57]。这也就说明,光强度以某种方式作为一种记忆储存在藻类细胞中。当这种光节律(指光强度,而不是光周期或持续时间)发生变化时,细胞代谢就会被触发,从而产生虾青素[1]。
除了进行白光照射,另外一种提高虾青素产量的有效策略是补料方式,发酵过程中不同的补料方式对虾青素产量也存在一定的影响。底物加料方式一般包括在各个分散时刻的瞬时加料(脉冲加料)或连续加料来保持糖浓度恒定。结果表明,脉冲投糖法效果更佳,间歇投糖法比连续投糖法虾青素产量显著提高(54.9%)[58]。如果对糖和pH进行结合控制,可以使X.dendrorhous发酵的最终生物量增加20%。
3.4 外源物质添加
添加合适的前体物质是促进虾青素合成的简便有效的方法之一。例如,当在培养基中添加0.1%的MAP,红法夫酵母的虾青素和总类胡萝卜素产量可以提高4倍[59];发酵过程中添加谷氨酸可以促进葡萄糖的消耗,进而提高虾青素的含量,但是对细胞生长无明显影响[60]。虾青素是一种四萜化合物,外源添加单萜可以促进虾青素的积累。α-蒎烯被证明可以增加虾青素的含量,当在培养基中添加500 μL/L α-蒎烯,可使P.rhodozyma 菌株虾青素浓度由1 554 μg/L提高到1 883 μg/L[61]。
真菌激发子是一类能激活与次生代谢产物合成有关的酶活力的物质。WANG等[62]研究了6种分别来自深红酵母、粘红酵母、紫革耳、花斑巨苔、粘液毛霉和高山被孢霉M-2的真菌激发子对红法夫酵母生长和虾青素产量的影响。与对照相比,添加红桃诱导子后红法夫酵母虾青素在总类胡萝卜素中的占比提高了18.85%。
乙醇可以提高乙醇脱氢酶和羟甲基戊二酰辅酶A还原酶的活力,促进类胡萝卜素的产生。在培养基中添加0.2%(体积分数)乙醇可提高类胡萝卜素的比产率。如通过葡萄糖和乙醇2种状态间歇培养,P.rhodozyma菌的细胞干重可达30 g/L,虾青素含量达0.72 mg/g,比不添加乙醇的培养物高2.2倍[63]。除此之外,白池花籽油富含脂肪酸和维生素E。KIKUKAWA等[64]的研究发现,在培养基中添加0.1 g/L 的白池花籽油不仅可以提高X.dendrorhous的生长速度和虾青素的产量,也可以促进酵母细胞中脂肪酸的合成。酵母的生长速度、总脂肪酸和虾青素产量分别提高了3.0倍、2.7倍和1.4倍。因此,白池花籽油可以作为促进因子,可提高X.dendrorhous合成虾青素和脂肪酸的能力。
4 利用廉价碳资源生产虾青素
4.1 农业废弃资源
采用淀粉质原料,如葡萄糖等作为底物合成虾青素是影响虾青素生产成本的主要因素之一,而利用一些低成本和可再生资源为底物可以显著降低虾青素合成的生产成本。目前,一些粮食作物和果汁已被广泛应用于微生物发酵生产虾青素。以枣汁为原料时,X.dendrorhous虾青素的产量可达6.17 mg/L[65];以葡萄汁为原料时,虾青素的产量和含量分别达到9.8 mg/L和1 350 μg/g[66]。通过优化营养物质浓度、发酵pH和搅拌水平(氧传递率)等,当利用甘蔗汁培养基时,其含量可以达到为418 μg/g[67]。FONTANA等[68]设计了一种以蔗原汁、玉米浸泡液和白酒废水为碳、氮源的低成本培养基, X.dendrorhous的最终生物量可达9.2 g/L,虾青素含量为1.9 mg/g。
除了利用果汁,一些粮食作物的汁液也可以作为生产虾青素的原料,如甜高粱富含非结构糖和结构糖。在2 L的生物反应器中,添加适量氮源后,X.dendrorhous的生物量可高达29 g/L,虾青素产量可达65.4 mg/L。许多其他作物提取物也被广泛研究用于生产虾青素。如橡树叶提取物和无机磷酸盐的添加,可以使X.dendrorhous SK984菌株的虾青素含量增加1.4倍,达到1.98 mg/g。马铃薯、胡萝卜和大麦麦芽肉汤提取物也对X.dendrorhous DSM 5626的微生物生长和虾青素生产存在一定的影响。结果表明,胡萝卜浸膏培养基对虾青素的合成促进效果最好,虾青素浓度可达235 mg/L。出现这个现象的原因可能是胡萝卜提取物中含有合成虾青素所需的前体[69]。菊芋块茎中含有丰富的淀粉,其干块茎中菊粉含量甚至可达50 %以上,是优良的多汁饲料。与粮食作物不同,洋蓟在贫瘠的土地上生长良好,具有耐旱、耐盐、不与粮食作物争夺耕地等优点。在3 L生物反应器中,以菊芋为原料,最终得到的类胡萝卜素浓度可以达到982.50 mg/L,产率可达13.30 mg/g[70]。
还有其他一些低成本的农产品,如金盏菊花、玉米种子粉、小麦种子粉和狼尾草种子粉也可以被成为X.dendrorhous MTCC 7536菌株生产虾青素的基质。BHATT等[71]以上述4种低成本农业资源的混合物为基质培养X.dendrorhous,其虾青素的含量可以达到1 448.38 μg/g(细胞干重),体积产量达到1 333.96 μg/mL,胞内游离虾青素的产量提升了12倍。
4.2 农业副产品和废弃物
除了利用农业资源生产虾青素,农业副产品和废弃物的利用不仅可以降低生产成本,还有助于废弃物的回收利用。甘蔗是世界上产量最高的营养丰富的作物之一,对甘蔗渣进行化学或生物处理后可转化为葡萄糖、纤维素二糖、木糖等不同的糖类,可作为微生物发酵的碳源。MONTANTI等[72]研究发现X.dendrorhous可利用约40 g/L氨水处理过的甘蔗渣,通过发酵可生产3 mg/L虾青素。
ZHUANG等[22]研究发现,突变体X.dendrorhous Y1可以利用甘蔗渣水解物生产虾青素,其生物量和类胡萝卜素浓度可分别达12.65 g/L和88.57 mg/L。椰奶也是一种富含营养成分的天然碳源,椰子浆也广泛应用于生产洗发水、糖果等。突变体X.dendrorhous R1以椰浆为碳源进行发酵时,可生产1 850 μg/g的虾青素。芥菜废物是芥菜籽合成异硫氰酸烯丙酯时产生的一种副产物[73]。X.dendrorhous TISTR 5730可利用芥菜废物水解液进行发酵,其生物量和虾青素产量可分别达到19.6 g/L和25.8 mg/L。与工业酵母麦芽培养基相比,虾青素产量提高了11倍。VILLEGAS-MÉNDEZ等[74]的研究发现,X.dendrorhous也可以发酵荚蒾提取物,合成了4 130.23 μg/L的类胡萝卜素。粮食作物废弃物是一种最常见的有机废弃物,X.dendrorhous JTM158可以以大麦秸秆水解产物为底物生产虾青素,其产量可达3 mg/L,这也为以木质纤维素废弃物为原料生物生产虾青素提供了参考[72]。另外,小麦废料也是世界上主要的农业工业废料之一。DURSUN等[75]采用固态发酵技术,发现X.dendrorhous ATCC 24202酵母可利用小麦废渣生产109.23 μg/L的虾青素。
4.3 其他有机废弃物
探索发现,海洋副产物也可以被作为虾青素生产的底物。例如,AMADO等[76]发现,X.dendrorhous可利用贻贝加工废水生产虾青素,虾青素产量达22.5~26 mg/L。厨余垃圾是城市地区一种常见的有机废弃物,其含有大量的营养物质,如淀粉、蛋白质和金属元素。LAI等[77]开发了一种通过X.dendrorhous直接生物转化厨余垃圾生产虾青素的新工艺。在此过程中,X.dendrorhous能分泌少量淀粉酶直接水解淀粉用于微生物生长和虾青素合成。同时,油脂和金属元素对类胡萝卜素的产生和微生物的生长也有显著的积极影响。X.dendrorhous酵母直接发酵厨余垃圾的最终类胡萝卜素产量可达129.5 mg/L。采用分批进料发酵的方法,X.dendrorhous可以利用水果和蔬菜废物生产410 μg/g的虾青素[78]。这充分展示了低成本工业化生产虾青素的潜力。
目前,利用廉价碳资源为底物生产虾青素逐渐被行业关注,表2总结了酵母利用低成本资源生产虾青素的现状。
表2 酵母利用低成本资源合成虾青素总结
Table 2 summarizes the utilization of low-cost resources by yeast to produce astaxanthin

原料 产量参考文献甜高粱汁65.4 mg/L[79]橡树叶提取物1.7 mg/L[80]小麦废弃物109.23 mg/g DCW[75]玉米浆干粉2 mg/L[81]厨余垃圾129.5 mg/L[77]胡萝卜提取物235 mg/L[69]枣汁6.17 mg/L[42]芥菜废物25.8 mg/L[82]
5 虾青素的应用
5.1 饲料行业
虾青素可以用于鱼类、甲壳类动物及观赏鱼类等的饲料中,充当饲料添加剂。作为天然产物,虾青素具有一定的营养价值,饲料中的虾青素会在鱼类等动物体内积累,使其富含营养,同时也可以改善鱼类颜色,使其色泽鲜艳,更具观赏性。肉禽类饲喂了添加虾青素的饲料后,可以提高禽肉的营养价值[83-84]。
5.2 化妆品行业
紫外辐射会导致表皮光老化,也是造成皮肤癌的主要原因。虾青素可以清除紫外照射产生的自由基,降低光化学引起的危害。而且它具有极强的抗氧化性,抗氧化能力是维生素C的6 000倍,可以减少皱纹及雀斑的产生。目前,虾青素已经逐渐被应用于一些抗老、抗氧化产品中,例如抗老面霜、防晒化妆品及抗氧精华等产品[83]。
6 挑战与展望
虾青素的生物合成虽然取得了很大进展,但尚未实现大规模产业化应用。目前虾青素的主要生产途径仍是化学合成为主,这也限制了虾青素的应用。主要原因是化学合成的虾青素副产物高、活性低、成本高。与化学方法相比,生物方法具有独特的优势,因为天然衍生的虾青素更安全、且更容易被批准应用于人类使用,并且生物方法生产的虾青素的抗氧化活性远高于化学合成。与细菌等原核生物相比,酵母具有广泛的底物谱、生长速度快且易于培养等优点,所以酵母作为生产虾青素的底盘细胞具有巨大的潜力。
随着基因工程技术的迅速发展,越来越多的酵母底盘细胞被用于虾青素的生产。然而,基因工程仍然存在许多不确定性,世界上大多数国家仍然禁止使用基因工程产品,特别是人类消费。红法夫酵母作为唯一的虾青素原生生产酵母,应该被给予更多地关注。针对红法夫酵母菌株工业化生产虾青素还存在很多急需解决的问题,如筛选高产、健壮的菌株,提升发酵温度,开发更多的转基因工具,利用更便宜的底物等。同时,虾青素的高效分离提取也将是今后研究的重点。
[1] AHIRWAR A, MEIGNEN G, KHAN M J, et al. “Light modulates transcriptomic dynamics upregulating astaxanthin accumulation in Haematococcus: A review”[J]. Bioresource Technology, 2021, 340:125707.
[2] HECHT K A, SCHNACKENBERG J, NAIR A, et al. Astaxanthin for Improved Muscle Function and Enhanced Physical Performance[M].Amsterdam: Elsevier, 2021:447-467.
[3] ANEESH P A, AJEESHKUMAR K K, KUMAR LEKSHMI R G, et al. Bioactivities of astaxanthin from natural sources, augmenting its biomedical potential: A review[J]. Trends in Food Science &Technology, 2022, 125:81-90.
[4] MA Y S, LI J B, HUANG S W, et al. Targeting pathway expression to subcellular organelles improves astaxanthin synthesis in Yarrowia lipolytica[J]. Metabolic Engineering, 2021, 68:152-161.
[5] LI B F, LEE J Y, LUO Y C. Health benefits of astaxanthin and its encapsulation for improving bioavailability: A review[J]. Journal of Agriculture and Food Research, 2023, 14:100685.
[6] LEE C C. Astaxanthin: Sources, Properties and Benefits[M]. Cham: Springer International Publishing, 2023:1-41.
[7] 冼啟志, 林劲冬, 周应芳, 等. 天然叶黄素转化的虾青素的热异构化研究[J]. 中国食品添加剂, 2019, 30(3):87-93.XIAN Q Z, LIN J D, ZHOU Y F, et al. Study on thermal isomerization of astaxanthin transformed from natural lutein[J]. China Food Additives, 2019, 30(3):87-93.
[8] SUN J N, YAN J, DONG H, et al. Astaxanthin with different configurations: Sources, activity, post modification, and application in foods[J]. Current Opinion in Food Science, 2023, 49:100955.
[9] MCLEAN R, SCHWANDER T, DIEHL C, et al. Exploring alternative pathways for the in vitro establishment of the HOPAC cycle for synthetic CO2 fixation[J]. Science Advances, 2023, 9(24): eadh4299.
[10] 陈颖, 李晟硕, 刘滢, 等. 微生物生产天然虾青素的合成途径及其研究进展[J]. 食品科技, 2023, 48(8):15-22.CHEN Y, LI S S, LIU Y, et al. Synthetic pathway and research progress of natural astaxanthin production by microorganisms[J]. Food Science and Technology, 2023, 48(8):15-22.
[11] BASIONY M, OUYANG L M, WANG D N, et al. Optimization of microbial cell factories for astaxanthin production: Biosynthesis and regulations, engineering strategies and fermentation optimization strategies[J]. Synthetic and Systems Biotechnology, 2022, 7(2):689-704.
[12] DUTTA S, JEEVAN KUMAR S P, BANERJEE R. A comprehensive review on astaxanthin sources, structure, biochemistry and applications in the cosmetic industry[J]. Algal Research, 2023, 74:103168.
[13] WANG Q, QUAN S, XIAO H. Towards efficient terpenoid biosynthesis: Manipulating IPP and DMAPP supply[J]. Bioresources and Bioprocessing, 2019, 6(1):6.
[14] ZHANG C Q, CHEN X X, TOO H P. Microbial astaxanthin biosynthesis: Recent achievements, challenges, and commercialization outlook[J]. Applied Microbiology and Biotechnology, 2020, 104(13):5725-5737.
[15] FANG N, WANG C K, LIU X F, et al. De novo synthesis of astaxanthin: From organisms to genes[J]. Trends in Food Science &Technology, 2019, 92:162-171.
[16] YU W J, ZHANG L T, ZHAO J, et al. Exogenous sodium fumarate enhances astaxanthin accumulation in Haematococcus pluvialis by enhancing the respiratory metabolic pathway[J]. Bioresource Technology, 2021, 341:125788.
[17] JING Y W, WANG Y X, ZHOU D W, et al. Advances in the synthesis of three typical tetraterpenoids including β-carotene, lycopene and astaxanthin[J]. Biotechnology Advances, 2022, 61:108033.
[18] LI Z P, CHEN L N, YANG H Y, et al. The role of key genes in astaxanthin biosynthesis in Phaffia rhodozyma by transcript level and gene knockout[J]. Process Biochemistry,2022,113:158-166.
[19] VISSER H, VERDOES J C, VAN OOYEN A J J. Fermentation and Carotenoid Analysis of the Yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma)[M].Berlin, Heidelberg: Springer Berlin Heidelberg, 2003:309-313.
[20] FANG T J, CHENG Y S. Improvement of astaxanthin production by Phaffia rhodozyma through mutation and optimization of culture conditions[J]. Journal of Fermentation and Bioengineering, 1993, 75(6):466-469.
[21] HU Z C, ZHENG Y G, WANG Z, et al. pH control strategy in astaxanthin fermentation bioprocess by Xanthophyllomyces dendrorhous[J]. Enzyme and Microbial Technology, 2006, 39(4):586-590.
[22] ZHUANG Y, JIANG G L, ZHU M J. Atmospheric and room temperature plasma mutagenesis and astaxanthin production from sugarcane bagasse hydrolysate by Phaffia rhodozyma mutant Y1[J]. Process Biochemistry, 2020, 91:330-338.
[23] KOTHARI D, LEE J H, CHON J W, et al. Improved astaxanthin production by Xanthophyllomyces dendrorhous SK984 with oak leaf extract and inorganic phosphate supplementation[J]. Food Science and Biotechnology, 2019, 28(4):1171-1176.
[24] MIAO L L, WANG Y X, CHI S, et al. Reduction of fatty acid flux results in enhancement of astaxanthin synthesis in a mutant strain of Phaffia rhodozyma[J]. Journal of Industrial Microbiology &Biotechnology, 2010, 37(6):595-602.
[25] GASSEL S, SCHEWE H, SCHMIDT I, et al. Multiple improvement of astaxanthin biosynthesis in Xanthophyllomyces dendrorhous by a combination of conventional mutagenesis and metabolic pathway engineering[J]. Biotechnology Letters, 2013, 35(4):565-569.
[26] JIANG G Z, YANG Z M, WANG Y, et al. Enhanced astaxanthin production in yeast via combined mutagenesis and evolution[J]. Biochemical Engineering Journal, 2020, 156:107519.
[27] CONTRERAS G, BARAHONA S, ROJAS M C, et al. Increase in the astaxanthin synthase gene (crtS) dose by in vivo DNA fragment assembly in Xanthophyllomyces dendrorhous[J]. BMC Biotechnology, 2013, 13:84.
[28] GONZ LEZ A M, VENEGAS M, BARAHONA S, et al. Damage response protein 1 (Dap1) functions in the synthesis of carotenoids and sterols in Xanthophyllomyces dendrorhous[J]. Journal of Lipid Research, 2022, 63(3):100175.
LEZ A M, VENEGAS M, BARAHONA S, et al. Damage response protein 1 (Dap1) functions in the synthesis of carotenoids and sterols in Xanthophyllomyces dendrorhous[J]. Journal of Lipid Research, 2022, 63(3):100175.
[29] TSENG C C, LIN Y J, LIU W T, et al. Metabolic engineering probiotic yeast produces 3S, 3’S-astaxanthin to inhibit B16F10 metastasis[J]. Food and Chemical Toxicology, 2020, 135:110993.
[30] RAIMONDI S, ZANNI E, AMARETTI A, et al. Thermal adaptability of Kluyveromyces marxianus in recombinant protein production[J]. Microbial Cell Factories, 2013, 12:34.
[31] LIN Y J, CHANG J J, LIN H Y, et al. Metabolic engineering a yeast to produce astaxanthin[J]. Bioresource Technology, 2017, 245:899-905.
[32] YANG X X, WANG D M, HONG J. Carotenoid production from nondetoxified xylose mother liquid or corncob hydrolysate with engineered Kluyveromyces marxianus[J]. Bioresource Technology, 2022, 364:128080.
[33] KILDEGAARD K R, ADIEGO-PÉREZ B, DOMÉNECH BELDA D, et al. Engineering of Yarrowia lipolytica for production of astaxanthin[J]. Synthetic and Systems Biotechnology, 2017, 2(4):287-294.
[34] MADZAK C. Yarrowia lipolytica Engineering as a Source of Microbial Cell Factories[M]. Amsterdam: Elsevier, 2021:345-380.
[35] WANG D N, FENG J, YU C X, et al. Integrated pathway engineering and transcriptome analysis for improved astaxanthin biosynthesis in Yarrowia lipolytica[J]. Synthetic and Systems Biotechnology, 2022, 7(4):1133-1141.
[36] LI L, TANG X Y, LUO Y Y, et al. Accumulation and conversion of β-carotene and astaxanthin induced by abiotic stresses in Schizochytrium sp.[J]. Bioprocess and Biosystems Engineering, 2022, 45(5):911-920.
[37] DING Y W, LU C Z, ZHENG Y, et al. Directed evolution of the fusion enzyme for improving astaxanthin biosynthesis in Saccharomyces cerevisiae[J]. Synthetic and Systems Biotechnology, 2023, 8(1):46-53.
[38] ZHOU P P, XIE W P, LI A P, et al. Alleviation of metabolic bottleneck by combinatorial engineering enhanced astaxanthin synthesis in Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2017, 100:28-36.
[39] ZHOU P P, YE L D, XIE W P, et al. Highly efficient biosynthesis of astaxanthin in Saccharomyces cerevisiae by integration and tuning of algal crtZ and bkt[J]. Applied Microbiology and Biotechnology, 2015, 99(20):8419-8428.
[40] LI M, ZHOU P P, CHEN M K, et al. Spatiotemporal regulation of astaxanthin synthesis in S. cerevisiae[J]. ACS Synthetic Biology, 2022, 11(8):2636-2649.
[41] GASSEL S, BREITENBACH J, SANDMANN G. Genetic engineering of the complete carotenoid pathway towards enhanced astaxanthin formation in Xanthophyllomyces dendrorhous starting from a high-yield mutant[J]. Applied Microbiology and Biotechnology, 2014, 98(1):345-350.
[42] WANG R Z, GU X L, YAO M D, et al. Engineering of β-carotene hydroxylase and ketolase for astaxanthin overproduction in Saccharomyces cerevisiae[J]. Frontiers of Chemical Science and Engineering, 2017, 11(1):89-99.
[43] ZHOU P P, LI M, SHEN B, et al. Directed coevolution of β-carotene ketolase and hydroxylase and its application in temperature-regulated biosynthesis of astaxanthin[J]. Journal of Agricultural and Food Chemistry, 2019, 67(4):1072-1080.
[44] PARAJO J C, SANTOS V, VAZQUEZ M. Co-production of carotenoids and xylitol by Xanthophyllomyces dendrorhous (Phaffia rhodozyma)[J]. Biotechnology Letters, 1997, 19(2):139-142.
[45] V ZQUEZ M, SANTOS V, PARAJ
ZQUEZ M, SANTOS V, PARAJ J C. Effect of the carbon source on the carotenoid profiles of Phaffia rhodozyma strains[J]. Journal of Industrial Microbiology and Biotechnology, 1997, 19(4):263-268.
J C. Effect of the carbon source on the carotenoid profiles of Phaffia rhodozyma strains[J]. Journal of Industrial Microbiology and Biotechnology, 1997, 19(4):263-268.
[46] PAN X S, WANG B B, GERKEN H G, et al. Proteomic analysis of astaxanthin biosynthesis in Xanthophyllomyces dendrorhous in response to low carbon levels[J]. Bioprocess and Biosystems Engineering, 2017, 40(7):1091-1100.
[47] VUSTIN M M, BELYKH E N, KISHILOVA S A. Relationship between astaxanthin production and the intensity of anabolic processes in the yeast Phaffia rhodozyma[J]. Mikrobiologiia, 2004, 73(6):751-757.
[48] FLORES-COTERA L B, S NCHEZ S. Copper but not iron limitation increases astaxanthin production by Phaffia rhodozyma in a chemically defined medium[J]. Biotechnology Letters, 2001, 23(10):793-797.
NCHEZ S. Copper but not iron limitation increases astaxanthin production by Phaffia rhodozyma in a chemically defined medium[J]. Biotechnology Letters, 2001, 23(10):793-797.
[49] LI Z Y, LI A J, ZHANG H R, et al. Interfacial engineering for stabilizing polymer electrolytes with 4V cathodes in lithium metal batteries at elevated temperature[J]. Nano Energy, 2020, 72:104655.
[50] BRASIL F B, BERTOLINI GOBBO R C, SOUZA DE ALMEIDA F J, et al. The signaling pathway PI3K/Akt/Nrf2/HO-1 plays a role in the mitochondrial protection promoted by astaxanthin in the SH-SY5Y cells exposed to hydrogen peroxide[J]. Neurochemistry International, 2021, 146:105024.
[51] LIU Y S, WU J Y. Hydrogen peroxide-induced astaxanthin biosynthesis and catalase activity in Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2006, 73(3):663-668.
[52] AN G H, CHANG K W, JOHNSON E A. Effect of oxygen radicals and aeration on carotenogenesis and growth of Phaffia rhodozyma (Xanthophyllomyces dendrorhous)[J]. Journal of Microbiology and Biotechnology, 1996, 6: 103-109.
[53] AN G H, JOHNSON E A. Influence of light on growth and pigmentation of the yeast Phaffia rhodozyma[J]. Antonie Van Leeuwenhoek, 1990, 57(4):191-203.
[54] STACHOWIAK B. Astaxanthin synthesis by Xanthophyllomyces dendrorhous DSM 5626 and its mutants on carrot extract medium under different illumination intensity[J]. Applied Biochemistry and Microbiology, 2014, 50(5):471-476.
[55] RODR GUEZ-S
GUEZ-S IZ M, DE LA FUENTE J L, BARREDO J L. Xanthophyllomyces dendrorhous for the industrial production of astaxanthin[J]. Applied Microbiology and Biotechnology, 2010, 88(3):645-658.
IZ M, DE LA FUENTE J L, BARREDO J L. Xanthophyllomyces dendrorhous for the industrial production of astaxanthin[J]. Applied Microbiology and Biotechnology, 2010, 88(3):645-658.
[56] DOM NGUEZ A, PEREIRA S, OTERO A. Does Haematococcus pluvialis need to sleep?[J]. Algal Research, 2019, 44:101722.
NGUEZ A, PEREIRA S, OTERO A. Does Haematococcus pluvialis need to sleep?[J]. Algal Research, 2019, 44:101722.
[57] 太田, 雄久, 粟生, 等. 子どもの感性を育てる小学校理科授業の実践とその効果の検証―小学校第5学年「電流の働き」の実践より―[J]. 理科教育学研究, 2018, 59: 1-10.
[58] HU Z C, ZHENG Y G, WANG Z, et al. Effect of sugar-feeding strategies on astaxanthin production by Xanthophyllomyces dendrorhous[J]. World Journal of Microbiology and Biotechnology, 2005, 21(5):771-775.
[59] CALO P, DE MIGUEL T, VEL ZQUEZ J B, et al. Mevalonic acid increases trans-astaxanthin and carotenoid biosynthesis in Phaffia rhodozyma[J]. Biotechnology Letters, 1995, 17(6):575-578.
ZQUEZ J B, et al. Mevalonic acid increases trans-astaxanthin and carotenoid biosynthesis in Phaffia rhodozyma[J]. Biotechnology Letters, 1995, 17(6):575-578.
[60] PAN X S, WANG B B, DUAN R, et al. Enhancing astaxanthin accumulation in Xanthophyllomyces dendrorhous by a phytohormone: Metabolomic and gene expression profiles[J]. Microbial Biotechnology, 2020, 13(5):1446-1460.
[61] MEYER P S, DU PREEZ J C, VAN DYK M S. The effect of monoterpenes on astaxanthin production by a mutant ofPhaffia rhodozyma[J]. Biotechnology Letters, 1994, 16(2):125-128.
[62] WANG W J, YU L J, ZHOU P P. Effects of different fungal elicitors on growth, total carotenoids and astaxanthin formation by Xanthophyllomyces dendrorhous[J]. Bioresource Technology, 2006, 97(1):26-31.
[63] YAMANE Y, HIGASHIDA K, NAKASHIMADA Y, et al. Astaxanthin production by Phaffia rhodozymaenhanced in fed-batch culture with glucose and ethanol feeding[J]. Biotechnology Letters, 1997, 19(11):1109-1111.
[64] KIKUKAWA H, SHIMIZU C, HIRONO-HARA Y, et al. Screening of plant oils promoting growth of the red yeast Xanthophyllomyces dendrorhous with astaxanthin and fatty acid production[J]. Biocatalysis and Agricultural Biotechnology, 2021, 35:102101.
[65] RAM REZ J, NU
REZ J, NU EZ M L, VALDIVIA R. Increased astaxanthin production by a Phaffia rhodozyma mutant grown on date juice from Yucca fillifera[J]. Journal of Industrial Microbiology and Biotechnology, 2000, 24(3):187-190.
EZ M L, VALDIVIA R. Increased astaxanthin production by a Phaffia rhodozyma mutant grown on date juice from Yucca fillifera[J]. Journal of Industrial Microbiology and Biotechnology, 2000, 24(3):187-190.
[66] MEYER P S, DU PREEZ J C. Astaxanthin production by a Phaffia rhodozyma mutant on grape juice[J]. World Journal of Microbiology &Biotechnology, 1994, 10(2):178-183.
[67] FLOR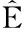 NCIO J A, SOCCOL C R, FURLANETTO L F, et al. A factorial approach for a sugarcane juice-based low cost culture medium: Increasing the astaxanthin production by the red yeast Phaffia rhodozyma[J]. Bioprocess Engineering, 1998, 19(3):161-164.
NCIO J A, SOCCOL C R, FURLANETTO L F, et al. A factorial approach for a sugarcane juice-based low cost culture medium: Increasing the astaxanthin production by the red yeast Phaffia rhodozyma[J]. Bioprocess Engineering, 1998, 19(3):161-164.
[68] FONTANA J D, CHOCIAL M B, BARON M, et al. Astaxanthinogenesis in the yeast Phaffia rhodozyma: Optimization of low-cost culture media and yeast cell-wall Lysis[J]. Applied Biochemistry and Biotechnology, 1997, 63-65:305-314.
[69] STACHOWIAK B. Astaxanthin synthesis by yeast Xanthophyllomyces dendrorhous and its mutants on media based on plant extracts[J]. Indian Journal of Microbiology, 2012, 52(4):654-659.
[70] JIANG G L, ZHOU L Y, WANG Y T, et al. Astaxanthin from Jerusalem artichoke: Production by fed-batch fermentation using Phaffia rhodozyma and application in cosmetics[J]. Process Biochemistry, 2017, 63:16-25.
[71] BHATT P C, AHMAD M, PANDA B P. Enhanced bioaccumulation of astaxanthin in Phaffia rhodozyma by utilising low-cost agro products as fermentation substrate[J]. Biocatalysis and Agricultural Biotechnology, 2013, 2(1):58-63.
[72] MONTANTI J, NGHIEM N P, JOHNSTON D B. Production of astaxanthin from cellulosic biomass sugars by mutants of the yeast Phaffia rhodozyma[J]. Applied Biochemistry and Biotechnology, 2011, 164(5):655-665.
[73] ZHOU D W, YANG X Y, WANG H X, et al. Biosynthesis of astaxanthin by using industrial yeast[J]. Biofuels, Bioproducts and Biorefining, 2023, 17(3):602-615.
[74] VILLEGAS-MÉNDEZ M  , PAPADAKI A, PATERAKI C, et al. Fed-batch bioprocess development for astaxanthin production by Xanthophyllomyces dendrorhous based on the utilization of Prosopis sp. pods extract[J]. Biochemical Engineering Journal, 2021, 166:107844.
, PAPADAKI A, PATERAKI C, et al. Fed-batch bioprocess development for astaxanthin production by Xanthophyllomyces dendrorhous based on the utilization of Prosopis sp. pods extract[J]. Biochemical Engineering Journal, 2021, 166:107844.
[75] DURSUN D, DALG Ç A C. Optimization of astaxanthin pigment bioprocessing by four different yeast species using wheat wastes[J]. Biocatalysis and Agricultural Biotechnology, 2016, 7:1-6.
Ç A C. Optimization of astaxanthin pigment bioprocessing by four different yeast species using wheat wastes[J]. Biocatalysis and Agricultural Biotechnology, 2016, 7:1-6.
[76] AMADO I R, V ZQUEZ J A. Mussel processing wastewater: A low-cost substrate for the production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Microbial Cell Factories, 2015, 14:177.
ZQUEZ J A. Mussel processing wastewater: A low-cost substrate for the production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Microbial Cell Factories, 2015, 14:177.
[77] LAI J X, CHEN X, BU J, et al. Direct production of astaxanthin from food waste by Phaffia rhodozyma[J]. Process Biochemistry, 2022, 113:224-233.
[78] GERVASI T, SANTINI A, DALIU P, et al. Astaxanthin production by Xanthophyllomyces dendrorhous growing on a low cost substrate[J]. Agroforestry Systems, 2020, 94(4):1229-1234.
[79] STOKLOSA R J, JOHNSTON D B, NGHIEM N P. Utilization of sweet Sorghum juice for the production of astaxanthin as a biorefinery co-product by Phaffia rhodozyma[J]. ACS Sustainable Chemistry &Engineering, 2018, 6(3):3124-3134.
[80] HARA K Y, KAGEYAMA Y, TANZAWA N, et al. Development of astaxanthin production from Citrus peel extract using Xanthophyllomyces dendrorhous[J]. Environmental Science and Pollution Research International, 2021, 28(10):12640-12647.
[81] HAYMAN G T, MANNARELLI B M, LEATHERS T D. Production of carotenoids byPhaffia rhodozyma grown on media composed of corn wet-milling co-products[J]. Journal of Industrial Microbiology, 1995, 14(5):389-395.
[82] TINOI J, RAKARIYATHAM N, DEMING R L. Utilization of mustard waste isolates for improved production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Journal of Industrial Microbiology &Biotechnology, 2006, 33(4):309-314.
[83] LI T, ZHENG P H, ZHANG X X, et al. Effects of dietary astaxanthin on growth performance, muscle composition, non-specific immunity, gene expression, and ammonia resistance of juvenile Ivory shell (Babylonia areolate)[J]. Fish &Shellfish Immunology, 2024, 145:109363.
[84] 焦雪峰. 虾青素在化妆品中的应用[J]. 广东化工, 2006, 33(1):13-15.JIAO X F. Application of astaxanthin on cosmetics[J]. Guangdong Chemical Industry, 2006, 33(1):13-15.