姜黄主要用来提取姜黄素,提取后会产生油状副产物(也被称为姜黄油树脂),呈红棕色粘稠膏状,具有姜黄的特征气味,其中挥发性成分约30%~33%,姜黄素类化合物姜黄素(curcumin,CurⅠ)、去甲氧基姜黄素(demethoxycurcumin,CurⅡ)和双去甲氧基姜黄素(bisdemethoxycurcumin,CurⅢ)约26%~29.3%[1-2]。这些成分使得姜黄素提取后油状副产物(oily by-product after curcumin extraction,OBP)可能和姜黄一样,具有丰富的抗氧化能力,同时在抗菌和抗炎特性方面也具有较高的生物活性[3-4]。因此,除应用于调味料外,OBP在功能食品、药品领域都具有一定的开发前景。
OBP的水不溶性和高黏度,使其应用受到较多的限制,工业上会将其分离纯化得到高浓度高纯度的活性成分[5]。但这些活性成分的稳定性问题是进一步限制OBP应用的重要原因。例如对CurⅠ而言,热、光、pH值以及金属离子都是影响其稳定性的重要因素。CurⅠ经光、热或碱性处理后会快速分解生成阿魏酸和阿魏酰甲烷等产物,在溶液环境中则会加快且更彻底得分解为环戊二酮,稳定性相较固体粉末更差[6-7]。一些常见的金属离子,如Fe3+、Cu2+、Zn2+等,除会引起CurⅠ降解外,也会引起颜色变化[8]。而针对CurⅡ、CurⅢ这两类姜黄素化合物的稳定性研究还较少,仅知道其在单一的体系中稳定性优于CurⅠ[9]。
除了姜黄素类化合物外,OBP中也含有大量的挥发性成分,包括姜黄烯、姜黄酮、芳姜黄酮、β-倍半水芹烯等,其中的萜类化合物热不稳定,在高温下易发生自氧化和降解[10]。实际生产中会提取姜黄或OBP中的挥发性成分,即姜黄精油,提取过程中的高温会使得其中的挥发性成分分解,进而影响精油的产量。例如,RAY等[11]报道了不同干燥方法对姜黄中精油产量的影响,结果显示精油中挥发性成分的显著变化与干燥方法有关,选择冻干方法,相较于热风干燥,精油中α-姜黄酮和β-姜黄酮的占比显著增加。
虽然目前针对单一成分的稳定性、抗氧化活性研究已经比较全面,但OBP作为成分复杂的混合物,其中的成分可能会发生协同作用,不能从单一或几种成分的角度判断其稳定性和抗氧化活性。因此,本文结合HPLC以及GC-MS技术对OBP中的姜黄素类化合物和挥发性成分进行定性定量分析,探究OBP在不同光、热、pH值、金属离子条件下的稳定性,及其抗氧化活性,以期为其在实际中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
OBP,宁波中药制药股份有限公司;CurⅠ、CurⅡ、CurⅢ标品(分析纯)、无水乙醇、甲醇(色谱纯),上海源叶生物科技有限公司;三氯化铁、二氯化锌、硫酸铜、正十三烷(分析纯),上海麦克林科技股份有限公司;β-胡萝卜素、吐温80(分析纯),上海阿拉丁生化科技股份有限公司;亚油酸,东京化成工业株式会社;全部用水为去离子水。
1.2 仪器与设备
气相色谱高分辨质谱联用仪、1260高效液相色谱仪,美国安捷伦科技有限公司;多功能酶标仪Bioteck SynergyH1,美国Bioteck公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;K15200B超声清洗仪,昆山市超声仪器有限公司;P7型双光束紫外分光光度仪,上海美谱达仪器有限公司。
1.3 实验方法
1.3.1 姜黄素类化合物含量的测定
采用HPLC法测定OBP中3种姜黄素类化合物的含量,通过姜黄素类化合物的浓度与峰面积的标准曲线进行定量。HPLC条件:色谱柱:Agilent pro shell C18(150 mm×4.6 mm,5 μm);流动相:0.5‰甲酸水(体积分数,下同)(A)-0.5‰甲酸乙腈(B),梯度洗脱:0~10 min,65%~55% A;10~20 min,55%~30% A;20~25 min,30%~5% A;25~30 min,5% A;30~35 min,5%~60% A;35~40 min,60% A;流速:1.0 mL/min;进样量:10 μL;检测波长:415 nm;柱温:30 ℃。
1.3.2 挥发性成分的测定
采用GC-MS法测定OBP中挥发性成分的含量,分别测定内标物和待测组分的峰面积,通过其比值和内标物浓度计算出每种成分的百分含量[12]。GC-MS条件:采用Elite-WAX ETR(0.25 μm×0.25 mm×30 m)毛细管柱;程序升温:初始温度70 ℃,保持2 min,以 6 ℃/min升温至150 ℃,以8 ℃/min升温至230 ℃,保持15 min;载气为高纯氮气(≥99.999%),流量2 mL/min,分流比5∶1,氢气45 mL/min,空气450 mL/min;检测器FID,检测器温度280 ℃,进样口温度250 ℃;进样量1.0 μL。
1.3.3 稳定性研究
1.3.3.1 光热稳定性
称取10.000 g OBP样品,在60、70、80 ℃水浴加热,不同光照条件下,包括避光、日光照射和紫外光照[距紫外灯(30 W)10 cm处,紫外辐射强度64.3 μW/cm3],分析姜黄素类化合物的变化。
1.3.3.2 pH稳定性
取400 μL亚油酸和4 mL吐温80,在不同pH的柠檬酸磷酸盐缓冲液中充分溶解后制成乳化液,添加OBP,制成pH值为2~10,质量浓度为0.4 mg/mL的OBP乳液。在室温下避光保存,于24 h内定时取样。
1.3.3.3 金属离子稳定性
取400 μL亚油酸和4 mL吐温80,添加OBP,制成质量浓度为0.4 mg/mL的OBP乳液。选择常见的3种具有氧化性的金属离子Fe3+、Cu2+、Zn2+分别配成0.1 mol/L的浓度以2%的质量分数添加到OBP乳液中,以不添加金属离子的溶液作为空白对照,20 ℃避光放置,观察现象,于24 h内定时取样,分析姜黄素类化合物的变化。
1.3.4 抗氧化性研究
通过DPPH自由基清除率、铁离子还原能力以及β-胡萝卜素漂白抑制率评估OBP的抗氧化活性[4,13]。其中β-胡萝卜素乳液由10 mL β-胡萝卜素氯仿溶液(1 mg/mL)、400 μL亚油酸和4 mL吐温80充分混合后,40 ℃旋转蒸发除去氯仿,再加入100 mL去离子水,混合制成。
1.4 数据分析
实验所得数据均为3次重复实验所得平均值;采用Origin 2022软件绘制数据图,并进行线性拟合得到降解动力学方程,计算其反应速率(k)、半衰期(t2/1)和相关性系数(R2)。
2 结果与分析
2.1 OBP主要成分分析
2.1.1 姜黄素类化合物含量分析
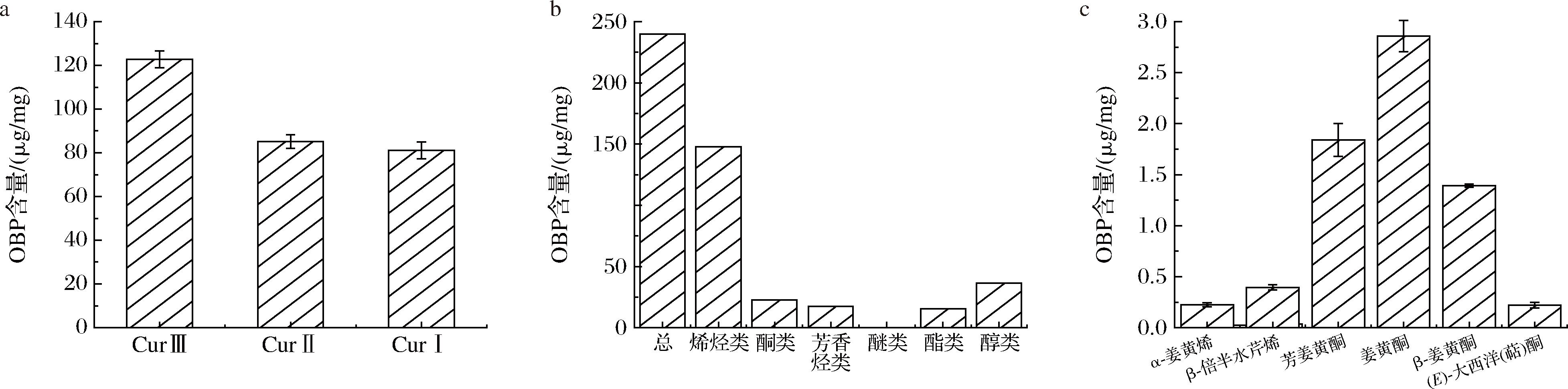
姜黄素类化合物含量如图1-a所示。3种姜黄素类化合物的含量分别为122.80,85.16,81.16 μg/mg OBP,总量约占OBP的28.90%。BAMPIDIS等[2]的研究表明姜黄油树脂中含有20%~35%(质量分数)的姜黄素类化合物;同时有研究检测了6批OBP发现,其中的姜黄素类化合物包括CurⅢ、CurⅡ和CurⅠ,含量范围分别为15.45~28.13 μg/mL、14.60~18.09 μg/mL、8.45~9.89 μg/mL[14]。虽然由于原料姜黄的产地批次、提取工艺和检测方法存在差异,导致测得的姜黄素类化合物总量有差别,但不同的研究都表明含量依次为CurⅢ>CurⅡ>CurⅠ。
a-姜黄素类化合物;b-挥发性成分;c-特征挥发性成分
图1 OBP中的主要成分含量
Fig.1 The main component content in OBP
2.1.2 主要挥发性成分含量分析
由表1可知,OBP中的主要挥发性成分有约30种,包括烯烃类、酮类、醇类、芳香烃类、酯类等。烯烃类的种类最多,有约18种,如石竹烯、α-姜黄烯和β-倍半水芹烯等,酮类成分主要有7种,包括特征性成分β-姜黄酮、芳姜黄酮以及大西洋(萜)酮等。OBP中的倍半萜种类丰富,如雪松烯、石竹烯、姜黄烯和β-倍半水芹烯等,这些物质具有一定香气,是姜黄芳香气息的主要来源,且其中的部分物质具有抗氧化、抗炎、抗增殖作用。JOSHI等[4]检测出了姜黄油树脂中的α-姜黄酮、β-姜黄酮、姜黄烯等,但由于检测手段和原料的差异,较少检测出烯烃类和酯类。
表1 OBP的主要挥发性成分
Table 1 The main volatile component of OBP

编号保留时间/min常用名匹配度/%分子式CAS号结构式烯烃类18.789 3α-蒎烯96.6C10H16(MW:136.234)80-56-8210.452 1月桂烯94.5C10H16(MW:136.234)123-35-3310.987 4α-侧柏烯96.3C10H16(MW:136.234)2867-05-2411.301 94(5)-蒈烯98.0C10H16(MW:136.234)29050-33-7511.683 3(+)-柠檬烯95.4C10H16(MW:136.234)5989-27-5611.736 83-异丙基-6-亚甲基-1-环己烯92.1C10H16(MW:136.234)555-10-2712.559 9 萜品烯98.3C10H16(MW:136.234)99-85-4813.396 3萜品油烯98.6C10H16(MW:136.234)586-62-9922.804 4(+)-1,7-二表-α-雪松烯95.1C15H24(MW:204.351)50894-66-11022.871 31-石竹烯97.8C15H24(MW:204.351)87-44-51123.162 4(顺)-α-香柠檬烯90.5C15H24(MW:204.351)18252-46-51223.606 9(顺)-β-金合欢烯92.8C15H24(MW:204.351)28973-97-91323.794 8紫穗槐二烯94.5C15H24(MW:204.351)92692-39-21424.363 5α-姜黄烯97.6C15H22(MW:202.335)644-30-41524.706 3姜油烯97.7C15H24(MW:204.351)495-60-3
续表1

编号保留时间/min常用名匹配度分子式CAS号结构式1625.025 2β-红没药烯98.1C15H24(MW:204.351)495-61-41725.424 1β-倍半水芹烯97.2C15H24(MW:204.351)20307-83-91825.494 41,2,3,4,4a,5,8,9,12,12a-十氢-1,4-甲烷苯并环十二烯82.6C15H22(MW:202.340)74708-73-9酮类15.212 7异丙叉丙酮88.3C6H10O(MW:98.143)141-79-7226.457 91-(1,2,3-三甲基环戊-2-烯-1-基)乙酮87.5C10H16O(MW:152.233)70987-81-4328.532 3(顺)-γ-大西洋酮91.8C15H22O(MW:218.330)108549-48-0428.648 5芳姜黄酮94.9C15H20O(MW:216.319)532-65-0528.769 6姜黄酮94.1C15H22O(MW:218.330)180315-67-7629.532 6β-姜黄酮97.4C15H22O(MW:218.330)82508-14-3731.085 0 (-)-(反)-α-大西洋酮94.0C15H22O(MW:218.330)108645-54-1芳香烃类14.453 2甲苯91.0C7H8(MW:92.138)108-88-3211.536 1邻异丙基甲苯98.7C10H14(MW:134.218)527-84-4313.526 81-异丙烯基-3-甲基苯96.6C10H12(MW:132.202)1124-20-5酯类14.965 1硼酸三乙酯93.5C6H15BO3(MW:145.992)150-46-925.590 8乙酸丁酯86.0C6H12O2(MW:116.158)123-86-4醇类111.787 0桉叶油素89.4C10H18O(MW:154.249)470-82-6
注:MW代表分子质量。
通过图1-b、图1-c可知,OBP中的挥发性成分占总量的23.9%,其中烯烃类含量最高,占总挥发性成分的61.6%;醇类虽然种类少,但是含量却高达挥发性成分的15.11%。特征的挥发性成分包括α-姜黄烯(0.22‰)、β-倍半水芹烯(0.39‰)、芳姜黄酮(1.84‰)、姜黄酮(2.86‰)、β-姜黄酮(1.39‰)以及大西洋(萜)酮(0.22‰)。不同的原料类型对挥发性成分测得的含量有影响,DOSOKY等[15]对姜黄中的挥发性成分的测定结果显示其主要挥发性成分为芳姜黄酮(12.19%~36.64%)、α-姜黄酮(9.39%~43.30%)和曲酮(3.36%~37.75%),虽然其测得的成分和具体含量与本文研究结果存在差异,但从仍可看出其中含量最高的2种成分为芳姜黄酮和姜黄酮,与本研究结论一致。
将OBP置于室温避光贮存,间隔固定时间取样测定其主要成分,其变化如图2所示。由图2可以看出姜黄素类化合物的含量变化不大,在室温避光条件下稳定。主要的挥发性成分含量变化较大,其中α-姜黄烯和β-倍半水芹烯的含量下降最为明显,40 d后分别下降了65.31%和73.44%,芳姜黄酮的含量下降最少,降解率为26.78%。有研究表示在贮藏过程中由于功能性成分的挥发,不同种类的挥发油均出现了抗氧化性和抗菌活性下降,因此挥发油经提取后不宜放置时间过长,且应当低温密封贮存,尽可能减少有效功能成分的损失[16-17]。由于在室温避光条件下姜黄素类化合物的含量变化不大,在后续实验中进一步讨论了不同热、光、pH值以及金属离子条件对其稳定性的影响。

a-姜黄素类化合物;b-特征挥发性成分
图2 室温避光条件下OBP中主要成分的含量变化
Fig.2 Change of major components in OBP at room temperature
2.2 OBP稳定性研究
2.2.1 热稳定性研究
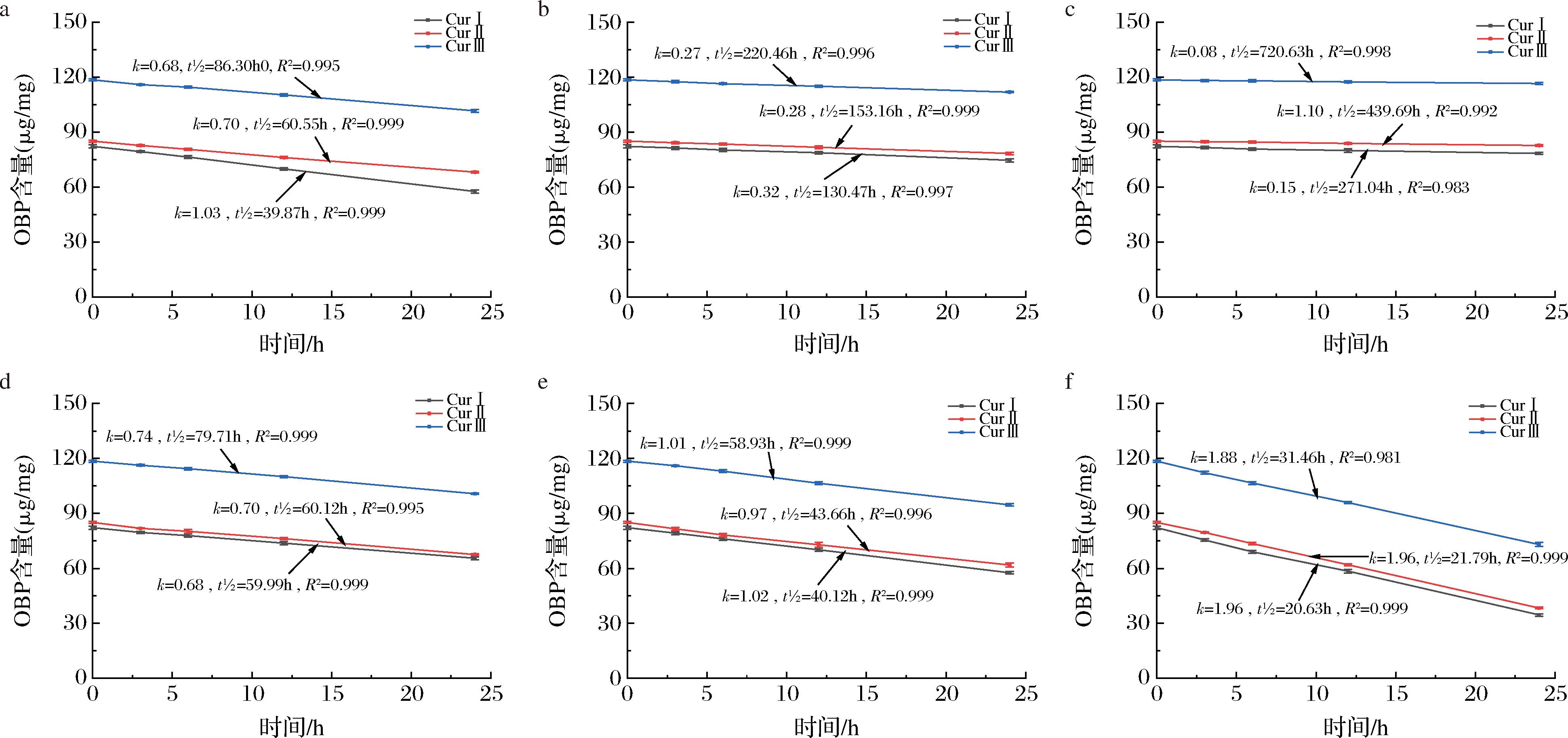
由图3可知,OBP中的姜黄素类化合物的含量在60、70、80 ℃的条件下,均出现明显下降,其中CurⅠ的降解速度明显快于CurⅡ和CurⅢ,以70 ℃时为例,3种姜黄素的降解率分别为16.44%、7.62%和4.68%;随温度升高,CurⅠ的降解率增加,在加热9 h后,姜黄素的降解率分别达到了9.25%、16.44%和21.95%,70和80 ℃加热条件下的CurⅠ降解明显更快。JIANG等[18]报道了CurⅠ在100 ℃处理30 min后的降解率达到了约50%。相对于文献中单体CurⅠ的热稳定性,OBP中的CurⅠ热稳定性有所提高,这可能是由于OBP中的其他成分对姜黄素的保护作用[19]。

a-60 ℃;b-70 ℃;c-80 ℃
图3 不同温度处理后OBP中姜黄素类化合物的不同变化
Fig.3 Different changes of curcumin compounds in OBP after different temperature treatments
2.2.2 光稳定性研究
图4是分别在紫外和日光照射下,OBP中3种姜黄素类化合物含量随时间的变化。可以看出,日光照射和紫外光照射均使得姜黄素类化合物含量大幅下降,尤其是CurⅠ,在3 d后的降解率分别达到了57.80%和42.10%。在JIANG等[18]的研究结果中,紫外会造成姜黄素约70%的降解率,这与本研究结果相类似。此外,CurⅠ、CurⅡ和CurⅢ的降解速率随时间延长而减缓,且CurⅠ的降解速度明显快于CurⅡ和CurⅢ。光照能引发自由基的产生,致使姜黄素类化合物发生光氧化反应[19]。但具体是哪段波长的光照对姜黄素类化合物的降解影响更大,目前的研究还不够具体,同时辐照强度会影响姜黄素类化合物的降解,例如不同的研究中,CurⅠ在长时间室外光照后的降解率分别为70%和97%[6,20]。

a-紫外照射;b-日光照射
图4 不同光照处理后OBP中姜黄素类化合物的不同变化
Fig.4 Different changes of curcumin compounds in OBP after different light treatments
2.2.3 pH稳定性研究
不同酸碱性条件下,姜黄素类化合物含量呈现的不同变化如图5所示,在pH为4和6时,姜黄素类化合物降解较慢,相比于酸性环境,姜黄素类化合物的含量下降在碱性环境中更明显,pH=2~10时CurⅠ的降解率在pH=6时最低为4.65%,pH=10时最高为57.99%,CurⅡ和CurⅢ的变化趋势与其类似。在韩兴曼等[21]的研究中,姜黄素在模拟肠液条件下(pH=7.2)12 h损失了47%。同样的,也有研究表明在pH>7.4时姜黄素的降解率会达到90%以上[21]。同时发现,随pH升高,OBP乳液的颜色也逐渐加深,在pH=10时呈红褐色,这主要是因为CurⅠ是一种常见的pH敏感性天然色素,在碱性条件下呈红褐色。
a-pH=2;b-pH=4;c-pH=6;d-pH=7;e-pH=8;f-pH=10
图5 不同酸碱条件下OBP中姜黄素类化合物的不同变化
Fig.5 Different changes of curcumin compounds in OBP under different acid-base conditions
2.2.4 金属离子稳定性研究
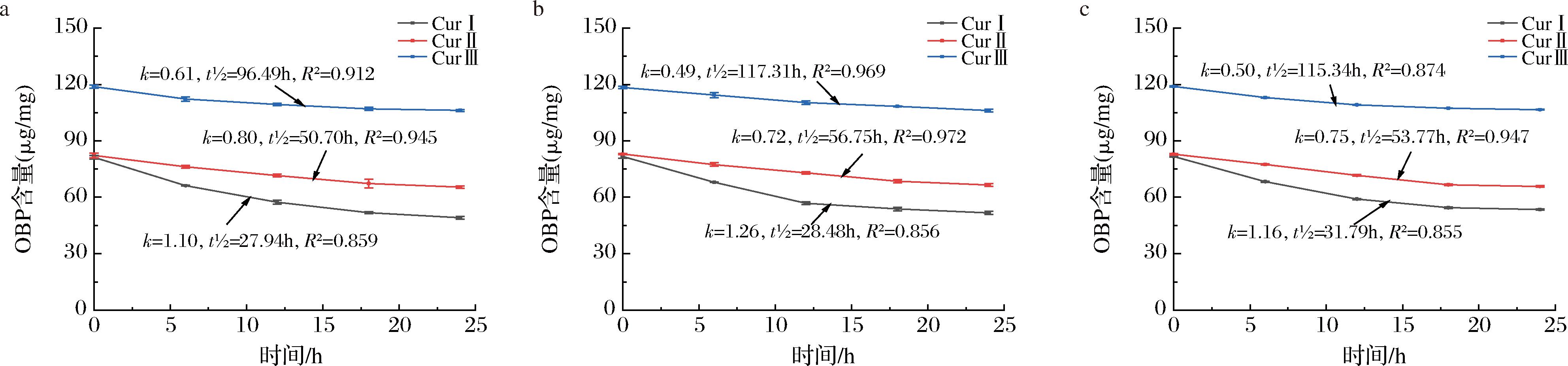
如图6所示,Fe3+、Cu2+、Zn2+对OBP稳定性的影响明显。在3种溶液中的姜黄素类化合物均出现了明显的降解,并且随时间增长,降解速率逐渐减缓,且均表现出稳定性CurⅠ
a-Fe3+;b-Cu2+;c-Zn2+
图6 同金属离子环境下OBP中姜黄素类化合物的不同变化
Fig.6 Different changes of curcumin compounds in OBP in different metal ion environments
随着时间延长,3种溶液中均出现了沉淀,并产生了不同的颜色变化,Zn2+使得溶液颜色变深,Fe3+使其变成深褐色,加入Cu2+后的溶液呈现黄绿色,后两者的颜色变化也有可能是加入的金属离子溶液本身存在颜色导致的。出现沉淀则是因为,CurⅠ与不同金属离子鳌合形成了稳定的六元环配合物,具有不同的颜色和生物功能活性[22]。
由图3~图6可以看出,随温度升高,同种姜黄素类化合物的降解动力学方程的k值增大,说明其降解速率加快,稳定性下降;在碱性环境中,当pH>6时,随pH升高也出现同样的趋势;虽然3种金属离子环境中24 h后姜黄素类化合物的降解率相近,但从t1/2可以看出长时间后Fe3+对其稳定性影响更大。光照和碱性环境对OBP的稳定性影响较大,在日光照射和pH=10时,姜黄素降解动力学方程的k值最大,分别为2.15和1.96,同时t1/2最小,分别为17.84 h和20.63 h,进一步说明了CurⅠ在这2种环境中会快速降解。
通过计算降解动力学方程的k值和t1/2发现,在不同处理条件下均姜黄素类化合物的稳定性均表现为CurⅢ>CurⅡ>CurⅠ。这3种姜黄素类化合物的主要区别在于,姜黄素的类苯环上存在—OH和—OCH3,这两者都是给电子能力较强的基团,使得碳链上更容易发生亲电反应[19];而CurⅡ和CurⅢ,在缺少—OCH3的情况下,给电子能力更低,使得亲电反应活性减弱,因此姜黄素类化合物中CurⅠ最不稳定,CurⅢ最为稳定。而这3种姜黄素类化合物都是由两个芳香族丙烯酸聚合成的二酮类化合物,在碱性环境中其中一个羰基发生断裂,结合氢原子生成羟基,成为新的酮类物质,因此3种姜黄素类化合物的酸碱稳定性相对来说差别不大[23]。同时,由于OBP的成分复杂,其中的部分成分可能对CurⅠ有保护作用,使得OBP的稳定性优于单体CurⅠ。
2.3 OBP抗氧化性研究
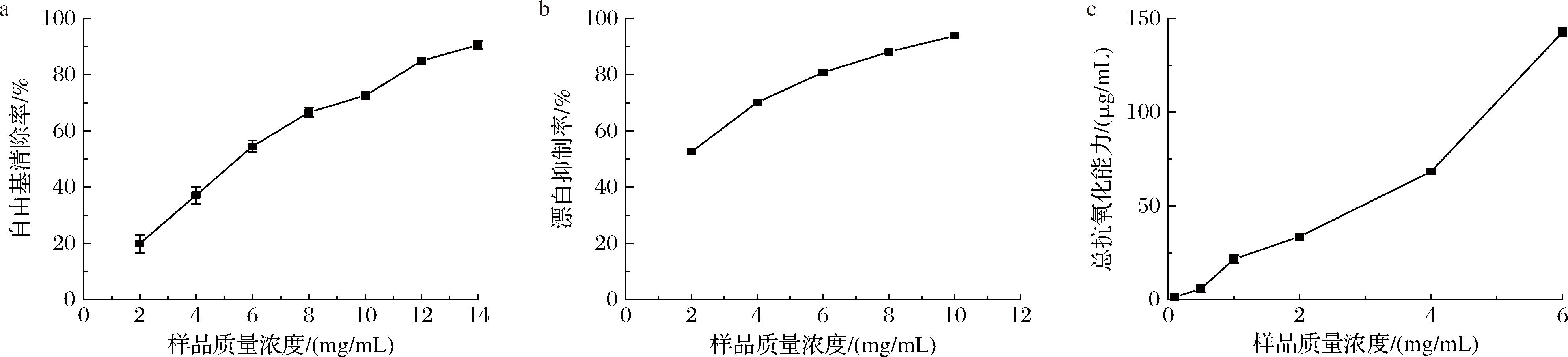
OBP的DPPH自由基清除率、β-胡萝卜素漂白抑制率和铁离子还原能力随浓度的提高均呈递增趋势,前两者分别能达到90.59%和93.82%,对比抗坏血酸的DPPH自由基可知,此时OBP的DPPH自由基清除活力为4 μg/mL维生素C当量。铁离子还原能力在样品质量浓度为6 mg/mL时能达到(142.79±2.06) μg/mL维生素C当量(图7)。OBP的抗氧化性主要来自于其中的姜黄素类化合物,因为其分子结构中的酚羟基可以捕获或清除自由基,已有研究证实了姜黄素类化合物良好的体内和体外抗氧化性[3,5]。同时有实验对OBP进行分离纯化后,发现其中的非姜黄素类化合物,也具有抗氧化活性[4]。
a-DPPH自由基清除活性;b-β-胡萝卜素漂白抑制率;c-铁离子还原能力
图7 OBP的抗氧化性
Fig.7 Antioxidant properties of the OBP
3 结论与讨论
对OBP的成分研究表明,其中含有约30%的姜黄素类化合物(CurⅠ、CurⅡ和CurⅢ),以及近30种挥发性成分,主要有α-姜黄烯、β-倍半水芹烯、芳姜黄酮、姜黄酮、β-姜黄酮等。在室温避光贮存条件下,姜黄素类化合物稳定性良好,而易挥发的成分会大量损失,因此工业中贮藏时应注意低温密封。OBP中的姜黄素类化合物对光、热、碱性环境以及具有氧化性的金属离子敏感,在不同处理条件中的姜黄素类化合物的稳定性均表现为CurⅢ>CurⅡ>CurⅠ,尤其是碱性条件和日光照射会明显促进姜黄素类化合物的降解。在实际工业生产或保存运输中,要注意环境、操作条件以及容器的选择。同时发现碱性环境以及Fe3+、Zn2+对OBP的乳液有增色作用,可将该特性应用于智能响应材料的制备,拓宽了OBP的应用前景。OBP还具有良好的体外抗氧化性,可作为一种天然抗氧化剂使用。总之,OBP在食品、营养保健品和制药工业中具有广泛的应用前景。
[1] HALDAR S, MAJUMDAR G C, MISHRA H N.Modeling the kinetics of extracting oleoresin from dried turmeric (Curcuma longa L.) rhizome using acetone as solvent[J].Journal of Food Engineering, 2015, 146:116-121.
[2] BAMPIDIS V, AZIMONTI G, BASTOS M L, et al.Safety and efficacy of turmeric extract, turmeric oil, turmeric oleoresin and turmeric tincture from Curcuma longa L.rhizome when used as sensory additives in feed for all animal species[J].EFSA Journal, 2020, 18(6):e06146.
[3] JACOB J N.Comparative studies in relation to the structure and biochemical properties of the active compounds in the volatile and nonvolatile fractions of turmeric (C.longa) and ginger (Z.officinale)[M].Studies in Natural Products Chemistry.Amsterdam:Elsevier, 2016:101-135.
[4] JOSHI P, JOSHI S, SEMWAL D K, et al.Chemical composition, antioxidative and antimicrobial activities of turmeric spent oleoresin[J].Industrial Crops and Products, 2021, 162:113278.
[5] BRUSOTTI G, CESARI I, DENTAMARO A, et al.Isolation and characterization of bioactive compounds from plant resources:The role of analysis in the ethnopharmacological approach[J].Journal of Pharmaceutical and Biomedical Analysis, 2014, 87:218-228.
[6] LI J L, SHIN G H, LEE I W, et al.Soluble starch formulated nanocomposite increases water solubility and stability of curcumin[J].Food Hydrocolloids, 2016, 56:41-49.
[7] TYPEK R, DAWIDOWICZ A L, WIANOWSKA D, et al.Formation of aqueous and alcoholic adducts of curcumin during its extraction[J].Food Chemistry, 2019, 276:101-109.
[8] 刘玲红, 程荣, 罗曼, 等.天然色素的复配调色及稳定性研究[J].食品工业, 2022, 43(4):117-122.LIU L H, CHENG R, LUO M, et al.Study on the compound toning of natural pigments and their stability[J].The Food Industry, 2022, 43(4):117-122.
[9] IWEALA E J, UCHE M E, DIKE E D, et al.Curcuma longa (Turmeric):Ethnomedicinal uses, phytochemistry, pharmacological activities and toxicity profiles—A review[J].Pharmacological Research-Modern Chinese Medicine, 2023, 6:100222.
[10] GOPIKA S K, SUBRAMANIAN R.Recovery of bioactive volatiles from byproduct of curcumin manufacture by membrane processing[J].Industrial Crops and Products, 2020, 158:112984.
[11] RAY A, MOHANTY S, JENA S, et al.Drying methods affects physicochemical characteristics, essential oil yield and volatile composition of turmeric (Curcuma longa L.)[J].Journal of Applied Research on Medicinal and Aromatic Plants, 2022, 26:100357.
[12] 洪宗超, 吴和珍, 杨艳芳, 等.基于GC-MS及GC技术对片姜黄挥发油成分的定性定量分析[J].中南药学, 2019, 17(3):426-434.HONG Z C, WU H Z, YANG Y F, et al.Qualitative and quantitative analysis of volatile oil from Rhizoma Wenyujin Concisum by GC-MS and GC[J].Central South Pharmacy, 2019, 17(3):426-434.
[13] 王佳丽, 张晓南, 熊婷婷, 等.香茅挥发油提取工艺优化及抗氧化、抑真菌活性研究[J].食品与机械, 2022, 38(8):166-173;201.WANG J L, ZHANG X N, XIONG T T, et al.Optimization of the extraction process of citronella volatile oil and its antioxidant and antifungal activities[J].Food &Machinery, 2022, 38(8):166-173;201.
[14] 贾锶锶, 刘文清, 马丽婷, 等.多波长HPLC内标法同时测定姜黄油树脂中5种成分的含量[J].化学研究与应用, 2022, 34(11):2765-2770.JIA S S, LIU W Q, MA L T, et al.Simultaneous determination of five components in Turmeric oleoresin by multi-wavelength HPLC internal standard method[J].Chemical Research and Application, 2022, 34(11):2765-2770.
[15] DOSOKY N S, SATYAL.P, SETZER W N.Variations in the volatile compositions of Curcuma species[J].Foods, 2019, 8(2):53.
[16] RAFFO A, BUCCI R, D′ALOISE A, et al.Combined effects of reduced malaxation oxygen levels and storage time on extra-virgin olive oil volatiles investigated by a novel chemometric approach[J].Food Chemistry, 2015, 182:257-267.
[17] SIRIPOLTANGMAN N, CHICKOS J.Vapor pressure and vaporization enthalpy studies of the major components of ginger, α-zingiberene, β-sesquiphellandrene and (-) ar curcumene by correlation gas chromatography[J].The Journal of Chemical Thermodynamics, 2019, 138:107-115.
[18] JIANG L W, XIA N, WANG F, et al.Preparation and characterization of curcumin/β-cyclodextrin nanoparticles by nanoprecipitation to improve the stability and bioavailability of curcumin[J].LWT, 2022, 171:114149.
[19] 韩刚, 崔静静, 毕瑞, 等.姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素稳定性研究[J].中国中药杂志, 2008, 33(22):2611-2614. HAN G, CUI J J, BI R, et al.Study on stability of curcumine,demethoxycurcumin and bisdemethoxycurcumin[J].China Journal of Chinese Materia Medica, 2008, 33(22):2611-2614.
[20] 马诗经. 姜黄素固体制剂制备及其抗炎作用与机理研究[D].广州:广东工业大学, 2016.MA S J.Preparation anti-inflammatory effect evaluation and mechanism study of curcumin solid preparations[D].Guangzhou:Guangdong University of Technology, 2016.
[21] 韩兴曼, 樊金玲, 王攀, 等.植物糖原负载提高姜黄素的稳定性和生物活性[J].食品科学, 2020, 41(15):39-47.HAN X M, FAN J L, WANG P, et al.Enhanced stability and bioactivity of curcumin encapsulated in phytoglycogen nanoparticles[J].Food Science, 2020, 41(15):39-47.
[22] APPENDINO G, ALLEGRINI P, DE COMBARIEU E, et al.Shedding light on curcumin stability[J].Fitoterapia, 2022, 156:105084.
[23] XIANG H, SUN-WATERHOUSE D, CUI C, et al.Modification of soy protein isolate by glutaminase for nano complexation with curcumin[J].Food Chemistry, 2018, 268:504-512.